- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Документы и приказы: Клинические рекомендации ЭОЗИНОФИЛЬНЫЙ ЭЗОФАГИТ 2022 - 2025
Полный текст статьи:
Клинические рекомендации ЭОЗИНОФИЛЬНЫЙ ЭЗОФАГИТ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: К20
Год утверждения (частота пересмотра): 2022
Возрастная категория: Взрослые и дети
Год окончания действия: 2025
Разработчик клинической рекомендации
Российское научное медицинское общество терапевтов
Российская ассоциация аллергологов и клинических иммунологов Ассоциация детских аллергологов и иммунологов России
Российское общество профилактики неинфекционных заболеваний Российское общество патологоанатомов
Одобрено Научно-практическим Советом Минздрава РФ
ОГЛАВЛЕНИЕ
Термины и определения 6
1. Краткая информация по заболеванию или состоянию (группе заболеваний или состояний) 6
1.1 Определение заболевания или состояния (группы заболеваний или состояний) 6
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний) 7
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний) 10
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанны 10
1.5 Классификация заболевания или состояния (группы заболеваний или состояний) 11
1.6. Клиническая картина заболевания или состояния (группы заболеваний или состояний) 11
2. Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики 12
2.1 Жалобы и анамнез 15
2.2. Физикальное обследование 16
2.3. Лабораторные диагностические исследования 17
2.4. Инструментальные диагностические исследования 17
2.5. Иные диагностические исследования 24
3. ЛЕЧЕНИЕ, ВКЛЮЧАЯ МЕДИКАМЕНТОЗНУЮ И НЕМЕДИКАМЕНТОЗНУЮ ТЕРАПИИ, ДИЕТОТЕРАПИЮ, ОБЕЗБОЛИВАНИЕ, МЕДИЦИНСКИЕ ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ МЕТОДОВ ЛЕЧЕНИЯ 25
3.1 Диета 26
3.2 Медикаментозное лечение 29
3.3 Эндоскопическое лечение 34
4. МЕДИЦИНСКАЯ РЕАБИЛИТАЦИЯ И САНАТОРНО-КУРОРТНОЕ ЛЕЧЕНИЕ, МЕДИЦИНСКИЕ ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ МЕТОДОВ МЕДИЦИНСКОЙ РЕАБИЛИТАЦИИ, В ТОМ ЧИСЛЕ ОСНОВАННЫХ НА ИСПОЛЬЗОВАНИИ ПРИРОДНЫХ ЛЕЧЕБНЫХ ФАКТОРОВ 35
5. ПРОФИЛАКТИКА И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ, МЕДИЦИНСКИЕ ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ МЕТОДОВ ПРОФИЛАКТИКИ 35
6. ОРГАНИЗАЦИЯ ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ 36
7. ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ (В ТОМ ЧИСЛЕ ФАКТОРЫ ВЛИЯЮЩИЕ НА ИСХОД ЗАБОЛЕВАНИЯ ИЛИ СОСТОЯНИЯ) 36
КРИТЕРИИ ОЦЕНКИ КАЧЕСТВА МЕДИЦИНСКОЙ ПОМОЩИ 37
СПИСОК ЛИТЕРАТУРЫ 38
ПРИЛОЖЕНИЕ А1. СОСТАВ РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ 46
ПРИЛОЖЕНИЕ А2. МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ 47
ПРИЛОЖЕНИЕ А3. СПРАВОЧНЫЕ МАТЕРИАЛЫ, ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ ЛЕКАРСТВЕННОГО ПРЕПАРАТА. 49
ПРИЛОЖЕНИЕ Б. АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА 50
ПРИЛОЖЕНИЕ В. ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА 52
ПРИЛОЖЕНИЕ Г1 - ГN. ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ. 52
СПИСОК СОКРАЩЕНИЙ, ИСПОЛЬЗОВАННЫХ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
АтД Атопический дерматит
АР Аллергический ринит
БА Бронхиальная астма
ВЗК Воспалительные заболевания кишечника
ГЭРБ Гастроэзофагеальная рефлюксная болезнь
ИПП Ингибиторы протонной помпы
ИЛ (IL) Интерлейкин
УДД Уровень достоверности доказательств
УУР Уровень убедительности рекомендаций
ЭоЭ Эозинофильный эзофагит
ЭГДС Эзофагогастродуоденоскопия
CRTh2 Молекула, гомологичная хемоаттрактантному рецептору
FLG Филаггрин
Ig Иммуноглобулин
ILC2 Лимфоидные клетки 2 типа
PGD Простагландин
TGF Фактор роста опухолей
Th Т-хелперы
TNF Фактор некроза опухоли
TSLP Thymic stromal lymphopoietin (тимический стромальный лимфопоэтин)
TSLPR Thymic stromal lymphopoietin receptor (рецептор к тимическому
стромальному лимфопоэтину)
Термины и определения
Эозинофильный эзофагит – хроническое, медленно-прогрессирующее иммуноопосредованное заболевание пищевода, характеризующееся выраженным эозинофильным воспалением слизистой оболочки пищевода, развитием подслизистого фиброза, клинически проявляющееся нарушением глотания (дисфагия, обтурация пищевода пищевым комком, рвота проглоченной пищей и др.).
1. Краткая информация по заболеванию или состоянию (группе заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Эозинофильный эзофагит – хроническое, медленно-прогрессирующее иммуноопосредованное заболевание пищевода, характеризующееся выраженным эозинофильным воспалением слизистой оболочки пищевода, развитием подслизистого фиброза, клинически проявляющееся нарушением глотания (дисфагия, обтурация пищевода пищевым комком, рвота проглоченной пищей и др.).
Диагноз «эозинофильный эзофагит» может быть установлен только после исключения заболеваний, сопровождающихся эозинофилией пищевода (паразитарные и грибковые инфекции, болезнь Крона, гиперэозинофильный синдром, ахалазия, системные заболевания соединительной ткани и др.). Изолированная эозинофильная инфильтрация слизистой оболочки пищевода без ключевого симптома заболевания -дисфагии-не может служить критерием ЭоЭ. Наряду с эозинофилами в патогенез ЭоЭ вовлечены различные субпопуляции лейкоцитов (лимфоциты, тучные клетки), эпителиальные клетки, фибробласты, гладкомышечные клетки и другие. Указание же в названии заболевания на эозинофильный характер воспаления призвано подчеркнуть появление и преобладание в составе инфильтрата в слизистой оболочке пищевода нехарактерных для данного отдела пищеварительной трубки клеток лейкоцитарного ряда – эозинофилов.
Важно, что из дефиниции ЭоЭ исключен термин «антиген-опосредованное» заболевание, использовавшийся ранее. Согласно накопленным на сегодняшний день данным, не существует однозначного представления о том, что служит триггером развития эозинофильного воспаления в слизистой оболочке пищевода: воздействие пищевых и респираторных антигенов на иммуно-скомпрометированный организм или же нарушение барьерной функции слизистой оболочки пищевода, способствующее более глубокому проникновению экзогенных антигенов в толщу слизистой оболочки и инициации иммунного воспаления.
Более того, многими работами было показано, что терапия ингибиторами протонной помпы, восстанавливая целостность эпителиального барьера, во многих случаях приводит не только к клинической, но и к гистологической ремиссии ЭоЭ. По этой же причине эзофагеальную эозинофилию, разрешающуюся при терапии ИПП, решено более не относить к отдельной нозологической форме, поскольку клинически, эндоскопически, гистологически и даже генетически она неотличима от ЭоЭ и, по всей видимости, является фенотипическим подтипом ЭоЭ [1].
Заболевание имеет относительно невысокую распространенность, которая по усредненным оценкам составляет 5-10 на 100000 человек [10]. Однако его развитие существенно нарушает качество жизни пациентов за счет характерных симптомов – дисфагии, острых эпизодов вклинения пищи в пищевод [1,2,3].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
ЭоЭ – это хроническое Th2-ассоциированное заболевание пищевода, характеризующееся развитием выраженного эозинофильного воспаления (более 15 эозинофильных лейкоцитов в поле зрения микроскопа высокого разрешения при увеличении х400 или более 60 в 1 мм2) в слизистой оболочке пищевода и подслизистого фиброза. ЭоЭ относится к мультифакториальным заболеваниям. К факторам, играющим роль в формировании ЭоЭ, относятся:
• генетическая предрасположенность к развитию иммунного ответа по пути активации Т-хелперов 2 типа;
• нарушение барьерной функции слизистой оболочки пищевода (воспаление, расширение межклеточных пространств, нарушение синтеза белков плотных контактов), способствующее более глубокой пенетрации антигенов в толщу слизистой оболочки;
• сенсибилизация к респираторным и пищевым антигенам.
Существует много фактов, свидетельствующих, что среди внешне-средовых триггеров ЭоЭ ведущую роль играют антигенные протеины (аллергены), индуцирующие Th2-тип иммунных реакций. Специфическое аллергологическое обследование с использованием кожного тестирования и определения аллерген-специфических IgE выявило сенсибилизацию у 75–80% пациентов с ЭоЭ, что превышает общепопуляционные показатели в три раза. Среди сопутствующих ЭоЭ аллергических заболеваний регистрируются аллергический ринит (АР) у 40–80 % больных, бронхиальная астма (БА) – у 14–75 %, атопический дерматит (АД) – у 4–60 % пациентов. Нередко в анамнезе больных ЭоЭ отмечаются оральный аллергический синдром как проявление перекрестной пыльцевой/пищевой аллергии и клинические симптомы IgE-опосредованной пищевой сенсибилизации.
Этиопатогенез ЭоЭ связан с вовлечением звеньев адаптивного и врожденного иммунитета. При воздействии респираторных и пищевых аллергенов на слизистую оболочку пищевода у лиц с имеющейся генетической предрасположенностью к атопии и/или нарушением эпителиального барьера происходит высвобождение эпителиальных цитокинов (аларминов) TSLP, ИЛ-25, ИЛ-33, которые приводят к усилению функций антигенпрезентирующих клеток. Антигенпрезентирующие клетки поглощают антиген, процессируют его и в последующем представляют Тh0-лимфоцитам, что приводит к их активации и дифференцировке в Тh2-лимфоциты, синтезирующие ИЛ-4, ИЛ-5, ИЛ-13, ИЛ-9. ИЛ-4 вызывает пролиферацию В-лимфоцитов, играет роль в переключении синтеза антител на изотип IgE. IgE, синтезированные плазматическими клетками, фиксируются на высокоаффинных рецепторах RFcέ1 на мембране тучных клеток. При повторном контакте происходит перекрестное связывание антител с аллергеном, что приводит к дегрануляции тучных клеток и высвобождению преформированных медиаторов, в первую очередь,
гистамина, и возникновению гистамин-опосредованных реакций. Воспаление в дальнейшем усиливается при образовании вновь синтезируемых медиаторов (производных арахидоновой кислоты). В то же время, согласно современным представлениям, IgE-зависимый механизм не играет ведущую роль в патогенезе ЭоЭ.
Наряду с этим в процесс вовлекаются звенья врожденного иммунитета — врожденные лимфоидные клетки 2 типа (ILC2). Данные клетки продуцируют аналогичный спектр цитокинов, за исключением ИЛ-4.
Перечисленные выше цитокины играют ключевую роль в развитии эозинофильного воспаления: их уровень коррелирует со степенью эозинофилии слизистой пищевода.
ИЛ-5 является важным фактором, обуславливающим миграцию эозинофилов в ткани, отвечает за выживаемость и увеличение продолжительности жизни клеток. У пациентов с ЭоЭ отмечается повышенная экспрессия ИЛ-13. Известно, что ИЛ-13, оказывая влияние на эпителиальные клетки, приводит к увеличению синтеза эотаксина 3, который является эозинофил-активирующим хемокином, и периостина. Кроме того, ИЛ-13 приводит к гиперплазии базальных клеток, отложению коллагена, ремоделированию ткани, повреждению эпителиального барьера за счет снижения экспрессии десмосомального протеина десмоглеина 1.
Таким образом формируется эозинофильная инфильтрация стенки, и в первую очередь — слизистой оболочки пищевода. Происходит дегрануляция эозинофилов, высвобождение белков с ферментативной активностью, в том числе главного основного белка, обладающего свойствами гистаминазы, катионного белка, эозинофильной пероксидазы, эозинофильного нейротоксина. Протеолитические ферменты эозинофилов оказывают выраженное деструктивное действие на эпителий, собственную пластинку слизистой оболочки пищевода и подслизистый слой (рисунок 1).
Рисунок 1. Патогенез эозинофильного эзофагита (адаптировано с O'Shea KM, Aceves SS, Dellon ES, Gupta SK, Spergel JM, Furuta GT, Rothenberg ME. Pathophysiology of Eosinophilic Esophagitis.
Gastroenterology. 2018): факторы внешней среды (пищевые, воздушные антигены, микроорганизмы), контактируя с антигенпрезентирующими клетками в слизистой оболочке пищевода, стимулируют продукцию цитокинов (ИЛ-4, тимический стромальный лимфопоэтин (TSLP)). Данные цитокины детерминируют дифференцировку наивных Т-лимфоцитов по пути образования Т-хелперов 2 типа. Секреция Т-хелперами 2 типа цитокинов (ИЛ-13, ИЛ-5 и др.) запускает каскад иммунологических реакций с участием эозинофилов, мастоцитов, В –лимфоцитов и др.
Роль Th2 воспаления является центральной в понимании патогенеза ЭоЭ. Повреждение слизистой оболочки и подслизистого слоя пищевода иммунокомпетентными клетками постепенно приводит к вовлечению в процесс фибробластов, миоцитов и эндотелиоцитов, развитию гиперплазии базального слоя эпителия и гладкомышечных клеток, активации фиброзогенеза и ангионеогенеза в подслизистом слое, что обуславливает потерю эластичности соединительной и мышечной ткани, ремоделированию стенки пищевода, развитию стриктур [2,3,4,5,106].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
За последние десятилетия наблюдается неуклонный и стремительный рост заболеваемости эозинофильным эзофагитом. Заболеваемость ЭоЭ в странах Европы и США составляет на сегодняшний день 3,7 заболевших на 100000 человек в год (95% CI, 1,7–6,5). Низкие показатели заболеваемости зарегистрированы в Нидерландах (2,1 на 100000 в год), наиболее высокие – в США (12,8 на 100000 в год) [10]. Число вновь зарегистрированных больных ЭоЭ за последние годы возросло почти в 100 раз.
ЭоЭ страдают преимущественно мужчины (75% больных) белой расы (более 90% больных). ЭоЭ встречается во всех возрастных группах, однако чаще в молодом возрасте (средний возраст больных составляет 36–42 года). Прослеживается определенная наследственная предрасположенность: наличие родственников первой степени родства с ЭоЭ повышает риск развития заболевания. ЭоЭ – это хроническое персистирующее заболевание, в связи с чем наблюдается неизбежный ежегодный прирост распространенности ЭоЭ [10].
Среди стран, в которых проводились эпидемиологические исследования, наименьшая распространенность ЭоЭ установлена в Дании (2,3 на 100000 человек), наибольшая – в США (штат Огайо): 90,7 на 100000. В среднем распространенность ЭоЭ составляет 22,7 на 100000 человек (95% CI, 12,4–36,0): 43,4 на 100000 (95% CI, 22,5–71,2)
взрослых и 29,5 на 100000 (95% CI, 17,5–44,7) детей [10].
Распространенность ЭоЭ значительно варьирует в зависимости от географического расположения страны: она максимальна в странах Западной Европы и Северной Америки, значительно ниже в Японии и Китае. Описаны случаи заболевания в Южной Америке, Корее, Турции, Ближнем Востоке, литературных данных по распространенности ЭоЭ в Индии и странах Африки нет. Эпидемиологические исследования по изучению распространенности и заболеваемости ЭоЭ в России не проводились. В отечественной литературе имеются единичные публикации с описанием клинических случаев [5-16]
Распространенность ЭоЭ варьирует не только в различных географических зонах, его частота отличается в группах пациентов с различными клиническими симптомами. Так, среди лиц, которым проводилась ЭГДС, ЭоЭ обнаруживается в среднем у 2,4–6,6%. При этом ЭоЭ выявляется при проведении ЭГДС у 1–8 % пациентов с рефрактерной изжогой у 6% больных с жалобами на некардиальную боль в грудной клетке, в среднем в 4% случаев – при абдоминальной боли, в 5% — при пищевой аллергии.
Среди пациентов с жалобами на нарушение глотания (дисфагию) вероятность выявления ЭоЭ при эндоскопическом обследовании значительно выше и составляет 12- 23% случаев. У больных с острыми эпизодами вклинения пищи в пищевод ЭоЭ диагностируется не менее, чем в 50% случаев [10].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанны
К20 Эзофагит
К22.2 Непроходимость пищевода Стеноз пищевода
Стриктура пищевода
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
В настоящее время отсутствует единая классификация эозинофильного эзофагита. С точки зрения клинической значимости стоит выделять эозинофильный эзофагит без осложнений и эозинофильный эзофагит с развитием стриктур и стенозов.
По степени клинико-морфологической активности заболевания выделяют (см. приложение Г6):
• Неактивный ЭоЭ;
• ЭоЭ слабой степени активности;
• ЭоЭ средней степени активности;
• ЭоЭ с высокой активностью.
1.6. Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Характер и выраженность жалоб значительно отличаются в зависимости от возраста больного и продолжительности заболевания (таблица 1). Симптомы ЭоЭ у детей раннего возраста неспецифичны и включают срыгивания, тошноту и рвоту, возникающие во время еды, затруднения при глотании, боли в животе, отставание в физическом развитии.
Дети подросткового возраста предъявляют жалобы, более характерные для ГЭРБ: на изжогу, боли за грудиной, необходимость длительно пережевывать пищу и запивать ее водой («медленно-едящие и много пьющие» пациенты).
Таблица 1. Симптомы ЭоЭ у детей и взрослых
Симптомы у детей первых лет жизни Симптомы у детей дошкольного и
школьного возраста Симптомы у подростков/взрослых
Задержка физического
развития Дисфагия Дисфагия
Затруднения при приеме пищи (поперхивания, регургитация, отказ от
пищи) Эпизоды вклинения пищи в пищевод Эпизоды вклинения пищи в пищевод
Рвота Затруднения при приеме пищи (поперхивания, регургитация, рвотные позывы, длительное пережевывание пищи, обильное питье во время еды, отказ от
пищи) Затруднения при приеме пищи
Беспокойный сон Снижение аппетита,
избирательный подход Исключение из рациона
твердых и объемных
К еде продуктов, измельчение пищи
на маленькие кусочки
Боль в
животе/груди/горле Длительное пережевывание
пищевого комка
Рвота/срыгивания Страх приема пищи в
обществе
Тошнота Боль в груди
Беспокойный сон Упорная изжога
Клинические проявления ЭоЭ у взрослых (рисунок 2) нередко свидетельствуют о прогрессирующем сужении просвета пищевода: дисфагия, загрудинные боли и эпизоды вклинения пищи в пищевод. Описаны также случаи спонтанного разрыва пищевода, возникшие у больных ЭоЭ на фоне обтурации пищевым комком (синдром Бурхаве).
Рисунок 2. Симптомы ЭоЭ у детей и взрослых
Дисфагия у больных ЭоЭ может возникать остро (при застревании пищевого комка твердой консистенции) или беспокоить пациентов постоянно, вынуждая изменять пищевое поведение [1,3,4,17-21].
2. Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза заболевания/состояния:
Диагноз «эозинофильный эзофагит» устанавливается на основании совокупности клинических симптомов дисфункции пищевода (дисфагия, вклинение пищи в пищевод у взрослых и рвота, упорные срыгивания, трудности при
кормлении и глотании, абдоминальная боль у детей), характерной эндоскопической картины (отек, трахеевидный пищевод, экссудат, продольные борозды, стриктуры) и патоморфологического подтверждения эозинофильной инфильтрации пищевода (с количеством эозинофилов 15 и более в поле зрения микроскопа высокого разрешения при увеличении х400), после обязательного исключения заболеваний, сопровождающихся эозинофилией пищевода [1,2,21].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии. Проведение эндоскопического исследования пищевода у лиц с характерной симптоматикой с обязательным выполнением патологоанатомического исследования не менее 6 биоптатов из дистального и проксимального отделов пищевода является обязательным диагностическим минимумом для установления диагноза
«эозинофильный эзофагит».
Патоморфологическое исследование включает комплексную гистологическую оценку биоптатов, окрашенных гематоксилином и эозином. Главным критерием установления диагноза ЭоЭ служит интраэпителиальная эозинофильная инфильтрация с количеством эозинофилов в поле зрения микроскопа высокого разрешения 15 и более при увеличении х400.
Важно, что факт обнаружения большого количества эозинофилов в слизистой оболочке пищевода не может служить единственным критерием диагноза. Это связано с тем, что эзофагеальная эозинофилия выявляется при целом ряде других заболеваний, таких как: ГЭРБ, эозинофильный гастроэнтерит, целиакия, болезнь Крона, лучевой и инфекционный эзофагит (грибковые и паразитарные инфекции), гиперэозинофильный синдром, лекарственный эзофагит, васкулиты, ахалазия кардии, системные заболевания соединительной ткани, злокачественные опухоли (таблица 2) [1,2,3,21].
Таблица 2. Заболевания, ассоциированные с эозинофилией пищевода
Заболевание Диагностические критерии
Эозинофильный гастроэнтерит или колит Эозинофильная инфильтрация слизистой оболочки желудка и двенадцатиперстной кишки, толстой
кишки
Болезнь Крона Экстраэзофагеальные поражения, подтвержденные данными колоноскопии, компьютерной томографии, морфологического
исследования
Паразитарные и грибковые инфекции Экстраэзофагеальные симптомы и данные микробиологических исследований (крови, стула, слюны и
т.д)
Ахалазия Клинические особенности (дисфагия, рвота), данные манометрии пищевода,
рентгенологического исследования
пищевода
Гиперэозинофильный синдром Число эозинофилов в периферической крови >1,5 x 109/л, эозинофильно- обусловленные поражения внутренних органов (сердечно-сосудистая система, нервная система, кожа, желудочно-
кишечный тракт, дыхательная система)
Лекарственная гиперчувствительность Сыпь, лихорадка, лимфаденопатия, мультиорганные поражения, разрешение симптоматики после
отмены лекарственного препарата
Целиакия Данные морфологического исследования слизистой оболочки тонкой кишки, данные серологического исследования (антитела к тканевой
трансглутаминазе, эндомизию)
Васкулиты; Пемфигоид;
Системные заболевания соединительной ткани;
Болезнь трансплантат против хозяина Системные проявления
Таким образом, диагноз «эозинофильный эзофагит» может быть установлен только по совокупности клинических симптомов дисфункции пищевода и патоморфологического подтверждения эозинофильной инфильтрации пищевода, после обязательного исключения заболеваний, сопровождающихся эозинофилией пищевода (рисунок 3).
Рисунок 3. Диагностический алгоритм ЭоЭ
2.1 Жалобы и анамнез
Рекомендуется тщательная оценка жалоб и детальный сбор анамнеза пациента, которые служат неотъемлемой, а в ряде случаев критически важной частью обследования пациентов с подозрением на эозинофильный эзофагит.
Комментарии. Клинические проявления ЭоЭ (подробно описаны в разделе 1.6 настоящих рекомендаций) у взрослых пациентов и подростков включают дисфагию при приеме твердой пищи, необходимость длительно жевать пищу, измельчать и блендировать, обильно запивать пищу жидкостью, эпизоды вклинения пищи в пищевод (эпизоды острой обтурационной дисфагии), загрудинную боль, не связанную с глотанием. Для детей младшего возраста более характерны жалобы на срыгивание съеденной пищей, рвоту, боль в животе, частый отказ от пищи, задержка физического развития.
Дисфагия, особенно при приеме твердой пищи (потребность длительно пережевывать и обильно запивать пищевой комок водой для завершения глотка («медленно-едящие и много пьющие» пациенты) является одним из самых частых (у 70–80%) и специфичных симптомов ЭоЭ у взрослых, в связи с чем, более 35% пациентов вынуждены значительно удлинять время приема пищи [22]. ЭоЭ — медленно прогрессирующее заболевание, манифестирующее дисфагией уже в зрелом возрасте (средний возраст установления диагноза 36-42 года), однако при тщательном сборе анамнеза можно выяснить, что с детства пациенты имели сложности с приемом пищи, избегали многих пищевых продуктов, длительно пережевывали пищу. Эпизоды острой обтурационной дисфагии (вклинение пищи в пищевод) возникают у 33–54%
взрослых больных. Дисфагия и вклинение пищи в пищевод у молодых мужчин служат главными предикторами ЭоЭ. Менее специфичными симптомами ЭоЭ у взрослых являются изжога, регургитация и загрудинная боль, возникающая при физической нагрузке [23-26].
Симптомы заболевания у детей несколько отличаются. Дети раннего возраста с ЭоЭ чаще демонстрируют многообразие неспецифических жалоб со стороны верхних отделов желудочно-кишечного тракта: трудности при кормлении, возможен полный отказ от еды, тошноту, рвоту, боль в животе. Наиболее распространѐнными симптомами у детей с ЭоЭ являются ГЭРБ-подобные жалобы (изжога, регургитация, отрыжка). У детей старше 10 лет и подростков клиническая картина сходна с проявлениями у взрослых, возможно появление жалоб на затруднение при глотании твердой пищи и застревание пищи в пищеводе [24-26].
У пациентов с ЭоЭ часто наблюдается сочетание с другими аллергическими заболеваниями: различными клиническими проявлениями пищевой аллергии (до 81%), пищевой анафилаксии (около 15%), экземой (4-60%), аллергическим ринитом (40–75%), бронхиальной астмой (14-70%). В целом, 28–86% взрослых и 42–93% детей с верифицированным ЭоЭ, имеют атопические заболевания на момент обращения, и около 50-60% — в анамнезе. Многие пациенты с ЭоЭ имеют отягощенную наследственность по ЭоЭ, бронхиальной астме, поллинозу и другим атопическим заболеваниям [3]. Необходимо отметить, что симптомы эозинофильного эзофагита могут иметь выраженную сезонную вариабельность, обостряясь весной и летом, в период повышенной антигенной нагрузки [21].
Таким образом, тщательно собранные жалобы и данные анамнеза (начиная с раннего детского возраста) уже при первичном обращении пациента могут стать ключом к установлению верного диагноза.
Опросники и шкалы для оценки выраженности симптомов и качества жизни пациентов сЭоЭ
Разработано несколько опросников для оценки тяжести и активности симптомов, эффективности терапии ЭоЭ (см. приложения Г4, Г5).
Опросник по оценке «качества жизни» пациентов с ЭоЭ (EoE quality of life): валидированный опросник, заполняемый пациентами самостоятельно, в котором предлагается оценить влияние симптомов заболевания на социальную активность, эмоциональный статус, ежедневную деятельность в течение последней недели. Опросник содержит 30 вопросов-утверждений, на каждое утверждение предлагается выбрать один из пяти ответов.
Опросник для оценки дисфагии клиники Мейо (Mayo Dysphagia Questionnaire): валидизированный опросник, оригинальная версия которого была разработана для оценки выраженности дисфагии у больных со стриктурами пищевода. Опросник содержит 28 пунктов и требует около 10 минут на заполнение. В исследованиях, посвященных сопоставлению результатов опросника с данными гистологического исследования, была выявлена значительная вариабельность результатов, что не позволяет использовать его для контроля за активностью заболевания.
Несмотря на то, что данные опросники широко используются в научных
исследованиях, их применение в клинической практике затруднено. На сегодняшний день разработаны пациенто-ориентированные опросники, содержащие меньшее количество вопросов. Одним из таких опросников, является Опросник по оценке дисфагии (The Dysphagia Symptom Questionnaire), содержащий всего 3 вопроса, ответы на которые пациенты дают ежедневно в течение 30 дней (приложение Г):
- Ели ли Вы сегодня твердую пищу?
- Наблюдали ли вы сегодня, что пища при глотании продвигается слишком медленно или застревает в горле или грудной клетке?
- Приходилось ли Вам сегодня использовать какие-то дополнительные приемы, чтобы проглотить пищу?
2.2. Физикальное обследование
Всем больным с подозрением на эозинофильный эзофагит рекомендуется физикальное обследование (осмотр кожных покровов, перкуссия, пальпация, аускультация органов дыхания и живота) с обязательной оценкой нутритивного статуса.
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5) Комментарии. Характерные изменения в объективном статусе пациента с ЭоЭ отсутствуют. Однако, при внимательном физикальном обследовании могут быть обнаружены дефицит питания, отставание в физическом развитии, наличие признаков атопических заболеваний кожи, пищевой аллергии, заболеваний органов дыхания (бронхиальная астма). Несмотря на поражение слизистой оболочки пищевода изменения слизистой оболочки полости рта отсутствуют.
2.3. Лабораторные диагностические исследования
Всем больным с подозрением на эозинофильный эзофагит рекомендуется выполнение стандартного перечня лабораторных диагностических исследований (общий и биохимический анализ крови) для исключения других заболеваний, сопровождающихся эозинофилией пищевода, оценки эозинофилии периферической крови.
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5) Комментарии. Всем пациентам выполняется общий (клинический) анализ крови; анализ крови биохимический общетерапевтический (глюкоза, мочевина, креатинин, амилаза, билирубин, АлАТ, АсАТ).
Эозинофилия периферической крови наблюдается у части больных ЭоЭ, при этом абсолютное число эозинофилов в периферической крови статистически значимо коррелирует со степенью эозинофильной инфильтрации слизистой оболочки пищевода и заметно уменьшается при достижении гистологической ремиссии ЭоЭ на фоне лечения ИПП или топическими стероидами. Следует отметить, что эозинофилия не является специфичной только для ЭоЭ, в связи с чем этот показатель необходимо оценивать с учетом возраста пациента, наличия аллергических заболеваний, времени года (цветение трав и деревьев) и других факторов, способных повлиять на изменение числа эозинофилов в крови.
Методики, связанные с оценкой сывороточной концентрации потенциальных биомаркеров ЭоЭ (сывороточный IgE, IgG4, провоспалительные цитокины [ИЛ-4, ИЛ-
5, ИЛ-6, ИЛ-9, ИЛ-13], ферменты эозинофильных гранул, эотаксин-3, тимический стромальный лимфопоэтин, факторы роста опухолей и др.) на сегодняшний день считаются непригодными для диагностики ЭоЭ и контроля за активностью воспалительного процесса. Несмотря на то, что данные биологически активные вещества принимают непосредственное участие в патогенезе ЭоЭ, их уровень в сыворотке крови слабо коррелирует со степенью эозинофильного воспаления в слизистой оболочке пищевода.
2.4. Инструментальные диагностические исследования
Всем пациентам с дисфагией неясного генеза рекомендовано проведение ЭГДС с забором не менее 6 биоптатов (по 3 из дистального и среднего/проксимального отделов пищевода), а также биоптатов из желудка и двенадцатиперстной кишки (для исключения их эозинофильного поражения) [1,21].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Всем пациентам с подозрением на эозинофильный эзофагит перед проведением диагностической ЭГДС рекомендуется отмена ИПП как минимум за 3 недели до эндоскопического исследования [21].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3)
Всем пациентам, поступившим в экстренные эндоскопические и хирургические отделения в связи с вклинением пищи в пищевод, необходимо после извлечения
пищи провести множественную биопсию из пищевода (не менее 6 биоптатов (по 3 из дистального и среднего/проксимального отделов пищевода).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Все пациенты с эпизодом острого вклинения пищи в пищевод в случае спонтанного разрешения непроходимости должны быть направлены на проведение ЭГДС с забором не менее 6 биоптатов (по 3 из дистального и среднего/проксимального отделов пищевода), а также биоптатов из желудка и двенадцатиперстной кишки (для исключения их эозинофильного поражения).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3)
Всем пациентам детского возраста, которым по поводу симптомов со стороны верхних отделов пищеварительного тракта проводится ЭГДС, рекомендовано проведение биопсии из пищевода для исключения эозинофильного эзофагита [1,21]. Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Всем пациентам детского возраста с типичными симптомами ГЭРБ, рефрактерными к терапии ИПП, рекомендовано проведение ЭГДС с биопсией из пищевода для исключения эозинофильного эзофагита [21].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
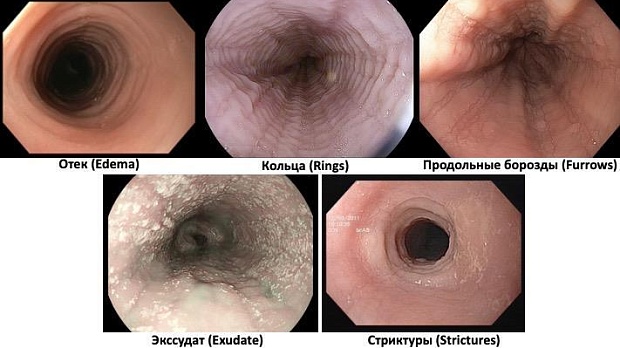
Комментарии. При проведении ЭГДС у больных с ЭоЭ обнаруживаются неспецифические признаки активного воспалительного процесса на всем протяжении пищевода: отек слизистой оболочки пищевода, белесый экссудат, линейные продольные борозды. У взрослых больных ЭоЭ в дополнение к вышеперечисленным признакам нередко обнаруживаются изменения, отражающие развитие подслизистого фиброза: множественные концентрические сужения пищевода (трахеевидный или «кошачий» пищевод) и стриктуры пищевода (рисунок 4). Нормальная эндоскопическая картина при ЭоЭ имеет место по разным данным у 5%–32% больных.
Рисунок 4. Эндоскопические особенности ЭоЭ
Использование современного оборудования высокого разрешения значительно увеличивает диагностическую ценность эндоскопического исследования, позволяя устанавливать верный диагноз до 95% больных ЭоЭ. Всем больным с подозрением на ЭоЭ при проведении ЭГДС должна быть выполнена множественная биопсия.
Показаниями для проведения биопсии служат:
1. Эндоскопическая картина, характерная для эозинофильного эзофагита;
2. Наличие характерных клинических симптомов (дисфагия, вклинение пищи в пищевод) у взрослых даже в случае нормальной эндоскопической картины.
3. Симптомы ГЭРБ у детей (изжога, загрудинная боль, срыгивание), рефрактерные к терапии ИПП, даже в случае нормальной
эндоскопической картины.
Для получения корректных патоморфологических результатов необходимо производить биопсию не менее, чем в 6–8 участках из дистального, среднего/проксимального отделов пищевода, предпочтительно из наиболее измененных
участков слизистой оболочки (белый экссудат, линейные продольные борозды). Биоптат должен включать эпителий на всю его глубину и собственную пластинку слизистой оболочки (для оценки степени подслизистого фиброза).
Диагностическая чувствительность возрастает при увеличении числа биоптатов. Оптимальным числом биоптатов на сегодняшний день считается 6 (из дистального и среднего/проксимального отделов пищевода) [1,3,27-31,32]. Данные рекомендации обусловлены тем, что воспалительные изменения при ЭоЭ носят фокальный характер и захватывают в равной степени как дистальный, так и проксимальный участки пищевода. В связи с тем, что на ранних стадиях заболевания выраженность эндоскопических изменений минимальна, биопсия должна проводиться у пациентов с дисфагией даже в случае отсутствия изменений слизистой оболочки пищевода при визуальном осмотре [1,22,31,32]. Вышесказанное особенно касается пациентов детского возраста, у которых достаточно часто наблюдается нормальная эндоскопическая картина в пищеводе (до 21-42,8%). В связи с этим при проведении ЭГДС у детей с неспецифическими симптомами со стороны верхних отделов пищеварительного тракта рекомендуется проведение биопсии из пищевода (даже при отсутствии визуальных признаков ЭоЭ) [21,32]. Особое внимание следует уделить пациентам детского возраста с типичными симптомами ГЭРБ, рефрактерными к терапии ИПП, поскольку в 30% случаев ЭоЭ у детей сопровождается изжогой. Таким образом, детям, у которых не удается достичь адекватного купирования симптомов ГЭРБ, целесообразно проведение ЭГДС с множественной биопсией из пищевода для исключения ЭоЭ [31].
Для дифференциальной диагностики с эозинофильным гастроэнтеритом при первом эндоскопическом обследовании должны быть взяты биоптаты из желудка и двенадцатиперстной кишки (при ЭоЭ в них не обнаруживается патологических изменений) [1,22,31,32].
Необходимо помнить, что прием ИПП, топических или системных стероидов может значительно изменять эндоскопическую и гистологическую картину заболевания. В случае, если пациенту с подозрением на ЭоЭ планируется диагностическая ЭГДС, рекомендовано (если это позволяет состояние пациента) отменять данные медикаменты как минимум за 3 недели до эндоскопического исследования [21].
С целью повышения информативности ЭГДС в диагностике ЭоЭ, стандартизации методики оценки степени и характера поражения пищевода была разработана эндоскопическая шкала EREFS (приложение Г1, Г2, рисунки 4а, 4б,4в,4г,4д), описывающая 5 главных эндоскопических признаков ЭоЭ (Edema –отек, Rings -кольца, Exudate-экссудат, Furrows-борозды, Strictures-стриктуры).
Рисунок 4а: Отек оценивается по четкости визуализации сосудистого рисунка Степень 0: сосудистый рисунок четкий;
Степень 1: слабая (снижение четкости сосудистого рисунка); Степень 2: сильная (отсутствие сосудистого рисунка).
Рисунок 4б: Кольца оцениваются по наличию и выраженности циркулярных сужений в просвете пищевода
Степень 0: циркулярные сужения отсутствуют;
Степень 1: слабая (тонкие формирующиеся циркулярные сужения при растяжении пищевода при инсуффляции);
Степень 2: умеренная (четкие циркулярные сужения, не препятствующие проведению стандартного взрослого эндоскопа диаметром 8,5–9 мм);
Степень 3: сильная (четкие циркулярные сужения, препятствующие свободному проведению стандартного взрослого эндоскопа диаметром 8,5-9 мм).
Рисунок 4в: Экссудат оценивается по наличию белого налета на поверхности слизистой оболочки пищевода
Степень 0: экссудат отсутствует;
Степень 1: слабая (белый налет, покрывающий <10% поверхности пищевода); Степень 2: сильная (белый налет, покрывающий ≥10% поверхности пищевода).
Рисунок 4г: Борозды продольные оцениваются по наличию вертикальных линий с углублением на слизистой оболочке пищевода
Степень 0: вертикальные линии отсутствуют;
Степень 1: слабая (вертикальные линии без видимого углубления);
Степень 2: сильная (вертикальные линии с выраженным углублением (вдавлением) в слизистую оболочку).
Рисунок 4д: Стриктуры пищевода оцениваются по наличию сужений пищевода, непроходимых для эндоскопа
Степень 0: отсутствуют;
Степень 1: присутствуют.
Корреляция результатов EREFS с гистологическими данными оказалась недостаточно высока, поскольку вышеперечисленные эндоскопические признаки не являются специфичными только для ЭоЭ и встречаются и при других заболеваниях пищевода.
Таким образом, эндоскопическое исследование пищевода не может служить единственным критерием установления диагноза ЭоЭ без патоморфологического исследования полученных биоптатов.
Всем пациентам с подозрением на ЭоЭ рекомендовано проведение патоморфологического исследования биоптатов из пищевода, желудка и двенадцатиперстной кишки с использованием микроскопа высокого разрешения при окраске гематоксилином и эозином. Критерием установления диагноза ЭоЭ служит интраэпителиальная эозинофильная инфильтрация с количеством эозинофилов 15 и более в поле зрения микроскопа высокого разрешения при увеличении х400 (или ≥ 60 эозинофилов на 1 мм2) [1,21].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии. Патоморфологическое исследование биоптатов при ЭоЭ выполняется с использованием окраски гематоксилином и эозином с использованием микроскопа высокого разрешения (увеличение х400). Окраска биоптатов гематоксилином и эозином является достаточной для осуществления подсчета числа эозинофилов и идентификации других гистологических маркеров ЭоЭ. Использование иммуногистохимического исследования, электронной и конфокальной микроскопии для диагностики ЭоЭ оправдано только в научных целях [1].
Главным критерием установления диагноза ЭоЭ служит интраэпителиальная эозинофильная инфильтрация с количеством эозинофилов в поле зрения микроскопа высокого разрешения 15 и более (или ≥ 60 эозинофилов на 1 мм2) (рисунок 5).
Рисунок 5. Морфологическое исследование биоптата из проксимального отдела пищевода, окраска гематоксилином и эозином
А) Скопления эозинофильных лейкоцитов, увеличение х200.
Б) Скопления эозинофильных лейкоцитов более 60 в поле зрения, увеличение х400
Дополнительными гистологическими критериями ЭоЭ являются эозинофильные микроабсцессы (рисунок 6), гиперплазия базального слоя эпителия, расширение межклеточных пространств (рисунок 7), расположение эозинофилов в поверхностных слоях эпителия, мастоцитарная и лимфоцитарная инфильтрация, удлинение сосочков и фиброз собственной пластинки слизистой оболочки (рисунок 8) [1].
Рисунок 6. Эозинофильные абсцессы. Биоптат из проксимального отдела пищевода, окраска гематоксилином и эозином, увеличение х400.
Рисунок 7. Расширенные межклеточные пространства: округлые перицелюллярные пространства в плоском эпителии пищевода, в которых иногда определяются межклеточные мостики. Биоптат из проксимального отдела пищевода, окраска гематоксилином и эозином, увеличение х400.
Рисунок 8. Фиброз собственной пластинки слизистой оболочки. Биоптат из проксимального отдела пищевода, окраска по Маллори, увеличение х200.
Для стандартизации гистологической оценки биоптатов рекомендуется использовать систему балльной оценки (тяжесть и распространенность оценивается в диапазоне от 0-3 баллов) восьми наиболее характерных гистологических изменений, обнаруживаемых у больных с ЭоЭ. Данная шкала, получившая условное название
«Шкала ЭоЭ-специфичных гистологических показателей» (EoE-specific histologic scoring system (EoEHSS)) включает в себя оценку плотности эозинофильной инфильтрации, гиперплазии базального слоя эпителия, наличия эозинофильных абсцессов, поверхностного расположения эозинофилов в слизистой оболочке, расширения межклеточных пространств, повреждения поверхностных слоев эпителия, наличия дискератоза, фиброза собственной пластинки слизистой оболочки [1,3].
Применение шкалы EoEHSS позволяет достичь согласованности в работе морфологов, а также верифицировать диагноз у пациентов, получающих противовоспалительную терапию на момент проведения биопсии (приложение Г3: система балльной оценки биоптатов при ЭоЭ (EoEHSS)).
Необходимо помнить, что у пациентов, получающих лечение антисекреторными препаратами или глюкокортикостероидами, число эозинофилов может быть повышено незначительно или вовсе не превышать норму (5 эозинофилов в поле зрения). Кроме того, в активной стадии заболевания происходит массивная дегрануляция эозинофилов в толще слизистой оболочки пищевода, что также может снижать число видимых эозинофилов. Немаловажную роль играют и технические особенности микроскопов (разные размеры участка ткани, осматриваемого при высоком увеличении), различной технология окраски и фиксации биоптатов. Высокая вариабельность числа эозинофилов в слизистой оболочке пищевода в зависимости от вышеперечисленных факторов значительно затрудняет диагностику ЭоЭ [1,32].
Для оценки степени активности ЭоЭ с учетом клинической картины, данных ЭГДС, данных гистологического исследования биоптатов была разработана шкала активности ЭоЭ (индекс активности ЭоЭ — Eosinophilic Esophagitis Severity Index) [109]. Данная шкала подразумевает оценку в баллах частоты возникновения симптомов, наличия осложнений, эпизоды госпитализаций и экстренных обращений за медицинской помощью, выраженность эндоскопических и гистологических изменений при каждом обращении пациента (приложение Г6). В зависимости от полученного результата активность ЭоЭ оценивается как неактивный (менее 1 балла), легкая степень: 0-6 баллов, средняя: 7-14 баллов, высокая: более 15 баллов.
Пациентам с диагнозом «эозинофильный эзофагит» и стойкой дисфагией рекомендовано проведение рентгеноскопии пищевода с барием с целью определения наличия и распространенности стриктур пищевода.
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарии. Рентгенконтрастное исследование пищевода в диагностике ЭоЭ является дополнительным методом, позволяющим с высокой точностью выявить проксимальные и дистальные стриктуры пищевода, оценить их протяженность, диаметр пищевода в месте сужения, принять решение о необходимости дилатации или бужирования (рисунок 9).
Рисунок 9. Рентгеноскопия пищевода с контрастом: протяженная стриктура дистального отдела пищевода
Пациентам с ЭоЭ и дисфагией, сохраняющейся несмотря на адекватно проводимое лечение и отсутствие стриктур в пищеводе по данным ЭГДС, рекомендовано проведение функциональных методов исследования (манометрии пищевода высокого разрешения, рН импедансометрии пищевода, импеданспланиметрии пищевода).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3). Комментарии. Манометрия пищевода позволяет оценить сократительную функцию пищевода и НПС. У пациентов с ЭоЭ при проведении манометрии нередко выявляются такие нарушения, как неэффективная моторика пищевода, эзофагоспазм. В некоторых случаях (для верификации сочетанной ГЭРБ) пациентам может быть проведена суточная рН-импедансометрия, которая позволяет выявить эпизоды кислых и некислых рефлюксов в пищевод, длительность экспозиции кислоты и болюса в пищеводе.
2.5. Иные диагностические исследования
Пациентам с диагнозом «эозинофильный эзофагит» в рутинном порядке не
рекомендовано проведение кожных аллергологических тестов и исследование уровня сывороточного IgE.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 4)
Комментарии. На ранних этапах изучения патогенеза ЭоЭ существовала точка зрения, что эозинофильное воспаление в пищеводе возникает как проявление пищевой аллергии, разрешающейся на фоне диет. Данная гипотеза поддерживалась тем фактом, что до 50-60
% больных с ЭоЭ имеют в анамнезе атопические заболевания и подтвержденную сенсибилизацию к различным пищевым или воздушным антигенам при проведении специфического аллергологического обследования (кожные скарификационные тесты, определение аллергенспецифических IgE в сыворотке крови).
Известно также, что аллергические реакции на пищевые антигены у значительной доли больных ЭоЭ (15-43%) являются IgE-опосредованными и нередко протекают по типу анафилаксии. С другой стороны, существует целая когорта больных ЭоЭ, не страдающих атопическими заболеваниями, у которых не удается выявить сенсибилизацию к каким- либо пищевым или воздушным аллергенам. В дальнейшем, при исследовании диагностической ценности кожных скарификационных и аппликационных тестов у больных с ЭоЭ оказалось, что они обладают очень невысокой прогностической ценностью в отношении продуктов питания, вызывающих активацию эозинофильного воспаления в слизистой оболочке пищевода у конкретных больных. На сегодняшний день известно, что патогенез ЭоЭ не связан с реакциями гиперчувствительности немедленного типа и гиперпродукцией IgE, поэтому исследование уровня сывороточного IgE или проведение кожных аллергологических тестов с целью диагностики ЭоЭ не обосновано [1,21].
Однако аллергологическое тестирование показано пациентам с сопутствующими аллергическими заболеваниями (аллергический ринит, бронхиальная астма, атопический дерматит), а также пациентам с подозрением на пищевую аллергию.
Диагностика коморбидных аллергических заболеваний (БА, АтД, АР/конъюнктивит) рекомендуется как необходимый компонент оценки атопической конституции у пациентов с ЭоЭ и проводится аллергологом-иммунологом. При подозрении на пищевую аллергию выполняются кожные тесты с аллергенами, определение специфических IgE, тесты элиминации-провокации.
3. ЛЕЧЕНИЕ, ВКЛЮЧАЯ МЕДИКАМЕНТОЗНУЮ И НЕМЕДИКАМЕНТОЗНУЮ ТЕРАПИИ, ДИЕТОТЕРАПИЮ,
ОБЕЗБОЛИВАНИЕ, МЕДИЦИНСКИЕ ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ МЕТОДОВ ЛЕЧЕНИЯ
Целями терапии ЭоЭ являются достижение клинической (купирование дисфагии) и гистологической ремиссии заболевания, предотвращение развития осложнений (стриктуры пищевода). Под гистологической ремиссией ЭоЭ подразумевают разрешение эозинофильного воспаления (менее 15 эозинофилов в поле зрения микроскопа высокого разрешения при увеличении х400 или менее 60 эозинофилов в 1 мм2). Современная
концепция лечения больных ЭоЭ включает медикаментозную терапию, диетические ограничения, и, при необходимости, проведение эндоскопической дилатации пищевода.
Диетические ограничения, ИПП и топические стероиды являются терапией первой линии в лечении больных ЭоЭ. Тактика лечения зависит от предпочтений пациента и может быть впоследствии изменена. Эндоскопическая дилатация пищевода должна проводиться пациентам с тяжелой дисфагией и эпизодами вклинения пищи в пищевод независимо от типа применяемой базисной терапии.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии. До 50 % больных с ЭоЭ отвечают на терапию ИПП установлением клинической и гистологической ремиссии (<15 эозинофилов в поле зрения микроскопа высокого разрешения). На сегодняшний день ИПП рассматриваются как препараты первой линии в терапии ЭоЭ в связи с высокой эффективностью, удобством применения (по сравнению с топическими стероидами), безопасностью.
Решение о выборе метода лечения рекомендовано принимать совместно с пациентом, обсудив с ним все положительные и отрицательные стороны альтернативных методов лечения (топические стероиды, эмпирическая диета).
Топические стероиды и диета являются терапией выбора для пациентов, не достигших ремиссии на фоне приема ИПП. В данном случае решение о тактике лечения должно приниматься исходя из возраста пациента, выраженности его симптомов и тяжести воспалительного процесса в слизистой оболочке пищевода. Известно, что дети и подростки с трудом придерживаются диетических ограничений, в связи с чем, более рациональным для них будет назначение топических кортикостероидов. Справедливо это и для пациентов с тяжелыми симптомами заболевания, у которых диетические ограничения скорее всего будут неэффективны.
Важно, что терапия пациентов с ЭоЭ может со временем изменяться (при желании пациента, возникновении побочных эффектов и проч.), поскольку существуют данные, показывающие, что достижение ремиссии на фоне ИПП не исключает эффективности топических стероидов или диеты и наоборот
Всем пациентам с установленным диагнозом «эозинофильный эзофагит» рекомендуется поведение терапии как можно в более ранние сроки. Своевременно начатая терапия позволяет предотвратить в будущем развитие осложнений (стриктуры), требующих эндоскопического лечения [21].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3) Комментарии. Имеющиеся на сегодняшний день данные свидетельствуют о том, что несвоевременно начатое лечение (после появления первых симптомов) длительностью 2 года приводит к развитию стриктур пищевода у 17%–19% больных, начало лечения через 20 лет после манифестации первых симптомов осложняется стриктурами у 71% пациентов. В то же время своевременное начало лечения топическими стероидами или диетическими ограничениями позволяет достичь обратного развития фибростенотических изменений в стенке пищевода [35-37].
3.1 Диета
Неоспоримые преимущества диетической терапии ЭоЭ включают отсутствие
побочных эффектов, невысокую стоимость, эффективность (особенно у детей) в достижении не только клинической, но и гистологической ремиссии (приложение Б). Недостатками применения диет для лечения ЭоЭ являются значительное снижение качества жизни пациентов, вынужденных пожизненно придерживаться строгих ограничений, социальная дезадаптация, необходимость проведения ЭГДС в случае введения новых пищевых продуктов в рацион (для контроля за активностью воспалительного процесса). В лечении ЭоЭ используются несколько диетических режимов: элементная диета, элиминационная диета, основанная на данных аллергологического тестирования и диета с исключением 6 продуктов (4 или 2 продуктов).
Сочетание диеты и медикаментозной терапии не должно назначаться в рутинном порядке всем больным с ЭоЭ. Такая комбинация может быть рассмотрена только при неэффективности медикаментозной терапии.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3)
Комментарии. Медикаментозная терапия и диета имеют сопоставимую эффективность в достижении гистологической ремиссии заболевания. Однако соблюдение диеты сопряжено с большим количеством неудобств, ограничений, значительно снижает качество жизни. При несбалансированном рационе диета может стать причиной дефицита нутриентов и привести к потере массы тела (у детей – к задержке физического развития), требует проведения частых эндоскопических исследований для оценки активности воспаления после введения в рацион нового продукта-триггера. В связи с этим, пациенты чаще отдают предпочтение медикаментозному лечению, которого, в большинстве случаев, вполне достаточно для купирования симптомов заболевания и достижения гистологической ремиссии. Сочетание диеты и медикаментозной терапии может быть рекомендовано только в случае неэффективности монотерапии диетой или медикаментами [21].
Пациентам с ЭоЭ не рекомендовано применение диеты, основанной на данных аллергологического (скарификационные, аппликационные и прик- кожные тесты, определение специфических IgE к продуктам) тестирования.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3) Комментарии. Элиминационная диета составляется индивидуально для каждого пациента с ЭоЭ, основываясь на данных аллергологического тестирования (кожные скарификационные и аппликационные пробы, данные серологического тестирования IgE).
Несмотря на то, что очень часто больные ЭоЭ страдают сопутствующими атопическими заболеваниями (астма, экзема, ринит), ассоциированными с IgE, ЭоЭ не является IgE зависимым заболеванием, поэтому эффективность данного диетического режима крайне невысока.
В среднем, ремиссии на фоне элиминационной диеты удается достичь у 45,5% (95% CI 35,4–55,7%) больных с ЭоЭ, причем эффективность данного терапевтического подхода у взрослых больных значительно ниже, чем у детей [1,3,40-44]. В настоящее время считается нецелесообразным назначение данной диеты для лечения ЭоЭ в связи с ее невысокой эффективностью.
Пациентам с ЭоЭ рекомендовано назначение эмпирической диеты с исключением 6 групп продуктов питания (коровье молоко, глютен, морепродукты, орехи, яйца, соя и бобовые).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3)
Пациентам с ЭоЭ может быть рекомендована диета с исключением 4 групп (коровье молоко, глютен, яйца, соя и бобовые) или 2 групп (глютен/ коровье молоко или яйца/ коровье молоко) продуктов питания. Такая диета характеризуется более высоким уровнем приверженности пациентов, однако меньшей эффективностью, чем диета с исключением 6 групп продуктов.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3)
Комментарии. Исключение из рациона больных ЭоЭ шести групп продуктов с наибольшим аллергенным потенциалом (коровье молоко, глютен, морепродукты, орехи, яйца, соя и бобовые) приводит к индукции ремиссии у двух третей пациентов, независимо от их возраста. Диета с исключением 4 групп продуктов приводит к индукции ремиссии у половины пациентов, диета с исключением 2 групп продуктов (молоко и глютен или молоко и яйца) – у 40% пациентов [39,43,45,46].
В настоящее время широко дискутируется вопрос о возможности ступенчатого подхода к диетическим ограничениям: исключение 1 или 2 продуктов (молоко, пшеница, яйца) на начальном этапе лечения с постепенным расширением списка запрещенных продуктов у пациентов, не достигших гистологической ремиссии на фоне более либеральной диеты.
Ступенчатый подход к диетическим ограничениям у больных ЭоЭ уже оценен в клиническом исследовании и опубликован в 2016 г с обнадеживающими результатами: исключение коровьего молока и глютен-содержащих злаков привел к ремиссии у 40% больных. У пациентов, не достигших ремиссии на фоне такого режима, в последующем исключались из рациона 4 групп продуктов (ремиссия у 52%). Далее, в случае неудачи, вводилась диета с ограничением 6 групп продуктов (ремиссия у 65%) [47-52].
Диета должна назначаться и корректироваться с участием опытного врача диетолога. Связано это с тем, что продукты питания, исключаемые при ЭоЭ, служат важным источником нутриентов, микро- и макроэлементов, необходимы для полноценного роста и развития. На фоне элиминационных диет повышен риск развития дефицита витамина D, кальция, железа, потери (или у детей — задержки прибавки) массы тела. Необходимо составление сбалансированного рациона, полностью обеспечивающего потребности в макро- и микронутриентах. При необходимости должны быть использованы специализированные продукты лечебного питания, обогащенные продукты, витаминно-минеральные комплексы (приложение Б, алгоритм 3). Обязательна оценка эффективности диеты путем проведения ЭГДС с множественной биопсией через 8–12 недель после инициации диеты и, в дальнейшем, при введении каждого нового продукта-триггера в рацион [21].
Пациентам с ЭоЭ в случае неэффективности медикаментозной терапии и элиминационных диет может быть рекомендована элементная диета (аминокислотные смеси).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3) Комментарии. Элементная диета включает употребление в пищу специально приготовленных аминокислотных смесей с минимальной антигенной активностью (на фоне полного исключения из рациона любой другой пищи). Применение элементной диеты приводит к достижению гистологической ремиссии у 90,8% (95% CI 84,7–95,5%) больных ЭоЭ.
Столь высокая эффективность элементной диеты, к сожалению, сопряжена с целым рядом сопутствующих факторов, не позволяющих применять ее у большинства пациентов. Так, вкус смесей зачастую требует применения назогастрального зонда для их введения у детей, а более чем треть взрослых отказываются от диеты в течение 4 недель. Наряду с этим, необходимость полностью исключить из рациона привычную пищу вызывает значительный моральный дискомфорт, социальную дезадаптацию и в целом приводит к выраженному снижению качества жизни пациента. Элементные диеты имеют ограниченную роль при эозинофильном эзофагите, они обладают высокой эффективностью, но низким уровнем соблюдения режима лечения и должны применяться для пациентов, невосприимчивых к другим видам лечения.
Таким образом, в реальной клинической практике применение аминокислотных смесей в качестве лечебной тактики при ЭоЭ возможно главным образом у грудных детей с выраженными клиническими симптомами и эозинофильным воспалением слизистой оболочки пищевода, не разрешающимися на фоне медикаментозной терапии [1,38,39]. Однако смеси на основе аминокислот могут использоваться у детей старше года в составе элиминационных диет с целью формирования полноценного рациона. Аминокислотные смеси могут быть полезными в качестве дополнения к элиминационной диете, особенно когда происходит потеря веса или имеет место ограничение размеров порций и/или избегание еды.
3.2 Медикаментозное лечение
Пациентам с ЭоЭ показано назначение ИПП на срок 8–12 недель для индукции клинической и гистологической ремиссии в стандартной дозе в режиме 2 раза в день. Уровень убедительности рекомендаций А (уровень достоверности доказательств — 3).
Пациентам, ответившим на терапию ИПП возникновением гистологической и клинической ремиссии, показана длительная поддерживающая терапия [1, 55–65].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 3).
Комментарии. Развитие клинико-гистологической ремиссии на фоне приема ИПП наблюдается примерно у половины больных ЭоЭ детей (50,5%) и взрослых (60,8%). Несмотря на не столь очевидную эффективность ИПП при ЭоЭ, удобство применения и низкая частота побочных эффектов (даже при длительном применении) делает их
препаратами первой линии терапии [21].
На сегодняшний день в терапии взрослых больных ЭоЭ рекомендовано применение 20-40 мг омепразола дважды в день или эквивалентных доз других ИПП [1,3].
Для индукции ремиссии тяжелого эзофагита у детей рекомендовано назначение ИПП (омепразола или эзомепразола) из расчета 1 мг/кг на 1 прием дважды в день в течение 8 недель. Дозы ИПП у детей не должны превышать следующие: лансопразол 30 мг 2 раза в день, эзомепразол 40 мг в день или омепразол 40 мг 2 раза в день [21].
Мета анализ по сравнению режима приема ИПП (один раз в день или два раза в день) показал незначительное повышение эффективности лечения при разделении суточной дозировки на 2 приема [62].
Вопрос о длительности терапии и дозах ИПП, необходимых для поддержания ремиссии по сей день остается открытым. Рецидив клинической симптоматики и активизация эозинофильного воспаления возникает в среднем через 3-6 месяцев после отмены ИПП. В случае, если на фоне ИПП удалось достичь гистологической ремиссии заболевания, рекомендуется продолжить терапию длительно [1,3,21, 55–65]. На сегодняшний день опубликованы исследования, где длительность поддерживающей терапии составляла максимально 12 месяцев, эффективность данного подхода в отношении поддержания клинической и гистологической ремиссии составила 69,9% пациентов [103].
Эффективность ИПП при ЭоЭ объясняется восстановлением целостности эпителиального барьера, что препятствует глубокому проникновению экзогенных антигенов в толщу слизистой оболочки, а также наличием у ИПП собственной противовоспалительной активности.
В связи с тем, что нарушение барьерной функции слизистой оболочки пищевода признано одним из ключевых факторов патогенеза ЭоЭ, а также учитывая высокую частоту сочетанного течения ГЭРБ и ЭоЭ применение ИПП в лечении больных ЭоЭ представляется достаточно обоснованным. Воздействие агрессивного рефлюктата при ГЭРБ приводит к повреждению слизистой оболочки пищевода и более глубокой пенетрации антигенов, высвобождению медиаторов воспаления клетками лейкоцитарного ряда, стимулирует увеличение продолжительности жизни эозинофилов. Заживление слизистой оболочки под влиянием ИПП предупреждает дальнейшую антигенную стимуляцию иммунокомпетентных клеток в слизистой оболочке пищевода и тем самым тормозит воспалительный процесс.
Собственная противовоспалительная активность ИПП основана на блокировании стимулированной (цитокинами Т-хелперов 2 типа) экспрессии эотаксина-3 в эпителиальных клетках слизистой оболочки пищевода, угнетении экспрессии молекул сосудистой адгезии, функции нейтрофилов и продукции провоспалительных цитокинов.
Интересно, что еще совсем недавно пациентов, отвечающих на терапию ИПП облегчением симптомов и нормализацией гистологической картины, не относили к ЭоЭ, а включали в группу больных «эзофагеальной эозинофилией, разрешающейся при терапии ИПП». Последние несколько лет были ознаменованы большим количеством исследований, призванных внести ясность в терминологию. Большинство работ показали отсутствие каких бы то ни было отличий в клинических проявлениях, эндоскопических, гистологических, функциональных (рН-метрия пищевода) и
молекулярно-генетических особенностях у больных ЭоЭ и больных с эзофагеальной эозинофилией, отвечающей на терапию ИПП.
Согласно последним международным консенсусным документам эзофагеальная эозинофилия, разрешающаяся на фоне терапии ИПП является одним из фенотипических проявлений ЭоЭ, а не отдельным заболеванием [1].
Пациентам с ЭоЭ, не достигшим клинической и гистологической ремиссии на фоне приема ИПП, показано назначение топических кортикостероидов для индукции и поддержания ремиссии [1,3,66-81].
Уровень убедительности рекомендаций А (уровень достоверности доказательств
— 1).
Комментарии. Препаратами выбора в индукции и поддержании гистологической ремиссии являются топические стероиды. Системные кортикостероиды в лечении ЭоЭ в настоящее время не используются.
Для лечения больных ЭоЭ используются различные лекарственные формы топических стероидов: таблетки, длительно растворяющиеся во рту, аэрозоль флутиказона (по системе впрыск-глоток), густая суспензия будесонида (смешать 1–2 мг будесонида с 5 мг сукралозы). Частота достижения клинико-патологической ремиссии на фоне топических стероидов варьирует (в зависимости от лекарственной формы и длительности терапии) от 57–84% (таблица 3) [21]. При применении будесонида в виде густого сиропа удается достичь гистологической ремиссии у 64% больных и лишь у 27% больных, применявших небулайзер с флутиказоном [71]. Объясняется это более длительной аппликацией сиропа (по сравнению с аэрозолем) будесонида на слизистой оболочке дистального отдела пищевода (что было доказано с помощью сцинтиграфии).
Наибольшую эффективность (ремиссия у 84% пациентов) продемонстрировали таблетки будесонида, растворяющиеся во рту, применявшиеся в течение 12 недель (1 мг 2 раза в сутки) [104].
Таблица 3. Дозы топических кортикостероидов для индукции и поддержания ремиссии у больных ЭоЭ
Лекарственный препарат Целевая популяция Доза для индукции ремиссии Доза для
поддерживающей терапии
Флутиказона пропионат Дети 880–1760 мкг/сут 440–880 мкг/сут
Взрослые 1760 мкг/сут 880–1760 мкг/сут
Будесонид Дети 1–2 мг/сут 1 мг/сут
Взрослые 2–4 мг/сут 1-2 мг/сут
В течение 30–60 минут после применения топических стероидов важно воздержаться от приема пищи и жидкостей во избежание удаления лекарственного препарата со слизистой оболочки пищевода (таблица 3).
Дозы топических стероидов для детей рекомендуется подбирать исходя из антропометрических показателей: для индукции ремиссии при росте менее 150 см назначается 1 мг будесонида в сутки, при росте 150 см и более — 2 мг будесонида в сутки
(в один или два приема). В случае, если на такой дозе не удается достичь гистологической ремиссии, допустимо увеличить дозу до 4 мг в сутки (для детей старше 11 лет, рост более 150 см).
У большинства больных рецидив эозинофильного воспаления наступает уже через несколько недель после отмены топических стероидов, в связи с чем необходима длительная поддерживающая терапия. В настоящее время для поддержания ремиссии у взрослых рекомендовано использовать будесонид в дозе 0,5 мг 2 раза в сутки или 1 мг 2 раза в сутки. Эффективность таких режимов составляет соответственно 73,5 и 75% [105]. Рекомендованная длительность поддерживающей терапии — 1 год и более. Для поддерживающей терапии у детей должна подбираться минимально эффективная доза будесонида в зависимости от роста, веса и выраженности побочных эффектов.
Топические стероиды отличаются достаточно высоким профилем безопасности.
Доказанным побочным эффектом их применения является развитие кандидоза пищевода. Терапия кандидоза пищевода проводится назначением противогрибковых препаратов перорально (нистатин или флуконазол) [21].
Существуют некоторые опасения, касающиеся возможного влияния заглатываемых топических стероидов на секрецию эндогенного кортизола, особенно у детей. Пациентам детского возраста, принимающим высокие дозы топических стероидов, рекомендуется регулярное мониторирование уровня сывороточного кортизола с целью профилактики развития надпочечниковой недостаточности [1,3,66- 81].
Применение системных кортикостероидов для лечения ЭоЭ не рекомендовано.
Уровень убедительности рекомендаций А (уровень достоверности доказательств
— 1).
Комментарии. Доказано, что системные и топические стероиды одинаково эффективны в достижении клинической и гистологической ремиссии ЭоЭ. Однако побочные эффекты, такие как повышение аппетита, увеличение массы тела, кушингоид, развивающиеся не менее чем у 40 % больных, делают применение системных стероидов в лечении ЭоЭ нецелесообразным [66].
Азатиоприн и 6-меркаптопурин не рекомендованы для лечения ЭоЭ [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Антигистаминные препараты, антагонисты лейкотриеновых рецепторов (монтелукаст) не рекомендованы для лечения ЭоЭ, однако могут использоваться для коррекции сопутствующих атопических заболеваний.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
Комментарии. Антигистаминные препараты, с успехом используемые в лечении аллергического ринита и бронхиальной астмы, оказались абсолютно несостоятельны в купировании симптомов и влиянии на выраженность эозинофильного воспаления в
слизистой оболочке пищевода у больных ЭоЭ [84,85].
Кромогликат натрия, препятствующий дегрануляции тучных клеток (мастоцитов), также показал свою неэффективность при лечении больных ЭоЭ, несмотря на доказанную роль мастоцитов в патогенезе ЭоЭ [86].
Антогонист лейкотриеновых рецепторов 1 типа (монтелукаст), используемый в высоких дозах (10–100 мг) [87] у взрослых и стандартных дозах у детей [88], приводит к некоторому клиническому улучшению, однако гистологической ремиссии на фоне приема монтелукаста достигнуть не удалось [89-90].
Препараты моноклональных антител, используемые для лечения воспалительных заболеваний кишечника (антитела к ФНО), не рекомендованы для лечения ЭоЭ.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3).
Подтверждена эффективность и безопасность биологической терапии моноклональными антителами к альфа-субъединице рецептора ИЛ-4 (ИЛ-4Rα) у пациентов с эозинофильным эзофагитом. Требуются дальнейшие исследования, чтобы доказать эффективность биологической терапии другими препаратами (моноклональные антитела к ИЛ-5, к ИЛ-5Rα, ИЛ-14)
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3).
Комментарии. Известно, что экспрессия Th2-ассоциированных цитокинов (ИЛ-4, ИЛ-5, ИЛ-13) в слизистой оболочке пищевода больных ЭоЭ значительно повышена [91].
В патогенезе ЭоЭ ИЛ-5 является ключевым цитокином, который стимулирует пролиферацию эозинофилов в костном мозге, их экспансию в слизистую оболочку пищевода и увеличивает продолжительность жизни эозинофилов [92,93]. ИЛ-5 продуцируется Т-хелперами 2 типа, мастоцитами, эозинофилами.
В экспериментах на мышах ИЛ-5 вызывал развитие эозинофилии пищевода, тогда как нейтрализация данного цитокина приводила к купированию эзофагита [93]. Эти наблюдения послужили поводом к проведению исследований по изучению эффективности человеческих моноклональных антител к ИЛ-5 в лечении ЭоЭ. К сожалению, использование антител к ИЛ-5 (меполизумаб) не оказало значимого влияния на клиническую картину заболевания, несмотря на некоторое снижение интенсивности эозинофильной инфильтрации слизистой оболочки пищевода [94]. В настоящее время проводятся исследования с использованием препарата бенрализумаб, представляющего собой моноклональные антитела к рецептору ИЛ-5 (anti-IL-5Rα) [95,96].
ИЛ-13 – цитокин, участвующий в патогенезе большинства атопических заболеваний. В слизистой оболочке больных ЭоЭ наблюдается гиперэкспрессия ИЛ-13. Основными источниками ИЛ-13 являются Т-хелперы 2 типа и эозинофилы [97-101].
Первые исследования с использованием антител к ИЛ-13 показали значительное снижение выраженности эозинофильного воспаления в пищеводе, симптомов заболевания и улучшение гистологической картины (включая случаи заболевания,
резистентные к терапии глюкокортикостероидами) [99,100].
Еще одной стратегией лечения ЭоЭ является применение препарата дупилумаб, представляющего собой человеческие моноклональные антитела к субъединице альфа рецептора IL-4Rα – общей для ИЛ-4 и ИЛ-13. ИЛ-4 является цитокином, регулирующим дифференцировку наивных Т-хелперов по пути образования Т- хелперов 2 типа, который стимулирует преобразование В-лимфоцитов в плазмоциты, синтезирующие IgE. Свои эффекты ИЛ-4 реализует, связываясь с рецептором IL-4Rα и активируя ген STAT6.
Дупилумаб, подавляющий сигнальные пути ИЛ-4 и ИЛ-13, показал высокую эффективность в лечении атопического дерматита и бронхиальной астмы. Применение дупилумаба* для лечения основного заболевания (бронхиальной астмы, атопического дерматита или полипозного риносинусита), у пациентов с ЭоЭ способствует улучшению симптомов и приводит к гистологической ремиссии заболевания, а также снижает потребность в терапии эозинофильного эзофагита [102].
Возможности использования дупилумаба* при ЭоЭ изучены в настоящее время у взрослых и детей от 12 лет и старше (завершено исследование фазы 3, достигнуты первичные и вторичные конечные точки, улучшение симптомов и гистологическая ремиссия эозинофильного эзофагита) [107]. На основании полученных результатов препарат зарегистрирован в США в мае 2022 г. для лечения эозинофильного эзофагита у взрослых и детей от 12 лет и старше с массой тела не менее 40 кг. В июле 2022 г. представлены положительные результаты исследования 3 фазы применения дупилумаба* у детей с эозинофильным эзофагитом в возрасте от года до 12 лет [108].
*Дупилумаб, бенрализумаб, меполизумаб не зарегистрированы в РФ для терапии пациентов с эозинофильным эзофагитом.
Эффективность медикаментозной терапии и диетических режимов должна быть обязательно оценена через 8–12 недель после начала лечения путем проведения ЭГДС с биопсией на фоне продолжающегося приема препаратов и/или соблюдения диеты.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарии. Степень активности воспалительного процесса в слизистой оболочке пищевода при ЭоЭ не коррелирует с выраженностью симптомов заболевания. Для оценки эффективности лечения и контроля за активностью воспалительного процесса необходимо гистологическое исследование биоптатов. Критерием эффективности лечения служит достижение гистологической ремиссии заболевания (менее 15 эозинофилов в поле зрения при увеличении х400мм3).
3.3 Эндоскопическое лечение
Пациентам с ЭоЭ со стриктурами и/или стенозами пищевода, приводящими к стойкой дисфагии и эпизодам вклинения пищи в пищевод, показано проведение эндоскопической баллонной дилатации или бужирования пищевода.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарии. ЭоЭ — хроническое иммуно-воспалительное прогрессирующее заболевание, которое в отсутствии адекватного лечения неизбежно приводит к развитию стриктур/стеноза пищевода. Жалобы, обусловленные воспалительными изменениями в слизистой оболочке пищевода, могут быть успешно купированы медикаментозной терапией или диетой. Фиброзные изменения стенки, приводящие к тяжелой дисфагии, подлежат обязательному эндоскопическому лечению.
Дилатация пищевода приводит к облегчению/разрешению дисфагии у 75% (95% CI 58–93%) пациентов [82]. Применение дилатации пищевода значительно облегчает проявление дисфагии у пациентов с пищеводными стриктурами, если ранее проводимая медикаментозная терапия не была успешной. Осложнения (перфорации, кровотечения, загрудинная боль) эндоскопической дилатации пищевода возникают редко (в 0,1-0,3% случаев). После эндоскопической дилатации пациентов может беспокоить загрудинная боль (треть больных в первые дни после дилатации пищевода и до 2% в отдаленный постоперационный период) [1,3,82].
Эндоскопическую дилатацию или бужирование рекомендуется проводить пациентам со стриктурами и стенозом пищевода (при диаметре пищевода <13 мм) после пробного курса медикаментозной терапии.
Эндоскопическая дилатация пищевода не может быть единственным лечебным мероприятием у больных с ЭоЭ, она должна проводиться на фоне базисной противовоспалительной терапии ИПП или топическими кортикостероидами.
Эндоскопическая дилатация не оказывает влияния на иммуно-воспалительный процесс в слизистой оболочке, данная процедура проводится с целью снижения выраженности клинических симптомов, вызванных необратимыми фибротическими изменениями стенки пищевода.
4. МЕДИЦИНСКАЯ РЕАБИЛИТАЦИЯ И САНАТОРНО- КУРОРТНОЕ ЛЕЧЕНИЕ, МЕДИЦИНСКИЕ ПОКАЗАНИЯ И
ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ МЕТОДОВ МЕДИЦИНСКОЙ РЕАБИЛИТАЦИИ, В ТОМ ЧИСЛЕ ОСНОВАННЫХ НА ИСПОЛЬЗОВАНИИ ПРИРОДНЫХ ЛЕЧЕБНЫХ ФАКТОРОВ
Методы реабилитации при ЭоЭ не разработаны.
5. ПРОФИЛАКТИКА И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ, МЕДИЦИНСКИЕ ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К
ПРИМЕНЕНИЮ МЕТОДОВ ПРОФИЛАКТИКИ
Первичная профилактика ЭоЭ не разработана. Вторичная профилактика направлена на предотвращение развития осложнений, таких как стриктуры и стенозы, и включает в себя своевременную диагностику заболевания, назначение адекватной
постоянной поддерживающей медикаментозной терапии и проведение ЭГДС с биопсией из пищевода с периодичностью 1 раз в год.
6. ОРГАНИЗАЦИЯ ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ
Большинство пациентов с ЭоЭ подлежат наблюдению и лечению в амбулаторных условиях. Показания для плановой госпитализации: нарастание дисфагии.
Показания для экстренной госпитализации: острая обтурационная дисфагия (эпизод вклинения пищи в пищевод).
7. ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ (В ТОМ ЧИСЛЕ ФАКТОРЫ ВЛИЯЮЩИЕ НА ИСХОД ЗАБОЛЕВАНИЯ ИЛИ
СОСТОЯНИЯ)
Эозинофильный эзофагит был выделен в отдельную нозологию лишь около 30 лет назад, в связи с чем данные о частоте развития осложнений или спонтанных ремиссий, прогнозе заболевания, сроках поддерживающей терапии по сей день остаются скудными и противоречивыми.
В целом ЭоЭ характеризуется доброкачественным течением. В литературе нет данных о развитии рака пищевода на фоне ЭоЭ. Другой особенностью заболевания является крайне медленное его прогрессирование. Скорее всего, это связано с тем, что выраженность дисфагии у пациентов с ЭоЭ зависит в первую очередь от фибротического ремоделирования стенки пищевода, которое при ЭоЭ происходит в течение нескольких лет/десятилетий. Кроме того, больные постепенно адаптируются к возникающим симптомам, более тщательно пережевывают пищу, обильно запивают ее водой, избегают продуктов с твердой и грубой текстурой.
Благоприятное течение заболевания подтверждается также данными о том, что даже кратковременное медикаментозное лечение ЭоЭ приводит к многомесячной ремиссии заболевания. Дилатация стриктур пищевода обеспечивает купирование дисфагии на срок до 1 года даже при отсутствии противовоспалительной медикаментозной терапии.
Существующая модель прогрессирования ЭоЭ отражает постепенный переход от воспалительных изменений к фиброзу и стенозу пищевода с развитием дисфагии у большинства больных ЭоЭ (рисунок 10). В случае своевременного начала медикаментозной терапии и диетических ограничений на ранних стадиях заболевания возможно замедление прогрессирования фибротических изменений. Описаны случаи возникновения спонтанных ремиссий заболевания (без применения медикаментозной терапии или диет), однако они нехарактерны для ЭоЭ и являются скорее исключением. Имеющиеся на современном этапе данные не позволяют сформулировать однозначные рекомендации относительно длительности поддерживающей терапии при ЭоЭ.
Рисунок 10. Естественное течение (при отсутствии лечения) ЭоЭ
КРИТЕРИИ ОЦЕНКИ КАЧЕСТВА МЕДИЦИНСКОЙ ПОМОЩИ
№ Критерии качества Уровень достоверности доказательств Уровень убедительности рекомендаций
1 Проведена ЭГДС с биопсией из дистального и среднего/проксимального отделов
пищевода А 1
2 Проведена биопсия как минимум
из 2 отделов пищевода, не менее 6 биоптатов А 1
3 Проведена биопсия из желудка и двенадцатиперстной кишки для исключения их эозинофильной
инфильтрации А 1
4 Проведена медикаментозная терапия ИПП или топическими
стероидами и/или назначена А 1
диета с исключением продуктов-
триггеров для индукции ремиссии
5 Проведено контрольное эндоскопическое исследование пищевода через 8–12 недель после назначения медикаментозной терапии или диеты с проведением множественной биопсии (не менее 6 биоптатов) для оценки
эффективности лечения А 2
5 Проведена эндоскопическая дилатация или бужирование пищевода при повторяющихся эпизодах вклинения пищи в пищевод и/или тяжелой дисфагии, не купирующихся на фоне
медикаментозной терапии и диеты А 2
6 Назначена постоянная поддерживающая медикаментозная терапия в минимально эффективной
дозировке или эффективная диета В 2
7 Проведено эндоскопическое наблюдение 1 раз в год (ЭГДС с
биопсией из пищевода) С 5
СПИСОК ЛИТЕРАТУРЫ
ПРИЛОЖЕНИЕ А1. СОСТАВ РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ КЛИНИЧЕСКИХ
РЕКОМЕНДАЦИЙ
Драпкина Оксана Михайловна — академик РАН доктор медицинских наук, профессор. Конфликт интересов отсутствует.
Кайбышева Валерия Олеговна — кандидат медицинских наук. Конфликт интересов отсутствует.
Кашин Сергей Владимирович — кандидат медицинских наук. Конфликт интересов отсутствует.
Куваев Роман Олегович — кандидат медицинских наук. Конфликт интересов отсутствует. Лохматов Максим Михайлович — доктор медицинских наук, профессор. Конфликт интересов отсутствует.
Макарова Светлана Геннадиевна — доктор медицинских наук, профессор. Конфликт интересов отсутствует.
Малявин Андрей Георгиевич — доктор медицинских наук, профессор. Конфликт интересов отсутствует.
Мартынов Анатолий Иванович — доктор медицинских наук, профессор, академик РАН. Конфликт интересов отсутствует.
Михалева Людмила Михайловна — член-корреспондент РАН, доктор медицинских наук, профессор. Конфликт интересов отсутствует.
Мухаметова Евгения Маратовна — кандидат медицинских наук. Конфликт интересов отсутствует.
Ненашева Наталья Михайловна — доктор медицинских наук, профессор. Конфликт интересов отсутствует.
Никонов Евгений Леонидович — доктор медицинских наук, профессор. Конфликт интересов отсутствует.
Пирогов Сергей Сергеевич — доктор медицинских наук. Конфликт интересов отсутствует.
Смолкин Юрий Соломонович — доктор медицинских наук, профессор. Конфликт интересов отсутствует.
Шаповальянц Сергей Георгиевич — доктор медицинских наук, профессор. Конфликт интересов отсутствует.
Федоров Евгений Дмитриевич — доктор медицинских наук, профессор. Конфликт интересов отсутствует.
Хакимова Резеда Фидаиловна — доктор медицинских наук, профессор. Конфликт интересов отсутствует.
Горбачев Евгений Васильевич — кандидат медицинских наук. Конфликт интересов отсутствует.
Иванова Екатерина Викторовна — доктор медицинских наук. Конфликт интересов отсутствует.
Будкина Татьяна Николаевна — кандидат медицинских наук. Конфликт интересов отсутствует.
Бордин Дмитрий Станиславович — доктор медицинских наук, профессор. Конфликт интересов отсутствует.
Валитова Элен Робертовна — кандидат медицинских наук. Конфликт интересов отсутствует.
ПРИЛОЖЕНИЕ А2. МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Предлагаемые рекомендации имеют своей целью довести до практических врачей современные представления об этиологии и патогенезе эозинофильного эзофагита, познакомить с применяющимся в настоящее время алгоритмом диагностики и лечения.
Целевая аудитория данных клинических рекомендаций:
1. Врачи-гастроэнтерологи
2. Врачи общей практики (семейные врачи)
3. Врачи-терапевты
4. Врачи-эндоскописты
5. Врачи-морфологи
6. Врачи-педиатры
7. Врачи-аллергологи-иммунологи
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД Расшифровка
1 Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с
применением мета-анализа
2 Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных
клинических исследований, с применением мета-анализа
3 Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования,
В том числе когортные исследования
4 Несравнительные исследования, описание клинического случая
5 Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Уровни достоверности доказательств с указанием использованной классификации уровней достоверности доказательств (УДД)
УДД Расшифровка
1 Систематический обзор рандомизированных клинических исследований с
применением мета-анализа
2 Отдельные рандомизированные клинические исследования и систематические
обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета- анализа
3 Нерандомизированные сравнительные исследования, в том числе когортные
исследования
4 Несравнительные исследования, описание клинического случая или серии
случаев, исследование «случай-контроль»
5 Имеется лишь обоснование механизма действия вмешательства
(доклинические исследования) или мнение эксперта
Таблица 3. Уровни убедительности рекомендаций (УУР) с указанием использованной классификации уровней убедительности рекомендаций
УУР Расшифровка
А Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим
исходам являются согласованными)
В Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по
интересующим исходам не являются согласованными)
С Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по
интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждѐнным КР, но не чаще 1 раза в 6 месяцев.
ПРИЛОЖЕНИЕ А3. СПРАВОЧНЫЕ МАТЕРИАЛЫ, ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К
ПРИМЕНЕНИЮ И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ ЛЕКАРСТВЕННОГО ПРЕПАРАТА.
Данные клинические рекомендации разработаны с учетом следующих нормативно- правовых документов:
1. Приказ Министерства здравоохранения и социального развития Российской Федерации от 02.06.2010 No 415н ―Об утверждении Порядка оказания медицинской помощи населению при заболеваниях гастроэнтерологического профиля‖
2. Приказ Министерства здравоохранения Российской Федерации от 10 мая 2017 г. No 203н "Об утверждении критериев оценки качества медицинской помощи».
ПРИЛОЖЕНИЕ Б. АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
ПРИЛОЖЕНИЕ В. ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Эозинофильный эзофагит — это наследственно обусловленное доброкачественное хроническое заболевание пищевода, которое может приводить к развитию сужений пищевода и нарушению нормального процесса глотания (дисфагии). Для предотвращения развития осложнений эозинофильного эзофагита необходима постоянная поддерживающая терапия препаратами из группы ингибиторов протонной помпы или кортикостероидных гормонов, применяемых местно внутрь. Небольшой доле пациентов с
эозинофильным эзофагитом для поддержания ремиссии заболевания помогает диета с ограничением продуктов, вызывающих воспаление. Для контроля за эффективностью терапии и течением заболевания необходимо регулярно (раз в год) проходить эндоскопическое исследование с биопсией из пищевода. В случае, если стриктура или сужение пищевода все же развиваются, то проводится эндоскопическая процедура дилатации (расширения) стриктуры, после которой процесс глотания, как правило, нормализуется.
ПРИЛОЖЕНИЕ Г1 - ГN. ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ
РЕКОМЕНДАЦИЯХ.
Приложение Г1. Эндоскопическая шкала EREFS при оценке эозинофильного эзофагита
Эндоскопическая шкала EREFS при оценке эозинофильного эзофагита
Отек (Edema) оценивается по четкости визуализации сосудистого рисунка
Степень 0 сосудистый рисунок четкий
Степень 1 слабая (снижение четкости сосудистого рисунка)
Степень 2 сильная (отсутствие сосудистого рисунка)
Кольца (Rings) оценивается по наличию и выраженности кольцевидных
циркулярных сужений просвета пищевода
Степень 0 кольцевидные сужения отсутствуют
Степень 1 слабая (тонкие формирующиеся циркулярные кольца при
растяжении пищевода при инсуффляции)
Степень 2 умеренная (четкие циркулярные кольца, не препятствующие
проведению стандартного взрослого эндоскопа диаметром 8,5-9мм)
Степень 3 сильная (четкие циркулярные кольца, препятствующие свободному
проведению стандартного взрослого эндоскопа диаметром 8,5-9мм)
Экссудат (Exudates) оценивается по наличию белого налета на поверхности
слизистой оболочки пищевода
Степень 0 экссудат отсутствует
Степень 1 слабая (белый налет, покрывающий <10% поверхности пищевода)
Степень 2 сильная (белый налет, покрывающий ≥10% поверхности пищевода)
Борозды (Furrows) оценивается по наличию вертикальных линий с углублением
на слизистой оболочке пищевода
Степень 0 борозды (вертикальные линии) отсутствуют
Степень 1 слабая (вертикальные линии без видимого углубления)
Степень 2 сильная (вертикальные линии с выраженным углублением
(вдавлением) в слизистую оболочку)
Стриктуры (Strictures) оценивается по наличию сужений пищевода, непроходимых
для эндоскопа
Степень 0 отсутствуют
Степень 1 присутствуют
Приложение Г2. Эндоскопическая шкала EREFS при оценке эозинофильного эзофагита (с фото)
Приложение Г3. Система балльной оценки биоптатов при ЭоЭ (EoEHSS)
Гистологический
критерий ЭоЭ Степень поражения Распространенность
(стадия)
Эозинофильное воспаление1 0-интраэпителиальные эозинофилы отсутствуют 0 -интраэпитэлиальные эозинофилы 0-14/ПЗР, х400.
1 = ПЭЧ < 15/ПЗР, х400 1 = ПЭЧ ≥ 15/ПЗР, х400
в <33% ПЗР, х400
2 = ПЭЧ 15-59/ПЗР, х400 2 = ПЭЧ ≥ 15/ПЗР, х400
в 33-66% ПЗР, х400
3 = ПЭЧ > 60/ПЗР, х400 3 = ПЭЧ ≥ 15/ПЗР, х400
>66% ПЗР, х400
1 В норме в биоптатах пищевода интраэпителиальные эозинофилы отсутствуют, поэтому наличие любого количества интраэпителиальных эозинофилов рассматривается как патологическое изменение. Балльная шкала эозинофильного воспаления основана на количестве эозинофилов в одном поле зрения при большом увеличении (ПЗР, х400) - пиковое эозинофильное число (ПЭЧ) при оценке участка с наиболее выраженными воспалительными изменениями.
2 Базальный слой плоского эпителия пищевода состоит из тесно - расположенных мелких клеток, в норме его толщина составляет <15% общей толщины эпителия. Верхняя граница базального слоя определяется как уровень, на котором ядра базальных клеток отделены друг от друга расстоянием равным или превышающим диаметр ядра базальной клетки.
Гистологический
критерий ЭоЭ Степень поражения Распространенность
(стадия)
Эозинофильные абсцессы (ЭА) 3 0 = скопления эозинофилов не определяются 0 = скопления эозинофилов не определяются
1 = скопления 4-9 эозинофилов 1 = ЭА (любая степень>0) в <33% эпителия
2 = скопления 10-20 эозинофилов 2 = ЭА (любая степень>0) в 33-66% эпителия
3 = скопления >20 эозинофилов 3 = ЭА (любая
степень>0) в >66% эпителия
3Эозинофильные абсцессы — интраэпителиальные скопления или агрегаты эозинофилов, в которых клетки образуют солидные структуры. Эпителиальная
архитектоника нарушена таким образом, что соседние эозинофилы не разделены эпителиальной тканью.
Гистологический
критерий ЭоЭ Степень поражения Распространенность
(стадия)
Эозинофильное 0 = ПН отсутствует 0 = ПН отсутствует
поверхностное наслоение (менее 3 линейно
«пластообразование» 4 расположенных
эозинофилов)
Бальная шкала для 1 = ПН 3-4 эозинофилов 1 = ПН (любая
поверхностного степень>0) в <33%
наслоения (ПН) эпителия
основывалась на
количестве эозинофилов, 2 = ПН 5-10 2 = ПН (любая
формирующих слой эозинофилов степень>0) в 33-66%
эпителия
3 = ПН >10 3 = ПН (любая
эозинофилов степень>0) в >66%
эпителия
4Эозинофильное поверхностное наслоение («пластообразование») - линейное распределение (расположение) как минимум трех эозинофилов в верхней трети многослойного эпителия слизистой оболочки пищевода параллельно поверхности.
Гистологический
критерий ЭоЭ Степень поражения Распространенность
(стадия)
Расширенные 0 = РМП не 0 = РМП не определяется
межклеточные определяется при при любом увеличении
пространства (РМП)5 любом увеличении
1= межклеточные 1 = РМП (любая
мостики в РМП степень>0) в <33%
различимы только при эпителия
увеличении х400
2 = межклеточные 2 = РМП (любая
мостики в РМП степень>0) в 33-66%
различимы при эпителия
увеличении х200
3 = межклеточные 3 = РМП (любая
мостики в РМП степень>0) в >66%
различимы при эпителия
увеличении х100 и
менее
5Расширенные межклеточные пространства - округлые перицеллюлярные пространства в плоском эпителии пищевода, в которых определяются межклеточные мостики.
Балльная шкала РМП основана на степени увеличения микроскопа, необходимой для обнаружения межклеточных мостиков.
Гистологический
критерий ЭоЭ Степень поражения Распространенность
(стадия)
Повреждение 0 = ППЭ не 0 = ППЭ не
поверхностного эпителия определяется определяется
(ППЭ)6
1 = ППЭ без 1 = ППЭ (любая
эозинофильного степень>0) в <33%
компонента эпителия
2 = ППЭ с любым 2 = ППЭ (любая
количеством степень>0) в 33-66%
эозинофилов эпителия
3 = слущивание 3 = ППЭ (любая
поврежденного степень>0) в >66%
поверхностного эпителия
эпителия в сочетании с
большим количеством
эозинофилов
6Повреждение поверхностного эпителия (ППЭ): изменения тинкториальных свойств поверхностного эпителия, проявляющиеся усилением (более темный оттенок красного) окрашивания клеток поверхностного слоя эпителия при наличии или отсутствии эозинофильной инфильтрации. Балльная шкала ППЭ основана на выраженности эозинофильной инфильтрации в поврежденном поверхностном эпителии.
Гистологический
критерий ЭоЭ Степень поражения Распространенность
(стадия)
Дискератоз7 0 = Дискератоз не определяется 0 = Дискератоз не определяется
1= 1 клетка с дискератозом/ПЗР, х400 1 = Дискератоз (любой степени>0) в <33% эпителия
2 = 2-5 клеток с дискератозом/ПЗР, х400 2 = Дискератоз (любой степени>0) в 33-66% эпителия
3 = >5 клеток с дискератозом/ПЗР, х400 3 = Дискератоз (любой степени>0) в 66% эпителия эпителия
7Дискератоз-появление отдельных эпителиальных клеток с ярко-эозинофильной цитоплазмой и мелким округлым гиперхромным ядром. Балльная шкала основана на количестве клеток с явлениями дискератоза.
Гистологический
критерий ЭоЭ Степень поражения Распространенность
(стадия)
Фиброз собственной 0 = ФСП не 0 = ФСП не определяется
пластинки слизистой определяется
оболочки (ФСП)8 1= волокна сцеплены 1 = ФСП (любой
друг с другом, степени>0) в <33%
пространство между собственной пластинке
ними не определяется слизистой
2 = диаметр волокон 2 = ФСП (любой
равен диаметру ядер степени>0) в 33-66%
клеток базального слоя собственной пластинке
слизистой
3 = диаметр волокон 3 = ФСП (любой
превышает диаметр степени>0) в 66%
ядер клеток базального собственной пластинке
слоя слизистой
8Фиброз собственной пластинки слизистой оболочки (ФСП): утолщение соединительнотканных волокон собственной пластинки слизистой оболочки. Волокна собственной пластинки, расположенные по одиночке и имеющие диаметр менее размера ядер клеток базального слоя, рассматривались как нормальные; сцепленные друг с другом волокна обычного диаметра, а также волокна, имеющие диаметр равный или превышающий размер ядер клеток базального слоя, рассматривались как патологичные. Балльная шкала ФСП основана на степени утолщения волокон.
Приложение Г4. Опросник для оценки качества жизни больных с ЭоЭ Подумайте о своей жизни за последнюю неделю (7 дней) и посмотрите на утверждения ниже. На каждое утверждение приводится по пять ответов. Отметьте для каждого утверждения ответ, который лучше всего описывает вашу жизнь с эозинофильным эзофагитом.
Совсем
немного Немного Умеренно Значительно Крайне
сильно
В течение прошлой недели...
1.Из-за ЭоЭ я испытываю стресс.
2.Из-за ЭоЭ мне приходится соблюдать осторожность в
отношении еды.
3.Я испытываю панику или
теряю контроль, когда мне
трудно глотать.
4.Я беспокоюсь о долгосрочных
побочных эффектах моих лекарств от ЭоЭ.
5.Из-за ЭоЭ я чувствую, что не могу вести нормальную
повседневную жизнь.
6. Я испытываю беспомощность
из-за ЭоЭ.
7.Я замечаю, что перед приемом пищи я нервничаю или
тревожусь.
8.Я боюсь, что не смогу дышать
во время приступа затрудненного глотания.
9.Мне неловко, когда
приходится просить о чем-то особом в ресторанах.
10.Я беспокоюсь о том, что
лечение ЭоЭ может продлиться всю жизнь.
11.Я чувствую, что в моей жизни
меньше радости из-за ЭоЭ.
12.Я переживаю о том, что причина, по которой у меня
развился ЭоЭ, никогда не станет известна.
13.Я испытываю злость и обиду
из-за того, что болею ЭоЭ.
14.Я стараюсь скрыть свои трудности с глотанием, чтобы другие люди не знали, что со
мной происходит.
15.Я переживаю, что ЭоЭ станет
тяжелее или разовьется в какое- то другое заболевание.
16.Я злюсь и расстраиваюсь из- за того, что не могу есть то, что
хочу, из-за ЭоЭ.
17.Я переживаю, что члены моей семьи тревожатся, когда у меня возникают трудности с
глотанием.
18.Меня беспокоит, что ЭоЭ является относительно новым
заболеванием.
19.Я злюсь и расстраиваюсь, когда люди думают, что я самостоятельно провоцирую приступы удушья, потому что ем
слишком быстро или слишком
большими кусками.
20.Я переживаю о том, когда
будет следующий приступ затрудненного глотания.
21.Мне сложно объяснить своим близким, что такое ЭоЭ, чтобы
развеять их опасения.
22.Я смущаюсь, если приходится проводить много времени в ванной, чтобы справиться с
затрудненным глотанием.
23.Я чувствую себя оторванным
от других людей из-за того, что у меня ЭоЭ.
24.Меня беспокоит, что я никогда не смогу нормально
питаться из-за ЭЭ.
25.Находясь на улице, я волнуюсь, что не найду ничего
поесть.
26.Я боюсь есть вне дома из-за
того, что еда может быть заражена.
27.Я провожу много времени,
планируя свое питание.
28.Меня утомляют чтение этикеток на продуктах питания и походы за покупками в
специальные магазины.
29.Я замечаю, что из-за ЭоЭ
трачу больше денег на продукты питания.
30.Из-за ЭоЭ мне трудно находить подходящие мне
продукты питания.
Taft TH, Kern E, Kwiatek MA, Hirano I, Gonsalves N, Keefer L. The adult eosinophilic oesophagitis quality of life questionnaire: a new measure of health-related quality of life. Aliment Pharmacol Ther. 2011 Oct;34(7):790-8. doi: 10.1111/j.1365-2036.2011.04791.x. Epub 2011 Aug 2. PMID: 21806649.
Приложение Г5. Опросник для оценки выраженности дисфагии
Опросник по оценке дисфагии (The Dysphagia Symptom Questionnaire), содержащий всего 3 вопроса, ответы на которые пациенты дают ежедневно в течение 30 дней.
Вопрос Вариант ответа оценка
1. После пробуждения
сегодня утром Вы ели Да -
Нет -
твердую пищу?
2. После пробуждения сегодня утром Вы замечали, что пища медленно проходила вниз или застревала в горле или
в груди?
Нет
0
Да 2
3. В самом трудном случае при проглатывании пищи сегодня (в течение последних 24 часов) Вам приходилось что-либо делать, чтобы пища прошла вниз или чтобы Вам стало легче? Нет, улучшение или исчезновение симптомов произошло само по себе 0
Да, мне пришлось пить жидкость, чтобы стало легче
1
Да, мне пришлось кашлять и (или) натужиться, чтобы стало легче
2
Да, мне становилось легче только после рвоты
3
Да, мне пришлось обратиться за медицинской помощью, чтобы стало легче 4
4.Следующий вопрос касается выраженности боли, которую Вы испытывали при глотании пищи. Опишите самую сильную боль, которую Вы испытывали сегодня при
глотании пищи? Боли не было 0
Слабая 1
Умеренная 2
Сильная 3
Очень сильная 4
Hudgens S, Evans C, Phillips E, Hill M. Psychometric validation of the Dysphagia Symptom Questionnaire in patients with eosinophilic esophagitis treated with budesonide oral suspension.
J Patient Rep Outcomes. 2017;1(1):3. doi: 10.1186/s41687-017-0006-5. Epub 2017 Sep 12. PMID: 29757322; PMCID: PMC5934937.
Приложение Г6
Индекс активности эозинофильного эзофагита [109]
Баллы 1 балл 2 балла 4 балла 15 баллов
Симптомы и осложнения
Симптомы Еженедельно Ежедневно Много раз за день или нарушают
социальную активность -
Осложнения - Вклинение пищи в пищевод с обращением в экстренным обращением за медицинской помощью (пациенты старше 18 лет) Вклинение пищи в пищевод с обращением в экстренным обращением за медицинской помощью (пациенты младше 18 лет)
Госпитализац ия в связи с ЭоЭ Перфорация пищевода
Отставание в росте, дефицит массы тела
Рефрактерное течение ЭоЭ, необходимость прибегать к элементной диете, системным кортикостероидам, терапии иммуномодулятора
ми
Характеристики активности воспаления
Эндоскопическ ие особенности (отек, борозды,
экссудат) Локализованн ые Диффузные - -
Гистологически е особенности 15-60
эозинофилов в поле зрения микроскопа высокого разрешения Более 60 эозинофилов в поле зрения микроскопа
высокого разрешения - -
Характеристики подслизистого фиброза
Эндоскопическ ие особенности (кольца, стриктуры) Легко проходимы для эндоскопа Присутствую т, требуют дилатации или расширяются при затрудненном прохождении
эндоскопа - Стандартный эндоскоп не проходит, повторяющиеся дилатации в возрасте старше 18 лет или хотя бы 1 дилатация в
возрасте менее 18
лет
Гистологически е особенности - Гиперплазия базального слоя или фиброз собственной пластинки слизистой оболочки (дискератоз, повреждение поверхностн
ых слоев эпителия)
Данная таблица заполняется на каждом визите пациента и оценивает клинико- морфологическую активность заболевания: неактивный ЭоЭ: менее 1 балла, легкая
степень: 0-6 баллов, средняя: 7-14 баллов, высокая: более 15 баллов
.
Список литературы:
2. Ивашкин В.Т., Баранская Е.К., Кайбышева В.О., Трухманов А.С., Шептулин А.А. Клинические рекомендации по диагностике и лечению эозинофильного эзофагита. М., 2013. [Ivashkin V.T., Baranskaya E.K., Kaibysheva V.O., Trukhmanov A.S., Sheptulin A.A. Klinicheskie rekomendatsii po diagnostike i lecheniyu eozinofil'nogo ezofagita. M., 2013. (In Russ.)]
3. Кайбышева В.О., Михалева Л.М. Эозинофильный эзофагит, Издательство Медиа Сфера, 2021
4. Кайбышева В.О., Кашин С.В., Михалева Л.М., Видяева Н.С., Куваев Р.О., Галкова З.В., Ильчишина Т.А., Печникова В.В., Никонов Е.Л., Шаповальянц С.Г.
Эозинофильный эзофагит: современный взгляд на проблему и собственные клинические наблюдения. Доказательная гастроэнтерология. 2019;8(1):58-83. https://doi.org/10.17116/dokgastro2019801158
5. Кайбышева В.О., Михалева Л.М., Никонов Е.Л., Шаповальянц С.Г. Эпидемиология, этиология и патогенез эозинофильного эзофагита. Новейшие данные. Доказательная гастроэнтерология. 2019;8(2):5072.
Kaibysheva VO, Mikhaleva LM, Nikonov EL, Shapoval’yants SG. Epidemiology, etiology and pathogenesis of eosinophilic esophagitis. The latest data. Russian Journal of Evidence-Based Gastroenterology. 2019;8(2):5072. (In Russ., In Engl.). https://doi.org/10.17116/dokgastro2019802150
6. Arias A, Perez-Martinez I, Tenias JM, Lucendo AJ. Systematic review with meta- analysis: the incidence and prevalence of eosinophilic oesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther 2016;43:3-15. https://doi.org/10.1111/apt.13441
7. van Rhijn BD, Verheij J, Smout AJ, Bredenoord AJ. Rapidly increasing incidence of eosinophilic esophagitis in a large cohort. Neurogastroenterol Motil 2013;25:47-5. https://doi.org/10.1111/nmo.12009
8. Warners M, de Rooij WE, Van Rhijn BD, Verheij J, Smout AJ, Bredenoord AJ. Large Increase in Incidence of Eosinophilc Esophagitis Over the Last 20 Years in the Netherlands: Results from a Nationwide Pathology Database. Gastroenterology 2017;152:862-863. https://doi.org/10.1016/S0016-5085(17)32964-5
9. Noel RJ, Putnam PE, Rothenberg ME. Eosinophilic esophagitis. N Engl J Med 2004;351:940-1.
10. Dellon ES, Hirano I. Epidemiology and Natural History of Eosinophilic Esophagitis. Gastroenterology. 2018;154(2):319-332. https://doi.org/10.1053/j.gastro.2017.06.06
11. Prasad GA, Alexander JA, Schleck CD, Zinsmeister AR, Smyrk TC, Elias RM, Locke GR, Talley NJ. Epidemiology of eosinophilic esophagitis over three decades in Olmsted County, Minnesota. Clin Gastroenterol Hepatol 2009;7:1055-61. https://doi.org/10.1016/j.cgh.2009.06.023
12. Syed AA, Andrews CN, Shaffer E, Urbanski SJ, Beck P, Storr M. The rising incidence of eosinophilic oesophagitis is associated with increasing biopsy rates: a population-based study. Aliment Pharmacol Ther 2012;36:950-8. https://doi.org/10.1111/apt.12053
13. Dellon ES, Erichsen R, Baron JA, Shaheen NJ, Vyberg M, Sorensen HT, Pedersen L. The increasing incidence and prevalence of eosinophilic oesophagitis outpaces changes in endoscopic and biopsy practice: national population-based estimates from Denmark. Aliment Pharmacol Ther 2015;41:662-70. https://doi.org/10.1111/apt.13129
14. Giriens B, Yan P, Safroneeva E, Zwahlen M, Reinhard A, Nydegger A, Vavricka S, Sempoux C, Straumann A, Schoepfer AM. Escalating incidence of eosinophilic esophagitis in Canton of Vaud, Switzerland, 1993-2013: a population-based study. Allergy 2015;70:1633-9. https://doi.org/10.1111/all.12733
15. Straumann A, Simon HU. Eosinophilic esophagitis: escalating epidemiology? J Allergy Clin Immunol 2005;115:418-9. https://doi.org/10.1016/j.jaci.2004.11.006
16. Dellon ES, Liacouras CA, Molina-Infante J et al. Updated International Consensus Diagnostic Criteria for Eosinophilic Esophagitis: Proceedings of the AGREE Conference.
Gastroenterology. 2018 Sep 6. pii: S0016-5085(18)34763-2. https://doi.org/10.1053/j.gastro.2018.07.009.
17. Straumann A, Katzka DA. Diagnosis and Treatment of Eosinophilic Esophagitis. Gastroenterology. 2018 Jan;154(2):346-359. https://doi.org/10.1053/j.gastro.2017.05.066
18. Lucendo AJ, Friginal-Ruiz AB, Rodriguez B. Boerhaave's syndrome as the primary manifestation of adult eosinophilic esophagitis. Two case reports and a review of the literature. Dis Esophagus 2011;24:E11-5. https://doi.org/10.1111/j.1442- 2050.2010.01167.x
19. Straumann A, Bussmann C, Zuber M, et al. Eosinophilic esophagitis: analysis of food impaction and perforation in 251 adolescent and adult patients. Clin Gastroenterol Hepatol 2008;6:598- 600. https://doi.org/10.1016/j.cgh.2008.02.003
20. Jackson WE, Mehendiratta V, Palazzo J, et al. Boerhaave's syndrome as an initial presentation of eosinophilic esophagitis: a case series. Ann Gastroenterol 2013;26:166- 169.
21. Dhar A, Haboubi HN, Attwood SE, Auth MKH, Dunn JM, Sweis R, Morris D, Epstein J, Novelli MR, Hunter H, Cordell A, Hall S, Hayat JO, Kapur K, Moore AR, Read C, Sami SS, Turner PJ, Trudgill NJ. British Society of Gastroenterology (BSG) and British Society of Paediatric Gastroenterology, Hepatology and Nutrition (BSPGHAN) joint consensus guidelines on the diagnosis and management of eosinophilic oesophagitis in children and adults. Gut. 2022 Aug;71(8):1459-1487. doi: 10.1136/gutjnl-2022-327326. Epub 2022 May 23. PMID: 35606089; PMCID: PMC9279848.
22. Ивашкин В.Т., Баранская Е.К., Кайбышева В.О., Иванова Е.В., Федоров Е.Д. Эозинофильный эзофагит: обзор литературы и описание собственного наблюдени. РЖГГК;2012: 1. 71–81. [Ivashkin V.T., Baranskaya E.K., Kaibysheva V.O., Ivanova E.V., Fedorov E.D. Eozinofil'nyi ezofagit: obzor literatury i opisanie sobstvennogo nablyudeniya // RZhGGK. 2012: 1. 71–81. (In Russ.)]
23. Dellon ES, Gibbs WB, Fritchie KJ, et al. Clinical, endoscopic, and histologic findings distinguish eosinophilic esophagitis from gastroesophageal reflux disease. Clin Gastroenterol Hepatol 2009;7:1305–1313.
24. Remedios M, Campbell C, Jones DM, et al. Eosinophilic esophagitis in adults: clinical, endoscopic, histologic findings, and response to treatment with fluticasone propionate. Gastrointest Endosc 2006;63:3–12.
25. Croese J, Fairley SK, Masson JW, et al. Clinical and endoscopic features of eosinophilic esophagitis in adults. Gastrointest Endosc 2003;58:516–522.
26. Kahn J, Bussmann C, Beglinger C, et al. Exercise-induced chest pain: an atypical manifestation of eosinophilic esophagitis. Am J Med 2015;128:196–199. https://doi.org/10.1016/j.amjmed.2014.08.007
27. Gonsalves N, Policarpio-Nicolas M, Zhang Q, et al. Histopathologic variability and endoscopic correlates in adults with eosinophilic esophagitis. Gastrointest Endosc 2006;64:313–319.
28. Shah A, Kagalwalla AF, Gonsalves N, et al. Histopathologic variability in children with eosinophilic esophagitis. Am J Gastroenterol 2009;104:716–721.
29. Peery AF, Cao H, Dominik R, et al. Variable reliability of endoscopic findings with white-light and narrow-band imaging for patients with suspected eosinophilic esophagitis. Clin Gastroenterol Hepatol 2011;9:475–480. https://doi.org/10.1016/j.cgh.2011.02.026
30. Dellon ES, Speck O, Woodward K. The patchy nature of esophageal eosinophilia in eosinophilic esophagitis: Insights from pathology samples from a clinical trial. Gastroenterology 2012;142(Suppl):Su-1129. https://doi.org/10.1016/S0016- 5085(12)61626-6
31. DeBrosse CW, Collins MH, Buckmeier Butz BK, et al. Identification, epidemiology, and chronicity of pediatric esophageal eosinophilia, 1982-1999. J Allergy Clin Immunol 2010;126:112–9.
32. Kim HP, Vance RB, Shaheen NJ, et al. The prevalence and diagnostic utility of endoscopic features of eosinophilic esophagitis: a meta-analysis. Clin Gastroenterol Hepatol 2012;10:988–996. https://doi.org/10.1016/j.cgh.2012.04.019
33. Hirano I, Moy N, Heckman MG, et al. Endoscopic assessment of the oesophageal features of eosinophilic oesophagitis: validation of a novel classification and grading system. Gut 2013;62:489-95. https://doi.org/10.1136/gutjnl-2011-301817
34. Dellon ES, Gibbs WB, Fritchie KJ, et al. Clinical, endoscopic, and histologic findings distinguish eosinophilic esophagitis from gastroesophageal reflux disease. Clin Gastroenterol Hepatol 2009;7:1305-13; https://doi.org/10.1016/j.cgh.2009.08.030
35. Schoepfer AM, Safroneeva E, Bussmann C, et al. Delay in diagnosis of eosinophilic esophagitis increases risk for stricture formation in a time-dependent manner. Gastroenterology 2013;145:1230–2.
36. Lipka S, Kumar A, Richter JE. Impact of diagnostic delay and other risk factors on eosinophilic esophagitis phenotype and esophageal diameter. J Clin Gastroenterol 2016;50:134–40.
37. Warners MJ, Oude Nijhuis RAB, de Wijkerslooth LRH, et al. The natural course of eosinophilic esophagitis and long-term consequences of undiagnosed disease in a large cohort. Am J Gastroenterol 2018;113:836–44.
38. Peterson KA, Byrne KR, Vinson LA, et al. Elemental diet induces histologic response in adult eosinophilic esophagitis. Am J Gastroenterol 2013;108:759- 766. https://doi.org/10.1038/ajg.2012.468
39. Arias A, Gonzalez-Cervera J, Tenias JM, et al. Efficacy of dietary interventions for inducing histologic remission in patients with eosinophilic esophagitis: a systematic review and meta-analysis. Gastroenterology 2014;146:1639–1648. https://doi.org/10.1053/j.gastro.2014.02.006
40. Spergel JM, Beausoleil JL, Mascarenhas M, et al. The use of skin prick tests and patch tests to identify causative foods in eosinophilic esophagitis. J Allergy Clin Immunol 2002;109:363–368.
41. Spergel JM, Brown-Whitehorn TF, Cianferoni A, et al. Identification of causative foods in children with eosinophilic esophagitis treated with an elimination diet. J Allergy Clin Immunol 2012;130:461–467. https://doi.org/10.1016/j.jaci.2012.05.021
42. Kagalwalla AF, Shah A, Ritz S, et al. Cow’s milk protein-induced eosinophilic esophagitis in a child with gluten-sensitive enteropathy. J Pediatr Gastroenterol Nutr 2007;44:386–388. https://doi.org/10.1097/01.mpg.0000243430.32087.5c
43. Wolf WA, Jerath MR, Sperry SLW, et al. Dietary elimination therapy is an effective option for adults with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2014;12:1272–1279. https://doi.org/10.1016/j.cgh.2013.12.034
44. Molina-Infante J, Martin-Noguerol E, Alvarado-Arenas M, et al. Selective elimination diet based on skin testing has suboptimal efficacy for adult eosinophilic esophagitis. J Allergy Clin Immunol 2012;130:1200–1202. https://doi.org/10.1016/j.jaci.2012.06.027
45. Kagalwalla AF, Sentongo TA, Ritz S, et al. Effect of six-food elimination diet on clinical and histologic outcomes in eosinophilic esophagitis. Clin Gastroenterol Hepatol 2006;4:1097–1102.
46. Henderson CJ, Abonia JP, King EC, et al. Comparative dietary therapy effectiveness in remission of pediatric eosinophilic esophagitis. J Allergy Clin Immunol 2012;129:1570– 1578. https://doi.org/10.1016/j.jaci.2012.03.023
47. Kagalwalla AF, Shah A, Li BUK, et al. Identification of specific foods responsible for inflammation in children with eosinophilic esophagitis successfully treated with empiric elimination diet. J Pediatr Gastroenterol Nutr 2011;53:145–149. https://doi.org/10.1097/MPG.0b013e31821cf503
48. Molina-Infante J, Arias A, Barrio J, et al. Four-food group elimination diet for adult eosinophilic esophagitis: A prospective multicenter study. J Allergy Clin Immunol 2014;134:1093–1099. https://doi.org/10.1016/j.jaci.2014.07.023
49. Philpott H, Nandurkar S, Royce SG, et al. Allergy tests do not predict food triggers in adult patients with eosinophilic oesophagitis. A comprehensive prospective study using five modalities. Aliment Pharmacol Ther 2016 ;44:223– 233. https://doi.org/10.1111/apt.13676
50. Kagalwalla AF, Amsden K, Shah A, et al. Cow’s milk elimination: a novel dietary approach to treat eosinophilic esophagitis. J Pediatr Gastroenterol Nutr 2012;55:711–716. https://doi.org/10.1097/MPG.0b013e318268da40
51. Kruszewski PG, Russo JM, Franciosi JP, et al. Prospective, comparative effectiveness trial of cow’s milk elimination and swallowed fluticasone for pediatric eosinophilic esophagitis. Dis Esophagus 2016;29:377–384. https://doi.org/10.1111/dote.12339
52. Molina-Infante J, Arias Á, Alcedo J, Garcia-Romero R, Casabona-Frances S, Prieto- Garcia A, Modolell I, Gonzalez-Cordero PL, Perez-Martinez I, Martin-Lorente JL, Guarner-Argente C, Masiques ML, Vila-Miravet V, Garcia-Puig R, Savarino E, Sanchez- Vegazo CT, Santander C, Lucendo AJ. Step-up empiric elimination diet for pediatric and adult eosinophilic esophagitis: The 2-4-6 study. J Allergy Clin Immunol. 2018;141(4):1365-1372. https://doi.org/10.1016/j.jaci.2017.08.038
53. Gonsalves N, Yang G-Y, Doerfler B, et al. Elimination diet effectively treats eosinophilic esophagitis in adults; food reintroduction identifies causative factors. Gastroenterology 2012;142:1451–1455. https://doi.org/10.1053/j.gastro.2012.03.001
54. Lucendo AJ, Arias A, Gonzalez-Cervera J, et al. Empiric 6-food elimination diet induced and maintained prolonged remission in patients with adult eosinophilic esophagitis: a prospective study on the food cause of the disease. J Allergy Clin Immunol 2013;131:797–804. https://doi.org/10.1016/j.jaci.2012.12.664
55. Moawad FJ, Veerappan GR, Dias JA, et al. Randomized controlled trial comparing aerosolized swallowed fluticasone to esomeprazole for esophageal eosinophilia. Am J Gastroenterol 2013;108:366–372. https://doi.org/10.1038/ajg.2012.443
56. Peterson KA, Thomas KL, Hilden K, et al. Comparison of esomeprazole to aerosolized, swallowed fluticasone for eosinophilic esophagitis. Dig Dis Sci 2010;55:1313–1319. https://doi.org/10.1007/s10620-009-0859-4
57. Cheng E, Zhang X, Huo X, Yu C, Zhang Q, Wang DH, Spechler SJ, Souza RF. Omeprazole blocks eotaxin-3 expression by oesophageal squamous cells from patients with eosinophilic oesophagitis and GORD. Gut. 2013 Jun;62(6):824-32. https://doi.org/10.1136/gutjnl-2012-302250.
58. Ngo P, Furuta GT, Antonioli DA, et al. Eosinophils in the esophagus--peptic or allergic eosinophilic esophagitis? Case series of three patients with esophageal eosinophilia. Am J Gastroenterol 2006;101:1666–1670.
59. Dranove JE, Horn DS, Davis MA, et al. Predictors of response to proton pump inhibitor therapy among children with significant esophageal eosinophilia. J Pediatr 2009;154:96– 100. https://doi.org/10.1016/j.jpeds.2008.07.042
60. Molina-Infante J, Ferrando-Lamana L, Ripoll C, et al. Esophageal eosinophilic infiltration responds to proton pump inhibition in most adults. Clin Gastroenterol Hepatol 2011; 9: 110–117. https://doi.org/10.1016/j.cgh.2010.09.019
61. Gutierrez-Junquera C, Fernandez-Fernandez S, Cilleruelo ML, et al. High revalence of response to proton-pump inhibitor treatment in children with esophageal eosinophilia. J Pediatr Gastroenterol Nutr 2016;62:704–710. https://doi.org/10.1097/MPG.0000000000001019
62. Lucendo AJ, Arias A, Molina-Infante J. Efficacy of proton pump inhibitor drugs for inducing clinical and histologic remission in patients with symptomatic esophageal eosinophilia: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2016;14:13–22. https://doi.org/10.1016/j.cgh.2015.07.041
63. Cheng E, Zhang X, Wilson KS, Wang DH, Park JY, Huo X, Yu C, Zhang Q, Spechler SJ, Souza RF. JAK-STAT6 Pathway Inhibitors Block Eotaxin-3 Secretion by Epithelial Cells and Fibroblasts from Esophageal Eosinophilia Patients: Promising Agents to Improve Inflammation and Prevent Fibrosis in EoE. PLoS One. 2016 Jun 16;11(6):e0157376. https://doi.org/10.1371/journal.pone.0157376.
64. Dellon ES, Liacouras CA. Advances in clinical management of eosinophilic esophagitis. Gastroenterology 2014;147:1238–1254. https://doi.org/10.1053/j.gastro.2014.07.055
65. Molina-Infante J, Rodriguez-Sanchez J, Martinek J, et al. Long-term loss of response in proton pump inhibitor-responsive esophageal eosinophilia is uncommon and influenced by CYP2C19 genotype and rhinoconjunctivitis. Am J Gastroenterol 2015;110:1567– 1575. https://doi.org/10.1038/ajg.2015.314
66. Schaefer ET, Fitzgerald JF, Molleston JP, et al. Comparison of oral prednisone and topical fluticasone in the treatment of eosinophilic esophagitis: a randomized trial in children. Clin Gastroenterol Hepatol 2008;6:165–173.
67. Alexander JA, Jung KW, Arora AS, et al. Swallowed fluticasone improves histologic but not symptomatic response of adults with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2012;10:742–749. https://doi.org/10.1016/j.cgh.2012.03.018
68. Gupta SK, Vitanza JM, Collins MH. Efficacy and safety of oral budesonide suspension in pediatric patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2015;13:66– 76. https://doi.org/10.1016/j.cgh.2014.05.021
69. Dohil R, Newbury R, Fox L, et al. Oral viscous budesonide is effective in children with eosinophilic esophagitis in a randomized, placebo-controlled trial. Gastroenterology 2010;139:418–429. https://doi.org/10.1053/j.gastro.2010.05.001
70. Konikoff MR, Noel RJ, Blanchard C, et al. A randomized, double-blind, placebo- controlled trial of fluticasone propionate for pediatric eosinophilic esophagitis. Gastroenterology 2006;131:1381–1391.
71. Dellon ES, Sheikh A, Speck O, et al. Viscous topical is more effective than nebulized steroid therapy for patients with eosinophilic esophagitis. Gastroenterology 2012;143:321–324. https://doi.org/10.1053/j.gastro.2012.04.049
72. Butz BK, Wen T, Gleich GJ, et al. Efficacy, dose reduction, and resistance to high-dose fluticasone in patients with eosinophilic esophagitis. Gastroenterology 2014;147:324– 333. https://doi.org/10.1053/j.gastro.2014.04.019
73. Miehlke S, Hruz P, Vieth M, et al. A randomised, double-blind trial comparing budesonide formulations and dosages for short-term treatment of eosinophilic oesophagitis. Gut 2016;65:390–399. https://doi.org/10.1136/gutjnl-2014-308815
74. Tan N Di, Xiao YL, Chen MH. Steroids therapy for eosinophilic esophagitis: Systematic review and meta-analysis. J Dig Dis 2015;16:431–442. https://doi.org/10.1111/1751- 2980.12265
75. Sawas T, Dhalla S, Sayyar M, et al. Systematic review with meta-analysis: pharmacological interventions for eosinophilic oesophagitis. Aliment Pharmacol Ther 2015;41:797–806. https://doi.org/10.1111/apt.13147
76. Murali AR, Gupta A, Attar BM, et al. Topical steroids in eosinophilic esophagitis: systematic review and meta-analysis of placebo controlled randomized clinical trials. J Gastroenterol Hepatol 2015; 31:1111-1119. https://doi.org/10.1111/jgh.13281
77. Chuang M-YA, Chinnaratha MA, Hancock DG, et al. Topical steroid therapy for the treatment of eosinophilic esophagitis (EoE): a systematic review and meta- analysis. Clin Transl Gastroenterol 2015;6:e82. https://doi.org/10.1038/ctg.2015.9
78. Straumann A, Conus S, Degen L, et al. Long-term budesonide maintenance treatment is partially effective for patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2011;9:400–409. https://doi.org/10.1016/j.cgh.2011.01.017
79. Philla KQ, Min SB, Hefner JN, et al. Swallowed glucocorticoid therapy for eosinophilic esophagitis in children does not suppress adrenal function. J Pediatr Endocrinol Metab 2015;28:1101–1106. https://doi.org/10.1515/jpem-2014-0260
80. Golekoh MC, Hornung LN, Mukkada VA, et al. Adrenal insufficiency after chronic swallowed glucocorticoid therapy for eosinophilic esophagitis. J Pediatr 2016;170:240– 245. https://doi.org/10.1016/j.jpeds.2015.11.026
81. Harel S, Hursh BE, Chan ES, et al. Adrenal suppression in children treated with oral viscous budesonide for eosinophilic esophagitis. J Pediatr Gastroenterol Nutr 2015;61:190–193. https://doi.org/10.1097/MPG.0000000000000848
82. Moawad FJ, Cheatham JG, DeZee KJ. Meta-analysis: the safety and efficacy of dilation in eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;38:713–720. https://doi.org/10.1111/apt.12438
83. Netzer P, Gschossmann JM, Straumann A, et al. Corticosteroid-dependent eosinophilic oesophagitis: azathioprine and 6-mercaptopurine can induce and maintain long-term remission. Eur J Gastroenterol Hepatol 2007;19:865–869.
84. Abonia JP, Blanchard C, Butz BB, et al. Involvement of mast cells in eosinophilic esophagitis. J Allergy Clin Immunol 2010;126:140–149. https://doi.org/10.1016/j.jaci.2010.04.009
85. Arias A, Lucendo AJ, Martinez-Fernandez P, et al. Dietary treatment modulates mast cell phenotype, density, and activity in adult eosinophilic oesophagitis. Clin Exp Allergy 2016;46:78–91. https://doi.org/10.1111/cea.12504
86. Liacouras CA, Spergel JM, Ruchelli E, et al. Eosinophilic esophagitis: A 10-year experience in 381 children. Clin Gastroenterol Hepatol 2005;3:1198–1206.
87. Attwood SEA, Lewis CJ, Bronder CS, et al. Eosinophilic oesophagitis: a novel treatment using Montelukast. Gut 2003;52:181–185.
88. Stumphy J, Al-Zubeidi D, Guerin L, Mitros F, Rahhal R. Observations on use of montelukast in pediatric eosinophilic esophagitis: insights for the future. Dis Esophagus. Australia; 2011;24(4):229–34. https://doi.org/10.1111/j.1442-2050.2010.01134.x
89. Alexander JA, Ravi K, Enders FT, Geno DM, Kryzer LA, Mara KC, Smyrk TC, Katzka DA. Montelukast Does not Maintain Symptom Remission After Topical Steroid Therapy for Eosinophilic Esophagitis. Clin Gastroenterol Hepatol. 2017;15(2):214-221.e2. https://doi.org/10.1016/j.cgh.2016.09.013
90. Lucendo AJ, De Rezende LC, Jimenez-Contreras S, et al. Montelukast was inefficient in maintaining steroid-induced remission in adult eosinophilic esophagitis. Dig Dis Sci 2011;56:3551–3558. https://doi.org/10.1007/s10620-011-1775-y
91. Straumann A, Bauer M, Fischer B, Blaser K, Simon H-U. Idiopathic eosinophilic esophagitis is associated with a Th2-type allergic inflammatory response. J Allergy Clin Immunol. 2001; 108(6): 954–61
92. O’Byrne PM, Inman MD, Parameswaran K. The trials and tribulations of IL-5, eosinophils, and allergic asthma. J Allergy Clin Immunol. 2001; 108(4):503–8.
93. Mishra A, Rothenberg ME. Intratracheal IL-13 induces eosinophilic esophagitis by an IL- 5, eotaxin-1, and STAT6-dependent mechanism. Gastroenterology. 2003; 125(5):1419– 27.
94. Straumann A, Conus S, Grzonka P, et al. Anti-interleukin-5 antibody treatment (mepolizumab) in active eosinophilic oesophagitis: a randomised, placebo- controlled, double-blind trial. Gut 2010;59:21–30. https://doi.org/10.1136/gut.2009.178558
95. Assa’ad AH, Gupta SK, Collins MH, et al. An antibody against IL-5 reduces numbers of esophageal intraepithelial eosinophils in children with eosinophilic esophagitis. Gastroenterology 2011;141:1593–1604. https://doi.org/10.1053/j.gastro.2011.07.044
96. Spergel JM, Rothenberg ME, Collins MH, et al. Reslizumab in children and adolescents with eosinophilic esophagitis: results of a double-blind, randomized, placebo-controlled trial. J Allergy Clin Immunol 2012;129:456–463. https://doi.org/10.1016/j.jaci.2011.11.044
97. Zuo L, Fulkerson PC, Finkelman FD, Mingler M, Fischetti CA, et al. IL-13 induces esophageal remodeling and gene expression by an eosinophil-independent, IL-13Rα2- inhibited pathway. J Immunol. 2010; 185(1):660–69. https://doi.org/10.4049/jimmunol.1000471
98. Doran E, Cai F, Holweg CTJ, Wong K, Brumm J, Arron JR. Interleukin-13 in Asthma and Other Eosinophilic Disorders. Front Med (Lausanne). 2017 Sep 19;4:139. https://doi.org/110.3389/fmed.2017.00139
99. Davis BP, Stucke EM, Khorki ME, et al. Eosinophilic esophagitis-linked calpain 14 is an IL-13- induced protease that mediates esophageal epithelial barrier impairment. JCI Insight 2016;1:86355. https://doi.org/10.1172/jci.insight.86355
100. Rothenberg ME, Wen T, Greenberg A, et al. Intravenous anti-IL-13 mAb QAX576 for the treatment of eosinophilic esophagitis. J Allergy Clin Immunol 2015;135:500-7. https://doi.org/10.1016/j.jaci.2014.07.049.
101. Blanchard C, Mishra A, Saito-Akei H, Monk P, Anderson I, Rothenberg ME. Inhibition of human interleukin-13-induced respiratory and oesophageal inflammation by anti-human-interleukin-13 antibody (CAT-354). Clin Exp Allergy. 2005; 35(8):1096– 103.
102. Spergel BL, Ruffner MA, Godwin BC et al. Improvement in eosinophilic esophagitis when using dupilumab for other indications or compassionate use. Ann Allergy Asthma Immunol. 2022 May;128(5):589-593. doi: 10.1016/j.anai.2022.01.019. Epub 2022 Jan 25. PMID: 3508581
103. Laserna-Mendieta EJ, Casabona S, Guagnozzi D, et al. Efficacy of proton pump inhibitor therapy for eosinophilic oesophagitis in 630 patients: results from the EoEconnect registry. Aliment Pharmacol Ther 2020;52:798–807.
104. Lucendo AJ, Miehlke S, Schlag C, et al. Efficacy of budesonide orodispersible tablets as induction therapy for eosinophilic esophagitis in a randomized placebo- controlled trial. Gastroenterology 2019;157:74–86.
105. Straumann A, Lucendo AJ, Miehlke S, et al. Budesonide Orodispersible tablets maintain remission in a randomized, placebo-controlled trial of patients with eosinophilic esophagitis. Gastroenterology 2020;159:1672–85.
106. Sahiner UM, Layhadi JA, Golebski K, et al. Innate lymphoid cells: The missing part of a puzzle in food allergy. Allergy. 2021;76:2002–2016. https://doi.org/10.1111/ all.14776
107. Study to Determine the Efficacy and Safety of Dupilumab in Adult and Adolescent Patients With Eosinophilic Esophagitis (EoE). Электронный ресурс: https://clinicaltrials.gov/ct2/show/NCT03633617.
108. Study to Investigate the Efficacy and Safety of Dupilumab in Pediatric Patients With Active Eosinophilic Esophagitis (EoE) (EoE KIDS). Электронный ресурс: https://clinicaltrials.gov/ct2/show/NCT04394351
109. Dellon ES, Khoury P, Muir AB, Liacouras CA, Safroneeva E, Atkins D, Collins MH, Gonsalves N, Falk GW, Spergel JM, Hirano I, Chehade M, Schoepfer AM, Menard-Katcher C, Katzka DA, Bonis PA, Bredenoord AJ, Geng B, Jensen ET, Pesek RD, Feuerstadt P, Gupta SK, Lucendo AJ, Genta RM, Hiremath G, McGowan EC, Moawad FJ, Peterson KA, Rothenberg ME, Straumann A, Furuta GT, Aceves SS. A Clinical Severity Index for Eosinophilic Esophagitis: Development, Consensus, and Future Directions. Gastroenterology. 2022 Jul;163(1):59-76. doi: 10.1053/j.gastro.2022.03.025. Epub 2022 May 20. PMID: 35606197; PMCID: PMC9233087.
Рекомендуемые статьи
Эозинофильный эзофагит
— хроническое, медленно прогрессирующее иммуноопосредованное заболевание пищевода, характеризующееся выраженным эозинофильным воспалением слизистой оболочки пищевода, развитием подслизистого фиброза, клинически проявляющееся нарушением глотания (дисфагия, обтурация пищевода пищевым комком, рвота проглоченной пищей и др.)
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.















.jpg)





.png)















Комментарии