- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Дайджест
- QuaCol
- Разделы
- Пациентy
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Внутрипротоковая папиллярно-муцинозная опухоль поджелудочной железы — трудности и ошибки диагностики и лечения
 of Pancreas in Elderly Patient - Opera-min.png)
Полный текст статьи:
Введение
Внутрипротоковая папиллярно-муцинозная опухоль (ВПМО) впервые описана K. Ohhashi и соавт. в 1982 г. как муцинпродуцирующая опухоль поджелудочной железы (ПЖ) [17]. Самостоятельное место в классификации опухолей ПЖ ВПМО заняла в 2000 г., когда муцинпродуцируюшие опухоли ПЖ были выделены ВОЗ в две отдельные группы - внутрипротоковые папиллярно-муцинозные неоплазии и муцинозные кистозные неоплазии.
Опухоль исходит из эпителия панкреатических протоков и может быть представлена различными гистологическими вариантами - от легкой степени дисплазии до карциномы, которые по сути являются биологическими стадиями развития заболевания и могут определяться в пределах одной опухоли. Отличительный клинико-морфологический признак ВПМО - кистозное расширение главного и/или боковых панкреатических протоков обусловленное развивающейся панкреатической гипертензней.
Среди выявляемых опухолей ПЖ на долю ВПМО приходится от 5 до 7,5%, среди злокачественных опухолей - 1% [13]. Как свидетельствуют данные литературы, при клинической настороженности и целенаправленном диагностическом поиске в специализированных учреждениях частота выявления ВПМО достигает 16-25% [6, 15, 21].
По морфологической структуре опухоли делят на 4 типа: желудочный, кишечный, панкреатобилиарный и онкоцитарный [5].
В зависимости от локализации и распространенности опухолевого процесса выделяют 3 типа ВПМО: I - с поражением главного панкреатического протока (ГПП), II - с поражением боковых панкреатических протоков, III - комбинированный [10]. По частоте выявления злокачественных форм ВПМО с вовлечением ГПП и боковых протоков железы имеет значимые различия. При ВПМО I типа частота злокачественных форм достигает 57-92%, в то время как при II типе - 6-46% [3, 4, 9, 10, 14, 20, 23, 25, 29]. Таким образом, определение типа опухоли имеет важное прогностическое значение. При гистологическом исследовании ткани ВПМО с поражением боковых протоков может быть выявлено вовлечение в процесс и ГПП, что соответствует опухоли III типа. Некоторые авторы относят III тип к распространенной форме I или II типа, не выделяя его отдельно [28].
Наиболее частой локализацией ВПМО (около 65%) является головка или крючковидный отросток ПЖ [1, 14, 24, 27].
Макроскопически ВПМО выглядит как единичная крупная или множественные мелкие кистозные опухоли, заполненные густой слизью. В некоторых наблюдениях на внутренней стенке кисты имеются пристеночные мягкотканные сосочковые разрастания, которые наиболее характерны для карцином. Чем большего размера достигает опухоль, тем более вероятно ее перерождение в карциному.
ВПМО может быть отнесена к опухоли с неопределенным потенциалом злокачественности. По данным ряда авторов, период удвоения опухоли составляет 450 дней, а предположительная вероятность трансформации из аденомы в карциному - 15-63% в течение 5 лет [8, 11, 12, 20]. Более того, у пациентов с ВПМО часто обнаруживают синхронную протоковую аденокарциному [11, 31].
Материал и методы
В Институте хирургии им. А.В. Вишневского с 2006 по 2010 г. находились на лечении 15 больных ВПМО. Большинство (12) составили мужчины. Возраст больных варьировал от 40 до 69 лет. Общее количество больных с опухолями ПЖ за данный период составило 334, доля пациентов с ВПМО - 4,5%.
Лабораторная диагностика включала стандартный комплекс анализов: общие анализы крови и мочи, развернутый биохимический анализ крови, дополненный определением уровня онкомаркеров СЕА и СА 19-9.
Ультразвуковое исследование (УЗИ) органов брюшной полости и забрюшинного пространства в В-режиме выполнено 15 больным и производилось на аппаратах Voluson 730 pro V фирмы «General Electric» (США), Sonoline Elegra, Sonoline Sienna фирмы «Siemens» (Германия) с мультичастотными датчиками на частоте 3,5 МГц. 10 больным выполнено дуплексное сканирование (ДС) магистральных сосудов билиопанкреатодуоденальной зоны. Эндоскопическое ультразвуковое исследование (эндоУЗИ) произведено 9 больным аппаратом Olympus GF UM 160 с механическим датчиком и Fuginon EG 530 UR с электрическим конвексным датчиком.
Спиральная компьютерная томография (СКТ) и мультидетекторная спиральная компьютерная томография (МДСКТ) выполнена 15 больным на аппаратах Tomoscan Secura и Brilliance-64 фирмы «Philips» (Голландия) по стандартной методике с получением срезов 5-9 и 1-3 мм в аксиальной, сагиттальной и коронарной плоскостях. При выполнении СКТ задержка сканирования при введении контрастного вещества была 20-25 с, при МДСКТ с болюсным контрастным усилением сканирование начинали по программе bolus-tracking.
Магнитно-резонансная томография (МРТ) выполнена 12 больным на аппарате Philips Intera 1.0 Т. Всем больным исследование проводили получением аксиальных сканов толщиной 5-7 мм в режимах Т2ВИ (TSE, STIR), Т1ВИ (FFE). Для оценки состояния желчных и панкреатических протоков применяли магнитно-резонансную холангиопанкреатикографию (МРХПГ) с использованием 3D жестко взвешенных Т2ВИ (TR - 1800 мс, ТЕ - 470 мс).
Эндоскопическое исследование включало оценку состояния слизистой пищевода, желудка и двенадцатиперстной кишки с прицельным осмотром большого сосочка двенадцатиперстной кишки.
Морфологическое исследование во всех наблюдениях проводили как интраоперационно, так и в плановом порядке. По данным срочного гистологического исследования оценивали предположительный морфотип опухоли, а также наличие опухолевых клеток в краях резекции. На основании данных планового гистологического исследования уточняли гистологическую структуру опухоли, ее дифференцировку и степень злокачественности.
Результаты и обсуждение
Оценка клинических проявлений ВПМО показала, что ведущим симптомом у всех больных были боли в верхних отделах живота, как правило, опоясывающего характера. Интенсивность болевого синдрома была различной, варьируя от чувства дискомфорта до интенсивных болей, требующих приема анальгетиков. Снижение массы тела отмечено у 5 пациентов, из них 3 теряли 10-30 кг за 1 год. Реже встречались такие неспецифические симптомы, как слабость, вздутие живота, снижение аппетита.
Длительность заболевания колебалась от 3 мес до 15 лет. Всех больных обследовали и лечили амбулаторно, 9 из них неоднократно госпитализировали в терапевтические и хирургические стационары с диагнозом хронического (6) или острого (3) панкреатита. Достоверные анамнестические данные, свидетельствующие о перенесенном панкреонекрозе, были у одного больного. На амбулаторном этапе одному больному выполнена пункция опухолевого образования под контролем УЗИ, однако при морфологическом исследовании пунктата опухолевых клеток не обнаружено.
Во время клинического осмотра болезненность в эпигастральной области при пальпации выявлена у 13 больных. Опухолевидные образования размером от 5 до 10 см прощупывались у 4 больных: в эпигастральной области - у 3, в левом подреберье - у 1. При пальпации они были малоболезненными, несмещаемыми, имели четкие контуры, эластичную консистенцию.
Лабораторные методы исследования не показали специфических изменений. Однако повышение уровня СА 19-9 (557,81 и 71,24 ед/мл) выявлено у 2 больных. В обоих наблюдениях по данным гистологического исследования операционного материала установлена карцинома.
Эзофагогастродуоденоскопия (ЭГДС) позволила выявить выделение слизи из большого сосочка двенадцатиперстной кишки у 2 больных.
При УЗИ у всех больных обнаружены кистозные образования ПЖ, которые в 12 наблюдениях трактовалось как кистозные опухоли (ВПМО заподозрена лишь у 1 больного). У 3 больных кистозные образования ошибочно расценены как постнекротические кисты на фоне хронического панкреатита. Кистозные образования при УЗИ брюшной полости в 6 наблюдениях локализовались в головке ПЖ, в 7 - в дистальных отделах. В 2 наблюдениях установлено поражение всех отделов ПЖ. У 11 больных определена солитарная опухоль, в то время как в 4 наблюдениях характер опухоли оценен как множественный. Размер выявленных кистозных образований колебался от 8 до 122 мм (в среднем 50,4±34,3 мм). По плотности образования оценивали как анэхогенные либо пониженной эхогенности. В некоторых наблюдениях в их структуре определялся гиперэхогенный солидный компонент, гиперэхогенные перегородки. Форма чаще была округлой или овальной, однако встречались образования неправильной, ромбовидной формы. В 2 наблюдениях содержимое кистозных полостей трактовалось как вязкое, в остальных оно имело однородный жидкостной характер. Капсула образования определялась в 7 наблюдениях, при этом у 3 больных стенки образования при УЗИ были плотные, гиперэхогенные. Связь кистозных образований с протоковой системой ПЖ выявлена в 3 наблюдениях.
По характеру кровоснабжения, определяемому при ДС, в 7 наблюдениях опухоль была аваскулярной. У 2 больных удалось определить кровоток в опухолевом образовании, однако это было связано с наличием в кистозной полости гиперэхогенного компонента, в котором и лоцировались кровеносные сосуды. При оценке кровотока в верхних брыжеечных, селезеночных сосудах, воротной вене гемодинамически значимая компрессия сосудов выявлена у 3 больных. Ни в одном наблюдении достоверных признаков прорастания опухоли в сосудистую стенку не обнаружено.
У 7 больных отмечено увеличение размеров ПЖ. Структура ее чаще характеризовалась как неоднородная, диффузно уплотненная, повышенной эхогенности. В одном наблюдении оценить структуру ткани ПЖ не удалось в связи с полным замещением ее опухолью. Расширение ГПП отмечено у 7 больных: равномерное - у 2 (диаметр составил 8,5 и 17 мм), неравномерное - у 5 (диаметр варьировал в различных отделах ПЖ от 4,5 до 20 мм).
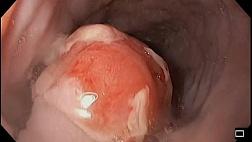
ЭндоУЗИ позволило выявить ВПМО в 8 наблюдениях. В одном наблюдении допущена диагностическая ошибка - поставлен диагноз постнекротической кисты ПЖ на фоне хронического панкреатита. ВПМО I типа при эндосонографии характеризовались наличием солитарных крупных кист или баллонообразно расширенного ГПП, в просвете кист визуализированы пристеночно расположенные сосочковые разрастания. ВПМО II типа имели полициклическую форму, состояли из нескольких анэхогенных полостей, без общей капсулы, были разделены тонкими перегородками, придающими образованию вид грозди винограда. Контур кист был ровным, четким, без дополнительных образований в просвете. В отличие от серозной цистаденомы при ВПМО во всех наблюдениях отсутствовал кальциноз перегородок. В 3 наблюдениях выявлено мультифокальное поражение ПЖ, при этом в 1 - практически полное замещение паренхимы железы опухолевыми кистами. Расширение ГПП от 4 до 17 мм отмечалось в 7 наблюдениях из 9, при этом в 6 оно имело равномерный характер, в 1 - было неравномерным, «четкообразным». У 2 больных визуализированы расширенные боковые панкреатические протоки. Размеры ПЖ у большинства больных ВПМО превышали нормальные значения за счет как наличия опухолевого процесса, так и увеличения железы на фоне длительно существующего хронического панкреатита. Структура железы представлялась диффузно неоднородной, с признаками атрофии.
При КТ признаки опухолевого поражения ПЖ выявлены у 13 больных, при этом у 10 из них опухоль трактовалась как ВПМО. У 2 больных кистозные образования ошибочно расценивались как постнекротические кисты ПЖ на фоне хронического панкреатита. ВПМО определялась в виде единичного или множественных кистозных образований, в некоторых наблюдениях с наличием пристеночного солидного компонента, перегородок внутри кистозных полостей. При введении контрастного препарата неинтенсивное накопление его отмечалось лишь в солидном компоненте опухоли или внутрикистозных перегородках. У 3 больных при КТ выявлена связь кистозного образования с ГПП. В одном наблюдении определено расширение протоков ПЖ второго порядка. Локализация опухоли в головке ПЖ установлена в 5 наблюдениях, из них в 1 опухоль распространялась на тело железы. У 6 больных опухоль локализовалась в дистальных отделах (у 4 - в хвосте, у 2 - в теле). В остальных 4 наблюдениях при КТ выявлено диффузное поражение ПЖ с вовлечением в опухолевый процесс всех ее отделов. Контакт с магистральными сосудами при КТ выявлен у 3 больных: у 1 по контуру образования определялась верхняя брыжеечная вена, у 1 - селезеночная артерия и вена, у 1 - ствол воротной вены. У последнего больного имелись КТ-признаки сдавления опухолью воротной вены с сужением ее просвета. Признаков прорастания опухолью сосудистой стенки ни в одном наблюдении не выявлено.
Увеличение размеров ПЖ при КТ отмечено у 7 больных, структура паренхимы железы имела неоднородный характер с признаками атрофии. Расширение ГПП имело место в 11 наблюдениях: в 1 - равномерное до 6 мм во всех отделах ПЖ, в 10 - неравномерное, варьировавшее в различных отделах ПЖ от 4 до 41 мм.
При МРТ с МРХПГ во всех наблюдениях выявлены изменения в паренхиме и протоковой системе ПЖ. ВПМО заподозрена у 10 больных, у 1 больного МР-картина трактовалась как множественные постнекротические кисты на фоне хронического панкреатита, в 1 наблюдении в заключении исследования была отмечена лишь панкреатическая гипертензия, генез которой уточнить не удалось. Кистозные образования локализовались в головке у 5, в дистальных отделах ПЖ у 5 больных. В 2 наблюдениях выявлено диффузное поражение всех отделов ПЖ. Опухоли визуализировались как одиночные (4 наблюдения) или множественные (5 наблюдений) кистозные полости правильной округлой или овальной формы с однородным содержимым либо как диффузное расширение ГПП или боковых панкреатических протоков. Связь кистозных полостей с просветом ГПП выявлена в 6 наблюдениях. У 5 больных, помимо расширения ГПП, имелось увеличение диаметра боковых панкреатических протоков. Чувствительность КТ, МРТ и эндоУЗИ составила 66, 83 и 88% соответственно.
Правильный диагноз ВПМО можно установить лишь при наличии у клинициста знания об этом заболевании и его целенаправленном поиске. В противном случае неизбежно допускаются диагностические ошибки. В качестве примера приводим клиническое наблюдение.
Больной К., 46 лет, направлен в Институт хирургии им. А.В. Вишневского на госпитализацию одной из поликлиник Москвы с диагнозом: хронический панкреатит, постнекротическая киста ПЖ.
На протяжении 15 лет пациента беспокоили боли в верхнем отделе живота опоясывающего характера; при амбулаторном обследовании диагностирован хронический панкреатит. В 2000 г. обнаружено кистозное образование в области хвоста ПЖ диаметром 30 мм, которое трактовалось как постнекротическая киста; больной продолжал наблюдаться в поликлинике. При контрольном УЗИ и КТ в 2008 г. отмечено, что размеры образования достигли 10 см, однако хирургического лечения предложено не было. Лишь в 2010 г., когда по данным амбулаторного обследования кистозное образование увеличилось до 15 см, направлен в Институт хирургии им. А.В. Вишневского.
В Институте при УЗИ в проекции хвоста ПЖ выявлено образование размером 119×111×122 мм, с четкими ровными контурами, по структуре образование жидкостное, с наличием изо- и гипоэхогенных слоистых тонких перегородок, капсула гиперэхогенная толщиной 9 мм. Заключение: хронический панкреатит; постнекротическая киста(?). Кистозная опухоль(?) хвоста ПЖ.
КТ органов грудной и брюшной полости с болюсным усилением (рис. 1):
МРТ органов брюшной полости (рис. 2):
ЭндоУЗИ (рис. 3):
При ЭГДС и ирригоскопии органических изменений не выявлено.
Таким образом, на основании клинических проявлений заболевания и комплексного лучевого обследования установлен диагноз ВПМО тела и хвоста ПЖ. С учетом длительности заболевания и большого размера опухоли заподозрено наличие карциномы.
Больной оперирован в плановом порядке, выполнена робот-ассистированная корпорокаудальная резекция ПЖ, спленэктомия, лимфодиссекция в области артерий бассейна чревного ствола (рис. 4).
В описанном наблюдении диагностическая ошибка и тактически неверное ведение больного привели к запоздалой операции, выполненной через 15 лет от начала заболевания уже при наличии злокачественной опухоли.
Операции, выполненные по поводу ВПМО, отражены в таблице.
Гистологическое исследование подтвердило наличие ВПМО у всех оперированных больных. I тип ВПМО выявлен у 7, II тип - у 1, смешанный тип - у 4 больных; в 3 наблюдениях тип опухоли после исследования не указан. В 8 наблюдениях гистологическая структура опухоли соответствовала карциноме, аденома выявлена у 3 больных, опухоль с пограничным потенциалом злокачественности - у 4. По данным морфологического исследования радикальность оперативного вмешательства соответствовала R0 в 11, Rl в 4 наблюдениях.
Послеоперационные осложнения отмечены у 7 больных. У 2 больных возник длительный гастростаз, разрешившийся на фоне консервативной терапии. Несостоятельность билиодигестивного анастомоза была в одном наблюдении, выполнено дренирование жидкостного скопления под ультразвуковым контролем. У одного больного в послеоперационном периоде отмечено формирование инфильтрата в зоне резекции головки ПЖ, вызвавшего компрессию общего желчного протока, выполнена ЭРХП со стентированием общего желчного протока. Нагноение послеоперационной раны имело место у одного пациента. Двум больным потребовалось выполнить релапаротомию: одному в связи с внутрибрюшным кровотечением из культи ПЖ, другому произведены санация и дренирование брюшной полости в связи с холеперитонеумом, развившимся после удаления дренажа из общего желчного протока. Летальных исходов не было.
ВПМО является редко встречающейся опухолью ПЖ. В отечественной литературе практически отсутствуют сообщения об этом заболевании, однако каждый хирург и гастроэнтеролог в свой практике неизбежно сталкиваются с такими пациентами. Как показывают анализ данных литературы и результаты нашего исследования, ВПМО не имеет каких-либо патогномоничных клинических проявлений. Стенозирование главного или боковых панкреатических протоков сосочковыми разрастаниями и нарушение оттока густого муцина приводят к панкреатической гипертензии. Протоковая гипертензия способствует возникновению хронического или острого панкреатита с соответствующими клиническими проявлениями, однако развитие панкреонекроза нехарактерно из-за медленного нарастания панкреатической гипертензии. По нашим данным, лишь у одного больного имелся достоверно доказанный эпизод ранее перенесенного панкреонекроза.
На ранних стадиях заболевания правильный диагноз установить чрезвычайно трудно. Клиническая картина заболевания чаще соответствует хроническому панкреатиту, по поводу которого больных длительное время лечат амбулаторно или стационарно. Лабораторные тесты не дают специфической информации и не могут помочь в диагностике. По-видимому, единственным патогномоничным признаком, который можно выявить при дуоденоскопии, является симптом «рыбьего глаза» - выделение прозрачной слизи из расширенного большого сосочка двенадцатиперстной кишки. Однако этот симптом удается выявить довольно редко, нами он был обнаружен в 2 наблюдениях.
По мере увеличения опухоли и нарастания панкреатической гипертензии информативность диагностических методов существенно возрастает. УЗИ имеет скрининговый характер. При этом исследовании определяются характеристики паренхимы ПЖ, состояние протоковой системы, наличие и локализация кистозной опухоли, ее структура. Высказать предположение о морфологическом типе опухоли, как правило, не удается. Нами лишь в одном наблюдении была заподозрена ВПМО.
Основным эндосонографическим критерием ВПМО любого типа служит наличие связи кистозных образований с расширенной протоковой системой ПЖ, отсутствие кальциноза перегородок.
КТ брюшной полости, МРТ являются информативными методами, позволяющими с высокой степенью вероятности предположить наличие ВПМО. Характерными признаками ВПМО служат расширение главного или боковых панкреатических протоков, связь опухоли с протоковой системой ПЖ. Бесспорным признаком опухолевой природы расширения панкреатического протока следует считать визуализацию пристеночных папиллярных разрастаний и их контрастирование при введении рентгеноконтрастных и магнитно-резонансных контрастных средств.
Зачастую только комплексное лучевое исследование (УЗИ, эндоУЗИ, КТ и МРТ) с детальным анализом всей полученной информации позволяет установить правильный диагноз.
Наиболее частой диагностической ошибкой при лучевых методах диагностики является трактовка обнаруженного кистозного образования ПЖ как постнекротической кисты. Наличие нескольких мелких кистозных структур в паренхиме ПЖ должно трактоваться в пользу опухолевого поражения даже у пациентов с картиной хронического панкреатита.
Проведение дифференциальной диагностики является сложной задачей из-за схожести рентгенологических и ультразвуковых признаков. Пункционная биопсия оказывается малоинформативной. Верификации диагноза помогает сопоставление инструментальных данных и анамнеза заболевания, отсутствие указаний на перенесенный панкреонекроз при наличии рентгенологической картины кистозного образования следует трактовать в пользу опухоли, а не постнекротической кисты.
Единое мнение о лечении ВПМО отсутствует. Контролируемых рандомизированных исследований в настоящее время нет. Не вызывает сомнений необходимость хирургического лечения ВПМО I и III типов, поскольку при них высока вероятность малигнизации [1, 4, 14, 19, 22].
Опухоли II типа без клинической симптоматики, размером менее 3 см, расположенные в боковых панкреатических протоках и не обладающие пристеночными разрастаниями и перегородками, имеют доброкачественное течение. Поэтому при этих опухолях допустимо динамическое наблюдение [11, 14, 19, 26, 32]. Однако недавние исследования показали, что у больных, оперированных по поводу ВПМО II типа, при гистологическом исследовании препаратов обнаружено распространение опухоли на ГПП, что существенно увеличивает вероятность развития карциномы [18]. Кроме того, ни один из существующих на сегодняшний день методов дооперационного обследования не позволяет полностью исключить злокачественный характер опухоли. На наш взгляд, выжидательная тактика при ВПМО II типа оправдана у пожилых пациентов с бессимптомным течением заболевания и у лиц с тяжелыми сопутствующими заболеваниями.
По нашему мнению, тактика хирургического лечения при ВПМО должна быть разумно агрессивной. Мы согласны с мнением хирургических коллективов, считающих, что при опухолях размером менее 30 мм и отсутствии при экспресс-гистологическом интраоперационном исследовании признаков карциномы возможно выполнение органосберегающих операций [16, 28, 30].
По данным литературы, 5-летняя выживаемость оперированных пациентов с доброкачественными и злокачественными неинвазивными формами ВПМО (carcinoma in situ) составляет 80-100% [2, 7, 19, 22, 26]. При инвазивных формах карциномы, даже при наличии прорастания воротной или верхней брыжеечной вены, необходимо хирургическое лечение. У больных с коллоидной инвазивной карциномой прогноз более благоприятный, чем у больных с инвазивной протоковой аденокарциномой [1]. Необходимо стремиться выполнять операцию в объеме R0, для чего требуется не только удаление лимфатических коллекторов, но и обязательное интраоперационное морфологическое исследование среза удаленного препарата.
Таким образом, внутрипротоковая папиллярно-муцинозная опухоль длительное время протекает под «маской» хронического панкреатита, что, как правило, на ранней стадии заболевания приводит к диагностическим ошибкам. Лабораторная диагностика не несет специфической информации. УЗИ обеспечивает выявление кистозного образования поджелудочной железы, но не позволяет высказать предположение о его характере. КТ и особенно МРТ с высокой степенью вероятности способствуют правильной диагностике. Наиболее информативна эндосонография. Однако ни один из лучевых методов диагностики не дает возможности полностью избежать диагностических ошибок в первую очередь при дифференциальной диагностике с постнекротическими кистами поджелудочной железы. Интрапаренхиматозные кисты малых размеров следует трактовать не как постнекротические изменения, а как проявления опухоли. Хирургическая тактика лечения должна быть разумно активной и направленной на выполнение радикальных вмешательств независимо от размера новообразования.
Список литературы:
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.












.jpg)



.png)


















Комментарии