- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Обзоры: Обзор литературы: ПОРТАЛЬНАЯ ГИПЕРТЕНЗИВНАЯ ГАСТРОПАТИЯ ПГГ 2018
| Авторы: | Елена Симонова |
Полный текст статьи:
ПОРТАЛЬНАЯ ГИПЕРТЕНЗИВНАЯ ГАСТРОПАТИЯ. ОБЗОР ЛИТЕРАТУРЫ
Портальная гипертензивная гастропатия (гастропатия при портальной гипертензии, портальная гастропатия, ПГГ) - это термин, используемый для описания характерного мозаичного рисунка слизистой желудка, часто - с подслизистыми кровоизлияниями, выявляемого с определенной частотой у пациентов с портальной гипертензией.
ПГГ является вторичным изменением слизистой оболочки (СО), а также подслизистого слоя желудка на фоне цирроза печени (ЦП) любой этиологии и сопутствующей ему портальной гипертензии. В то же время, данная патология может развиваться при гипертензии не только цирротического, но и любого другого генеза (болезнь Бадда-Киари, внепеченочная окклюзия портальной вены и др.) [1].
История изучения вопроса. Связь между ЦП и развитием патологии желудка и двенадцатиперстной кишки (ДПК) была замечена многие десятилетия назад. В 1937 Eppinger описал изменения в СО желудка и тонкой кишке при ЦП и связал их с влиянием на СО токсичных метаболитов, поступающих из кишки [2].
T.T.McCormack с соавторами в 1985г. описал эндоскопические и гистологические изменения СО желудка у больных с портальной гипертензией, и отметил, что, не смотря на схожесть макроскопических проявлений, данное состояние имеет иные морфологические признаки, включающие нарушения микроциркуляции в СО. Авторы впервые применили термин «застойная гастропатия» вместо «гастрит», подчёркивая уникальность изменений СО желудка при портальной гипертензии. Позже описанное состояние получило название «портальная гипертензивная гастропатия» [1, 3].
Эпидемиология. Распространенность ПГГ, по данным разных авторов, колеблется от 20% до 98%. Такой широкий диапазон значений может быть обусловлен неоднородностью групп исследуемых больных, различной интерпретацией эндоскопических изменений и отсутствием единых диагностических критериев и классификации [1, 4].
Частота развития ПГГ также взаимосвязана с различной продолжительностью ЦП, наличием или отсутствием варикозно расширенных вен (ВРВ) пищевода и желудка, кровотечений в анамнезе, с видами лечения ВРВ пищевода (склеротерапия, лигирование), динамичным состоянием ПГГ [4,5].
В среднем, ПГГ встречается более, чем в 40% случаев при ЦП и часто сочетается с ВРВ пищевода и желудка, являясь предиктором будущего кровотечения из пищеводных
вариксов. В то же время, облитерация ВРВ пищевода может увеличивать частоту ПГГ. Частота ПГГ повышается при увеличении тяжести течения ЦП [4,5].
По данным М. Primignani с соавт. (2000), частота ПГГ у больных с вновь выявленным ЦП составила 56%, у больных с существующим ЦП без кровотечений в анамнезе – 75%, с кровотечением из ВРВ пищевода и желудка в анамнезе – 91% [6]. По данным М. Мerli и соавт. (2004), частота ПГГ у больных с длительностью анамнеза ЦП до одного года составила 3%, до трех лет – 24%, частота ПГГ была выше у больных с наличием ВРВ пищевода, чем без таковых (35 и 11% соответственно) [7].
Патогенез ПГГ. Вопросы патогенеза ПГГ во многом остаются неясными и продолжают дискутироваться.
В литературе обсуждается влияние гемодинамических, вазоактивных факторов, дисбаланса факторов защиты и агрессии, дискутируется вопрос о влиянии H. pylori на развитие ПГГ у больных с ЦП [1,4,5, 7,8,9,12].
Исследователи полагают, что в основе заболевания лежит портальная гипертензия. Гипердинамическое состояние внутриорганного кровотока при портальной гипертензии сопровождается увеличением сердечного выброса и уменьшением периферического сосудистого сопротивления, вызывает циркуляторные нарушения практически во всех органах, включая желудочно-кишечный тракт, почки, лёгкие. Одним из таких последствий является полнокровие и венозный застой СО желудка, что приводит к гипертрофии эндотелия сосудов и делает его чувствительным к повреждающим агентам
Несмотря на то, что исследования не продемонстрировали существование прямой зависимости между степенью портальной гипертензии и тяжестью ПГГ, были выявлены определенные различия в градиенте внутрипеченочного венозного давления в группе больных без ПГГ и с явлениями тяжелой ПГГ [4,5]. Вероятно, повышенное портальное давление может играть важную, но не самую значимую роль в развитии ПГГ.
К развитию и прогрессированию ПГГ, по данным ряда исследователей, приводит эндоскопическая инъекционная склеротерапия ВРВ пищевода [4,5,8,11]. ПГГ значительно прогрессирует в течение 6–9 месяцев после облитерации ВРВ пищевода путем склеротерапиии, однако, затем может быть постепенное регрессирование ее проявлений [5]. Наложение гастроренального шунта может играть защитную роль в развитии ПГГ после проведения склеротерапии [5, 10]. Эти данные свидетельствуют о том, что развитие ПГГ в большей степени связано не с особенностями портальной гемодинамики, а с нарушением местной гемодинамики желудка, в частности, с повышенным кровенаполнением сосудов СО желудка (ряд экспериментальных работ выявили
значительное возрастание кровотока желудка в целом и, в частности, в слизистой оболочке при ПГГ) [4, 5].
По мнению N.Urruganda с соавт. (2014), основным патологическим процессом при ПГГ является нарушение регуляции микроциркуляции слизистой, что приводит к гипоксии СО, повреждению целостности эпителиальных клеток из-за перепроизводства свободных радикалов кислорода, оксида азота, тумор-некротизирующий фактор α (TNF- α), эндотелина-1, и простагландина. Кроме того, из-за нарушения желудочного кровотока и, возможно, нарушения регуляции местных цитокинов и сосудистых факторов, изменения в СО при ПГГ приводят к ухудшению процессов репарации и механизмов защиты, что, в свою очередь, может увеличить риск кровотечения [4].
В результате изучения частоты контаминации СО желудка Н. pylori у больных ЦП с ПГГ, зависимости степени ПГГ от выраженности ее колонизации, были получены противоречивые данные. В целом, предполагается, что ПГГ с геморрагическими кровоизлияниями и отеком СО желудка не создает благоприятных условий для колонизации H. pylori. [5]. Более того, V. Batmanabane и соавт. (2004) выявили снижение инфицированности СО желудка H. pylori с увеличением тяжести ПГГ (при легкой степени ПГГ H. pylori выявлен в 52%, при умеренной – в 22% случаев, при тяжелой ПГГ H. pylori не выявлен). В целом, анализ литературных данных позволяет сделать вывод о маловероятной роли инфекции в патогенезе ПГГ и отсутствии причин для проведения стандартной эрадикационной терапии [5, 12].
Клинические проявления. Клиническое течение ПГГ в большинстве случаев бессимптомное. У части пациентов могут иметь место неспецифические проявления – болевые ощущения давящего, ноющего характера в животе, тошнота, рвота, чувство тяжести в эпигастрии, чувство раннего насыщения и переполнения, снижение массы тела.
При присоединении эрозивно-язвенных поражений гастродуоденальной зоны, по данным J. Auroux и соавт. (2003), к клиническим проявлениям ПГГ могут присоединиться жалобы на ноющие боли в эпигастральной области различной интенсивности, возникающие после еды или натощак, диспептические проявления, умеренная болезненность при пальпации в эпигастральной области [5, 11].
Абсолютное большинство исследователей в качестве основного проявления ПГГ рассматривают явные или скрытые кровотечения. При этом значительное количество пациентов предъявляет жалобы, связанные с хронической кровопотерей или железодефицитной анемией [1, 4, 5].
Диагностика ПГГ. Золотым стандартом диагностики ПГГ является эндоскопическое исследование.
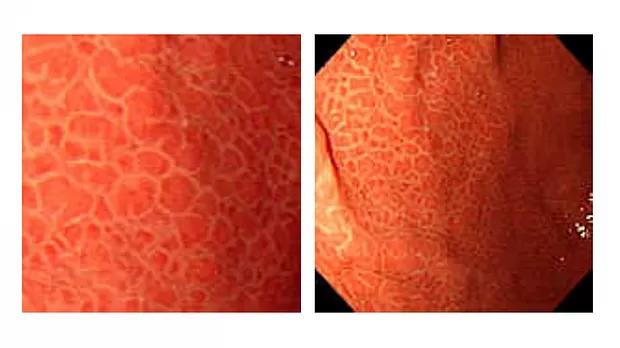
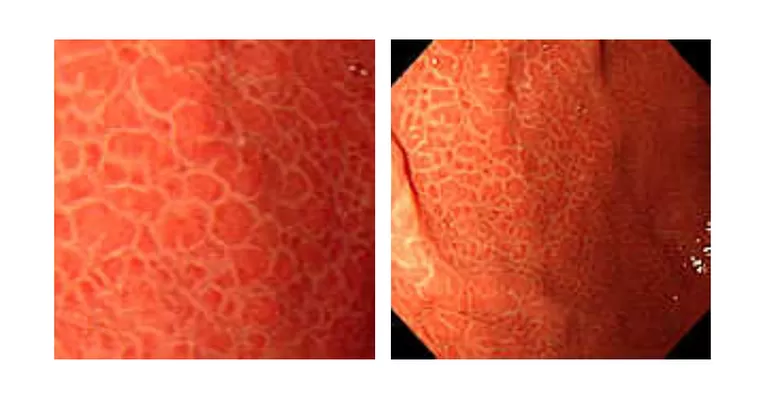
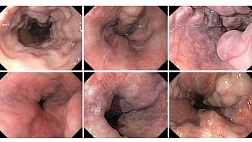
Эндоскопически СО желудка представлена множественными небольшими приподнятыми участками в виде мозаики (рис. 1), т.н. «змеиной кожи» (рис. 2), разделенные ретикулярной сетью прожилок белесого или желтоватого цвета, утолщенными, застойными складками (рис. 3), в более тяжелых случаях такая картина дополняется подслизистыми кровоизлияниями (вишневые, вишнево-коричневые, черно- коричневые пятна) и даже просачиванием крови из слизистой желудка (рис. 4, 5). ПГГ часто, но далеко не обязательно, сочетается c ВРВ пищевода или желудка [3,4,5,8,14, 15].
Изменения СО желудка, характерные для ПГГ, чаще всего локализованы в области тела и дна желудка, но по данным M. Primignani и соавт. (2000), у 50% больных ЦП при ПГГ вовлекается в процесс весь желудок [5,6].
Подобные изменения могут встречаться на всем протяжении желудочно-кишечного тракта, включая тонкий и толстый кишечник [4,5].
Классификации. Существует несколько вариантов классификаций ПГГ. К ним относятся: руководство Всемирной организации пищеварительного тракта (OMED), Новоитальянского эндоскопического клуба (NIEC), документы согласительных конференций по портальной гипертензии Baveno II, III, IV, V, а также классификации T.T. McCormack и K. Tanoue с соавт. [5, 6, 16,17,18,19, 20].
Согласно критериям OMED, гастропатия при портальной гипертензии включает в себя следующие типы эндоскопических проявлений со стороны желудка:
1) скарлатиноподобный рисунок: в мелкую розовую крапинку (рис. 6);
2) мозаичный рисунок: множественные участки эритемы, очерченные переплетающейся белой сетчатой структурой (рис. 7);
3) вишнево-красные пятна: сливающиеся между собой диффузно кровоточащие участки (рис. 8);
4) темно-коричневые пятна: диффузно расположенные темные точки и пятна, обусловленные отложениями гематина в субэпителиальном слое.
Скарлатиноподобный и мозаичный рисунок относят к легкой форме, вишнево- красные пятна и темно-коричневые пятна – к тяжелой форме ПГГ [17].
Северный итальянский клуб эндоскопистов (NIEK) предложил макроскопическую классификацию ПГГ, которая позволила более четко определять степень тяжести заболевания [6]. При этом в СО желудка обычно наблюдаются слизистые и подслизистые расширения сосудов без элементов воспаления. В соответствии с критериями NIEC выделяют следующие степени ПГГ:
умеренная – характеризуется наличием мозаичной картины (MLP – mosaic-like pattern) СО желудка;
тяжелая – характеризуется наличием красных точечных повреждений (RPLs – red point lesions): вишнево-красных пятен (CRSs – cherry red spots), черно-коричневых пятен (BBSs – black brown spots), которые могут сливаться между собой.
В настоящее время red point lesions и cherry red spots объединены в термин «red marks» («красные знаки»). По данным NIEC, в результате эндоскопического исследования
373 пациентов ЦП с ПГГ выявлено, что MLP, RPLs, CRSs, BBSs встречаются –
соответственно – у 59,0, 37,0, 5,9 и 8,3% больных [6].
При выраженной ППГ СО желудка становится очень тонкой, ломкой вследствие чего проведение эндоскопического исследования или взятие биопсии может спровоцировать развитие желудочного кровотечения.
На конференции Baveno III (2000) ПГГ классифицирована как умеренная – при наличии мозаичности СО желудка умеренной степени выраженности и отсутствии красных пятен в центре розовой ареолы; как тяжелая – при наличии выраженной мозаичности СО желудка и красных пятен в центре розовой ареолы или других красных знаков [19].
Классификация T.T. McCormack et al. предполагает две степени поражения СО желудка. При ПГГ легкой степени эндоскопически выявляют мозаичный рисунок СО желудка, при тяжелой – в дополнение к мозаичному рисунку появляются диффузные темно-красные пятна, подслизистые геморрагии. Эта классификация также удобна для прогнозирования вероятности развития кровотечения. Так, при легкой степени ПГГ риск кровотечения составляет 3,5-31%, при тяжелой – 38-62%. Легкая ПГГ выявляется в 49%, а тяжелая – в 14% случаев портальной гипертензии [3].
K. Tanoue и соавт. (1992) классифицировали ПГГ по трем степеням тяжести:
1 ст. – небольшое покраснение СО желудка, имеющее «застойный», но не мозаичный вид;
2 ст. – выраженное покраснение (яркая гиперемия) с участками возвышающейся отечной СО желудка, разделенными тонкой белой ретикулярной сетью, или изменения по типу мозаики;
3 ст. – точечные геморрагии на фоне макроскопической картины, характерной для
2- й степени [16].
Однако, трехкатегорийная классификационная система ПГГ не нашла широкого распространения на практике.
Морфологическая диагностика. Основные гистологические изменения при ПГГ включают расширение капилляров и венул в слизистом и подслизистом слое без существенного воспаления. Ряд исследований показали, что отклонения в микроциркуляции СО могут быть связаны с застоем, который развивается в результате повышения объема жидкости в слизистой желудка, при этом одновременно снижается степень оксигенации, что подтверждает застойный характер патологических изменений и приводит к снижению защитных механизмов СО желудка [1,3,4,5].
При гистологическом исследовании гастробиоптата в собственной пластинке выявляют увеличение количества капилляров, извитость (застойный ангиоматоз), полнокровие и неравномерность калибра сосудов с запустеванием части из них, утолщение капиллярных стенок, микротромбозы, фиброзирование собственной пластинки. При исследовании ультраструктуры происходящих морфологических изменений СО желудка у больных ПГГ наблюдается диапедез эритроцитов через поврежденные участки эндотелия в интраэпителиальное пространство [4,5,8].
ПГГ с преобладанием в проксимальных отделах желудка расценивается как диффузный тип желудочной сосудистой эктазии.
Другие диагностические методы. Кроме эндоскопических методов диагностики ПГГ, в настоящее время применяются компьютерная томография и магнитно-резонансной томография. Признаками ПГГ является при КТ-исследовании является утолщение внутреннего слоя СО желудка, выявляемое в раннюю, позднюю и отсроченную фазы контрастирования (у 90% больных ЦП с ПГГ). Магнитно-резонансная томография используется для измерения диаметра левой желудочной, параэзофагеальный и непарной вен у больных с портальной гипертензией [4,5].
Течение ПГГ. В результате исследований выявлено, что ПГГ является динамичным состоянием. При повторных эндоскопических исследованиях патологические изменения СО желудка могут прогрессировать в более тяжелые формы, а также могут подвергаться обратному развитию и иногда могут полностью исчезать. Исследователи предполагают, что если признаки ПГГ существуют более 3 месяцев, то,
вероятно, они будут наблюдаться продолжительное время, а если они имеют место более 6 месяцев, то их регресс невозможен [5,7]. Отмечено, что чаще регресс ПГГ наблюдается у больных с нецирротической портальной гипертензией (при перипортальном фиброзе (в т.ч. при болезни Банти), внепеченочной обструкции портальной вены), чем при ЦП.
Кровотечение. ПГГ у больных ЦП рассматривается как потенциальный источник острого или хронического гастродуоденального кровотечения. Кровотечение при ПГГ чаще всего носит не тяжелый характер. Частота его возникновения варьирует от 2 до 60 % случаев [4, 5,6,7,21].
Чаще встречается хроническое кровотечение, которое по данным литературы, происходит у 3% - 60% пациентов с ПГГ и не всегда легко диагностируется. Хроническое кровотечение подозревают при снижении гемоглобина на 2 г/дл в течение 6 месяцев без признаков острого кровотечения, при исключении других источников, в том числе в толстой и тонкой кишке, и без приема нестероидных противовоспалительных препаратов. Другие исследователи указывают на наличие железодефицитной анемии с положительным тестом на скрытую кровь [4]. Смертность, ассоциированная с таким кровотечением, мала и ПГГ не является самостоятельным прогностическим фактором выживаемости пациентов. В то же время, хронические кровопотери приводят к выраженным нарушениям функции печени, возникновению и прогрессированию печеночной энцефалопатии, значительно утяжеляя состояние больного.
Острая кровопотеря является менее характерной для портальной гастропатии. Частота острых желудочно-кишечных кровотечений при ПГГ у пациентов с циррозом составляет от 2% до 12%. Большинство этих случаев происходит при тяжелых формах ПГГ (90% -95%). Об остром гемодинамически значимом кровотечении, ассоциированном с ПГГ, можно говорить при наличии рвоты с кровью (кофейной гущей) или мелены и снижении гемоглобина не менее 2 g/dl, при отсутствии других источников кровопотери. При эндоскопическом исследовании выявляют активное кровотечение (просачивание крови) из повреждений при портальной гастропатии или неудаляемые сгустки на поверхности поражений, или, если имеются признаки портальной гипертензии с характерными изменениями в желудке при отсутствии иного источника кровотечения [4].
Установлена прямая корреляция между тяжестью ПГГ и риском возникновения кровотечения. По данным Y. Zhou и соавт. (2002), при умеренной ПГГ желудочные кровотечения встречаются у 13% больных, при тяжелой ПГГ – у 75% [22].
Облитерация ВРВ пищевода, как путем склеротерапии так и лигирования латексными кольцами, утяжеляет ПГГ и увеличивает риск кровотечения, что возможно объясняется местными изменениями гемодинамики - увеличение объема, скорости и давления кровотока в венах желудка [4, 11, 22].
По данным исследователей, наличие ПГГ сопряжено с ухудшением прогноза заболевания, что диктует необходимость совершенствования диагностики и лечебной тактики этого осложнения ЦП, которые должны основываться на знаниях его патогенеза и диагностических возможностей [5].
Лечение ПГГ и ее осложнений, преимущественно, консервативное и направлено на снижение портального давления и восстановления кровотока в сосудах желудка путем использования неселективных бета-блокаторов. Основной препарат для лечения ПГГ и профилактики кровотечений – пропранолол в суточной дозе 40–320 мг, надолол или карведилол под контролем уровня артериального давления и частоты сердечных сокращений. При наличии противопоказаний к применению бета-блокаторов можно использовать нитраты (изосорбида-5-мононитрат и его аналоги. Однако, согласно международным согласительным документам, единственным препаратом для лечения ПГГ считается назначение бета-блокаторов [1,4,5,23, 24].
У больных, рефрактерных к приему пропранолола, для профилактики кровотечения может быть предложено наложение трансюгулярного внутрипеченочного портосистемного шунта (TIPS), что приводит к снижению венозного давления в воротной вене и улучшению нарушенной перфузии желудка у больных с явлениями ПГГ [5].
При появлении признаков острого кровотечения из верхних отделов желудочно- кишечного тракта оправдано назначение препаратов, снижающих давление в венах брюшной полости (соматостатина или его синтетического аналога октреотида). Эти препараты снижают кровоток в СО желудка, однако этот эффект носит транзиторный характер. Для дополнительного эффекта можно сочетать назначение октреотида с ингибиторами протонной помпы. Рекомендуется применять соматостатин или октреотид для остановки острого кровотечения, а бета-блокаторы – для профилактики его рецидива и контроля хронического кровотечения [5, 22, 24].
Эндоскопическая терапия малоэффективна т.к. кровотечение чаще всего носит невыраженный и диффузный характер. При визуализации конкретной точки кровотечения можно использовать инъекционную терапию или коагуляцию термическим зондом или лазером.
Таким образом, ПГГ является важным и достаточно частым осложнением портальной гипертензии, имеющим в своей основе гемодинамические нарушения. Основополагающим в диагностике данной патологии является эндоскопический метод, базирующийся на типичных эндоскопических проявлениях. Лечение и профилактика основного осложнения ПГГ – кровотечения, подразумевает медикаментозную терапию.
Список литературы:
1. Бабак О.Я., Колесникова Е.В. Цирроз печени и его осложнения / О.Я.Бабак, Е.В.Колесникова. –К., 2011. -576 с.
2. Москаль О.М. Гепатогенні ерозивно-виразкові ураження шлунка: клініко- біохімічне, імунологічне та мікробіологічне обгрунтування лікування. Автореф. Дис. канд. мед. наук. –Дніпропетровськ, 2008. – 20 с.
3. McCormack T.T. Gastric lesions in portal hypertension: inflammatory gastritis or congestive gastropathy? / T.T. McCormack, J.Sims, I. Eyre-Brook, H. Kennedy et.al.// Gut. – 1985. - N 26. – P.1226-1232.
4. Urruganda N.H. Portal hypertensive gastropathy and colopathy / N.H. Urruganda, D.C.Rockey// Clin. Liver Dis. – 2014. – 18 (2). –P. 389-406.
5. Малаева Е.Г. Портальная гипертензивная гастропатия // Е.Г.Малаева, Н.Н.Силивончик // ARS MEDICA. – 2009. - № 6 (16). – С. 87-97.
6. Primignani M. Natural history of portal hypertensive gastropathy in patients with liver cirrhosis. The New Italian Endoscopic Club for the study and treatment of esophageal varices (NIEC) / M. Primignani [et al.] // Gastroenterology. – 2000. – Vol. 119, № 1. – P. 181– 187.
7. Merli M. The natural history of portal hypertensive gastropathy in patients with liver cirrhosis and mild portal hypertension / M. Merli [et al.] // Am J Gastroenterol. – 2004. – Vol. 99, № 10. – P. 1959–1965.
8. Cubillas R. Portal hypertensive gastropathy: a review / R.Cubillas, D.C.Rockey // Liver Int. – 2010. - N 30. –P. 1094–102. [PubMed: 20536720].
9. Pathogenesis of portal hypertensive gastropathy: translating basic research into clinical practice / R.F.Perini, P.R.Camara, J.G. Ferraz // Nat Clin Pract Gastroenterol Hepatol. - 2009. - N 6. – P.150–8. [PubMed: 19190600].
10. Pathogenesis of portal hypertensive gastropathy: a clinical and experimental review / M.Ohta, S.Yamaguchi, N.Gotoh, M.Tomikawa // Surgery. – 2002. –N 131(1 Suppl). –P. S165-70.
11. Effects of endoscopic injection sclerotherapy on portal hypertensive gastropathy: a prospective study / K.Tanoue, M.Hashizume, H.Wada [et al.] // Gastrointest. Endosc. – 1992.
– N 38. –P. 582–5. [PubMed: 1397916]
12. Batmanabane V. Prevalence of Helicobacter pylori in patients with portal hypertensive gastropathy – a study from south India / V. Batmanabane, V. Kate, N. Ananthakrishnan // Med Sci Monit. – 2004. – Vol. 10, № 4. – P. 133–136.
13. Auroux J. Gastroduodenal ulcer and erosions are related to portal hypertensive gastropathy and recent alcohol intake in cirrhotic patients / J. Auroux [et al.] // Dig Dis Sci. – 2003. – Vol. 48, № 6. – P. 1118–1123.
14. de Macedo G.F. Reliability in endoscopic diagnosis of portal hypertensive gastropathy / G.F. de Macedo, F.G. Ferreira, M.A. Ribeiro // World J Gastrointest Endosc. – 2013. -N 5. –P. 323–31. [PubMed: 23858376].
15. Spina GP, Arcidiacono R, Bosch J.. Gastric endoscopic features in portal hypertension: final report of a consensus conference, Milan, Italy, September 19, 1992 / G.P.Spina, R.Arcidiacono, J.Bosch // J Hepatol. -1994. - N 21. –P.461–7. [PubMed: 7836719]
16. Accuracy and reliability of the endoscopic classification of portal hypertensive gastropathy / H.Y.Yoo, J.A.Eustace, S.Verma [et al.]. - Gastrointest Endosc. – 2002. - N56. –P. 675–80. [PubMed: 12397275].
17. Маржатка, З. Терминология, определения терминов и диагностические критерии в эндоскопии пищеварительного тракта / З. Маржатка. – 3-е изд. – Бад-Хомбург: Нормед, 1996. – 141 с.
18. Prospective study on the application of the Baveno II Consensus Conference criteria in patients with cirrhosis and gastrointestinal bleedind / P. Cales [et al.] // J.of Hepatology. – 2000. – Vol. 33, № 1. – P. 738–741.
19. de Franchis R. Updating consensus in portal hypertension: report of the Baveno III Consensus Workshop on definitions, methodology and therapeutic strategies in portal hypertension / R. de Franchis. - J Hepatol. – 2000. - N 33. – P. 846–52. [PubMed: 11097497].
20. de Franchis R. Revising consensus in portal hypertension: report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension R. de Franchis, B.V.Faculty // J Hepatol. -2010. - N 53. – P. 762–8. [PubMed: 20638742]
21. Lyles T. A risk scoring system to predict in-hospital mortality in patients with cirrhosis presenting with upper gastrointestinal bleeding / T.Lyle, A.Elliott, D.S.Rockey // J Clin Gastroenterol. -2013. - Epub ahead of print.
22. Zhou Y. Comparison of the efficacy of octreotide, vasopressin, and omeprazole in the control of acute bleeding in patients with portal hypertensive gastropathy: a controlled study / Y. Zhou [et al.] // J Gastroenterol Hepatol. – 2002. – Vol. 17, № 9. – P. 973–979.
23. Ripoll C. The management of portal hypertensive gastropathy and gastric antral vascular ectasia / C.Ripoll, G.Garcia-Tsao // Dig Liver Dis. -2011. -N 43. –P.345–51. [PubMed: 21095166].
24. de Franchis, R. Evolving Consensus in Portal Hypertension Report of the Baveno IV Consensus Workshop on methodology of diagnosis and therapy in portal hypertension / R. de Franchis // Hepatology. – 2005. – Vol. 43, № 1. – P. 167–176.
Автор обзора: Елена Симонова, ГУ "Институт гастроэнтерологии НАМН Украины" Материал предоставлен Автором.
Опубликовано в группе Endoscopy в FB(#EndoExpert.ru) Информационно-образовательный медицинский портал EndoExpert.ru
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.


.jpg)




.png)


















Комментарии