- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Химические ожоги пищеварительного тракта: Разработка и валидация прогностической шкалы
| Авторы: | Joan Tosca, Rosana Villagrasa, Ana Sanahuja, Ana Sanchez, Galo Antonio Trejo, Isabel Pascual, Pilar Mas, Andres Peña, Miguel Minguez 1 Belen Herreros 2 2021г. |
| Об авторах: |
1. Department of Digestive Medicine, Hospital Clínic Universitari, Universitat de Valencia, Valencia, Spain 2. Department of Digestive Medicine, Hospital de la Marina Baixa de la Vila Joiosa, Alicante, Spain |
Аннотация:
Актуальность проблемы Проглатывание каустика - потенциально тяжелое состояние, и раннее выявление неблагоприятного исхода важно для улучшения лечения; однако прогноз, основанный только на эндоскопии, может переоценить тяжесть. Это исследование было направлено на разработку и подтверждение прогностической оценки.
Методы . Проспективное когортное исследование было разработано для включения всех последовательных пациентов в возрасте> 15 лет, которые поступили с проглатыванием едкого вещества в период с 1995 по 2017 год. Неблагоприятный исход определялся поступлением в отделение интенсивной терапии, неотложной операцией или смертью. Прогностическая ценность клинических, аналитических и эндоскопических переменных была оценена в первой когорте (деривационная когорта), а прогностическая оценка, основанная на результирующих факторах риска, была разработана с помощью логистической регрессии. Была проведена внутренняя валидация (бутстрэппинг), а затем внешняя валидация была проверена на независимой выборке пациентов (валидационная когорта).
Результаты Было включено 469 случаев проглатывания каустика, 265 - в когорту дериваций и 204 - в когорту валидации. Проглатывание кислых веществ (отношение шансов [OR] 3,13, 95% доверительный интервал [CI] 2,33–4,21), количество нейтрофилов (OR 1,05, 95% CI 1,04–1,06), метаболический ацидоз (значение бикарбоната, OR 0,82, 95% CI 0,78–0,85) и эндоскопическое повреждение (OR 3,81, 95% ДИ 3,35–4,34) были независимыми факторами риска неблагоприятного исхода. Прогностическая оценка, основанная на этих переменных, обеспечивала лучшую точность, чем только эндоскопия ( P = 0,04), с высокой чувствительностью, специфичностью, положительными и отрицательными прогностическими значениями (93,3%, 92,7%, 72,7%, 98,5% соответственно) и площадью под кривая (0,976, 95% ДИ 0,973 - 0,979; P <0,001).
Выводы. Эта оценка позволяла надежно прогнозировать попадание каустика в организм и была более точной, чем оценка, основанная на эндоскопии.
Полный текст статьи:
Вступление
Проглатывание едких веществ - медицинская проблема, имеющая широкое клиническое выражение. В острой стадии некоторые пациенты протекают бессимптомно, в то время как другие эпизоды приводят к опасным для жизни ситуациям, поступлению в отделение интенсивной терапии (ОИТ), неотложной операции и даже смерти. Раннее выявление пациентов с плохим прогнозом является ключом к точному ведению таких случаев; однако распознать неблагоприятный исход не всегда просто, и отсутствуют надежные прогностические баллы.
Практически все опубликованные статьи, посвященные прогностическим факторам, являются ретроспективными и оценивают только определенные особенности заболевания. Более того, данные о прогностической ценности симптомов неубедительны: некоторые исследования ставят под сомнение связь между наличием симптомов и исходом проглатывания каустика [ 1 ] [ 2 ] [ 3 ] [ 4 ], в то время как другие приписывают прогностическую ценность существованию некоторых симптомов [ 5 ] [ 6 ] [ 7 ] [ 8 ] [ 9 ] [ 10 ] [ 11 ] [ 12 ] [13 ] [ 14 ]. Эндоскопическая оценка была основой прогноза с момента публикации серии статей Заргар [ 1 ] [ 2 ] [ 15 ], хотя этому подходу присущи некоторые недостатки. Изолированная эндоскопическая оценка может переоценить тяжесть, если не учитывать глубину повреждения стенки желудочно-пищеводного тракта или системное поражение [ 16 ]. Более того, эндоскопия иногда может быть противопоказана, обычно в самых тяжелых случаях, когда точный прогноз наиболее важен.
Мы предположили, что сочетание клинических, эндоскопических и аналитических данных может улучшить предсказательную способность и сделать надежный прогноз в остром периоде.
Целями нашего исследования были: 1) определение клинических, аналитических и / или эндоскопических параметров, определяющих неблагоприятный клинический исход; 2) разработать и проверить прогностическую модель, позволяющую раннее обнаруживать случаи с плохим прогнозом; и 3) сравнить точность модели с точностью только эндоскопии.
Методы
Дизайн исследования
Было разработано проспективное и продольное когортное исследование, и две группы пациентов были последовательно набраны для разработки и подтверждения прогностической оценки. Гипотеза и переменные исследования были определены перед началом исследования, на этапе разработки исследования перед набором пациентов. Сбор данных впоследствии проводился в соответствии с этим первоначальным протоколом в обеих когортах пациентов. В первую когорту (когорта деривации) вошли пациенты, которые поступили с едким повреждением в период с января 1995 года по сентябрь 2009 года. Вторая когорта (когорта валидации) включала пациентов с проглатыванием каустика с октября 2009 года по май 2017 года. Исследование проводилось в больнице Clinic Universitari de Валенсия, медицинский центр в Валенсии, Испания.
Протокол исследования соответствовал этическим принципам Хельсинкской декларации 1975 г. и более поздним поправкам к ней, что отражено в одобрении Комитетом по этике клинических исследований больничной клиники Universitari de Valencia.
Пациенты
Критериями включения в исследование были пациенты в возрасте старше 15 лет, которые случайно или добровольно проглотили какое-либо вещество с едкими свойствами. Критериями исключения были незначительное потребление очень небольшого объема, особенно в ситуациях, когда едкое вещество контактировало с полостью рта, но было выброшено без проглатывания, и пациенты, которые отказались участвовать в исследовании. Эти критерии применимы к обеим когортам.
Пациенты, соответствующие этим критериям, были идентифицированы из нашего институционального реестра, в котором каждый случай проглатывания каустика, присутствующий в нашей больнице, проспективно регистрировался с 1995 года, включая пациентов, которые обратились в службу экстренной помощи нашей больницы, а также тех, кто был направлен из первичной или другой медицинской помощи. высший центр. Набор был систематическим, и все пациенты, которые соответствовали критериям отбора, были последовательно включены в когорты деривации или валидации. Базовые характеристики обеих когорт сравнивали, чтобы выявить любую систематическую ошибку отбора.
Поскольку некоторые пациенты получали едкую травму более одного раза, в нашем анализе мы учитывали количество случаев проглатывания едкой щелочи, а не количество пациентов. Поскольку за период исследования не было значительных достижений в лечении проглатывания каустика, в обеих когортах применялось одинаковое лечение на основе эндоскопии.
Переменные
Основным результатом исследования была неблагоприятная эволюция, определяемая как поступление в ОИТ, срочная операция или смерть в остром периоде едкого повреждения. Хронические осложнения, такие как стриктуры пищевода или желудка и рак пищевода, в исследовании не рассматривались.
Показаниями для наблюдения в ОИТ были стойкая гемодинамическая недостаточность, несмотря на восполнение жидкости, необходимость мониторинга центрального венозного давления, дыхательная недостаточность, несмотря на введение кислорода, и необходимость инвазивной вентиляции. Срочная операция проводилась, если перфорация была доказана при эндоскопическом или радиологическом исследовании или в случае клинического подозрения (прогрессирующее клиническое ухудшение), несмотря на отсутствие эндоскопического или радиологического подтверждения.
Выжившие пациенты наблюдались в течение не менее 3 месяцев после выписки, чтобы исключить любые последующие осложнения, связанные с едкой травмой. Основной результат был установлен после этого 3-месячного периода наблюдения в обеих когортах исследователем, отличным от того, который собирал данные для потенциальных предикторов.
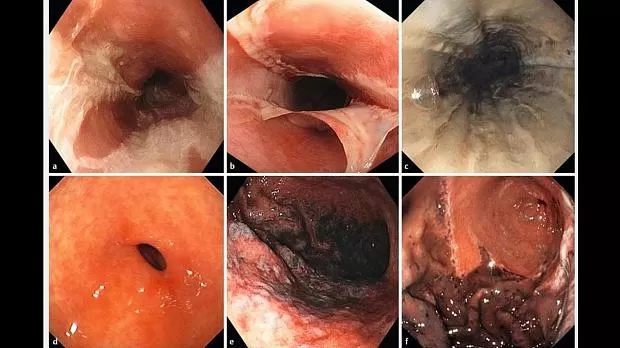
Пол, возраст и история гастроэнтерологических и психических расстройств рассматривались как потенциальные предикторы. Также оценивались характеристики проглатывания щелочи (т. Е. Тип вещества, объем, разбавление и причина проглатывания). Остальные исследованные клинические переменные включали наличие симптомов, а также оценку повреждений полости рта, глотки и гортани отоларингологом. Мы собрали различные аналитические данные, такие как гемоглобин (г / дл), лейкоциты (× 10 9 / л), тромбоциты (× 10 9/ Л), мочевина (мг / дл), креатинин (мг / дл), электролиты (ммоль / л) и артериальный (если сатурация кислорода <95%) или венозный газ крови с pH и бикарбонатом (мэкв / л) в чтобы проверить эти факторы как потенциальные прогностические маркеры. Согласно протоколу исследования, всем пациентам была предложена экстренная эндоскопия вне зависимости от тяжести попадания едкого натра. Таким образом, эндоскопия проводилась, за исключением случаев отказа пациента или противопоказаний, особенно тяжелых отоларингологических повреждений, стойкой гемодинамической или дыхательной недостаточности, несмотря на лечение или подозрение на перфорацию; эндоскопическое повреждение классифицировалось согласно классификации Заргара ([ Рис. 1 ]) [ 15]. Все эти переменные были собраны во время оказания неотложной помощи в обеих когортах в соответствии с протоколом сбора данных, разработанным перед началом исследования.
Размер образца
Размер исследования был рассчитан на основании следующих данных: ожидаемая специфичность прогностической оценки составила 86,4%, что на 15% выше, чем оценка Заргара [ 15]; выбранный уровень достоверности составил 95%, а допустимая погрешность - 5%; расчетное соотношение между благоприятным развитием и неблагоприятным исходом составляло 6 (это соотношение было основано на включенных случаях после первых 2 лет набора). Согласно программному обеспечению Epidat (версия 4.2; Служба здравоохранения Галиции [Xunta de Galicia, Испания], PAHO-WHO и Университет CES [Медельин, Колумбия]) ожидались 181 случай хорошего клинического развития и 31 случай плохого результата. Мы также ожидали, что эндоскопия не будет проведена в 15% случаев. Таким образом, потребовалось 213 случаев благоприятного развития и 37 случаев неблагоприятного исхода; когда необходимое количество было достигнуто, набор для деривационной когорты был остановлен и начался набор для валидационной когорты.
статистический анализ
Количественные переменные были представлены в виде среднего и стандартного отклонения для нормально распределенных данных и в виде медианы и межквартильного размаха для ненормально распределенных данных. Колмогоров-Смирнов применялся в качестве критерия нормальности для размера выборки ≥ 50, а критерий Шапиро-Уилка был выбран для меньшей выборки.
Двумерный анализ проводился с качественными переменными с помощью критерия хи-квадрат Йейтса или точного критерия Фишера, когда более 20% ожидаемых значений были ≤ 5; множественные сравнения переменных были скорректированы с использованием метода Холма-Бонферрони. Порядковые переменные анализировались линейно-линейной связью, а количественные переменные сравнивались с использованием t- критерия Стьюдента для независимых выборок или U- критерия Манна-Уитни, если нельзя было предположить нормальное распределение. Для количественных переменных сила ассоциации была рассчитана с помощью простой бинарной логистической регрессии для бинарных результатов и представлена как отношение шансов (OR) с 95% доверительным интервалом (CI).
Двумерный анализ проводился в случаях, принадлежащих к когорте деривации, чтобы определить потенциальные детерминанты плохого прогноза. Переменные, полученные в результате этого первого шага, были рассмотрены для многомерного анализа. Множественная бинарная модель логистической регрессии (тест Вальда, анализ полного случая) была вручную построена с данными из той же деривационной когорты, чтобы определить факторы риска неблагоприятного исхода. Отобранными переменными были те, которые: 1) считались клинически более важными; 2) позволил построить модель, которая наилучшим образом объясняет результат с наименьшим количеством переменных; 3) пониженная мультиколлинеарность. Наличие мультиколлинеарности подозревалось, если коэффициенты корреляции между ковариатами были> 0,7 (порядковые переменные считались непрерывными для этой цели). Множественная линейная регрессия была проведена с различными независимыми переменными для расчета их толерантности и коэффициента инфляции дисперсии. Значения допуска <0,2 и значения коэффициента увеличения дисперсии> 3 считались показательными для возможной мультиколлинеарности.
Модель логистической регрессии оценивалась в соответствии со статистикой согласия (отклонение и тест Хосмера-Лемешоу) и показателями прогнозирующей способности, такими как R-квадрат и площадь под кривой рабочей характеристики приемника (ROC) (AUC).
Предполагалось, что отсутствующие данные возникли случайным образом в зависимости от тяжести проглатывания (например, у бессимптомных пациентов с малым объемом приема слабого едкого вещества могут отсутствовать анализы крови или эндоскопия). Для многофакторного анализа было выполнено множественное вменение в предикторы, которые были зарегистрированы в <95% случаев. Недостающие данные оценивались с помощью логистической регрессии и линейной регрессии для дихотомических и количественных переменных соответственно. Множественное вменение было основано на итеративном методе Монте-Карло цепи Маркова, и правила Рубина использовались для объединения оценок каждого вмененного набора данных в одну общую оценку. Переменными, включенными в модель множественного вменения, были возраст, тип едкого вещества, количество нейтрофилов, pH, степень эндоскопического повреждения и основной результат.
Поскольку основная цель исследования была скорее прогностической, чем объяснительной, количественные значения обрабатывались как непрерывные переменные для двумерного анализа, но для большей применимости они также были дихотомизированы для анализа логистической регрессии. Точки отсечения были выбраны в зависимости от результата анализа кривой ROC, чтобы обеспечить наилучшее сочетание чувствительности и специфичности (индекс Юдена).
В зависимости от значений коэффициента регрессии, полученных в результате анализа логистической регрессии, выполненного с этими категориальными переменными, каждому предиктору присваивался балл для получения окончательного прогностического индекса. Прогностическая модель была проверена дважды: во-первых, внутренняя проверка была выполнена методом повторной выборки (бутстрэппинг, с 2000 выборок) с данными из когорты дериваций. После подтверждения внутренней валидации прогностический индекс применялся в когорте валидации, и прогнозируемые результаты сравнивались с наблюдаемыми для оценки внешней валидации. Точность измерялась чувствительностью, специфичностью, положительной прогностической ценностью (PPV), отрицательной прогностической ценностью (NPV) и анализом AUC. Диагностическая точность только прогностического индекса и эндоскопического поражения (одинаковое эндоскопическое пороговое значение, IIb в пищеводе и III в желудке) сравнивали с помощью теста Макнемара; Сравнение обеих кривых ROC было выполнено с помощью непараметрического теста для родственных выборок. ВсеЗначения P были двусторонними, а глобальный уровень значимости был установлен на уровне P ≤ 0,05. Статистический анализ был выполнен с использованием IBM SPSS Statistics, версия 26.0 (IBM Corp, Армонк, Нью-Йорк, США). Результаты были представлены после заявления TRIPOD [ 17] [ 18 ].
Результаты
В течение периода набора в нашу больницу было оказано лечение 645 эпизодов проглатывания каустика и проведена оценка их соответствия критериям; 469 соответствовали критериям отбора и были включены в исследование, 265 - в когорту деривации и 204 - в когорту валидации ([рис2]). Исходные характеристики пациентов и распределение предикторов и исходов были аналогичными в двух когортах (см. Таблицу 1 в дополнительном материале, доступном только в режиме онлайн).
|
Прогностическая модель с категориальными переменными | ||||
|
β |
ИЛИ |
95% ДИ |
Значение P | |
|
Кислотный каустик |
1,61 |
4,99 |
1,58–15,70 |
0,006 |
|
Количество нейтрофилов ≥ 75% |
1,86 |
6,42 |
1,99 - 20,77 |
0,002 |
|
Бикарбонат <22 мэкв / л |
2,13 |
8,44 |
2,84 - 25,11 |
<0,001 |
|
Травма пищевода ≥ IIb или эндоскопия противопоказана |
1,34 |
3,81 |
1,19 - 12,17 |
0,024 |
|
Травма желудка ≥ III степени или эндоскопия противопоказана |
2,63 |
13,83 |
4,27–44,79 |
<0,001 |
β - коэффициент регрессии; ИЛИ - отношение шансов; ДИ, доверительный интервал.
Неблагоприятный исход
В целом, 61 случай (13,0%, 95% ДИ 10,0-16,0) прогрессировал неблагоприятно за период исследования, 39 (14,7%, 95% ДИ 10,4-19,0) в когорте деривации и 22 в когорте валидации (10,8%, 95%). CI 6.5 - 15.1). В когорте деривации в 38 случаях (14,3%, 95% ДИ 10,1 - 18,6) потребовалась госпитализация в ОИТ, 8 (3,0%, 95% ДИ 0,9-5,1) перенесли операцию и 14 (5,3%, 95% ДИ 2,6-8,0) умер. Обе когорты имели схожие клинические характеристики ( таблица 1 s ).
Предикторы неблагоприятного исхода
Возраст (OR 1,02, 95% CI 1,01 - 1,04) и объем приема пищи (OR 1,01, 95% CI 1,00 - 1,01) постепенно увеличивали риск плохой эволюции, но прием кислоты был самым сильным предиктором неблагоприятного исхода (OR 22,6, 95%). CI 9,6 - 52,9) в одномерном анализе. Добровольный прием, нейтрализация, разбавление и психические расстройства были смешивающими факторами в многомерном анализе. Все демографические и клинические данные сведены в Таблицу 2 s .
|
Точки | |
|
Поступление кислого едкого вещества |
1 |
|
Количество нейтрофилов ≥ 75% |
2 |
|
Бикарбонат ≤ 22 мэкв / л |
2 |
|
Тяжелая эндоскопическая травма | |
|
1 |
|
2 |
|
В случае противопоказаний к эндоскопии добавьте оба пункта. | |
|
≥ 4 баллов - неблагоприятный исход | |
Все симптомы были связаны с более высоким риском осложнений ( Таблица 3 s ). Лейкоцитоз (OR 11,8, 95% ДИ 5,3 - 26,3 для лейкоцитов ≥ 15 × 10 9 / л), нейтрофилия (OR 10,0, 95% ДИ 4,7 - 21,3 для числа нейтрофилов ≥ 10 × 10 9 / л) и метаболический ацидоз (OR 15,5, 95% доверительный интервал 6,8 - 35 для pH <7,35) были аналитическими маркерами серьезности поступления щелочи. Степень метаболического ацидоза зависела от природы и объема проглоченного едкого вещества, а также от тяжести эндоскопического поражения ( рис. 1 с, таблица 4 с ).
Эндоскопия была проведена в 239 случаях в когорте дериваций. В остальных 26 случаях эндоскопия не проводилась из-за отказа пациента (15 пациентов) или противопоказаний (11 случаев). Противопоказание к эндоскопии означало повышенный риск неблагоприятного исхода (OR 17,9, 95% ДИ 4,5–71,1).
Риск осложнений возрастает с увеличением степени эндоскопического повреждения, но не линейно. Порог травмы, увеличивающий риск неблагоприятного исхода, определялся степенью Заргара: IIb для пищевода и III для желудка и двенадцатиперстной кишки ( таблица 5 s ).
Хотя результаты не были значимыми в когорте дериваций, серьезные осложнения также зависели от степени поражения желудка, когда анализ проводился для всей серии (OR для пангастрального и локализованного повреждения составляло 3,4, 95% ДИ 1,7–6,7).
Разработка модели
Кислотность едкого вещества (ОШ 3,13, 95% ДИ 2,33–4,21), количество нейтрофилов (ОШ 1,05, 95% ДИ 1,04–1,06), бикарбонатное число (ОШ 0,82, 95% ДИ 0,78–0,85) и степень эндоскопической травма (ОШ 3,81, 95% ДИ 3,35–4,34) оказалась моделью с лучшей предсказательной способностью ( таблица 6 s ). Для всех этих независимых переменных коэффициенты корреляции были <0,7, значения допуска были> 0,6, а коэффициенты инфляции дисперсии были <1,7 ( таблица 7 s ).
Внутренняя проверка этих переменных была проверена загрузкой с 2000 выборок ( таблица 6 s ); как только их внутренняя валидность была проверена, непрерывные переменные были дихотомизированы, и каждому пункту была присвоена оценка в зависимости от их коэффициента регрессии, чтобы преобразовать модель в прогностический индекс([ Таблица 1 ], [ Таблица 2 ]). В этом результирующем индексе оценки каждого предиктора должны быть добавлены для получения окончательного результата.
Производительность модели
Степень соответствия прогнозной модели оценивалась с помощью отклонения (98,9) и теста Хосмера-Лемешоу (5,69, P = 0,224); его прогностическая способность была измерена с помощью R-квадрата (0,782) и кривой ROC ([ Рис. 3a-c ]), которая определила AUC 0,976 (95% ДИ 0,973–0,979).
В соответствии с индексом Юдена было выбрано отсечение в 4 балла, так что сумма ≥ 4 баллов означает неблагоприятный исход. Это значение обеспечивало чувствительность и специфичность> 92% в когорте дериваций с PPV и NPV 75% и 98,2% соответственно.
Затем диагностическая способность прогностической модели была рассчитана в когорте валидации, где она выполнялась аналогично (чувствительность 95,2% и специфичность 91,7%) с PPV 69% и NPV 99% ( таблица 6 s ).
Диагностическая эффективность этого прогностического показателя была выше, чем у одного эндоскопического повреждения. Сочетание эндоскопических и аналитических данных улучшило выявление случаев неблагоприятного исхода. Принимая во внимание только случаи, в которых выполнялась эндоскопия, для тех же самых конечных точек эндоскопии (IIb в пищеводе или III в желудке) чувствительность, специфичность, PPV и NPV результаты только по эндоскопии составили 89,8%, 90,3%, 56,4% и 98,4%, тогда как диагностическая способность индекса была выше (93,8%, 93,1%, 71,4% и 98,8% соответственно) в этой настройке. В целом точность прогностического индекса (93,1%, 95% ДИ 90,5 - 95,8%) была выше, чем точность только эндоскопии (90,5%, 95% ДИ 87,6 - 93,3%; P = 0,04). AUC оценки, рассчитанной с помощью прогностического индекса (0,976, 95% ДИ 0,96–0,993), также была выше, чем прогноз, основанный исключительно на эндоскопическом повреждении (0,897, 95% ДИ 0,85–0,944) ( P <0,001) ([ рис 3г]). В случаях противопоказаний к эндоскопии прогностический индекс выявлял все случаи плохой эволюции (чувствительность 100%).
Обсуждение
Эти результаты показывают, что прогнозирование исхода эпизода проглатывания едкого вещества с помощью простых параметров возможно и безопасно, и что добавление аналитических данных и химической природы едкого вещества к прогностической оценке улучшает традиционный подход, основанный на эндоскопии.
Одним из ограничений исследования является небольшое количество случаев неблагоприятного исхода, несмотря на длительный период набора. Это ограничение является неотъемлемой частью критериев отбора, поскольку все пациенты с проглатыванием каустика были последовательно включены без каких-либо ограничений в зависимости от тяжести проглатывания; это состояние снизило распространенность осложнений до 13%, что ниже, чем в большинстве опубликованных серий. Тем не менее, такой скорости плохой эволюции достаточно для обеспечения соотношения 10 случаев на предсказатель, а также может лучше отражать серьезность проглатывания каустика, возможно, даже повышая применимость прогностической оценки.
Несмотря на перспективный дизайн, появления недостающих данных избежать не удалось, в основном потому, что были включены пациенты из других центров нашей области здравоохранения, а также потому, что в более легких случаях не были выполнены все запланированные дополнительные тесты. Чтобы предотвратить любую систематическую ошибку при полном анализе случая, было выполнено множественное вменение с учетом этого последнего условия, что минимизировало потенциальное влияние пропущенных значений в прогностической модели [ 17 ] [ 18 ].
Прогностическая точность оценки в валидационной когорте была аналогична производительности в деривационной когорте. Хотя проглоченный объем был немного ниже, а добровольное потребление было менее частым в когорте валидации, эти различия не означали более низкую клиническую тяжесть, поэтому обе когорты можно считать сопоставимыми. Хотя внешняя проверка подтверждает прогностическую способность модели, исследование проводилось среди западных жителей. Азиатские серии имеют более высокую долю попадания кислой щелочи в организм из-за большей доступности [ 15 ] [ 19 ] [ 20 ] [ 21 ]]. Прежде чем применять этот прогностический индекс в популяции Востока, было бы целесообразно проверить его эффективность в популяции, в которой преобладает употребление кислоты.
Высокая точность модели, возможно, связана с сочетанием эндоскопического повреждения и других маркеров, таких как химическая природа едкого вещества, воспалительная реакция, вызванная повреждением (лейкоцитоз), или степень трансмурального поражения (ацидоз). По сути, модель дополняет информацию, предоставляемую поражением слизистой оболочки, его трансмуральным и системным вовлечением, облегчая определение того, какие поражения с тяжелым поражением слизистой оболочки влекут за собой худшее прогрессирование.
В соответствии с этой идеей, некоторые исследования показали, что поражение самых глубоких слоев пищеварительного тракта является маркером тяжести. Хотя глубокие поражения, обнаруженные эндоскопическим ультразвуком, были связаны с худшим прогнозом, этот результат был более устойчивым в долгосрочной перспективе для прогнозирования стеноза, чем немедленных осложнений [ 22 ] [ 23 ]. Тем не менее, радиологический трансмуральный некроз, подтвержденный компьютерной томографией (КТ), более четко ассоциировался с ухудшением развития в остром периоде и с более высокими показателями хирургического вмешательства [ 24 ] [ 25 ].]. Согласно нашей оценке, интеграция оценки слизистой оболочки с аналитическим выражением трансмурального поражения улучшает возможность выявления случаев с худшим развитием и преодолевает ограничения оценки, основанной только на эндоскопии. Поскольку лейкоцитоз и ацидоз очень эффективны для выявления тяжелых случаев, мы рекомендуем выполнять эти анализы при подозрении на клинические осложнения (нарушение клинического статуса, поражение дыхательных путей или тяжелое эндоскопическое повреждение).
В нескольких исследованиях оценивали факторы, предрасполагающие к плохой эволюции после повреждения едкой [ 26 ] [ 27 ] [ 28 ], влияние симптомов на прогноз [ 1 ] [ 2 ] [ 3 ] [ 4 ] [ 5 ] [ 6 ] [ 7 ]]. [ 8 ] [ 9 ] [ 10 ] [ 11 ] [ 14 ] [ 29 ], а также прогностическая способность эндоскопии [ 2 ] [ 23 ]] [ 30 ] [ 31 ] [ 32 ] [ 33 ] [ 34 ]. Однако некоторые из этих исследований содержат методологические ограничения из-за их ретроспективного дизайна, возможных ошибок отбора (некоторые исследования включали только госпитализированных пациентов или тех, кто прошел эндоскопию), а также того факта, что большинство их результатов не были подтверждены.
Еще одно преимущество шкалы состоит в том, что она позволяет количественно оценить бремя противопоказаний к эндоскопии; Насколько нам известно, этот вопрос ранее не исследовался, но тем не менее он улучшает производительность и полезность прогнозирования.
Некоторые авторы предложили КТ в качестве первого обследования, которое следует проводить после приема щелочи [ 35 ]; однако данные основаны на серии с вероятной ошибкой отбора, с большим количеством тяжелых проглатываний и критических пациентов, которые в конце концов перенесли операцию (20%). Эта стратегия не кажется подходящей в качестве систематического метода в реальных популяциях с более низкой распространенностью хирургических вмешательств (3,2%), в которых PPV CT снижается. В этом случае наша оценка может быть полезна для выявления пациентов с плохим прогнозом, которым будет полезна компьютерная томография.
Эта оценка проста и может быть легко применена с ограниченными данными; кроме того, он повышает точность по сравнению с одной только эндоскопией и может выполняться даже в случае противопоказаний к эндоскопии. Его основная полезность заключается в раннем и надежном прогнозе течения эпизода. Тем не менее, учитывая неоднородную эволюцию проглатывания каустика, необходимы дополнительные прогностические индикаторы, чтобы выбрать лучший подход в каждом случае и установить научно обоснованное управление заглатыванием каустика..
Список литературы:
1 Zargar SA, Kochhar R, Nagi B. et al. Ingestion of corrosive acids. Gastroenterology 1989; 97: 702-707
2 Zargar SA, Kochhar R, Nagi B. et al. Ingestion of strong corrosive alkalis: spectrum of injury to upper gastrointestinal tract and natural history. Am J Gastroenterol 1992; 87: 337-341
3 Gupta SK, Croffie JM, Fitzgerald JF. Is esophagogastroduodenoscopy necessary in all caustic ingestions?. J Pediatr Gastroenterol Nutr 2001; 32: 50-53
4 Gaudreault P, Parent M, Mcguigan MA. et al. Predictability of esophageal injury from signs and symptoms: a study of caustic ingestion in 378 children. Pediatrics 1983; 71: 767-770
5 Crain EF, Gershel JC, Mezey AP. Caustic ingestions: symptoms as predictors of esophageal injury. Am J Dis Child 1984; 138: 863-865
6 Previtera C, Giusti F, Guglielmi M. Predictive value of visible lesions (cheeks, lips, oropharynx) in suspected caustic ingestion: may endoscopy reasonably be omitted in completely negative pediatric patients?. Pediatr Emerg Care 1990; 6: 176-178
7 Gorman RL, Khin-Maung-Gyi MT, Klein-Schwartz W. et al. Initial symptoms as predictors of esophageal injury in alkaline corrosive ingestions. Am J Emerg Med 1992; 10: 189-194
8 De Jong AL, Macdonald R, Ein S. et al. Corrosive esophagitis in children: a 30-year review. Int J Pediatr Otorhinolaryngol 2001; 57: 203-211
9 Rigau J, Padrós J, Giménez-Roca A. et al. [Digestive lesions resulting from ingestion of caustic substances] [Article in Spanish]. Gastroenterol Hepatol 2001; 24: 319
10 Tseng Y-LL, Wu M-HH, Lin M-YY. et al. Outcome of acid ingestion related aspiration pneumonia. Eur J Cardiothoracic Surg 2002; 21: 638-643
11 Núñez Ó, González-Asanza C, de la Cruz G. et al. [Study of predictive factors of severe digestive lesions due to caustics ingestions] [Article in Spanish]. Med Clin (Barc) 2004; 123: 611-614
12 Havanond C, Havanond P. Initial signs and symptoms as prognostic indicators of severe gastrointestinal tract injury due to corrosive ingestion. J Emerg Med 2007; 33: 349-353
13 Prieto P, Martín D, Grande A. et al. Caustic ingestion: a review of cases of a third level hospital [Article in Spanish]. Bol Pediatr 2007; 47: 55-61
14 Betalli P, Falchetti D, Giuliani S. et al. Caustic ingestion in children: is endoscopy always indicated? The results of an Italian multicenter observational study. Gastrointest Endosc 2008; 68: 434-439
15 Zargar SA, Kochhar R, Mehta S. et al. The role of fiberoptic endoscopy in the management of corrosive ingestion and modified endoscopic classification of burns. Gastrointest Endosc 1991; 37: 165-169
16 Tosca J. Caustic ingestion in adults: clinical outcome and determinant factors [Article in Spanish, Doctoral thesis]. Universitat de València; 2010
17 Moons KGM, Altman DG, Reitsma JB. et al. Transparent reporting of a multivariable prediction model for individual prognosis or diagnosis (TRIPOD): explanation and elaboration. Ann Intern Med 2015; 162: W1-W73
18 Collins GS, Reitsma JB, Altman DG. et al. Transparent reporting of a multivariable prediction model for individual prognosis or diagnosis (TRIPOD): the TRIPOD statement. Eur Urol 2015; 67: 1142-1151
19 Ryu HH, Jeung KW, Lee BK. et al. Caustic injury: can CT grading system enable prediction of esophageal stricture?. Clin Toxicol 2010; 48: 137-142
20 Chang J-M, Liu N-J, Pai BC-J. et al. The role of age in predicting the outcome of caustic ingestion in adults: a retrospective analysis. BMC Gastroenterol 2011; 11: 72
21 Cheng Y-J, Kao E-L. Arterial blood gas analysis in acute caustic ingestion injuries. Surg Today 2003; 33: 483-485
22 Kamijo Y, Kondo I, Kokuto M. et al. Miniprobe ultrasonography for determining prognosis in corrosive esophagitis. Am J Gastroenterol 2004; 99: 851-854
23 Chiu HM, Lin JT, Huang SP. et al. Prediction of bleeding and stricture formation after corrosive ingestion by EUS concurrent with upper endoscopy. Gastrointest Endosc 2004; 60: 827-833
24 Chirica M, Resche-Rigon M, Pariente B. et al. Computed tomography evaluation of high-grade esophageal necrosis after corrosive ingestion to avoid unnecessary esophagectomy. Surg Endosc Other Interv Tech 2015; 29: 1452-1461
25 Chirica M, Resche-Rigon M, Zagdanski AM. et al. Computed tomography evaluation of esophagogastric necrosis after caustic ingestion. Ann Surg 2016; 264: 107-113
26 Mamede RC, de Mello Filho FV. Ingestion of caustic substances and its complications. Sao Paulo Med J 2001; 119: 10-15
27 Chang J-MM, Wu M-HH, Lai W-WW. et al. Acid corrosive injury in patients with a history of partial gastrectomy: outcome analysis. Dig Surg 2007; 24: 202-207
28 Hollenbach M, Tünnemann J, Struck M. et al. Endoscopic findings and outcome in caustic ingestion of acid and alkaline agents in adults. Endoscopy 2018; 50: S157
29 Santos S, Borges V, Simões G. et al. Caustic ingestion: predictors of clinical and endoscopic severity. Endoscopy 2019; 51: S170
30 García Díaz E, Castro Fernández M, Romero Gómez M. et al. Upper gastrointestinal tract injury caused by ingestion of caustic substances [Article in Spanish]. Gastroenterol Hepatol 2001; 24: 191-195
31 Rigo GP, Camellini L, Azzolini F. et al. What is the utility of selected clinical and endoscopic parameters in predicting the risk of death after caustic ingestion?. Endoscopy 2002; 34: 304-310
32 Poley J-W, Steyerberg EW, Kuipers EJ. et al. Ingestion of acid and alkaline agents: outcome and prognostic value of early upper endoscopy. Gastrointest Endosc 2004; 60: 372-377
33 Cheng H-T, Cheng C-L, Lin C-H. et al. Caustic ingestion in adults: the role of endoscopic classification in predicting outcome. BMC Gastroenterol 2008; 8: 31
34 Arévalo-Silva C, Eliashar R, Wohlgelernter J. et al. Ingestion of caustic substances: a 15-year experience. Laryngoscope 2006; 116: 1422-1426
35 Chirica M, Bonavina L, Kelly MD. et al. Caustic ingestion. Lancet 2016; 389: 2041-2052
Рекомендуемые статьи
Эластография при эндосонографии (ЭУС или эндоУЗИ)
Эластография (эластосонография) – метод виртуальной пальпации (технология улучшенной визуализации при ЭУС диагностике), позволяющий дифференцировать злокачественные и доброкачественные поражения лимфоузлов. Основана на принципе, что более мягкие ткани при сжатии легче деформируются, это позволяет объективно оценить консистенцию ткани, показать различия в плотности между нормальными и патологически измененными тканями.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.

.jpg)





.png)

.jpg)
















Комментарии