- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Документы и приказы: Болезнь Крона. Дети. Клинические рекомендации 2024 -2026
Полный текст статьи:
Министерство
Здравоохранения
Российской Федерации
Клинические рекомендации Болезнь Крона
Год утверждения (частота пересмотра): 2024
Пересмотр не позднее: 2026
ID: 682_2
Возрастная категория: Дети
Разработчик клинической рекомендации
Союз педиатров России, Общероссийская общественная организация "Российская ассоциация детских хирургов", Автономная некоммерческая организация "Общество детских гастроэнтерологов, гепатологов и нутрициологов"
Одобрено Научно-практическим Советом Минздрава России
Оглавление
· Список сокращений
· Термины и определения
· 1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
· 1.1 Определение заболевания или состояния (группы заболеваний или состояний)
· 1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
· 1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
· 1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
· 1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
· 1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
· 2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
· 2.1 Жалобы и анамнез
· 2.2 Физикальное обследование
· 2.3 Лабораторные диагностические исследования
· 2.4 Инструментальные диагностические исследования
· 2.5 Иные диагностические исследования
· 3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
· 4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
· 5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
· 6. Организация оказания медицинской помощи
· 7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
· Критерии оценки качества медицинской помощи
· Список литературы
· Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
· Приложение А2. Методология разработки клинических рекомендаций
· Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
· Приложение Б. Алгоритмы действий врача
· Приложение В. Информация для пациента
· Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Список сокращений
МП – меркаптопурин**
АЗА – азатиоприн**
БК – болезнь Крона
ГКС – глюкокортикоиды
ЖКТ – желудочно-кишечный тракт
ИФМ – #инфликсимаб**
КТ – компьютерная томография
МР – энтерография – магнитно-резонансная энтерография
МРТ – магнитно-резонансная томография
МТ – метотрексат**
НПВП – нестероидные противовоспалительные и противоревматические препараты
«Печеночные» ферменты - определение активности аланинаминторансферазы (АЛТ), аспартатаминотрансферазы (АСТ), гамма-глютамилтрансферазы (ГГТ), щелочной фосфатазы в крови
ПКВ13 – вакцина для профилактики пневмококковой инфекции полисахаридная, конъюгированная, адсорбированная** и вакцина для профилактики пневмококковых инфекций**(конъюгированная) (13-валентные)
ППВ23 – вакцина для профилактики пневмококковых инфекций**(полисахаридная, 23-валентная)
ПСХ – первичный склерозирующий холангит
ПЭП – полное энтеральное питание
РКИ – рандомизированное контролируемое исследование
СОЭ – скорость оседания эритроцитов
СРБ – С-реактивный белок
Тиопурины – (L04AX) Другие иммунодепрессанты / (L01BB) Аналоги пурина
УЗИ – ультразвуковое исследование
ЯК – язвенный колит
PCDAI – педиатрический индекс активности болезни Крона
Термины и определения
Болезнь Крона (БК) – хроническое, рецидивирующее мультисистемное заболевание неясной этиологии, с преимущественным поражением желудочно-кишечного тракта на всем его протяжении, характеризующееся фокальным, асимметричным, трансмуральным, сегментарным, гранулематозным воспалением, стенки тонкой и/или толстой кишки или всего желудочно-кишечного тракта, сопровождающееся кишечными и внекишечными осложнениями. воспалением. Устаревшее наименование – регионарный энтерит.
Обострение (рецидив, атака) БК – это появление типичных симптомов заболевания впервые или у больных БК в стадии клинической ремиссии, спонтанной или медикаментозно поддерживаемой.
Ремиссия БК – исчезновение типичных проявлений заболевания.
Ремиссия БК, клиническая – отсутствие симптомов БК (соответствует значению Педиатрического Индекса активности БК (PCDAI) <10 [1].
Ремиссия БК, эндоскопическая – отсутствие видимых макроскопических признаков воспаления при эндоскопическом исследовании [1], соответствующие значению упрощенного эндоскопического индекса тяжести БК (SES CD) <= 3
Немедицинское переключение (НМП) – изменение проводимой пациенту терапии на альтернативную по причинам, не связанным с клинической неэффективностью, возникновением нежелательных побочных реакций (НПР) или непереносимостью терапии пациентом [2, 3].
1. Краткая информация
1.1 Определение заболевания или состояния
Болезнь Крона (БК) - хроническое, рецидивирующее заболевание желудочно-кишечного тракта неясной этиологии, характеризующееся трансмуральным, сегментарным, воспалением стенки тонкой и/или толстой кишки или всего желудочно-кишечного тракта с развитием местных и системных осложнений.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Этиология воспалительных заболеваний кишечника (ВЗК), в том числе БК, точно не установлена: заболевание развивается в результате сочетания нескольких факторов, включающих генетическую предрасположенность, дефекты врожденного и приобретенного иммунитета, изменение кишечной микробиоты и различные факторы окружающей среды.
Обнаружено более 100 генов, предрасполагающих к ВЗК, большинство из которых контролирует взаимодействие иммунной системы с внешними антигенами, среди них при БК с большей частотой встречаются мутации NOD2, IL23R, ATG16L1, IRGM, NKX2-3, 1q24, 5p13, HERC2, CCNY, 10q21. Более 50% генов, определяющих предрасположенность к ВЗК, ассоциированы и с другими воспалительными и аутоиммунными заболеваниями, что может объяснить развитие внекишечных проявлений ВЗК [4]. При этом каких-либо специфических генетических особенностей, свойственных детям, обнаружено не было, за исключением группы детей раннего возраста.
Изменения кишечной микробиоты выявлены у всех больных БК, они характеризуются уменьшением видового разнообразия, уменьшением числа толерогенных видов (например, Faecalibacterium prausnitzii, Bacteroides thetaiotaomicron), увеличением жгутиковых бактерий, изменением вирома, усилением проницаемости слоя слизи и количества микробов, пенетрирующих слизистый слой [5].
Хроническое воспаление при ВЗК является следствием аномальной и пролонгированной активации иммунной системы кишечника. Многочисленные исследования продемонстрировали, что нарушения имеют место практически во всех звеньях иммунного ответа [6], начиная от барьерных функций эпителия и распознавания антигена паттерн-распознающими рецепторами, передачи сигнала дендритными клетками и сигнальными молекулами, презентации антигена HLA, и заканчивая эффекторными функциями моноцитов-макрофагов, Т- и В-лимфоцитов. Образование инфламмасом, активация каспазы-1 и секреции провоспалительных цитокинов: IL-1, IL-17, IL-23, IL-6, TNF-a обусловливают кишечное воспаление с развитием массивной глубокой воспалительной инфильтрации кишечника. Младенческие формы ВЗК могут быть обусловлены нарушением формирования иммунологической толерантности к собственной микробиоте кишечника вследствие мутации отдельных генов, например, IL-10, FOXP3, XIAP и др [7].
Каскад гуморальных и клеточных реакций при БК приводит к трансмуральному воспалению кишечной стенки с образованием характерных для БК саркоидных гранулем, состоящих из эпителиоидных гистиоцитов без очагов некроза и гигантских клеток.
При БК могут поражаться любые отделы желудочно-кишечного тракта - от полости рта до ануса. Тем не менее, в подавляющем большинстве случаев у детей доминирует поражение илеоцекального отдела (70%), изолированное поражение толстой кишки встречается в 30%, аноректальной области – у 20%, поражение верхних отделов ЖКТ – у 5-15% [8].
1.3 Эпидемиология заболевания или состояния
Во всем мире наблюдается рост частоты воспалительных заболеваний кишечника (ВЗК) у детей, в частности - болезни Крона (БК), заболеваемость которой варьирует от 1,5 до 11,4 на 100000 [9,10], при этом расчетное значение распространенности БК составляет 58/100000. Точных данных о распространенности БК у детей в России нет, но отдельные региональные наблюдения указывают на аналогичную тенденцию. Так, в Санкт-Петербурге заболеваемость БК возросла за последние 10 лет более чем в 10 раз и составила 5,5 на 100000, а распространенность – 20 на 100000 детей и подростков [8]. Примерно у 10% больных БК впервые манифестирует в возрасте до 17 лет, за последние 10 лет ВЗК с началом в детском возрасте возросли в 3 раза [11].
1.4 Особенности кодирования заболевания или состояния
К 50 Болезнь Крона [регионарный энтерит]
K50.0 Болезнь Кронa тонкой кишки
K50.1 Болезнь Кронa толстой кишки
K50.8 Другие рaзновидности болезни Кронa
K50.9 Болезнь Кронa неуточненнaя
K52.3 Неопределенный колит
K52.9 Неинфекционный гастроэнтерит и колит неуточненный
1.5 Классификация заболевания или состояния
Для классификации БК по локализации поражения и фенотипическим вариантам течения рекомендуется использовать, применительно к детям, международную классификацию болезни Крона, принятую в 2010 г. в Париже (табл.1).
Таблица 1. Классификация Болезни Крона
|
Критерий |
Градации |
Сочетания |
|
Возраст начала болезни1 |
А1а – 0 - < 10 лет А1b – 10 - < 17 лет А2 – 17 – 40 лет А3 - > 40 лет |
|
|
Локализация |
L1 - Терминальный илеит L2 - Изолированный колит – L3 - Илеит и колит L4a - Верхние отделы с поражением до связки Трейца L4b – Верхние отделы с поражением ниже связки Трейца, но выше дистальной 1/3 подвздошной кишки |
L1+L4 L2+L4 L3+L4 L4ab |
|
Форма |
В1 - нестриктурирующая и непенетрирующая (воспалительная) В2 - стриктурирующая В3 – пенетрирующая В2В3 - стриктурирующая и пенетрирующая р – перианальные проявления |
B2B3 – сочетание стеноза и пенетрации Сочетание с перианальным поражением В1р, В2р, В3р |
|
Рост |
Go – нет задержки роста, G1 – задержка роста |
|
Сейчас выделяют также ВЗК с очень ранним началом (ОРН ВЗК) – до 6 лет, а также младенческие ВЗК – с началом в первые 2 года жизни [8].
По характеру течения выделяют:
1. Острое течение (менее 6 месяцев от дебюта заболевания);
2. Хроническое непрерывное течение (отсутствие более чем 6-месячных периодов ремиссии на фоне адекватной терапии);
3. Хроническое рецидивирующее течение (наличие более чем 6-месячных периодов ремиссии).
В зависимости от ответа на гормональную терапию и облегчения выбора рациональной лечебной тактики, поскольку целью консервативного лечения является достижение стойкой ремиссии с прекращением терапии ГКС выделяются:
· стероидорезистентность (сохранение активности заболевания несмотря на пероральный прием адекватной дозы ГКС в течение 7-14 дней);
· стероидозависимость (определяется при достижении клинической ремиссии на фоне терапии глюкокортикоидами и возобновлении симптомов при снижении дозы или в течение 3 месяцев после полной отмены, а также в случаях, если терапию глюкокортикоидами не удается прекратить в течение 14-16 недель).
Также определяется педиатрический индекс активности болезни Крона (для определения клинической активности атаки БК) (приложение Г1) [10].
1.6 Клиническая картина заболевания или состояния
В детском возрасте ВЗК характеризуются более агрессивным течением, чем у взрослых, процесс имеет более распространенный характер, склонен к прогрессирующему нарастанию тяжести, заболевание сопряжено с более вероятным развитием осложнений и требует более интенсивной терапии, в частности, назначения глюкокортикоидов, тиопуринов, #метотрексата** и ингибиторов фактора некроза опухоли альфа (ФНО-альфа) (антицитокиновых препаратов) [12,13]. Вероятность осложнений, требующих хирургического вмешательства, также более высока у пациентов с дебютом БК в детском возрасте. К 30 годам риск резекции части кишки составляет у них 48 ± 5% в сравнении с 14 ± 2% заболевших взрослыми [14].
Клиническая картина на ранних этапах развития БК может быть стертой, симптоматика неспецифичной, что затрудняет своевременную диагностику. Иногда БК протекает латентно, проявляясь лишь задержкой физического развития ребенка, иногда первыми симптомами могут быть осложнения или внекишечные проявления (ВКП).
К осложнениям БК относят: наружные свищи (кишечно-кожные), внутренние свищи (межкишечные, кишечно-пузырные, ректо-вагинальные), инфильтрат брюшной полости, межкишечные или интраабдоминальные абсцессы, стриктуры ЖКТ (с нарушением кишечной проходимости и без таковой), анальные трещины, парапроктит (при аноректальном поражении), кишечное кровотечение (редко).
Более 40% детей имеют внекишечные проявления болезни [10] (табл.2). Вероятность развития ВКП повышается с нарастанием длительности БК, они чаще встречаются при толстокишечной форме БК, ассоциированные с активностью заболевания ВКП нередко сочетаются друг с другом. Принципиально при ВЗК возможны поражения любых органов, но наиболее часто встречаются поражения суставов, печени, глаз и кожи [8].
Таблица 2 – Внекишечные проявления болезни Крона
|
Аутоиммунные, связанные с активностью заболевания |
Аутоиммунные, не связанные с активностью заболевания |
Обусловленные длительным воспалением и метаболическими нарушениями |
|
Периферическая артропатия 1-го типа (олигомоноартрит) Поражение кожи (узловатая эритема, гангренозная пиодермия, синдром Свита) Поражение слизистых (афтозный стоматит) Поражение глаз (увеит, ирит, иридоциклит, эписклерит) |
Периферическая артропатия 2-го типа (полиартрит) Анкилозирующий спондилит (сакроилеит) Первичный склерозирующий холангит (редко) Остеопороз, остеомаляция Псориаз
|
Холелитиаз Стеатоз печени, стеатогепатит Тромбоз периферических вен, тромбоэмболия легочной артерии Амилоидоз
|
Аутоиммунные проявления, связанные с активностью воспалительного процесса, появляются вместе с основными кишечными симптомами обострения и исчезают вместе с ними на фоне лечения. Аутоиммунные проявления, не связанные с активностью процесса (сопутствующими аутоиммунными заболеваниями), имеют тенденцию к прогрессированию независимо от фазы основного заболевания (обострение или ремиссия) и часто определяют неблагоприятный прогноз болезни.
Своевременная и точная диагностика, адекватная терапия способны изменить естественное течение БК, при этом выбор терапии должен соответствовать локализации процесса, его активности, учитывать индивидуальные особенности пациента, в частности, возраст и имеющиеся факторы риска.
2. Диагностика
Однозначных диагностических критериев БК не существует, диагноз устанавливается на основании сочетания данных анамнеза, клинической картины и типичных эндоскопических и патолого-анатомических (гистологических) изменений [15,16].
В практике возможно ориентироваться на критерии диагностики болезни Крона по Lennrd-Johns включающими определение семи основных признаков заболевания:
1. Поражение любого отдела ЖКТ от полости рта до анального канала: хроническое гранулематозноепоражение слизистой оболочки губ или щек; пилородуоденальное поражение, поражение тонкой кишки, хроническое перианальное поражение
2. Прерывистый характер поражения ЖКТ
3. Трансмуральный характер поражения: афтозные язвы, язвы-трещины, абсцессы, свищи
4. Фиброз: стриктуры
5. Лимфоидное: трансмуральное воспаление, лимфоидные скопления
6. Муцин: нормальное содержание муцина в зоне
7. активного воспаления слизистой оболочки толстой кишки
8. Обнаружение неказеозной гранулемы
Диагноз БК достоверен: 3 признака или 1 любого признака+гранулема
Также выделяют фенотипы ВЗК в зависимости от частоты и вероятный диагноз в зависимости от первоначального фенотипа (у нелеченного ребенка) [8,17] (табл.3)
Таблица 3.Фенотипы ВЗК в зависимости от частоты и вероятный диагноз в зависимости от первоначального фенотипа (у нелеченного ребенка)

Для верификации периода заболевания (обострение или ремиссия), оценки тяжести обострения, а также для динамической оценки эффективности лечения больного следует использовать расчет Педиатрического индекса активности болезни Крона (PCDAI) (Приложение Г1) [10].
2.1 Жалобы и анамнез
К наиболее частым клиническим симптомам БК у детей относятся [10]:
· длительная хроническая диарея (более 6 нед), чаще без примеси крови;
· боль в животе упорного характера с четкой локализацией;
· потеря массы, значительный дефицит массы тела, отставание в росте;
· длительная лихорадка неясного генеза;
· анемия, чаще железодефицитная и/или анемия хронического воспаления;
· перианальные осложнения (хронические анальные трещины, парапроктит, свищи прямой кишки).
У пациентов с БК с поражением верхних отделов ЖКТ могут наблюдаться и другие гастроэнтерологические жалобы. Так, при поражении пищевода отмечаются жалобы на боли в грудной клетке, изжогу и срыгивание (напоминающие таковые при гастроэзофагеальной рефлюксной болезни), в более тяжелых случаях – на дисфагию и одинофагию, рвоту и потерю массы тела. При БК с поражением желудка и двенадцатиперстной кишки больные могут предъявлять жалобы на боли, тяжесть и переполнение в эпигастральной области, тошноту, снижение аппетита [1,15].
При сборе анамнеза стоит обратить внимание на информацию о поездках в южные страны, непереносимости пищевых продуктов, приеме лекарственных препаратов (включая антибактериальные препараты системного действия и нестероидные противовоспалительные и противоревматические препараты (НПВП)), курении и семейном анамнезе в отношении ВЗК и других аутоиммунных заболеваний.
2.2 Физикальное обследование
В объективное обследование ребенка следует включать оценку физического и полового развития, полный осмотр, включая осмотр перианальной области. При осмотре могут быть обнаружены различные проявления болезни, включая дефицит массы тела, отставание в росте и половом развитии, афты слизистой рта, наличие инфильтрата брюшной полости, наружных кишечных свищей, перианальных изменений (трещин, свищей), а также внекишечных проявлений.
2.3 Лабораторные исследования
· Рекомендовано при подозрении на БК (см. раздел 2.1 «Жалобы и анамнез») провести исследование уровня кальпротектина в кале (определение кальпротектина в кале) как показателя активности воспаления в кишечнике с целью диагностики БК. [18,19,20].
(УУР – А УДД - 1).
Комментарии: Уровень фекального кальпротектина значительно выше при толстокишечном воспалении.
При повышении уровня фекального кальпротектина более чем в 5 раз (250 мг/г либо выше, в зависимости от возраста) ребенок должен быть направлен в гастроэнтерологическое отделение для углубленного обследования (следует учесть, что у детей раннего возраста уровень кальпротектина всегда повышен и может в норме составлять до 2000мкг/г) [21,22].
Детям с установленным диагнозом БК – контроль уровня фекального кальпротектина – в среднем, 1 раз в год с целью контроля воспалительной реакции кишечника и своевременной коррекции терапии либо при обострении. Фекальный кальпротектин является чувствительным маркером воспаления, применяется также в качестве способа мониторинга активности заболевания. Для повышения чувствительности фекального кальпротектина в мониторинге активности заболевания, рекомендовано также дополнительно определение СРБ и клинического индекса активности БК. PCDAI [10].
· Рекомендовано всем пациентам при подозрении на БК и далее – при динамическом наблюдении исследовать Общий (клинический) анализ крови развернутый (оценка гематокрита, Исследование уровня эритроцитов в крови, Исследование уровня тромбоцитов в крови, Исследование уровня лейкоцитов в крови, Дифференцированный подсчет лейкоцитов (лейкоцитарная формула), Просмотр мазка крови для анализа аномалий морфологии эритроцитов, тромбоцитов и лейкоцитов, Определение размеров эритроцитов, скорость оседания эритроцитов (СОЭ)) с целью выявления анемии и признаков воспалительной реакции, С-реактивный белок – для оценки воспалительной реакции. [19,20,23].
(УУР – С УДД -3).
Комментарии: Доказательных данных по необходимой частоте проведения этих лабораторных исследований нет. Следует контролировать показатели общего (клинического) анализа крови развернутого и С-реактивного белка, в среднем не реже 1-2 раза в годпри ремиссии заболевания, при необходимости (дебют, обострение) контроль показателей м.б. чаще (при госпитализации – обязательно) и определяется тяжестью состояния пациента.
Общий (клинический) анализ крови развернутый контролируется у пациентов, получающих определенные виды иммуносупрессивной терапии (Тиопурины или #метотрексат**), не реже одного раза в 1-3 месяца (Приложение А3.1).
Изменения в лабораторных данных при БК имеют неспецифический характер. В общем анализе крови могут быть обнаружены анемия (чаще железодефицитная или анемии хронического заболевания, реже В-12- или фолиеводефицитная), лейкоцитоз (на фоне хронического воспаления, при наличии абсцесса или на фоне стероидной терапии), увеличение СОЭ.
· Детям с подозрением на БК рекомендовано проведение анализа крови биохимического общетерапевтического (общий белок, определение альбумин/глобулинового соотношения в крови, печеночные ферменты (определение активности аланинаминторансферазы (АЛТ), аспартатаминотрансферазы (АСТ), гамма-глютамилтрансферазы (ГГТ), щелочной фосфатазы в крови), электролиты (натрий, калий, магний, хлор), уровень железа сыворотки крови, трансферрин, ферритин, уровень общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови уровня глюкозы в крови, Исследование уровня креатинина в крови, Исследование уровня мочевины в крови с целью оценки воспаления, функции печени, почек, обмена железа, электролитного баланса [19,20, 24].
(УУР-С; УДД-5)
Комментарий: биохимическое исследование крови позволяет выявить диспротеинемию (в частности, гипоальбуминемию и повышение a2- и γ-глобулинов).
При поражении печени может быть повышен уровень АЛТ, АСТ, ГГТ, общего билирубина, прямой фракции билирубина при холестатическом поражении печени.
В дальнейшем при динамическом наблюдении следует контролировать параметры анализа крови биохимического общетерапевтического. Частота и выбор параметров устанавливается индивидуально, в зависимости от фазы заболевания, тяжести течения и клинических проявлений. В динамике, в среднем, исследования могут проводиться 1-2 раза в год. Пациентам, получающим тиопурины или #метотрексат**, исследуются АЛТ, АСТ, ГГТ в среднем не реже 1 раза в 1-3 месяца (Приложение А3.1).
· Рекомендовано пациентам с признаками БК проведение общего (клинического) анализа мочи с целью своевременной скрининговой диагностики изменений со стороны почек [24, 26].
(УУР-С; УДД-4)
Комментарии: общий (клинический) анализ мочи следует проводить при диагностике и в динамическом наблюдении.
· Рекомендовано пациентам с подозрением на БК при первичной диагностике в сомнительных случаях с целью диференциальной диагностики проведение Микроскопического исследования кала на яйца и личинки гельминтов/Микроскопического исследования кала на гельминты с применением методов обогащения и/или Микроскопического исследования кала на простейшие /Микроскопического исследование кала на простейшие с применением методов обогащения (Strongyloides, Trichuris trichiura (власоглав)), (Amoeba (по эпид. показаниям)). [8].
(УУР-С; УДД-5)
Комментарии: исследования могут проводиться и в процессе динамического наблюдения при подозрении на глистные инвазии.
· Рекомендовано при остром начале диареи выполнить исследование кала для исключения острой кишечной инфекции, исследование токсинов А и В Clostridioides difficile (устаревшее наименование - Clostridium difficile) (Определение токсинов возбудителя диффициального клостридиоза (Clostridium difficile) в образцах фекалий, Исследование кала на наличие токсина клостридии диффициле (Clostridium difficile), Иммунохроматографическое экспресс-исследование кала на токсины А и В клостридии (Clostridium difficile)) или Определение ДНК возбудителя диффициального клостридиоза (Clostridium difficile) в образцах фекалий методом ПЦР (при недавно проведенном курсе антибиотикотерапии или пребывании в стационаре для исключения псевдомембранозного колита) [8,20].
(УУР-С; УДД-5)
Комментарий: При подозрении на кишечные инфекции проводятся соответствующие тесты на выявление Salmonella, Shigella, Yersinia, Campylobacter (например: Микробиологическое (культуральное) исследование фекалий/ректального мазка на микроорганизмы рода сальмонелла (Salmonella spp.), Микробиологическое (культуральное) исследование фекалий/ректального мазка на возбудителя дизентерии (Shigella spp.), Микробиологическое (культуральное) исследование фекалий/ректального мазка на иерсинии (Yersinia spp.), Микробиологическое (культуральное) исследование фекалий/ректального мазка на возбудитель иерсиниоза (Yersinia enterocolitica), Микробиологическое (культуральное) исследование фекалий/ректального мазка на возбудитель псевдотуберкулеза (Yersinia pseudotuberculosis), Микробиологическое (культуральное) исследование фекалий/ректального мазка на патогенные кампилобактерии (Campylobacter jejuni/coli)) с определением чувствительности к антибактериальным препаратам.
Определение антител к возбудителям стронгиллоидоза (Strongyloides stercoralis), Молекулярно-биологическое исследование фекалий на возбудителя стронгиллоидоза (Strongyloides stercoralis), Определение ДНК возбудителя стронгиллоидоза (Strongyloides stercoralis) в фекалиях методом ПЦР
Проводится 3-кратное бактериологическое исследование кала на кишечную группу, в том числе на кампилобактер, а также серологическое исследование крови для определения уровня антител к кишечным инфекциям. При наличии антител в невысоком титре исследование проводят повторно, при кишечной инфекции титр антител нарастает. В настоящее время расширяются возможности ПЦР-диагностики кишечных инфекций, что также следует использовать [8].
· Детям с подозрением на БК при необходимости проведения дифференциальной диагностики с язвенным колитом рекомендовано исследование в крови иммунологических маркеров ВЗК: ASCA (Определение антител класса G (IgG) в крови к Sacchаromyces cerevisiae (ASCA)) и ANCA (Определение маркеров ANCA-ассоциированных васкулитов: PR3 (c-ANCA), МПО (p-ANCA)) [19,20].
(УУР - С УДД - 5).
Комментарии: Наличие ASCA (антитела к Saccharomyces cerevisiae) - в пользу диагноза болезнь Крона и является маркером неблагоприятного фенотипа
Отсутствие ASCA не исключает диагноз, т.к. положительны они лишь у 20% пациентов.
В Номенклатуре медицинских услуг (Приказ Министерства здравоохранения РФ от 13 октября 2017 г. N 804н) услуга Определение антител класса G (IgG) в крови к Sacchаromyces cerevisiae (ASCA) отсутствует.
· Рекомендовано проведение исследования биоптатов кишки на цитомегаловирус при остром стероидрезистентном колите с целью подтверждения/исключения колита цитомегаловирусной этиологии [20].
(УУР-С; УДД- 5)
Комментарии: предпочтительно в биоптате кишки, полученной при ректосигмоидоскопии (Определение ДНК цитомегаловируса (Cytomegalovirus) в биоптатах и пунктатах из очагов поражения органов и тканей методом ПЦР, качественное исследование, Определение ДНК цитомегаловируса (Cytomegalovirus) в биоптатах и пунктатах из очагов поражения органов и тканей методом ПЦР, количественное исследование). При положительном результате теста требуется соответствующая терапия.
· Всем детям при диагностике БК рекомендовано проведение диагностики гепатита В (Определение антигена (HbsAg) вируса гепатита В (Hepatitis В virus) в крови) с целью отбора пациентов для иммунизации против данной инфекции или назначения соответствующей терапии при выявлениии заболевания [20].
(УУР-С; УДД-5).
· Рекомендовано перед началом анти-ФНО терапии и ежегодно на фоне лечения данными препаратами проведение исследования на туберкулез с целью выявления латентной туберкулезной инфекции и своевременного ее лечения (см. Приложение А3.1) [19,20].
(УУР-С; УДД-5)
Комментарий: могут проводиться Внутрикожная проба с туберкулезным аллергеном и/или IGRA-тесты (Interferon-γ release assays) – иммунологические методы, основанные на стимуляции Т-лимфоцитов пептидными антигенами и выработке интерферона –γ, секретируемого клетками крови инфицированного M. tuberculosis человека (Исследование уровня интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови).
Следует относиться с осторожностью к результатам внутрикожных тестов, так как при воспалительных заболеваниях кишечника может быть анергия.
Кроме лабораторных исследований следует оценить данные анамнеза и клинической картины, а также рентгенографии органов грудной клетки и /или компьютерной томографии органов грудной полости [26].
· Рекомендовано проведение исследования коагуляции Коагулограмма (ориентировочное исследование системы гемостаза) детям с подозрением на БК или с установленным диагнозом БК при подозрении на наличие изменений параметров гемостаза, в том числе, в комплексной оценке активности болезни с целью своевременной коррекции терапии [27].
(УУР - С УДД - 5).
Комментарии: возможно Определение тромбинового времени в крови, фибриногена, Определение международного нормализованного отношения (MHO), Определение концентрации Д-димера в крови и др.
· Рекомендовано определение содержания антител к тканевой трансглютаминазе в крови (класса IgA) и Исследование уровня иммуноглобулина А в крови при необходимости проведения дифференциальной диагностики с целиакией [19,20,28].
(УУР - С УДД - 5).
Комментарии: дальнейшие исследования и тактика при сомнительных результатах – согласно соответствующим клиническим рекомендациям. Следует также принять во внимание нередкое сочетание БК и целиакии [29, 30].
· Рекомендовано пациентам с БК регулярно проводить исследование уровня витамина D (Исследование уровня 25-ОН витамина Д в крови) с целью определения возможного дефицита и проведении коррекции[20,31].
(УУР - С УДД - 5).
Комментарии: Исследование уровня 25-ОН витамина Д в крови следует проводить всем пациентам регулярно, в среднем, 1 раз в год.
· Рекомендовано пациентам с БК проведение исследований уровней В12 (Определение уровня витамина В12 (цианокобаламин) в крови), Исследование уровня фолиевой кислоты в сыворотке крови, Исследование уровня цинка в крови, витаминов А, Е в крови при подозрении на витаминодефицитные состояния и/или дефицит цинка с целью своевременного выявления отклонений и назначения соответствующих препаратов для коррекции [19,20,31].
(УУР - С УДД - 5).
Комментарии: показания и частота исследований устанавливаются индивидуально, например: Исследование уровня 25-ОН витамина Д в крови следует проводить всем пациентам регулярно, цианокобаламин обязателен для контроля пациентам после терминальной резекции подвздошной кишки, цианокобаламина и фолиевой кислоты – при наличии макроцитарной анемии, цинка – пациентам с профузными диареями или высокими свищами, витаминов А, Е – редко и при возможности.
· Рекомендовано пациентам с БК с внутрибрюшными абсцессами проведение Микробиологического (культурального) исследования абсцессов на аэробные и факультативно-анаэробные микроорганизмы и Микробиологического исследования крови на аэробные и анаэробные/факультативно анаэробные микроорганизмы, а также на дрожжевые грибы (Микробиологическое (культуральное) исследование крови на стерильность, Микробиологическое (культуральное) исследование крови на дрожжевые грибы, Микробиологическое (культуральное) исследование крови на облигатные анаэробные микроорганизмы), Определение чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам с целью идентификации патогена, и коррекции стартовой антимикробной терапии [32].
(УУР - С УДД - 5)
Комментарий: В Номенклатуре услуг в настоящее время отсутствует услуга по Микробиологическому (культуральному) исследованию крови на аэробные и факультативно анаэробные микроорганизмы.
При необходимости может рассматриваться проведение экспресс-тестов для идентификации патогенов и их чувствительности к антимикробным препаратам.
В случае развития септического состояния или подозрении на него ведение пациента осуществляется согласно ссответствующим рекомендациям
2.4 Инструментальные исследования
2.4.1 Эндоскопические методы исследования
· Всем детям с подозрением на БК рекомендовано проводить:
· колоноскопию с илеоскопией (Колоноскопия, Видеоколоноскопия, Интестиноскопия)
· эзофагогастродуоденоскопию
· ступенчатую биопсию слизистой оболочки всех осмотренных отделов [19,20].
(УУР – C; УДД -5)
Комментарии: детям колоноскопия, видеоколоноскопия, интестиноскопия проводится под наркозом, эзофагогастродуоденоскопия – при наличии показаний.
Данные исследования также проводятся в динамическом наблюдении – частота устанавливается индивидуально (в т.ч., при рецидивах, при подозрении на прогрессирование, при контроле после хирургического лечения)
· При подозрении на поражение тонкой кишки и невозможности достоверного подтверждения диагноза по данным колоноскопии (с исследованием терминального отдела тонкой кишки), КТ и МРТ, невозможности проведения видеокапсульного исследования рекомендовано селективноепроведение баллонной энтероскопии (Интестиноскопия двухбаллонная) с биопсией (Биопсия тонкой кишки эндоскопическая) с целью уточнения диагноза [33, 34].
(УУР – В; УДД – 3).
Комментарии: исследование проводится под наркозом
2.4.2 Методы визуализации
· При подозрении на поражение тонкой кишки при БК рекомендовано проведение:
МР-энтерографии (гидро-МРТ, (Магнитно-резонансная томография тонкой кишки, Магнитно-резонансная томография тонкой кишки с контрастированием)) и/или КТ-энтерографии (гидро-КТ, (Компьютерная томография тонкой кишки с контрастированием)) с целью уточнения диагноза [20,35]
(УУР – С; УДД - 5)
Комментарии: МРТ может быть предпочтительна у детей в связи с отсутствием лучевой нагрузки, однако КТ больше подходит при неотложных состояниях.
При выборе исследования следует ориентироваться на состояние, возраст и возможности пациента, медицинской организации.
Наркоз проводится по показаниям.
· При невозможности проведения МРТ или КТ рекомендуется рентгеноконтрастное исследование тонкой кишки с рентгенконтрастными средствами, содержащими бария сульфат**(Рентгенография тонкой кишки с контрастированием) (после исключения признаков непроходимости или перфорации) [19,20,36, 37].
(УУР – С; УДД - 5)
· Комментарии: исследования с барием сульфатом** противопоказаны пациентам с известной или предполагаемой перфорацией, т.к. в таких случаях может развиться бариевый перитонит. Вместо бария сульфата** следует использовать препарат группы «контрастные средства» (водорастворимый).
· Детям с подозрением на ВЗК в качестве альтернативы МР-энтерографии (гидро-МРТ, (Магнитно-резонансная томография тонкой кишки, Магнитно-резонансная томография тонкой кишки с контрастированием)), а также при отрицательном результате данного исследования, но при серьезном подозрении на БК рекомендуется селективное проведение видеокапсульной эндоскопии (Тонкокишечная эндоскопия видеокапсульная, Толстокишечная эндоскопия видеокапсульная) c уточнения диагноза и оценки местного воспаления [19,20,38].
(УУР – С; УДД – 5).
Комментарий: Видеокапсульная эндоскопия (Тонкокишечная эндоскопия видеокапсульная, Толстокишечная эндоскопия видеокапсульная) более чувствительна по отношению к выявлению местных изменений слизистой оболочки по сравнению с МР-энтерографией (гидро-МРТ, (Магнитно-резонансная томография тонкой кишки, Магнитно-резонансная томография тонкой кишки с контрастированием) [38].
Ограничением к использованию Тонкокишечной эндоскопии видеокапсульной и Толстокишечной эндоскопии видеокапсульной является невозможность взятия биоптата, однако малая инвазивность, отсутствие необходимости проведения наркоза позволяет применять данное исследование, в том числе, в процессе динамического наблюдения за пациентом.
При БК перед проведением видеокапсульной эндоскопии следует выполнить рентгенологические исследованиия (пассаж бария по кишечнику) [39,40,41] (Рентгенография тонкой кишки с контрастированием, Рентгеноконтроль прохождения контрастного вещества по желудку, тонкой и ободочной кишке) или КТ-энтерография (Компьютерная томография тонкой кишки с контрастированием)) или МР-энтерографию (Магнитно-резонансная томография тонкой кишки, Магнитно-резонансная томография тонкой кишки с контрастированием) [42] для исключения/подтверждения стриктур тонкой кишки при подозрении на данные состояни. Тонкокишечная эндоскопия видеокапсульная проводится при подозрении на поражение тонкой кишки и при отсутствии стриктур [43] .
· Рекомендовано проведение ультразвукового исследования органов брюшной полости (Ультразвуковое исследование органов брюшной полости (комплексное)), забрюшинного пространства, малого таза (Ультразвуковое исследование органов малого таза (комплексное (трансвагинальное и трансабдоминальное)), в том числе, с допплеровским анализом всем пациентам с целью выявления некоторых признаков и осложнений БК – утолщение стенки кишки, инфильтрат, абсцесс брюшной полости, наличие фистул, воспаление брюшины и др. [19,20].
(УУР – С, УДД - 5)
Комментарий: согласно приказу Минздрава России от 13.10.2017 N 804н "Об утверждении номенклатуры медицинских услуг" - Ультразвуковое исследование органов малого таза (комплексное (трансвагинальное и трансабдоминальное). В реальной практике трансвагинальное исследование детям с БК не проводится.
Данный метод имеет ограниченные возможности в диагностике поражений кишечника. При этом процедура неинвазивна, что обусловливает ее широкое использование, особенно в детском возрасте.
· При перианальных поражениях, свищах заднего прохода (в том числе, слепо заканчивающихся в мягких тканях), а также при подозрениях на поражение параректальной клетчатки пациентам с БК рекомендовано проведение трансректального и/или трансперинеального ультразвукового или магнитно-резонансного исследования прямой кишки (Ультразвуковое исследование прямой кишки трансректальное, Магнитно-резонансная томография толстой кишки, Магнитно-резонансная томография толстой кишки с контрастированием) и Магнитно-резонансная томография органов малого таза с целью визуализации свищевых ходов и уточнения степени воспаления и протяженности поражения прямой кишки и анального канала [35,44, 45].
(УУР – C, УДД - 5)
· Рекомендовано проведение Магнитно-резонансной томографии органов малого таза (возможно с пероральным или внутривенным контрастированием) детям с перианальными проявлениями БК в виде свищей прямой кишки при подозрении на них для диагностики фистул для подтверждения диагноза (в т.ч., определения локализации, протяженности свищевого хода и наличия отсутствия осложнений) [20,46].
(УУР – С; УДД - 5)
Комментарии: в случае невозможности проведения Магнитно-резонансной томографии органов малого таза с внутривенным контрастированием проводится КТ органов малого таза с контрастированием (Компьютерная томография органов малого таза у женщин с контрастированием, Компьютерная томография органов таза у мужчин с контрастированием) или фистулография (Фистулография свищей прямой кишки и перианальной области) или ультразвукового исследования ректальным датчиком.
Наркоз по показаниям.
· Магнитно-резонансная холангиопанкреатография рекомендована детям с БК при наличии данных (подозрений) о вовлечении в процесс печени и/или желчных протоков [19].
(УУР – С; УДД - 5)
· Пациентам при подозрении на осложнение БК - кишечную непроходимость или перфорацию кишечника - рекомендуется обзорная рентгенография брюшной полости для подтверждения данного состояния. [19,47].
(УУР – С, УДД - 5)
· Рекомендовано проведение рентгеноденситометрии детям с БК с целью оценки состояния костной ткани, своевременной диагностики остеопороза, оценки необходимости и терапии [48].
(УДД 5, УУР С)
Комментарии: снижение плотности костей отмечено у 30% детей с ВЗК. Частота проведения исследования определяется индивидуально согласно клиническим рекомендациям по остеопорозу и снижении минеральной плотности костной ткани [49,50,51]
2.5 Иные исследования
Не применимо.
2.5.1 Патолого-анатомическое исследование (гистологическое исследование)
· Патолого-анатомическое исследование взятых в ходе эндоскопического исследования биоптатов и резецированных участков кишечника рекомендуется для диагностики болезни Крона и оценки эффективности лечения [52,53]. В случае эндоскопических признаков поражения пищевода, желудка и 12-перстной кишки также проводится патолого-анатомическое исследование биоптатов, полученных из указанных отделов (до 23% случаев в педиатрической практике) [54].
(УУР – С, УДД – 5)
Комментарии: Патолого-анатомическое исследование биопсийного (операционного) материала тонкой кишки, Патолого-анатомическое исследование биопсийного (операционного) материала тонкой кишки с применением иммуногистохимических методов, Патолого-анатомическое исследование биопсийного (операционного) материала тонкой кишки с применением гистохимических методов.
Патолого-анатомическое исследование биопсийного (операционного) материала толстой кишки, Патолого-анатомическое исследование биопсийного (операционного) материала толстой кишки с применением иммуногистохимических методов, Патолого-анатомическое исследование биопсийного (операционного) материала толстой кишки с применением гистохимических методов, Патолого-анатомическое исследование биопсийного (операционного) материала прямой кишки, Патолого-анатомическое исследование биопсийного (операционного) материала прямой кишки с применением гистохимических методов, Патолого-анатомическое исследование биопсийного (операционного) материала прямой кишки с применением иммуногистохимических методов.
Патолого-анатомическое исследование биопсийного (операционного) материала пищевода, Патолого-анатомическое исследование биопсийного (операционного) материала пищевода с применением иммуногистохимических методов, Патолого-анатомическое исследование биопсийного (операционного) материала пищевода с применением гистохимических методов.
Патолого-анатомическое исследование биопсийного (операционного) материала желудка, Патолого-анатомическое исследование биопсийного (операционного) материала желудка с применением иммуногистохимических методов, Патолого-анатомическое исследование биопсийного (операционного) материала желудка с применением гистохимических методов.
Патолого-анатомическое исследование биопсийного (операционного) материала 12-перстной кишки, Патолого-анатомическое исследование биопсийного (операционного) материала 12-перстной кишки с применением иммуногистохимических методов, Патолого-анатомическое исследование биопсийного (операционного) материала 12-перстной кишки с применением гистохимических методов
· Рекомендуется брать не менее 2 биоптатов из подвздошной кишки и, по меньшей мере, из 5 участков толстой кишки, включая прямую кишку. При верификации диагноза БК у пациентов с симптомами фульминантного колита рекомендуется взять не менее 2 биоптатов из одного отдела толстой кишки с целью установления диагноза [52,53].
(УУР – С, УДД - 5)
Комментарии: обычно биоптаты берутся из одного отдела, позволяющего выполнить исследование с минимальными осложнениями
Биоптаты рекомендуется брать, как из измененных, так и из эндоскопически нормальных участков с целью установления диагноза [52,53].
(УУР – С, УДД -5)
· Рекомендуется в направлении биопсийного материала на патолого-анатомическое исследование указывать информацию о возрасте ребенка, его анамнезе (включая эпидемиологический), жалобах, данные лабораторных и инструментальных исследований (включая протокол эндоскопического исследования) и проводимом лечении с целью точной трактовки полученных результатов для постановки диагноза [52,53].
(УУР – С, УДД - 5)
Комментарии:
1. Биоптаты взятые из различных отделов желудочно-кишечного тракта должны быть помещены в отдельную маркированную пробирку с забуференным формалином.
2. Протокол патолого-анатомического (гистологического) исследования должен содержать информацию о наличии или отсутствии признаков воспалительного заболевания кишечника (хронического воспаления), данные о локализации и активности воспалительных изменений, а также о наличии или отсутствии дисплазии.
3. К признакам хронического воспаления относятся: базальный плазмоцитоз, нарушение архитектоники желез (крипт), пилорическая метаплазия в подвздошной кишке, неказеозные некриптолитические гранулемы. Отсутствие последних не исключает болезнь Крона. К признакам активного воспаления относятся: криптиты, крипт-абсцессы, эрозии и язвы.
4. Для болезни Крона характерны сегментарность поражения, фокальный и трансмуралный характер воспаления, хроническое активное воспаление в тонкой кишке и верхних отделах пищеварительного тракта.
5. Патолого-анатомический (гистологический) протокол должен содержать вывод о наличии воспалительного заболевания кишечника и заключение о том, что наиболее вероятным диагнозом является болезнь Крона.
2.5.2. Консультации специалистов
· Рекомендовано при диагностике и ведении детей с БК применять мультидисциплинарный подход с привлечением необходимых специалистов на всех этапах диагностики и лечения с целью обеспечения адекватной диагностики, мониторинга и терапии [20].
(УУР – С; УДД - 5)
Комментарии: диагностику и ведение пациентов осуществляет врач-гастроэнтеролог (или врач-педиатр с соответствующей подготовкой), проводятся консультации, при необходимости, врача-диетолога, врача-детского хирурга, врача-клинического фармаколога, врача-детского онколога-гематолога, врача-дерматовенеролога, врача-аллерголога-иммунолога, врача-детского эндокринолога, врача по лечебной физкультуре, медицинского психолога и др. При наличии показаний необходима госпитализация в хирургический стационар.
2.5.3 Дифференциальная диагностика
· Дифференциальную диагностику проводят с рядом заболеваний. К ним относят:
· язвенный колит (табл. 4),
· острые кишечные инфекции (дизентерия, сальмонеллез, кампилобактериоз, иерсиниоз, амебиаз, паразитозы),
· C.difficile-ассоциированную диарею,
· цитомегаловирусный колит,
· туберкулез кишечника,
· системные васкулиты,
· неоплазии толстой и тонкой кишки,
· болезнь Бехчета,
· аппендицит,
· синдром раздраженного кишечника,
· целиакию (при этом следует учесть, что диагноз целиакии не исключает диагноза болезни Крона, описаны нередкие их сочетания),первичные иммунодефицитные состояния и др (табл. 5). [19,20].
Для исключения/подтверждения данных заболеваний/состояний проводится обследование согласно соответствующим клиническим рекомендациям Болезнь Крона часто приходится дифференцировать с язвенным колитом. Признаки данных заболеваний представлены в таблицах 4 и 5.
Таблица 4. Признаки болезни Крона и язвенного колита у детей [52,54].
|
Признаки |
Болезнь Крона |
Язвенный колит |
|
Пол |
мальчики > девочки |
мальчики = девочки |
|
Симптомы и признаки |
Боль в животе, диарея, потеря массы тела, анорексия, задержка роста |
Диарея с кровью в стуле, боль в животе |
|
Диарея |
Стул редко наблюдается, чаще чем 4-6 раз, кашицеобразный преимущественно в дневное время |
Стул частый, жидкий, нередко с ночными дефекациями |
|
Боли в животе |
Типичны, чаще неинтенсивные |
Только в период обострения, интенсивные перед дефекацией, после опорожнения стихают |
|
Возраст начала болезни |
до 7-10 лет - очень редко |
любой |
|
Характер начала болезни |
Острое - крайне редко, постепенное в течении нескольких лет |
Острое у 5-7% больных, у остальных постепенное (3-6 мес.) |
|
Кровотечения |
Редко, чаще - при вовлечении в процесс дистальных отделов толстой кишки |
В период обострения - постоянные |
|
Запор |
Более типичен |
Редко |
|
Пальпация области живота |
Инфильтраты и конгломераты кишечных петель, чаще в правой подвздошной зоне |
Спазмированная, болезненна толстая кишка |
|
Локализация процесса |
Весь желудочно-кишечный тракт (от ротовой полости до ануса) вовлечение всех слоев кишечной стенки, наиболее часто поражается илеоцекальный отдел |
Толстая кишка, поражается только слизистая оболочка, наиболее часто – поражение на всем протяжении толстой кишки |
|
Эндоскопическая картина |
Сегментарность поражения, афтозные язвы, глубокие щелевидные язвы, «булыжная мостовая», перианальные осложнения (хронические анальные трещины (язвы), парапроктит, свищи прямой кишки, стриктуры) |
Диффузная и непрерывная эритема, рыхлость, зернистость, потеря сосудистого рисунка прямой кишки в различной степени |
|
Патологоанатомическая картина (гистология) |
Хотя бы одна неказеозная гранулема в любом отделе ЖКТ (отсутствие гранулем не исключает БК); фокальное нарушение архитектоники; фокальное воспаление; фокальные криптиты; трансмуральное воспаление во отсутствие тяжелого колита; пилорическая метаплазия; активное воспаление в подвздошной кишке (при слабо выраженном воспалении в слепой кишке; в проксимальных отделах толстой кишки воспаление более выражено, чем в идстальных; наличие невоспаленных участков между очагами воспаления (у нелеченных больных и, исключая скачкообразное поражение слепой кишки при левостороннем язвенном колите) |
Отсутствие гранулем; диффузное нарушение архитектоники; диффузное воспаление; в дистальных отделах воспаление более выражено, чем в проксимальных; диффузные криптиты; отсутствие скачкообразного поражения (м.б. скачкообразное поражение слепой кишки при левостороннем колите); крипт-абсцессы; уменьшение слизи и бокаловидных клеток; метаплазия клеток Панета в левых отделах; |
|
Рентенологические признаки |
Ригидные стенозированные сегменты, сегментарные поражения, свищи |
Дилатация толстой кишки, токсический мегаколон |
|
Перфорации |
Более типичны прикрытые |
При токсической дилатации в свободную брюшную полость, протекают малосимптомно |
|
Ремиссия |
Отмечаются улучшения, абсолютной ремиссии нет, структура кишечника не восстанавливается |
Характерна, возможно длительное отсутствие обострений с обратным развитием структурных изменения в кишечнике |
Таблица 5. Воспалительные заболевания кишечника: дифференциальная диагностика у детей [19]
|
Симптомы |
Внекишечные проявления |
Дифференциальный диагноз |
|
· Лихорадка · Слабость · Бледность кожи и слизистых оболочек · Жидкий стул · Скрытая/видимая кровь в стуле · Диарея с кровью в стуле · Боль в животе · Болезненность при пальпации живота · Напряжением мышц живота при пальнации (особенно в правой подвздошной области) · Тенезмы · Задержка развития · Перианальные фистулы, трещины, абсцессы |
· Нарушение/задержка роста · Афтозный стоматит · Колцевидная эритема · Склерит, эписклерит · Артрит, артропатия · Первичный склерозирующий холангит · Камни в желчном пузыре · Аутоиммунный гепатит · Тромбоэмболия вен · Нефролитиаз · Панкреатит |
· Мальабсорбция углеводов · Инфекционный колит, энтероколит · Аллергия к белкам коровьего молока · Целиакия · Геморрагический васкулит · Аппендицит · Анальные трещины · Полипы кишечника · Геморрой · Инвагинация · Дивертикул Меккеля · Иммунодефициты · Функциональные нарушения органов желудочно-кишечного тракта · Туберкулез кишечника · Неблагоприятные реакции на лекарственные средства |
Первичные иммунодефицитные состояния чаще всего дебютируют у детей младше 2 лет, следует обратить внимание на следующие признаки:
· Семейный анамнез первичного иммунодефицита;
· Родители или >2 кровных родственников в семье с ранним началом ВЗК;
· «Младенческий» (<2 лет) ВЗК;
· Тяжелое, рефрактерное к лечению ВЗК, в особенности с перианальным/ректовагинальным вовлечением/абсцессами;
· Рецидивирующие инфекции (легочные инфекции, кожные абсцессы) при отсутствии иммуносупрессивной терапии;
· Нейтропения, тромбоцитопения, абнормальный иммунный статус (уровень Ig) при отсутствии иммуносупрессивной терапии;
· Дистрофия ногтей и заболевания волос (trichorrhexis nodosa);
· Заболевания кожи (врожденная экзема, альбинизм) [56].
3. Лечение
Цель лечения БК у детей – это:
· максимально быстрое достижение «полной» или «глубокой» ремиссии, под которой подразумевается не только клиническая, но и эндоскопическая ремиссия. Достижение морфологической ремиссии в настоящее время не является целью терапии;
· как можно более длительное поддержание ремиссии без приема ГКС;
· профилактика осложнений;
· предупреждение операций, а при прогрессировании процесса и развитии опасных для жизни осложнений – своевременное назначение хирургического лечения;
· улучшение качества жизни;
· обеспечение нормальных темпов роста и развития ребенка.
Выбор терапии должен проводиться с учетом факторов риска неблагоприятного течения БК. По мнению экспертов ESPGHAN [10], это:
· глубокое язвенное поражение толстой кишки при эндоскопическом исследовании
· сохраняющееся тяжелое течение заболевания, несмотря на адекватную индукционную терапию
· распространенное поражение (тотальное поражение тонкой кишки)
· значительное замедление линейного роста (показатель отклонения роста Z> -2,5)
· тяжелый остеопороз
· стенозирующее и (или) пенетрирующее течение на момент дебюта заболевания (течение заболевания B2 и/или B3)
· тяжелое поражение перианальной области.
Наличие даже одного из этих факторов позволяет предположить неблагоприятный исход заболевания, что должно послужить основанием для оптимизации проводимой терапии и применения препаратов, которые, как было установлено, изменяют естественное течение заболевания, таких как тиопурины, #метотрексат** и ингибиторы фактора некроза опухоли альфа (ФНО-альфа) (биологические препараты), а при осложнениях - соответствующей операции.
Выбор терапии БК должен проводиться в соответствии с ее локализацией, распространенностью и тяжестью. Недостаточная эффективность индукционной терапии требует интенсификации лечении. По достижении ремиссии проводится дальнейшая поддерживающая терапия.
3.1 Консервативная терапия
3.1.1 Индукция ремиссии
Потенциальное влияние БК на рост, половое и эмоциональное развитие пациентов подчеркивает необходимость специфического подхода к лечению в детском возрасте. Целью терапии является не только ослабление симптомов, но также обеспечение физического развития в соответствии с возрастом и удовлетворительного качества жизни [57] Факторы, которые влияют на использование специального энтерального питания включают: выбор пациента и его родителей, характер осложнений, вкусовые предпочтения пациента, отсутствие осложнений при использовании кортикостероидов системного действия, потенциальная польза, в виде улучшения трофического статуса и темпа роста ребёнка
· Полное энтеральное питание (ПЭП) в течение 6-8 недель рекомендуется в качестве терапии первой линии для индукции ремиссии у детей с вновь установленным диагнозом БК (за исключением тяжелого панколита, оральной или изолированной перианальной БК) или обострением воспалительной формы БК [19,10].
(УУР – С; УДД - 5)
Комментарии:
1. При лечении детей с поражением кишечника, включая поражение толстой кишки, для достижения заживления слизистой оболочки, нормализации минеральной плотности костной ткани и роста должно отдаваться предпочтение ПЭП, а не кортикостероидам системного действия (H02) или кортикостероидам для местного применения (A07EA) в капсулах кишечнорастворимых). ПЭП обладает той же эффективностью, что и ГКС, при индукции ремиссии у детей с активной БК. Однако в отношении эффективности ПЭП у пациентов с тяжелым изолированным панколитом при болезни Крона достоверные данные отсутствуют. Также отсутствуют данные о пользе применения ПЭП при изолированном поражении ротовой полости или перианальной области.
2. ПЭП может быть повторно использовано в случае рецидива
3. Энтеральное питание осуществляется с помощью жидких полимерных смесей (продукт детского диетического лечебного питания, продукт энтерального питания, сухая быстрорастворимая полноценная сбалансированная смесь, специализированный продукт для энтерального питания, сухая полноценная смесь), которые лучше переносятся, имеют лучшие органолептические свойства и низкую стоимость. Гидролизованные или аминокислотные смеси следует применять только в случае наличия конкретного медицинского показания для их использования (например, аллергия на белок коровьего молока). В ряде исследований показано преимущество специализированных смесей, обогащенных противовоспалительным компонентом – трансформирующим фактором роста бета-2 (TGF β2) (продукт детского диетического лечебного питания, продукт энтерального питания, сухая быстрорастворимая полноценная сбалансированная смесь, специализированный продукт для энтерального питания, сухая полноценная смесь ,.
4. Необходимый суточный объем смеси рассчитывается в соответствии с возрастными энергетическими потребностями (см. Методические рекомендации MP 2.3.1.2432-08 "Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации" (утв. Главным государственным санитарным врачом РФ 18 декабря 2008 г.) и может быт увеличен у детей с белково-энергетической недостаточностью. Первоначально смесь должна вводиться перорально. Назогастральный зонд может быть использован, когда не удается добиться адекватного перорального приема.
5. ПЭП рекомендуется на срок не менее 8 недель. Если клинический ответ при использовании ПЭП в течение первых 2 недель отсутствует, следует решить вопрос о применении альтернативных методов лечения.
6. Решение о применении ПЭП или альтернативных методов лечения следует принимать индивидуально с учетом качества жизни пациента
7. Доказательная база в отношении перехода к обычному питанию после завершения применения ПЭП отсутствует. Эксперты ESPGHAN предлагают постепенное введение обычной пищи одновременно с уменьшением объема питательной смеси каждые 2-3 дня в течение 2-3 недель[58,59,60]
· Рекомендовано применять частичное энтеральное питание в комплексе с медикаментозной терапией при обострении БК или для индукции ремиссии [10].
(УУР – С; УДД - 5)
Комментарии: частичное энтеральное питание не применяется в виде монотерапии, при этом имеются доказательные данные о том, что оно способствует пролонгированию достигнутой ремиссии на фоне специализированной диеты в сочетании с медикаментозной терапией.
Несмотря на то, что ПЭП признано методом выбора при индукции ремиссии при БК у детей, оно часто создает проблемы с комплаенсом: бόльшая часть пациентов считает ПЭП неприемлемым и около половины не уверены в эффективности такого способа лечения. Большинство пациентов предпочитают употребление плотной пищи. В многоцентровом прямом РКИ у детей с легким и средне-тяжелым течением БК показано преимущество использования режима частичного энтерального питания полимерной смесью, обогащенной TGF β2 (продукт детского диетического лечебного питания, продукт энтерального питания, сухая быстрорастворимая полноценная сбалансированная смесь, специализированный продукт для энтерального питания, сухая полноценная смесь плюс специализированнной диеты для болезни Крона (Crohn’s Disease Exclusion Diet, СDED), по сравнению с ПЭП, в отношении переносимости и стойкости ремиссии к 12 неделе.
· Рекомендовано при болезни Крона назначать специализированную диету с исключением продуктов и блюд, предположительно способных нарушать кишечную микробиоту, повышать проницаемость кишечного барьера и вызывать хроническое воспаление (глютен, животные жиры, мясные продукты промышленного производства, эмульгаторы, консерванты и др.) с целью предотвращения негативного воздействия питания на состояние кишечника [61] (УУР – А; УДД - 2)
Комментарии: Продукты, которые следует избегать при болезни Крона [62]
|
Группа продуктов |
Продукты, которые следует избегать |
|
Молоко и молочные продукты |
· Молоко цельное · Сливки · Сметана · Йогурт с ягодами, цедрой апельсина или лимона или орехами · Мороженое (кроме обезжиренного или обезжиренного) |
|
Мясо и другие белковые продукты |
· Жаренные мясные блюда · Кобласы · Копченые мясные продуктв · Продукты фаст-фуд · Яйца, сваренные вкрутую, жаренные · Яичница-глазунья · Орехи |
|
Крупы |
· На основе цельного зерна хлеб, булочки, крекеры или макароны · Коричневый рис и дикий рис · Крупы из цельного зерна · Любые зерновые продукты, приготовленные из семян или орехов. |
|
Овощи |
· Свекла · Брокколи, брюссельская капуста, кочанная капуста, квашеная, цветная капуста, · Кукуруза · Зелень (шпинат, горчица, репа и капуста) · Лимская фасоль, · Грибы, · Лук, пастернак, перец |
|
Фрукты |
· Все сырые фрукты, кроме очищенных яблок, спелых бананов. · Консервированные ягоды, консервированная вишня · Сухофрукты, включая изюм · Сливовый сок |
|
Напитки |
· Напитки с кофеином, такие как кофе, чай, кола и т.д. · Спортивные напитки · Избегать сладких фруктовых соков и других напитков, приготовленных с сахаром или кукурузным сиропом, если они усиливают диарею. |
|
Другие ингредиенты |
· Сахарные спирты (сорбит, маннит и ксилит), которые могут вызывать у ряда пациентов диарею. · Эти ингредиенты часто содержатся в жевательных резинках и конфетах без сахара, а также в некоторых лекарствах. |
Эффективность кортикостероидов для местного применения и кортикостероидов системного дейтвия
В связи с тем, что только в нескольких исследованиях сообщалось о применении глюкокортикоидов у детей, страдающих ВЗК, стратегия лечения у детей в основном основана на опыте лечения взрослых пациентов [63]. Было проведено два РКИ у детей [64,65], в которых проводилось сравнение преднизолона** и #будесонида**, и одно исследование [66], в котором проводилось сравнение преднизолона** и комбинации преднизолона** с #меркаптопурином** у детей с впервые установленным диагнозом БК. Кроме того, дополнительные данные были получены из регистров детей, страдающих ВЗК, и из популяционных исследований. Значения частоты достижения ремиссии в течение тридцати дней после начала лечения для преднизолона** в исследованиях у детей колебались от 57% [67] до 79% [66] в РКИ и 62% в популяционном исследовании [68]. В исследованиях использовалась схема снижения дозы глюкокортикоидов продолжительностью от восьми до 12 недель. В клинической практике начало применения и снижение дозы глюкокортикоидов не стандартизировано и осуществляется на основании опыта врача. Однократный прием суточной дозы в утреннее время уменьшает потенциальное негативное влияние препаратов, связанное с замедлением роста [69]. Внутривенное введение глюкокортикоидов применяется только для лечения тяжелого обострения заболевания.
Глюкокортикоиды и заживление слизистой оболочки
Клинический ответ при лечении болезни Крона не коррелирует с эндоскопическим улучшением [70], а оценка эндоскопического ответа на применение глюкокортикоидов у детей, страдающих БК, была проведена только в двух исследованиях: Berni Canani [67] установил, что эндоскопическое улучшение наблюдалось у 4 из 10 пациентов, однако ни у одного пациента не было зарегистрировано заживления слизистой оболочки через 8 недель после начала лечения. В исследовании, проведенном Borrelli и соавт.[71], наблюдалось частичное заживление слизистой оболочки у 6 из 18 (33%) пациентов, получавших глюкокортикоиды, на 10 неделе. В исследовании поддерживающей терапии в течение года полное заживление слизистой оболочки при эндоскопическом исследовании было достигнуто при монотерапии #будесонидом** у 24% пациентов, а при его комбинации с азатиоприном** – у 83% пациентов [72].
Варианты лечения и эффективность в зависимости от локализации и течения заболевания
У пациентов с легкой или среднетяжелой формой БК с локализацией патологического процесса в подвздошной кишке или восходящей ободочной кишке применение #будесонида** предпочтительно [64,65,73]. В исследовании, проведенным Levine и соавт. [74], были зарегистрированы лучшие показатели достижения ремиссии и ответа в течение 7 недель при использовании дозы 12 мг, по сравнению со стандартной дозой 9 мг (66% и 74% по сравнению с 42% и 51% соответственно) через 7 недель.
Поддержание ремиссии с использованием глюкокортикоидов не рекомендуется, а в случае развития стероидозависимости обязателен переход на другую терапию (тиопурины или #метотрексат**, биологическая терапия).
Безопасность глюкокортикоидов и нежелательные эффекты
Подавление функции надпочечников может развиваться даже через одну неделю после начала лечения кортикостероидами системного действия [75]. Риски развития нежелательных эффектов зависят от дозы и продолжительности лечения [76]. однако чувствительность у различных пациентов может существенно различаться. Одной из важнейших проблем, возникающих при лечении кортикостероидами системного действия детей с БК, является замедление роста. В связи с этим, длительные курсы кортикостероидов системного действия у детей не допустимы.
· Кортикостероиды системного действия рекомендуются для индукции ремиссии у детей со среднетяжелым и тяжелым обострением воспалительной формы БК при повторном обострении, а также при первой атаке, если применение ПЭП невозможно [10, 19,20, 57]
(УУР – С, УДД - 5)
Комментарии:
· Рекомендуемая доза преднизолона** (или аналогичного препарата) для приема внутрь при обострении БК для большинства пациентов детского возраста составляет 1 мг/кг (максимальная доза 40 мг/сутки) однократно в сутки утром. При недостаточном эффекте может потребоваться увеличение дозы до 1,5 мг/кг (максимальная доза 60 мг/сутки) [57].
· При отсутствии эффекта от перорального применения кортикостероидов системного действия у некоторых пациентов может быть эффективным внутривенное введение кортикостероидов системного действия [57].
· Рекомендуется назначение первоначальной дозы в течение 2 недель с последующим постепенным снижением и отменой не позднее 12 недель. Схема снижения дозы преднизолона** приведена в таблице 5.
Таблица 5. Схема снижения дозы преднизолона** при проведении индукционной терапии БК у детей (в соответствии с рекомендациями The Medical Management of Paediatric Crohn’s Disease: an ECCO-ESPGHAN Guideline Update. /Consensus Advance Access publication Paper. October 7, 2020. Journal of Crohn's and Colitis, 2020, 1–24, doi:10.1093/ecco-jcc/jjaa161) [10]1.
|
|
Масса тела |
|
|
|
Неделя |
10–20 кг |
20–30 кг |
> 30 кг |
|
1–3 |
20 мг |
30 мг |
40 мг |
|
4 |
15 мг |
25 мг |
35 мг |
|
5 |
15 мг |
20 мг |
30 мг |
|
6 |
12.5 мг |
15 мг |
25 мг |
|
7 |
10 мг |
15 мг |
20 мг |
|
8 |
7.5 мг |
10 мг |
15 мг |
|
9 |
5 мг |
10 мг |
10 мг |
|
10 |
2.5 мг |
5 мг |
5 мг |
1 Поскольку схемы постепенного снижения дозы преднизолона** в значительной степени основаны на эмпирических рекомендациях, а не на клинических испытаниях, на практике подходы несколько варьируют. Сокращение каждого этапа с 7 до 5 дней или любое другое изменение режима снижения может рассматриваться в индивидуальном порядке.
· У детей с легким и среднетяжелым поражением илеоцекальной области при болезни Крона в качестве альтернативы кортикостероидам системного действия для индукции ремиссии рекомендовано использование #будесонида** (капсулы кишечнорастворимые) [19,20,77, 74.]
(УУР – А, УДД - 2)
Комментарии: Начальная доза #будесонида** – 9 мг ежедневно в течение 7 недель, затем 6 мг ежедневно в течение 3 недель (общий курс лечения - 10 недель).
· Не рекомендовано использовать детям кортикостероиды системного действия и кортикостероиды для местного применения в качестве поддерживающей терапии [19,10]
(УУР – С, УДД - 5)
· На фоне лечения кортикостероидами системного действия и кортикостероидами для местного применения, а также при дефицитных состояниях рекомендуется назначение препаратов кальция (например, кальция глюконат**, кальция глицерофосфат (для детей с 2-х летнего возраста), а так же кальция карбонат + кальция лактоглюконат (для детей с 3-х летнего возраста) и с Колекальциферолом** (для детей начиная с раннего возраста препарат применяют в виде порошка для приготовления суспензии для приема внутрь) и витамина D и его аналогов (Колекальциферол**(для детей старше 2 недель)), для коррекции недостаточности и снижения риска остеопении/остеопороза, профилактики и лечения гипокальциеми (дефицита кальция) [78].
(УУР – С; УДД – 5)
Комментарии: в практике удобнее применять комбинированные препараты (например, Кальция карбонат+Колекальциферол).
· Рекомендуется использовать антибактериальные препараты системного действия, такие как #метронидазол** #ципрофлоксацин**, для лечения пациентам с БК с формированием свищей в перианальной области только в комплексе с анти-ФНО терапией при необходимости регуляции микробной колонизации [10].
(УУР – С, УДД - 5)
Комментарии:
1. Стандартная суточная доза #метронидазола** составляет 30 мг/кг, а #ципрофлоксацина** – 20 мг/кг, возможно использование рифаксимина (согласно инструкции, противопоказан до 12 лет, по 400 мг каждые 8-12 часов) 14 дней [79]. Длительность терапии не менее 8 недель.
2. При отсутствии эффекта при комбинированной терапии следует пересмотреть дозу ингибиторов фактора некроза опухоли альфа (ФНО-альфа) (повысить дозу #инфликсимаба** (см. подраздел 3.1.2.4: более высокие дозы – (до 10 мг/кг) и/или более короткие интервалы (до 4х недель) тем, у кого отсутствует реакция на препарат или, когда низкий уровень ЛП. Следует снижать дозу #инфликсимаба** когда минимальный уровень превышает 8-10 мкг/мл и наступает ремиссия) (наилучший эффект – при целевых минимальных уровнях препарата в крови >12,7 мкг/мл )) [10]
Другие препараты могут быть рассмотрены в индивидуальном порядке по клинической ситуации.
· При более тяжелом течении заболевания, протекающего с формированием свищей, антибактериальные средства системного действия рекомендуется использовать в качестве дополнительной терапии, например, перед назначением иммуносупрессивной терапии при невозможности ее начала в связи с необходимостью хирургического вмешательства [20]
(УУР – С, УДД - 5)
Комментарий: могут применяться антибактериальные препараты системного действия курсом до 14 дней (препараты первой линии #метронидазол** 10-20 мг/кг/день перорально в три приема и #ципрофлоксацин** 20 мг/кг/день перорально в 2 приема [80]
3.1.2 Поддерживающая терапия
Эффективность азатиоприна** и #меркаптопурина**
У детей с БК проведено одно плацебо-контролируемое и семь наблюдательных исследований, в которых оценивалось применение тиопуринов для поддержания ремиссии. В РКИ, проведенном Markowitz [66], частота рецидивов составила 4 и 9% в группе #меркаптопурина** (n = 27 пациентов) и 26 и 47% в группе плацебо (n = 28 пациентов) через 6 и 18 месяцев соответственно после индукции ремиссии с использованием преднизолона** у пациентов с впервые диагностированной среднетяжелой и тяжелой БК. В ретроспективных исследованиях серий случаев при использовании азатиоприна** наблюдался более длительный период поддержания ремиссии, более низкая частота госпитализаций, повторного назначения кортикостероидов системного действия и выполнения хирургических вмешательств [81,82]. Применение азатиоприна** в более высокой дозе 2,5 мг/кг/сутки было более эффективным по сравнению с более низкими дозами 1,0 или 2,0 мг/кг/сутки. При проведении наблюдательных исследований у взрослых было отмечено уменьшение необходимости в выполнении хирургических вмешательств, а также профилактический эффект в отношении поражения перианальной области, в особенности в случае раннего начала лечения [83,84], однако в более поздних исследованиях эффективность тиопуринов в отношении поддержания ремиссии была поставлена под сомнение [85,86]. В исследовании SONIC были получены данные проспективного анализа заживления слизистой оболочки, проведенного у максимального количества взрослых пациентов с БК; из 115 пациентов, получавших азатиоприн**, заживление слизистой оболочки (заживление язв) наблюдалось у 16,5% [87]. В случае применения азатиоприна** в дозе 3 мг/кг наблюдалась стабилизация или улучшение значения показателя отклонения роста (Z-показателя) у 36% детей, страдающих БК [88].
Безопасность и побочные эффекты азатиоприна** и #меркаптопурина**
Побочные реакции при применении тиопуринов были зарегистрированы у 15-46% пациентов [89,90,91]. В 8%–28% случаев они стали причиной снижения дозы препарата, а в 18%–43% случаев лечение было прекращено. Применение азатиоприна** в более высокой дозе 3 мг/кг/сутки у детей, страдающих ВЗК, приводит к отмене препарата у 30% пациентов [88]. Дозозависимая токсичность может проявиться как спустя несколько недель, так и несколько лет после начала лечения и включает в себя гепатотоксичность и миелосупрессию. При применении препаратов в стандартных дозах гематологическая токсичность наблюдается у 1,8%-13,7% пациентов [89,90,91]. Риск развития инфекций составляет ~ 8% [91], однако при анализе данных, полученных из последних крупных регистров детей DEVELOP и взрослых TREAT, было установлено, что применение иммунодепрессантов не было связано с повышенным риском инфекций, в то время как применение иммунодепрессантов – ингибиторов фактора некроза опухоли альфа (ФНО-альфа) (биологических препаратов) более чем удваивало риск инфекций [92,93].
Токсичность, не зависящая от дозы препарата, обычно проявляется в течение первых недель после начала лечения. Панкреатит относится к наиболее частым проявлениям реакции гиперчувствительности и наблюдается у 3-4% пациентов. Другие нежелательные лекарственные реакции, не зависящие от дозы препарата, включают диспепсические расстройства (5-8%), лихорадку, гриппоподобные симптомы, миалгию, артралгию и сыпь (наблюдается ~ 9% пациентов). Замена препарата на #меркаптопурин** может быть успешной примерно у 50% пациентов с непереносимостью азатиоприна**, в особенности при миалгии или артралгии, но также может быть эффективной в случае гепатотоксичности, симптомов со стороны желудочно-кишечного тракта, гриппоподобных проявлений и сыпи [90]. Результаты недавнего небольшого исследования серии случаев позволяют предположить, что попытка применения #меркаптопурина** может быть успешной и безопасной у некоторых пациентов с панкреатитом, индуцированным применением азатиоприна** [94]. Примерно 9% пациентов с ВЗК не отвечают на применение тиопуринов [95], а у пациентов с высокой активностью ТПМТ (>14 Ед/мл эритроцитов) наблюдается меньшая эффективность лечения [96].
На основании долгосрочных наблюдений было установлено, что риск развития лимфомы у пациентов с ВЗК, получающих тиопурины, особенно у мужчин, увеличивается примерно в четыре раза, однако абсолютный риск у детей и подростков был меньшим [97,98]. Было рассчитано, что у детей риск составляет 4,5 случаев/10000 пациенто-лет [99], он был задокументирован в детском регистре DEVELOP [100]. Кроме того, примерно у 40 подростков и взрослых пациентов, страдающих ВЗК, была зарегистрирована Т-клеточная лимфома печени и селезёнки с летальным исходом; практически все пациенты были мужского пола, и у 50% пациентов опухоль возникла в возрасте до 20 лет. Примерно половина этих пациентов получала в течение длительного времени только тиопурины, а другая половина получала длительное время тиопурины в комбинации с ингибиторами фактора некроза опухоли альфа (ФНО-альфа), длительность экспозиции анти-ФНО терапии при этом существенно варьировала [101]. Применение тиопуринов также было связано с 4-5 кратным увеличением риска развития немеланомного рака кожи даже в возрасте до 50 лет [102,103]. Интересно отметить, что в недавних исследованиях было выявлено, что применение тиопуринов приводит к снижению риска развития новообразований колоректальной области, как у пациентов с БК, так и с ЯК, и данный профилактический эффект, по-видимому, более выражен, чем у аминосалициловой кислоты** и аналогичных препаратов [104]. Следует избегать назначения тиопуринов во время инфекции, вызванной вирусом Эпштейн-Барр (ВЭБ), в связи с риском развития лимфом, ассоциированных с ВЭБ.
· Азатиоприн** или #Меркаптопурин**) рекомендованы в качестве лечения для поддержания ремиссии у детей, которым требуется терапия кортикостероидами системного действия и/или #будесонидом** капсулы кишечнорастворимые, а также детей из группы риска неблагоприятного исхода заболевания [19,20].
(УУР – С; УДД - 5)
Комментарии:
1. Тиопурины эффективны в поддержании ремиссии БК, достигнутой на фоне кортикостероидов системного действия и/или кортикостероидов для местного применения. Для получения максимального эффекта от тиопуринов может потребоваться от 8 до 16 недель, поэтому начинать терапию ими следует на фоне снижения дозы преднизолона** [10].
2. У пациентов без нарушений метаболизма тиопуринов рекомендуется применение азатиоприна** в дозе 2,0-2,5 мг/кг или #меркаптопурина** в дозе, в среднем, 1,5 мг/кг в сутки перорально [10] (длительность лечения определяется индивидуально и может составлять, в среднем, от 6 мес до 18 мес [66, 105], азатиоприн** может применяться до достижения и поддержания устойчивой ремиссии в течение 2 лет [106].
3. Исследование активности тиопуринметилтрансферазы (ТПМТ) перед началом терапии тиопуринами (норма 230-450 ед/мл) позволяет выявить пациентов с высоким риском миелосупрессии. Если проведение этого исследования невозможно, в начале лечения может быть назначена половинная доза тиопурина с контролем общего анализа крови еженедельно в течение 2 недель [11], если миелосупрессии не отмечается, рекомендуется постепенное увеличения дозы тиопурина до полной. Снижение дозы аналогов пурина (тиопурина) в 2 раза рекомендуется при снижении лейкоцитов в крови ниже 3000/мм3, тиопурины противопоказаны в редких случаях, когда абсолютное количество лейкоцитов снижается ниже 1500/мм3.
4. В течение первого месяца после начала лечения обязателен контроль общего анализа крови и активности «печеночных» ферментов (определение активности аланинаминторансферазы (АЛТ), аспартатаминотрансферазы (АСТ), гамма-глютамилтрансферазы (ГГТ), щелочной фосфатазы в крови), первоначально – каждые 1-2 недели с последующим уменьшением частоты; а в дальнейшем на протяжении всего лечения тиопуринами необходим контроль этих показателей каждые 3 месяца у всех пациентов (независимо от активности ТПМТ).
6. Панкреатит может развиваться независимо от дозы в ранние сроки после начала применения тиопуринов), при его развитии обычно требуется отмена препарата. Необходимо уделить особое внимание дифференциальной диагностике истинной токсичности, связанной с применением тиопуринов, и внекишечными проявлениями ВЗК в форме панкреатита.
7. Решение о переводе с азатиоприна** (AZA) на #меркаптопурин** (MP) и наоборот может быть принято у пациентов с гриппоподобным синдромом или острыми симптомами со стороны желудочно-кишечного тракта.
8. Увеличение активности трансаминаз более двух норм может носить транзиторный характер или потребовать снижения дозы препарата или его отмены. При повышении активности ТПМТ и уровня трансаминаз рекомендуется снижение дозы тиопурина и назначение #аллопуринола**.
9. При добавлении к лечению #аллопуринола** доза тиопурина должна быть снижена до 25-33% от первоначальной дозы. Стандартная доза #аллопуринола** для взрослых составляет 100 мг/сутки, доза #аллопуринола** для детей должна быть уменьшена (50-75 мг в зависимости от массы тела).[57]
11. Всем пациентам, которые применяют или ранее применяли тиопурины, рекомендуется избегать воздействия солнечных лучей в течение всей жизни, а также проходить регулярное дерматологическое обследование в связи с повышенным риском опухолей кожи.
Примечание: Нумерация пунктов дана в соответствии с официальным текстом документа-источника.
· Не рекомендуется применение у детей с БК тиопуринов для индукции ремиссии БК [19,20,10].
(УУР - С УДД - 5)
· Рекомендовано селективное проведение (при возможности) исследования активности тиопуринметилтрансферазы (ТПМТ, TPMT) перед началом терапии тиопуринами с целью выявления пациентов с высоким риском миелосупрессии (при доступности данного исследования) [19,20].
(УУР - С УДД -5)
Комментарий: исследование позволяет выявить пациентов с высоким риском миелосупрессии (норма 230-450 ед/мл). При отсуствии возможности определения – поэтапное повышение дозы азатиоприна** [8,17]
· Рекомендовано селективное определение уровней метаболитов (6-тиогуаниновые нуклеотиды [6-TGN] и 6-метилмеркаптопурин [6-MMP]) (при доступности данного исследования) пациентам с БК, получающим тиопурины с субоптимальным ответом на терапию для выявления причин цитопении или повышенных «печеночных» ферментов, мониторинга жалоб и для оптимизации дозирования [10].
(УУР - С УДД - 5)
Комментарии:
При отсутствии возможности определения – поэтапное повышение дозы азатиоприна** [8,17].
Интерпретация уровней метаболитов тиопуринов
|
6-TGN [pmol/8×108 Эр]a |
6-MMP [pmol/8×108 Эр] |
Дозозависимые побочные эффекты |
Интерпретация |
Рекомендации |
|
низкий [<230] |
норма [<5700] |
- |
Недостаточная доза или низкий комплайнс |
Повысить комплайнс или дозу тиопуринов до адекватного уровня |
|
низкий [<230] |
высокий [≥5700] |
Гепатотоксичность и другие |
TPMT гиперметаболизатор |
Рассмотреть добавление #аллопуринола** 50 мг х 1р/сут [10] и уменьшение дозы тиопуринов до 25-33% от стандартной или сменить препарат |
|
терапевтический [230–450] |
Норма или высокий |
Рефрактерность |
Неэффективность терапии |
Если имеются клинические признаки резистентности – сменить препарат |
|
высокий [>450] |
Норма |
Миелосупрессия |
Низкая активность TPMT [гетеро-илигомозигота] |
Сменить препарат в случае гомозиготности или уменьшить дозу вполовину в случае гетерозиготности |
|
высокий |
Высокий |
Миелосупрессия и гепатотоксичность |
Передозировка |
Если имеются клинические признаки резистентности – сменить препарат |
a «Отрезные» значения основаны на методе в соответствии с [107]
Более высокие «отрезные» значения [therapeutic range of 6-TGN from 300 to 600 pmol/8×108 RBC] необходимы при оценке методом Dervieux and Boulieu. [108]
Эффективность #метотрексата**
Результаты, полученные в 7 ретроспективных когортных исследованиях у детей, позволяют предположить, что эффективность #метотрексата** у детей, у которых лечение тиопуринами было неэффективным или наблюдалась их плохая переносимость, составляет от 50 до 80% [109,110,111,112,113,114,115; при этом частота ремиссии через 6 и 12 месяцев составила 37–62% и 25–33% соответственно, а частота ремиссии в течение всего первого года - 15-35%. В двух небольших исследованиях (n=50) не было выявлено различий между #метотрексатом** и #меркаптопурином** (в отношении поддержания ремиссии БК (ОР 2,63; 95%ДИ 0,74-9,37; P=0,14). У детей, ответивших на лечение отмечена нормализация линейного роста, что может быть косвенным признаком эффективного контроля воспаления слизистой оболочки. Оценка эффективности #метотрексата** заживлять слизистую оболочку не проводилась, за исключением одного исследования у взрослых, в котором оно достигнуто у 2 из 11 пациентов, получавших #метотрексат**, 8 из 18, получавших азатиоприн** (p = 0,011 по сравнению с #метотрексатом**) и 9 из 16 пациентов, получавших инфликсимаб** (p = 0,008 по сравнению с #метотрексатом**) [116].
Безопасность и нежелательные эффекты #метотрексата**
Побочные реакции сдерживают широкое применение #метотрексата**. К ним относятся тошнота/рвота, гриппоподобные симптомы, поражение печени и, значительно реже, миелосупрессия. Проблема тошноты и рвоты может быть особенно неприятной, и данные явления часто становятся причиной прекращения применения препарата [117]; в исследовании, проведенном Uhlen и соавт.[110], тошнота/рвота наблюдалась у 7/61 (11%) пациентов, а в исследовании, проведенном Turner и соавт.[109], у 4/17 (24%) детей, принимавших препарат внутрь, и у 6/39 (15%) пациентов из группы, получавшей препарат подкожно. Появление тошноты и рвоты можно предотвратить путем превентивного применения ондансетрона** (согласно инструкции, противопоказан до 1 мес) [118]. Токсическое влияние на органы дыхания относится к очень серьезным, но крайне редким осложнениям применения #метотрексата**; ни одного случая данного явления у детей с БК зарегистрировано не было. Повышение активности печеночных ферментов может наблюдаться у 30% пациентов и обычно проходит после временного прекращения применения #метотрексата** и/или снижения дозы.
· #Метотрексат** рекомендуется в качестве одного из вариантов поддержания ремиссии у детей с высоким риском неблагоприятного исхода заболевания в качестве препарата первой линии для поддержания ремиссии или при неэффективности или непереносимости тиопуринов [20].
(УУР - С УДД - 5)
Комментарии:
#Метотрексат** следует назначать в дозе 15 мг/м2 1 раз в неделю; максимальная доза – 25 мг.
1. Если у пациента в течение нескольких месяцев наблюдается стойкая полная ремиссия с нормальными значениями маркеров воспаления, может быть предпринята попытка снижения дозы до 10 мг/м2 один раз в неделю (максимальная доза – 15 мг).
2. #Метотрексат** обычно назначается в виде подкожных инъекций, эффективность которых аналогична эффективности внутримышечных инъекций.
3. На фоне терапии #метотрексатом** рекомендуется прием внутрь #фолиевой кислоты** (5 мг через 24-72 часа после введения #метотрексата** или 1 мг однократно в сутки 5 дней в неделю) [10].
4. У пациентов со стойкой ремиссией необходим периодический контроль общего анализа крови и активности АЛТ.
5. #Метотрексат** строго противопоказан при беременности, а также его применение противопоказано половым партнерам женщины при планировании беременности, при необходимости следует использовать эффективный метод контрацепции.
6. При плохой переносимости #метотрексата** (тошнота) следует назначить ондансетрон** (согласно инструкции, противопоказан до 1 мес) за час до инъекции
· Рекомендовано в качестве альтернативы иммунодепрессантам (азатиоприн**) и аналогам пурина (#меркаптопурин**) и #инфликсимабу** при стероидорефрактерной БК средней и тяжелой степени – селективное назначение #такролимуса** 0,1- мг/кг х 2р/дн [119, ].
(УУР – С; УДД – 4)
Комментарии: доза (при возможности) корректируется по уровню такролимуса в крови (целевые – в среднем, 10 и 15 нг/мл) (Исследование уровня лекарственных препаратов в крови) [119].
В процессе терапии #такролимусом** следует проводить контрольное обследование: Исследование уровня креатинина в крови, Исследование уровня глюкозы в крови, исследование уровня электролитов в крови (Исследование уровня натрия в крови, Исследование уровня калия в крови, Исследование уровня общего кальция в крови, Исследование уровня общего магния в сыворотке крови), Исследование уровня триглицеридов в крови, измерение артериального давления на периферических артериях, при необходимости - профилактика пневмонии, вызванной P.jirovecii согласно соответствующим рекомендациям.
Эффективность анти-ФНО терапии
Воспалительная форма заболевания. Эффективность инфликсимаба** (по инструкции – детям с 6 лет) для индукции и поддержания ремиссии у детей с БК доказана в нескольких РКИ. В рандомизированном исследовании REACH [120] дети в возрасте от 6 до 17 лет с активной БК после предшествующего недостаточно эффективного лечения глюкокортикоидами и иммунодепрессантами получали инфликсимаб** по схеме 0, 2 и 6 недель. У 98 (88%) из 112 пациентов был достигнут ответ на лечение, у 59% через 10 недель наблюдалась клиническая ремиссия. Пациенты, ответившие на лечение через 10 недель, были рандомизированы для дальнейшего лечения инфликсимабом** (5 мг/кг) каждые 8 недель или каждые 12 недель при продолжающемся лечением одним из тиопуринов). Введение препарата с интервалом 8 недель было более эффективным. Применение инфликсимаба** на ранних стадиях заболевания может привести к лучшим результатам у отдельных пациентов из группы высокого риска [121].
Исследование IMAgINE было первым двойным слепым рандомизированным исследованием [122], в котором была проведена оценка эффективности адалимумаба** (препарат по инструкции показан детям, начиная с 6-летнего возраста) у 192 детей в возрасте 6-17 лет с умеренно тяжелой и тяжелой активной БК (PCDAI>30), несмотря на применение пероральных глюкокортикоидов и/или иммунодепрессантов. В исследование включались пациенты, ранее отвечавшие на лечение инфликсимабом**, у которых эффективность данного препарата была утрачена, и пациенты, которые не переносили данный препарат. После открытой фазы индукции дети были рандомизированы для лечения высокой или низкой дозой адалимумаба**. Через 54 недели у 31/93 детей (33,3%), получавших высокую дозу препарата, наблюдалась клиническая ремиссия. В ретроспективном многоцентровом исследовании, проведенном у 115 пациентов детского возраста, страдающих БК, которые получили, как минимум, 1 дозу адалимумаба** (95% из них ранее получали инфликсимаб**), частота без-стероидной ремиссии в течение 1 года составила 42% [123]. Данные, полученные у детей, были сравнимы с данными, полученными в исследованиях адалимумаба у взрослых.
Пенетрирующая форма заболевания. Данные, подтверждающие эффективность инфликсимаба** у детей с БК, протекающей с формированием свищей, малочисленны. При ретроспективном анализе эффективности инфликсимаба** при сопутствующем поражении перианальной области у 31 пациента в исследовании REACH (28%), было установлено, что через 2 недели после однократной инфузии препарата у 41% было достигнуто частичное или полное закрытие свища [124]. В недавнем исследовании серии случаев у детей GETAID [125] было установлено, что частота ответа на лечение инфликсимабом** через 12 месяцев составила 75% (75/101 пациента с БК), при этом у 54% наблюдалось полное закрытие свища.
Данные, касающиеся закрытия свищей у детей с БК, получавших адалимумаб**, ограничены. При проведении анализа подгрупп в исследовании IMAgINE было установлено, что закрытие свища было достигнуто через 52 недели у 23,8% пациентов (5/21) в группе, получавшей низкую дозу препарата, и у 40% - высокую дозу. У взрослых было установлено существенное преимущество инфликсимаба** перед плацебо (55% пациентов с закрытием всех свищей по сравнению с 13% в группе плацебо) (P=0,002) [126]. Медиана времени до получения ответа на лечение инфликсимабом** составила 14 дней. Что касается адалимумаба**, частота закрытия свищей через 12 недель составила 48% у пациентов, ранее не получавших ингибиторы фактора некроза опухоли альфа (ФНО-альфа)), и 26% у пациентов, ранее получавших инфликсимаб** [127]. На 24 неделе частота закрытия свищей была значительно выше в группе пациентов, ранее не получавших ингибиторы фактора некроза опухоли альфа (ФНО-альфа)) (60% и 20%, P<0,01).
Внекишечные проявления БК
У взрослых показано, что инфликсимаб** может быть эффективным для лечения внекишечных проявлений БК [129]. Применение инфликсимаба** у детей с внекишечными проявлениями было описано в исследовании серии случаев пациентов с гангренозной пиодермией, поражением лица и полости рта, эритемой, метастатическим поражением кожи полового члена и кожи мошонки при БК, увеитом, первичным поражением легких, первичным склерозирующим холангитом в сочетании с панкреатитом и остеомиелитом [130,131,132,133,134].
Заживление слизистой оболочки
В недавнем исследовании, проведенном в Польше [135], наблюдалось полное заживление слизистой оболочки через 10 недель у 23% из 66 получавших лечение ингибиторами фактора некроза опухоли альфа (ФНО-альфа) детей с БК. Заживление слизистой оболочки сопряжено с увеличением скорости роста и формирования костной ткани. Malik и соавт. [136] описали когорту пациентов, в которой у 42%, получавших адалимумаб**, наблюдалось улучшение линейного роста, в особенности у детей, у которых была достигнута ремиссия. При определении концентрации маркеров образования костной ткани в сыворотке крови наблюдалось быстрое их улучшение после лечения ингибиторами фактора некроза опухоли альфа (ФНО-альфа)как у детей, так и у взрослых с БК [137,138,139,140]. Применение ингибиторов фактора некроза опухоли альфа (ФНО-альфа)снижает необходимость выполнения хирургических вмешательств [84].
Оптимизация (интенсификация) лечения ингибиторами фактора некроза опухоли альфа (ФНО-альфа)
Для достижения стойкой клинической ремиссии в детской гастроэнтерологической клинической практике иногда требуется оптимизация (интенсификация лечения ингибиторами фактора некроза опухоли альфа (ФНО-альфа). Увеличивается доза препарата (с 5 мг/кг до 10 мг/кг инфликсимаба**) и/или сокращаются интервалы между введениями (переход на введение каждые 4 недели для инфликсимаба** и на еженедельное введение для адалимумаба**). Оптимизацию проводят в случае неэффективности лечения или утраты ответа на лечение. Важно поддерживать минимальную остаточную концентрацию препарата в сыворотке крови на определяемом уровне (3-8 мкг/мл) (при возможности определения) - Исследование уровня лекарственных препаратов в крови [141].
Комбинированная терапия
Вопрос о том, следует ли применять ингибиторы фактора некроза опухоли альфа (ФНО-альфа) в виде монотерапии или в комбинации с иммунодепрессантом, вызывал особенно много споров в детской практике. В исследовании SONIC, проведенном у взрослых пациентов [87], ранее не получавших ни иммунодепрессанты, ни инфликсимаб**, было выявлено умеренное увеличение эффективности инфликсимаба** в случае его комбинации с азатиоприном**. Однако в исследовании SONIC не рассматривался вопрос о преимуществе комбинированной терапии перед монотерапией инфликсимабом**, если предшествующее лечение азатиоприном** было неэффективным. Как в исследовании ACCENT I, так и в исследовании ACCENT II не было выявлено никаких различий в отношении достижения ремиссии и ответа на лечение между пациентами на монотерапии инфликсимабом** и комбинированной терапии [142]. Сходные результаты были получены в отношении адалимумаба** в исследовании CHARM [143]. Но было выявлено незначительное преимущество комбинированной терапии, в особенности в течение первых 6 месяцев лечения [144,145]. Были зарегистрированы более высокие значения концентрации антител к инфликсимабу** и более низкие остаточные концентрации ингибитора фактора некроза опухоли альфа (ФНО-альфа) препарата у больных, получавших монотерапию инфликсимабом**, что сопровождалось большей частотой инфузионных реакций и менее благоприятным исходом лечения. В недавнем мета-анализе было установлено, что применение комбинированной терапии с использованием азатиоприна** дает лучшие клинические результаты, чем монотерапия инфликсимабом**, даже в случае отсутствия эффекта от азатиоприна** в анамнезе.
Негативным моментом комбинированной терапии ингибиторами фактора некроза опухоли альфа (ФНО-альфа)и азатиоприном** является повышенный риск развития лимфомы [146]. Комбинация с #метотрексатом** является более привлекательной в связи с отсутствием доказательств повышения риска развития лимфомы, и наличием данных, показавших пользу сочетания #метотрексата** и инфликсимаба** у ревматологических больных. В клиническом исследовании COMMIT взрослые пациенты, страдающие БК в качестве индукционной терапии, получали инфликсимаб** и кортикостероиды системного действия в сочетании с #метотрексатом** или плацебо [147]. Никаких различий в клиническом ответе выявлено не было, но назначение #метотрексата** сопровождалось более высокой концентрацией инфликсимаба** и уменьшением частоты образования антител к нему. При проведении ретроспективного анализа в исследовании ESPGHAN у 70 детей, страдающих БК и получавших лечение адалимумабом** [148], частота достижения ремиссии была выше у тех больных, которые одновременно получали иммунодепрессанты (34/46 (74%) против 9/24 (37%), p=0,003). С учетом этого, можно сделать вывод о допустимости одновременного применения азатиоприна** в течение первых 6 месяцев терапии инфликсимабом**, а затем лучше отменить азатиоприн**, в особенности у мальчиков, однако тактика лечения должна быть индивидуальной и основываться на оценке прогностических факторов. Прекращение комбинированной терапии является обоснованным только у пациентов, у которых была достигнута глубокая ремиссия (заживление слизистой оболочки). Роль #метотрексата** в комбинированной терапии у детей с БК должна быть определена в клинических исследованиях.
Сравнение инфликсимаба** и адалимумаба**
В ретроспективном когортном исследовании [149] было проведено сравнение результатов, полученных у 100 взрослых пациентов, страдающих БК, получавших инфликсимаб**, и 100 пациентов, получавших адалимумаб**, не было выявлено никаких различий в достижении клинического ответа; ответ на лечение через 1 и 2 года наблюдался у 62% и 41% пациентов, получавших адалимумаб**, и 65% и 49% пациентов, получавших инфликсимаб**, соответственно.
Безопасность ингибиторов фактора некроза опухоли альфа (ФНО-альфа) и нежелательные эффекты
Образование антител к ингибиторам фактора некроза опухоли альфа (ФНО-альфа) может привести к развитию острых инфузионных реакций, отсроченных реакций гиперчувствительности, снижению концентрации препаратов в сыворотке крови, а также потере ответа на лечение [150,151,152]. Нерегулярное введение препаратов может привести к увеличению риска образования антител [152]. В трех небольших исследованиях, проведенных у детей, антитела к инфликсимабу** были выявлены у трети пациентов, страдающих БК [151,152,153]. При проведении мета-анализа 18 исследований (включающих 3326 взрослых пациентов, страдающих БК и получавших инфликсимаб**) [154] было установлено, что частота образование антител к инфликсимабу** составила 45,8% при использовании эпизодических инфузий и 12,4% при проведении регулярной поддерживающей терапии. В исследовании IMAgINE только у 2,3% пациентов в группе, получающей высокую дозу препарата, и у 4,4% пациентов в группе, получающей низкую дозу препарата, обнаружены антитела к адалимумабу**.
Наиболее распространенные симптомы острой инфузионной реакции: одышка, приливы, тошнота, головная боль, гипоксемия и тахикардия. Анализ 18 исследований у детей показал, что острая инфузионная реакция была зарегистрирована у 168 из 1100 пациентов, получавших инфликсимаб** (15%) [10]. Большинство реакций были легкими, и наблюдался быстрый ответ на лечение в виде временного прекращения инфузии препарата или уменьшения скорости инфузии. Применение премедикации (антигистаминных средств системного действия, других анальгетиков и антипиретиков (жаропонижающих препаратов) или глюкокортикоидов), по-видимому, не предотвращает развития острой инфузионной реакции [155,156,157,158]. Частота инфузионных реакций у детей была аналогичной таковой у взрослых [142,159]. Тяжелые инфузионные реакции в виде гипоксии, гипотензии или затруднения дыхания являются противопоказанием для дальнейшего применения инфликсимаба**.
Отсроченные реакции гиперчувствительности могут наблюдаться минимум через день после инфузии препарата и характеризуются развитием артралгии и отеком суставов, которые могут сопровождаться лихорадкой и/или сыпью. Частота возникновения данных реакций у детей, получающих инфликсимаб**, достигает 8% [120], аналогичная ситуация наблюдается и у взрослых [142,159]. У 20-29% детей при этом обнаружены антинуклеарные антитела (АНА). Клиническая значимость положительных АНА после лечения ингибиторами фактора некроза опухоли альфа (ФНО-альфа) до сих пор остается неясной.
Серьезные инфекции, таких как сепсис, менингит, пневмония, абсцессы, опоясывающий лишай или инфекция, вызванная вирусом ветряной оспы, гемофагоцитарный лимфогистиоцитоз, обусловленный вирусом Эпштейн-Барр, дерматомикозы и оппортунистические грибковые инфекции, были зарегистрированы у 49 из 1483 пациентов, получавших инфликсимаб** (3,3%) [160]. У детей, страдающих БК и получавших адалимумаб** из когорты BSPGHN, частота зарегистрированных серьезных нежелательных явлений составила 6%, включая два случая смерти от сепсиса у пациентов, получавших также иммунодепрессанты и домашнее парентеральное питание [148].
Риск развития оппортунистических инфекций (инвазивные грибковые инфекции, реактивация латентного туберкулеза) увеличивается у пациентов, получающих комбинированную терапию с использованием иммунодепрессантов, а также у пациентов с недостаточностью питания [161]. Если пациент не болел ветряной оспой и у него отсутствуют антитела к данному вирусу, целесообразна вакцинация против ветряной оспы, если возможна отсрочка начала лечения (так как необходим 4-6-недельный интервал между иммунизацией и началом иммуносупрессивной терапии).
При изучении долгосрочной безопасности схем лечения, включающих ингибиторы фактора некроза опухоли альфа (ФНО-альфа), был выявлен повышенный риск новообразований: гепатолиенальной Т-клеточной лимфомы - у 30 пациентов, страдающих ВЗК и получавших лечения с использованием ингибиторов фактора некроза опухоли альфа (ФНО-альфа) в комбинации с тиопуринами [162], что позволяет предположить, что развитие лимфомы связано с применением тиопуринов, а комбинация с инфликсимабом** является катализатором [146]. У детей, получавших ингибиторы фактора некроза опухоли альфа (ФНО-альфа) (биологические препараты,) по данным FDA на апрель 2008 года было зарегистрировано 48 случаев злокачественных новообразований, включая лимфому и злокачественные новообразования кожи, в том числе меланому (31 случай после применения инфликсимаба**, 2 случая после применения адалимумаба** и 15 случаев после применения #этанерцепта** (по инструкции – с 12 лет)) [163].
Появление симптомов со стороны кожи, таких как экзема или псориазоподобные поражения, было зарегистрировано у 20% взрослых пациентов, страдающих ВЗК [159], увеличивается их частота и у детей с ВЗК. Псориаз, индуцированный применением инфликсимаба**, наблюдался у 8% (6/73) пациентов детского возраста, страдающих ВЗК [164].
Утрата ответа на лечение
Первичное отсутствие ответа на лечение – это отсутствие ответа на индукционный курс в течение первых 6 месяцев после начала лечения. Утрата ответа на лечение - это ситуация, когда у пациента, который ранее отвечал на лечение ингибиторами фактора некроза опухоли альфа (ФНО-альфа) (биологическим препаратом), ухудшилось течение заболевания или возник рецидив, несмотря на регулярное введение ингибиторов фактора некроза опухоли альфа (ФНО-альфа) (биологического препарата), что сопровождается укорочением интервала времени ремиссии после инфузии. Определение минимальной остаточной концентрации препарата может помочь выяснить причину утраты ответа на лечение и решить вопрос о дальнейшей тактике лечения в случае сохранения утраты ответа на лечение.
Неиммунные факторы, ведущие к утрате ответа на лечение, включают усиление воспаления, возникновение воспалительных процессов, на которые не могут подействовать применяемые препараты, осложнения заболевания (стеноз или пенетрация). Возможны проблемы, связанные с приверженностью, субоптимальные схемы лечения и уменьшение концентрации препарата или его метаболитов. Часто встречаются факторы, не связанные с ВЗК, такие как оппортунистические и другие инфекции или синдром раздраженного кишечника, не связанный с воспалительными изменениями. Таким образом, всегда необходимо проводить повторное обследование пациента в случае утраты эффективности лечения, и убедиться в том, что симптомы действительно обусловлены активностью данного заболевания. В настоящее время для лечения пациентов с утратой ответа используется тактика увеличения дозы препарата, которая заключается в применении удвоенной дозы или укорочения интервала между инфузиями /инъекциями, которая может быть эффективной у детей с низкой остаточной концентрацией препарата даже при наличии антител в невысоких титрах. При проведении ретроспективных исследований в Израиле [165] и Бельгии [166] не было выявлено преимуществ использования удвоенной дозы инфликсимаба** по сравнению с укорочением интервала между введениями, но по причинам, связанным с затратами на лечение и удобством пациента, предпочтительнее первоначально использовать удвоение дозы препарата. В целом, у 47% пациентов наблюдался устойчивый ответ в течение 1 года после увеличения дозы или укорочения интервала между введениями [165]. У десяти пациентов с наличием антител к инфликсимабу** использовалась более интенсивная схема лечения, при этом клинический ответ наблюдался у 6 (60%) пациентов. После применения более интенсивной схемы лечения концентрация антител к инфликсимабу** снизилась у пяти пациентов.
В последнее время появились доказательства, позволяющие предположить, что добавление тиопуринов или #метотрексата** к схеме лечения пациентов, получавших инфликсимаб** в виде монотерапии и утративших ответ на лечение по причине образования антител к инфликсимабу**, может привести к исчезновению антител и восстановлению уровня остаточной концентрации, а также клинического ответа [167]. При выявлении соответствующих титров антител к инфликсимабу** может быть как назначена более интенсивная схема, так и добавлен иммунодепрессант. При отсутствии эффекта от использования более интенсивной схемы лечения и комбинированной терапии или при высоком титре антител к инфликсимабу** может быть принято решение о переходе на другой ингибитор фактора некроза опухоли альфа (ФНО-альфа). Karmiris и соавт. [168] провели анализ 168 пациентов, которые начали получать адалимумаб** по причине утраты ответа на лечение, обусловленной образованием антител к инфликсимабу**. Клинический ответ был достигнут у 93% пациентов и был устойчивым у 62% пациентов; медиана периода наблюдения составила 20 месяцев. Такая тактика не будет успешной у пациентов с активным заболеванием и достаточной концентрацией препарата в крови; в данном случае показан переход на биологическую терапию молекулами другого класса.
· Инфликсимаб** (с 6 лет) или адалимумаб** (с 6 лет) рекомендуются для индукции и поддержания ремиссии у детей с воспалительной формой БК в случае сохраняющейся активности, несмотря на предшествующую оптимизированную терапию иммуносупрессорами [10]. Препарат по инструкции разрешен детям с 6 лет, при необходимости #инфликсимаб назначают в более младшем возрасте (согласно исследованиям, с 2,4 года в дозе 5 мг/кг в/в 0-2-6 и далее каждые 8 нед. (режим дозирования соответствует режиму применения у детей с 6 лет – по инструкции); отсутствуют данные о применении до 2,4 года [169, 170, 171].
(УУР – С, УДД - 5)
Комментарии: Внутривенное введение #инфликсимаба** обычно составляет 5 мг/кг с тремя индукционными дозами в течение 6 недель [Недели 0-2-6], за которыми следует поддерживающая терапия 5 мг/кг каждые 8 недель.
Однако есть достаточно доказательств того, что детям <30 кг и тем, у кого имеется распространенный процесс и низкий уровень сывороточного альбумина, требуются более высокие индукционные дозы #инфликсимаба** до 10 мг/кг, более короткие интервалы дозирования или и то, и другое, чтобы достичь целевых минимальных уровней [9].
· #Инфликсимаб** или адалимумаб** рекомендуются для индукции ремиссии у детей с активной БК при гормонорезистентности [10].
(УУР – С, УДД - 5)
Комментарии: дозы #инфликсимаба** – см. выше
· #Инфликсимаб** или адалимумаб** рекомендуются в качестве препаратов первой линии для индукции и поддержания ремиссии активной болезни Крона у детей при наличии свищей в перианальной области (вместе с соответствующим хирургическим лечением) [19,20,10].
(УУР – С, УДД - 5)
Комментарии: дозы #инфликсимаба** – см. выше
· #Инфликсимаб** или адалимумаб** для поддержания ремиссии у пациентов, ответивших на индукционную терапию ингибиторами фактора некроза опухоли альфа (ФНО-альфа), рекомендуется применять по схеме с регулярным, а не эпизодическим введением препарата. [10].
(УУР – С, УДД - 5)
Комментарии: дозы #инфликсимаба** – см. выше
1. Решение о применении ингибиторов фактора некроза опухоли альфа (ФНО-альфа) в качестве препарата первой линии для индукции ремиссии может быть принято у отдельных пациентов детского возраста при наличии факторов риска неблагоприятного исхода заболевания (см. выше).
3. Решение о раннем начале применения ингибиторов фактора некроза опухоли альфа (ФНО-альфа) должно быть принято у пациентов с тяжелыми внекишечными проявлениями заболевания (например, тяжелый артрит, гангренозная пиодермия).
4. Оценка первоначальной эффективности лечения ингибиторов фактора некроза опухоли альфа (ФНО-альфа) должна проводиться после введения второй или третьей дозы препарата, и при отсутствии значимого эффекта применение препарата должно быть прекращено (первичная неэффективность лечения).
5. У пациентов, ранее не получавших ингибиторы фактора некроза опухоли альфа (ФНО-альфа) (наивные к анти-ФНО терапии), #инфликсимаб** и адалимумаб** имеют равную эффективность и профиль побочных реакций. Выбор препарата проводят в соответствии с доступностью, предпочтительным способом введения, предпочтением пациента, стоимостью и местными нормативными требованиями.
6. Данных для оценки риска/пользы комбинированной или монотерапии детей с БК недостаточно. По-видимому, комбинированная терапия в течение первых 6 месяцев может снижать образование антител и обусловленную ими утрату ответа на лечение. Но это преимущество следует оценивать с учетом увеличения со временем риска развития лимфомы на фоне тиопуринов, поэтому данный вопрос следует решать индивидуально (учитывая факторы неблагоприятного прогноза заболевания). Одновременное применение #метотрексата** в низких дозах может быть более безопасным, чем тиопуринов, но эта комбинация имеет меньшую доказательную базу.
7. Рутинная премедикация парацетамолом**, кортикостероидами системного действия или антигистаминными средствами системного действия (противоаллергическими средствами - H1-гистаминовых рецепторов блокаторами) перед введением ингибиторов фактора некроза опухоли альфа (ФНО-альфа) не показана.
8. Перед началом терапии ингибиторами фактора некроза опухоли альфа (ФНО-альфа)) обязательно проведение исследования на туберкулез: рентгенография органов грудной клетки, внутрикожная проба с очищенным туберкулином и/или IGRA-тесты (Interferon-γ release assays) – иммунологические методы, основанные на стимуляции Т-лимфоцитов пептидными антигенами и выработке интерферона –γ, секретируемого клетками крови инфицированного M. tuberculosis человека (Исследование уровня интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови).
А также уточнения иммунизации – а именно вакцинаии и титра антител к гепатиту В, ветряной оспе, кори [172].
9. Для индукции ремиссии #инфликсимаб** назначают в дозе 5 мг/кг, 3 дозы в течение 6 недель (недели 0-2-6) с последующей поддерживающей терапией с введением препарата в дозе 5 мг/кг каждые 8 недель. У пациентов, у которых наблюдается уменьшение эффективности препарата или при низкой концентрации препарата может потребоваться применение более высоких доз препарата до 10 мг/кг и/или сокращение продолжительности интервалов между введениями до 4-х недель. Однако есть достаточно доказательств того, что детям <30 кг и тем, у кого имеется распространенный процесс и низкий уровень сывороточного альбумина, требуются более высокие индукционные дозы до 10 мг/кг, более короткие интервалы дозирования или и то, и другое, чтобы достичь целевых минимальных уровней [14]. Уменьшение дозы #инфликсимаба** показано, если его остаточная концентрация превышает 8-10 мкг/мл.
10. Для индукции ремиссии адалимумаб** детям с массой тела ˃40 кг назначают в дозе 2,4 мг/кг (максимальная доза 160 мг) на первую инъекцию, 1,2 мг/кг (максимальная доза 80 мг) через 2 недели, с последующим введением препарата в дозе 0,6 мг/кг (максимальная доза 40 мг) каждые 2 недели. У пациентов с массой тела до 40 кг: 80 мг на первую инъекцию, -40мг – через 2 недели, -20 мг – один раз в 2 недели. (40 мг для детей с массой тела ˃40 кг, 20 мг – для детей с массой тела ˂40 кг) Детям с массой тела ˃40 кг возможно назначение в такой ситуации дозы 80 мг один раз в 2 недели. Еженедельное введение показано при снижении эффективности и низкой остаточной концентрацией препарата [173] .
11. В случае недостаточного ответа или снижения эффективности лечения для установления причины целесообразно определение остаточной концентрации #инфликсимаба** и адалимумаба**, а также антител к ним в сыворотке крови.
· В случае отсутствия эффективности оптимизированной анти-ФНО терапии рекомендовано селективное применение #устекинумаб** или #ведолизумаб** [10].
(УУР – С, УДД -5)
Комментарий:
Оба препарата могут быть назначены off-label - в соответствии с показателями (характеристиками), не указанными в инструкции по его применению .
· #Устекинумаб** – человеческие моноклональные антитела, блокирующие активность интерлейкинов 12 и 13, предотвращая связывание субъединицы р40 с рецептором 12R-?1 на поверхности иммунных клеток. Систематический обзор и мета-анализ, включавший 1947 взрослых пациентов с болезнью Крона, продемонстрировали эффективность #устекинумаба** в индукции ремиссии по сравнению с плацебо (RR: 0,91; 95% CI: 0,86-0,95) [174]. Данные относительно эффективности #устекинумаба** у детей получены в ходе небольших исследований. Назначение #устекинумаба** (без применения глюкокортикоидов) позволило достичь ремиссию к 52 неделе у 39-40% детей с болезнью Крона [174].
· Для индукции ремиссии #устекинумаб** вводят внутривенно в дозе 6 мг/кг, округляя до 130 мг (максимальная доза - 520 мг). Эффективность устекинумаба оценивают через 8 недель. Поддерживающую дозу вводят подкожно каждые 8 недель (взрослым – 90 мг; детям – пропорционально поверхности тела, ориентируясь на стандартную поверхность тела взрослого – 1,73 м2) [10].
· #Ведолизмумаб** – гуманизированные моноклональные антитела (IgG1), которые связываются с b4a7-интегрином и молекулами клеточной адгезии слизистой оболочки кишечника адрессином-1 (MAdCAM-1), препятствуя миграции Тh-клеток в кишечную стенку [175]. Назначение #ведолизумаба** позволяет достичь ремиссии к 14 неделе, в среднем, у 40 детей с болезнью Крона [176, 177].
· Вероятность достижения ремиссии при назначении #ведолизумаба** выше у детей с Крон-колитом и у анти-ФНО наивных пациентов [176].
· Назначение #ведолизумаба** не ассоциируется с повышенным риском оппортунистических инфекций и малигнизации [178].
· Для индукции ремиссии пациентам с массой тела более 40 кг #ведолизумаб** вводят внутривенно трижды в дозе 300 мг (0-2-6 недели). Затем препарат вводят в дозе 300 мг каждые 8 недель.
· Детям с массой менее 40 кг препарат вводят в дозе 6 мг/кг (максимальная разовая доза – 300 мг) или пропорционально поверхности тела, ориентируясь на стандартную поверхность тела взрослого – 1,73 м2 [10].
· Для достижения ремиссии может потребоваться 14 недель. В связи с этим может быть использована «связующая» терапия глюкокортикоидами [10].
· Рекомендовано селективное применение #упадацитиниба** детям с рефрактерными к терапии вариантами болезни Крона с 8 лет в начальной дозе 45 мг/сут 8-12 недель, далее – поддерживающая доза 15 мг в день [179, 180, 181.] или - после начальной дозы 45 мг/кг в течение 12 недель - далее применять по 30 мг/сут, при нормализации уровня кальпротектина – перейти на поддерживающую дозу 15 мг в день [181, 182] с целью достижения и поддержания ремиссии.
(УУР – С, УДД -4)
В настоящее время зарегистрированы биоаналоги (биосимиляры) ингибиторов фактора некроза опухоли альфа (ФНО-альфа) (анти-ФНО препаратов), которые эквивалентны им по строению, часть из которых в клинических испытаниях показали схожую с оригинальными препаратами эффективность [183], однако не для всех биоаналогов проведены такие исследования.
· Переход с оригинального препарата на биосимиляр рекомендовано рассмотреть только после достижения ремиссии (не ранее, чем после введения 3-х доз оригинального #инфликсимаба**) и после обсуждения перехода с пациентом и/или законным представителем с целью достижения максимально возможного эффекта терапии и возможности точной оценки ее результативности [183].
(УУР – С; УДД – 5)
Комментарии:
При применении как оригинальных препаратов, так и биосимиляров, необходим тщательный контроль со своевременной подачей сведений в систему Мониторинга эффективности и безопасности лекарственных препаратов Росздравнадзора (https://roszdravnadzor.gov.ru/drugs/monitpringlp).
Общероссийская общественная организация «Ассоциация колопроктологов России» и «Всероссийское общество по изучению воспалительных заболеваний кишечника» по вопросу немедицинского переключения биологической терапии при воспалительных заболеваниях кишечника в рамках Национального саммита по лечению воспалительных заболеваний кишечника 22 июня 2019 г вынесли следующую резолюцию:
Биосимиляр может быть назначен пациентам, не получавшим ранее ингибиторы фактора некроза опухоли альфа (ФНО-альфа), при наличии соответствующих показаний и в том случае, если его стоимость ниже, чем оригинального ингибитора фактора некроза опухоли альфа (ФНО-альфа), и поддерживается совместным решением пациента и врача.
Решение о возможности замены оригинального ингибитора фактора некроза опухоли альфа (ФНО-альфа) на его биосимиляр должно приниматься врачом исходя из индивидуальных особенностей течения ВЗК, а также с учетом отнесения пациента к особым популяциям (дети, беременные, пожилые и др.) и должно быть согласовано с пациентом в соответствии с мировыми практиками.
Не допустима автоматическая замена оригинального препарата на биосимиляр и/или переключение с одного биосимиляра на другой ввиду отсутствия в настоящий момент достаточных данных об их безопасности и эффективности [184].
· Не рекомендуются множественные переключения (более одного переключения) между различными биоаналогами (биосимилярами) или между биосимиляром и оригинальным препаратом пациентам с ВЗК так как становится сложным отслеживание лекарственного препарата в случае потери эффективности и/или сигналов безопасности [183,185, 186].
(УУР – С; УДД – 5)
· рименение препаратов аминосалициловой кислоты и ее производных в виде монотерапии рекомендуется только у отдельных пациентов с легким течением заболевания в связи с недостаточной эффективностью [20].
(УУР – C; УДД -5)
Комментарии:
· Доказательства того, что применение аминосалициловой кислоты и ее производных (месалазин** гранулы с пролонгированным высвобождением для приема внутрь/таблетки кишечнорастворимые с пролонгированным высвобождением, покрытые пленочной оболочкой/таблетки с пролонгированным высвобождением (детям с 6 лет - согласно Инструкции) месалазин** таблетки кишечнорастворимые, покрытые пленочной оболочкой детям с 3 лет (согласно Инструкции)- индуцирует заживление слизистой оболочки, отсутствуют, и в связи с этим данные препараты должны рассматриваться в качестве вспомогательной терапии. Если препарат группы аминосалициловая кислота и ее производные используется в качестве единственного лекарственного средства для лечения легких форм при отсутствии глубоких язвенных дефектов, для подтверждения полной ремиссии необходим тщательный контроль таких показателей, как концентрация CРБ, СОЭ и концентрация фекального кальпротектина, а также должен быть установлен низкий порог для необходимости усиления терапии.
· Эффективность аминосалициловой кислоты и ее производных (аминосалицилатов) при применении с целью поддержания ремиссии низкая (не выше 5% по сравнению с плацебо)
· Не рекомендуется использовать противодиарейные микроорганизмы (пробиотики) для поддержания ремиссии БК у детей ввиду отсутствия доказательств их эффективности для этой цели [10].
(УУР – С, УДД - 5)
Комментарий: Имеющиеся доказательства позволяют предположить, что противодиарейные микроорганизмы (пробиотики) могут быть эффективны для уменьшения воспаления в экспериментальных моделях колита и могут оказывать положительное влияние при некоторых клинических ситуациях, таких как поучит и ЯК. Мета-анализ реультатов 7 небольших исследований у пациентов с БК, которые различались в зависимости от исследуемого противодиарейного микроорганизма (пробиотика), качества методики и схемы применения препарата не обнаружил статистически значимого преимущества применения противодиарейных микроорганизмов (пробиотиков) в отношении уменьшения риска рецидива по сравнению со стандартной поддерживающей терапией [10].
3.2 Хирургическое лечение болезни Крона у детей
Прогрессирующее течение заболевания приводит к развитию кишечных осложнений у каждого второго больного за десятилетний период наблюдения, кроме того, до 90% пациентов с БК подвергаются в течение жизни одной или нескольким операциям [187. Невозможность радикального излечения БК нередко приводит к повторным вмешательствам, увеличивая риск синдрома короткой кишки [188].
Современная стратегия хирургического лечения БК направлена на выполнение экономных резекций кишки, применение малоинвазивных методик и органосохраняющих вмешательств [189]. Оперативное вмешательство может изменить течение заболевания у детей с БК, которые растут физически и интеллектуально, поэтому решение о хирургическом лечении должно быть принято после тщательного рассмотрения показаний и оценки целесообразности операции [10].
3.2.1 Показания к хирургическому лечению БК у детей
· Показаниями к хирургическому лечению являются острые и хронические кишечные осложнения БК, а также неэффективность консервативной терапии с задержкой физического развития [10,190,191,192,193].
(УУР – С, УДД - 4)
· Рекомендовано селективное применение хирургического лечения у детей с БК в препубертатном и пубертатном возрасте, при наличии задержки физического развития (с задержкой костного возраста за 6-12-месячный период) после оптимизации медикаментозной терапии и нутритивной поддержки [194].
(УУР –С, УДД -5)
Комментарии: О неэффективности консервативной терапии свидетельствует наличие гормональной зависимости и резистентности; кроме того, проявлением неадекватной лекарственной терапии также может являться задержка физического развития [10, 1, 195]. У детей с тяжелым течением БК, при неэффективности консервативного лечения, особенно в препубертатном или пубертатном возрасте, либо с задержкой роста и локальным поражением кишечника, может быть полезным выполнение резекции кишки для обеспечения практически здорового интервала в 2-3 года[196], и в этих случаях первичный кишечный анастомоз обычно безопасен [197].
Острые осложнения БК.
К ним относят кишечное кровотечение, перфорацию кишки и токсическую дилатацию ободочной кишки
· Рекомендуется экстренное хирургическое вмешательство пациентам с БК, осложненной перфорацией кишечника с перитонитом, а также при профузном кишечном кровотечении [194, 198].
(УУР –С, УДД -5)
Комментарии:
· При кишечном кровотечении экстренное хирургическое вмешательство показано в случае массивной кровопотери, на фоне проведения адекватной медикаментозной терапии БК, при ухудшении состояния или отсутствии положительной динамики в течение 24-48 часов, несмотря на интенсивную гемостатическую терапию и заместительные гемотрансфузии эритроцитарной массы (у детей важными критериями продолжающегося кишечного кровотечения являются - учащенный более 6 раз в сутки стул с примесью крови, примесь крови в стуле более 10-15% объема циркулирующей крови, тахикардия, снижение гемоглобина менее 80 г/л) [199].
· В случае кишечного кровотечения при БК выполняют резекцию тонкой кишки для интерпозиции, с наложением энтеро-энтероанастомоза, или резекцию пораженного участка кишечника и формирование стомы, включая илеостомию, экономную резекцию кишки с наложением анастомоза и/или формированием кишечной стомы; кроме того, с целью выявления дополнительных источников кровотечения, желательно проведение интраоперационной эзофагогастроинтестиноскопии и видеоколоноскопии [200].
· Перфорация тонкой кишки в свободную брюшную полость является достаточно редким осложнением и обычно возникает в области патологического участка кишки со стриктурой [201].
· При клинико-рентгенологических признаках перитонита (абдоминальный болевой синдром, положительные симптомы раздражения брюшины, свободный газ в брюшной полости - по данным обзорной рентгенографии органов брюшной полости) показано экстренное хирургическое вмешательство, которое в данной ситуации может быть ограничено резекцией пораженного отдела кишки с формированием стомы или анастомоза. В случае экстренной операции рекомендуется избегать формирования первичного кишечного анастомоза без наложения превентивной кишечной стомы.
· Перфорация толстой кишки при БК встречается крайне редко, операцией выбора является резекция ободочной кишки с формированием стомы [202].
· Рекомендуется пациентам с токсической дилатацией ободочной кишки (токсическим мегаколоном) при неэффективности интенсивной консервативной специфической и симптоматической терапии в течение 24-48 часов, проведение хирургического вмешательства - илеостомии с отключением толстой кишки, либо субтотальной колэктомии с илеостомией, резекции ободочной кишки, лапароскопической резекции толстой кишки, резекции ободочной кишки с формированием стомы [203].
(УУР –С, УДД -5).
Комментарий: Токсическая дилатация ободочной кишки (токсический мегаколон) является редким осложнением при БК толстой кишки и представляет собой не связанное с обструкцией расширение кишки на фоне симптомов интоксикации [204]. По данным обзорной рентгенографии органов брюшной полости отмечают увеличение диаметра поперечной ободочной кишки: у взрослых пациентов более 60мм в диаметре, у детей старше 11 лет - более 55мм, младше 11 лет - более 40мм. К факторам риска токсической дилатации относятся гипокалиемия, гипомагниемия, подготовка кишки к колоноскопии при помощи осмотических слабительных средств, применение Противодиарейных, кишечных противовоспалительных и противомикробных препаратов (антидиарейных препаратов). О развитии токсической дилатации толстой кишки свидетельствует вздутие живота, резкое сокращение частоты стула на фоне ранее имевшейся диареи, а также внезапное уменьшение или исчезновение болей в животе с нарастанием симптомов интоксикации (появление тахикардии, артериальной гипотонии, фебрилитета) [203].
Хронические кишечные осложнения.
Хронические осложнения БК включают стриктуры кишки, внутрибрюшные инфильтраты и абсцессы, внутренние или наружные кишечные свищи, наличие дисплазии эпителия высокой степени - неоплазии [1,194,205 .].
3.2.2 Хирургическое лечение БК в форме терминального илеита или илеоколита
БК в детском возрасте часто представлена более тяжелыми осложненными формами, чем у взрослых, непредсказуемым прогнозом, и нередко приводит к необратимым изменениям не только в результате естественного течения заболевания, но и вследствие перенесенных хирургических вмешательств [32,206,207]. Вероятность повторной резекции кишечника у детей с БК составляет до 29% в течение 10 лет после первого вмешательства [208].
К факторам, достоверно повышающим необходимость в хирургическом лечении БК, относятся: курение; пенетрирующий и стриктурирующий фенотип БК; раннее использование гормональной терапии; поражение подвздошной и тощей кишки и начало заболевания в раннем возрасте [209].
· Рекомендуется пациентам с осложненной формой БК при формировании стриктуры подвздошной кишки или илеоцекального клапана проведение хирургического вмешательства - резекция илеоцекального угла с наложением анастомоза тонкой кишки в толстую кишку [197.].
(УУР –С, УДД -4)
· Хирургическое лечение рекомендуется как предпочтительный вариант для пациентов с ограниченной илеоцекальной БК, с симптомами кишечной непроходимости, но без значительно выраженного активного воспаления [210]
(УУР – С, УДД – 5)
· Рекомендуется наложение анастомоза тонкой кишки в толстую кишку сшивающим аппаратом по типу "бок-в-бок" (функциональный - "конец-в-конец") [211]
(УУР – С; УУР -5)
Комментарий: При стриктурирующем фенотипе илеоцекальной БК формируется стриктура терминального отдела подвздошной кишки или илеоцекальной области [212]. Выявленное супрастенотическое расширение подвздошной кишки более чем на 3см в диаметре у детей с БК, значительно ассоциировано с необратимыми фиброзными изменениями кишки и может являться показанием к хирургическому вмешательству [213, 214.]. Предпочтительной методикой формирования тонко-толстокишечного анастомоза является наложение анастомоза по типу "конец-в-конец" или аппаратного анастомоза по типу «бок-в-бок», что уменьшает вероятность его несостоятельности и последующего развития стриктуры анастомоза [215].
· Лапароскопический доступ рекомендовано считать предпочтительным для выполнения илеоцекальных резекций у детей с БК, как минимально инвазивного вмешательства, с хорошим косметическим результатом, более ранним восстановлением в послеоперационном периоде и коротким пребыванием в стационаре [216, 217, 218].
(УУР – С, УДД -3).
· При более сложных вариантах БК (с межкишечными свищами, внутрибрюшным абсцессом, проксимальной стриктурой кишки) или при повторной кишечной резекции, лапароскопический доступ, как метод первого выбора, может быть рекомендован только в тех учреждениях, где хирурги имеют достаточный опыт проведения подобных операций [219].
(УУР –С, УДД -5)
Комментарий: при отсутствии инфильтрата и абсцесса предпочтительней выполнение хирургического вмешательства на тонкой кишке и илеоцекальной зоне лапароскопическим способом [220,221,222]. Лапароскопические вмешательства в последнее десятилетие получили большое распространение у детей и взрослых пациентов с БК, как минимальная инвазивная процедура, с хорошим косметическим результатом, более ранним восстановлением в послеоперационном периоде и коротким пребыванием в стационаре [216,223]. После лапароскопических операций реже возникают такие осложнения, как спаечная непроходимость и раневая инфекция, однако частота послеоперационного рецидива БК сравнима с открытыми вмешательствами [224,225,226,227].
· Рекомендуется при осложненном течении БК с образованием стриктур тощей или подвздошной кишки, включая стриктуры анастомоза после предшествовавшей операции, альтернативой кишечной резекции выполнение органосохраняющих операций - рассечение рубцовых стриктур тонкой кишки (и стриктуропластика), позволяющих избежать обширных резекций тонкой кишки [194,228,229].
(УУР –В, УДД -3)
Комментарий: при коротких стриктурах не более 6-7 см длиной наиболее общепринятой методикой является стриктуропластика по Хайнеке-Микуличу (продольное рассечение кишки в области стриктуры с поперечным анастомозом), при стриктурах кишки длиной 10-25 см используют методику Финнея (наложение широкого анастомоза по типу "бок-в-бок" на петле кишки со стриктурой), а в случае более протяженного поражения - операцию Мичеласси (пересечение кишки проксимальнее стриктуры и создание кишечного анастомоза по типу "бок-в-бок" по всей длине измененного участка) [230]. Противопоказаниями к стриктуропластике являются инфильтраты, абсцессы, злокачественные новообразования кишки или активное кровотечение и выраженное воспаление в области пораженного участка [228].
· Рекомендуется детей с активной БК тонкой кишки при выявлении внутрибрюшного абсцесса у лечение начинать с антибактериальной терапии препаратами широкого спектра действия в соответствии с локальными данными о резистентности микрофлоры [32,231], чрескожного или оперативного дренирования абсцесса (вскрытие и дренирование флегмоны (абсцесса), резекция тонкой кишки для интерпозиции, наложение энтеро-энтероанастомоза, илеостомия, энтеростомия), с последующей отсроченной резекцией кишки при необходимости [232,233].
(УУР С, УДД -4)
Комментарии: наименования услуг: вскрытие и дренирование флегмоны (абсцесса), резекция тонкой кишки для интерпозиции, наложение энтеро-энтероанастомоза, илеостомия, энтеростомия).
При БК осложненной формированием внутрибрюшного абсцесса требуется назначение антибактериальной терапии, а также проведение дренирования абсцесса или резекции пораженного участка кишки [232,233], дополнительно к противомикробным препаратам системного действия и дренированию абсцесса должна быть усилена специфическая противовоспалительная терапия БК, снижена доза кортикостероидов системного действия (а также рассмотреть отмену глюкокортикоидов для местного применения (группа АТХ A07EA) в предоперационном периоде), проведена оптимизация энтерального питания. Внутрибрюшные абсцессы у детей с БК в 90% случаев могут быть успешно дренированы чрескожным доступом [32,234]. У пациентов с абсцессами, которые не могут быть дренированы (менее 2см в диаметре), должны использоваться максимальные дозы антибактериальных препаратов системного действия. Радикальное оперативное вмешательство показано в случае внутрибрюшных абсцессов, невосприимчивых к комбинации антимикробной и специфической терапии БК и невозможности проведения дренирования [235].
· Рекомендуется пациентам с БК, осложненной межкишечными и кишечно-пузырными свищами, хирургическое лечение - разобщение тонкокишечных свищей, иссечение пузырно-кишечного свища, с резекцией тонкой кишки для интерпозиции с наложением энтеро-энтероанастомоза [ 236.].
(УУР –С, УДД -5)
Комментарий: При выявлении межкишечных или кишечно-пузырных свищей у пациентов с БК основной целью является разобщение свища с ограниченной резекцией кишечного сегмента, несущего свищ, сохраняющей длину кишки [189]. Оперативное вмешательство следует рассмотреть у пациентов с межкишечными свищами если они сочетаются с внутрибрюшным абсцессом и/или кишечной стриктурой, а также если у пациентов выражена диарея и синдром мальабсорбции [32,188,237]
· Рекомендуется пациенту с БК с клинической картиной острого аппендицита, при ревизии брюшной полости и выявлении макроскопически неизмененного червеобразного отростка и терминального илеита, воздержаться от выполнения аппендэктомии, а также резекции кишки [238].
(УУР –С, УДД -3)
Комментарий: дебют БК в виде терминального илеита может протекать под маской острого аппендицита, что приводит к госпитализации пациента в стационар общехирургического профиля и нередко к аппендэктомии и неоправданной резекции пораженного отдела подвздошной кишки [239].
3.2.3. Хирургическое лечение БК толстой кишки
· Рекомендуется пациентам с ограниченным поражением толстой кишки проведение резекции пораженного сегмента с формированием кишечного анастомоза в пределах здоровых тканей. У пациентов с распространенной БК толстой кишки с тяжелыми клиническим проявлениями, операцией выбора рекомендуется субтотальная колэктомия с наложением одноствольной илеостомы (илеостомия). У пациентов с поражением двух различных отделов толстой кишки рекомендованы две сегментарные резекции толстой кишки (например, Лапароскопическая резекция толстой кишки) [211,240].
(УУР –А , УДД -2).
Комментарии: пациентам с поражением двух различных отделов толстой кишки две сегментарные резекции толстой кишки (например, Лапароскопическая резекция толстой кишки) – проводятся по решению врача исходя из клинической ситуации.
· Не рекомендуются пациентам с локализацией стриктуры в толстой кишке выполнение рассечения рубцовых стриктур толстой кишки (стриктуропластики) в связи с недостаточной эффективностью [230].
(УУР –С, УДД -2).
Комментарии: Ограниченное поражение толстой кишки при БК (менее трети ободочной кишки) не требует проведения колэктомии [217]. При выявлении стриктуры восходящей ободочной кишки возможно выполнение правосторонней гемиколэктомии с наложением анастомоза тонкой кишки в толстую кишку. При поражении поперечно-ободочного или нисходящего отдела толстой кишки выполняется резекция измененного участка ободочной кишки с наложением трансверзосигмоанастомоза. При левостороннем поражении выполняется резекция левых отделов с формированием колоректального анастомоза - левосторонняя гемиколэктомия. При выявлении непротяженной стриктуры толстой кишки возможно выполнение эндоскопической дилатации стриктуры [241], однако данная манипуляция связана с более высоким риском рецидива заболевания по сравнению с резекцией пораженного участка кишечника [242].
· Рекомендовано пациентам с тяжелым активным колитом и неэффективностью медикаментозного лечения - наложение отводящей илеостомы [243].
(УУР – С, УДД -4).
Комментарии: Операция «отключения» транзита кишечного содержимого по толстой кишке путем формирования илеостомы показана только у крайне истощенных пациентов на фоне тяжелого активного колита [220]. Данный вид хирургического лечения является временным [244]. Хирургическое вмешательство возможно безопасно выполнить с использованием лапароскопической техники [221,245].
· Рекомендуется пациентам с тотальным поражением толстой кишки и неэффективностью консервативной терапии в качестве операции выбора селективное проведение колэктомии с илеостомией. с последующим формированием илео-ректального анастомоза в случае сохранности структуры прямой кишки и отсутстия клинически значимого перианального поражения [211].
(УУР –С , УДД -5).
Комментарий: при вовлечении в патологический процесс всей ободочной кишки, при минимальной активности воспалительных изменений в прямой кишке, с адекватной функцией анального сфинктера и отсутствии перианальных поражений, возможно формирование илео-ректоанастомоза [206]. Проведение колэктомии в пубертатном периоде улучшает физическое развитие подростков с тяжелой рефрактерной БК толстой кишки [246]. Возможность формирования тонкокишечного резервуарного анастомоза при БК толстой кишки является спорной, учитывая высокий риск осложнений и частую необходимость удаления резервуара в связи с развитием перианальных поражений и БК резервуара [247].
3.2.4 Хирургическое лечение БК с поражением верхних отделов ЖКТ
Вовлечение в воспалительный процесс верхних отделов ЖКТ у детей с БК встречается чаще, чем у взрослых (до 30%), является хорошо известной фенотипической особенностью детского возраста [17,248] и обусловливает неблагоприятный прогноз, особенно при стриктурирующем фенотипе [194].
Поражение верхних отделов ЖКТ при БК встречается чаще у детей, чем у взрослых, но потребность в хирургическом вмешательстве не увеличивается.
· Рекомендуется пациентам с БК, осложненной стриктурой верхних отделов ЖКТ, рассмотреть проведение эндоскопической баллонной дилатации стриктуры или формирование обходного анастомоза (при локализации стриктуры в 12-перстной кишке), выполнение рассечения рубцовых стриктур (стриктуропластики) или резекции пораженного участка (при локализации стриктуры в тонкой кишке).
· В качестве хирургического лечения БК с поражением верхних отделов ЖКТ рекомендовано проведение эндоскопической баллонной дилатации стриктуры или формирование обходного анастомоза тонкой кишки (при локализации стриктуры в 12-перстной кишке), выполнение рассечения рубцовых стриктур тонкой кишки (стриктуропластики) или резекции пораженного участка (при локализации стриктуры в тонкой кишке), [194,249,250].
(УУР – С, УДД -5)
Комментарий: прибегать к формированию обходного тонкокишечного анастомоза на изолированной петле следует лишь в исключительных случаях (например, при стриктурах двенадцатиперстной кишки) из-за высокого риска развития синдрома избыточного бактериального роста в отключенной части тонкой кишки и малигнизации [251]. Стриктуры гастродуоденальной зоны (как правило, 12-перстной кишки) поддаются баллонной дилатации [250]. Также эффективным является выполнение стриктуропластики при коротких стриктурах тонкой кишки менее 10 см длиной [230,252]. Обширные резекции способствуют формированию синдрома короткой кишки [253].
3.2.5 Лечение БК с перианальными поражениями
Перианальные поражения развиваются у 13-67% детей, могут встречаться при любой локализации БК [284] и представлены гипертрофированными кожными подвесками (воспаленными анальными бахромками), анальными трещинами, параректальными абсцессами и свищами, стенозами ануса и прямой кишки [285]. У 10-12% детей с БК перианальные поражения являются первыми проявлениями заболевания [286].
До настоящего времени нет консенсуса по классификации параректальных свищей при БК. В клинической практике большинство экспертов используют упрощенную классификацию параректальных свищей с разделением на простые или сложные.
В последние годы в стратегию лечения пациентов с перианальными поражениями при БК были внесены изменения, сопряженные с новыми целями:
1. использовать простые эффективные процедуры;
2. минимизировать боль;
3. отдавать предпочтение паллиативной помощи против агрессивного хирургического вмешательства [285].
В клинической практике большинство хирургов используют упрощенную классификацию параректальных свищей у пациентов с болезнью Крона с разделением на простые или сложные, в зависимости от локализации свищевого хода по отношению к сфинктеру и наличию множественных ходов и параректальных затеков и полостей. В 2022 году опубликован консенсус экспертов по модифицированной классификации перианальной фистулизирующей БК у взрослых, которая выделяет четыре группы пациентов со стратификацией в соответствии с тяжестью заболевания, а также исходом после операций. Кроме того, к каждому конкретному классу прилагается предложение по стратегии лечения и клиническим испытаниям [287].
· Рекомендуется при БК с перианальными поражениями назначать ингибиторы фактора некроза опухоли альфа (биологические анти-ФНО) препараты, в качестве первой линии терапии при индукции ремиссии и поддержании ремиссии в комбинации с антибактериальной терапией или хирургической коррекцией [10].
(УУР – С, УДД - 5).
Комментарий: учитывая высокую эффективность биологической терапии при надлежащем дренировании сложных свищей оправдано раннее назначение анти-ФНО терапии [10,288].
· Рекомендуется визуализировать перианальные поражения перед началом хирургического вмешательства. Осмотр под анестезией с проведением дренирования абсцесса является обязательным в лечении сложных свищей с целью оптимизации терапии [211,289.].
(УУР –С, УДД - 5).
· Не рекомендуется пациентам с трещинами анального канала проводить хирургическое вмешательство. Рекомендуется консервативное лечение - противовоспалительная терапия БК и местная терапия препаратами группы «Антисептики и дезинфицирующие средства» (растворами антисептиков) [290, 291].
(УУР –С, УДД -5).
Комментарии: подход к хирургическому вмешательству на перианальной области должен быть индивидуален для каждого пациента [292, 293, 294].
· Не рекомендуется девочкам с бессимптомными низкими ректо-вагинальными (ректо-вестибулярных) свищах хирургическое лечение вследствие того, что при данных состояниях обычно эффективна консервативная терапия [211, 295].
(УУР –С, УДД -5).
Комментарии: при наличии низкого свища между прямой кишкой и преддверием влагалища возможно проведение консервативного лечения [295]. Спонтанного закрытия ректо-вестибулярных свищей не происходит. При наличии клинической симптоматики возможно оперативное лечение под прикрытием отводящей стомы или без наложения стомы [296].
· Рекомендуется пациентам с параректальными свищами и абсцессами выполнение их дренирования (с установкой дренажей хирургических (латексных дренажей-сетонов) [297].
(УУР –С, УДД -5).
Комментарии: во многих клинических рекомендациях по лечению перианальной БК отмечена важная роль мануальной ревизии промежности под наркозом ("exam under anesthesia"), которая является не только ценным диагностическим мероприятием (т.н. "золотым стандартом" в руках опытного хирурга), но и может сопровождаться хирургическим вмешательством - вскрытием и дренированием парапроктита, с проведением дренирующей непересекающей лигатуры, т.н. дренажа хирургического - дренажа-сетона [276, 298,299].
Симптоматические простые перианальные свищи требуют лечения. Размещение дренирующей лигатуры в сочетании с антибиотиками (#метронидазол** 10-20 мг/кг/день перорально в 3 приема и #ципрофлоксацин** 20 мг/кг/день перорально в 2 приема [80]) является предпочтительной стратегией [300].
· При наличии у ребенка сложной перианальной БК, после адекватного хирургического дренирования, рекомендовано использование #инфликсимаба** или адалимумаба** (#адалимумаба**) (дозировки подробнее – см. в п.п.3.1.2.4) в качестве терапии первой линии. Комбинация #ципрофлоксацина** 20 мг/кг/день перорально в 2 приема [80] и ингибиторов фактора некроза опухоли альфа (ФНО-альфа) улучшает краткосрочные результаты. Для усиления эффекта в комплексном лечении сложной перианальной БК можно использовать комбинацию ингибиторов фактора некроза опухоли альфа (ФНО-альфа) с тиопуринами [57].
(УУР – С, УДД - 5).
· Рекомендовано пациентам со сложными перианальными свищами, особенно с активной БК прямой кишки, с высокой частотой приводящих к развитию гнойно-септических осложнений, отключение пассажа кишечного отделяемого по толстой кишке путем формирования двуствольной илеостомы [221, 301, 302].
(УУР –С, УДД -4).
Комментарии: прекращение пассажа по кишечнику не приводит к заживлению свища (только уменьшает симптоматику), но позволяет с успехом оперировать в условиях "отключенной" толстой кишки.
· Рекомендовано пациентам при отсутствии воспаления в дистальном отделе толстой кишки селективное выполнение низведения слизисто-мышечного лоскута прямой кишки с пластикой внутреннего свищевого отверстия с лечебной целью [217, 289, 303, 304.].
(УУР –С, УДД -4).
Комментарий: показания рассматриваются индивидуально, в зависимости от клинической ситуации.
· Рекомендуется пациентам с БК с выраженной активностью воспалительного процесса в прямой кишке и неэффективностью консервативной терапии, наложение кишечной стомы с отсроченной резекцией прямой кишки (резекция и формирование стомы), как крайней мерой оперативного лечения [305]
(УУР – С, УДД -4).
Комментарии: наличие стриктуры нижне-ампулярного отдела прямой кишки или стеноза анального канала является наиболее неблагоприятным фактором, повышающим вероятность формирования постоянной кишечной стомы [306,307]. Формирование постоянной стомы у детей с перианальными поражениями потребовалось в 10% случаев по данным ретроспективного объединенного обзора из двух центров [308]. В большинстве случаев данные осложнения требуют выполнения резекции прямой кишки [309]. В отдельных ситуациях, при отсутствии активного воспаления в вышележащих отделах кишки, возможно использование малоинвазивных способов коррекции дистальных стриктур, включающих инъекции кортикостероидов системного действия и ингибиторов фактора некроза опухоли альфа (ФНО-альфа)в область стриктуры, использование баллонной дилатации, бужирование стриктуры расширителями Гегара (при стриктуре анального канала до зубчатой линии), до более травматичных хирургических методов, таких как стриктуропластика (услуга отсутствует в действующей Номенклатуре) или резекция прямой кишки [285, 310].
3.2.6. Медикаментозная и нутритивная поддержка в периоперационный период
Прием преднизолона** в суточной дозе более 20 мг в течение более шести недель до операции является значительным фактором риска для хирургических осложнений [254,255].
Комментарии: в значительной степени изучено влияние предоперационной консервативной терапии БК на послеоперационные хирургические осложнения [256]. Напротив, тиопурины можно безопасно использовать в периоперационный период, отмены препарата до операции не требуется [257,258]. В то время как лечение ингибиторами фактора некроза опухоли альфа (ФНО-альфа) до операции может увеличивать частоту послеоперационных осложнений. Недавние исследования и мета-анализы показали повышенный риск развития послеоперационного сепсиса, раневых инфекций, внутрибрюшных абсцессов и несостоятельности анастомоза у пациентов с БК [259,260,261,262,263]. Сочетание терапии кортикостероидами системного действия и ингибиторами фактора некроза опухоли альфа (ФНО-альфа)повышает риск послеоперационных осложнений [254.]
· Рекомендовано пациентам с потерей 10% массы тела или более в течение 6-месячного периода проводить предоперационную нутритивную поддержку путем парентерального питания с целью снижения вероятности развития осложнений. [264].
(УУР –С , УДД -5).
Комментарии: Недостаточное питание является значительным фактором риска послеоперационных осложнений, включая несостоятельность анастомоза, поскольку адекватное питание обеспечивает трофические свойства тканей, помогая заживлению ран [265]. Потеря 10% массы тела или более в течение 6-месячного периода, считается выраженным дефицитом веса, сопровождается задержкой физического развития. Уровень сывороточного альбумина не является основным маркером нарушения нутритивного статуса, так как уровень альбумина может зависеть от множества факторов, включая острый или хронический сепсис; в дополнение к уровню альбумина следует использовать другие показатели и инструментальные оценки [266, 267].
3.2.7 Противорецидивная терапия после хирургического лечения БК.
Риск рецидива симптомов через 1 год после хирургического лечения достигает 20-37%, а через 3 года после резекции – 43-86% [268,269, 270]
Факторами риска послеоперационного рецидива у пациентов с БК являются курение, предшествующая резекция кишки, генетические маркеры, перфорирующее течение БК, протяженность поражения (>40см тонкой кишки), перианальные поражения, две и более резекции кишки в анамнезе и короткая продолжительность болезни перед первой операцией [224,271,272].
Эндоскопические маркеры рецидива появляются раньше симптомов обострения [273].
· Рекомендовано спустя 6-12 месяцев после хирургического лечения всем оперированным пациентам с БК проведение контрольного эндоскопического обследования (колоноскопия с илеоскопией, эзофагогастродуоденоскопия) с оценкой активности воспалительных изменений в области анастомоза по шкале Rutgeerts (Приложение Г3) [10].
(УУР - С; УДД – 5)
Комментарий: Наличие выраженных эндоскопических признаков воспаления (i2-4) свидетельствует о высоком риске повторного хирургического вмешательства и является основанием для эскалации терапии [274,275].
· Для выработки тактики ведения пациента, подвергшегося оперативному вмешательству при невозможности визуализировать зону анастомоза рекомендуется констатировать наличие или отсутствие рецидива, основываясь на сочетании данных инструментальных методов (МРТ-энтерографии, видеокапсульной эндоскопии, УЗИ кишечника (тонкой кишки, толстой кишки, сигмовидной и прямой кишки)) и неинвазивных маркеров воспаления - исследование уровня C-реактивного белка в сыворотке крови, исследование уровня кальпротектина в кале и др. [276,277, 278].
(УУР –А; УДД – 1)
· Рекомендуется раннее начало терапии после хирургического лечения с целью предотвращения рецидива [10].
(УУР – С, УДД – 5)
· Рекомендуется раннее начало терапии после хирургического лечения с целью предотвращения рецидива: в течение 4 недель после оперативного вмешательства. Пациентам с высоким риском рецидива (i2-4) показано назначение анти-ФНО терапии [10].
(УУР – С, УДД – 5)
Комментарии:
· #инфликсимаб** или адалимумаб** (дозировки и режим см. п.п. 3.1.2.4) имеют, приблизительно, одинаковую эффективность [279].
· Пациентам, ранее не получавшим анти-ФНО терапию, для предотвращения послеоперационного рецидива могут быть назначены тиопурины.
· Если до хирургического вмешательства пациент получал анти-ФНО терапию, то она может быть продолжена после операции.
· В случае выявления эндоскопических признаков рецидива (i2-4) у пациентов, получающих тиопурины, необходима эскалация терапии (назначение ингибиторов фактора некроза опухоли альфа (ФНО-альфа
· Назначение месалазина** (по инструкции применение таблеток, покрытых кишечнорасторимой оболочкой ограничено к применению у детей возрастом до 3 лет, применение препарата в виде гранул показано детям, начиная с 6-летнего возраста) и антибактериальных препаратов системного действияв незначительно снижает риск рецидива после хирургического лечения [280, 281, 282].
· В дальнейшем, вне зависимости от характера течения заболевания и клинической манифестации БК, следует не реже раза в 1-3 года выполнять контрольное эндоскопическое исследование, следуя этому же алгоритму выбора противорецидивной терапии [283].
3.4 Иные методы лечения
· Рекомендована детям с БК посильная физическая нагрузка с целью улучшения тонуса, повышения качества жизни [311, 312].
(УДД – С, УУР -4)
Комментарий: имеются также данные о вероятном положительном влиянии физической активности на минеральную плотность костей у детей с ВЗК [312].
4. Реабилитация
Дети с болезнью Крона, как правило, нуждаются в социальной и психологической реабилитации [313]. А также в нутритивной поддержке при белково-энергетической недостаточности.
В настоящее время нет доказательств достаточного уровня для выбора методики реабилитации при слабости и утомляемости, характерных для пациентов с БК [314].
Болезнь Крона в детском возрасте противопоказана для санаторно-курортного лечения.
5. Профилактика
5.1. Профилактика
5.1.1 Профилактика заболевания
Не существует
5.1.2 Вакцинация детей с БК
Воспалительные заболевания кишечника – состояния, которые характеризуются повышенным риском присоединения и/или реактивации различных инфекций, особенно подвержены риску пациенты на иммуносупрессивной терапии, а также имеющие хронические заболевания (например, диабет, хроническая болезнь почек, ВИЧ-инфекция, первичный иммунодефицит), а также нарушения нутритивного статуса.
Стратегиями по нивелированию рисков для пациента признаны своевременная диагностика инфекций и вакцинация [315, 316, 317].
· Рекомендовано пациентам с БК, при диагностике заболевания оценить вакцинальный статус, риск заражения и последствия перенесённой инфекции с целью определения необходимости и вида вакцинации [318, 315].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: также следует уточнить, переносил ли пациент ранее вакцинопредотвратимые инфекции (например, корь, краснуха, ветряная оспа, эпидемический паротит и др.). В дальнейшем в ходе наблюдения и лечения следует регулярно мониторировать вакцинальный статус пациента.
· Рекомендовано пациентам с БК проведение вакцинации в соответствии с национальным календарем профилактических прививок с целью предотвращения/уменьшения вероятности тяжелого (осложненного) течения инфекций, с учетом периода заболевания и получаемой терапии [319, 315, 316, 317, 320].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарий: пациентам, не получающим иммуносупрессивную терапию (таблица 2), могут применяться любые вакцины в соответствии инструкцией (инактивированные и живые). Пациентам, получающим иммуносупрессивную терапию не назначаются вакцины (живые).
В настоящее время нет однозначных данных об оптимальном интервале до возможности применения вакцин (живых) после завершения иммуносупрессивной терапии.
Согласно [Методическим указаниям МУ 3.3.1.1095—02. «Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок»], дозой кортикостероидов системного действия, вызывающей иммуносупрессию, является для преднизолона** 2 мг/кг/сут, принимаемой в течение 14 дней и более; введение вакцин (живых) этим пациентам допускается через 1 месяц и более после окончания терапии. Использование такой дозы в течение менее 2 недель или меньших доз в течение более длительного периода не ведет к развитию выраженной иммуносупрессии, так что введение живых вакцин возможно сразу по окончании курса лечения. Использование поддерживающих доз глюкокортикоидов, а также ингаляционное, местное или внутрисуставное их применение не является противопоказанием к введению любых вакцин».
Вакцины (живые) могут быть назначены не ранее, чем через 1-3 мес. после завершения иммуносупрессивной терапии [315, 316, 320]. В случае применения высоких доз глюкокортикоидов – интервал после окончания лечения и возможностью введения вакцин (живых) может составлять до 6 месяцев в зависимости от инструкции к препарату [315].
Необходимую иммунизацию с использованием вакцин (живых) следует, при возможности, проводить до старта иммуносупрессивной терапии. В ином случае, иммунизация может быть продолжена при установлении контроля над заболеванием, при необходимости его поддержания – на фоне назначения базисной терапии, строгого соблюдения диетологических и других рекомендаций гастроэнтеролога. Иммуносупрессивное лечение может быть начато не ранее, чем через 3-4 недели после введения вакцин (живых). [315, 316].
У ряда пациентов с воспалительными заболеваниями кишечника сохраняется риск недостаточного иммунного ответа после проведения стандартной схемы вакцинации, в связи с чем возможно рассмотреть проведение выборочного контроля напряженности иммунитета не ранее, чем через 1 месяц после завершенной вакцинации (например, после вакцины для профилактики вирусного гепатита B** - Определение антител к поверхностному антигену (anti-HBs) вируса гепатита В (Hepatitis В virus) в крови, количественное исследование) с последующим введением бустерной дозы вакцины при отсутствии защитных титров антител [315, 316, 321].
Таблица 2 Перечень лекарственных препаратов, применяемых в терапии ВЗК, в зависимости от наличия иммуносупрессивного действия
|
Обладающие иммуносупрессивным действием |
|
Глюкокортикоиды (преднизолон**, метилпреднизолон**, #будесонид**) |
|
Азатиоприн** |
|
#Меркаптопурин** |
|
#Такролимус** |
|
#Циклоспорин** |
|
#Инфликсимаб** (включая биосимиляры)(дозировки и режим см. п.п. 3.1.2.4) |
|
Адалимумаб** (включая биосимиляры)(дозировки и режим см. п.п. 3.1.2.4) |
|
#Голимумаб** |
|
#Устекинумаб** |
|
#Тофацитиниб** |
|
#Упадацитиниб** |
|
Не обладающие иммуносупрессивным действием |
|
Аминосалициловая кислота** |
|
Сульфасалазин** |
|
#Ведолизумаб**1 |
Примечание: 1 Ведолизумаб не включен в список препаратов, обладающих иммуносупрессивным действием, поскольку обладает селективным действием на кишечник, тем не менее, согласно инструкции, в очень редких случаях могут возникать инфекционные осложнения
Особо высок у пациентов с ВЗК риск тяжелого течения инфекций, вызванных пневмококком, вирусами гриппа, гепатита В, кори, краснухи, эпидемического паротита, ветряной оспы.
· Вакцинацию против пневмококковой инфекции пациентам с БК с профилактической целью рекомендовано проводить последовательно, начиная с однократной дозы ПКВ13 наиболее широкой валентности с последующим введением ППВ23 с минимальным интервалом 8 недель. Повторная вакцинация предусмотрена с применением ППВ23 через 5 лет [316].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
· Рекомендовано пациентам с БК проведение ежегодной вакцинации против гриппа при подготовке к сезону гриппа с применением вакцин (инактивированных) с профилактической целью [315, 316]. .
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
· Рекомендовано пациентам с БК перед назначением иммуносупрессивной терапии при отсутствии подтверждения перенесенной инфекции или выполненной вакцинации против гепатита В, ветряной оспы, кори, краснухи и эпидемического паротита проведение соответствующей вакцинации [315,316]. .
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: вакцинация проводится в соответствии с инструкциями
5.2 Диспансерное наблюдение
В связи с прогрессирующим характером заболевания пациенты, страдающие БК, должны получать постоянную (пожизненную терапию) и проходить регулярный (пожизненный) мониторинг активности заболевания. Контроль активности заболевания позволяют не только инструментальные методы исследования, но и лабораторные методы анализа маркеров воспаления, в первую очередь, уровня фекального кальпротектина, концентрация которого в стуле коррелирует со степенью активности воспалительного процесса в кишечнике.
Периодичность и объем диспансерного наблюдения определяется индивидуально, но у большинства пациентов целесообразно придерживаться следующего:
· Рекомендовано для детей с БК, в среднем, каждые 3 месяца - диспансерный прием (осмотр, консультация) врача-гастроэнтеролога и/или диспансерный прием (осмотр, консультация) врача-педиатра с полным объективным исследованием, включая перианальную область, оценка физического и полового развития, общий (клинический) анализ крови развернутый, исследование уровня СРБ, определение уровня фекального кальпротектина [8].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: если ребенок наблюдается в стационаре – осмотры и исследования не дублируются. При отсутствии
· Не рекомендовано рутинное (ежегодное) эндоскопическое исследование при отсутствии клинических показаний (сомнений в диагнозе, необходимости исключения сопутствующих состояний, нарастания клинических проявлений, подозрений на осложнения, необходимости контроля после оперативного лечения) в большинстве случаев не проводится [8].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
· При ухудшении состояния, нарастании уровня маркеров воспаления (С-реактивного белка, фекального кальпротектина) детям с БК рекомендовано выполнять (илео)колоноскопию для оценки активности заболевания [8].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: проводится в стационарных условиях
· Необходимо полное обследование, включая эндоскопическое, патолого-анатомическое (гистологическое), лабораторное, при переходе подростка с БК во взрослую сеть для дальнейшего наблюдения [8].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: проводится в стационарных условиях
6. Организация оказания медицинской помощи
Пациентам с БК, в зависимости от необходимости, может быть оказана медицинская помощь любого вида, условия, формы, предусмотренных законодательством Российской Федерации.
Первичная специализированная медико-санитарная помощь оказывается врачом-гастроэнтерологом, врачом-колопроктологом/врачом-детским хирургом и иными врачами-специалистами.
Для диагностики БК пациент, в большинстве случаев, направляется в стационар.
При подозрении и (или) выявлении у пациента БК в ходе оказания ему скорой медицинской помощи таких пациентов переводят или направляют в стационар для определения тактики ведения и необходимости применения дополнительно других методов специализированного лечения, включая проведение таргетной биологической терапии и хирургического лечения.
Специализированная, в том числе высокотехнологичная, медицинская помощь при БК оказывается врачами-гастроэнтерологами, врачами-колопроктологами/врачами-детскими хирургами.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную медицинскую помощь при БК определяются врачом-гастроэнтерологом и/или врачом-колопроктологом (врачом-детским хирургом) и/или врачом-инфекционистом и др.
Показанием для госпитализации пациента в медицинскую организацию в экстренной или неотложной форме является:
1. наличие осложнений БК, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2. наличие осложнений лечения БК (хирургическое вмешательство, биологическая терапия, гормональная и цитостатическая терапия и т.д.).
Показанием для госпитализации в медицинскую организацию в плановой форме является:
1. необходимость выполнения сложных инвазивных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2. наличие показаний к специализированному лечению БК (хирургическое вмешательство, гормональная и иммуносупрессивная терапия, биологическая и таргетная терапия), требующему наблюдения в условиях круглосуточного или дневного стационара.
Организация диетического питания пациентов при стационарном лечении в медицинских организациях проводится в соответствии с Приложением 3 приказа Минздрава России от 23.09.2020 № 1008н «Об утверждении порядка обеспечения пациентов лечебным питанием».
Показанием к выписке пациента из медицинской организации является:
1. завершение курса лечения, или одного из этапов оказания специализированной, в том числе высокотехнологичной медицинской помощи, в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2. отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной медицинской помощи в условиях круглосуточного или дневного стационара,;
3. необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам или телемедицинской консультации и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация
7.1 Исходы и прогноз
Прогностически неблагоприятными факторами при БК являются курение, дебют заболевания в детском возрасте, перианальные поражения, пенетрирующий фенотип заболевания и распространенное поражение тонкой кишки. С ребенком/законными представителями следует провести профилактическую беседу о вреде табакокурения. С пациентом - курильщиком в обязательном порядке должна быть проведена беседа о необходимости прекращения табакокурения, в том числе, электронных сигарет.
Ранняя диагностика, адекватное ведение и лечение пациентов улучшает исходы и прогноз при БК у детей.
Критерии оценки качества медицинской помощи
Критерии оценки качества специализированной медицинской помощи детям при болезни Крона (коды по МКБ - 10: K50)
|
№ п/п |
Критерии оценки качества |
Оценка выполнения |
|
1. |
Выполнена эзофагогастродуоденоскопия и/или колоноскопия (с проведением илеоскопии) (при установлении диагноза или через 6-12 месяцев после хирургического лечения) |
Да/Нет |
|
2. |
Выполнена биопсия пищевода с помощью эндоскопии и/или биопсия желудка с помощью эндоскопии, и/или биопсия двенадцатиперстной кишки с помощью эндоскопии, и/или биопсия тонкой кишки эндоскопическая, и/или биопсия ободочной кишки эндоскопическая, и/или биопсия сигмовидной кишки с помощью видеоэндоскопических технологий, и/или биопсия прямой кишки с помощью видеоэндоскопических технологий (при установлении диагноза) |
Да/Нет |
|
3. |
Выполнено исследование кала на наличие токсина клостридии диффициле (Clostridium difficile) или иммунохроматографическое экспресс-исследование кала на токсины A и B клостридии (Clostridium difficile), или молекулярно-биологическое исследование фекалий на возбудителя диффициального клостридиоза (Clostridium difficile) (при остром начале диареи и/или при недавно проведенном курсе антибиотикотерапии или пребывании в стационаре) |
Да/Нет |
|
4. |
Проведено лечение кортикостероидами для местного применения и/или кортикостероидами системного действия, и/или метотрексатом, и/или азатиоприном, или меркаптопурином, или инфликсимабом, или адалимумабом, или устекинумабом, или ведолизумабом (при индукции или поддержании ремиссии, в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний) |
Да/Нет |
|
5. |
Выполнен прием (осмотр, консультация) врача-детского хирурга первичный (в случае стриктурирующего, пенетрирующего или абсцедирующего течения болезни Крона, при перианальных поражениях, при определении показаний к хирургическому лечению) |
Да/Нет |
Список литературы
1. Шелыгин Ю.А., Ивашкин В.Т., Ачкасов С.И., и соавт. Клинические рекомендации. Болезнь Крона (К50), взрослые. Колопроктология. 2023; 22(3): 10-49. https://doi.org/10.33878/2073-7556-2023-22-3-10-49.
2. Azevedo V, et al. Biosimilars: considerations for clinical practice. Considerations Med 2017;1:13–18.
3. Гущина Ю.Ш., Зырянов С.К., Орлихина И.А. Клинические и фармакоэкономические аспекты изменения анти-ФНО терапии по немедицинским причинам // Качественная клиническая практика. – 2017. – №2. – С. 35-48.
4. Franke A. Genome-wide meta-analysis increases to 71 the number of confermed Crohn’s disease susceptibility loci – Nature genet., 2010, v.42, p.1118-1125.
5. Maloy K.J., Powrie F. Intestinal homeostasis and its breakdown in inflammatory bowel disease – Nature insight, 2011, v.474, No7351, p.298-306.
6. Strober W., Fuss I., Mannon P. The fundamental basis of inflammatory bowel disease – J. Clin. Investigation, 2007, v.117 (3), p.514-521.
7. Langholz E., Munkholm P., Krasilnikoff P.A. Inflammatory bowel disease with onset in childhood. Clinical features, morbidity and mortality in a regional cohort. – Scand.J. Gastroenterol., 1997, v.32, p.139-147.
8. Корниенко, Е.А. Воспалительные заболевания кишечника у детей / Е.А. Корниенко // М.: Прима Принт. - 2019. - 228 с.: ил. - ISBN 978-5-60442241-1-3.
9. Benchimol EI, Fortinsky KJ, Gozdyra P, Van den Heuvel M, Van Limbergen J, Griffiths AM. Epidemiology of pediatric inflam¬matory bowel disease: a systematic review of international trends. Inflamm Bowel Dis. 2011;17(1):423-39.
10. van Rhenen PF, Aloi M, Assa A, Bronsky J, Escher JC, Fagerberg UL, Gasparetto M, Gerasimidis K, Griffiths A, Henderson P, Koletzko S, Kolho KL, Levine A, van Limbergen J, Martin de Carpi FJ, Navas-López VM, Oliva S, de Ridder L, Russell RK, Shouval D, Spinelli A, Turner D, Wilson D, Wine E, Ruemmele FM. The Medical Management of Paediatric Crohn's Disease: an ECCO-ESPGHAN Guideline Update. J Crohns Colitis. 2020 Oct 7:jjaa161. doi: 10.1093/ecco-jcc/jjaa161. Epub ahead of print. PMID: 33026087.
11. Bernstein C., et al. WHO global guidelines on Inflammatory Bowel Disease - Guidelines for the Diagnosis and Management of IBD in 2010. Inflamm Bowel Dis. 2010 Jan; 16:112–124. doi:10.1002/ibd.21048.
12. Van Limbergen J, Russell RK, Drummond HE, Aldhous MC, Round NK, Nimmo ER, et al. Definition of phenotypic characteristics of childhood-onset inflammatory bowel disease. Gastroenterology 2008; 135(4):1114-22.
13. Vernier-Massouille G, Balde M, Salleron J, Turck D, Dupas JL, Mouterde O, et al. Natural history of pediatric Crohn's disease: a population-based cohort study. Gastroenterology 2008; 135(4): 1106-13.
14. Pigneur B, Seksik P, Viola S, Viala J, Beaugerie L, Girardet JP, et al. Natural history of Crohn's disease: comparison between childhood- and adult-onset disease. Inflamm Bowel Dis 2010; 16(6):953-61.
15. Horsthuis K., Bipat S., Bennink R.J., Stoker J. Inflammatory bowel disease diagnosed with US, MR, scintigraphy, and CT: metaanalysis of prospective studies. Radiology. - 2008;247(1):64-79.
16. Чашкова Е.Ю., Владимирова А.А., Неустроев В.Г. и соавт. Воспалительные заболевания толстой кишки - аспекты диагностики. Бюллетень Восточно-Сибирского научного центра СО РАМН. - 2011. - № 4-2. - с.209-221.
17. Levine A., Koletzko S., Turner D., et al. ESPGHAN revised Porto criteria for the diagnosis of inflammatory bowel disease in children and adolescents – J.Pediatric Gasroenterol Nutr., 2014, v.58 (6), p.795-806.
18. Waugh N, Cummins E, Royle P, Kandala NB, Shyangdan D, Arasaradnam R, et al. Faecal calprotectin testing for differentiating amongst inflammatory and non-inflammatory bowel diseases: systematic review and economic evaluation. Health Technol Assess 2013;17:xv–xix, 1–211.
19. Däbritz J, Gerner P, Enninger A, Claßen M, Radke M. Inflammatory Bowel Disease in Childhood and Adolescence. Dtsch Arztebl Int. 2017 May 12;114(19):331-338,
20. Oliveira SB, Monteiro IM. Diagnosis and management of inflammatory bowel disease in children. BMJ. 2017 May 31;357:j2083
21. Hestvik, E., Tumwine, J.K., Tylleskar, T. et al. Faecal calprotectin concentrations in apparently healthy children aged 0-12 years in urban Kampala, Uganda: a community-based survey. BMC Pediatr 11, 9 (2011). https://doi.org/10.1186/1471-2431-11-9
22. Campeotto F, Butel MJ, Kalach N, Derrieux S, Aubert-Jacquin C, Barbot L, Francoual C, Dupont C, Kapel N: High faecal calprotectin concentrations in newborn infants. Arch Dis Child Fetal Neonatal Ed. 2004, 89 (4): F353-355. 10.1136/adc.2002.022368.
23. Mack DR, Langton C, Markowitz J, LeLeiko N, Griffiths A, Bousvaros A, Evans J, Kugathasan S, Otley A, Pfefferkorn M, Rosh J, Mezoff A, Moyer S, Oliva-Hemker M, Rothbaum R, Wyllie R, delRosario JF, Keljo D, Lerer T, Hyams J, Pediatric Inflammatory Bowel Disease Collaborative Research Group Pediatrics. 2007;119(6):1113.).
24. Kumar S, Pollok R, Goldsmith D. Renal and Urological Disorders Associated With Inflammatory Bowel Disease. Inflamm Bowel Dis. 2023 Aug 1;29(8):1306-1316
25. Waters AM, Zachos M, Herzenberg AM, Harvey E, Rosenblum ND. Tubulointerstitial nephritis as an extraintestinal manifestation of Crohn's disease. Nat Clin Pract Nephrol. 2008 Dec;4(12):693-7
26. Lee WS, Arai K, Alex G, Treepongkaruna S, Kim KM, Choong CL, Mercado KC, Darma A, Srivastava A, Aw MM; APPSPGHAN PIBD Working Group. Management and monitoring of pediatric inflammatory bowel disease in the Asia-Pacific region: A position paper by the Asian Pan-Pacific Society for Pediatric Gastroenterology, Hepatology, and Nutrition (APPSPGHAN) PIBD Working Group: Surgical management, disease monitoring, and special considerations. J Gastroenterol Hepatol. 2023 Apr;38(4):510-522. doi: 10.1111/jgh.16084
27. Matowicka-Karna J. Markers of inflammation, activation of blood platelets and coagulation disorders in inflammatory bowel diseases. Postepy Hig Med Dosw (Online). 2016 Apr 13;70:305-12.
28. Dai Y, Zhang Q, Olofson AM, Jhala N, Liu X. Celiac Disease: Updates on Pathology and Differential Diagnosis. Adv Anat Pathol. 2019 Sep;26(5):292-312. doi: 10.1097/PAP.0000000000000242.
29. Mårild K, Söderling J, Lebwohl B, Green PHR, Pinto-Sanchez MI, Halfvarson J, Roelstraete B, Olén O, Ludvigsson JF. Association of Celiac Disease and Inflammatory Bowel Disease: A Nationwide Register-Based Cohort Study. Am J Gastroenterol. 2022 Sep 1;117(9):1471-1481. doi: 10.14309/ajg.0000000000001834
30. Yuan S, Kim JH, Xu P, Wang Z. Causal association between celiac disease and inflammatory bowel disease: A two-sample bidirectional Mendelian randomization study. Front Immunol. 2023 Jan 4;13:1057253. doi: 10.3389/fimmu.2022.1057253
31. Ghishan FK, Kiela PR. Vitamins and Minerals in Inflammatory Bowel Disease. Gastroenterol Clin North Am. 2017 Dec;46(4):797-808.
32. Pfeferkorn MD, Marshalleck FE, Saeed SA, et al. NASPGHAN Clinical Report on the Evaluation and Treatment of Pediatric Patients With Internal Penetrating Crohn Disease: Intraabdominal Abscess With and Without Fistula. JPGN 2013; 57:394–400. doi: 10.1097/MPG.0b013e31829ef8.
33. Chen H, Liu Y, Fu L, Lin X, Fan D, Li C. Clinical utility of double-balloon enteroscopy in children: A single-centre experience in South China. J Paediatr Child Health. 2019 Feb;55(2):188-193.
34. UchidaK, Yoshiyama S, Inoue M, Koike Y, Yasuda H, Fujikawa H, Okita Y, Araki T, Tanaka K, Kusunoki M. Double balloon enteroscopy for pediatric inflammatory bowel disease. Pediatr Int. 2012 Dec;54(6):806-9.
35. MaltzR, Podberesky DJ, Saeed SA Imaging modalities in pediatric inflammatory bowel disease. Curr Opin Pediatr. 2014;26(5):590-6.
36. Crohn Disease Workup Author: Leyla J Ghazi, MD; Chief Editor: Praveen K Roy, MD et.al. https://emedicine.medscape.com/article/172940-workup#c11 Updated: Jul 26, 2019
37. Sturm , Maaser C, Calabrese E, eta al. ECCO-ESGAR Guideline for Diagnostic Assessment in IBD Part 2: IBD scores and general principles and technical aspects. J Crohns Colitis. 2019 Mar 26;13(3):273-284. doi: 10.1093/ecco-jcc/jjy114. PMID: 30137278.
38. Oliva S, Thomson M, de Ridder L, Martín-de-Carpi J, Van Biervliet S, Braegger C, Dias JA, Kolacek S, Miele E, Buderus S, Bronsky J, Winter H, Navas-López VM, Assa A, Chong SKF, Afzal NA, Smets F, Shaoul R, Hussey S, Turner D, Cucchiara S. Endoscopy in Pediatric Inflammatory Bowel Disease: A Position Paper on Behalf of the Porto IBD Group of the European Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2018 Sep;67(3):414-430.
39. Magline D. D., Sandrasegaran K., Chiorean M., Dewitt J. et al. Radiologic investigations complement and add diagnostic information to capsule endoscopy of small-bowel diseases Am. J. Roentgenol. 2007. Vol. 189. N 2. P. 306–312.
40. Spada C., Riccioni M. E., Costamagna G. Patients with known small bowel stricture or with symptoms of small bowel obstructionsecondary to Crohn’s disease should not perform video capsule endoscopy without being previously tested for small bowel patency // Am. J. Gastroenterol. 2007. Vol. 102. N 7. P. 1542–1543.
41. Kopylov U, et al. Diagnostic yield of capsule endoscopy versus magnetic resonance enterography and small bowel contrast ultrasound in the evaluation of small bowel Crohn’s disease: Systematic review and meta-analysis. Dig Liver Dis 2017;49:854–63.
42. Podgórka J., Pacho R., Albrecht P. MR enterography imaging of Crohn’s disease in pediatric patients. Pol J Radiol, 2014; 79: 79-87 doi:10.12659/PJR.889760.
43. Hijaz NM, Attard TM, Colombo JM, Mardis NJ, Friesen CA. Comparison of the use of wireless capsule endoscopy with magnetic resonance enterography in children with inflammatory bowel disease. World J Gastroenterol 2019; 25(28): 3808-3822. DOI:10.3748/wjg.v25.i28.3808.
44. Hwang JY, Yoon HK, Kim WK, Cho YA, Lee JS, Yoon CH, Lee YJ, Kim KM. Transperineal ultrasonography for evaluation of the perianal fistula and abscess in pediatric Crohn disease: preliminary study. Ultrasonography. 2014 Jul;33(3):184-90. doi: 10.14366/usg.14009..
45. Аносов И.С., Нанаева Б.А., Варданян А.В., Захаров М.А. Перианальные свищи при болезни Крона (обзор литературы). Колопроктология. 2023; т. 22, № 1, с. 128–137. https://doi.org/10.33878/2073-7556-2023-22-1-128-137
46. de Zoten EF, Pasternak BA, Mattei P, et al. Diagnosis and Treatment of Perianal Crohn Disease: NASPGHAN Clinical Report and Consensus Statement. JPGN. 2013 Sep; 57:401–412. doi: 10.1097/MPG.0b013e3182a025ee.
47. Kolara M., Pilkingtona M., Winthropa A., MacDonalda H., Justinichb C., Soboleskic D., Slyc L., Hurlbut D. Free intestinal perforation in children with Crohn's disease. Journal of Pediatric Surgery Case Reports 32 (2018) 5–10. doi:10.1016/j.epsc.2018.01.002.
48. Sakka D, Cheung MS. Management of primary and secondary osteoporosis in children. Ther Adv Musculoskelet Dis. 2020 Nov 2;12:1759720X20969262.
49. Herzog D, Bishop N, Glorieux F, Seidman EG Interpretation of bone mineral density values in pediatric Crohn's disease Inflamm Bowel Dis. 1998;4(4):261-7.
50. Gokhale R, Favus MJ, Karrison T, Sutton MM, Rich B, Kirschner BS,. Bone mineral density assessment in children with inflammatory bowel disease. Gastroenterology. 1998;114(5):902-11.
51. Maratva K, Hradsky O, Matyskova J, Copova I, Soucek O, Sumnik Z, Bronsky J. Musculoskeletal system in children and adolescents with inflammatory bowel disease: normal muscle force, decreased trabecular bone mineral density and low prevalence of vertebral fractures. Eur J Pediatr. 2017 Oct;176(10):1355-1363.
52. Magro F, Langner C, Driessen A, Ensari A, Geboes K, Mantzaris GJ, Villanacci V, Becheanu G, Borralho Nunes P, Cathomas G, Fries W, Jouret-Mourin A, Mescoli C, de Petris G, Rubio CA, Shepherd NA, Vieth M, Eliakim R; European Society of Pathology (ESP); European Crohn's and Colitis Organisation (ECCO). European consensus on the histopathology of inflammatory bowel disease. J Crohns Colitis. 2013 Nov;7(10):827-51. doi: 10.1016/j.crohns.2013.06.001. Epub 2013 Jul 17. PMID: 23870728
53. Feakins RM; British Society of Gastroenterology. Inflammatory bowel disease biopsies: updated British Society of Gastroenterology reporting guidelines. J Clin Pathol. 2013 Dec;66(12):1005-26. doi: 10.1136/jclinpath-2013-201885. Epub 2013 Sep 2. PMID: 23999270.
54. Goodhand J, Dawson R, Hefferon M, Tshuma N, Swanson G, Wahed M, Croft NM, Lindsay JO. Inflammatory bowel disease in young people: the case for transitional clinics. Inflamm Bowel Dis. 2010 Jun;16(6):947-52. doi: 10.1002/ibd.21145
55. Birimberg-Schwartz L, Zucker DM, Akriv A, Cucchiara S, Cameron FL, Wilson DC, Lazowska I, Yianni L, Paul SP, Romano C, Kolacek S, Buderus S, Pærregaard A, Russell RK, Escher JC, Turner D; Pediatric IBD Porto group of ESPGHAN. Development and Validation of Diagnostic Criteria for IBD Subtypes Including IBD-unclassified in Children: a Multicentre Study From the Pediatric IBD Porto Group of ESPGHAN. J Crohns Colitis. 2017 Sep 1;11(9):1078-1084. doi: 10.1093/ecco-jcc/jjx053. PMID: 2843089.
56. Uhlig HH, Charbit-Henrion F, Kotlarz D, Shouval DS, Schwerd T, Strisciuglio C, de Ridder L, van Limbergen J, Macchi M, Snapper SB, Ruemmele FM, Wilson DC, Travis SPL, Griffiths AM, Turner D, Klein C, Muise AM, Russell RK; Paediatric IBD Porto group of ESPGHAN. Clinical Genomics for the Diagnosis of Monogenic Forms of Inflammatory Bowel Disease: A Position Paper From the Paediatric IBD Porto Group of European Society of Paediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2021 Mar 1;72(3):456-473. doi: 10.1097/MPG.0000000000003017..
57. Ruemmele FM, Veres G, Kolho KL, Griffiths A, Levine A, Escher JC, et al; European Crohn's and Colitis Organisation; European Society of Pediatric Gastroenterology,Hepatology and Nutrition. Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn's disease. J Crohns Colitis. 2014 Oct;8(10):1179-207. DOI: 10.1016/j.crohns.2014.04.005.
58. Miele E, Shamir R, Aloi M, Assa A, Braegger C, Bronsky J, et al. Nutrition in Pediatric Inflammatory Bowel Disease: A Position Paper on Behalf of the Porto Inflammatory Bowel Disease Group of the European Society of Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2018 Apr;66(4):687-708. DOI: 10.1097/MPG.0000000000001896.
59. Хавкин АИ, Сорвачёва ТН, Рославцева ЕА. Патогенетическое обоснование диетотерапии болезни Крона у детей. Экспериментальная и клиническая гастроэнтерология. 2021;186(2):94-105. DOI: 10.31146/1682-8658-ecg-186-2-94-105.
60. Hartman C, Berkowitz D, Weiss B, Shaoul R, Levine A, Adiv OE, Shapira R, Fradkin A, Wilschanski M, Tamir A, Shamir R. (2008) Isr Med Assoc J. 10(7):503-7. Nutritional supplementation with polymeric diet enriched with transforming growth fac tor-beta 2 for children with Crohn’s disease.
61. Levine A, Wine E, Assa A, Sigall Boneh R, Shaoul R, Kori M, Cohen S, Peleg S, Shamaly H, On A, Millman P, Abramas L, Ziv-Baran T, Grant S, Abitbol G, Dunn KA, Bielawski JP, Van Limbergen J. Crohn's Disease Exclusion Diet Plus Partial Enteral Nutrition Induces Sustained Remission in a Randomized Controlled Trial. Gastroenterology. 2019 Aug;157(2):440-450.e8. doi: 10.1053/j.gastro.2019.04.021. Epub 2019 Jun 4.
62. Brown ACV, Rampertab SD Mullin GE. Existing dietary guidelines for Crohn’s disease and ulcerative colitis. Expert Rev. Gastroenterol. Hepatol. 2011. 5(3), 411–425
63. Ford AC, Bernstein CN, Khan KJ, Abreu MT, Marshall JK, Talley NJ, et al. Glucocorticosteroid therapy in inflammatory bowel disease: systematic review and meta-analysis. Am J Gastroenterol 2011;106(4):590-9 [quiz 600].
64. Escher JC. Budesonide versus prednisolone for the treatment of active Crohn's disease in children: a randomized, double-blind, controlled, multicentre trial. Eur J Gastroenterol Hepatol 2004;16(1):47-54.
65. Levine A, Weizman Z, Broide E, Shamir R, Shaoul R, Pacht A, et al. A comparison of budesonide and prednisone for the treatment of active pediatric Crohn disease. J Pediatr Gastroenterol Nutr 2003;36(2):248-52.
66. Markowitz J, Grancher K, Kohn N, Lesser M, Daum F. A multicenter trial of 6-mercaptopurine and prednisone in children with newly diagnosed Crohn's disease. Gastroenter¬ology 2000; 119(4):895-902.
67. Berni Canani R, Terrin G, Borrelli O, Romano MT, Manguso F, Coruzzo A, et al. Short- and long-term therapeutic efficacy of nutritional therapy and corticosteroids in paediatric Crohn's disease. Dig Liver Dis 2006;38(6):381-7.
68. TungJ, Loftus Jr EV, Freese DK, El-YoussefM, Zinsmeister AR, Melton III LJ, et al. A population-based study of the frequency of corticosteroid resistance and dependence in pediatric patients with Crohn's disease and ulcerative colitis. Inflamm Bowel Dis 2006;12(12):1093-100.
69. Byron MA, Jackson J, Ansell BM. Effect of different corticoste¬roid regimens on hypothalamic-pituitary-adrenal axis and growth in juvenile chronic arthritis. J R Soc Med 1983;76(6): 452-7.
70. Modigliani R, Mary JY, Simon JF, Cortot A, Soule JC, Gendre JP, et al. Clinical, biological, and endoscopic picture of attacks of Crohn's disease. Evolution on prednisolone Groupe d'Etude Therapeutique des Affections Inflammatoires Digestives. Gas¬troenterology 1990;98(4):811-8.
71. Borrelli O, Cordischi L, Cirulli M, Paganelli M, Labalestra V, Uccini S, et al. Polymeric diet alone versus corticosteroids in the treatment of active pediatric Crohn's disease: a random¬ized controlled open-label trial. Clin Gastroenterol Hepatol 2006;4(6):744-53.
72. Mantzaris GJ, Christidou A, Sfakianakis M, Roussos A, Koilakou S, Petraki K, et al. Azathioprine is superior to budesonide in achieving and maintaining mucosal healing and histologic remission in steroid-dependent Crohn's disease. Inflamm Bowel Dis 2009;15(3):375-82.
73. Jakobsen C, Munkholm P, Paerregaard A, Wewer V. Steroid dependency and pediatric inflammatory bowel disease in the era of immunomodulators—a population-based study. Inflamm Bowel Dis 2011; 17(8):1731 -40.
74. Levine A, Kori M, Dinari G, Broide E, Shaoul R, Yerushalmi B, et al. Comparison of two dosing methods for induction of response and remission with oral budesonide in active pediatric Crohn's disease: a randomized placebo-controlled trial. Inflamm Bowel Dis 2009; 15(7):1055-61.
75. Dilger K, AlbererM, Busch A, Enninger A, Behrens R, Koletzko S, et al. Pharmacokinetics and pharmacodynamic action of budesonide in children with Crohn's disease. Aliment Pharmacol Ther 2006;23(3):387-96.
76. Huscher D, Thiele K, Gromnica-Ihle E, HeinG, DemaryW, Dreher R, et al. Dose-related patterns of glucocorticoid-induced side effects. Ann Rheum Dis 2009;68(7):1119-24.
77. Cohen SA, Aloi M, Arumugam R, Baker R, Bax K, Kierkuś J, Koletzko S, Lionetti P, Persson T, Eklund S. Enteric-coated budesonide for the induction and maintenance of remission of Crohn's disease in children. Curr Med Res Opin. 2017 Jul;33(7):1261-1268. doi: 10.1080/03007995.2017.1313213. Epub 2017 Apr 19. PMID: 28420280
78. Greenley RN, Stephens KA, Nguyen EU, Kunz JH, Janas L, Goday P, Schurman JV. Vitamin and mineral supplement adherence in pediatric inflammatory bowel disease. J Pediatr Psychol. 2013 Sep;38(8):883-92. doi: 10.1093/jpepsy/jst037. Epub 2013 Jul 1. PMID: 23818680/
79. Gawronska A, Banasiuk M, Lachowicz D, Pituch H, Albrecht P, Banaszkiewicz A. Metronidazole or Rifaximin for Treatment of Clostridium difficile in Pediatric Patients with Inflammatory Bowel Disease: A Randomized Clinical Trial. Inflamm Bowel Dis. 2017 Dec;23(12):2209-2214.
80. Lahad A, Weiss B. Current therapy of pediatric Crohn's disease. World J Gastrointest Pathophysiol. 2015 May 15;6(2):33-42. doi: 10.4291/wjgp.v6.i2.33. PMID: 25977836
81. Barabino A, Torrente F, Ventura A, Cucchiara S, Castro M, Barbera C. Azathioprine in paediatric inflammatory bowel disease: an Italian multicentre survey. Aliment Pharmacol Ther 2002;16(6):1125-30.
82. Jaspers GJ, Verkade HJ, Escher JC, de Ridder L, Taminiau JA, Rings EH. Azathioprine maintains first remission in newly diagnosed pediatric Crohn's disease. Inflamm Bowel Dis 2006;12(9):831-6.
83. Ramadas AV, Gunesh S, Thomas GA, Williams GT, Hawthorne AB. Natural history of Crohn's disease in a population-based cohort from Cardiff (1986-2003): a study of changes in medical treatment and surgical resection rates. Gut 2010;59(9):1200-6.
84. Peyrin-Biroulet L, Oussalah A, Williet N, Pillot C, Bresler L, Bigard MA. Impact of azathioprine and tumour necrosis factor antagonists on the need for surgery in newly diagnosed Crohn's disease. Gut 2011;60(7):930-6.
85. CosnesJ, BourrierA, Laharie D, Nahon S, BouhnikY, Carbonnel F, et al. Early administration of azathioprine vs conventional management of Crohn's Disease: a randomized controlled trial. Gastroenterology 2013;145(4):758-65 [e2; quize14-5].
86. Panes J, Lopez-Sanroman A, Bermejo F, Garcia-Sanchez V, Esteve M, Torres Y, et al. Early azathioprine therapy is no more effective than placebo for newly diagnosed Crohn's disease. Gastroenterology 2013;145(4):766-74 [e1].
87. Colombel JF, Sandborn WJ, Reinisch W, Mantzaris GJ, Kornbluth A, Rachmilewitz D, et al. Infliximab, azathioprine, or combination therapy for Crohn's disease. N Engl J Med 2010;362(15):1383-95.
88. Fuentes D, Torrente F, Keady S, Thirrupathy K, Thomson MA, Walker-Smith JA, et al. High-dose azathioprine in children with inflammatory bowel disease. Aliment Pharmacol Ther 2003;17(7):913-21.
89. Gearry RB, Barclay ML, Burt MJ, Collett JA, Chapman BA. Thiopurine drug adverse effects in a population of New Zealand patients with inflammatory bowel disease. Pharmacoepidemiol Drug Saf 2004; 13(8):563-7.
90. Hindorf U, Lindqvist M, Hildebrand H, Fagerberg U, Almer S. Adverse events leading to modification of therapy in a large cohort of patients with inflammatory bowel disease. Aliment Pharmacol Ther 2006;24(2):331-42.
91. Kirschner BS. Safety of azathioprine and 6-mercaptopurine in pediatric patients with inflammatory bowel disease. Gastro¬enterology 1998; 115(4):813-21.
92. Lichtenstein GR, Feagan BG, Cohen RD, Salzberg BA, Diamond RH, Price S, et al. Serious infection and mortality in patients with Crohn's disease: more than 5 years of follow-up in the TREAT registry. Am J Gastroenterol 2012;107(9):1409-22.
93. Baldassano R, Colletti RB, Cucchiara S, DubinskyM, Escher JC, Faubion WA, et al. 41 serious infections and associated risk factors in patients receiving infliximab and immunotherapies for children with inflammatory bowel disease: develop registry data. Gastroenterology 2013;144(5 Suppl 1):S-11.
94. Ledder OD, Lemberg DA, Ooi CY, Day AS. Are thiopurines always contraindicated after thiopurine-induced pancreatitis in inflammatory bowel disease? J Pediatr Gastroenterol Nutr 2013;57(5):583-6.
95. Dubinsky MC, Yangf H, Hassard§ PV, Seidmanll EG, Kam LY, Abreu MT, et al. 6-MP metabolite profiles provide a biochemical explanation for 6-MP resistance in patients with inflammatory bowel disease. Gastroenterology 2002; 122(4): 904-15.
96. Ansari A, Hassan C, Duley J, Marinaki A, Shobowale-Bakre EM, Seed P, et al. Thiopurine methyltransferase activity and the use of azathioprine in inflammatory bowel disease. Aliment Pharmacol Ther 2002;16(10):1743-50.
97. Kandiel A, Fraser AG, Korelitz BI, Brensinger C, Lewis JD. Increased risk of lymphoma among inflammatory bowel disease patients treated with azathioprine and 6-mercaptopurine. Gut 2005; 54(8):1121 -5.
98. Camus M, Seksik P, Bourrier A, Nion-Larmurier I, Sokol H, Baumer P, et al. Long-term outcome of patients with Crohn's disease who respond to azathioprine. Clin Gastroenterol Hepatol 2013; 11 (4):389-94.
99. Ashworth LA, Billett A, Mitchell P, Nuti F, Siegel C, Bousvaros A. Lymphoma risk in children and young adults with inflam¬matory bowel disease: analysis of a large single-center cohort. Inflamm Bowel Dis 2012;18(5):838-43.
100. Colletti RB, Cucchiara S, Dubinsky M, Escher JC, Faubion WA, Fell J, et al. 833 malignancies in children receiving infliximab and other inflammatory bowel disease therapies: an inflam-matory bowel disease multicenter, prospective, long-term registry of pediatric patients (develop) registry data. Gastro¬enterology 2013;144(5, Supplement 1):S-147.
101. Kotlyar DS, Osterman MT, Diamond RH, Porter D, Blonski WC, Wasik M, et al. A systematic review of factors that contribute to hepatosplenic T-cell lymphoma in patients with inflamma-tory bowel disease. Clin Gastroenterol Hepatol 2011;9(1): e1-e41.
102. Peyrin-Biroulet L, Khosrotehrani K, Carrat F, Bouvier AM, Chevaux JB, Simon T, et al. Increased risk for nonmelanoma skin cancers in patients who receive thiopurines for inflam-matory bowel disease. Gastroenterology 2011; 141 (5): 1621-8 [e1-5].
103. Singh H, Nugent Z, Demers AA, Bernstein CN. Increased risk of nonmelanoma skin cancers among individuals with inflam¬matory bowel disease. Gastroenterology 2011; 141 (5): 1612-20.
104. van Schaik FD, van Oijen MG, Smeets HM, van der Heijden GJ, Siersema PD, Oldenburg B. Thiopurines prevent advanced colorectal neoplasia in patients with inflammatory bowel disease. Gut 2012;61(2):235-40.
105. Boyle BM, Kappelman MD, Colletti RB, Baldassano RN, Milov DE, Crandall WV. Routine use of thiopurines in maintaining remission in pediatric Crohn's disease. World J Gastroenterol. 2014 Jul 21;20(27):9185-90. doi: 10.3748/wjg.v20.i27.9185
106. Jeong TJ, Kim ES, Kwon Y, Kim S, Seo SW, Choe YH, Kim MJ. Discontinuation of Azathioprine could be considered in pediatric patients with Crohn's disease who have sustained clinical and deep remission. Sci Rep. 2022 Jan 11;12(1):507. doi: 10.1038/s41598-021-04304-6. PMID: 35017546; PMCID: PMC8752804
107. Lennard L. Assay of 6-thioinosinic acid and 6-thioguanine nucleotides, active metabolites of 6-mercaptopurine, in human red blood cells. J Chromatogr. 1987 Dec 25;423:169-78
108. Dervieux T, Boulieu R. Simultaneous determination of 6-thioguanine and methyl 6-mercaptopurine nucleotides of azathioprine in red blood cells by HPLC. Clin Chem. 1998 Mar;44(3):551-5.
109. Turner D, Grossman AB, Rosh J, Kugathasan S, Gilman AR, Baldassano R, et al. Methotrexate following unsuccessful thiopurine therapy in pediatric Crohn's disease. Am J Gastroenterol 2007;102(12):2804-12 [quiz 3, 13].
110. Uhlen S, Belbouab R, Narebski K, Goulet O, Schmitz J, Cezard JP, et al. Efficacy of methotrexate in pediatric Crohn's disease: a French multicenter study. Inflamm Bowel Dis 2006; 12(11): 1053-7.
111. Boyle B, Mackner L, Ross C, Moses J, Kumar S, Crandall W. A single-center experience with methotrexate after thiopurine therapy in pediatric Crohn disease. J Pediatr Gastroenterol Nutr 2010;51(6):714-7.
112. Mack DR, Young R, Kaufman SS, Ramey L, Vanderhoof JA. Methotrexate in patients with Crohn's disease after 6-mercaptopurine. J Pediatr 1998;132(5):830-5.
113. Ravikumara M, Hinsberger A, Spray CH. Role of methotrexate in the management of Crohn disease. J Pediatr Gastroenterol Nutr 2007;44(4):427-30.
114. Weiss B, Lerner A, Shapiro R, Broide E, Levine A, Fradkin A, et al. Methotrexate treatment in pediatric Crohn disease patients intolerant or resistant to purine analogues. J Pediatr Gastroenterol Nutr 2009;48(5):526-30.
115. Willot S, Noble A, Deslandres C. Methotrexate in the treatment of inflammatory bowel disease: an 8-year retrospective study in a Canadian pediatric IBD center. Inflamm Bowel Dis 2011;17(12):2521-6.
116. Laharie D, Reffet A, Belleannee G, Chabrun E, Subtil C, Razaire S, et al. Mucosal healing with methotrexate in Crohn's disease: a prospective comparative study with azathioprine and infliximab. Aliment Pharmacol Ther 2011;33(6):714-21.
117. Hashkes PJ, Becker ML, Cabral DA, Laxer RM, Paller AS, Rabinovich CE, et al. Methotrexate: new uses for an old drug. J Pediatr 2014;164:231-6.
118. Kempinska A, Benchimol EI, Mack A, Barkey J, Boland M, Mack DR. Short-course ondansetron for the prevention of methotrexate-induced nausea in children with Crohn disease. J Pediatr Gastroenterol Nutr 2011;53(4):389-93.
119. Athos Bousvaros MD, Barbara S. Kirschner MD, Steven L. Werlin MD, Lorraine Parker-Hartigan RN, Fredric Daum MD, Katherine B. Freeman MD, Jane P. Balint MD, Andrew S. Day MB, ChB, FRACP, Anne M. Griffiths MD, David Zurakowski PhD, George D. Ferry MD, Alan M. Leichtner MD Oral tacrolimus treatment of severe colitis in children The Journal of Pediatrics Volume 137, Issue 6, December 2000, Pages 794-799
120. Hyams J, Crandall W, Kugathasan S, Griffiths A, Olson A, Johanns J, et al. Induction and maintenance infliximab therapy for the treatment of moderate-to-severe Crohn's disease in children. Gastroenterology 2007;132(3):863-73 [quiz 1165-6].
121. Kugathasan S, Werlin SL, Martinez A, Rivera MT, Heikenen JB, Binion DG. Prolonged duration of response to infliximab in early but not late pediatric Crohn's disease. Am J Gastroenterol 2000;95(11): 3189-94.
122. Hyams JS, Griffiths A, Markowitz J, Baldassano RN, Faubion Jr WA, Colletti RB, et al. Safety and efficacy of adalimumab for moderate to severe Crohn's disease in children. Gastroenter-ology 2012; 143(2):365-74 [e2].
123. Rosh JR, Lerer T, Markowitz J, Goli SR, Mamula P, Noe JD, et al. Retrospective Evaluation of the Safety and Effect of Adalimumab Therapy (RESEAT) in pediatric Crohn's disease. Am J Gastroenterol 2009;104(12):3042-9.
124. Crandall W, Hyams J, Kugathasan S, Griffiths A, Zrubek J, Olson A, et al. Infliximab therapy in children with concurrent perianal Crohn disease: observations from REACH. J Pediatr Gastroenterol Nutr 2009;49(2):183-90.
125. Teitelbaum JE, Saeed S, Triantafyllopoulou M, Daum F. Infliximab in pediatric Crohn disease patients with enterovesicular fistulas. J Pediatr Gastroenterol Nutr 2007;44(2):279-82.
126. Present DH, Rutgeerts P, Targan S, Hanauer SB, Mayer L, van Hogezand RA, et al. Infliximab for the treatment of fistulas in patients with Crohn's disease. N Engl J Med 1999;340(18): 1398-405.
127. Panaccione R, Loftus Jr EV, Binion D, McHugh K, Alam S, Chen N, et al. Efficacy and safety of adalimumab in Canadian patients with moderate to severe Crohn's disease: results of the Adalimumab in Canadian SubjeCts with ModErate to Severe Crohn's DiseaSe (ACCESS) trial. Can J Gastroenterol 2011;25(8): 419-25.
128. Dewint P, Hansen BE, Verhey E, Oldenburg B, Hommes DW, Pierik M, et al. Adalimumab combined with ciprofloxacin is superior to adalimumab monotherapy in perianal fistula closure in Crohn's disease: a randomised, double-blind, placebo con¬trolled trial (ADAFI). Gut 2014;63:292-9.
129. Barrie A, Regueiro M. Biologic therapy in the management of extraintestinal manifestations of inflammatory bowel disease. Inflamm Bowel Dis 2007; 13 (11):1424-9.
130. Kugathasan S, Miranda A, Nocton J, Drolet BA, Raasch C, Binion DG. Dermatologic manifestations of Crohn disease in children: response to infliximab. J Pediatr Gastroenterol Nutr 2003;37(2): 150-4.
131. Escher JC, Stoof TJ, van Deventer SJ, van Furth AM. Successful treatment of metastatic Crohn disease with infliximab. J Pediatr Gastroenterol Nutr 2002;34(4):420-3.
132. Krishnan S, Banquet A, Newman L, Katta U, Patil A, Dozor AJ. Lung lesions in children with Crohn's disease presenting as nonresolving pneumonias and response to infliximab therapy. Pediatrics 2006;117(4):1440-3.
133. Silbermintz A, Krishnan S, Banquet A, Markowitz J. Granulo¬matous pneumonitis, sclerosing cholangitis, and pancreatitis in a child with Crohn disease: response to infliximab. J Pediatr Gastroenterol Nutr 2006;42(3):324-6.
134. Carpenter E, Jackson MA, Friesen CA, Scarbrough M, Roberts CC. Crohn's-associated chronic recurrent multifocal osteomy¬elitis responsive to infliximab. J Pediatr 2004;144(4):541-4.
135. Kierkus J, Dadalski M, Szymanska E, Oracz G, Wegner A, Gorczewska M, et al. The impact of infliximab induction therapy on mucosal healing and clinical remission in Polish pediatric patients with moderate-to-severe Crohn's disease. Eur J Gastroenterol Hepatol 2012;24(5):495-500.
136. Malik S, Ahmed SF, Wilson ML, Shah N, Loganathan S, Naik S, et al. The effects of anti-TNF-alpha treatment with adalimumab on growth in children with Crohn's disease (CD). J Crohns Colitis 2012;6(3):337-44.
137. Ryan BM, Russel MG, Schurgers L, Wichers M, Sijbrandij J, Stockbrugger RW, et al. Effect of antitumour necrosis factor-alpha therapy on bone turnover in patients with active Crohn's disease: a prospective study. Aliment Pharmacol Ther 2004;20(8):851-7.
138. Franchimont N, Putzeys V, Collette J, Vermeire S, Rutgeerts P, De Vos M, et al. Rapid improvement of bone metabolism after infliximab treatment in Crohn's disease. Aliment Pharmacol Ther 2004; 20(6):607-14.
139. Thayu M, Leonard MB, Hyams JS, Crandall WV, Kugathasan S, Otley AR, et al. Improvement in biomarkers of bone formation during infliximab therapy in pediatric Crohn's disease: results of the REACH study. Clin Gastroenterol Hepatol 2008;6(12): 1378-84.
140. Miheller P, Kiss LS, Lorinczy K, Lakatos PL. Anti-TNF trough levels and detection of antibodies to anti-TNF in inflammatory bowel disease: are they ready for everyday clinical use? Expert Opin Biol Ther 2012;12(2):179-92.
141. Steenholdt C, Brynskov J, Thomsen OO, Munck LK, Fallingborg J, Christensen LA, et al. Individualised therapy is more cost-effective than dose intensification in patients with Crohn's disease who lose response to anti-TNF treatment: a randomised, controlled trial. Gut 2014;63:919-27.
142. Hanauer SB, Feagan BG, Lichtenstein GR, Mayer LF, Schreiber S, Colombel JF, et al. Maintenance infliximab for Crohn's disease: the ACCENT I randomised trial. Lancet 2002;3 59(9317):1541-9.
143. Colombel JF, Sandborn WJ, Rutgeerts P, Enns R, Hanauer SB, Panaccione R, et al. Adalimumab for maintenance of clinical response and remission in patients with Crohn's disease: the CHARM trial. Gastroenterology 2007;132(1):52-65.
144. Armuzzi A, Pugliese D, Danese S, Rizzo G, Felice C, Marzo M, et al. Infliximab in steroid-dependent ulcerative colitis: effectiveness and predictors of clinical and endoscopic remission. Inflamm Bowel Dis 2013;19(5):1065-72.
145. Sprakes MB, Ford AC, Warren L, Greer D, Hamlin J. Efficacy, tolerability, and predictors of response to infliximab therapy for Crohn's disease: a large single centre experience. J Crohns Colitis 2012;6(2):143-53.
146. Cucchiara S, Escher JC, Hildebrand H, Amil-Dias J, Stronati L, Ruemmele FM. Pediatric inflammatory bowel diseases and the risk of lymphoma: should we revise our treatment strategies? J Pediatr Gastroenterol Nutr 2009;48(3):257-67.
147. Feagan BG, McDonald JW, Panaccione R, Enns RA, Bernstein CN, Ponich TP, et al. Methotrexate in combination with infliximab is no more effective than infliximab alone in patients with Crohn's disease. Gastroenterology 2014; 146:681 -8.
148. Russell RK, Wilson ML, Loganathan S, Bourke B, Kiparissi F, Mahdi G, et al. A British Society of Paediatric Gastroenterol¬ogy, Hepatology and Nutrition survey of the effectiveness and safety of adalimumab in children with inflammatory bowel disease. Aliment Pharmacol Ther 2011;33(8):946-53.
149. Kestens C, van Oijen MG, Mulder CL, van Bodegraven AA, Dijkstra G, de Jong D, et al. Adalimumab and infliximab are equally effective for Crohn's disease in patients not previously treated with anti-tumor necrosis factor-alpha agents. Clin Gastroenterol Hepatol 2013; 11 (7):826-31.
150. Baert F, Noman M, Vermeire S, Van Assche G, DH G, Carbonez A, et al. Influence of immunogenicity on the long-term efficacy of infliximab in Crohn's disease. N Engl J Med 2003;348(7): 601-8.
151. Miele E, Markowitz JE, Mamula P, Baldassano RN. Human antichimeric antibody in children and young adults with inflammatory bowel disease receiving infliximab. J Pediatr Gastroenterol Nutr 2004;38(5):502-8.
152. Candon S, Mosca A, Ruemmele F, Goulet O, Chatenoud L, Cezard JP. Clinical and biological consequences of immunization to infliximab in pediatric Crohn's disease. Clin Immunol 2006; 118(1):11 -9.
153. Wynands J, Belbouab R, Candon S, Talbotec C, Mougenot JF, Chatenoud L, et al. 12-month follow-up after successful infliximab therapy in pediatric crohn disease. J Pediatr Gastroenterol Nutr 2008;46(3):293-8.
154. Lee LY, Sanderson JD, Irving PM. Anti-infliximab antibodies in inflammatory bowel disease: prevalence, infusion reactions, immunosuppression and response, a meta-analysis. Eur J Gastroenterol Hepatol 2012;24(9):1078-85.
155. Jacobstein DA, Markowitz JE, Kirschner BS, Ferry G, Cohen SA, Gold BD, et al. Premedication and infusion reactions with infliximab: results from a pediatric inflammatory bowel disease consortium. Inflamm Bowel Dis 2005; 11 (5):442-6.
156. Lahdenne P, Wikstrom AM, Aalto K, Kolho KL. Prevention of acute adverse events related to infliximab infusions in pediatric patients. Arthritis Care Res 2010;62(6):785-90.
157. Kolho KL, Ruuska T, Savilahti E. Severe adverse reactions to infliximab therapy are common in young children with inflammatory bowel disease. Acta Paediatr 2007;96(1): 128-30 [Oslo, Norway : 1992].
158. Hamalainen A, Lahdenne P, Wikstrom A, Aalto K, Kolho KL. Prevention of infusion reactions to infliximab in paediatric patients with oral acetylsalicylic acid. Clin Exp Rheumatol 2012;30(4):590-1.
159. Fidder H, Schnitzler F, Ferrante M, Noman M, Katsanos K, Segaert S, et al. Long-term safety of infliximab for the treatment of inflammatory bowel disease: a single-centre cohort study. Gut 2009;58(4):501-8.
160. de Bie CI, Escher JC, de Ridder L. Antitumor necrosis factor treatment for pediatric inflammatory bowel disease. Inflamm Bowel Dis 2012; 18(5):985-1002.
161. Rahier JF, Ben-Horin S, Chowers Y, Conlon C, De Munter P, D'Haens G, et al. European evidence-based consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. J Crohns Colitis 2009;3(2):47-91.
162. Mackey AC, Green L, Leptak C, Avigan M. Hepatosplenic T cell lymphoma associated with infliximab use in young patients treated for inflammatory bowel disease: update. J Pediatr Gastroenterol Nutr 2009;48(3):386-8.
163. Diak P, Siegel J, La Grenade L, Choi L, Lemery S, McMahon A. Tumor necrosis factor alpha blockers and malignancy in children: forty-eight cases reported to the Food and Drug Administration. Arthritis Rheum 2010;62(8):2517-24.
164. Hiremath G, Duffy L, Leibowitz I. Infliximab-induced psoriasis in children with inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2011;52(2):230-2.
165. Katz L, Gisbert JP, Manoogian B, Lin K, Steenholdt C, Mantzaris GJ, et al. Doubling the infliximab dose versus halving the infusion intervals in Crohn's disease patients with loss of response. Inflamm Bowel Dis 2012; 18(11):2026-33.
166. Vande Casteele N, Gils A, Singh S, Ohrmund L, Hauenstein S, Rutgeerts P, et al. Antibody response to infliximab and its impact on pharmacokinetics can be transient. Am J Gastroenterol 2013; 108(6):962-71.
167. Ben-Horin S, Waterman M, Kopylov U, Yavzori M, Picard O, Fudim E, et al. Addition of an immunomodulator to infliximab therapy eliminates antidrug antibodies in serum and restores clinical response of patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2013; 11 (4):444-7.
168. Karmiris K, Paintaud G, Noman M, Magdelaine-Beuzelin C, Ferrante M, Degenne D, et al. Influence of trough serum levels and immunogenicity on long-term outcome of adalimumab therapy in Crohn's disease. Gastroenterology 2009; 137(5): 1628-40.
169. Kelsen, J., Gupta, K., Grossman, A., Mamula, P., & Baldassano, R. (2011). Infliximab therapy in pediatric patients 7 years of age and younger. Inflammatory Bowel Diseases, 17, S5. doi:10.1097/00054725-201112002-00012
170. Щиголева Н. Е. и др. Применение инфликсимаба при воспалительных заболеваниях кишечника у детей //Педиатрическая фармакология. – 2010. – Т. 7. – №. 1. – С. 55-61
171. Levine AE, Mark D, Smith L, Zheng HB, Suskind DL. Pharmacologic Management of Monogenic and Very Early Onset Inflammatory Bowel Diseases. Pharmaceutics. 2023 Mar 17;15(3):969. doi: 10.3390/pharmaceutics15030969. PMID: 36986830; PMCID: PMC10059893
172. Ardura MI, Toussi SS, Siegel JD, Lu Y, Bousvaros A, Crandall WNASPGHAN Clinical Report: Surveillance, Diagnosis, and Prevention of Infectious Diseases in Pediatric Patients With Inflammatory Bowel Disease Receiving Tumor Necrosis Factor-αInhibitors.J Pediatr Gastroenterol Nutr. 2016 Jul;63(1):130-55.
173. https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=ca33f239-4d15-4927-876f-223ca3671b01&t=
174. MacDonald JK, Nguyen TM, Khanna R, Timmer A. Anti-IL-12/23p40 antibodies for induction of remission in Crohn’s disease. Cochrane Database Syst Rev 2016;11:CD 007572.
175. Soler D, Chapman T, Yang LL, et al. The binding specificity and selective antagonism of vedolizumab, an anti-α4β7 integrin therapeutic antibody in development for inflammatory bowel diseases. J Pharmacol Exp Ther. 2009;330:864-875
176. Singh N, Rabizadeh S, Jossen J, Pittman N, Check M, Hashemi G, Phan BL, Hyams JS, Dubinsky MC. Multi-Center Experience of Vedolizumab Effectiveness in Pediatric Inflammatory Bowel Disease. Inflamm Bowel Dis. 2016 Sep;22(9):2121-6. doi: 10.1097/MIB.0000000000000865. PMID: 27542130
177. Ledder O, Assa A, Levine A, Escher JC, de Ridder L, Ruemmele F, Shah N, Shaoul R, Wolters VM, Rodrigues A, Uhlig HH, Posovszky C, Kolho KL, Jakobsen C, Cohen S, Shouval DS, de Meij T, Martin-de-Carpi J, Richmond L, Bronsky J, Friedman M, Turner D. Vedolizumab in Paediatric Inflammatory Bowel Disease: A Retrospective Multi-Centre Experience From the Paediatric IBD Porto Group of ESPGHAN. J Crohns Colitis. 2017 Oct 1;11(10):1230-1237. doi: 10.1093/ecco-jcc/jjx082. Erratum in: J Crohns Colitis. 2018 Apr 27;12(5):630. PMID: 28605483
178. Luthra P, Peyrin-Biroulet L, Ford AC. Systematic review and meta- analysis: opportunistic infections and malignancies during treatment with anti-integrin antibodies in inflammatory bowel disease. Aliment Pharmacol Ther 2015;41:1227–36.
179. A Potapov, A Vinokurova, A Pushkareva, M Prokhorenkova, A Anushenko, A Fisenko, P590 Use of upadacitinib in Refractory Paediatric Inflammatory Bowel Diseasein: A Single-Center Cohort Study, Journal of Crohn's and Colitis, Volume 18, Issue Supplement_1, January 2024, Page i1148, https://doi.org/10.1093/ecco-jcc/jjad212.0720
180. Collen LV. Rapid Clinical Remission With Upadacitinib in a Pediatric Patient With Refractory Crohn's Disease. Inflamm Bowel Dis. 2023 Jul 5;29(7):1175-1176. doi: 10.1093/ibd/izad048. PMID: 36933200
181. Spencer EA, Bergstein S, Dolinger M, Pittman N, Kellar A, Dunkin D, Dubinsky MC. Single-center Experience With Upadacitinib for Adolescents With Refractory Inflammatory Bowel Disease. Inflamm Bowel Dis. 2023 Dec 22:izad300. doi: 10.1093/ibd/izad300. Epub ahead of print. PMID: 38134405
182. Liu Y, Song X, Xiang L, Tan W, Zou M, Guo H. Rapid Remission With Upadacitinib in a Child With Refractory Crohn's Disease and ATM Mutation: A Case Report. Curr Ther Res Clin Exp. 2024 Jul 30;101:100756. doi: 10.1016/j.curtheres.2024.100756. PMID: 39257480; PMCID: PMC11385748
183. de Ridder L, Assa A, Bronsky J, Romano C, Russell RK, Afzal NA, Hauer AC, Knafelz D, Lionetti P, Strisciuglio C, Veres G, Winter H, Wolters VM, Sladek M, Vulto AG, Dias JA; Paediatric IBD Porto group of ESPGHAN. Use of Biosimilars in Pediatric Inflammatory Bowel Disease: An Updated Position Statement of the Pediatric IBD Porto Group of ESPGHAN. J Pediatr Gastroenterol Nutr. 2019 Jan;68(1):144-153. doi: 10.1097/MPG.0000000000002141. PMID: 30169454.
184. Материалы Всероссийской научно-практической конференции с международным участием «Российский колопроктологический форум» Колопроктология, том 18 №3s 2019, nch 11-12 (Резолюция общественной организации «Ассоциация колопроктологов России» и «Всероссийского общества по изучению воспалительных заболеваний кишечника» по вопросу немедицинского переключения биологической терапии при воспалительных заболеваниях кишечника в рамках Национального саммита по лечению воспалительных заболеваний кишечника 22 июня 2019 г.) https://doi.org/10.33878/2073-7556-2019-18-3-pril
185. Franchimont D, Ferrante M, Louis E, De Vos M, Dewit O, Van Hootegem P, Moreels T, Liefferinckx C, Bossuyt P, Baert F, Rahier JF, Vermeire S. Belgian IBD research group (BIRD) position statement 2017 on the use of biosimilars in inflammatory bowel diseases (IBD). Acta Gastroenterol Belg. 2018 Jan-Mar;81(1):49-53. PMID: 29562378.
186. Danese S, Fiorino G, Raine T, Ferrante M, Kemp K, Kierkus J, Lakatos PL, Mantzaris G, van der Woude J, Panes J, Peyrin-Biroulet L. ECCO Position Statement on the Use of Biosimilars for Inflammatory Bowel Disease-An Update. J Crohns Colitis. 2017 Jan;11(1):26-34.
187. Lourenc R, Azevedo S, Lopes AI. Surgery in Pediatric Crohn Disease: Case Series from a Single Tertiary Referral Center. GE Port J Gastroenterol. 2016; 23(4):191-196. doi:10.1016/j.jpge.2016.03.007.
188. Gupta N, Bostrom AG, Kirschner BS, et al. Incidence of Stricturing and Penetrating Complications of Crohn’s Disease Diagnosed in Pediatric Patients. Inflamm Bowel Dis. 2010 Apr; 16(4):638–644. doi:10.1002/ibd.21099.
189. Kim S. Surgery in Pediatric Crohn’s Disease: Indications, Timing and Post-Operative Management. Pediatr Gastroenterol Hepatol Nutr 2017 March 20(1):14-21. doi.org/10.5223/pghn.2017.20.1.14.
190. Мазанкова Л.Н., Водилова О.В., Халиф И.Л. Осложнения болезни Крона у детей. Колопроктология. - 2004. - № 3 (9). - С. 30-35.
191. Щербакова О.В. Практические рекомендации по хирургическому лечению осложненной болезни Крона у детей. Экспериментальная и клиническая гастроэнтерология. - 2015. - Т.1. - №113. - С.78-83.
192. Aloi M, Viola F, D’Arcangelo G, et al. Disease course and efficacy of medical therapy in stricturing paediatric Crohn’s disease. Digestive and Liver Disease. 2013;45:464–468. doi:10.1016/j.dld.2013.01.020.
193. Baillie CT, Smith JA. Surgical strategies in paediatric inflammatory bowel disease. World J Gastroenterol. 2015 May; 21(20):6101–6116. doi:10.3748/wjg.v21.i20.6101.
194. Bemelman WA, Warusavitarne J, Sampietro GM, Serclova Z, Zmora O, Luglio G, de Buck van Overstraeten A, Burke JP, Buskens CJ, Colombo F, Dias JA, Eliakim R, Elosua T, Gecim IE, Kolacek S, Kierkus J, Kolho KL, Lefevre JH, Millan M, Panis Y, Pinkney T, Russell RK, Shwaartz C, Vaizey C, Yassin N, D'Hoore A. ECCO-ESCP Consensus on Surgery for Crohn's Disease. JCC, 2018, 12 (1): 1–16. doi:10.1093/ecco-jcc/jjx061.
195. Abraham BP, Mehta S, El-Serag HB. Natural History of Pediatric-onset Inflammatory Bowel Disease. J Clin Gastroenterol. 2012 Aug; 46(7):581–589. doi:10.1097/MCG.0b013e318247c32f..
196. Sentongo TA, Stettler N, Christian A, et al. Growth after intestinal resection for Crohn's disease in children, adolescents, and young adults. Inflamm Bowel Dis 2000;6:265–9.
197. Hojsak I, Kolacek S, Hansen LF, et al. Long-term outcomes after elective ileocecal resection in children with active localized Crohn's disease - a multicenter European study. J Pediatr Surg. 2015 Oct; 50(10):1630-5. doi:10.1016/j.jpedsurg.2015.03.054.
198. Kim E, Kang Y, Lee MJ, Park YN, Koh H. Life-threatening lower gastrointestinal hemorrhage in pediatric Crohn's disease. Pediatr Gastroenterol Hepatol Nutr. 2013 Mar;16(1):53-60. doi: 10.5223/pghn.2013.16.1.53
199. Diefenbach KA, Breuer CK. Pediatric inflammatory bowel disease. World J Gastroenterol. 2006 May;12(20): 3204–3212. doi:10.3748/wjg.v12.i20.3204.
200. Korzenik J.R. Massive lower gastrointestinal hemorrhage in Crohn’s disease. Curr. Treat Options Gastroenterol. - 2000;3:211-6.
201. Werbin N., Haddad R., Greenberg R., et al. Free perforation in Crohn’s disease. Isr. Med. Assoc. J. - 2003;5:175-7.
202. Joshi A, Bajwa R, Bhattacharjee N, et al. Bowel Perforation Associated With Infliximab Use in a Pediatrics Patient. WMJ. 2016 Apr; 115(2):90-92.
203. Traa MX, Orkin BA, Flores A, et al. Toxic colitis in a 10 year old girl with Crohn’s disease. J Ped Surg Case Reports. 2013; 1:284-287. doi.org/10.1016/j.epsc.2013.08.003.
204. Papi C., Festa V., Fagnani C., et al. Evolution of clinical behaviour in Crohn’s disease: predictive factors of penetrating complications. Dig. Liver Dis. - 2005;37:247-53.
205. Lightner AL, Vogler S, McMichael J, Jia X, Regueiro M, Qazi T, Steele SR. Dysplastic Progression to Adenocarcinoma is Equivalent in Ulcerative Colitis and Crohn's Disease. J Crohns Colitis. 2021 Jan 13;15(1):24-34. doi: 10.1093/ecco-jcc/jjaa133. PMID: 32592468.
206. Von Allmen D. Surgical management of Crohn's disease in children. Curr Treat Options Gastroenterol. 2005 Oct; 8(5):405-10.
207. Blackburn SC, Wiskin AE, Barnes C, et al. Surgery for children with Crohn’s disease: indications, complications and outcome. Arch Dis Child 2014; 99:420–426. doi:10.1136/archdischild-2013-305214.
208. Boualit M, Salleron J, Turck D, et al. Long-term outcome after first intestinal resection in paediatric-onset Crohn's disease: A population-based study. Inflamm Bowel Dis. 2013 Jan; 19(1):7-14. doi:10.1002/ibd.23004.
209. Levine A, Chanchlani N, Hussey S, Ziv-Baran T, Escher JC, Amil Dias J, Veres G, Koletzko S, Turner D, Kolho KL, Paerregaard A, Staiano A, Lionetti P, Nuti F, Sladek M, Shaoul R, Lazowska-Prezeorek I, Martin de Carpi J, Sigall Boneh R, Pfeffer Gik T, Cohen-Dolev N, Russell RK. Complicated Disease and Response to Initial Therapy Predicts Early Surgery in Paediatric Crohn's Disease: Results From the Porto Group GROWTH Study. J Crohns Colitis. 2020 Jan 1;14(1):71-78. doi: 10.1093/ecco-jcc/jjz111.
210. Dignass A, Van Assche G, Lindsay JO, Lemann M, Soderholm J, Colombel JF, et al. The second European evidence-based consensus on the diagnosis and management of Crohn's disease: current management. J Crohns Colitis 2010;4(1):28-62.
211. Amil-Dias J, Kolacek S, Turner D, Pærregaard A, Rintala R, Afzal NA, Karolewska-Bochenek K, Bronsky J, Chong S, Fell J, Hojsak I, Hugot JP, Koletzko S, Kumar D, Lazowska-Przeorek I, Lillehei C, Lionetti P, Martin-de-Carpi J, Pakarinen M, Ruemmele FM, Shaoul R, Spray C, Staiano A, Sugarman I, Wilson DC, Winter H, Kolho KL; IBD Working Group of ESPGHAN (IBD Porto Group). Surgical Management of Crohn Disease in Children: Guidelines From the Paediatric IBD Porto Group of ESPGHAN. J Pediatr Gastroenterol Nutr. 2017 May;64(5):818-835.
212. Rieder F, Zimmermann EM, Remzi FH, et al. Crohn’s disease complicated by strictures: a systematic review. Gut. 2013; 62:1072–1084. doi:10.1136/gutjnl-2012-304353.
213. Barkmeier DT, Dillman JR, Al-Hawary M, et al. MR enterography-histology comparison in resected pediatric small bowel Crohn disease strictures: can imaging predict fibrosis? Pediatr Radiol. 2016 Apr;46(4):498-507. doi:10.1007/s00247-015-3506-6.
214. Bettenworth D, Baker ME, Fletcher JG, Jairath V, Lu C, Bemelman W, d'Haens G, d'Hoore A, Dignass A, Dotan I, Feakins R, Fleshner P, Ha C, Henderson G, Lyu R, Panes J, Rogler G, Mao R, Rimola J, Sandborn WJ, Ng SC, Siegmund B, Silverberg M, Taylor SA, Verstockt B, Gordon IO, Bruining DH, Feagan BG, Rieder F; Stenosis Therapy Anti-Fibrotic Research (STAR) Consortium. A global consensus on the definitions, diagnosis and management of fibrostenosing small bowel Crohn's disease in clinical practice. Nat Rev Gastroenterol Hepatol. 2024 Jun 3. doi: 10.1038/s41575-024-00935-y
215. Simillis C., Purkayastha S., Yamamoto T., et al. A meta-analysis comparing conventional end-to-end anastomosis vs. other anastomotic configurations after resection in Crohn's disease. Dis. Colon Rectum. - 2007;50(10):1674-87.
216. Diamond IR, Gerstle JT, Kim PC, Langer JC. Outcomes after laparoscopic surgery in children with inflammatory bowel disease. Surg Endosc. 2010 Nov;24(11):2796-802. doi: 10.1007/s00464-010-1050-x. Epub 2010 Apr 16. PMID: 20396907.
217. Pini-Prato A, Faticato MG, Barabino A, et al. Minimally invasive surgery for paediatric inflammatory bowel disease: Personal experience and literature review. World J Gastroenterol. 2015 Oct; 21(40):11312–11320. doi:10.3748/wjg.v21.i40.11312.
218. Поддубный И.В., Алиева Э.И., Сытьков В.В., Малашенко А.С., Козлов М.Ю., Щербакова О.В., Никитин А.В., Яблокова Е.А., Ерохина М.И., Cеверинов Д.А. Плановые лапароскопические резекции кишечника у детей с болезнью Крона. Вопросы практической педиатрии. 2023; 18(4): 13–19. DOI: 10.20953/1817-7646-2023-4-13-19
219. Kessler H, Mudter J, Hohenberger W. Recent results of laparoscopic surgery in inflammatory bowel disease. World J Gastroenterol. 2011 Mar 7;17(9):1116-25. doi: 10.3748/wjg.v17.i9.1116. PMID: 21448415; PMCID: PMC3063903.
220. Воробьев Г.И., Болихов К.В., Варданян А.В. Место лапароскопической илеостомии в лечении болезни Крона толстой кишки (обзор литературы). Колопроктология. - 2009. - №3(29). - с. 52-58.
221. Варданян А.В., Кашников В.Н., Болихов К.В., et al. Лапароскопическая илеостомия при болезни Крона. Журнал «Колопроктология». - 2011. - №3(37). - с. 20-23.
222. Mahida JB, Asti L, Deans KJ, et al. Laparoscopic bowel resection for pediatric inflammatory bowel disease. J Surg Res. 2015 Nov; 199(1):130-6. doi:10.1016/j.jss.2015.04.009.
223. Поддубный И. В., Алиева Э.И., Козлов М.Ю., Щербакова О.В. и соавт. Лапароскопические резекции кишечника у детей с болезнью Крона. Педиатрия. Журнал им.Г.Н.Сперанского. - 2015. - Т.94. - №6. - С.79-81.
224. Bobanga ID, Bai S, Swanson MA, et al. Factors influencing disease recurrence after ileocolic resection in adult and pediatric onset Crohn’s disease. Am J Surg. 2014 Oct;208(4):591-6. doi:10.1016/j.amjsurg.2014.06.008.
225. Abdelaal K, Jaffray B. Colonic disease site and perioperative complications predict need for later intestinal interventions following intestinal resection in pediatric Crohn's disease. J Pediatr Surg. 2016 Feb;51(2):272-6. doi:10.1016/j.jpedsurg.2015.10.078.
226. Page AE, Sashittal SG, Chatzizacharias NA, et al. The Role of Laparoscopic Surgery in the Management of Children and Adolescents With Inflammatory Bowel Disease. Medicine. 2015 May; 94(21):874-877. doi:10.1097/MD.0000000000000874.
227. Diederen K, de Ridder L, van Rheenen P, et al. Complications and Disease Recurrence After Primary Ileocecal Resection in Pediatric Crohn's Disease: A Multicenter Cohort Analysis. See comment in PubMed Commons belowInflamm Bowel Dis. 2017 Feb;23(2):272-282. doi:10.1097/MIB.0000000000000999.
228. Bamford R, Hay A, Kumar D. Resection Leads to Less Recurrence Than Strictureplasty in a Paediatric Population with Obstructive Crohn's Disease. Surg Res Pract. 2014; 2014:709045. doi:10.1155/2014/709045.
229. Romeo E, Jasonni V, Caldaro T, et al. Strictureplasty and intestinal resection: different options in complicated pediatric-onset Crohn disease. J Pediatr Surg. 2012 May; 47(5):944-8. doi: 10.1016/j.jpedsurg.2012.01.054.
230. Yamamoto T., Fazio V.W., Tekkis P.P. Safety and efficacy of strictureplasty for Crohn’s disease: a systematic review and meta-analysis. Dis. Colon Rectum. - 2007;50:1968-86.
231. Reuken P. A., Kruis W., Maaser C., Teich N., Buning J., Preis J.C., Schmelz R., Bruns T., Fichtner-Feigl S., Stallmach A. Microbial Spectrum of Intra-Abdominal Abscesses in Perforating Crohn’s Disease: Results from a Prospective German Registry. Journal of Crohn's and Colitis, 2018, 695–701. doi:10.1093/ecco-jcc/jjy017.
232. Clancy C, Boland T, Deasy J, et al. A meta-analysis of percutaneous drainage versus surgery as the initial treatment of Crohn's disease-related inta-abdominal abscess. J Crohns Colitis. 2016: 202-208. doi:10.1093/ecco-jcc/jjv198.
233. Alkhouri RH, Bahia G, Smith AC, et al. Outcome of medical management of intraabdominal abscesses in children with Crohn's disease. J Pediatr Surg. 2017 Mar;S0022-3468(17):30208-7. doi:10.1016/j.jpedsurg.2017.03.059.
234. Rypens F, Dubois J, Garel L, Deslandres C, Saint-Vil D. Percutaneous drainage of abdominal abscesses in pediatric Crohn's disease. AJR Am J Roentgenol. 2007;188(2):579‐585. doi:10.2214/AJR.06.0181.
235. Dotson JL, Bashaw H, Nwomeh B, et al. Management of Intra-abdominal Abscesses in Children With Crohn’s Disease: A 12-year, Retrospective Single-center Review. Inflamm Bowel Dis. 2015 May; 21(5):1109–1114. doi:10.1097/MIB.0000000000000361
236. Gecse K, Khanna R, Stoker J, Jenkins JT, Gabe S, Hahnloser D, D’Haens G. Fistulizing Crohn’s disease: Diagnosis and management. United European Gastroenterology Journal 2013; 1(3):206–213. doi:10.1177/2050640613487194.].
237. Schecter WP, Hirshberg A, Chang DS, Harris HW, Napolitano LM, Wexner SD, et al. Enteric fistulas: principles of management. J Am Coll Surg. 2009;209(4):484-91.
238. Quaresma AB, Miranda EF, Kotze PG. Management of ileocecal crohn's disease during surgical treatment for acute appendicitis: a systematic review. Arq Gastroenterol. 2021 Oct-Dec;58(4):560-565. doi: 10.1590/S0004-2803.202100000-98. PMID: 34909865
239. Шелыгин Ю.А., Ачкасов С.И., Решетов И.В., Маев И.В., Драпкина О.М., Белоусова Е.А., Варданян А.В., Нанаева Б.А., Абдулганиева Д.И., Адамян Л.В., Намазова-Баранова Л.С., Разумовский А.Ю., Ревишвили А.Ш., Хатьков И.Е., Шабунин А.В., Ливзан М.А., Сажин А.В., Тимербулатов В.М., Хлынова О.В., Щербакова О.В., Яцык С.П. и др. Консенсус по спорным вопросам хирургического лечения болезни Крона с применением Дельфийского метода. Колопроктология. 2023; т. 22, № 2, с. 173–184. https://doi.org/10.33878/2073-7556-2023-22-2-172-183.
240. Tekkis P.P., Purkayastha S., Lanitis S., et al. A comparison of segmental vs. subtotal/total colectomy for colonic Crohn’s disease: a meta-analysis. Colorectal Dis. - 2006;8:82-90.
241. Tichansky D., Cagir B., Yoo E., et al. Strictureplasty for Crohn’s disease: meta-analysis. Dis Colon Rectum. 2000;43:911-9.
242. Reese G.E., Purkayastha S., Tilney H.S., et al. Strictureplasty vs. resection in small bowel Crohn’s disease: an evaluation of short-term outcomes and recurrence. Colorectal Dis. -2007;9:686-94.
243. Maxwell EC., Dawany N, Baldassano RN, Mamula P, Mattei P, Albenberg L, Kelsen JR. Diverting Ileostomy for the Treatment of Severe, Refractory, Pediatric Inflammatory Bowel Disease. J Pediatr Gastroenterol Nutr. 2017 Sep;65(3):299-305. doi:10.1097/MPG.0000000000001498.
244. Kariv Y, Remzi FH, Strong SA, et al. Ileal pouch rectal anastomosis: a viable alternative to permanent ileostomy in Crohn’s proctocolitis patients. J Am Coll Surg 2009;208:390–9. doi:10.1016/j.jamcollsurg.2008.10.037.
245. Yamamoto T., Allan R.N., Keighley M.R. Effect of fecal diversion alone on perianal Crohn’s disease. World J. Surg. - 2000;24:1258-62.
246. Singh Ranger G, Lamparelli MJ, Aldridge A, Chong SK, Mitton SG, Albanese A, et al. Surgery results in significant improvement in growth in children with Crohn's disease refractory to medical therapy. Pediatr Surg Int. 2006;22(4):347-52.
247. Melton G.B., Fazio V.W., Kiran R.P., et al. Long-term outcomes with ileal pouch-anal anastomosis and Crohn’s disease: pouch retention and implications of delayed diagnosis. Ann. Surg. - 2008;248:608-16.
248. de Bie CI, Paerregaard A, Kolacek S, et al. Disease phenotype at diagnosis in pediatric Crohn's disease: 5-year analyses of the EUROKIDS Registry. Inflammatory Bowel Diseases. 2013;19(2):378-85.
249. Bamford R, Hay A, Kumar D. Resection Leads to Less Recurrence Than Strictureplasty in a Paediatric Population with Obstructive Crohn's Disease. Surg Res Pract. 2014; 2014:709045. doi:10.1155/2014/709045
250. Di Nardo G, Oliva S, Passariello M, Pallotta N, Civitelli F, Frediani S, Gualdi G, Gandullia P, Mallardo S, Cucchiara S. Intralesional steroid injection after endoscopic balloon dilation in pediatric Crohn's disease with stricture: a prospective, randomized, double-blind, controlled trial. Gastrointest Endosc. 2010 Dec;72(6):1201-8. doi:10.1016/j.gie.2010.08.003.
251. Butt WT, Ryan ÉJ, Boland MR, McCarthy EM, Omorogbe J, Hazel K, Bass GA, Neary PC, Kavanagh DO, McNamara D, O'Riordan JM. Strictureplasty versus bowel resection for the surgical management of fibrostenotic Crohn's disease: a systematic review and meta-analysis. Int J Colorectal Dis. 2020 Apr;35(4):705-717. doi: 10.1007/s00384-020-03507-z
252. Dietz D.W., Laureti S., Strong S.A., et al. Safety and longterm efficacy of strictureplasty in 314 patients with obstructing small bowel Crohn’s disease. J. Am. Coll. Surg. - 2001;192:330-7.
253. Gionchetti P, Dignass A, Danese S, et al. 3rd European Evidence-Based Consensus on the Diagnosis and Management of Crohn's Disease 2016: Part 2: Surgical Management and Special Situations. J Crohns Colitis. 2017; 11(2):135-149. doi:10.1093/ecco-jcc/jjw169.
254. Aberra FN, Lewis JD, Hass D, et al. Corticosteroids and immunomodulators: postoperative infectious complication risk in inflammatory bowel disease patients. Gastroenterology. 2003;125(2):320-7.
255. Lake J.P., Firoozmand E., Kang J.C., et al. Effect of high-dose steroids on anastomotic complications after proctocolectomy with ileal pouch-anal anastomosis. J. Gastrointest. Surg. – 2004; 8: 547-51.
256. Kumar A, Auron M, Aneja A, et al. Inflammatory bowel disease: perioperative pharmacological considerations. Mayo Clin Proc. 2011; 86(8):748-757. doi:10.4065/mcp.2011.0074.
257. Tay GS, Binion DG, Eastwood D, et al. Multivariate analysis suggests improved perioperative outcome in Crohn's disease patients receiving immunomodulator therapy after segmental resection and/or strictureplasty. Surgery. 2003;134(4):565-72.
258. Subramanian V., Pollok R.C., Kang J.Y., et al. Systematic review of postoperative complications in patients with inflammatory bowel disease treated with immunomodulators. Br. J. Surg. – 2006; 93: 793-9.
259. Pugliese D., Armuzzi A., Rizzo G. et al. Effect of anti-TNF-alpha treatment on short-term post-operative complications in patients with inflammatory bowel disease. Gut. – 2010; 59 (Suppl III):A13.
260. Kopylov U, Ben-Horin S, Zmora O, et al. Anti-tumor necrosis factor and postoperative complications in Crohn's disease: systematic review and meta-analysis. Inflammatory Bowel Diseases. 2012;18(12):2404-13.
261. Billioud V, Ford AC, Tedesco ED. Preoperative use of anti-TNF therapy and postoperative complications in inflammatory bowel diseases: A meta-analysis. J Crohns Colitis. 2013;7:853–867. doi:10.1016/j.crohns.2013.01.014.
262. El-Hussuna A, Krag A, Olaison G, et al. The effect of anti-tumor necrosis factor alpha agents on postoperative anastomotic complications in Crohn's disease: a systematic review. Diseases of the Colon & Rectum. 2013;56(12):1423-33.
263. Yang ZP, Hong L, Wu Q, et al. Preoperative infliximab use and postoperative complications in Crohn's disease: a systematic review and meta-analysis. International Journal Of Surgery. 2014;12(3):224-30.
264. Adamina M, Gerasimidis K, Sigall-Boneh R, Zmora O, de Buck van Overstraeten A, Campmans-Kuijpers M, Ellul P, Katsanos K, Kotze PG, Noor N, Schäfli-Thurnherr J, Vavricka S, Wall C, Wierdsma N, Yassin N, Lomer M. Perioperative Dietary Therapy in Inflammatory Bowel Disease. J Crohns Colitis. 2020 May 21;14(4):431-444. doi: 10.1093/ecco-jcc/jjz160. PMID: 31550347.
265. Wagner IJ, Rombeau JL. Nutritional support of surgical patients with inflammatory bowel disease. Surg Clin North Am. 2011 Aug;91(4):787-803, viii. doi: 10.1016/j.suc.2011.04.013.
266. Li Y, Zuo L, Zhu W, et al. Role of exclusive enteral nutrition in the preoperative optimization of patients with Crohn's disease following immunosuppressive therapy. Medicine (Baltimore). 2015;94(5):e478.
267. Щербакова О.В., Шумилов П.В. Послеоперационные осложнения у детей с болезнью Крона: анализ предикторов риска. Российский вестник детской хирургии, анестезиологии и реаниматологии. - 2022. - Т. 12. - №3. - C. 301-310. DOI: 10.17816/psaic1284
268. Baldassano RN, Han PD, Jeshion WC, Berlin JA, Piccoli DA, Lautenbach E, Mick R, Lichtenstein GR. Pediatric Crohn's disease: risk factors for postoperative recurrence. Am J Gastroenterol. 2001 Jul;96(7):2169-76. doi: 10.1111/j.1572-0241.2001.03876.x. PMID: 11467649
269. Swoger JM, Regueiro M. Evaluation for postoperative recurrence of Crohn disease. Gastroenterol Clin North Am. 2012 Jun;41(2):303-14. doi: 10.1016/j.gtc.2012.01.011. PMID: 22500519
270. Hansen LF, Jakobsen C, Paerregaard A, Qvist N, Wewer V. Surgery and postoperative recurrence in children with Crohn disease. J Pediatr Gastroenterol Nutr 2015;60:347-51. doi:10.1097/MPG.0000000000000616; Herfarth HH, Katz JA, Hanauer SB, et al.
271. Bernell O, Lapidus A, Hellers G. Risk Factors for Surgery and Postoperative Recurrence in Crohn’s Disease. Ann Surg. 2000 Jan; 231(1):38-45.
272. Gasparetto M, Guariso G. Highlights in Inflammatory Bowel Disease: Epidemiology and Its Natural History in the Paediatric Age. Gastroenterol Res Pract. 2013; 829040:12. doi:10.1155/2013/829040.
273. Hyams JS, Grand RJ, Colodny AH, Schuster SR, Eraklis A. Course and prognosis after colectomy and ileostomy for inflammatory bowel disease in childhood and adolescence. J Pediatr Surg. 1982 Aug;17(4):400-5. doi: 10.1016/s0022-3468(82)80498-3. PMID: 7120008
274. Rutgeerts P, Geboes K, Vantrappen G, Beyls J, Kerremans R, Hiele M. Predictability of the postoperative course of Crohn's disease. Gastroenterology. 1990 Oct;99(4):956-63. doi: 10.1016/0016-5085(90)90613-6. PMID: 2394349
275. Nguyen GC, Loftus EV Jr, Hirano I, Falck-Ytter Y, Singh S, Sultan S; AGA Institute Clinical Guidelines Committee. American Gastroenterological Association Institute Guideline on the Management of Crohn's Disease After Surgical Resection. Gastroenterology. 2017 Jan;152(1):271-275. doi: 10.1053/j.gastro.2016.10.038. Epub 2016 Nov 10. PMID: 27840074
276. Hukkinen M, Pakarinen MP, Merras-Salmio L, Koivusalo A, Rintala R, Kolho KL. Fecal calprotectin in the prediction of postoperative recur- rence of Crohn’s disease in children and adolescents. J Pediatr Surg 2016;51:1467–72.
277. Yung DE, Har-Noy O, Tham YS, et al. Capsule endoscopy, magnetic resonance enterography, and small bowel ultrasound for evaluation of postoperative recurrence in Crohn’s Disease: systematic review and meta-analysis. Inflamm Bowel Dis 2017;24:93–100
278. Tham YS, Yung DE, Fay S, et al. Fecal calprotectin for detec- tion of postoperative endoscopic recurrence in Crohn’s disease: systematic review and meta-analysis. Therap Adv Gastroenterol 2018;11:1756284818785571.
279. Bakouny Z, Yared F, El Rassy E, et al. Comparative efficacy of anti-TNF therapies for the prevention of postoperative recurrence of Crohn’s dis- ease: a systematic review and network meta-analysis of prospective trials. J Clin Gastroenterol 2019;53:409–17
280. Splawski JB, Pffefferkorn MD, Schaefer ME, Day AS, Soldes OS, Ponsky TA, Stein P, Kaplan JL, Saeed SA. NASPGHAN Clinical Report on Postoperative Recurrence in Pediatric Crohn Disease. J Pediatr Gastroenterol Nutr. 2017 Oct;65(4):475-486. doi: 10.1097/MPG.0000000000001606. PMID: 28937552
281. Doherty G, Bennett G, Patil S, Cheifetz A, Moss AC. Interventions for prevention of post-operative recurrence of Crohn's disease. Cochrane Database Syst Rev. 2009 Oct 7;(4):CD006873. doi: 10.1002/14651858.CD006873.pub2. PMID: 19821389
282. Gjuladin-Hellon T, Gordon M, Iheozor-Ejiofor Z, Akobeng AK. Oral 5-aminosalicylic acid for maintenance of surgically-induced remission in Crohn's disease. Cochrane Database Syst Rev. 2019 Jun 20;6(6):CD008414. doi: 10.1002/14651858.CD008414.pub3. PMID: 31220875; PMCID: PMC6586553.
283. American Society for Gastrointestinal Endoscopy Standards of Practice Committee, Shergill AK, Lightdale JR, Bruining DH, Acosta RD, Chandrasekhara V, Chathadi KV, Decker GA, Early DS, Evans JA, Fanelli RD, Fisher DA, Fonkalsrud L, Foley K, Hwang JH, Jue TL, Khashab MA, Muthusamy VR, Pasha SF, Saltzman JR, Sharaf R, Cash BD, DeWitt JM. The role of endoscopy in inflammatory bowel disease. Gastrointest Endosc. 2015 May;81(5):1101-21.e1-13. doi: 10.1016/j.gie.2014.10.030. Epub 2015 Mar 20. PMID: 25800660.
284. Keljo DJ, Markowitz J, Langton C, et al. Course and Treatment of Perianal Disease in Children Newly Diagnosed with Crohn’s Disease. Inflamm Bowel Dis. 2009 Mar; 15(3):383-387. doi:10.1002/ibd.20767.
285. Gecse KB, Bemelman W, Kamm MA, et al. A global consensus on the classification, diagnosis and multidisciplinary treatment of perianal fistulising Crohn’s disease. Gut. 2014; 63:1381–1392. doi:10.1136/gutjnl-2013-306709.
286. Водилова О.В., Мазанкова Л.Н., Халиф И.Л. Особенности течения болезни Крона в детском возрасте. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. - 2003. - Т.11. - №6. - С.69-73.
287. Geldof J, Iqbal N, LeBlanc JF, Anandabaskaran S, Sawyer R, Buskens C, Bemelman W, Gecse K, Lundby L, Lightner AL, Danese S, Spinelli A, Carvello M, Faiz O, Warusavitarne J, Lung P, De Looze D, D'Hoore A, Vermeire S, Hart A, Tozer P. Classifying perianal fistulising Crohn's disease: an expert consensus to guide decision-making in daily practice and clinical trials. Lancet Gastroenterol Hepatol. 2022 Jun;7(6):576-584. doi: 10.1016/S2468-1253(22)00007-3
288. Dupont-Lucas C, Dabadie A, Alberti C, Ruemmele FM; GETAID (Group d'Etude Thérapeutique des Affections Inflammatoires du Tube Digestif) Pédiatrique. Predictors of response to infliximab in paediatric perianal Crohn's disease. Aliment Pharmacol Ther. 2014 Oct;40(8):917-29. doi: 10.1111/apt.12928. Epub 2014 Aug 22. PMID: 25146368.
289. Forsdick VK, Tan Tanny SP, King SK. Medical and surgical management of pediatric perianal crohn's disease: A systematic review. J Pediatr Surg. 2019 Dec;54(12):2554-2558. doi: 10.1016/j.jpedsurg.2019.08.036.
290. Singer AAM, Gadepalli SK, Eder SJ, et al. Fistulizing Crohn’s Disease Presenting After Surgery on a Perianal Lesion. PEDIATRICS 2016 Mar; 137(3): e2 0152878. DOI: 10.1542/peds.2015-2878
291. Bouguen G, Siproudhis L, Bretagne JF, Bigard MA, Peyrin-Biroulet L. Nonfistulizing perianal Crohn's disease: clinical features, epidemiology, and treatment. Inflamm Bowel Dis. 2010 Aug;16(8):1431-42. doi:10.1002/ibd.21261.].
292. Шелыгин Ю.А., Кашников В. Н., Болихов К. В. и соавт. Эффективность илеостомии при болезни Крона толстой кишки с перианальными поражениями. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. - 2011. - Т.21. - №6. - С.64-68.
293. Щербакова О.В., Разумовский А.Ю., Шумилов П.В., Сытьков В.В. Хирургические подходы к лечению детей и подростков с перианальной болезнью Крона. Вестник хирургической гастроэнтерологии 2019. №4. С. 45-55.
294. Short SS, Dubinsky MC, Rabizadeh S, et al. Distinct phenotypes of children with perianal perforating Crohn’s disease. J Pediatr Surg. 2013 Jun; 48(6):1301–1305. doi:10.1016/j.jpedsurg.2013.03.027.
295. Al-Breiki S, Al-Faraidy N. A Crohn’s disease rectovaginal fistula in a nine year old girl masquerading as a case of sexual abuse, and literature review. Journal of the Saudi Society of Dermatology & Dermatologic Surgery. 2013;17:25–28. doi:10.1016/j.jssdds.2012.12.001.
296. Шелыгин Ю.А., Кашников В. Н., Болихов К. В., Варданян А.В. Предикторы эффективности илеостомии при осложненных формах болезни Крона толстой кишки. Анналы хирургии. - 2012. - №3. - С.37-42.
297. Akiba RT, Rodrigues FG, da Silva G. Management of Complex Perineal Fistula Disease. Clin Colon Rectal Surg. 2016 Jun;29(2):92-100. doi: 10.1055/s-0036-1580631. PMID: 27247533; PMCID: PMC4882183.
298. Rosen MJ, Moulton DE, Koyama T, et al. Endoscopic Ultrasound to Guide the Combined Medical and Surgical Management of Pediatric Perianal Crohn's Disease. Inflamm Bowel Dis. 2010 Mar; 16(3):461–468. doi:10.1002/ibd.21067.
299. Seemann NM, Elkadri A, Walters TD, Langer JC. The role of surgery for children with perianal Crohn's disease. J Pediatr Surg. 2015 Jan; 50(1):140-3. doi:10.1016/j.jpedsurg.2014.10.034.
300. Assa A., Amitai M., Greer M.-L., Castro D. A, Kuint R.C., Martınez-Leon M., Herman-Sucharska I., Coppenrath E., Anupindi S., Towbin A., Moote D., Konen O., Pratt L., Griffiths A., Turner D. Perianal Pediatric Crohn Disease Is Associated With a Distinct Phenotype and Greater Inflammatory Burden. JPGN 2017;65: 293–298. doi:0.1097/MPG.0000000000001484.
301. Dharmaraj R., Nugent M., Simpson P., Arca M., Gurram B., Werlin S. Outcomes after fecal diversion for colonic and perianal Crohn disease in children. J Pediatr Surg. 2017 Aug 24. pii: S0022-3468(17)30475-X. doi:10.1016/j.jpedsurg.2017.08.011
302. Bafford AC, Latushko A, Hansraj N, Jambaulikar G, Ghazi LJ. The Use of Temporary Fecal Diversion in Colonic and Perianal Crohn's Disease Does Not Improve Outcomes. Dig Dis Sci. 2017 Aug;62(8):2079-2086. doi: 10.1007/s10620-017-4618-7 Kuroki H, Sugita A, Koganei K, Tatsumi K, Nakao E, Obara N. Postoperative results and complications of fecal diversion for anorectal Crohn's disease. Surg Today. 2023 Mar;53(3):386-392. doi: 10.1007/s00595-022-02556-x
303. Щербакова О.В., Разумовский А.Ю., Шумилов П.В., Ионов А.Л. Выбор оптимальной стратегии лечения детей с болезнью Крона и кроноподобными иммунодефицитами с перианальными поражениями. Вопросы детской диетологии. 2019. Т. 17. № 1. С. 7-16. DOI: 10.20953/1727-5784-2019-1-7-16.
304. Stellingwerf ME, van Praag EM, Tozer PJ, Bemelman WA, Buskens CJ. Systematic review and meta-analysis of endorectal advancement flap and ligation of the intersphincteric fistula tract for cryptoglandular and Crohn's high perianal fistulas. BJS Open. 2019 Jan 21;3(3):231-241. doi: 10.1002/bjs5.50129. Erratum in: BJS Open. 2020 Feb;4(1):166-167. doi: 10.1002/bjs5.50249
305. Hain E., Maggiori L., Orville M., Tréton X., Bouhnik Y., Panis Y. Diverting Stoma for Refractory Ano-perineal Crohn’s Disease: Is It Really Useful in the Anti-TNF Era? A Multivariate Analysis in 74 Consecutive Patients. Journal of Crohn's and Colitis, 2019, 572–577. doi:10.1093/ecco-jcc/jjy195.
306. Galandiuk S, Kimberling J, Al-Mishlab TG, et al. Perianal Crohn Disease. Predictors of Need for Permanent Diversion. Ann Surg. 2005 May; 241(5):796–802. doi:10.1097/01.sla.0000161030.25860.c1.
307. Gasparetto M, Guariso G, Visona L, et al. Clinical course and outcomes of diagnosing Inflammatory Bowel Disease in children 10 years and under: retrospective cohort study from two tertiary centres in the United Kingdom and in Italy. BMC Gastroenterology. 2016; 16:35. doi:10.1186/s12876-016-0455-y.
308. Lawal TA, Frischer JS, Falcone RA, et al. The transanal approach with laparoscopy or laparotomy for the treatment of rectal strictures in Crohn's disease. J Laparoendosc Adv Surg Tech A. 2010 Nov; 20(9):791-5. doi:10.1089/lap.2009.0470.
309. Tozer PJ, Burling D, Gupta A, et al. Review article: medical, surgical and radiological management of perianal Crohn’s fistulas. Aliment Pharmacol Ther. 2011; 33:5–22.
310. Головенко А.О., Халиф И.Л., Головенко О.В. Профилактика послеоперационных рецидивов болезни Крона (обзор литературы). Колопроктология. - 2012. - № 4 (42). - С.40-48.
311. Engels M, Cross RK, Long MD. Exercise in patients with inflammatory bowel diseases: current perspectives. Clin Exp Gastroenterol. 2017 Dec 22;11:1-11. doi: 10.2147/CEG.S120816. PMID: 29317842; PMCID: PMC5743119.
312. Vanhelst J, Vidal F, Turck D, Drumez E, Djeddi D, Devouge E, Spyckerelle C, Zandzou SG, Legrand C, Michaud L, Béghin L, Gottrand F, Coopman S, Ley D. Physical activity is associated with improved bone health in children with inflammatory bowel disease. Clin Nutr. 2020 Jun;39(6):1793-1798]
313. Lowe W, Kenwright D, Wyeth J, Blair N. Crohn disease: effect on children's lifestyles. J Pediatr Gastroenterol Nutr. 2012 Mar;54(3):397-400. doi: 10.1097/MPG.0b013e318231cf17. PMID: 21857249.
314. Farrell D, Artom M, Czuber-Dochan W, Jelsness-Jørgensen LP, Norton C, Savage E. Interventions for fatigue in inflammatory bowel disease. Cochrane Database Syst Rev. 2020 Apr 16;4(4):CD012005. doi: 10.1002/14651858.CD012005.pub2. PMID: 32297974; PMCID: PMC7161727.
315. Ishige T, Shimizu T, Watanabe K, Arai K, Kamei K, Kudo T, Kunisaki R, Tokuhara D, Naganuma M, Mizuochi T, Murashima A, Inoki Y, Iwata N, Iwama I, Koinuma S, Shimizu H, Jimbo K, Takaki Y, Takahashi S, Cho Y, Nambu R, Nishida D, Hagiwara SI, Hikita N, Fujikawa H, Hosoi K, Hosomi S, Mikami Y, Miyoshi J, Yagi R, Yokoyama Y, Hisamatsu T. Expert consensus on vaccination in patients with inflammatory bowel disease in Japan. J Gastroenterol. 2023 Feb;58(2):135-157. doi: 10.1007/s00535-022-01953-w. Epub 2023 Jan 11. Erratum in: J Gastroenterol. 2023 Feb 10;: PMID: 36629948
316. Kucharzik T, Ellul P, Greuter T, Rahier JF, Verstockt B, Abreu C, Albuquerque A, Allocca M, Esteve M, Farraye FA, Gordon H, Karmiris K, Kopylov U, Kirchgesner J, MacMahon E, Magro F, Maaser C, de Ridder L, Taxonera C, Toruner M, Tremblay L, Scharl M, Viget N, Zabana Y, Vavricka S. ECCO Guidelines on the Prevention, Diagnosis, and Management of Infections in Inflammatory Bowel Disease. J Crohns Colitis. 2021 Jun 22;15(6):879-913. doi: 10.1093/ecco-jcc/jjab052. Erratum in: J Crohns Colitis. 2022 Aug 16
317. Rubin LG, Levin MJ, Ljungman P, Davies EG, Avery R, Tomblyn M, Bousvaros A, Dhanireddy S, Sung L, Keyserling H, Kang I; Infectious Diseases Society of America. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin Infect Dis. 2014 Feb;58(3):309-18
318. Martinelli M, Giugliano FP, Strisciuglio C, Urbonas V, Serban DE, Banaszkiewicz A, Assa A, Hojsak I, Lerchova T, Navas-López VM, Romano C, Sladek M, Veres G, Aloi M, Kucinskiene R, Miele E. Vaccinations and Immunization Status in Pediatric Inflammatory Bowel Disease: A Multicenter Study From the Pediatric IBD Porto Group of the ESPGHAN. Inflamm Bowel Dis. 2020 Aug 20;26(9):1407-1414
319. Dipasquale V, Romano C. Vaccination strategies in pediatric inflammatory bowel disease. Vaccine. 2017 Oct 27;35(45):6070-6075. doi: 10.1016/j.vaccine.2017.09.031. Epub 2017 Sep 28. PMID: 28967524
320. Методические указания МУ 3.3.1.1095—02. Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок
321. Санитарные правила и нормы СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней» Постановление главного санитарного врача от 28 января 2021 г. №4
322. Kammermeier J, Morris MA, Garrick V, et al. Management of Crohn’s disease. Arch Dis Child. 2016; 101:475–480. doi:10.1136/archdischild-2014-307217.
323. Turner D, Griffiths AM, Walters TD, Seah T, Markowitz J, Pfefferkorn M, Keljo D, Waxman J, Otley A, LeLeiko NS, Mack D, Hyams J, Levine A. Mathematical weighting of the pediatric Crohn's disease activity index (PCDAI) and comparison with its other short versions. Inflamm Bowel Dis. 2012 Jan;18(1):55-62
324. Turner D, Levine A, Walters TD, Focht G, Otley A, López VN, Koletzko S, Baldassano R, Mack D, Hyams J, Griffiths AM. Which PCDAI Version Best Reflects Intestinal Inflammation in Pediatric Crohn Disease? J Pediatr Gastroenterol Nutr. 2017 Feb;64(2):254-260
325. De Cruz P, Kamm MA, Prideaux L, Allen PB, Desmond PV. Postoperative recurrent luminal Crohn's disease: a systematic review. Inflamm Bowel Dis. 2012 Apr;18(4):758-77. doi: 10.1002/ibd.21825. Epub 2011 Aug 9. PMID: 21830279
Приложение А1. Состав рабочей группы
Баранов Александр Александрович - акад. РАН, профессор, д.м.н.; почетный президент Союза педиатров России, советник руководителя НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В.Петровского», профессор кафедры педиатрии и детской ревматологии ФГАОУ «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), главный внештатный специалист педиатр Минздрава России
Намазова-Баранова Лейла Сеймуровна - акад. РАН, профессор, д.м.н., президент Союза педиатров России; паст-президент EPA/UNEPSA; руководитель НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В.Петровского», заведующая кафедрой факультетской педиатрии педиатрического факультета иснститута материнства и детства ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России (Пироговский Университет), главный внештатный детский специалист по профилактической медицине Минздрава России
Разумовский Александр Юрьевич - член-корр. РАН, д.м.н., проф., заведующий кафедрой детской хирургии ФГАОУ ВО РНИМУ имени Н.И. Пирогова Минздрава России (Пироговский Университет), руководитель Российской ассоциации детских хирургов
Хавкин Анатолий Ильич - д.м.н., профессор, заведующий кафедрой гастроэнтерологии и диетологии им. А.В. Мазурина, руководитель Московского областного центра детской гастроэнтерологии и гепатологии Научно-исследовательского клинического института детства Министерства здравоохранения Московской области; профессор кафедры педиатрии с курсом детских хирургических болезней Медицинского института Белгородского государственного национального исследовательского университета, председатель Общества детских гастроэнтерологов, гепатологов и нутрициологов России, Член Союза педиатров России.
Аверкина Наталья Анатольевна - к.м.н., главный специалист ФГБУ «Центральный научно-исследовательский институт организации и информатизации здравоохранения» Минздрава России, врач-гастроэнтеролог, врач-педиатр детского КДО НМИЦ ТИО им.ак. В.И.Шумакова, член Союза педиатров России
Аксельров Михаил Александрович, д.м.н., доцент, заведующий кафедрой детской хирургии ФГБОУ ВО Тюменского государственного медицинского университета, заведующий хирургическим отделением для детей №1 ГБУЗ ТО ОКБ №2 г. Тюмень, главный детский хирург Тюменской области, член РАДХ.
Бельмер Сергей Викторович - профессор, доктор медицинских наук профессор кафедры госпитальной педиатрии №2 ПФ ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, сопредседатель Общества детских гастроэнтерологов, гепатологов и нутрициологов, член союза педиатров России
Боровик Татьяна Эдуардовна - доктор медицинских наук, профессор, заведующая лабораторией питания здорового и больного ребенка Национального медицинского исследовательского центра здоровья детей Министерства здравоохранения Российской Федерации; профессор кафедры педиатрии и детской ревматологии Первого Московского государственного медицинского университета им. И.М.Сеченова (Сеченовский Университет)
Вишнёва Елена Александровна - д.м.н., профессор РАН, заместитель руководителя НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В.Петровского», профессор кафедры факультетской педиатрии педиатрического факультета института материнства и детства ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» (Пироговский Университет) Минздрава России, член Союза педиатров России
Волынец Галина Васильевна - д.м.н., главный научный сотрудник отдела гастроэнтерологии НИКИ педиатрии им. академика Ю.Е. Вельтищева ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России
Габрусская Татьяна Викторовна - к.м.н., член Союза педиатров России (участие в исходной версии документа)
Горелов Александр Васильевич - академик РАН, профессор, заместитель директора по научной работе ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора д.м.н., профессор кафедры детских болезней ФГАОУ «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
Горячева Ольга Александровна - к.м.н., педиатр, гастроэнтеролог, ГБУЗ «Морозовская детская городская клиническая больница ДЗМ», кафедры пропедевтики детских болезней педиатрического факультета РНИМУ имени Н.И. Пирогова
Гурова Маргарита Михайловна - доктор медицинских наук, ведущий научный сотрудник лаборатории Медико-социальных проблем педиатрии НИЦ ФГОУ ВО СПбГПМУ Минздрава России, профессор кафедры пропедевтики детских болезней с курсом общего ухода ФГОУ ВО СПбГПМУ Минздрава России, член Союза педиатров России, член Общества детских гастроэнтерологов, гепатологов и нутрициологов, заместитель главного врача по медицинской части СПб ГБУЗ КДЦД.
Захарова Ирина Николаевна - д.м.н., профессор, заведующая кафедрой педиатрии ГБОУ ДПО РМАПО Минздрава России, член Союза педиатров России (участие в исходной версии документа)
Зокиров Нурали Зоирович - д.м.н., заведующий кафедрой Академии последипломного образования ФГБУ ФНКЦ ФМБА России, ФГБУ «ФНКЦ детей и подростков ФМБА России», член Союза педиатров России
Кайтукова Елена Владимировна – к.м.н., заместитель руководителя по медицинской деятельности - руководитель консультативно-диагностического центра для детей, врач-гастроэнтеролог, в.н.с. отдела орфанных болезней и профилактики инвалидизирующих заболеваний НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В.Петровского», доцент кафедры факультетской педиатрии педиатрического факультета института материнства и детства ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России (Пироговский Университет), член Союза педиатров России
Комарова Елена Владимировна - д.м.н., заместитель руководителя по экспертизе инновационных методов лечения и реабилитации, врач-гастроэнтеролог, гл.н.с. отдела орфанных болезней и профилактики инвалидизирующих заболеваний НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В.Петровского», профессор кафедры факультетской педиатрии педиатрического факультета института материнства и детства ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России (Пироговский Университет), член Союза педиатров России
Камалова Аэлита Асхатовна - д.м.н., доцент, член Союза педиатров России (участие в исходной версии документа)
Караваева Светлана Александровна, д.м.н., профессор, заведующая кафедрой детской хирургии ФГБОУ ВО Северо-западного государственного медицинского университета им. И.И. Мечникова, профессор кафедры детской хирургии с курсом анестезиологии и реанимации ФГБОУ ВО СПбГПМУ им. акад. И.П. Павлова, ведущий хирург службы неонатальной хирургии детского городского многопрофильного клинического специализированного Центра высоких медицинских технологий (Детская городская больница №1 г.Санкт-Петербурга), член РАДХ.
Корниенко Елена Александровна - д.м.н., профессор, заведующая кафедрой гастроэнтерологии ФП и ДПО (Факультета послевузовского и дополнительного профессионального образования) Санкт-Петербургского государственного педиатрического медицинского университета (СПбГПМУ), главный детский гастроэнтеролог и эндоскопист г. Санкт-Петербург
Котин Алексей Николаевич, к.м.н., доцент кафедры детской хирургии ФГБОУ ВО СПбГПМУ им. И.П.Павлова, врач-детский хирург детского городского многопрофильного клинического специализированного Центра высоких медицинских технологий (Детская городская больница №1 г.Санкт-Петербурга), член РАДХ.
Лохматов Максим Михайлович - д.м.н., заведующий отделением эндоскопических исследований ФГАУ «НМИЦ здоровья детей» Минздрава России, профессор кафедры детской хирургии, урологии и уроандрологии Первого Московского государственного медицинского университета имени И.М. Сеченова, член Союза педиатров России
Мокрушина Ольга Геннадьевна, д.м.н., профессор кафедры детской хирургии им. Ю.Ф. Исакова РНИМУ им. Н.И. Пирогова, зам главного врача по хирургической помощи ДГКБ №13 им. Н.Ф. Филатова, член Ассоциации колопроктологов России, член РАДХ.
Морозов Дмитрий Анатольевич, д.м.н., профессор, главный внештатный детский хирурги Минздрава России, директор научно-исследовательского клинического института им. акад. Ю.Е.Вельтищева, заведующий кафедрой детской хирургии и урологии-андрологии им. проф. Л.П.Александрова Первого Московского государственного медицинского университета им. И.М.Сеченова (Сеченовский университет) член РАДХ.
Новикова Валерия Павловна – д.м.н., профессор, заведующая кафедрой пропедевтики детских болезней, заведующая лабораторией медико-социальных проблем в педиатрии НИЦ Санкт-Петербургского государственного педиатрического медицинского университета
Новожилов Владимир Александрович, д.м.н., доцент – заведующий кафедрой детской хирургии ФГБОУ ВО Иркутского государственного медицинского университета, профессор кафедры детской хирургии Иркутской государственной медицинской академии последипломного образования - филиала ФГБОУ ДПО РМАНПО Минздрава России, главный врач ОГАУЗ Городская Ивано-Матренинская детская клиническая больница г. Иркутска, член Ассоциации колопроктологов России, член РАДХ.
Панфилова Виктория Николаевна - д.м.н., доцент, член Союза педиатров России (участие в исходной версии документа)
Петряйкина Елена Ефимовна - д.м.н., директор РДКБ ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, профессор кафедры факультетской педиатрии педиатрического факультета РНИМУ имени Н.И. Пирогова, профессор кафедры доказательной медицины медицинского института РУДН, Главный внештатный специалист детский эндокринолог Департамента здравоохранения города Москвы
Печкуров Дмитрий Владимирович - д.м.н., профессор, член Союза педиатров России (участие в исходной версии документа)
Поддубный Игорь Витальевич - д.м.н., проф., заведующий кафедрой детской хирургии, Московский государственный медико-стоматологический университет им. А.И.Евдокимова
Подкаменев Алексей Владимирович - д.м.н., Санкт-Петербургский государственный педиатрический медицинский университет, доцент/проф. кафедры хирургических болезней детского возраста им. академика Г.А. Баирова, главный внештатный специалист детский хирург Минздрава России
Потапов Александр Сергеевич - д.м.н. профессор, начальник центра воспалительных заболеваний кишечника у детей, заведующий гастроэнтерологическим отделением ФГАУ «НМИЦ здоровья детей» Минздрава России; профессор кафедры педиатрии и детской ревматологии Первого Московского государственного медицинского университета им. И.М.Сеченова (Сеченовский Университет), член Союза педиатров России
Сварич Вячеслав Гаврилович, д.м.н., доцент, профессор кафедры хирургических болезней детского возраста им. Г.А. Баирова ФГБОУ ВО СПбГПМУ, член РАДХ.
Селимзянова Лилия Робертовна, заведующая отделом стандартизации и изучения основ доказательной медицины НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В.Петровского», доцент кафедры педиатрии и детской ревматологии ФГАОУ «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), доцент кафедры факультетской педиатрии педиатрического факультета института материнства и детства ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России (Пироговский Университет), член Союза педиатров России
Сичинава Ирина Вениаминовна – д.м.н., доцент по кафедре, профессор кафедры детских болезней ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), член Союза педиатров России
Скворцова Тамара Андреевна, к.м.н., главный внештатный детский специалист гастроэнтеролог Департамента здравоохранения г. Москва, руководитель Центра детской гастроэнтерологии и Центра ВЗК, заведующая отделением гастроэнтерологии ГБУЗ «Морозовская детская городская клиническая больница ДЗМ»
Степанова Наталия Маратовна, к.м.н., доцент кафедры детской хирургии ФГБОУ ВО Иркутского государственного медицинского университета, руководитель Центра коррекции аномалий развития аноректальной области и колоректальной хирургии детского возраста ОГАУЗ Городской Ивано-Матренинской детской клинической больницы г. Иркутска, член Ассоциации колопроктологов России, член РАДХ.
Сурков Андрей Николаевич, д.м.н., заведующий отделением гастроэнтерологии для детей стационара для детей, заведующий отделом научных основ детской гастроэнтерологии, гепатологии и метаболических нарушений НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В.Петровского», профессор кафедры факультетской педиатрии Института материнства и детства ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), член Союза педиатров России, Ассоциации колопроктологов России
Сытьков Валентин Вячеславович, к.м.н., доцент кафедры детской хирургии НОИ клинической медицины им Н.А. Семашко ФГБОУ ВО «Российский университет медицины» Минздрава России, колопроктолог, врач-детский хирург хирургического отделения ФГБУ «Федеральный научно-клинический центр детей и подростков Федерального медико-биологического агентства», член Союза педиатров России, член Российской ассоциации детских хирургов, Российского общества колоректальных хирургов
Рославцева Елена Александровна, к.м.н., старший научный сотрудник лаборатории питания здорового и больного ребенка Национального исследовательского медицинского центра здоровья детей Министерства здравоохранения Российской Федерации
Ткаченко Михаил Арнольдович, к.м.н., педиатр, гастроэнтеролог, главный внештатный гастроэнтеролог Комитета по Здравоохранению Ленинградской области, доцент кафедры поликлинической педиатрии имени академика А.Ф. Тура Санкт-Петербургского государственного педиатрического медицинского университета.
Федосеенко М.В., к.м.н., заведующая отделом разработки научных подходов к иммунизации пациентов с отклонениями в состоянии здоровья и хроническими болезнями, ведущий научный сотрудник, врач-педиатр НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В.Петровского», доцент кафедры факультетской педиатрии педиатрического факультета института материнства и детства ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России (Пироговский Университет), член Союза педиатров России
Федулова Эльвира Николаевна - д.м.н., профессор, член Союза педиатров России (участие в исходной версии документа)
Филиппов Дмитрий Владимирович - к.м.н., Санкт-Петербургский государственный педиатрический медицинский университет, доцент кафедры хирургических болезней детского возраста им. академика Г.А. Баирова
Цимбалова Екатерина Георгиевна - к.м.н., заведующая отделением гастроэнтерологии РДКБ филиал ФГАОУ ВО РНИМУ им. Н.И, Пирогова, руководитель центра гастроэнтерологии РДКБ филиал ФГАОУ ВО РНИМУ им. Н.И, Пирогова, координатор педиатрической группы РДКБ филиал ФГАОУ ВО РНИМУ им. Н.И. Пирогова, , член Союза педиатров России, член детской группы Российского общества по изучению ВЗК , член Европейской ассоциации по изучению язвенного колита и болезни Крона (ECCO)
Шумилов Петр Валентинович - д.м.н., профессор, член Союза педиатров России (участие в исходной версии документа)
Щербакова Ольга Вячеславовна - д.м.н., заведующая хирургическим отделением ФГБУ «ФНКЦ детей и подростков ФМБА России»
Щиголева Наталья Евгеньевна - к.м.н., член Союза педиатров России (участие в исходной версии документа)
Яблокова Екатерина Александровна – к.м.н., доцент кафедры детских болезней ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), член Союза педиатров России
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
1. Врачи-педиатры
2. Врачи общей практики (семейные врачи)
3. Врачи-гастроэнтерологи, осуществляющие медицинскую помощь детям
4. Врачи-колопроктологи
5. Врачи-детские хирурги
6. Врачи-эндоскописты
7. Медицинские работники со средним медицинским образованием
8. Организаторы здравоохранения
9. Врачи-эксперты медицинских страховых организаций (в том числе при проведении медико-экономической экспертизы).
Рекомендации составлены на основании данных литературы, Европейского доказательного консенсуса по диагностике и лечению БК у детей [9], представленного совместно Европейским обществом по изучению язвенного колита и болезни Крона и Европейским обществом педиатров гастроэнтерологов, гепатологов и нутрициологов (ESPGHAN) в 2014г, Британского [322] и Североамериканского [46], а также на основе доказательного консенсуса Всемирной Организации Здравоохранения по лечению ВЗК [11] и лечению перианальной формы БК [285]; клинических рекомендаций по лечению взрослых пациентов с БК - Европейских [194,253] и Российскими рекомендациями по диагностике и лечению болезни Крона у взрослых пациентов Российских Ассоциаций колопроктологов и гастроэнтерологов [1].
Клинические рекомендации отражают мнение экспертов по ключевым вопросам. В клинической практике могут возникать ситуации, выходящие за рамки представленных рекомендаций, поэтому окончательное решение о тактике ведения каждого пациента должен принимать лечащий врач, на котором лежит ответственность за его лечение.
Таблица 1.Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД |
Расшифровка |
|
1 |
Систематический обзор РКИ с применением мета-анализа |
|
2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
|
3 |
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР |
Расшифровка |
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1. Об утверждении порядка оказания педиатрической помощи (Приказ Министерства здравоохранения Российской Федерации N 366н от 16 апреля 2012 г.)
2. «Об утверждении порядка оказания медицинской помощи населению с заболеваниями толстой кишки, анального канала и промежности колопроктологического профиля» Приказ от 2 апреля 2010 г. № 206н Министерства здравоохранения и социального развития Российской Федерации;
3. «Об утверждении Порядка оказания медицинской помощи населению по профилю «гастроэнтерология»; приказ Минздрава России от 12 ноября 2012 г. № 906н
4. «Об утверждении Порядка оказания медицинской помощи по профилю «детская хирургия» приказ Минздрава России от 31 октября 2012 г. № 562н
Информация о лекарственных препаратах: https://grls.rosminzdrav.ru/
Основные нормативно-правовые акты, регулирующие оказание
паллиативной медицинской помощи
1. Федеральный закон "О внесении изменений в Федеральный закон "Об основах охраны здоровья граждан в Российской Федерации" по вопросам оказания паллиативной медицинской помощи" от 06.03.2019 № 18-ФЗ.
2. Приказ Минздрава России № 345н, Минтруда России от 31.05.2019 № 372н «Об утверждении положения об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья».
3. Приказ Минздрава России № 348н от 31 мая 2019 года «Об утверждении перечня медицинских изделий, предназначенных для поддержания органов и систем организма человека, предоставляемых для использования на дому».
4. Приказ Минздрава России № 505н от 10 июля 2019 года «Об утверждении Порядка передачи от медицинской организации пациенту (его законному представителю) медицинских изделий, предназначенных для поддержания функций органов и систем организма человека, для использования на дому при оказании паллиативной медицинской помощи».
Прочие нормативно-правовые документы, с учетом которых разработаны клинические рекомендации:
1. Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (Собрание законодательства Российской Федерации, 2011 г., № 48, ст. 6724);
2. Международная классификация болезней, травм и состояний, влияющих на здоровье (МКБ – 10);
3. 04.12.2023) "Об утверждении Номенклатуры должностей медицинских работников и фармацевтических работников" (Зарегистрировано в Минюсте России 01.06.2023 N 73664).
4. Приказ Минздравсоцразвития России от 23.07.2010 N 541н (ред. от 09.04.2018) "Об утверждении Единого квалификационного справочника должностей руководителей, специалистов и служащих, раздел "Квалификационные характеристики должностей работников в сфере здравоохранения" (Зарегистрировано в Минюсте России 25.08.2010 N 18247).
5. Федеральный закон от 25.12.2018 № 489 489-ФЗ «О внесении изменений в статью 40 Федерального закона "Об обязательном медицинском страховании в Российской Федерации" и Федеральный закон "Об основах охраны здоровья граждан в Российской Федерации" по вопросам клинических рекомендаций».
6. Приказ Минздрава России № 103н от 28.02.2019 г. «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации».
7. Приказ Минздрава России от 13.10.2017 N 804н "Об утверждении номенклатуры медицинских услуг".
8. Приказ Министерства труда и социальной защиты РФ от 27 августа 2019 г. n 585н "О классификациях и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы" (вступает в силу с 1 января 2020 года);
9. Приказ Минздрава России от 24.11.2021 N 1094н "Об утверждении Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, Порядка оформления указанных бланков, их учета и хранения, форм бланков рецептов, содержащих назначение наркотических средств или психотропных веществ, Порядка их изготовления, распределения, регистрации, учета и хранения, а также Правил оформления бланков рецептов, в том числе в форме электронных документов" (Зарегистрировано в Минюсте России 30.11.2021 N 66124)
10. Приказ Министерство здравоохранения и социального развития Российской Федерации «О порядке применения лекарственных средств у больных по жизненным показаниям» от 9 августа 2005 г. № 494
11. Информационное письмо Минздрава России по возможности закупки лекарственного препарата по торговому наименованию (https://www.rosminzdrav.ru/news/2019/12/18/13043-minzdrav-podgotovil-informatsionnoe-pismo-po-vozmozhnosti-zakupki-lekarstvennogo-preparata-po-torgovomu-naimenovaniyu);
12. Постановление Правительства РФ от 30 июня 2020 г. № 965 «О внесении изменений в Правила формирования перечня лекарственных средств, закупка которых осуществляется в соответствии с их торговыми наименованиями, и о применении лекарственных препаратов с конкретными торговыми наименованиями»
13. Приказ Минздрава России от 23.09.2020 № 1008н «Об утверждении порядка обеспечения пациентов лечебным питанием»
Примеры диагнозов
При формулировании диагноза следует отразить протяженность поражения, характер течения заболевания, тяжесть текущей атаки или наличие ремиссии, наличие гормональной зависимости или резистентности, а также наличие осложнений БК, состояние роста. Ниже приведены примеры формулировок диагноза:
· Болезнь Крона: поражение 12-перстной, тощей и подвздошной кишки (L4a, L4b, L1), стриктурирующая форма (В2) (стриктура тощей кишки с нарушением кишечной проходимости), Хроническое непрерывное течение, гормональная резистентность, тяжелая атака, задержка роста (G1)
Приложение А3.1 Исследования, рекомендованные к проведению перед назначением иммунодепрессантов и ингибиторов фактора некроза опухоли альфа (ФНО-альфа)
[20].
|
Препараты |
Скрининг перед началом терапии |
Мониторинг в процессе лечения |
|
Иммунодепрессанты |
Туберкулез (см. раздел «Лабораторные методы») |
Общий (клинический) анализ крови развернутый и «печеночные ферменты» (определение активности аланинаминторансферазы (АЛТ), аспартатаминотрансферазы (АСТ), гамма-глютамилтрансферазы (ГГТ), щелочной фосфатазы в крови) каждые 3 месяца |
|
Тест на беременность перед метотрексатом**1 | ||
|
Рассмотреть определение титров антител к вирусу Epstein-Barr | ||
|
Ингибиторы фактора некроза опухоли альфа (ФНО-альфа) |
Туберкулез2 (см. Раздел «Лабораторные методы» |
Общий (клинический) анализ крови развернутый и «печеночные ферменты» (определение активности аланинаминторансферазы (АЛТ), аспартатаминотрансферазы (АСТ), гамма-глютамилтрансферазы (ГГТ), щелочной фосфатазы в крови) каждый визит (с инфузией), скрининг на туберкулез - ежегодно |
|
HbSAg3 | ||
|
Методы визуализации в случае подозрения на наличие интраабдоминального или параректального абсцесса или фистулы (см. раздел «Инструментальные методы» | ||
|
|
1Только для девушек.
2Рассмотреть необходимость обследования на гистоплазмоз, в зависимости от региона проживания
3Рекомендовать соответствующую вакцинацию.
Приложение А3.2 Расшифровка примечаний
· …** – лекарственный препарат, входящий в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2021 год (Распоряжение Правительства РФ от 12.10.2019 № 2406-р, от 23 ноября 2020 г. № 3073-р)
· # - применение off-label – вне зарегистрированных в инструкции лекарственного средства показаний осуществляется согласно ФЗ №323-ФЗ от 21.11.2011г. с изменениями;
· *** - медицинское изделие, имплантируемое в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи.
Примеры формулировки диагноза
· Болезнь Крона: илеоколит с поражением терминального отдела подвздошной кишки, слепой и восходящей ободочной кишки (L3), пенетрирующая форма осложненная инфильтратом брюшной полости, наружным кишечным свищом и перианальными поражениями (передняя и задняя анальные трещины) (В3р), среднетяжелая атака, хроническое рецидивирующее течение, без нарушения роста (G0)
· Болезнь Крона: терминальный илеит (L1), стенозирующая форма (стриктура терминального отдела подвздошной кишки без нарушения кишечной проходимости) (В2), хроническое рецидивирующее течение, ремиссия, без нарушения роста (G0).
· Болезнь Крона: колит с поражением восходящей ободочной, сигмовидной и прямой кишки (L2), воспалительная форма (В1р), хроническое непрерывное течение, тяжелая атака. Перианальные проявления в виде анальной трещины. Гормональная зависимость, без нарушения роста (G0).
· Болезнь Крона: колит с поражением прямой, сигмовидной и нисходящей ободочной кишки (L2), хроническое рецидивирующее течение, минимальной активности, осложненный стриктурой сигмовидной кишки с супрастеностическим расширением (В2), без нарушения роста (G0).
Приложение Б. Алгоритмы действий врача

Приложение Б1. Алгоритм лечения БК
[10]

Приложение В. Информация для пациента
БК – хроническое воспалительное заболевание ЖКТ, которое может затрагивать любой отдел ЖКТ, от ротовой полости до заднего прохода и перианальной области.
На настоящий момент способа полностью исцелиться от этого заболевания не существует, поэтому при БК в большинстве случаев проводится постоянное лечение различными препаратами, чтобы подавить и ограничить распространение воспаления, а также, чтобы предотвратить развитие осложнений.
При БК чередуются периоды усиления заболевания (рецидивы) и периоды улучшения самочувствия (наступает ремиссия).
У очень небольшой части больных ремиссия может сохраняться и без лечения, однако, в подавляющем большинстве случаев без постоянной терапии развиваются частые обострения и, главное, прогрессирует необратимое повреждение кишечной стенки. Со временем это приводит к осложнениям, которые включают сужение кишки (стриктуру), свищи (гнойные ходы из кишечника на кожу, во влагалище, в мочевой пузырь или в другую петлю кишки), перианальные поражения, общее истощение организма (кахексию) и даже рак. Эти осложнения могут угрожать жизни и часто требуют операции с удалением части кишечника, иногда – с формированием кишечной стомы.
Поскольку БК – достаточно редкое заболевание, ребенку с этой болезнью необходимо регулярно наблюдаться у врача, специализирующегося на лечении именно данной патологии, и строго следовать его рекомендациям по длительной, нередко, пожизненной, лекарственной терапии.
Следует отказаться от курения, в т.ч., пассивного, т.к. курение негативно влияет на течение болезни. Ни уровень физической нагрузки, ни прием конкретных продуктов питания, не влияют на риск обострения БК так, как влияет на него нерегулярный прием лекарств и несвоевременное обращение к специалисту.
Приложение Г1 - Г... Шкалы оценки, вопросники
Приложение Г1. Педиатрический индекс активности болезни Крона PCDAI
Название на русском языке: Педиатрический индекс активности болезни Крона PCDAI
Оригинальное название: PCDAI (Pediatric Crohn’s Disease Activity Index)
Источник (официальный сайт разработчиков, публикация с
валидацией): [323,324]
Тип: индекс
Назначение: определение активности болезни Крона у детей
Содержание (шаблон):
|
Критерии |
|
балл |
|
Боли в животе |
Нет |
0 |
|
Малой интенсивности |
5 | |
|
Сильной интенсивности |
10 | |
|
Стул, частота, консистенция |
0-1 раза в день, жидкий без примесей крови |
0 |
|
2-5 раза в день, с небольшой примесью крови |
5 | |
|
Более 6 раза в день |
10 | |
|
Самочувствие, активность |
Нет ограничения активности |
0 |
|
Умеренное ограничение активности |
5 | |
|
Значительное ограничение активности |
10 | |
|
Масса тела |
Нет снижения массы тела |
0 |
|
Снижение массы тела на 1-9% |
5 | |
|
Снижение массы тела более 10% |
10 | |
|
Рост |
Ниже одного центеля |
0 |
|
От 1-2 центелей |
5 | |
|
Ниже двух центелей |
10 | |
|
Болезненность в животе |
Нет болезненности |
0 |
|
Болезненность, отмечается уплотнение |
5 | |
|
Выраженная болезненность |
10 | |
|
Параректальные проявления |
нет |
0 |
|
Активная фистула, болезненность, абсцесс |
10 | |
|
Внекишечные проявления |
нет |
0 |
|
одно |
5 | |
|
Более двух |
10 | |
|
Гематокрит у детей до 10 лет |
>33 |
0 |
|
28-32 |
2,5 | |
|
<28 |
5 | |
|
Гематокрит (девочки 11-18 лет) |
>34 |
0 |
|
29-34 |
2.5 | |
|
<29 |
5 | |
|
Гематокрит (мальчики 11-14 лет) |
>35 |
0 |
|
30-34 |
2,5 | |
|
<30 |
5 | |
|
Гематокрит (мальчики 15-18 лет) |
>37 |
0 |
|
32-36 |
2,5 | |
|
<32 |
5 | |
|
СОЭ (мм/час) |
<20 |
0 |
|
20-50 |
2,5 | |
|
>50 |
5 | |
|
Альбумин (г/дл) |
>3.5 |
0 |
|
3.1-3.4 |
5 | |
|
<3.0 |
10 |
· Ключ (интерпретация) PCDAI:
o <10 : отсутствие активности (ремиссия)
o 11-30 : легкая или среднетяжелая форма
o 30-100 : тяжелая форма
· Клинический ответ на лечение:
o Снижение индекса PCDAI ≥ 15 баллов по сравнению с исходным;
o суммарный индекс PCDAI ≤ 30 баллов
· Клиническая ремиссия:
o PCDAI ≤ 10 баллов
· Утрата ответа на лечение:
o Увеличение PCDAI ≥ 15 баллов или PCDAI> 30 баллов
Пояснения: нет.
Приложение Г2. Макро- и микроскопические признаки БК в биоптате тонкой кишки в соответствии с обновленными Порто критериями
Оригинальное название (если есть): ESPGHAN revised Porto criteria for the diagnosis of inflammatory bowel disease in children and adolescents
Источник (официальный сайт разработчиков, публикация с валидацией): Levine A., Koletzko S., Turner D., et al. ESPGHAN revised Porto criteria for the diagnosis of inflammatory bowel disease in children and adolescents – J.Pediatric Gasroenterol Nutr., 2014, v.58 (6), p.795-806 [17]
Тип:
другое (уточнить): критерии
Назначение: постановка диагноза болезни Крона
Содержание (шаблон):
Ключ (интерпретация):
Макро- и микроскопические признаки болезни Крона у детей
|
Макроскопические |
Микроскопические |
|
Специфические: · Афтозные язвы · Щелевидные линейные или извитые язвы · Булыжная мостовая в терминальном илеуме · Стеноз с престенотической дилатацией · Утолщение стенки кишки с сужением просвета · Перианальные поражения (свищи, абсцессы, язвы или стеноз анального канала) · Язвы в тощей или подвздошной кишках |
Специфические: · Неказеозные гранулемы на расстоянии от крипт · Очаговость и неравномерность воспаления · Трансмуральный характер инфильтрата · Подслизистый фиброз |
|
Неспецифические: · Отек · Гиперемия · анимость · Гранулярность · Локальная потеря сосудистого рисунка |
Неспецифические: · Гранулема, прилежащая к разрыву крипты · Слабый воспалительный инфильтрат в собственной пластинке СОК · Эрозии и поверхностные язвы СОК · Нарушение архитектоники крипт, уменьшение бокаловидных клеток, метаплазия клеток Панета |
Пояснения: нет.
Приложение Г3. Шкала эндоскопической активности послеоперационного рецидива болезни Крона по Rutgeerts
Оригинальное название: Rutgeerts scoring system for endoscopic recurrence 158 of Crohn’s Disease
Источник (официальный сайт разработчиков, публикация с валидацией): [37,274,280,325]
Тип: шкала оценки
Назначение: оценка эндоскопической активности послеоперационного рецидива болезни Крона
Содержание:
Ключ (интерпретация):
|
|
Оценка |
Определение |
|
Эндоскопические признаки ремиссии |
i0 |
Нет признаков воспаления |
|
i1 |
<5 афтозных язв | |
|
Эндоскопические признаки рецидива |
i2 |
>5 афтозных язв с нормальной слизистой оболочкой между ними или протяженные участки здоровой слизистой оболочки между более выраженными изъязвлениями или поражения, ограниченные подвздошно-толстокишечным анастомозом. |
|
i3 |
Диффузный афтозный илеит с диффузно воспаленной слизистой оболочкой | |
|
i4 |
Диффузное воспаление с крупными язвами, «булыжной мостовой» и/или сужением просвета. |
Пояснения: нет.
.
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.











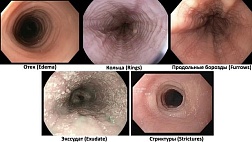


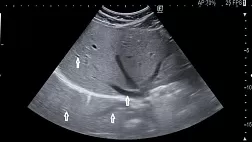


.jpg)




.png)















Комментарии