КЛИНИЧЕСКИЕ
РЕКОМЕНДАЦИИ
по лечению кровотечений из варикозно расширенных вен пищевода и желудка
2013
ПРОЕКТ
1.Введение
К настоящему времени накоплен существенный опыт ведения и лечения пациентов с кровотечениями из варикозно расширенных вен пищевода и желудка, который по-ложен в основу представленных рекомендаций [2, 4, 7]. Кровотечение из варикозно расширенных вен пищевода – завершающее звено в последовательности осложне-ний цирроза печени, вызванных прогрессирующим фиброзом ткани печени, блоком току крови через ее ткань, развитием синдрома портальной гипертензии, за которым следует сброс крови по путям коллатерального кровообращения, в т.ч. прогресси-рующее расширение вен пищевода с последующим их разрывом. Сегодня усилия врачей направлены на предотвращение развития последовательных стадий порталь-ной гипертензии и на поиск терапевтических и хирургических методов, позволяющих радикально уменьшить давление в системе воротной вены и таким образом пред-упредить риск развития кровотечения из варикозно расширенных вен пищевода.
Другой подход, это использование местной эндоскопической терапии варикозно расширенных вен с целью профилактики их разрыва [3, 5, 17]. Группой авторов про-веден анализ отечественных и зарубежных работ с целью выработки единых подхо-дов ведения пациентов с циррозом и портальной гипертензии, а также разработка текущих рекомендаций по предотвращению и терапии кровотечений из варикозно расширенных вен. В рекомендациях сделан акцент на нерешенных проблемах и перспективах на будущее, открываемых новыми исследовательскими разработками.
В настоящее время абсолютно очевиден жизнеугрожающий характер данного ос-ложнения цирроза печени. Варикозно расширенные вены пищевода выявляются у 30-40 % больных с компенсированным циррозом печени и у 60% с декомпенсиро-ванным циррозом, на момент его диагностики [4, 8, 24, 25]. Частота кровотечений из варикозно расширенных вен пищевода составляет 4% в год. Риск увеличивается до 15% у пациентов с венами средних и крупных размеров [26].
Риск развития повторного кровотечения очень высок и зависит от тяжести цирроза: в первый год рецидив наблюдается у 28% пациентов со степенью А (по Child-Pugh), у 48% – с B, у 68% – с C [10].
Несмотря на достижения последних десятилетий, кровотечения из ВРВ пищевода и желудка сопровождаются смертностью в 10– 20% в течение 6 недель [17, 18, 22].
Рекомендации по диагностике и лечению пациентов с кровотечениями из варикозно расширенных вен пищевода и желудка, служат руководством для практических вра-чей, осуществляющих ведение и лечение таких пациентов в стационарах различного
Авторы
доктор медицинских наук, профессор Анисимов Андрей Юрьевич (Казань) доктор медицинских наук, профессор Верткин Аркадий Львович (Москва) доктор медицинских наук, профессор Девятов Андрей Васильевич (Ташкент) доктор медицинских наук Дзидзава Илья Игоревич (Санкт-Петербург) доктор медицинских наук, профессор, академик РАМН Ивашкин Владимир Трофимович (Москва) доктор медицинских наук Киценко Евгений Александрович (Москва) доктор медицинских наук, профессор Котив Богдан Николаевич (Санкт-Петербург) кандидат медицинских наук Лопаткина Татьяна Николаевна (Москва) доктор медицинских наук, профессор Маевская Марина Викторовна (Москва) доктор медицинских наук, профессор Назыров Феруз Гафурович (Ташкент) доктор медицинских наук, профессор Огурцов Павел Петрович. (Москва) доктор медицинских наук, профессор Павлов Чавдар Савович. (Москва) доктор медицинских наук, профессор Прудков Михаил Иосифович (Екатеринбург) доктор медицинских наук Хоронько Юрий Владиленович (Ростов-на-Дону) доктор медицинских наук, профессор Чжао Алексей Владимирович (Москва) доктор медицинских наук, профессор Шерцингер Александр Георгиевич (Москва)
уровня. Они подлежат регулярному пересмотру в соответствии с новыми данными научных исследований в этой области.
Рекомендации сопровождаются пояснениями об уровне и доказательности отдель-ных положений, согласно принятым международным правилам Оксфордской систе-мы (таблица 1) [14].
Таблица 1. Уровни доказательности приводимых научных утверждений
Уровень доказательности Пояснения А Доказательство I уровня или устойчивые многочисленные данные II уровня доказательности В Доказательства II, III или IV уровня, считающиеся в целом устойчивыми данными С Доказательства II, III, IV уровня, но данные в целом неустойчивые.
D Слабые или несистематические эмпирические доказательства Рекомендации Пояснения
I
Доказательства получены в результате метаанализа большого числа хорошо спланированных рандомизированных исследований. Рандомизированные исследования с низким уровнем ложнопозитивных и ложнонегативных ошибок
II
Доказательства основаны на результатах не менее одного хорошо спланированного рандомизированного исследования.
Рандомизированные исследования с высоким уровнем ложнопозитивных и ложнонегативных ошибок.
III
Доказательства основаны на результатах хорошо спланированных нерандомизированных исследований.
Контролируемые исследования с одной группой больных, исследования с группой исторического контроля и т.д.
IV
Доказательства получены в результате нерандомизированных исследований. Непрямые сравнительные, описательно корелляционные исследования и исследования клинических случаев
V Доказательства основаны на клинических случаях и примерах
Настоящие рекомендации содержат: введение, этиология и патогенез портальной ги-пертензии, диагностика варикозно расширенных вен пищевода и желудка, лечение – медикаментозное, эндоскопическое, эндоваскулярное, хирургическое.
2. Этиология и патогенез
Портальная гипертензия – часто встречающийся клинический синдром, который с точки зрения нарушения гемодинамики характеризуется, патологическим увеличе-нием градиента давления в воротной вене (разность давления в воротной и нижней полой вене). Портальная гипертензия приводит к образованию портосистемных кол-латералей, через которые отводятся часть кровотока из воротной вены в системный кровоток в обход печени [1, 4, 9]. Нормальные значения градиента давления в во-ротной вене составляют 1–5 мм рт. ст.
О клинически значимой портальной гипертензии говорят при наличии ее клиниче-ских проявлений (расширения диаметра воротной и селезеночной вены по данным УЗИ, асцита, варикозно расширенных вен пищевода, желудка, прямой кишки) или когда градиент портального давления превышает пороговое значение 10 мм рт. ст.
Значение градиента портального давления в интервале 5–9 мм рт. ст. соответствует доклинической стадии портальной гипертензии [3–6].
2.1. Этиология и классификация
Портальная гипертензия наблюдается при любом патологическом процессе, сопро-вождающемся нарушением кровотока в системе воротной вены. В соответствии с анатомическим расположением препятствия для кровотока причины портальной ги-пертензии могут быть классифицированы как подпеченочные (с вовлечением селе-зенки, брыжеечной или воротной вены), внутрипеченочные (заболевания печени) и надпеченочные (заболевания, приводящие к блокированию венозного оттока выше печени).
Таблица 2. К лассификация портальной гипертензии в соответствии с анатомической областью бло-ка кровотоку в воротной вене
Подпеченочные Тромбоз селезеночной вены Тромбоз воротной вены Врожденный стеноз воротной вены Наружное сдавливание воротной вены Артериовенозная фистула
Внутрипеченочные Цирроз (вирусный, алкогольный, билиарный, метаболический) Гранулематозные заболевания (шистосомоз, саркоидоз, туберкулез,первичный билиарный цирроз Фокальная нодулярная гиперплазия* Врожденный фиброз печени Поликистоз* Идиопатическая портальная гипертензия* Гипервитаминоз А Отравление мышьяком, сульфатом меди, мономерным винилхлоридом Амилоидоз Мастоцитоз Болезнь Рандю-Ослера-Вебера Инфильтрация печени при гематологических заболеваниях Острая жировая дистрофия печени беременных Тяжелый острый вирусный или алкогольный гепатит Хронический активный гепатит Гепатоцеллюлярная карцинома Отравление цианамидом Веноокклюзионная болезнь Надпеченочные Тромбоз печеночных вен (синдром Бадда-Киари) Врожденные мальформации и тромбоз нижней полой вены Констриктивный перикардит Поражение трехстворчатого клапана
* Носит «пресинусоидальный» характер.
По данным статистики в развитых странах цирроз печени обусловливает около 90% случаев портальной гипертензии. В развивающихся странах, кроме цирроза, частой причиной служит поражение мелких ветвей воротной вен при шистосомозе.
Нецирротическая портальная гипертензия (вследствие воздействия других пато-генетических факторов) составляет от 10 до 20% из всех случаев развития данного синдрома [18].
Наиболее распространенной причиной подпеченочной портальной гипертензии яв-ляется тромбоз воротной вены (ТВВ). У взрослых до 70% случаев начала развития тромбоза обусловлены тромбофилическими синдромами – врожденными (такие, как дефицит белка С и S) или приобретенными (такие, как хронические формы миело-пролиферативного синдрома). Среди других факторов определенную роль в патоге-незе ТВВ играют: сепсис, травма живота и хирургическое вмешательство в брюшной полости. Примерно в 30% случаев не удается установить точный механизм развития тромбоза («идиопатический» ТВВ) [18]. Острый ТВВ диагностируется редко. Для него характерны следующие клинические признаки: боль в животе, повышение температу-ры, диарея и непроходимость кишечника в случаях присоединения тромбоза сосудов кишки. Диагноз обычно подтверждают данные методов визуализации (УЗИ брюшной полости с допплерографией, КТ ангиографическое исследование). Хронический ТВВ характеризуется образованием коллатеральных сосудов, которые создают «шунт», минуя препятствия току крови. Часто у таких пациентов на передней брюшной стенке можно увидеть характерный признак «голова медузы». У пациентов с хроническим ТВВ первым признаком портальной гипертензии часто служит эпизод кровотечения из варикозно расширенных вен.
Наиболее частой причиной надпеченочной портальной гипертензии является син-дром Бадда-Киари (тромбоз печеночных вен). Обтурация может возникнуть в основ-ных печеночных венах или в надпеченочном сегменте нижней полой вены. В качестве дополнительных факторов патогенеза часто выявляют ряд тромбофилических на-рушений в рамках миелопролиферативного заболевания. Среди других осложнений ТВВ необходимо помнить о возможности развития асцита и присоединения печеноч-ной недостаточности на фоне кровотечения из желудочно-кишечного тракта. Те-рапию проводят антикоагулянтными препаратами для предотвращения повторного развития и прогрессирования тромбоза. Наложение сосудистого портокавального анастомоза или трансъюгулярного внутрипеченочного портосистемного шунта реко-мендуется пациентам, состояние которых не улучшается в результате медикаментоз-ной терапии. Пациентам с тяжелой печеночной недостаточностью показана транс-плантация печени [10, 11].
Внутрипеченочные причины портальной гипертензии классифицируют в соответ-ствии с результатами при катетеризации печеночной вены. Такая классификация включает:
(a) пресинусоидальную ПГ: нормальное значение заклинивающего и свободного ве-нозного давления в печени (ЗВДП и СВДП); (b) синусоидальную ПГ: повышенное ЗВДП и нормальное СВДП; (c) постсинусоидальную ПГ: повышенное ЗВДП и СВДП.
Любые этиологические факторы хронических заболеваний печени, приводящие к развитию цирроза печени, за исключением хронического холестатического синдро-ма, вызывают синусоидальную ПГ [6, 10].
3. Диагностика варикозного расширения вен пищевода и желудка
В настоящее время ЭГДС является «золотым стандартом» как в диагностике ВРВ пи-щевода и желудка, так и в выборе лечебной тактики. Эндоскопическое исследование позволяет определить не только наличие, но и локализацию варикозных вен, оценить степень их расширения, состояние стенки вены, слизистой оболочки пищевода и же-лудка, выявить сопутствующую патологию, а также стигматы угрозы кровотечения [24, 32].
В нашей стране наиболее широкое применение получила классификация варикозных вен по степени выраженности [11]: I степень – диаметр вен 2–3 мм II степень – диаметр вен 3–5 мм III степень – диаметр вен >5 мм
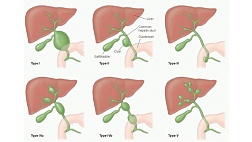
По локализации выделяют: изолированное варикозное расширение вен пищевода (ограниченный варикоз средней и нижней третей пищевода или тотальный варикоз) и варикозное расширение вен желудка. При варикозном расширении вен желудка выделяют 4 типа вен: I тип – гастроэзофагеальные ВРВ с распространением на кар-диальный и субкардиальный отделы малой кривизны желудка; II тип – гастроэзофа-геальные ВРВ от эзофагокардиального перехода по большой кривизне по направле-нию к дну желудка; III тип – изолированные ВРВ желудка без ВРВ пищевода – вари-козная трансформация вен фундального отдела желудка; IV тип – эктопические узлы тела, антрального отдела желудка, двенадцатиперстной кишки (рис. 1) [5].
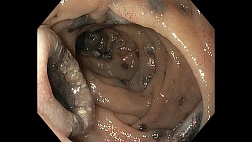
Наличие и выраженность васкуло- и гастропатии Васкуло- и гастропатия – это совокупность ма-кроскопических проявлений, наблюдаемых в слизистой оболочке пищевода и желудка при портальной гипертензии, связанных с эктазией и дилатацией сосудов слизистого и подслизи-стого слоев без значительных воспалительных изменений (рис. 2). • Легкая – небольшие участки розового цвета, окруженные белым контуром. • Средняя – плоские красные пятна в центре розовой ареолы • Тяжелая – сочетание с точечными кровоиз-лияниями
Определение степени дилатации пищевода: • Умеренная • Выраженная
Определение напряжения варикозно расширенных вен: • Вены при инсуффляции воздуха спадаются (не напряжены) – давление в порталь-ной системе невысокое и риск развития кровотечения мал • Вены при инсуффляции, не спадаются (напряжены) – давление в портальной систе-ме высокое, соответственно, высокий риск развития кровотечения.
Рис. 1. Классификация ВРВ желудкапо локализации
Рис. 2. Степени гастропатии: I – легкая, II – средняя, III – тяжелая [28].
I
II
III
Определение сопутствующей патологии Прогностические критерии возникновения кровотечения из ВРВ пищевода и желудка по эндоскопическим данным: • Степень ВРВ; • Локализация ВРВ; • Степень дилатации пищевода; • Напряжение ВРВ – спадение вен при инсуффляции воздухом; • Тяжесть васкулопатии для вен пищевода и тяжесть гастропатии для ВРВ желудка.
При выборе лечебной тактики у больных с ЦП необходимо оценить функциональное состояние печени. Для оценки тяжести состояния больных ЦП применяется класси-фикация по Child-Pugh (табл. 3) [4, 6, 10].
Таблица 3. Прогностическая шкала Child-Pugh (классификация печеночно-клеточной функции при ЦП)
Критерии оценки Количество баллов 1
2
3
Асцит отсутствует небольшой большой Степень энцефалопатии нет 1–2 3–4 Билирубин (ммоль/л) < 34 34–51 > 51 Альбумин (г/л) > 35 28–35 < 28 Протромбиновый индекс(%) >70 50–70 < 50 Общее количество баллов Класс
5–6
A
7–9
B
10–15
C
При функциональном классе ЦП «А» и «В» проведение хирургического вмешатель-ства считается возможным, при декомпенсированном ЦП (класс «С») риск операции предельно высок, а при возникновении кровотечений из ВРВ пищевода и желудка преимущество следует отдавать консервативным или малоинвазивным методам ле-чения.
4. Лечение
Основными причинами пищеводно-желудочных кровотечений при порталь-ной гипертензии являются: • Гипертонический криз в портальной системе; • Трофические изменения слизистой пищевода и желудка вследствие нарушения ге-моциркуляции и воздействия кислотно-пептического фактора; • Нарушения свертывающей системы.
Единого мнения относительно того, какой из этих факторов является основным, до настоящего времени нет [4, 7, 11, 13].
Рис. 3. Патогенез пищеводно-желудочных кровотечений при ПГ
Основные цели лечения: • Остановка кровотечения • Возмещение кровопотери • Лечение коагулопатии • Предотвращение рецидивов кровотечения Предотвращение ухудшения функции печени и осложнений, обусловленных кровоте-чениями (инфекции, печеночная энцефалопатия и т. д.) [3,12, 15,17].
Лечение острого кровотечения из ВРВ (рекомендации Baveno V) • Восполнение ОЦК, используя осторожное введение СЗП (1B; A) • Трансфузия эритромассы для поддержания Hb 80 г/л (1B; A) • Использование антибиотикотерапии для профилактики спонтанного бактериаль-ного перитонита (1a; A) • Профилактика печеночной энцефалопатии (5; D) • ЭГДС проводится сразу же при поступлении в стационар (5; D) • Баллонная тампонада должна использоваться только при массивном кровотече-нии как временная мера (2B; B) • При подозрении на кровотечение из ВРВ должны быть назначены вазоактивные препараты как можно раньше (1a; A) • ЭЛ является рекомендуемым методом гемостаза, при невозможности выполнить можно использовать ЭС (1B; A) • При кровотечении из ВРВ желудка используется тканевой адгезив (N-butyl-cyanoacrylate) [18] (5; D)
Алгоритм лечения острого варикозного кровотечения представлен на рис. 4.
4.1. Медикаментозное
В соответствии с механизмом снижения портального давления все лекарственные средства можно разделить на 2 основные группы: Венозные вазодилататоры • Нитроглицерин – периферический вазодилататор – снижает печеночный венозный градиент на 40–44% (перлинганит, изосорбид-5-мононитрат)
• Нитропруссид натрия (нанипрусс) • В качестве монотерапии нитраты используются редко и обычно применяются в комбинации с вазопрессином и его аналогами.
Рис. 4 Алгоритм лечения острого варикозного кровотечения
Дозировка: 1% – 1,0 мл раствора нитроглицерина (1 ампула перлинганита или на-нипрусса) на 400 мл раствора Рингера или физиологического раствора внутривенно капельно (10–12 капель в минуту). Включение нитратов в схему лечения возможно только при стабильной гемодинамике и на фоне проводимой коррекции гиповолемии препаратами гемодинамического действия.
Вазоконстрикторы • Соматостатин (стиламин, сандостатин, октреотид) – селективная вазоконстрикция внутренних органов, связанная с подавлением активности эндогенных вазодиля-таторов (в частности, глюкагон) и секреции соляной кислоты. Портальное давле-ние снижается на 20–25%. Октреотид вводится первоначально болюсно в дозе 50–100 мкг, затем переходят на длительную внутривенную инфузию в дозе 25–50 мкг/час в течение 5-7 дней. • Вазопрессин, глипрессин, терлипрессин (Реместип) – уменьшают артериальный приток в портальную систему, снижая портальное давление на 30–40%.
Терлипрессин: 1. Снижение портального давления на 30–40%. Эффект достигается в течение 5 минут. 2. Повышает АД на 15–20% и снижает частоту Ps на 15%. 3. Уменьшается число переливаний крови. 4. Остановка кровотечения у больных ЦП в течение 12 часов – 70% (плацебо 30%). 5. Рекомендовано вводить пациентам с подозрением на варикозное кровотечение до проведения эндоскопической диагностики. 6. При невозможности немедленного привлечения квалифицированных специали-стов по эндоскопии использование препарата улучшает выживаемость. 7. При кровотечениях неясного генеза 8. Для предупреждения и лечения гепаторенального синдрома. 9. Терлипрессин применяют вначале в виде болюсной инъекции в дозе 2 мг, а затем внутривенно по 1 мг каждые 6 часов (2–5 суток по показаниям) [13,18,27, 31].
Все терапевтические препараты, применяемые при кровотечениях на фоне порталь-ной гипертензией, перечислены в таблице 4.
Таблица 4. Дозы лекарственных препаратов, используемых для сниженияпортального давления при циррозе
лекарственный препарат Способ введения ДозаД прлиимтеелньенноисять Вазопрессин (ВП) + нитроглицерин (НП) ВП: в.в. инфузия Нг: подкожно
ВП: 0,4 мке/мин Нг: 20 мг
2–5 дней (острое кровотечение)
терлипрессин в.в. болюсная инъекция
2 мг/4 ч. в течение 24-48 ч., затем 1 мг/4 ч.
2–5 дней (острое кровотечение)
Соматостатин
в.в. болюсная инъекция, затем в.в. инфузия
250 мкг, затем 250–500 мкг/ч 2–5 дней (острое кровотечение)
Остреотид
в.в. болюсная инъекция, затем в.в. инфузия
50 мкг, затем 50 мкг/ч 2–5 дней (острое кровотечение)
Вапреотид
в.в. болюсная инъекция, затем в.в. инфузия
50 мкг, затем 50 мкг/ч 2–5 дней (острое кровотечение)
Пропранолол (неселективный ББ) Перорально
20 мг 2 раза в день; увеличение дозы до максимально переносимой (320 мг/день)
Постоянно (первичная и вторичная профилактика)
Надолол (неселективный ББ) Перорально
40 мг 2 раза в день; увеличение дозы до максимально переносимой (максимально 160 мг/день)
Постоянно (первичная и вторичная профилактика)
Карведилол (неселективный ББ с действием альфа-блокатора)
Перорально
6,25 мг 2 раза в день; увеличение дозы до максимально переносимой (50 мг/день)
Постоянно (первичная и вторичная профилактика)
изосорбид мононитрат Перорально
10–20 мг 2 раза в день; увеличение до 20–40 два раза в день при переносимости
Постоянно, только в сочетании с ББ (первичная и вторичная профилактика)
4.2.П рименение зонда-обтуратора Сенгстакена-Блекмора
После постановки диагноза «кровотечение из ВРВ пищевода или желудка» и извле-чения эндоскопа незамедлительно вводят зонд-обтуратор Сенгстакена-Блекмора и раздуваются манжетки, чем достигается надежный гемостаз (рис. 5).
Необходимо помнить, что введение зонда и пребывание его в носоглотке в течение многих часов – тяжело переносимая больным процедура, поэтому перед его введени-ем обязательным условием является премедикация (1,0 мл 2 % раствора промедола).
Зонд-обтуратор вводят через носовой ход, заводя желудочный баллон глубоко в же-лудок, предварительно замерив, расстояние от мочки уха до эпигастрия, что служит ориентиром правильного расположения зонда-обтуратора в пищеводе и желудке.
Затем при помощи градуированного шприца, присоединенного к катетеру желудоч-ного баллона, в последний вводят воздух в количестве 150 см3 (только не воду!) и катетер перекрывают зажимом. Зонд подтягивают до ощущения упругого сопротив-ления, чем и достигают сдавление вен в зоне кардии. После этого зонд фиксируют к верхней губе липким пластырем.
Пищеводный баллон раздувают редко и только в том случае, если продолжается срыгивание кровью, в противном случае достаточно разду-вания только желудочного баллона. Воздух в пищеводный баллон вводят небольшими пор-циями, первоначально 60 см3, в последующем – по 10–15 см3 с интервалом в 3–5 минут.
Соблюдение этих условий необходимо для того, чтобы дать возможность органам сре-достения адаптироваться к их смещению раз-дутым баллоном. Общее количество нагнетае-мого воздуха в пищеводном баллоне доводят обычно до 80–100 см3 в зависимости от вы-раженности дилатации пищевода и переноси-мости пациентом давления баллона на средо-стение.
После того как зонд установлен, аспирируют желудочное содержи-мое и промывают желудок холод-ной водой.
Контроль за кровотечением осу-ществляется путем динамическо-го наблюдения за желудочным содержимым, поступающим по зонду после тщательного промы-вания желудка.
Во избежание пролежней на сли-зистой оболочке пищевода че-рез 4 часа пищеводный баллон распускают, и если в этот мо-мент в желудочном содержимом примесь крови не появляется, то пищеводную манжетку остав-ляют спущенной. Желудочную манжетку распускают позже, спустя 1,5–2 часа. У больных с удовлетворительной функцией печени зонд должен находиться в желуд-ке еще в течение 12 часов для контроля за желудочным содержимым, а затем – удаляться.
В случае рецидива кровотечения зонд-обтуратор должен быть введен вновь, балло-ны раздуты, а больному ЦП (группа А и В) или ВПГ предложена операция или эндо-скопический гемостаз, ибо возможности консервативной терапии следует считать исчерпанными [3, 18].
4.3. Методы эндоскопического гемостаза
В клинической практике у нас применяются следующие методы эндоскопического гемостаза при кровотечении из ВРВ пищевода и желудка: • лигирование; • склеротерапия; • клеевые; • стентирование пищевода;
Рис. 6. Многозарядный эндоскопический лигатор фирмы Wilson-Cook.
Рис. 5. Схема расположения зонда
4.3.1. Эндоскопическое лигирование ВРВ пищевода
Для выполнения эндоскопического лигирования ВРВ пищевода используется устрой-ство Z.A. Saeed, которое поставляется в Россию в наборе на 6 или 10 латексных ко-лец фирмой Wilson-Cook Med. Inc. [1, 5, 26].
Показания к эндоскопическому лигированию: • профилактика и лечение кровотечений из ВРВ пищевода у больных с портальной гипертензией при невозможности хирургического лечения; • при наличии ВРВ пищевода у ранее оперированных больных или после эндоско-пического склерозирования вен кардиального отдела желудка; • невозможность лигирования вен фундального отдела желудка; • опасность эндоскопического лигирования при профузном кровотечении; • трудности выполнения эндоскопического лигирования после эндоскопического склерозирования ВРВ; • невозможность эндоскопического лигирования вен малого диаметра; • дифференцированный подход к лигированию ВРВ пищевода и желудка.
Вмешательство выполняют натощак, премедикацию за 30 минут до процедуры: про-медол 2% – 1,0 мл; метацин – 1,0 мл подкожно, реланиум – 2,0 мл внутримышечно.
Орошение глотки 1% раствором лидокаина (спрей). Эндоскоп с насадкой проводится через глоточное кольцо. Следует подчеркнуть не-обходимость перед сеансом лигирования выполнить диагностическую эндоскопию, так как пластмассовый цилиндр, надетый на дистальный конец эндоскопа, ухудшает обзор, делает его «туннельным».
После проведения эндоскопа с насадкой приступают к лигированию, при этом начи-нают с области эзофагокардиального перехода, чуть выше зубчатой линии.
Кольца накладывают по спирали, избегая наложения лигатурных колец в одной пло-скости по окружности для профилактики дисфагии в ближайшем и отдаленном пе-риодах.
Выбранный варикозный узел отсосом засасывается в цилиндр не менее чем на по-ловину высоты. После чего сбрасывают кольцо. Сразу же становится видно, что ли-гированный узел посинел. Следом необходимо возобновить подачу воздуха и не-
сколько извлечь эндоскоп: данные манипуляции позволяют удалить лигированный узел из цилиндра. За сеанс, в зависимости от выраженности ВРВ, накладывается от 6 до 10 лигатур.
Лигирование ВРВ при продолжающемся или состоявшемся кровотечения имеет не-которые технические особенности. Первую лигатуру необходимо накладывать на ис-точник кровотечения, а затем лигировать остальные ВРВ.
Первые сутки после ЭЛ назначают голод, но больной может пить. Со вторых суток – питание по 1-му столу, избегая больших глотков. Пища должна быть прохладной, жидкой или протертой. При болях назна-чаем альмагель А, содержащий анестезин.
При выраженных болях за грудиной назна-чают обезболивающие средства. Болевой синдром купируется обычно к 3-им суткам.
После ЭЛ с 3 по 7-е сутки лигированные узлы некротизируются, уменьшаются в раз-мерах, густо покрываются фибрином. К 7-8 суткам начинается отторжение некроти-ческих тканей с лигатурами и образованием обширных поверхностных изъязвлений.
Язвы заживают к 14–21-му дню, оставляя звездчатые рубчики, без стеноза просвета пищевода. К концу 2-го месяца после ЭЛ подслизистый слой замещается рубцовой тканью, а мышечный слой остается интактным. При отсутствии осложнений контрольная ЭГДС выполняется через месяц после ли-гирования. Дополнительные сеансы лигирования назначают при недостаточности первого сеанса, а также в связи с возникновением новых стволов варикозных вен с течением времени [1, 4, 19, 25].
Эндоскопическое лигирование ВРВ желудка Для выполнения эндоскопического лигирования ВРВ желудка используют лигиру-ющее устройство НХ-21 L-1 фирмы Olympus, в котором роль эластичного кольца
Рис. 7. Схема эндоскопического лигирования варикозных вен пищевода латексными кольцами играет нейлоновая петля диаметром 11 и 13 мм, которая соответствует размеру дис-тального колпачка.
Лигатор состоит из рабочей части с блоком управления и пластиковым тубусом для проведения инструмента через канал эндоскопа. Имеется прозрачный дистальный колпачок в наборе, соответствующий определенной модели гастроскопа. Рабочая часть представляет собой металлическую струну и собственно тягу с крючком.
После подготовки устройства и помещения прозрачного колпачка на дистальный ко-нец эндоскопа тубус вводят в канал эндоскопа, а затем через него проводят рабочую часть инструмента с предварительно надетой на крючок петлей. Когда петля появля-ется в поле зрения, ее укладывают в выемку на внутренней поверхности дистального края колпачка.
Вмешательство выполняют натощак, премедикацию за 30 минут до процедуры: про-медол 2% –1,0 мл; метацин – 1,0 мл подкожно, реланиум – 2,0 мл внутримышечно.
Орошение глотки 1% раствором лидокаина (спрей).
Эндоскоп с насадкой проводят через глоточное кольцо, после этого приступают к лигированию. Варикозную вену втягивают в колпачок при помощи аспиратора. Пет-лю затягивают до ощущения упора, после чего отстреливают плотно зафиксирован-ную лигатуру.
Для наложения следующей петли следует извлечь рабочую часть инструмента из ка-нала и повторить описанные действия. К положительным моментам данной методики относяится то обстоятельство, что нейлоновая петля сохраняется на лигированной вене желудка 7–14 дней в отличие от латексной легатуры фирмы Wilson Cook, кото-рая лизируется под действием желудочного сока и перистальтики [4, 5].
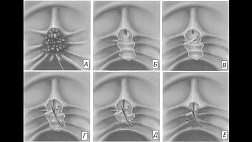
Комбинированное лигирование ВРВ пищевода и желудка ( 5) Принеобходимости лигировать пищеводно-желудочные ВРВ I и II типа у больных с ПГ используется следующая методика.
Вначале на ВРВ желудка накладывают нейлоновые петли, затем извлекают эндо-скоп, заряжают устройством фирмы Wilson Cook, после чего легируются латексными кольцами ВРВ эзофагокардиальной зоны и пищевода. Данный способ позволяет за один сеанс перевязывать до 14-15 варикозных узлов желудка и пищевода.
Опыт использования ЭЛ у больных с портальной гипертензией убедил в необходимо-сти пребывания больного в стационаре после данного вмешательства в течение 10 дней, а иногородним больным перед выпиской в обязательном порядке следует про-водить контрольную эндоскопию. Пациентам дают указания о характере пищи, за-прещают подъем тяжести, назначают обволакивающие и антисекреторные препара-ты. Такие ограничения режима рекомендовано соблюдать в течение 3 недель [5, 23].
Осложнения эндоскопического лигирования Общие • Реакция на латекс; • Гипертермия; • Аспирация желудочного содержимого.
Местные • Боли за грудиной; • Транзиторная дисфагия (1-3 сут); • Изъязвления слизистой оболочки и рецидивы ЖКК; • Перфорация пищевода; • Стриктура пищевода; • Образование ВРВ в фундальном отделе желудка. • Невозможность аспирировать ВРВ диаметром более 15 мм.
Рис. 8. Техника эндоскопического лигирования петлями Olimpus
Рис. 9. Алгоритм лечебных мероприятий при ранних рецидивах кровотечения после ЭЛ
Рис. 10. Алгоритм лечебных мероприятий при поздних рецидивах кровотечений после ЭЛ
4.3.2. Эндоскопическое склерозирование ВРВ пищевода
Метод эндоскопического склерозирования (ЭС) вен пищевода предложен в 1939 году C. Crafoord, P. Frenckner. Облитерация варикозных вен происходит после введения в просвет вены склерозанта через эндоскоп с помощью длинной иглы. Наряду с ин-травазальным способом склеротерапии существует метод паравазального ведения склерозанта, который основан на введении склерозанта рядом с веной, в результате чего происходит сдавление варикозных узлов, первоначально за счет отека, а затем за счет образования соединительной ткани.
Для интравазального введения чаще всего используют тетрадецилсульфат натрия (тромбовар) в количестве 5–10 мл на каждый вкол. После введения склерозанта не-обходимо сдавить вену в местах пункции, чем обеспечивают образование тромба в результате отека эндотелия сосуда. За один сеанс тромбируют не более 2 варикоз-ных стволов вен во избежание усиления застоя в ВРВ желудка.
Основной целью паравазальной склеротерапии является создание отека подсли-зистого слоя, что позволяет сдавить варикознодеформированную вену, тем самым, остановить кровотечение, а в последующем на 5-7 сутки за счет активизации скле-ротического процесса в подслизистом слое обеспечить создание рубцового каркаса [1, 2, 3, 5, 22, 29].
Процедура выполняется под местной анестезией 1% раствора лидокаина с пред-варительной премедикацией 1 мл 2% раствора промедола, 2 мл реланиума. Пред-варительно слизистая оболочка пищевода и желудка орошается 96% спиртом в количестве 10–12 мл. Склеротерапия начинается от области эзофагокардиального перехода и продолжается в проксимальном направлении. Из склерозирующих аген-тов, как правило, используется этоксисклерол (Германия), который содержит 5-20 мг полидоканола в 1мл этилового спирта. Чаще всего применяется этоксисклерол в 0,5% концентрации. При каждой инъекции вводят не более 3–4 мл склерозанта.
Обычно осуществляют от 15 до 20 вколов. За один сеанс расходуется до 24–36 мл склерозанта. Вводимый по инъектору склерозант создает по обеим сторонам вари-козной вены плотный отек, сдавливающий сосуд.
По окончании сеанса склеротерапии варикозные вены практически не определя-ются в отечной слизистой. Подтекание крови из мест проколов обычно незначи-тельно и не требует принятия дополнительных мер.
Ближайший период после сеанса склеротерапии обычно не сопровождается болевыми ощущениями. Больному разрешают пить и принимать жидкую пищу через 6–8 часов после процедуры.
После проведения 1-го сеанса склеротерапии через 5 дней повторяют процедуру, при этом стараются охватить участки пищевода с ВРВ, которые оказались вне зоны действия 1-го се-анса склеротерапии. 3-й сеанс склеротерапии проводят через 30 дней, при этом оценивают эффективность проводимого лечения, динамику уменьшения степени ВРВ и снятие угрозы кровотечения. 4-й сеанс склеротерапии назначают через 3 месяца.
Глубокий рубцовый процесс в подслизистом слое пищевода и желудка при проведении по-вторных сеансов ЭС предотвращает возмож-ность предсуществующим венозным коллате-ралям для их развития и варикозной трансформации.
Лечение продолжается до получения эффекта эрадикации, либо до достижения по-ложительного результата. Для этого требуется в среднем 4-5 сеансов склеротерапии в год. Динамический контроль осуществляется в последующем один раз в 6 месяцев.
В случае необходимости лечение повторяется.
Проведение склеротерапии при продолжающемся кровотечении имеет некоторые особенности. При обнаружении кровоточащей вены, в зависимости от локализации источника, введение склерозанта осуществляется по обе стороны кровоточащей вены. При этом приходится вводить значительное количество склерозанта до осу-ществления гемостаза.
Для достижения эффекта необходимое количество склерозанта нередко превышало 10–15 мл. Данное обстоятельство требует выполнения контрольной эндоскопии че-рез 3-4 дня после проведения эндоскопического гемостаза, нередко к этому времени уже формируется зона некроза участка слизистой оболочки.
При отсутствии осложнений больные подвергались контрольной эзофагогастродуо-деноскопии и в случае необходимости повторному склерозированию через 3, 6 ,12, 24, 36 месяцев [1, 2, 3, 5].
4.3.3 Применение клеевых композиций
В случаях когда склеротерапией не удается остановить кровотечение (при варикоз-ном расширении вен желудка), применяют цианокрилатные клеевые композиции.
Используют два тканевых клея:N-бутил-2-цианокрилат (гистоакрил) и изобутил-2-цианокрилат (букрилат). При попадании в кровь цианокрилат быстро полимеризуется (20 секунд), вызывая облитерацию сосуда, чем достигается гемостаз. Через несколь-ко недель после инъекции клеевая пробка отторгается в просвет желудка.
Время проведения инъекции ограничено 20 секундами из-за полимеризации гисто-акрила. Несоблюдение данного условия приводит к преждевременному застыванию клея в инъекторе, что не позволяет широко применять данный метод для лечения и профилактики кровотечений из ВРВ пищевода и желудка [18, 23].
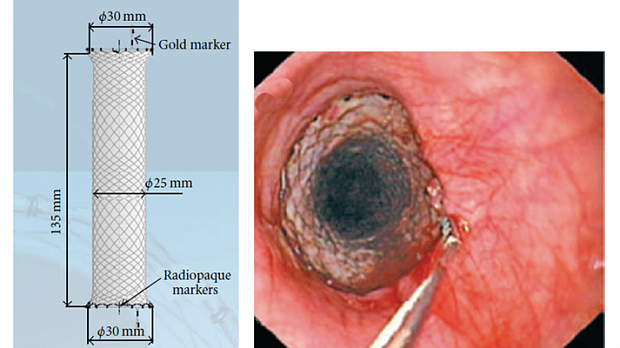
4.3.4. При неэффективности эндоскопического гемостаза и нали-чия источника кровотечения в пищеводе возможно использование стента Даниша (Danis, рис. 13) [15, 35, 36].
Рис. 11. Схема эндоскопического склерозирования ВРВ пищевода и желудка. А – паравазальное, Б – интравазальное
Рис. 12. А лгоритм действий при развитие осложнений после эндоскопической паравазальной склеротерапии
4.4. Эндоваскулярные методы лечения кровотечений из ВРВ пищевода и желудка
Плохая переносимость больными циррозом печени обширных травматических хи-рургических вмешательств послужила основанием для отказа от операций портока-вального шунтирования в пользу методики чреспеченочной чрескожной облитера-ции внеорганных вен желудка, описанного в 1974 году A.Lunderquist, J.Vang.
Смысл данного вмешательства заключается в разобщении портокавального перето-ка крови путем эмболизации левой желудочной и коротких вен желудка с помощью эмболизирующих материалов и металлической спирали Гиантурко, что позволяет снизить напряжение в ВРВ желудка и пищевода и тем самым уменьшить риск крово-течения (рис.14).
Эндоваскулярная эмболизация ВРВ желудка применяется с целью профилактики и лечения кровотечения из варикозно расширенных вен эзофагокардиальной зоны. Но она также эффективна при рецидивах кровотечений из вен желудка. Осуществить данную манипуляцию возможно только в клиниках, имеющих дорогостоящую рент-генангиографическую аппаратуру. Через 6 месяцев после первой процедуры необхо-димо повторять рентгенэндоваскулярную эмболизацию в связи с быстрой реканали-зацией тромбированных вен и высоким риском рецидива кровотечения.
Данный метод выпол-ним только у больных циррозом печени и проходимой ворот-ной веной. Фаталь-ным осложнением данной методики яв-ляется продолжен-ный тромбоз ворот-ной вены и последу-ющие неконтролиру-емые кровотечения из ВРВ пищевода и желудка.
4.5.TIPS
Большой интерес клиницистов вызвало внедрение в практику чрезъяремного вну-трипеченочного портосистемного шунтирования, разработанного J. Rosch и соавт. в 1969 году. Общепринято сокращенное название данной методики – TIPS (Transjugular intrahepatic portosystemic shunt).
После пункции яремной вены с помощью компактных сосуди-стых эндопротезов формируется внутрипеченочное соустье между крупными печеночными венами и ветвями воротной вены. В резуль-тате использования TIPS сохраня-ется гепатопетальный кровоток и осуществляется отчетливая пор-тальная декомпрессия (рис. 15).
Одним из показаний к данной про-цедуре является безуспешность проводимого консервативного и
Рис. 14. Эндоваскулярная эмболизация левой желудочной вены и коротких вен желудка
Рис. 13. Установка стента Даниша (Danis) в пищеводе
Рис. 15. Схема трансъюгулярного портокавального стентирования (TIPS)
эндоскопического лечения кровотечений из ВРВ пищевода и желудка.
Основными ранними осложнениями после установки TIPS является стенозирование и тромбоз шунта, что приводит к рецидиву кровотечения. Данное осложнение требу-ет повторной постановки стента.
К поздним осложнениям относят печеночную энцефалопатию, проявляющуюся у 30% больных. По мнению подавляющего большинства авторов, применение TIPS должно быть ограничено случаями профузных кровотечений из варикозно-расширенных вен пищевода и желудка у больных циррозом печени и портальной гипертензией, кото-рым планируется трансплантация печени [21, 24, 30].
При наличии высокого риска развития печеночной недостаточности целесообразнее использовать эндоскопические методы лечения ВРВ.
4.6. Хирургические методы лечения
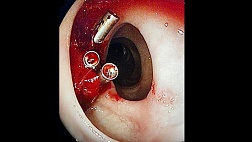
Методика операции прошивания варикозных вен желудка и пищевода (операция М.Д. Пациоры).
Производится верхняя срединная лапаротомия. На переднюю стенку желуд-ка ближе к кардии накладываются капроновые швы-держалки, между ко-торыми рассекают стенку желудка на протяжении 10÷12 см. Линия разре-за проходит продольно от дна желудка по направлению к малой кривизне (рис №169 a).
После вскрытия просвета желудка и отсасывания его содер жимого, в просвет же-лудка вводится зеркало, которым приподнимается верхняя часть передней стенки желудка. Затем хирург пальцами левой руки расправляет слизистую малой кривизны желудка ближе к пищеводному отверстию. Обычно этот прием дает возможность хо-рошо визуализировать варикозные вены кардии уходящие несколькими (обычно 3÷5) стволами в пищевод. Прошивание варикозно расширенных вен начинают, как правило, с малой кривизны желудка, с наиболее выраженного ствола отдельными узловыми швами (рисунок №16 в-г).
Затем, подтягивая за лигатуры, прошиваются вены пищевода, швы накладываются с интервалом 8÷10 мм. После обработки одного ствола переходят к прошиванию другого и т.д. Как правило, удается прошить вены в пищеводе на протяжении 2÷4 см выше эзофагокардиального перехода. Вены кардиального отдела прошивают также отдельными узловыми швами в «шахматном» порядке.
Во время прошивания иглу надо стараться проводить под стволом вены, не прошивая стенку желуд-ка или пищевода насквозь и не захватывая соседние вены. Если произошло повреждение стенки вены и началось кровотечение, последнее останавливают повтор-ным прошиванием.
В качестве шовного материа-ла рекомендуется использовать длительно рассасывающийся ма-териал: викрил, дексон, максон, полисорб, хромированн ый кетгут.
Не рекомендуется использовать нерассасывающийся шовный ма-териал: шелк, капрон, пролен и т.д., т.к. в области лигатур в по-следующем появляются лигатур-ные эрозии, которые могут явить-ся источником рецидив ирующих кровотечений.
Во время операции в пищеводе должен находиться для контроля желудочный зонд, который явля-ется ориентиром, чтобы не ушить просвет пищевода. После завер-шения основного этапа операции стенку желудка ушивают двухряд-ным швом.
Условия для прошивания вен пи-щевода у ранее оперированных больных ухудшаются. У них абдо-минальный доступ к кардиально-му отделу желудка значительно
Рис. 16. Гастротомия с прошиванием варикозно-рас-ширенных вен желудка и пищевода (этапы операции).
а – разрез передней стенки желудка; б – передняя стенка желудка приподнята, видны варикозно-рас-ширенные вены кардиального отдела желудка, ухо-дящие тремя стволами в пищевод; в – прошивание начинают с наиболее выраженного ствола по малой кривизне; г – подтягиванием за лигатуру низводят слизистую и прошивают вены абдоминального от-резка пищевода; д – вены прошиты в шахматном порядке.
затруднен из-за выраженных сращений и большой кровото чивости в зоне операции.
Передняя стенка желудка часто бывает прочно припаяна к передней брюшной стенке и левой доле печени.
В этой ситуации гастротомия может быть осуществлена через заднюю стенку желуд-ка, после вскрытия желудочно-ободочной связки.
Поэтому у ранее многократно оперированных больных в связи с выраженным спа-ечным процессом данное вмешательство выполняем из трансторакального доступа.
Гастротомия из торакального доступа, осуществляемая нами по 7÷8 межреберью слева с пересечением реберной дуги и последующей диафрагмот омией, выгодно отличается от гастротомии из абдоминального доступа тем, что создает хороший обзор области кардии и пищеводно-желудочного перехода и позволяет достаточно свободно прошить варикозно расширенные вены на протяжении 3÷5 см.
Операция заканчивается обязательным дренированием брюшной полост и (при абдо-минальном доступе) или плевральной (при трансторакальном доступе).
Пути улучшения непосредственных результатов прошивания ВРВ пищевода и желудка: • предоперационная подготовка при операции в плановом порядке: коррекция функциональных нарушений печени (для больных ЦП) и лечение трофических на-рушений в слизистой пищевода и желудка. При наличии рецидивов пищеводно-желудочного кровотечения у больных с ВПГ и ЦП группы А и В вопрос о срочной операции должен быть решен в течение 12–24 часов; • спленэктомия показана только при больших размерах селезенки, препятствующи-ми доступу к желудку; • абдоминальный доступ для выполнения операции является оптимальным у ранее не оперированных больных; • у больных с ВПГ и компенсированным ЦП – ранее многократно оперированных на брюшной полости, при невозможности выполнения ПКА данную операцию жела-тельно производить из трансторакального доступа; • абдоминальный доступ для выполнения операции является оптимальным у ранее не оперированных больных; • у больных с ВПГ и компенсированным ЦП ранее многократно оперированных на брюшной полости, при невозможности выполнения ПКА данную операцию жела-тельно производить из трансторакального доступа.
Важным моментом завершения операции является адекватное дренирование
Из послеоперационных осложнений у больных, оперированных по неотложным по-казаниям, возможно развитие асцит-перитонита. Поэтому антибиотикотерапию сле-дует начинать в операционной. В желудке устанавливается назогастральный зонд для введения гиперосмолярных растворов с целью быстрого очищения кишечника от крови, наряду с проведением сифонных клизм.
Довольно серьезным осложнением после операции является рецидив кровотечения после прорезывания лигатур в эзофагокардиальном отделе при прохождении пи-щевого комка. После введения зонда-обтуратора и остановки кровотечения оконча-тельный гемостаз достигается эндоскопическим обкалыванием 0,5% раствора эток-сисклерола места геморрагии [2, 4, 7].
Медикаментозная (вторичная) профилактика рецидива кровотечения должна начи-наться как можно скорее, так как первый эпизод желудочно-кишечного кровотече-ния у больных циррозом печени в 60% случаев сопровождается его рецидивом.
С этой целью назначаются неселективные бета-адреноблокаторы (пропранолол, на-долол, анаприлин, атенолол и др.), которые позволяют снизить риск рецидива кро-вотечения на 30-40%. Препараты назначаются в дозе, снижающей частоту пульса в покое на 25%, либо при исходно низком пульсе, до 55 ударов в минуту. При наличии противопоказаний альтернативой служит применение изосорбида мононитрата.
У данной группы пациентов возможно применение карведилола, который является неселективным бета-адреноблокатором с существенной анти-альфа1-адренерги-ческой активностью. В клинических исследованиях было показано, что назначение карведилола у больных циррозом печени вызывает более выраженное уменьшение портального давления.
В заключение совет экспертов еще раз подчеркивает, что решение клинической проблемы кровотечения из варикозных вен пищевода требует слаженных действий специалистов различных специальностей: гепатологов, эндоскопистов, хирургов, а постоянное совершенствование профессиональных знаний и практических умений врачей позволят сохранить жизнь наших пациентов.
Список литературы:
1. Аль-Сабунчи О. М. Обоснование принципов малоинвазивной хирургии в лече-нии кровотечений из варикозно расширенных вен пищевода: Автореф. дис. … докт. мед. наук. - М. – 2007. 41 с. 2. Борисов А.Е., Кузьмин-Крутецкий М.И., Кащенко В.А. и соавт. Кровотечения портального генеза. Санкт-Петербург. – 2001. – С. 25-149. 3. Ерамишанцев А.К., Киценко Е.А., Шерцингер А.Г., Жигалова С.Б. Кровотечения из ВРВ пищевода и желудка: диагностика, лечебная тактика (лекция) // Анналы хирургической гепатологии. –2006. –том.XI. –№2. –С105-111. 4. Ерамишанцев А.К., Шерцингер А.Г., Киценко Е.А. Портальная гипертензия. Кли-ническая хирургия: национальное руководство 2009 г, с 626-665. 5. Жигалова С.Б. Эндоскопические технологии в лечении и профилактике кро-вотечений из варикозно расширенных вен пищевода и желудка у больных с портальной гипертензией. Автореф. дис. … докт. мед. наук. - М. – 2011. 46 с. 6. Ивашкин В.Т. Болезни печени и желчевыводящих путей. Руководство для вра-чей. М., ИД «М-Вести», 2002 г. 7. Котив Б.Н. Хирургическая тактика и лечение пищеводно-желудочных крово-течений при портальной гипертензии: Дис. докт. мед. наук. –СПб. – 1998. – С. 6-132.
8. Мошарова А.А., Верткин А.Л. – Лечение и профилактика кровотечения из вари-козно расширенных вен пищевода. – Неотложная терапия, 1-2, 2012. С. 12-19. 9. Пациора М.Д. Хирургия портальной гипертензии. – Ташкент: Медицина. – 1984. – 319 с. 10. Шерлок Ш., Дули Дж. - Заболевания печени и желчных путей. - М.: ГЭОТАР Медицина. – 1999. 864 с. 11. Шерцингер А.Г. Патогенез, диагностика, профилактика и лечение кровотечений из варикозных вен пищевода и желудка у больных портальной гипертензией: Автореф. дис. …докт. мед. наук. – М. –1986. –310 с. 12. Abraldes JG, Bosch J. The treatment of acute variceal bleeding. J Clin Gastroenterol 2007; 41 Suppl 3: S312-S317 13. Abraldes JG, Villanueva C, Bañares R, Aracil C, Catalina MV, Garci A-Pagán JC, Bosch J. Hepatic venous pressure gradient and prognosis in patients with acute variceal bleedi ng treated with pharmacologic and endoscopic therapy. J Hepatol 2008; 48: 229-236
14. Available from: http://www.cebm.net/downloads/Oxford_EBM_Levels_5.rtf. 15. Angels Escorsell and Jaime Bosch. Self-ExpandableMetal Stents in the Treatment of Acute Esophageal Variceal Bleeding. Gastroenterology Research and PracticeVolume 2011.
16. Bambha K, Kim WR, Pedersen R, Bida JP, Kremers WK, Kamath PS. Predictors of early re-bleeding and mortality after acute variceal haemorrhage in patients with cirrhosis. Gut 2008; 57: 814-820 17. Bosch J, Abraldes JG, Berzigotti A, Garcia-Pagan JC. Portal hypertension and gastrointestinal bleeding. Semin Liver Dis 2008; 28: 3-25 18. de Franchis R. Revising consensus in portal hypertension: report of the Baveno V consensus workshop on methodolo gy of diagnosis and therapy in portal hypertension. J Hepatol 2010; 53: 762-768 19. Garcia-Pagán JC, Bosch J. Endoscopic band ligation in the treatment of portal hypertension. Nat Clin Pract Gastroenterol Hepatol 2005; 2: 526-535 20. Garcia-Pagan JC, Caca K, Bureau C, Laleman W, Appenrodt B, Luca A . An early decision for PTFE-TIPS improves survival in high risk cirrhotic patients admitted with an acute variceal bleeding. A multicenter RCT. ; : A373 21. Garcia-Tsao G, Bosch J, Groszmann RJ. Portal hyperten sion and variceal bleeding - unresolved issues. Summary of an American Association for the study of liver diseases and European Association for the study of the liver single-topic conference.
Hepatology 2008; 47: 1764-1772 22. Garcia-Tsao G, Bosch J. Management of varices and variceal hemorrhage in cirrhosis.
N Engl J Med 2010; 362: 823-832 23. Garcia-Tsao G, Sanyal AJ, Grace ND, Carey W. Prevention and management of gastroesophageal varices and variceal hemorrhage in cirrhosis. Hepatology 2007; 46: 922-938
24. Gilles Pomier-Layrargues, Louis Bouchard, Michel Lafortune, Julien Bissonnette, Dave Gu´erette, and Pierre Perreault. The Transjugular Intrahepatic Portosystemic Shunt in the Treatment of Portal Hypertension: Current Status. International Journal of Hepatology Volume 2012. 25. Gluud LL, Klingenberg S, Nikolova D, Gluud C. Banding ligation versus b-blockers as primary prophylaxis in esopha geal varices: systematic review of randomized trials. Am J Gastroenterol 2007; 102: 2842-2848; quiz 2841, 2849 26. Gonzalez R, Zamora J, Gomez-Camarero J, Molinero LM, Bañares R, Albillos A. Meta-analysis: Combination endos copic and drug therapy to prevent variceal rebleeding in
34
cirrhosis. Ann Intern Med 2008; 149: 109-122 27. Miñano C, Garcia-Tsao G. Clinical pharmacology of portal hypertension. Gastroenterol Clin North Am 2010; 39: 681-695 28. NIEC. Prediction of the first variceal hemorrhage in patients with cirrhosis of the liver and esophageal varices. A prospective multicenter study. The North Italian Endoscopic Club for the Study and Treatment of Esophageal Varices // N. Engl. J.
Med. – 1988; 319: 983-989. 29. Orloff MJ, Isenberg JI, Wheeler HO, Haynes KS, Jinich-Brook H, Rapier R, Vaida F, Hye RJ. Randomized trial of emergency endoscopic sclerotherapy versus emergency portacaval shunt for acutely bleeding esophageal varices in cirrhosis. J Am CollSurg 2009; 209: 25-40
30. Riggio O, Angeloni S, Salvatori FM, De Santis A, Cerini F, Farcomeni A, Attili AF, Merli M. Incidence, natural history, and risk factors of hepatic encephalopathy after transjugular intrahepatic portosystemic shunt with polytetrafluoroethylene-covered stent grafts. Am J Gastroenterol 2008; 103: 2738-2746 31. Ripoll C, Tandon P, Garcia-Tsao G. Should the Hepatic Ve nous Pressure Gradient Be Sequentially Measured to Monitor B-Blocker Therapy in the Prophylaxis of Variceal Hemor rhage? In: Donald Jensen. Controversies in hepatology: The experts analyze both sides. Thorofare: SLACK Incorporated, 2011: 123 32. Salvador Augustin, Antonio González, Joan Genescà. Acute esophageal variceal bleeding: Current strategies and new perspectives. World J Hepatol 2010 July 27; 2(7): 261-274.
33. Stiegmann G.V., Cambre Т., Sun J. A new endoscopic elastic band ligating device // Gastrointest. Endosc. – 1986; 32: 230-233. 34. Villanueva C, Aracil C, Colomo A, Lopez-Balaguer JM, Pi queras M, Gonzalez B, Torras X, Guarner C, Balanzo J. Clini cal trial: a randomized controlled study on prevention of variceal rebleeding comparing nadolol + ligation vs. hepatic venous pressure gradient-guided pharmacological therapy. Aliment Pharmacol Ther 2009; 29: 397-408 35. Wright G, Lewis H, Hogan B, Burroughs A, Patch D, O’Beirne J. A self-expanding metal stent for complicated variceal hemorrhage: experience at a single center.
Gastrointest Endosc 2010; 71: 71-78 36. Zehetner J, Shamiyeh A, Wayand W, Hubmann R. Results of a new method to stop acute bleeding from esophageal varices: implantation of a self-expanding stent. Surg Endosc 2008; 22: 2149-2152
36
















.jpg)





.png)


.jpg)













Комментарии