- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: ЭНДОЦИТОСКОПИЯ - НОВЫЙ МЕТОД ЭНДОСКОПИЧЕСКОГО ИССЛЕДОВАНИЯ: ОСНОВЫ И АЛГОРИТМ ВЫПОЛНЕНИЯ
| Авторы: | Пирогов С.С. 1 Соколов В. В. 2 Каприн А. Д. 3 Рябов А. Б. 4 Чуликов И. А. 5 2015г. |
| Об авторах: |
1. кандидат медицинских наук, заведующийотделом эндоскопии МНИОИ им. П. А. Герцена, филиал ФГБУ «НМИРЦ им. П. А. Герцена» МЗ РФ 2. доктор медицинских наук, профессор, руководитель эндоскопического отделения МНИОИ им. П. А. Герцена, филиал ФГБУ «НМИРЦ им. П. А. Герцена» МЗ РФ 3. доктор медицинских наук, профессор, член-корр. РАН, директор ФГБУ «НМИРЦ им. П. А. Герцена» МЗ РФ 4. доктор медицинских наук, руководитель отдела торако-абдоминальной онкологии МНИОИ им. П. А. Герцена, филиал ФГБУ «НМИРЦ им. П. А. Герцена» МЗ РФ 5. врач-ординатор эндоскопического отделения МНИОИ им. П. А. Герцена, филиал ФГБУ «НМИРЦ им. П. А. Герцена» МЗ РФ |
Аннотация:
Эндоцитоскопия является одним из наиболее новых методов эндоскопической диагностики, обеспечивающим исследование слизистой оболочки полых органов желудочно-кишечного тракта, дыхательных путей и ряда других полых органов с увеличением до 1150 раз, что позволяет оценивать ее тканевую и клеточную структуру непосредственно в процессе эндоскопического исследования. Данный метод, наряду с конфокальной лазерной эндомикроскопией, можно считать прижизненным морфологическим исследованием «оптической биопсией». В настоящее время все возможности эндоцитоскопии еще не исследованы, эндоцитоскопическое оборудование находится на стадии совершенствования прототипов. Эндоцитоскопия в настоящее время используется для уточняющей диагностики и оптической верификации предраковых состояний и раннего рака пищевода, желудка и толстой кишки, верхних дыхательных путей, а также раннего центрального рака легкого. Исследование выполняется при помощи различных моделей эндоцитоскопов, как вводимых в канал ширококанального материнского эндоскопа (так называемые, «baby-скопы») с фиксированным оптическим увеличением в 570-1150 раз, так и интегрированных моделей, обеспечивающих ступенчатое увеличение изображения от 80 до 380 раз. Как и для проведения традиционного цитологического исследования ex vivo, для выполнения эндоцитоскопии необходимо окрасить ядра эпителиоцитов слизистой оболочки исследуемого органа. С этой целью используются витальные красители метиленовый синий, толуидиновый синий и кристальный фиолетовый в различных концентрациях. 1 % водный раствор метиленового синего рекомендуется для витальной окраски ядер клеток, дифференцированных по плоскоклеточному типу в пищеводе, верхних дыхательных путях, трахее и бронхиальном дереве, в то время как для ядер эпителиоцитов кишечного типа: в пищеводе (при пищеводе Барретта), желудке (для оценки различных этапов предракового каскада P. Correa), а также в толстой кишке рекомендуется толуидиновый синий в такой же концентрации. Основные, исследуемые при эндоцитоскопии, критерии можно разделить на две группы: тканевые и клеточные. Тканевые критерии оцениваются, преимущественно, при визуализации кишечных типов эпителия: оценивается наличие контуров сосочков (ворсинок) и железистых структур слизистой оболочки, их форма и размер, а также целостность, наряду с полярностью расположения эпителиоцитов. Клеточными критериями, исследуемыми при эндоцитоскопии являются размер и форма ядер клеток, интенсивность их окраски витальным красителем.
Введение:
Endocytoscopy is one of the most novel endoscopic diagnostic procedures, providing optical magnification up to 1150 times of gastrointestinal and respiratory tract mucosa. Such approach allows real-time tissue and cellular structure visualization. Endocytoscopy, along with confocal laser endomicroscopy, can be considered as “optical biopsy” in
vivo. Of course, endocytoscopy currently is experimental diagnostic method, all available endocytoscopes are prototypes. According to published data, endocytoscopy can be used in precancerous conditions and early intramucosal cancer diagnostics in esophagus, stomach, colon and bronchial tree. Different types of endocytoscopes are used for examinations: some of them are baby-scopes, with fixed magnification 570-1150 times, introduced into accessory channel of the therapeutic parent-endoscope, others — are integrated type, providing scalable magnification from 80 to 380 times. As for traditional pathology ex vivo, for endocytoscopy mucosal cell nuclei stain is needed. For vital staining during endocytoscopy methylene blue, toluidine blue and crystal violet in different concentrations are more often used. In cases of squamous-cell dysplasia or cancer, it is recommended to use 1 % methylene blue solution, whereas in intestinal type metaplasia, dysplastic changes and cancer (Barrett’s esophagus, P. Correa precancerous cascade, colon adenomas), 1 % toluidine blue is preferred. With endocytoscopy, after vital staining, we can visualize and estimate mucosa tissue and cell characteristics: papillae, crypt and gland shapes and sizes, their integrity (tissue markers); cell nuclei size and shape, polarity and nuclear dye intensity (cell markers).
Eksperimental’naya i Klinicheskaya Gastroenterologiya 2015; 116 (4):12–21
Полный текст статьи:
Вам может быть интересно:
ЭНДОЦИТОСКОПИЯ НОВЫЙ МЕТОД ЭНДОСКОПИЧЕСКОГО ИССЛЕДОВАНИЯ ОРГАНОВ ЖЕЛУДОЧНО КИШЕЧНОГО ТРАКТА И ДЫХАТЕЛЬНЫХ ПУТЕЙ *
Пирогов С. С., Соколов В. В., Каприн А. Д., Соколов Д. В., Волченко Н. Н., Карпова Е. С., Павлов П. В., Телегина Л. В., Сухин Д. Г., Погорелов Н. Н., Рябов А. Б., Хомяков В. М., Чуликов И. А.
МНИОИ им. П. А. Герцена, филиал ФГБУ «НМИРЦ им. П. А. Герцена» МЗ РФ
Пирогов Сергей Сергеевич, кандидат медицинских наук, ведущий научный сотрудник эндоскопического отделения МНИОИ им. П. А. Герцена, филиал ФГБУ «НМИРЦ им. П. А. Герцена» МЗ РФ
Соколов Виктор Викторович, доктор медицинских наук, профессор, руководитель эндоскопического отделения МНИОИ им. П. А. Герцена, филиал ФГБУ «НМИРЦ им. П. А. Герцена» МЗ РФ
Каприн Андрей Дмитриевич доктор медицинских наук, профессор, член-корр. РАН, директор ФГБУ
«НМИРЦ им. П. А. Герцена» МЗ РФ
Соколов Дмитрий Викторович, доктор медицинских наук, старший научный сотрудник эндоскопического отделения МНИОИ им. П. А. Герцена, филиал ФГБУ «НМИРЦ им. П. А. Герцена» МЗ РФ
Волченко Надежда Николаевна, доктор медицинских наук, профессор, руководитель отдела патоморфологии МНИОИ им. П. А. Герцена, филиал ФГБУ «НМИРЦ им. П. А. Герцена» МЗ РФ
Карпова Елена Станиславовна, кандидат медицинских наук, старший научный сотрудник эндоскопического отделения МНИОИ им. П. А. Герцена, филиал ФГБУ «НМИРЦ им. П. А. Герцена» МЗ РФ
Павлов Павел Владимирович, кандидат медицинских наук, научный сотрудник эндоскопического отделения МНИОИ им. П. А. Герцена, филиал ФГБУ «НМИРЦ им. П. А. Герцена» МЗ РФ
Сухин Дмитрий Гарриевич, кандидат медицинских наук, научный сотрудник эндоскопического отделения МНИОИ им. П. А. Герцена, филиал ФГБУ «НМИРЦ им. П. А. Герцена» МЗ РФ
Погорелов Николай Николаевич, врач эндоскопического отделения МНИОИ им. П. А. Герцена, филиал ФГБУ
«НМИРЦ им. П. А. Герцена» МЗ РФ
Рябов Андрей Борисович, доктор медицинских наук, руководитель отдела торако-абдоминальной онкологии МНИОИ им. П. А. Герцена, филиал ФГБУ «НМИРЦ им. П. А. Герцена» МЗ РФ
Хомяков Владимир Михайлович, кандидат медицинских наук, руководитель отделения торако-абдоминальной онколо- гии МНИОИ им. П. А. Герцена, филиал ФГБУ «НМИРЦ им. П. А. Герцена» МЗ РФ
Чуликов Ислам Альвиевич, врач-ординатор эндоскопического отделения МНИОИ им. П. А. Герцена, филиал ФГБУ
«НМИРЦ им. П. А. Герцена» МЗ РФ
Sergey Pirogov, M. D., P. A. Herzen Moscow Cancer Research Institute, endoscopy department, lead researcher. Victor Sokolov, prof., Ph.D, M. D., P. A. Herzen Moscow Cancer Research Institute, head of endoscopy department Andrey Kaprin, prof., Ph.D, M. D., P. A. Herzen Moscow Cancer Research Institute, director
Dmitry Sokolov, Ph.D, M. D., P. A. Herzen Moscow Cancer Research Institute, endoscopy department, senior researcher Nadejda Volchenko, prof., Ph.D, M. D., P. A. Herzen Moscow Cancer Research Institute, head of pathology department Elena Karpova, M. D., P. A. Herzen Moscow Cancer Research Institute, endoscopy department, senior researcher
Pavel Pavlov, M. D., P. A. Herzen Moscow Cancer Research Institute, endoscopy department, researcher Dmitry Sukhin, M. D., P. A. Herzen Moscow Cancer Research Institute, endoscopy department, researcher Nikolay Pogorelov, P. A. Herzen Moscow Cancer Research Institute, endoscopy department, doctor
Andrey Ryabov, Ph.D, M. D., P. A. Herzen Moscow Cancer Research Institute, head of thoracic and abdominal oncology department Vladimir Khomyakov, Ph.D, M. D., P.A. Herzen Moscow Cancer Research Institute, vice-head of thoracic and abdominal oncology department Islam Chulikov, P. A. Herzen Moscow Cancer Research Institute, endoscopy department, trainee
Резюме
В большинстве опубликованных работ, посвященных исследованию возможностей эндоцитоскопии, опи- сывается ее применение при исследовании слизистой оболочки пищевода и желудка, однако, в ряде публи- каций, сообщается о ее использовании в качестве метода «оптической биопсии» тонкой и толстой кишки, а также — дыхательных путей и, даже — при лапароскопическом исследовании. Отдельные авторы сообщают о высокой точности эндоцитоскопии в оценке изменений слизистой оболочки 12-перстной кишки при целиа- кии, и возможности оптического стадирования данного заболевания по Marsch. Применение эндоцитоскопии в уточняющей диагностике заболеваний дргуих тонкой кишки в настоящее время ограничено, что обусловлено отсутствием прототипов эндоцитоскопов, совместимых с энтероскопами. При исследовании толстой кишки эндоцитоскопия используется достаточно широко, в первую очередь — для дифференциальной диагностики и картирования латерально-распространяющихся новообразований. Проф. S-E. Kudo разработал эндоцито- скопическую классификацию изменений слизистой оболочки толстой кишки, согласно которой, с точностью до 97,6% возможно дифференцировать гиперплазию слизистой оболочки, аденомы (включая оценку степени дисплазии эпителия), неинвазивную и инвазивную аденокарциному. В ряде публикаций также сообщается о возможности дифференциальной диагностики болезни Крона и неспецифического язвенного колита с использованием эндоцитоскопии. В исследовании дыхательных путей наибольший интерес представляют возможности эндоцитоскопии в выявлении предраковых изменений и раннего рака рото-, гортаноглотки и гортани, а также — оптической верификации раннего центрального рака легкого, данные предварительных исследований представляются многообещающими, однако, в настоящее время, применение эндоцитоскопии в исследовании бронхиального дерева все еще ограничено, что обусловлено отсутствием прототипов тонких эндоцито-бронхоскопов. Согласно данным отдельных работ, исследуется также возможность применения эндоцитоскопии в верификации метастатического поражения брюшины при диссеменированном раке желудка и яичников, а также — при эндоскопическом исследовании мочевого пузыря.
Экспериментальная и клиническая гастроэнтерология 2015; 117 (5):58–66
Введение
Эндоцитоскопия изначально была методом, разра- ботанным для уточняющей диагностики предра- ковых состояний и раннего плоскоклеточного рака пищевода и первые публикации с оценкой ее возможностей принадлежат проф. H. Inoue, раз- работавшему первую классификацию внутриэпи- телиальных капиллярных петель слизистой обо- лочки пищевода и первую эндоцитоскопическую классификацию изменений плоского эпителия пищевода [1]. Несколько позднее возможности эн- доцитоскопии в дифференциальной диагностике новообразований толстой кишки исследовал проф. S-E. Kudo [2]. В настоящее время, эндоцитоскопия начинает применяться и для исследования же- лудка, 12-перстной кишки, а также дыхательных путей и в ряде других органов и систем. Основ- ным преимуществом эндоцитоскопии является исследования эпителиальных новообразований слизистой оболочки с оптическим увеличением изображения от 380 до 1150 раз, что обеспечивает визуализацию тканевой и клеточной структуры слизистой оболочки
Эндоцитоскопия в исследовании 12-перстной кишки
Эндоцитоскопию в уточняющей диагности- ке заболеваний 12-перстной кишки используют сравнительно нечасто. Возможно, это обусловле- но тем фактом, что первичные злокачественные опухоли 12-перстной кишки и предраковые ее со- стояния — достаточно редко встречаемая патоло- гия. В настоящее время мировой опыт применения эндоцитоскопии в 12-перстной кишке сводится к уточняющей диагностике целиакии. При мор- фологическом исследовании слизистой оболочки 12-перстной кишки в случаях целиакии выявляется атрофия ворсинок, гиперплазия крипт и значи- тельная лимфаплазмацитарная инфильтрация. По мнению Matysiak-Budnik с соавт. данные измене- ния легко визуализируемы при эндоцитоскопии с увеличением в 570 раз после окраски слизистой оболочки 12-перстной кишки 1 % раствором мети- ленового синего (Рис 1,2,3,4) [3]. С учетом того, что целиакия очень редко правильно диагностирует- ся при обычном эндоскопическом исследовании и (в большинстве случаев, подтверждение диагноза требует выполнения множественной биопсии [4], эндоцитоскопия может стать методом выбора для диагностики данной патологии.
Н. Pohl с соавт., применяя эндоцитоскоп с уве- личением изображения в 1100 раз для уточняющей диагностики целиакии, пошли еще дальше, им удалось с высокой точностью стадировать тяжесть целиакии по Marsh. Так, III степень тяжести це- лиакии характеризовалась при эндоцитоскопии наличием полиморфных гиперхромных эпители- оцитов, расположенных нерегулярно, и четко не дифференцируемых от стромальных элементов (Рис 5, 6) [5]
Более широкого исследования возможностей эндоцитоскопии при заболеваниях 12-перстной кишки не проводилось, что обусловлено тем фактом, что все эндоцитоскопы в настоящее время являются прототипами. Было описано два клинических наблюдения возможностей эндо- цитоскопии в исследовании слизистой оболочки 12-перстной кишки. Watanabe с соавт. опублико- вал данные клинического наблюдения болезни Уиппла, исследованной с помощью эндоцитоско- пии [6]. Однако представленные авторами дан- ные — расширение ворсинок и макрофагальная инфильтрация могут свидетельствовать о любом воспалительном процессе слизистой оболочки 12-перстной кишки и значимость эндоцитоско- пии в уточняющей диагностике в таких случаях снижается. Возможно, применение витального красителя, отличного от метиленового синего, например — сходного с PAS, могло бы увеличить специфичность эндоцитоскопии при болезни Уиппла. В клиническом случае, представленном H. Newmann, исследовался «полип» 12-перстной кишки [7]. Подвижность полипа не позволила ориентировать и фиксировать эндоцитоскоп на фокусном расстоянии. Таким образом, пред- ставляется наиболее значимым использовать эндоцитоскопию в уточняющей диагностике стелящихся образований 12-перстной кишки, с целью выявления в них фокусов малигнизации и целиакии.
Эндоцитоскопия в исследовании тонкой кишки
В настоящее время опубликовано всего 2 исследо- вания, посвященных описанию клинических слу- чаев исследования новообразований тонкой кишки с использованием эндоцитоскопии. H. Shiwaku и S. Kudo с соавт. [8] выявили в терминальной части подвздошной кишки латерально-распространяю- щуюся плоско-углубленную опухоль размерами до 9 мм (Рис.), при осмотре в режиме NBI с опти- ческим увеличением в 150 раз — имеющую архи- тектонику ямок типа V по Kudo-классификации (Рис. 7,8), что могло бы соответствовать инвазив- ной аденокарциноме, при локализации опухоли в толстой кишке.
Однако, при эндоцитоскопии с предваритель- ной окраской слизистой оболочки раствором кристального фиолетового, было выявлено на- личие веретенообразных ядер клеток, распо- ложенных регулярно рядами вдоль базальной мембраны, просветы выводных протоков желез имели щелевидную форму, значимого ядерного полиморфизма не было выявлено (Рис. 9). Авто- рами сделано заключение, что данное образова- ние является аденомой без фокусов аденокарци- номы, что было подтверждено гистологическим исследованием (Рис. 10). Таким образом, обычные эндоскопические методы обеспечили гиперди- агностику и только эндоцитоскопия позволи- ла четко определить степень неопластической прогрессии.
A. Fasoli с соавт. [9] исследовали ex-vivo с помо- щью эндоцитоскопа Olympus XEC-300U с увеличе- нием х1100 удаленный препарат нейроэндокринной опухоли илеоцекального клапана с окраской его 1 % раствором метиленового синего. При эндо- цитоскопии, выполненной через 1 час после уда- ления опухоли в препарате было выявлено нали- чие «островков» плотно лежащих мономорфных мелких округлой формы ядер опухолевых клеток (Рис. 11, 12).
Эндоцитоскопия является многообещающим методом в дифференциальной диагностике ново- образований тонкой кишки. Однако, в настоящее время не существует прототипов эндоцитоскопов достаточной для осмотра тонкой кишки длины. В ряде случаев, возможен только осмотр под- вздошной кишки с применением эндоцитоскопа, вводимого в канал «материнского» колоноскопа. Кроме того, известно, что подавляющее боль- шинство опухолей подвздошной кишки имеют нейроэндокринную дифференцировку, и опухо- левые клетки располагаются обычно в глубоких частях слизистой оболочки и в подслизистом слое [10]. Современные же прототипы эндоцитоскопов обеспечивают исследование только на глубину не более 30 мкм [11], то есть — поверхностных частей слизистой оболочки и, соответственно, визуализация опухолевых клеток при нейроэн- докринных опухолях тонкой может быть затруд- нена. Для «оптической биопсии» аденогенных опухолей тонкой кишки применение эндоцито- скопии, как и в других отделах желудочно-ки- шечного тракта, полностью оправдано, так как может обеспечить точную информацию об их гистологическом строении.
Эндоцитоскопия в исследовании толстой кишки
Первые данные о возможности использования эндоцитоскопии в уточняющей диагностике заболеваний толстой кишки появились еще в 2007 году — с появлением первого прототипа эндоцитоскопа [2]. Подавляющее большинство исследований воз- можностей эндоцитоскопии толстой кишки в на- стоящее время посвящено дифференциальной диагностике полиповидных и латерально-рас- пространяющихся образований. С момента появ- ления узкоспектральной эндоскопии NBI, а поз- же — и с оптическим увеличением изображения, все усилия специалистов в области диагностики неоплазий толстой кишки были направлены на раз- работку патогномоничных критериев различных этапов неопластической прогрессии новообразо- ваний толстой кишки. Так, проф. Kudo была пред- ложена первая классификация ямочного рисунка слизистой оболочки, оцениваемая с помощью уз- коспектральной эндоскопии (NBI) [12]. Несколько позже было обнаружено, что специфичность пред- ложенных критериев не так высока (ссылка) и был предложен следующий вариант классификации ямочного и капиллярного рисунка — NICE, диффе- ренцирующей все новообразования толстой кишки с позиций выбора возможной лечебной тактики [13]. С появлением эндоцитоскопии в 2006 году, Sasajima, под руководством проф. SE. Kudo, [14] предложил свой вариант классификации вариан- тов эндоцитоскопического изображения слизистой оболочки толстой кишки. Авторами оценивались расположение и полярность эпителиоцитов, раз- мер, форма и регулярность расположения желез, форма и размер ядер клеток, а также — ядерно-ци- топлазматическое отношение. Такой подход мож- но считать прижизненным оптическим гистоло- гическим и цитологическим исследованием, так как исследуются как тканевые, так и клеточные изменения. Как и в большинстве исследований, для окраски слизистой оболочки толстой кишки Sasajima с соавт. использовал 1 % раствор метиле- нового синего и основным достижением данной работы можно считать разработку дифференци- ально-диагностических критериев инвазивной и неинвазивной аденокарциномы толстой кишки. Так, при выявлении тяжелой дисплазии эпителия аденомы с фокусами аденокарциномы основны- ми эндоцитоскопическими признаками могут быть нерегулярность расположения желез без их разрушения, полиморфизм ядер эпителиоцитов с потерей их полярности. При инвазивном раке визуализируется разрушение регулярной желе- зистой структуры слизистой оболочки. При ис- пользовании эндоцитоскопа с увеличением в 1100 раз возможна и визуализация крупнозернистого хроматина в ядрах клеток, что говорит о высокой митотической активности — признаке инвазивно- го роста опухоли (рис. 13).
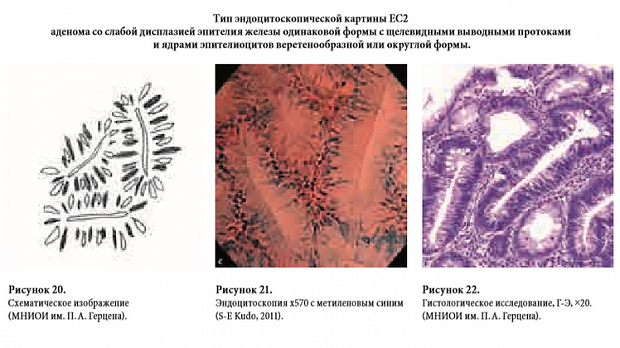
В 2011 году профессор S-E. Kudo 2011 году пред- ложил новый вариант эндоцитоскопической клас- сификации новообразований толстой кишки. Для исследования авторами был использован инте- грированный прототип эндоцитоскопа Olympus XCF-260EC1 с комплексной окраской слизистой оболочки раствором метиленового синего и кри- стального фиолетового [15].
Такой подход обеспечивает возможность визуализации как ядер эпи- телиоцитов, окрашиваемых метиленовым синим, так и цитоплазмы — окрашиваемой кристальным фиолетовым. На основании проведенного иссле- дования 213 новообразований толстой кишки авторы предложили использовать новый вариант Kudo-классификации — эндоцитоскопическую. Согласно ей, выявление на эндоцитоскопическом изображении желез правильной округлой формы с округлыми или овоидными выводными прото- ками и веретенообразными одинакового размера ядрами эпителиоцитов свидетельствует об отсут- ствии патологических изменений слизистой обо- лочки толстой кишки — тип EC1-a по эндоцито- скопической классификации Kudo (Рис. 14,15,16). В случае визуализации желез одинаковой формы с изрезанной формы вытянутыми выводными протоками и небольшими округлыми ядрами эпителиоцитов можно говорить о гиперпластиче- ском характере новообразования — — тип EC1-b по эндоцитоскопической классификации Kudo (Рис. 17,18,19). При выявлении желез одинаковой формы с щелевидными выводными протоками и ядрами эпителиоцитов веретенообразной фор- мы следует выставлять заключение аденомы со слабой или умеренной дисплазией — тип EC2 по эндоцитоскопической классификации Kudo (Рис. 20,21,22). Ключевым признаком аденомы со слабой или умеренной дисплазией эпителия, являются значительно удлиненные ядра эпители- оцитов. При этом может наблюдаться умеренный их полиморфизм, они могут иметь изогнутую форму и незначительно отличающиеся размеры. Однако нарушения полярности расположения эпителиоцитов и их ядер при аденоме со сла- бой или умеренной дисплазией эпителия быть не должно. Визуализация желез неправильной формы с увеличенными деформированными ги- перхромными ядрами эпителиоцитов, по мнению S-E. Kudo свидетельствует о наличии аденомы с тяжелой дисплазией эпителия или неинвазивной аденокарциноме — тип EC3-a по эндоцитоскопи- ческой классификации (Рис. 23,24,25). По анало- гии с кишечным типом аденокарциномы желудка, мы считаем, что можно проводить и различие между тяжелой дисплазией эпителия аденомы и аденокарциномой. Наиболее важным признаком наличия аденокарциномы может быть разруше- ние отдельных желез на фоне сохранения общей железистой структуры. Полностью разрушенная нерегулярная железистая структура слизистой оболочки толстой кишки с формирование ком- плексов плотно лежащих резко полиморфных ядер опухолевых клеток может свидетельствовать о наличии в исследуемой зоне инвазивной адено- карциномы — тип EC3-b по эндоцитоскопической классификации Kudo (Рис. 26,27,28).
С использованием разработанной проф. S-E Kudo классификации было проведено несколько исследований возможностей эндоцитоскопии в уточняющей диагностике эпителиальных новообразований толстой кишки. Во всех работах общая диагностическая точность превысила 90 % (табл. 1).
|
Автор
|
Количество случаев |
Чувствительность |
Специфичность
|
Точность |
|
Sasajima, 2006 [14] |
113 |
_ |
_ |
93% |
|
Cipoletta, 2011 [16] |
41 |
91% |
100% |
– |
|
Rotondano, 2010 [17] |
49 |
– |
– |
100% |
|
Kudo, 2011 [15] |
213 |
90,1% |
99,2% |
95,9% |
|
Y.Mori, 2013 [18] |
102 |
97,6% |
100% |
94,1% |
Безусловно, как и традиционные гистологиче- ское и цитологическое исследования биопсийно- го материала, эндоцитоскопия новообразований толстой кишки, даже с использованием предло- женных критериев, остается во многом субъектив- ным методом. Поэтому, в 2014 году Y. Mori с соавт. предпринял попытку разработки полностью авто- матического аппаратно-программного комплекса EC–CAD для объективизации эндоцитоскопиче- ского изображения с использованием критериев, предложенных S-E. Kudo, применяя прототип ин- тегрированного эндоцитоскопа последнего поко- ления — Olympus CF-Y002 с увеличением в 380 раз и окраской слизистой оболочки 1 % метиленовым синим и 0,05 % кристальным фиолетовым [19]. Ос- новным алгоритмом функционирования EC–CAD явился метод выделения ядер эпителиоцитов на эндоцитоскопическом изображении, с последую- щей оценкой их формы, размера и расположения (Рис. 29, 30). Диагностическая точность автома- тизированной системы, по данным Y. Mori соста- вила 89,2 %, что лишь немногим меньше точности специалиста в области эндоцитоскопии при ручном методе оценки изображений и видеофрагментов.
В ряде исследований эндоцитоскопия использовалась не только для изучения новообразований толстой кишки, но и неопухолевой ее патологии. Например, одной известной возможностью эндо- цитоскопии, помимо оценки тканевой и клеточной архитектоники слизистой оболочки толстой кишки, можно считать возможность исследования ее ми- крокапилляров и кровотока в них. И B. M. Yan c соавт. исследовал форму, размер и скорость потока эритроцитов в капиллярах слизистой оболочки толстой кишки [20]. По мнению авторов, изме- нение данных параметров может служить кос- венным признаком воспалительных изменений слизистой оболочки. Возможно, B. M. Yan в своем исследовании не обеспечил необходимого времени экспозиции витального красителя — метиленого синего, что привело к отсутствию окрашивания ядер эпителиоцитов прямой кишки. Расширение, извитость капилляров, ускорение кровотока в них может свидетельствовать о широком спектре воспалительных и опухолевых заболеваний толстой кишки, и использовать данные критерии в качестве оценочных представляется нерациональным. Воз- можно, более точным критерием будет объектив- ная оценка толщины капилляров. Так, в исследова- нии Y. Wada [21] были проведены соответствующие измерения и было выявлено, что в норме диаметр капилляра слизистой оболочки толстой кишки со- ставляет в среднем 7,8 мкм, при аденоме — 15,2 мкм, при инвазивном раке — 24,1 мкм, что, безусловно коррелирует с интенсивностью неоангиогенеза.
Более интересным представляется исследование Bessho c cоавт., [22] в котором с помощью эндоцито- скопии изучалась степень активности неспецифи- ческого язвенного колита (НЯК). Авторами оцени- вались форма крипт, расстояние между ними и их количество на эндоцитоскопическом изображении, а также — видимость капилляров. Полученные ре- зультаты сопоставлялись со степенью тяжести НЯК по Matt. Была разработана шкала оценки данных признаков (ECSS) и по сумме баллов высказывалось мнение об активности НЯК (Рис 31, 32, 33).
Дифференциальная диагностика болезни Крона и НЯК только с помощью эндоцитоскопии может быть затруднительна. H. Newmann соавт. [23] со- общает о возможности оценки степени тяжести болезни Крона при эндоцитоскопии с окраской слизистой оболочки толстой кишки 1 % раствором метиленового синего или толуидинового синего. Согласно мнению авторов, с использованием дан- ных красителей и увеличения эндоцитоскопа в 570 раз возможна дифференциальная диагностика различных вариантов лейкоцитов, инфильтриру- ющих слизистую оболочку толстой кишки при бо- лезни Крона: нейтрофильных (рис. 34,35), эозино- фильных (рис. 36,37) и базофильных гранулоцитов (рис.38,39), а также — лимфоцитов (рис. 40,41) и по их количеству на эндоцитоскопическом изображе- нии — судить о степени активности воспалитель- ных изменений.
По мнению H. Newmann наибольшей точностью в оценки степени тяжести болезни Крона с помо- щью эндоцитоскопии является оценка лимфоци- тарной инфильтрации. Мы считаем, что исполь- зование неспецифических красителей (в отличие от традиционного цитологического исследования) и увеличения даже в 570 раз не может обеспечить столь высокую точность дифференциальной диа- гностики различных видов лейкоцитов и в насто- ящее время, все-таки, следует оценивать суммар- ную инфильтрацию слизистой оболочки всеми вариантами клеток воспаления и это, безусловно, позволит оценить тяжесть болезни Крона. Авто- ры признают сложность дифференциальной ди- агностики НЯК и болезни Крона с применением эндоцитоскопии, что обусловлено незначитель- ной (не более 40 микрон) глубиной исследования слизистой оболочки толстой кишки, а описанные воспалительные изменения поверхностных слоев эпителия слизистой оболочки могут наблюдаться при обоих вариантах заболеваний.
Интересным можно считать исследование N. Hosoe c cоавт., [24] которым удалось визуали- зировать с помощью эндоцитоскопии трофозоиты Enteroamoeba hystolitica при остром эрозивном ко- лите (рис. 42, 43). Действительно, эндоскопическое исследование в белом свете не позволяет выска- заться о генезе эрозивных изменений слизистой оболочки толстой кишки. Применение эндоцито- скопии в таких случаях может обеспечить визуа- лизацию контуров клеточной стенки микроорга- низмов и по их форме судить о таксономической принадлежности. Безусловно, разработка более специфичных, в отношении различных простей- ших, витальных красителей, может значительно увеличить точность эндоцитоскопической диагно- стики инфекционных колитов.
Таким образом, эндоцитоскопия в исследовании слизистой оболочки толстой кишки имеет большое значение и, преимущественно в уточняю- щей диагностике эпителиальных новообразований. С использованием предлагаемой проф. S-E. Kudo классификации возможно с высокой точностью вы- сказываться о гистогенезе образования и степени дисплазии его эпителия, а также — предсказывать наличие или отсутствие инвазии опухоли в под- слизистый слой. Безусловно, применение только baby-эндоцитоскопов, вводимых в канал материн- ского ширококанального эндоскопа, во многом ограничивает распространение метода.
Однако, возможно, с появлением доступных коммерче- ских образцов интегрированных эндоцитоскопов подобное исследование слизистой оболочки тол- стой кишки может быть внедрено в повседневную практику медицинских учреждений, специализи- рующихся на диагностике и лечении предраковых заболеваний и ранних форм рака толстой кишки.
Эндоцитоскопия в исследовании верхних дыхательных путей
Исследование возможностей эндоцитоскопии в уточняющей диагностике предраковых состо- яний и ранних форм рака верхних дыхательных путей опубликовано всего в одной работе Shimzu с соавт [25]. Для выполнения эндоцитоскопии авто- рами был использован сравнительно новый прото- тип интегрированного эндоцитоскопа-гастроскопа Olympus GIF-Y0002 диаметром 11,8 мм, обычно применяемый для исследования пищевода и же- лудка и обеспечивающий два уровня оптического увеличения изображения — х80 и х450. С учетом того факта, что большинство опухолей верхних дыхательных путей по гистологическому строе- нию относятся к плоскоклеточному раку, Shimzu с соавт. решили использовать для оценки эндо- цитоскопических изображений классификацию ECA (EndoCytoscopic Atypia), предложенную проф. H. Inoue для исследования слизистой оболочки пи- щевода [26]. В качестве витального красителя, как и в большинстве работ, был использован 1 % рас- твор метиленового синего. Эндоцитоскопические критерии атипии плоского эпителия с высокой точностью характеризуют этап неопластической прогрессии плоского эпителия, выстилающего рото-, гортаноглотку и гортань. Степень клеточной атипии 1 соответствует нормальному эпителию (Рис. 45), в то время как атипия 5 степени с высокой долей вероятности может соответствовать плоско- клеточному раку (Рис 44., Рис. 46, Рис. 47)
Безусловно, использование эндоцитоскопии может иметь большие перспективы в выявлении предраковых изменений и раннего рака рото-, гор- таноглотки и гортани. Представляется необходимой разработка специализированного эндоцитоскопа для исследования данных локализаций, так как при- менение эндоцитоскопа-гастроскопа с избыточной длиной и значительным диаметром может затруд- нять, а, зачастую, и делать невозможной эндоци- тоскопическую визуализацию слизистой оболочки верхних дыхательных путей. Применение же тонкого эндоцитоскопа модификации XEC-300 также может быть неоправданным, так как у него отсутствуют рукоятки управления, то есть он может быть исполь- зован только в качестве дочернего baby-скопа, при этом — общая толщина вводимой части комбини- рованного эндоскопа значительно возрастет.
Эндоцитоскопия в исследовании трахеи и бронхов
Публикации, относительно возможностей эндо- цитоскопии в уточняющей диагностике эпите- лиальных новообразований дыхательных путей в настоящее время единичны, что обусловлено небольшим количеством произведенных прототи- пов эндоцитоскопов. Для исследования слизистой оболочки бронхиального дерева всеми авторами использовался специальная модификация прото- типа эндоцитоскопа Olympus XEC-300F, диаметром 3,2 мм, обеспечивающая увеличение изображения в 570 раз, которая вводилась в инструментальный канал (диаметр 4,2 мм) терапевтического (диаметр 6,9 мм) видеобронхоскопа. Для окраски слизистой оболочки бронхиального дерева был использован 0,5 % раствор метиленового синего. Участки слизи- стой оболочки бронхиального дерева без патоло- гических изменений характеризовались наличием округлых, окрашенных в темно-синий цвет ядер клеток реснитчатого эпителия (рис. 48,49). По на- шему мнению, как в исследовании Shibuya с соавт. [27], так и в описании клинического случая, опу- бликованного S. Nosaka и N. Kurimoto [28] имеет место избыточное накопление метиленового синего эпителием, можно думать об окрашивании не толь- ко ядер клеток эпителия, но и муцинозного налета на поверхности эпителия. В связи с этим, представ- ляется рациональным перед выполнением эндоци- тоскопии тщательная санация слизистой оболочки бронхиального дерева с использованием растворов муколитиков, например — ацетилцистеина. Безусловно, основной интерес представляют воз- можности эндоцитоскопии вуточняющей диагностике предраковых состояний, изменений слизистой обо- лочки и раннего центрального рака легкого и трахеи. По мнению Shibuya с соавт. диспластическим изменениям плоского эпителия бронхиального дерева могут соответствовать наличие округлых несколько полиморфных гиперхромных ядер кле- ток на эндоцитоскопическом изображении. При этом отмечается снижение ядерно-цитоплазма- тического отношения, то есть увеличение доли цитоплазмы в клетках. Можно также говорить о некотором нарушении регулярности расположе- ния клеток эпителия (рис. 50,51).
При плоскоклеточном центральном раке легкого и плоскоклеточном раке трахеи, в отличие от дис- плазии плоского эпителия, напротив, ядерно-ци- топлазматическое отношение увеличивается, ядра клеток становятся резко полиморфными, клетки располагаются скученно, отмечается формирова- ние перетяжек между клетками (рис. 52,53).
Аденокарцинома легкого характеризуется нали- чием частично разрушенных железистых структур, выполненных резко полиморфными крупными гиперхромными ядрами опухолевых клеток. Подобная эндоцитоскопическая картина, во многом, коррелирует с таковой для аденокарциномы же- лудка (рис. 54,55).
Безусловно, исследования возможностей эндо- цитоскопии в уточняющей диагностике предрако- вых заболеваний и раннего рака трахеи и бронхов находятся на самом раннем этапе развития. Это об- условлено, во-первых, новизной метода. Остается до конца неясным, какой из витальных красителей использовать для окраски ядер клеток. В опублико- ванных исследованиях использован 0,5 % раствор метиленового синего, по примеру его применения для исследований желудочно-кишечного тракта.
Вообще, исследования возможностей окраски слизистой оболочки бронхиального дерева с ис- пользованием витальных красителей — единичны [27]. Возможно, для эндоцитоскопии бронхиаль- ного дерева следует применять и другие виталь- ные красители. Кроме того, в большинстве стран мира, за исключением Японии, терапевтические бронхоскопы с инструментальным каналом 4,2 мм и общим диаметром 6,9 мм недоступны. Более того, Nosaka и Kurimoto [28], в описании клинического случая аденокарциномы легкого, исследованной с помощью эндоцитоскопии, оценивали удален- ный операционный материал и не проводили ви- тальную эндоцитоскопию. Авторы объясняют это тем фактом, что применение при эндоцитоскопии материнских бронхоскопов столь значительного диаметра, может привести к гиповентиляции ис- следуемых отделов бронхиального дерева в про- цессе исследования. Исследование с использова- нием таких аппаратов возможно только для трахеи и главных бронхов, визуализация сегментарных бронхов может быть затруднена, что обусловлено их диаметром. К сожалению, в настоящее время не разработано бронхоскопов с интегрированной оптической системой для выполнения эндоцито- скопии.
Таким образом, эндоцитоскопия в исследовании предраковых состояний, раннего центрального рака легкого и раннего рака трахеи может быть многообещающим методом, однако возможности ее использования в пульмонологической практике до настоящего времени практически не исследованы.
Эндоцитоскопия в исследовании других органов и тканей
С учетом новизны метода эндоцитоскопии, в на- стоящее время происходит только апробация его возможностей в уточняющей диагностике различ- ных патологических состояний в разных органах. Так, Ohigashi с соавт. [29] сообщают о первом опыте использования эндоцитоскопии при исследовании слизистой оболочки мочевого пузыря. Эндоцито- скоп диаметром 3,2 мм проводился через ригидный цистоскоп диаметром 25F и, после окраски слизи- стой оболочки раствором метиленового синего, авторами было отмечено значительное сходство получаемого эндоцитоскопического изображения с традиционным гистологическим.
В двух работах Rao с соавт [30,31] исследовалась возможность использования эндоцитоскопии ин- траоперационно. В частности, в мобилизованный главный панкреатический проток, после ороше- ния его раствором метиленового синего, был вве- ден эндоцитоскоп и визуализированы комплексы гиперхромных ядер опухолевых клеток со зна- чительно повышенным ядерно-цитоплазмати- ческим отношением (Рис. 56). При плановом ги- стологическом исследовании в этом клиническом наблюдении была подтверждена аденокарцинома поджелудочной железы (Рис. 57). Во втором сво- ем исследовании G. V. Rao с соавт. [31] исследовал париетальную брюшину у пациента с подозрением на перитонеальную диссеминацию рака желудка. После введения в лапароскопический порт эндо- цитоскопа XEC-300 и окраски брюшины раствором метиленового синего, в белесоватых участках, по- дозрительных в отношении диссеминатов (Рис. 58), при эндоцитоскопии были выявлены хаотично рас- положенные крупные полиморфные гиперхромные ядра опухолевых клеток (Рис. 59). При гистологи- ческом исследовании была подтверждена мета- статическая низкодифференцированная аденокарцинома.
В настоящее время опубликованы данные ряда предварительных исследований возможностей эндоцитоскопии в молекулярной диагностике. В частности, M. Muto c cоавт. [32] удалось визуализировать ex-vivo ядра опухолевых клеток пло- скоклеточного рака пищевода, меченных моно- клональными антителами к p53. Ядра опухолевых клеток, содержащие данный маркер, при эндоцито- скопии значительно отличались по цвету от остальных. Интересным представляется исследование Sumiyama с соавт., который изучил с помощью эн- доцитоскопии у лабораторных животных миоциты мышечного слоя стенки всех отделов желудоч- но-кишечного тракта. На первом этапе авторами выполнялось эндоскопическое туннелирование в подслизистом слое с целью доступа к мышечному слою стенки органа. В последующем мышечный слой стенки пищевода, желудка или толстой кишки окрашивался 2 % раствором толуидинового синего, после чего, через сформированный туннель вы- полнялась эндоцитоскопия с применением двух различных эндоцитоскопов с увеличением х570 и ×1100, что позволило визуализировать вытянутой формы гиперхромные ядра миоцитов (рис. 60). Авторы считают, что возможность визуализации нетолько эпителиальных клеток, но и миоцитов, может иметь большое значение в дифференциальной диагностике неэпителиальных опухолей.
Заключение
Таким образом, эндоцитоскопия является одним из наиболее интенсивно развивающихся методов эндоскопической диагностики, позволяющим ис- следовать слизистую оболочку, а, по данным ряда экспериментальных работ — строму и паренхиму различных органов, с увеличением изображения до 1100 раз. По разрешающей способности с ней может сравниться только конфокальная лазерная эндоми- кроскопия, обеспечивающая увеличение до 1000 раз. Преимуществом эндоцитоскопии над конфо- кальной лазерной эндомикроскопией является от- сутствие необходимости внутривенного введения флуорофоров. Витальные красители, наносимые топически на слизистую оболочку, свободно до- ступны и безопасны. С появлением, в ближайшем будущем, новых эндоцитоскопов для исследования пищевода, желудка, толстой кишки и дыхательных путей можно ожидать значительного увеличения точности эндоскопической диагностики ранних форм рака и предраковых заболеваний вышеописанных органов. Уже в настоящее время, с нарастанием увеличения изображения, обеспечиваемого эндоскопической аппаратурой, наблюдается тенденция смещения традиционной эндоскопической диагностики в сторону морфологического исследования и для эффективного выполнения эндоцитоскопии врачу-эндоскописту, безусловно, необходимо изучать тканевое и клеточное строение стенки органов желудочно-кишечного тракта и дыхательных путей.
Список литературы:
2. Hufford AR. A new light weight, extra flexible gastro-scope. Rev Gastroenterol. 1946 Sep-Oct;13 (5):381-3
3. Hayashida T. [Mass stomach examinations with the gastrocamera]. Boei Eisei. 1963 Jan;10:13-7
4. Hirschowitz BI, Curtiss LE, Peters CW et al. Demonstration of a new gastroscope, the fiberscope. Gastroenterology. 1958 Jul;35 (1):50; discussion 51-3
5. Matzen P, Kruse A, Krag E. Gastroscopy and gastropho-tography. Value of a fibre gastroscope with an external camera assessed on the basis of 200 consecutive investigations Ugeskr Laeger. 1973 Jun 11;135 (24):1241-3.
6. Matsuda A, Matsuda T, Shibata A, et al. Cancer Incidence and Incidence Rates in Japan in 2008: A Study of 25 Population-based Cancer Registries for the Monitoring of Cancer Incidence in Japan (MCIJ) Project. Japanese Journal of Clinical Oncology, 44 (4): 388-396, 2013 Liu HH, Kudo SE, Juch JP.
7. Pit pattern analysis by magnifying chromoendoscopy for the diagnosis of colorectal polyps. J Formos Med Assoc.
2003 Mar;102 (3):178-82.
8. Inoue H, Kaga M, Ikeda H et al. Magnification endoscopy in esophageal squamous cell carcinoma: a review of the intrapapillary capillary loop classification. Ann Gastroenterol. 2015 Jan-Mar;28 (1):41-48. Review.
9. Kumagai Y, Monma K, Kawada K. Magnifying chromoendoscopy of the esophagus: in-vivo pathological diagnosis using an endocytoscopy system. Endoscopy. 2004 Jul;36 (7):590-4.
10. Inoue H, Kudo SE, Shiokawa A. Novel endoscopic imaging techniques toward in vivo observation of living cancer cells in the gastrointestinal tract. Clin Gastroenterol Hepatol. 2005 Jul;3 (7 Suppl 1): S61-3. Review.
11. U.S. National Institutes of Health. Published online at ClinicalTrials.gov
12. Japan Ministry Of Health. Published online at mhlw.go.jp
13. Kumagai Y, Kawada K, Yamazaki S. Prospective replacement of magnifying endoscopy by a newly developed
• Форма, размер контуров желез
• Целостность контуров желез
• Размер и форма капиллярных петель
• Полярность расположения эпителиоцитов Клеточные критерии (для всех органов)
• Длина ядер клеток
• Форма ядер клеток
• Размер ядер клеток
• Интенсивность окраски ядер эпителиоцитов
• Интенсивность окраски цитоплазмы (при ее визуализации)
исследованы, эндоцитоскопическое оборудование находится на стадии совершенствования прототипов. Однако уже сейчас становится понятным, что развитие эндоскопической диагностики будет эволюционировать в сторону сверхвысокого увеличения изображения. Поэтому, врачу-эндоскописту, наряду с традиционной подготовкой, будет необходимо получение знаний о нормальной и патологической морфологии органов желудочно-кишечного тракта и дыхательных путей.
endocytoscope, the «GIF-Y0002». Dis Esophagus. 2010 Nov;23 (8):627-32. doi: 10.1111/j.1442-2050.2010.01074.x.
14. Пирогов С. С., Соколов В. В., Карпова Е. С., Конфокальная лазерная эндомикроскопия. Принцип и алгоритм выполнения при исследовании желудка Экспериментальная и клиническая гастроэнтерология. 2014. № 3 (103). С. 10-17.
15. Kumagai Y, Kawada K, Higashi M et al. Endocytoscopic observation of various esophageal lesions at x600: can nuclear abnormality be recognized? Dis Esophagus. 2014 Jan 28. doi: 10.1111/dote.12183
16. H Inoue, H Ikeda, A Yoshida Diagnostic Technique: In Vivo Diagnosis of Cellular Atypia Using Endocytoscope: EC Classification in Squamous Epithelium Video Journal & Encyclopaedia GI Endoscopy, June 2013 Volume 1, Issue 1, Pages 16-17
17. Canto, M. I. (1999). Staining in gastrointestinal endoscopy: The basics. Endoscopy, 31 (6), 479-486. doi:10.1055/s-1999-8041
18. Andrea M, Dias O, Santos A. Contact endoscopy during microlaryngeal surgery: a new technique for endoscopic examination of the larynx. Ann Otol Rhinol Laryngol. 1995 May; 104 (5):333-9.
19. Olliver JR, Wild CP, Sahay P Chromoendoscopy with methylene blue and associated DNA damage in Barrett's oesophagus. Lancet. 2003 Aug 2;362 (9381):373-4.
20. Minami, H., Inoue, H., Yokoyama, A., Ikeda, H., Satodate, H., Hamatani, S.,... Kudo, S. (2012). Recent advancement of observing living cells in the esophagus using CM double staining: Endocytoscopic atypia classification, 235-241. doi:10.1111/j.1442-2050.2011.01241.x
21. Berra CM, de Oliveira CS, Garcia CC Nucleotide excision repair activity on DNA damage induced by pho-toactivated methylene blue. Free Radic Biol Med. 2013 Aug;61:343-56. doi: 10.1016/j.freeradbiomed.2013.03.026. Epub 2013 Apr 6
22. Sridharan G. Toluidine blue: A review of its chemistry and clinical utility. J Oral Maxillofac Pathol. 2012 May-Aug; 16 (2): 251-255.
23. Myers EN. The toluidine blue test in lesions of the oral cavity. CA Cancer J Clin. 1970 May-Jun;20 (3):134-9.
24. Giler S, Kadish U, Urca I. Peroral staining method with toluidine blue as an aid in the diagnosis of malignant gastric lesions Am J Gastroenterol. 1976 Jan;65 (1):37-40.
25. Papazian A, Descombes P, Capron JP et al. Incidence of esophageal cancer synchronous with upper aerodigestive tract cancers (100 cases): value ofvital staining with lugol and toluidine blue. Gastroenterol Clin Biol. 1985 Jan;9 (1):16-22.
26. Kodashima, S., Fujishiro, M., Takubo, K., Kammori, M., Nomura, S., Kakushima, N.,... Omata, M. (2007). Ex vivo pilot study using computed analysis of endo-cytoscopic images to differentiate normal and malignant squamous cell epithelia in the oesophagus. Digestive and Liver Disease, 39, 762-766. doi:10.1016/j.dld.2007.03.004
27. Hurlstone DP, Sanders DS, Cross SS et al. Colonoscopic resection of lateral spreading tumours: a prospective analysis of endoscopic mucosal resection. Gut. 2004 Sep;53 (9):1334-9.
28. Amano Y, Kushiyama Y, Ishihara S et al. Crystal violet chromoendoscopy with mucosal pit pattern diagnosis is useful for surveillance of short-segment Barrett's esophagus. Am J Gastroenterol. 2005 Jan;100 (1):21-6.
29. Tabuchi M, Sueoka N, Fujimori T. Videoendoscopy with vital double dye staining (crystal violet and methylene blue) for detection of a minute focus of early stage ade-nocarcinoma in Barrett's esophagus: a case report. Gas-trointest Endosc. 2001 Sep;54 (3):385-8.
30. Freshney RI Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications John Wiley & Sons, 2011 ISBN-13: 978-0470528129
31. Ichimasa, K., Kudo, S. E., Mori, Y., Wakamura, K., Ikehara, N., Kutsukawa, M., ... Inoue, H. (2014). Double staining with crystal violet and methylene blue is appropriate for colonic endocytoscopy: An invivo prospective pilot study. Digestive Endoscopy, 26 (May 2011), 403-408. doi:10.1111/den.12164
32. Uedo N1, Fujishiro M, Goda K et al. Role of narrow band imaging for diagnosis of early-stage esophagogastric cancer: current consensus of experienced endoscopists in Asia-Pacific region Dig Endosc. 2011 May;23 Suppl 1:58-71. doi: 10.1111/j.1443-1661.2011.01119.x.
33. Sato, H., Inoue, H., Hayee, B. H., & Ikeda, H. (2014). In vivo histopathology using endocytoscopy for nonneoplastic changes in the gastric mucosa: a prospective pilot study (with video). Gastrointestinal Endoscopy, 1-7. doi:10.1016/j.gie.2014.08.019
34. Kaise, M., Kikuchi, D., Iizuka, T., Furuhata, T., Yama-da, A., Yamashita, S., ... Hoteya, S. (2012). Endocytoscopy Is a Feasible Modality With High Diagnostic Accuracy for Gastric Cancer. Gastrointestinal Endoscopy, 75 (Ccd), AB215-AB216. doi:10.1016/j.gie.2012.04.38
35. Suzuki S, Murakami H, Suzuki H. et al. An endoscopic staining method for detection and operation of early gastric cancer Int Adv Surg Oncol. 1979;2:223-41
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.















.jpg)





.png)














Комментарии