- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: ЭОЗИНОФИЛЬНЫЙ ЭЗОФАГИТ - астма пищевода?
| Авторы: | Кайбышева Валерия Олеговна 1 2022г. |
| Об авторах: |
1. к.м.н, старший научный сотрудник научно-исследовательской лаборатории хирургической гастроэнтерологии и эндоскопии Российского национального исследовательского медицинского университета им. Н.И. Пирогова, врач-гастроэнтеролог городской клинической больниц |
 (1)1280.jpeg)
Полный текст статьи:
Человечество непрерывно и беспощадно стремится к прогрессу, процветанию, благополучию. Современный homo sapiens сегодня существует в условиях внешней среды, кардинально отличающихся от тех, что окружали его миллионы лет предшествующей эволюции. Самое удивительное, что произошли столь значимые изменения менее, чем за сто лет. К чему привели технологический прогресс, модернизация сельского хозяйства, нацеленная на увеличение производительности, повсеместное применение антибактериальных препаратов, появление генетически-модифицированных продуктов, неблагоприятная экологическая ситуация, практически полное отсутствие естественного отбора? Для врачей клиницистов последствия очевидны - это появление новых, еще совсем недавно неизвестных нозологий, катастрофический рост больных с некогда редкими заболеваниями. Одним из таких заболеваний является эозинофильный эзофагит (ЭоЭ) – хроническое, непрерывно-прогрессирующее воспалительное заболевание пищевода, при котором наблюдается скопление эозинофилов в толще слизистой оболочки пищевода, развитие фиброза стенки пищевода, что с течением времени приводит к нарушению процесса глотания (дисфагия, обтурация пищевода пищевым комком, рвота проглоченной пищей и др.).
Интересно, что в некоторых научных статьях ЭоЭ называют «астмой пищевода», связано это с чрезвычайным сходством ЭоЭ и бронхиальной астмы (с одним лишь отличием-при ЭоЭ патологический процесс локализуется в стенке пищевода, а при бронхиальной астме - в стенке бронхов). При обоих заболеваниях наблюдается хроническое воспаление и отек слизистой оболочки, возникающие при контакте с аллергенами внешней среды, постепенное развитие фиброза в стенке органа, приводящие к нарушению функциональной активности бронхов\пищевода. И, если при бронхиальной астме, ключевым симптомом заболевания являются приступы удушья и одышка, то при ЭоЭ -затруднения при глотании пищи.
ЭоЭ страдают преимущественно мужчины (75% больных) белой расы (более 90% больных). ЭоЭ встречается во всех возрастных группах, однако чаще в молодом возрасте (средний возраст больных составляет 36-42 года). Поэтому, встречаясь в клинической практике с молодым мужчиной, который жалуется на сложности при глотании, необходимо помнить, что на сегодняшний день главной причиной дисфагии у лиц молодого возраста является именно ЭоЭ.
Первые описания эозинофилии пищевода были опубликованы совсем недавно- в 70-х годах прошлого века (Р. Лэндерс), а в начале 90- х годов эозинофильный эзофагит был выделен в отдельный клинико-морфологический синдром. Таким образом изучение этого нового заболевания продолжается не более 30 лет, в то время как число больных с каждым годом нарастает в экспоненциальной прогрессии. Согласно данным европейских популяционных исследований число вновь зарегистрированных больных ЭоЭ за последние годы возросло в 6-100 раз [1,2].
На сегодняшний день в странах Европы и Северной Америки эозинофильный эзофагит-это второе по распространенности заболевание пищевода после гастроэзофагеаальной рефлюксной болезни (ГЭРБ).
Считается, что в основе ЭоЭ лежат генетические аномалии и поломки, но почему данные аномалии стали проявлять себя лишь в начале 90-х годов прошлого века? Одной из самых популярных точек зрения, объясняющих растущую распространенность ЭоЭ в эпоху применения антибиотиков, является т.н. «гигиеническая гипотеза», гласящая о том, что тенденция к повсеместной чистоте и стерильности, применение дезинфектантов, средств гигиены с добавлением антибактериальных препаратов привели к нарушению естественной антигенной стимуляции иммунной системы детей, что стало причиной снижения иммунной толерантности, увеличения распространенности аутоиммунных и аллергических заболеваний. Иными словами, иммунная система ребенка, с рождения живущего в стерильных условиях, теряет способность распознавать свое от чужого, допускать присутствие неких антигенов в организме, реагируя на любой чужеродный агент агрессией[3].
Другими факторами, вероятно способствующими развитию ЭоЭ, признаются: загрязнение воздуха, повсеместное использование антибиотиков и ингибиторов протонной помпы (ИПП), массовая эрадикация H. pylori, герпетическая и микоплазменная инфекции и др. [3,4].
Существуют работы, показывающие, что преждевременные роды, кесарево сечение, искусственное вскармливание, применение антибиотиков в течение первого года жизни ребенка также связаны с повышенным риском развития ЭоЭ. В данном случае возникновение ЭоЭ связывают с патологически-измененным составом кишечной микробиоты [3,4].
Интересна связь роста больных ЭоЭ началом массовой эрадикации бактерии H. pylori. Несколькими исследованиями показана обратная ассоциация между частотой инфицирования H. рylori и распространенностью ЭоЭ. Существует теория, предполагающая защитную роль бактерии H. Рylori, инфицирование которой позволяет организму развивать «иммунную толерантность», учиться распознавать свое от чужого и относиться к некоторым чужеродным агентам «терпимо». Кроме того, считается, что инфицирование H. pylori способствует развитию иммунного ответа организма-хозяина по пути активизации T-хелперов 1 типа (Th1), в то время как отсутствие H. рylori предрасполагает к Тh2 - ассоциированному иммунному ответу. Подтверждается данная теория данными о большей распространенности атопических заболеваний (в основе патогенеза которых также лежит патологическая Th2 -иммунная реакция) у неинфицированных H. pylori лиц.
Прямых доказательств роли ИПП в развитии ЭоЭ нет, однако появление ИПП в 80-х годах ХХ века, совпавшее с ростом распространенности ЭоЭ, настораживает ученых. Более того, известно, что у части больных, принимающих ИПП, наблюдается синтез антител (IgE) к пищевым продуктам [5].
Этиология и патогенез
ЭоЭ –это хроническое заболевание пищевода, связанное со сбоем в работе иммунной системы, которая при контакте с аллергенами внешней среды активизируется в сторону образования Т-хелперов 2 типа.
В формировании ЭоЭ имеет место патогенетическое влияние трех групп факторов [4]:
· генетическая предрасположенность к развитию патологического иммунного ответа при контакте с чужеродными антигенами
· нарушение барьерной функции слизистой оболочки пищевода (воспаление, расширение межклеточных пространств, нарушение синтеза белков плотных контактов), способствующее более глубокому проникновению антигенов в толщу слизистой оболочки;
· сенсибилизация к воздушным и пищевым антигенам.
Роль пищевых и воздушных антигенов в патогенезе ЭоЭ
Пищевые продукты являются доказанным триггером развития ЭоЭ, применение диет лежит в основе лечения ЭоЭ, приводя к ремиссии заболевания у большинства больных. Тем не менее, остается загадкой, почему продукты, веками употреблявшиеся человеком в пищу, стали приводить к развитию ЭоЭ лишь около 30 лет назад. Возможно это связано с внедрением особых технологий в сельскохозяйственные процессы (применение антибиотиков, гормональных препаратов и специальных синтетических кормов при выращивании животных), с промышленными особенностями заготовки, хранения и упаковки пищевых продуктов, с добавлением консервантов, появлением генетически-модифицированных продуктов питания [4].
С другой стороны, вероятно речь идет о тенденции к снижению иммунной толерантности современного человека поскольку известно, что до 81% больных ЭоЭ страдают пищевой аллергией, около 15% имеют в анамнезе эпизоды пищевой анафилаксии, 40-75% страдают аллергическим ринитом, 4-60% - экземой, 14-70% - бронхиальной астмой. В целом, 28-86% взрослых и 42-93% детей, больных ЭоЭ, имеют атопические заболевания на момент обращения, и около 50-60% - в анамнезе [4].
Таким образом, ЭоЭ является одним из проявлений общей атопической реакции организма, а сенситизация к воздушным и пищевым антигенам служит ключевым звеном патогенеза ЭоЭ. Однако, следует помнить, что ЭоЭ не является проявлением пищевой аллергии. Пищевая аллергия и ЭоЭ – это патогенетически разнородные заболевания, а применение антигистаминных препаратов не показало свой эффективности в лечении ЭоЭ и на сегодняшний день не рекомендовано[6,7]!
Клиническая картина ЭоЭ
Выраженность и характер жалоб значительно отличается в зависимости от возраста больного (таблица 1)[8-10].
Таблица 1. Симптомы ЭоЭ у детей и взрослых
|
Симптомы у детей |
Симптомы у взрослых |
|
Задержка физического развития |
Дисфагия |
|
Затруднения при приеме пищи (отказ от пищи, регургитация, длительное пережевывание пищи, обильное питье во время еды) |
Исключение из рациона твердых и объемных продуктов, измельчение пищи на маленькие кусочки |
|
Тошнота и рвота |
Длительное пережевывание пищевого комка |
|
Боль в животе |
Страх приема пищи в обществе |
|
Изжога |
Боль в груди |
|
Избирательный подход к еде |
Изжога |
Симптомы у детей раннего возраста неспецифичны и включают срыгивания, тошноту и рвоту, возникающие во время еды, затруднения при проглатывании определенной пищи (морепродукты, яйца, орехи и др.), боли в животе, отставание в физическом развитии (редко).
Дети подросткового возраста предъявляют жалобы, более характерные для ГЭРБ: на изжогу, боли за грудиной, необходимость длительно пережевывать пищу и запивать ее водой («медленно-едящие и много пьющие» пациенты).
Взрослые пациенты страдают от симптомов, свидетельствующих о прогрессирующем сужении просвета пищевода: дисфагия, загрудинные боли и эпизоды вклинения пищи в пищевод.
Приступ острой обтурационной дисфагии, случившийся на фоне полного здоровья, должен насторожить врача в отношении возможного диагноза ЭоЭ. Необходимо помнить, что эозинофильный эзофагит является наиболее распространенной причиной острой обтурационной дисфагии у взрослых!
Дисфагия у больных с ЭоЭ, постепенно прогрессирующая с течением времени, вынуждает пациентов избирательно подходить к выбору продуктов питания, принимать пищу полужидкой или кашицеобразной консистенции, длительно пережевывать пищу и обильно запивать ее. Зачастую данные симптомы у детей остаются незамеченными либо воспринимаются как шалость, хотя при внимательном рассмотрении они являются основным ключом в постановке диагноза ЭоЭ.
Инструментальная диагностика ЭоЭ
Эзофагогастродуоденоскопия с морфологическим исследованием биоптатов из пищевода
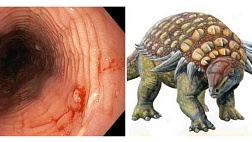
Ключевым методом диагностики ЭоЭ является ЭГДС с проведением множественной биопсии. На ЭГДС у больных с ЭоЭ обнаруживаются признаки активного воспалительного процесса на всем протяжении пищевода: отек и ранимость слизистой оболочки пищевода, белесый экссудат (эозинофильные микроабсцессы), линейные продольные борозды (рисунок 1). У взрослых больных ЭоЭ в дополнение к вышеперечисленным признакам нередко обнаруживаются изменения, отражающие развитие подслизистого фиброза: множественные концентрические кольца («трахеевидный» или «кошачий» пищевод), стриктуры и сужения пищевода [11-16].
Рисунок 1. Эндоскопические особенности ЭоЭ
a. отек, белый экссудат, белесые точки (эозинофильные микроабсцессы), узловатость (нодулярность)
б. множественные концентрические кольца («трахеевидный» пищевод)
в. продольные борозды
Необходимо помнить, что при ЭоЭ эндоскопическая картина может быть вполне нормальной (примерно у 20% больных), поэтому при любом подозрении на данное заболевание (например, жалобы на сложности глотания) необходимо проводить биопсию пищевода даже при отсутствии видимых изменений. Биопсия должна проводиться не только из дистального, но и из проксимального отдела пищевода (по 3-4 биоптата из каждого отдела).
По результатам гистологического исследования диагноз ЭоЭ может быть установлен, если число эозинофилов в поле зрения микроскопа высокого разрешения (х400) будет не менее 15 (рисунки 2б, 3б), а также будут исключены другие заболевания, которые могут вызывать эозинофилию пищевода (ГЭРБ, эозинофильный гастроэнтерит, целиакия, болезнь Крона, лучевой и инфекционный эзофагит (грибковые и паразитарные инфекции), гиперэозинофильный синдром, лекарственный эзофагит, васкулиты, ахалазия кардии, системные заболевания соединительной ткани, злокачественные опухоли)(таблица 2).
Рисунок 2. Морфологическое исследование биоптата из проксимального отдела пищевода, окраска гематоксилином и эозином
А) Скопления эозинофильных лейкоцитов, увеличение х200.
Б) Скопления эозинофильных лейкоцитов более 60 в поле зрения.
Рисунок 3. Морфологическое исследование биоптата из дистального отдела пищевода, окраска гематоксилином и эозином
А) Скопления эозинофильных лейкоцитов, увеличение х200.
Б) Скопления эозинофильных лейкоцитов более 60 в поле зрения, увеличение х400.
Таблица 2. Заболевания, ассоциированные с эозинофилией пищевода
|
Заболевания, ассоциированные с эозинофилией пищевода |
|
ГЭРБ |
|
Эозинофильный эзофагит |
|
Эозинофильный гастрит, гастроэнтерит или колит с поражением пищевода |
|
Целиакия |
|
Болезнь Крона с поражением пищевода |
|
Инфекционные поражения пищевода (грибковые, вирусные) |
|
Гиперэозинофильный синдром |
|
Ахалазия |
|
Лекарственный эзофагит |
|
Аутоиммунные поражения кожи и васкулиты |
|
Редкие наследственные синдромы (Марфана, Нетертона и др.) |
|
Системные заболевания соединительной ткани |
|
Болезнь «трансплантант против хозяина» |
Таким образом, диагноз «эозинофильный эзофагит» может быть установлен только при совокупности клинических симптомов (нарушения при глотании пищи) и гистологического подтверждения эозинофильной инфильтрации пищевода, после обязательного исключения заболеваний, сопровождающихся эозинофилией пищевода (рисунок 4).
Рисунок 4. Диагностический алгоритм ЭоЭ
Показатели периферической крови в диагностике ЭоЭ
При проведении общего анализа крови эозинофилия наблюдается у 30-80% больных ЭоЭ. К сожалению, эозинофилия не является специфичной только для ЭоЭ, в связи с чем этот показатель необходимо оценивать с учетом возраста пациента, наличия аллергических заболеваний, времени года (цветение трав и деревьев) и других факторов, способных повлиять на изменение числа эозинофилов в крови.
Лечение эозинофильного эзофагита
Современная концепция лечения больных ЭоЭ включает медикаментозную терапию, диетические ограничения, и, при необходимости, проведение эндоскопической дилатации пищевода.
Медикаментозная терапия ЭоЭ
Медикаментозная терапия ЭоЭ базируется на назначении топических кортикостероидов или/и ИПП.
Топические глюкокортикостероиды
Для лечения больных ЭоЭ применяются те же препараты, что и для бронхиальной астмы, что еще раз подчеркивает возможную общность патогенеза данных заболеваний. Так, при использовании аэрозоля флутиказона, необходимо сделать впрыск и глоток (а не вдох, как при астме), задерживая дыхание. Перед применением будесонида рекомендуется приготовить густую суспензию (смешать 1-2 мг будесонида с 5 мг сукралозы). Доза будесонида у детей должна корректироваться с учетом веса и возраста. В течение 30-60 минут после применения топических стероидов важно воздержаться от приема пищи и жидкостей во избежание удаления лекарственного препарата со слизистой оболочки пищевода (таблица 3).
Таблица 3. Дозы топических кортикостероидов для индукции и поддержания ремиссии у больных ЭоЭ [7]
|
Лекарственный препарат |
Целевая популяция |
Доза для индукции ремиссии |
Доза для поддерживающей терапии |
|
Флутиказона пропионат |
Дети |
880-1760 мкг/сут |
440-880 мкг/сут |
|
Взрослые |
1760 мкг/сут |
880–1760 мкг/сут | |
|
Будесонид |
Дети |
1-2 мг/сут |
1 мг/сут |
|
Взрослые |
2-4 мг/сут |
2 мг/сут |
Системные кортикостероиды в лечении ЭоЭ в настоящее время не используются [7].
В связи с тем, что ЭоЭ –хроническое, персистирующее заболевание, большинству больных ЭоЭ для поддержания ремиссии необходима длительная поддерживающая терапия.
Топические стероиды отличаются достаточно высоким профилем безопасности. Доказанным побочным эффектом их применения является развитие кандидоза пищевода у 10% больных.
Ингибиторы протонной помпы
Эффективность ИПП при ЭоЭ объясняется их способностью восстанавливать барьерную функцию слизистой оболочки пищевода, что препятствует глубокому проникновению антигенов внешней среды в толщу слизистой оболочки, а также наличием у ИПП собственной противовоспалительной активности.
Заживление слизистой оболочки под влиянием ИПП предупреждает дальнейшую антигенную стимуляцию иммунокомпетентных клеток в слизистой оболочке пищевода и тем самым тормозит воспалительный процесс.
На сегодняшний день в терапии взрослых больных ЭоЭ рекомендовано применение ИПП дважды в день (в дозах, эквивалентных 20-40 мг омепразола). Для индукции ремиссии тяжелого эзофагита у детей рекомендовано назначение ИПП из расчета 1 мг/кг на 1 прием дважды в день в течение 8 недель[7].
Вопрос о длительности терапии и дозах ИПП, необходимых для поддержания ремиссии по сей день остается открытым. Рецидив клинической симптоматики и активизация эозинофильного воспаления возникает в среднем через 3-6 месяцев после отмены ИПП. Рекомендовано постепенное снижение дозы ИПП до достижения минимально эффективной дозировки для каждого конкретного пациента [7].
Антиинтерлейкиновые препараты
Интерлейкины-биологически активные вещества, синтезируемые Т-лимфоцитами-хелперами 2 типа (ИЛ-4, 5, 13) играют важнейшую роль в патогенезе ЭоЭ, контролируя и стимулируя практически все драматические события, разворачивающиеся в толще слизистой оболочке пищевода. В связи с этим применение антиинтерлейкновых препаратов, уже доказавших свою эффективность в лечении бронхиальной астмы, кажется крайне перспективной затеей. На сегодняшний день существуют данные первых клинических исследований применения данных препаратов при ЭоЭ. Так, антитела к ИЛ-5 на 90% снижают эозинофилию периферической крови, на 55% -выраженность эозинофильной инфильтрации слизистой оболочки пищевода.
Применение антител к ИЛ-13 (препарат QAX576) в рандомизированном, двойном слепом, плацебо-контролируемом исследовании позволило снизить эозинофильную инфильтрацию слизистой оболочки пищевода в среднем на 60%. Эффект препарата сохранялся около 6 мес, было зафиксировано некоторое улучшение клинической симптоматики [17,18]. Вторая стадия плацебо-контролируемого исследования еще одного препарата, содержащего моноклональные антитела к ИЛ-13 (RPC4046), показала его высокую эффективность в снижении эозинофилии пищевода, улучшении эндоскопической картины, а главное - в купировании дисфагии. Благоприятный профиль безопасности, влияние на выраженность жалоб делают антитела к ИЛ-13 перспективными для дальнейших исследований [17,18].
Диета при эозинофильном эзофагите
В лечении ЭоЭ используются несколько диетических режимов:
1. Элементная диета (аминокислотная смесь) приводит к полной гистологической ремиссии у большинства больных ЭоЭ детей и у 80-90% больных взрослого возраста. Элементная диета применяется для лечения больных ЭоЭ только в случае неэффективности медикаментозной терапии и элиминационных диет.
Элементная диета включает употребление в пищу специально приготовленных аминокислотных смесей с минимальной антигенной активностью (на фоне полного исключения из рациона любой другой пищи).
Применение элементной диеты приводит к достижению гистологической ремиссии у 90,8% (95% CI 84,7–95,5%) больных ЭоЭ [19]. Столь высокая эффективность элементной диеты, к сожалению, омрачается целым рядом сопутствующих факторов, не позволяющих применять ее у большинства пациентов.
Вкус смесей зачастую требует применения назогастрального зонда для их введения у детей, а более чем треть взрослых отказываются от диеты в течение первых недель. Необходимость полностью исключить из рациона привычную пищу вызывает значительный моральный дискомфорт, социальную дезадаптацию, выраженное снижение качества жизни.
Таким образом, реалии применения аминокислотных смесей в качестве лечебной тактики при ЭоЭ таковы, что использоваться они могут главным образом у грудных детей с выраженными клиническими симптомами и эозинофильным воспалением слизистой оболочки пищевода, не разрешающимися на фоне медикаментозной терапии.
2. Элиминационные диеты с исключением продуктов, вызывающих аллергию у конкретного индивида. Элиминационная диета способствует индукции гистологической ремиссии менее, чем у трети взрослых больных ЭоЭ.
Элиминационная диета составляется индивидуально для каждого пациента с ЭоЭ, основываясь на данных аллергологического тестирования (кожные скарификационные и аппликационные пробы). При элиминационной диете из рациона больного исключаются продукты, доказавшие свой аллергенный потенциал у конкретного пациента.
В среднем, ремиссии на фоне элиминационной диеты удается достичь у 45,5% (95% CI 35,4–55,7%) больных с ЭоЭ, причем эффективность данного терапевтического подхода у взрослых больных значительно ниже, чем у детей [19].
3. Эмпирическая диета с исключением из рациона продуктов с высоким аллергенным потенциалом (яйца, молоко, соя, орехи, пшеница, рыба и другие). Эмпирическая диета эффективна в среднем у 67,2% больных, что сопоставимо с терапией топическими глюкокортикостероидами (63,3%).
Изначально в основу данного диетического режима были положены сведения о продуктах питания, наиболее часто вызывавших аллергические реакции в детской популяции г.Чикаго (США): белок коровьего молока, пшеница, яйца, соя, арахис и лесной орех, рыба, морепродукты. Постепенно, в попытках уйти от столь строгого режима питания и расширить рацион было выявлено, что у большинства пациентов с ЭоЭ (65%–85%) триггерами рецидива являются всего лишь 1-2 продукта [20-22].
Наиболее часто эозинофильное воспаление индуцировалось у больных ЭоЭ после употребления в пищу коровьего молока, глютена, яиц, сои/бобовых. Тогда как роль орехов, рыбы и морепродуктов оказалась не столь значительной. Основываясь на полученных данных была разработана новая эмпирическая диета с исключением 4 продуктов: коровьего молока, глютена, яиц, сои и бобовых [20-22].
В настоящее время дискутируется вопрос о возможности ступенчатого подхода к диетическим ограничениям: исключение 1 или 2 продуктов (молоко, глютен-содержащие злаки) на начальном этапе лечения с постепенным расширением списка запрещенных продуктов у пациентов, не достигших гистологической ремиссии на фоне более либеральной диеты [23].
.
Список литературы:
2. Giriens B, Yan P, Safroneeva E, Zwahlen M, Reinhard A, Nydegger A, Vavricka S, Sempoux C, Straumann A, Schoepfer AM. Escalating incidence of eosinophilic esophagitis in Canton of Vaud, Switzerland, 1993-2013: a population-based study. Allergy 2015;70:1633-9. https://doi.org/10.1111/all.12733
3. Dellon ES, Hirano I. Epidemiology and Natural History of Eosinophilic Esophagitis. Gastroenterology. 2018;154(2):319-332. https://doi.org/10.1053/j.gastro.2017.06.06
4. В. О. Кайбышева, Л. М. Михалева, Е. Л. Никонов, С. Г. Шаповальянц. Эпидемиология, этиология и патогенез эозинофильного эзофагита. Новейшие данные. Доказательная гастроэнтерология. 2019;8(2): 50-72. https://doi.org/10.17116/dokgastro2019802150
5. Merwat SN, Spechler SJ. Might the use of acid-suppressive medications predispose to the development of eosinophilic esophagitis? Am J Gastroenterol 2009;104:1897-902.
6. В. О. Кайбышева, С. В. Кашин, Л. М. Михалева, Н. С. Видяева, Р. О. Куваев, З. В. Галкова, Т. А. Ильчишина, В. В. Печникова, Е. Л. Никонов, С. Г. Шаповальянц. Эозинофильный эзофагит: современный взгляд на проблему и собственные клинические наблюдения. Доказательная гастроэнтерология. 2019;8(1): 58-83.
7. Кайбышева В.О., Федоров Е.Д., Михалева Л.М., С. И. Эрдес, Лохматов М.М., Иванова Е.В. Основные положения рекомендаций Европейского общества по изучению эозинофильного эзофагита. Доказательная гастроэнтерология. 2018;7(3): 65-90. https://doi.org/10.17116/dokgastro2018703165
8. O'Shea KM, Aceves SS, Dellon ES, Gupta SK, Spergel JM, Furuta GT, Rothenberg ME. Pathophysiology of Eosinophilic Esophagitis. Gastroenterology. 2018 Jan;154(2):333-345. https://doi.org/10.1053/j.gastro.2017.06.065
9. Steinbach EC, Hernandez M, Dellon ES. Eosinophilic Esophagitis and the
Eosinophilic Gastrointestinal Diseases: Approach to Diagnosis and Management. J
Allergy Clin Immunol Pract. 2018 Sep - Oct;6(5):1483-1495. https://doi.org/10.1016/j.jaip.2018.06.012201.
10. Dellon ES, Liacouras CA, Molina-Infante J et al.Updated International Consensus Diagnostic Criteria for Eosinophilic Esophagitis: Proceedings of the AGREE
Conference. Gastroenterology. 2018 Sep 6. pii: S0016-5085(18)34763-2. https://doi.org/10.1053/j.gastro.2018.07.009.
11. Hirano I, Moy N, Heckman MG, et al. Endoscopic assessment of the oesophageal features of eosinophilic oesophagitis: validation of a novel classification and grading system. Gut 2013;62:489-95. https://doi.org/10.1136/gutjnl-2011-301817
12. Kim HP, Vance RB, Shaheen NJ, et al. The prevalence and diagnostic utility of endoscopic features of eosinophilic esophagitis: a meta-analysis. Clin Gastroenterol Hepatol 2012;10:988-96 https://doi.org/10.1016/j.cgh.2012.04.019
13. Dellon ES, Gibbs WB, Fritchie KJ, et al. Clinical, endoscopic, and histologic findings distinguish eosinophilic esophagitis from gastroesophageal reflux disease. Clin Gastroenterol Hepatol 2009;7:1305-13; https://doi.org/10.1016/j.cgh.2009.08.030
14. Dellon ES, Cotton CC, Gebhart JH, et al. Accuracy of the eosinophilic esophagitis endoscopic reference score in diagnosis and determining response to rreatment. Clin Gastroenterol Hepatol 2016;14:31–39. 1 https://doi.org/0.1016/j.cgh.2015.08.040
15. van Rhijn BD, Warners MJ, Curvers WL, et al. Evaluating the endoscopic reference score for eosinophilic esophagitis: moderate to substantial intra- and interobserver reliability. Endoscopy 2014;46:1049–1055. https://doi.org/10.1055/s-0034-1377781
16. Rodriguez-Sanchez J, Barrio-Andres J, Nantes Castillejo O, et al. The Endoscopic Reference Score shows modest accuracy to predict either clinical or histological activity in adult patients with eosinophilic oesophagitis. Aliment Pharmacol Ther 2017;45:300-309. https://doi.org/10.1111/apt.13845
17. Rothenberg ME, Wen T, Greenberg A, et al. Intravenous anti-IL-13 mAb QAX576 for the treatment of eosinophilic esophagitis. J Allergy Clin Immunol 2015;135:500-7. https://doi.org/10.1016/j.jaci.2014.07.049.
18. Dellon ES, Collins M, Assouline-Dayan Y, et al. A Randomized, Double-Blind, Placebo-Controlled Trial of a Novel Recombinant, Humanized, Anti-Interleukin-13 Monoclonal Antibody (RPC4046) in Patients with Active Eosinophilic Esophagitis: Results of the HEROES Study. American Journal of Gastroenterology 2016;111:S186-S186.
19. Arias A, Gonzalez-Cervera J, Tenias JM, et al. Efficacy of dietary interventions for inducing histologic remission in patients with eosinophilic esophagitis: a systematic review and meta-analysis. Gastroenterology 2014;146:1639–1648. https://doi.org/10.1053/j.gastro.2014.02.006
20. Kagalwalla AF, Shah A, Li BUK, et al. Identification of specific foods responsible for inflammation in children with eosinophilic esophagitis successfully treated with empiric elimination diet. J Pediatr Gastroenterol Nutr 2011;53:145–149. https://doi.org/10.1097/MPG.0b013e31821cf503
21. Molina-Infante J, Arias A, Barrio J, et al. Four-food group elimination diet for adult eosinophilic esophagitis: A prospective multicenter study. J Allergy Clin Immunol 2014;134:1093–1099. https://doi.org/10.1016/j.jaci.2014.07.023
22. Kagalwalla A, Amsden K, Makhija MM, et al. A multicenter study assessing the clinical, endoscopic and histologic response to four food elimination diet for the treatment of eosinophilic esophagitis. Gastroenterology 2015;148:30. https://doi.org/10.1016/S0016-5085(15)30103-7
23. Kruszewski PG, Russo JM, Franciosi JP, et al. Prospective, comparative effectiveness trial of cow’s milk elimination and swallowed fluticasone for pediatric eosinophilic esophagitis. Dis Esophagus 2016;29:377–384. https://doi.org/10.1111/dote.12339
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.












.jpg)





.png)


















Комментарии