- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: К ЭНДОСКОПИЧЕСКОЙ КЛАССИФИКАЦИИ ХРОНИЧЕСКИХ ГАСТРИТОВ
| Авторы: | Короткевич А. Г. 1 Аксенов П. В. 2 2018г. |
| Об авторах: |
1. Новокузнецкий государственный институт усовершенствования врачей — филиал федерального государственного бюджетного образовательного учреждения дополнительного профессионального образования «Российская медицинская академия непрерывного профессионального об 2. Государственное бюджетное учреждение здравоохранения Кемеровской области «Новокузнецкая городская клиническая больница № 29» (Новокузнецк, Россия) |
Короткевич А. Г.1, Аксенов П. В.2
1 Новокузнецкий государственный институт усовершенствования врачей — филиал федерального государственного бюджетного образовательного учреждения дополнительного профессионального образования «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации (Новокузнецк, Россия)
2 Государственное бюджетное учреждение здравоохранения Кемеровской области «Новокузнецкая городская клиническая больница № 29» (Новокузнецк, Россия)
TO ENDOSCOPIC CLASSIFICATION OF CHRONIC GASTRITISES
Korotkevich A. G.1, Aksenov P. V.2
1 Novokuznetsk State Institute for Further Training of Physicians — Branch Campus of the Federal State Budgetary Educational Institution of Further Professional Education “Russian Medical Academy of Continuous Professional Education” of the Ministry of Healthcare of the Russian Federation (Novokuznetsk, Russia)
2 Municipal Hospital Nr.29 (Novokuznetsk, Russia)
Для цитирования: Короткевич А. Г., Аксенов П. В. К эндоскопической классификации хронических гастритов. Экспериментальная и клиническая гастроэнтерология. 2018;152(4): 53–59.
For citation: Korotkevich A. G.1, Aksenov P. V. To endoscopic classification of chronic gastritises. Experimental and Clinical Gastroenterology. 2018;152(4): 53–59.
Короткевич А. Г.— Новокузнецкий государственный институт усовершенство-вания врачей — филиал федерального государственного бюджетного образо-вательного учреждения дополнительного профессионального образования
«Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации; Государственное бюджетное учреждение здравоохранения Кемеровской области
«Новокузнецкая городская клиническая больница № 29», д.м.н., профессор кафедры хирургии, урологии и эндоскопии, заведующий отделением эндо-скопии
Аксенов П. В.— врач патологоанатомического отделения ГБУЗ КО НГКБ № 29 г. Новокузнецка
Korotkevich A. G.— Novokuznetsk State Institute for Further Training of Physi-cians — Branch Campus of the Federal State Budgetary Educational Institution of Further Professional Education “Russian Medical Academy of Continuous Pro-fessional Education” of the Ministry of Healthcare of the Russian Federation, Municipal Hospital Nr.29, MD, Chair of surgery, urology and endoscopy, pro-fessor, Head of Endoscopy Department
Aksenov P. V.— Municipal Hospital Nr.29, doctor of Pathoanatomical Department
Короткевич
Алексей Григорьевич Korotkevich Aleksey G. alkorot@mail.ru
Резюме
Статья посвящена анализу соответствия эндоскопических и гистологических исследований при разных формах хронического гастрита. Изучены в длительном динамическом наблюдении результаты обследования 3593 больных хроническим гастритом. Анализ эндоскопических признаков в описательной картине хронического гастрита независимо от давности заболевания выявил три основных общих показателя: пестрота, неровность, очаги атрофии слизистой оболочки желудка.
Ключевые слова: хронический гастрит, эндоскопическая диагностика, микроскопическая диагностика
Summary
Article is devoted to the analysis of compliance of endoscopic and histological studies of different forms of chronic gastritis. Results of inspection of 3593 pa-tients with chronic gastritis are studied in long dynamic observation. The analysis of endoscopic signs in a descriptive picture of chronic gastritis irrespective of prescription of a disease has revealed three main general signs: diversity, unevenness, foci of atrophy of gastric mucosa. Analysis of the microscopic picture showed the same atrophic-hyperplastic processes of varying degrees of severity in different forms of chronic gastritis (hypertrophic — nodular, verrucous, polypoid, small and large focal atrophic gastritis). There is high degree of correlation between the endoscopic and microscopic features. The scheme of development and interpretation of chronic gastritis is offered. Use in practice of the endoscopist the conclusion “chronic subatrophic gastritis” to a stage “chronic atrophic gastritis” is proved.
Keywords: chronic gastritis, endoscopic diagnosis, microscopic diagnosis
Введение
Проблема адекватной интерпретации хронического гастрита (ХГ), как и одинаковое понимание сути процесса, остается камнем преткновения между патологами, эндоскопистами и гастроэнтерологами. Попытки сопоставить эндоскопическую картину с гистологической показали превалирующую значимость микроскопии как в определении формы и стадии гастрита, так и риска малигнизации на его фоне [1, 2]. Предложенная в 1996 г. полуколичественная визуально-аналоговая шкала привела к признанию шкалы OLGA и OLGA-IM с высокой степенью согласованной оценки разными патологами [2–4], но эндоскопические описания хронического гастрита далеки от единства между собой и с патологами, а количество адекватно взятых биоптатов едва превышает 4%, в том числе из-за высоких трудозатрат на обеспечение такого исследования [5–8]. Смещение упора на этиологию ХГ, выявляемые детали патогенеза ХГ и превалирующая роль патоморфолога в определении как типа гастрита, так и степени атрофии слизистой оболочки в рамках канцеропревенции заставляют пересмотреть подходы к описанию эндоскопической картины в диагностике ХГ или адаптировать их для восприятия не эндоскопистами.
Материал и методы
С момента введения АРМ эндоскописта в 2000 г. по 2015 г. заключение «хронический субатрофический гастрит» (ХСГ) разной локализации, «хронический атрофический гастрит» (ХАГ), «хронический эрозивный гастрит» (ХЭГ), «хронический лимфоцитарный гастрит», «хронический узелковый гастрит» в качестве основной или сопутствующей патологии было дано в 59710 случаях 3593 пациентам, прикрепленным к ЛПУ и регулярно подвергавшимся гастроскопии в нашем отделении эндоскопии.
Статистическая обработка проведена с использованием пакетов программ Exel и Statistica 6.0. с использованием критерия χ2. Критический уровень значимости при проверке статистических гипотез принимали равным 0,05.
Результаты
Количество ЭГДС и выявленных ХГ за период наблюдения представлено на рисунке 1. Нет достоверных различий по частоте выявляемости ХГ за 15-летний период.
В среднем на 100 гастроскопий отмечено от 57 до 72 случаев выявления признаков ХГ.
Ежегодно от 300 до 1000 пациентов с установленным диагнозом ХГ подвергались повторной гастроскопии. Всего 3593 пациентов. Среднее количество ЭГДС в год у одного пациента при ХГ составило от 1,5 до 3,5.
Общее количество ЭГДС с получением материала для цитоморфологических исследований по годам, в сравнении с количеством биопсий при ХГ, представлено на рисунке 2.
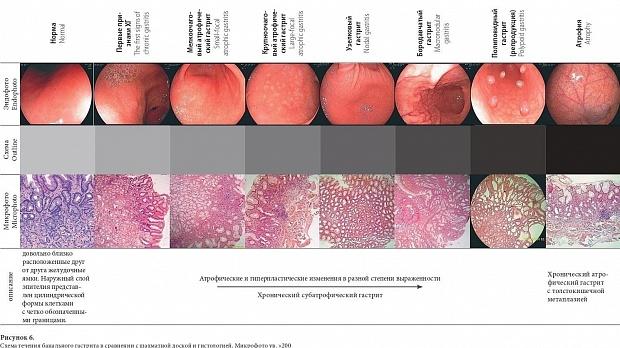
Как видно, в описательных признаках ХГ превалируют легко идентифицируемые независимо от площади поражения и локализации пестрота и неровность СОЖ. На основании этих признаков в своей практике мы использовали два основных заключения при ХГ: «хронический субатрофический гастрит» (ХСГ) при сохранных очагах СОЖ и «хронический атрофический гастрит» (ХАГ) в случаях диффузной атрофии СОЖ или поражения отдела желудка. Первым эндоскопическим признаком ХСГ считали появление разноразмерных желудочных полей и их неоднородное выступание над уровнем СОЖ. Встречаемость и структура ХГ в расчете на 1000 ЭГДС представлена на рисунке 3.
Локализация ХГ зависела от стадии его существования (рисунок 5) и достоверно различалась по частоте поражения антрального отдела (Chi-square (df=1) =145,15; p=0,0000) и проксимальных отделов желудка (Chi-square (df=1) = 609,95; p=0,0000).
Основной целью анализа было оценить эффективность микроскопической диагностики в соответствии используемым эндоскопическим формам ХГ. Соответствие эндоскопических и морфологических заключений представлено в таблице 2.
Основные микроскопические находки при ХСГ включали: снижение высоты и расширение валиков, уменьшение длины и расширение ямок, снижение зоны желез, уменьшение количества желез, гипермукоидность железистого и покровно-ямочного эпителия, диффузную лимфоплазмоцитарную инфильтрацию, наличие единичных фолликулоподобных структур. У пациентов с неравномерно расширенными желудочными полями и неровной СОЖ микроскопические признаки соответствовали ХСГ. При ХАГ: более выраженное (по сравнению с ХСГ) снижение высоты валиков, вплоть до полной сглаженности, более выраженное уменьшение длины ямок, наличие кистозно расширенных ямочных структур, значительное снижение зоны желез, значительное уменьшение количества желез, местами вплоть до полного исчезновения последних, выраженная гипермукоидность покровно-ямочного эпителия, наличие в отдельных случаях клеток типа бокаловидных, диффузная умеренная лимфоплазмоцитарная инфильтрация, наличие фолликулоподобных структур. Склероз собственной пластинки слизистой, в отдельных случаях всей слизистой.
Предполагаемая схема течения любого гастрита, в равной степени, но с разной долей зависимости от бактериального, аутоиммунного и химического компонентов, присутствующих при любом виде гастрита, представлена в таблице 3.
Два типа изменений СОЖ выявлены при длительном динамическом исследовании – увеличение площади и степени атрофии СОЖ и/или замещение очагов атрофии очагами метаплазии с уменьшением площади видимых мелких сосудов – псевдовосстановление СОЖ.
Обсуждение
Диагноз ХГ важен как предиктор рака желудка [4, 9]. Проблема в том, что диагноз гастрита и степень атрофии=стадия ХГ может устанавливаться только гистологически [1, 10]. Поэтому цель гастроскопии – установить факт ХГ, а цель патоморфолога – определить риск развития рака. Попытка создания классификации ХГ с учетом эндоскопии оказалась неудачной [2, 7]. Многочисленные визуальные градации ХГ несут большую долю субъективизма и не могут одинаково воспроизводиться разными врачами [11–13]. Осознание роли атрофии как маркёра нарушения регенеративных процессов дало новый вектор и импульс классификационным усилиям [1, 14]. Одновременно стало ясно, что эндоскопический осмотр в белом свете не дает важной этиологической информации как в силу неспецифичности изменений СОЖ, так и существенной зависимости качества эндоскопической диагностики от уровня технической оснащенности [8, 15, 16]. Вместе с тем, использование протокола OLGA и OLGA-IM оказалось эффективным в прогнозируемом течении ХГ и раковой трансформации [3, 6]. Усилия гастроэнтерологов и патоморфологов сегодня направлены на определение риска канцерогенеза для конкретного пациента с ХГ. В связи с вышеизложенным, становится ясно, что задачей эндоскопии является факт своевременной диагностики ХГ и поиск на фоне ХГ ранних признаков рака. О глубоких расхождениях эндоскопической и гистологической оценки СОЖ при ХГ известно давно [5, 7, 9, 10, 17, 18]. Вместе с тем, важно помнить, что ХГ является прогредиентным заболеванием с накоплением явлений атрофии от первой атаки острого гастрита до диффузной атрофии [19, 20]. Описательные термины также звучат вразнобой:
«пангастрит» трактуется по-разному: от диффузного поражения (всех отделов желудка) до сочетания этиологических причин – А и В типы по Сиднеевской классификации [2, 21]. Атрофический гастрит также описывается как поражение тела желудка или пангастрит – мультифокальный [2, 9]. Кстати, термин «диффузный», а не «пангастрит», для описания площади вовлечения СОЖ в процесс рекомендован терминологией ОМЕД [21]. Эндоскопия чаще всего выявляет уже запущенные случаи ХГ с явными визуальными признаками. ХГ = воспаление СОЖ, приводящее к уменьшению количества желудочных желез и интерстициальному фиброзу, но эти процессы в силу ячеистости кровоснабжения СОЖ возникают мультифокально, а пестрота СОЖ за счет белых или светлых участков является основным признаком атрофии при ХГ [17, 22]. Наши результаты показали, что при разной выраженности атрофии СОЖ – от расширенных желудочных полей до крупноочаговой атрофии – микроскопия всегда выявляет два одинаковых разнонаправленных процесса разной степени выраженности – атрофию и регенерацию. Это послужило поводом объединить все этапы течения ХГ от невидимых глазом первых проявлений ХГ до диффузной атрофии в единое заключение – «хронический субатрофический гастрит» (ХСГ) (таблица 3). Высокая корреляции гистологических заключений и эндоскопии, на наш взгляд, указывает на обоснованность такого подхода. Такие заключения не противоречат протоколу OLGA, но позволяют добиться высокого комплайенса между эндоскопистом, гастроэнтерологом и патоморфологом. Другая форма ХГ с высокой корреляцией эндоскопической картины и микроскопии – ХАГ. Крайняя степень дегенерации СОЖ имеет хорошо описанные признаки и легко идентифицируется врачами с разным уровнем подготовки и стажем работы [15, 22, 23]. Другой задачей эндоскопии является оценка распространенности и локализации ХГ. По нашим данным, эндоскопические признаки позволяют с высокой достоверностью говорить о локализации ХГ, дополняя градацию этапа неполной атрофии – ХСГ и терминальной стадии болезни – ХАГ. Возможно, внедрение в клиническую практику таких обобщающих эндоскопических заключений избавит патоморфолога от бесплодных усилий по верификации вида ХГ, но позволит ему сосредоточить внимание на оценке степени и типе атрофии СОЖ, а эндоскопии определить и занять свою нишу в диагностике ХГ и его осложнений. По нашим данным, хронический гастрит проявляется полиморфизмом изменений. Ранним признаком хронического гастрита является изменение желудочных полей – они становятся выступающими, имеют увеличенные и разные размеры. Другой признак – появление очагов атрофии слизистой – очагов белесого цвета разной площади и формы, располагающихся ниже уровня слизистой, на их фоне позже появляется сосудистый рисунок. Замещение желудочного эпителия другим – очагами кишечной и желудочной метаплазии, гипертрофии, привносят еще большую пестроту в картину ХГ. Появление лимфоидных фолликулов белесого цвета также добавляет пестроты. Одновременно изменяется характер желудочного секрета на вязкий белый малопрозрачный компонент. Основной признак хронического гастрита – пестрая и неравномерная слизистая оболочка [16, 17]. Вышеизложенные мысли мы предлагаем в виде схематического изображения течения ХГ (рисунок 6 на цветной вклейке в журнал).
ХГ всегда мультификальный процесс, т.к. ише-
мия при остром воспалении всегда неоднородна и страдают железы и строма, наиболее удаленные от микрососудов, питающих слизистую оболочку и железы. Наиболее однородна картина мелкоочаговой атрофии в самые ранние сроки ХГ. Позже, после ряда атак острого процесса, очаги атрофии не столь мелки и не столь равномерно распределены – они приобретают неправильную форму, сливаются между собой, образуя тусклые и уже хорошо различимые глазом участки. Одновременные (параллельные) процессы регенерации при ХГ не могут обеспечить адекватной замены эпителия, что приводит к нарушению процессов дифференцировки тканей и/или избыточному пролиферативному росту фрагментов слизистой. Без микроскопии отличить толстокишечную или кишечную метаплазию = атрофию бывает сложно или невозможно, что имеет следствием неправильную интерпретацию эндоскопических находок.
Таким образом, генерация представлений о возникновении и течении ХГ привела к кардинальным изменениям в классификационных патоморфологических оценках процесса, их не только микроскопической, но и иммуногистохимической детализации [24, 25]. Возможно, настало время понять, что крен эндоскопической детализации и диагностики ХГ нужно сместить в сторону патоморфологов, а эндоскопическое восприятие ХГ если не упростить, то сделать рациональнее и унифицировать. Задачей эндоскопии в диагностике ХГ должны быть установление факта ХГ и его распространенности. Выявление раннего рака на фоне ХГ и соблюдение протокола OLGA – это следующий раздел исследований после выявления и подтверждения факта ХГ.
Список литературы:
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.
















.jpg)




.png)













Комментарии