- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: МОРФОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ АТРОФИЧЕСКОГО ГАСТРИТА ПО КЛАССИФИКАЦИИ ПО KIMURA-TAKEMOTO
| Авторы: | Тебуева М.А. 1 Котелевец С.М. 2 2020г. |
| Об авторах: |
1. 1РГБ ЛПУ «Лечебно-реабилитационный центр», 369000, Российская Федерация, г.Черкесск 2. ФГБОУ ВО «Северо-Кавказская государственная академия», 369000, Российская Федерация, г.Черкесск |
Аннотация:
В связи с необходимостью внедрения более чувствительных методов морфологичекой детекции предраковых изменений слизистой оболочки желудка (СОЖ) при атрофическом гастрите была поставлена цель изучить распространенность предраковых изменений СОЖ при атрофическом гастрите в рамках новой морфологической модификации классификации Kimura-Takemoto.
DOI: 10.17238/issn2072-3180.2020.1.25-32 УДК: 616.33-002.27
©Тебуева М.А., Котелевец С.М., 2020
МОРФОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ АТРОФИЧЕСКОГО ГАСТРИТА ПО КЛАССИФИКАЦИИ ПО KIMURA-TAKEMOTO
М.А. ТЕБУЕВА 1,a, С.М. КОТЕЛЕВЕЦ 2,b
1. 1РГБ ЛПУ «Лечебно-реабилитационный центр», 369000, Российская Федерация, г.Черкесск
2. ФГБОУ ВО «Северо-Кавказская государственная академия», 369000, Российская Федерация, г.Черкесск
Резюме: В связи с необходимостью внедрения более чувствительных методов морфологичекой детекции предраковых изменений слизистой оболочки желудка (СОЖ) при атрофическом гастрите была поставлена цель изучить распространенность предраковых изменений СОЖ при атрофическом гастрите в рамках новой морфологической модификации классификации Kimura-Takemoto. Обследовано 169 пациентов, отобранных по эндоскопическим критериям Kimura-Takemoto. Мужчин было 58 (34 %). Женщин оказалось 111 (66 %). Средний возраст 66,44
± 10,22 лет. Биопсия была взята согласно протоколу из каждого участка, обозначенного границами атрофии С1, С2, С3, О1, О2, О3. Результаты гистологии трактовали согласно визуально-аналоговой шкалы Сиднейской системы. Среди 169 человек у шести человек обнаружена дисплазия высокой степени. Причем у этих пациентов не было выявлено сильной корреляционной связи с кишечной метаплазией тяжелой степени (r = 0,53, p>0,05). У двоих пациентов с выраженной дисплазией из шести, кишечная метаплазия не была выявлена. Тяжелая степень дисплазии была установлена у трех пациентов с верифицированным раком желудка. Эти больные впервые обратились и у них клинически был поставлен диагноз позднего рака. Возраст этих больных: 51, 70 и 76 лет. Еще трое больных с верифицированной диффузной атрофии СОЖ в ближайшее время умерли от сердечно-сосудистых заболеваний. Возраст их на момент выявления атрофического гастрита с тяжелой дисплазией составлял: 69, 87 и 79 лет. Сделан вывод об эффективности данной новой методики морфологической диагностики предраковых изменений в биоптатах СОЖ при атрофическом гастрите в соответствии с эндоскопической классификацией Kimura-Takemoto.
Ключевые слова: кишечная метаплазия, дисплазия, атрофический гастрит, распространённость, предрак.
MORPHOLOGICAL STUDY OF ATROPHIC GASTRITIS ACCORDING TO THE CLASSIFICATION BY KIMURA-TAKEMOTO
M.A. TEBUEVA 1,a, S.M. KOTELEVETS 2,b
1Republican state budgetary medical and preventive institution “Treatment and rehabilitation center”, 369000, Russia, Cherkessk
2North Caucasian State Academy, Medical Institute, Department of Propaedeutics of Internal Diseases, 369000, Russia, Cherkessk
Abstract:Due to the need of more sensitive methods for the morphological detection of precancerous changes in the gastric mucosa (coolant) with atrophic gastritis, the research goal was to study the prevalence of precancerous changes in the coolant in atrophic gastritis as part of a new morphological modification of the Kimura-Takemoto classification. We examined 169 patients selected by Kimura-Takemoto endoscopic criteria. There were 58 men (34%) and 111 women (66%). The average age was 66.44 ± 10.22 years. The biopsy was taken according to the proto-col from each site indicated by the boundaries of the atrophy C1, C2, C3, O1, O2, O3. The histology results were interpreted according to the visual-analogue scale of the Sydney system. Among 169 people, six patients had high-grade dysplasia. These patients did not show a strong correlation with severe intestinal metaplasia (r = 0.53, p> 0.05). In two patients with severe dysplasia out of six, intestinal metaplasia was not detected at all. Severe dysplasia was found in three patients (51, 70 and 76 years) with verified gastric cancer. These patients were first approached and were clinically diagnosed with late cancer. Three more patients with verified diffuse coolant atrophy died in the near future from cardiovascular diseases. Their age, at the time of detection of atrophic gastritis with severe dysplasia was: 69, 87 and 79 years. The effectiveness of research methodology for the morphological diagnosis of precancerous changes in coolant biopsy specimens in atrophic gastritis in accord-ance with the Kimura-Takemoto endoscopic classification was proven.
Key words: intestinal metaplasia, dysplasia, atrophic gastritis, prevalence, precancer.
Введение
Основой современной гастроэнтерологии является максимальное развитие методологии и ранней диагностики желудочного рака (канцеропревенция). Суть этой стратегии заключается в акцентировании внимания на скрининге предраковых болезней желудка и антигеликобактерных мероприятиях [1,2,3,4,5,6,7,8,9,10]. При этом верификация диагноза атрофического гастрита возможна только морфологически [11]. Формирование злокачественного желудочного заболевания последовательно проходит цепь дискретных морфологических этапов (это принято называть каскадом Корреа): банальный гастрит — гастрит с развитием атрофии — тонкокишечной метаплазии — толстокишечного образца метаплазии — дисплазии, которая прогрессирует в рак in situ, что в последующем завершается инвазивным раком. Все эти события происходят на протяжении двадцати-тридцати лет [12,13,9,14,15,16,17].
Материалы и методы
Для изучения клинико-морфологической характеристики атрофического гастрита локализованного в корпусе желудка популяция, населяющая город Черкесск, была структурирована по национальному составу (таблица 1). Общее количество пациентов, отобранных по эндоскопическим критериям Kimura-Takemoto, составило 169 человек. Мужчин было 58 человек, что составило 34 процента. Женщин оказалось 111 человек, что составило 66 процентов. От всех пациентов получено информированное согласие на дальнейшее углубленное исследование, в том числе инвазивное. Средний возраст пациентов включенных в следующий этап исследования и наблюдения равнялся 66,44 ± 10,22 годам. 169 человек прошли эндоскопическое обследование, в результате которого у всех был визуализирован атрофический гастрит в рамках эндоскопической классификации Kimura-Takemoto.
Всем была взята биопсия согласно протоколу, предусмотренному дизайном исследования из каждого участка, обозначенного границами атрофии С1, С2, С3, О1, О2, О3. Анализу подлежали результаты гистологии биоптатов территориально относящихся к корпусу желудка. Обозначим их как биоптаты С2, С3, О1, О2, О3. Степень атрофии, кишечной метаплазии и дисплазии в каждом из них оценивали по визуально-аналоговой шкале (ВАШ) которая используется для трактовки результатов в модифицированной Сиднейской системе. У 4 пациентов атрофии не выявили
Таблица 1
Структура этнического состава пациентов прошедших ЭГДС с биопсией
№/п Национальность пациентов Количество пациентов Доля пациентов
1 Карачаевцы 72 42 %
2 Русские 55 33 %
3 Черкесы 20 12 %
4 Абазины 17 10 %
5 Ногайцы 5 3 %
6 ИТОГО 169 100 %
Эндоскопическое исследование пациентов
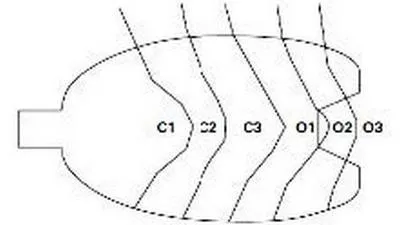
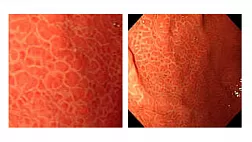
Пациентам с серологическими признаками атрофии СОЖ в эндоскопическом кабинете МБУЗ «Медико-санитарная часть» была выполнена ЭГДС с помощью эндоскопического оборудования GIF-PQ-20 фирмы «Olympus» (Япония) с последующим гистологическим изучением биоптатов. Биоптаты были взяты в количестве шести у каждого пациента. Место взятия биопсии соответствовало эндоскопическим границам С1 – О3 по Kimura-Takemoto. Дополнительно осуществляли взятие биоптатов СОЖ для постановки быстрого уреазного теста для установления факта инфицирования пациента H.pylori. Визуальную степень выраженности атрофического гастрита у пациентов при эндоскопическом исследовании нами оценивалась по схеме Kimura-Takemoto, которая схематично отражена на рис. 1.
Рис. 1. Расширение атрофической границы классификации Kimura-Takemoto. [18]
В соответствии с этой схемой все варианты атрофии классифицированы по 7 типам в зависимости от локализации атрофии в желудке (С-0 – О-3) (таблица 2).
ирургический урнал
Таблица 2
Характеристика желудочной атрофии по Kimura-Takemoto
Тип атрофии Степень распространенности атрофии по поверхности
C0 тип Нет атрофии
C1 тип Атрофии нет в теле, но есть в антральном отделе
C2 тип Граница атрофии на малой кривизне н/3 тела
C3 тип Граница атрофии на малой кривизне с/3 тела
О1 тип Граница между малой кривизной и перед. стенкой
O2 тип Граница атрофии в пределах передней стенки желудка
О3 тип Граница между задней стенкой и большой кривизной
Два биоптата О2 и О3, которые забирали в соответствии с эндоскопической классификацией Kimura-Takemoto полностью соответствовали двум биоптатам из тела желудка по Сиднейской системе.
Методика гистологического исследования слизи-стой оболочки желудка
Биоптаты слизистой оболочки желудка, по шесть от каждого пациента (в соответствии схеме Kimura-Takemoto от С1 до О3) фиксировали в 10% нейтральном формалине, забуференном по Лилли. После чего материал подвергали стандартной гистологической обработке с заливкой в парафиновую среду “Histomix”. Полученные парафиновые блоки подвергали резке на ротационном микротоме с получением серийных срезов толщиной 5 мкм. Для оценки атрофических изменений слизистой срезы были окрашены гематоксилином-эозином и пикрофуксином по Ван Гизон; железистый аппарат слизистой оценивали при окраске альциановым синим при рН 2,5 в сочетании с ШИКреакцией; дополнительное морфологическое тестирование наличия H.pylori в биоптатах осуществляли окрашивая срезы по методике Гимзы азур II-эозином с последующим изучением препаратов под иммерсионным увеличением х 630.
Проводили подсчет выраженности атрофических изменений полуколичественным методом в соответствии с визуально аналоговой шкалой. Атрофию СОЖ выражали в баллах от 0 до 3, при этом количественным значениям соответствовали следующие показатели тяжести атрофии: 0 – нет атрофии; 1 – легкая атрофия; 2 – умеренная атрофия; 3 – тяжелая атрофия. Кроме атрофии, в гистологических препаратах фиксировали наличие и оценивали выраженность кишечной метаплазии эпителия, а также наличие и степень тяжести дисплазии желудочного эпителия, используя те же градации, что и для атрофии (от 0 до 3 баллов, соответственно, от отсутствия до ее тяжелой степени).
Методы статистического анализа
Весь широкий спектр задач, поставленных нами, удалось реализовать с помощью применения всевозможных способов вариационной статистики для разных вариантов исследования. Характер изучаемого признака определял тот или иной статистический метод исследования, который был выбран.
При сравнении распространенности атрофического гастрита в группах-этносах нами был использован критерий t Стьюдента (вариант двусторонний), так как распределение в нашем случае было нормальным. Уровень значения Р был равен 0,05, что представляет собой ошибочную вероятность Р<0,05 и допускается при проводимых научных медицинских исследованиях.
При помощи русифицированного варианта про-граммы компьютерной обработки PrimeroBiostatistics 4.03 "Биостатистика", осуществили проведение анализа вышеупомянутых критериев оценки с помощью статобработки исследовательского материала.
Результаты
Распространенность кишечной метаплазии и дисплазии при атрофическом гастрите
Гистологическая оценка биопсии, которая была осуществлена в рамках эндоскопической классификации по KimuraTakemoto предусматривала выявление кишечной метаплазии и дисплазии СОЖ. Структура кишечной метаплазии (с учетом степени выраженности) представлена в таблице 3, дисплазии, также с учетом степени выраженности показана в таблице 4. Обращает на себя внимание, что среди 169 человек обследованных морфологически на предмет атрофического гастрита (таблица 5), у шести человек обнаружена дисплазия высокой степени. Причем у этих пациентов не было выявлено сильной корреляционной связи с кишечной метаплазией тяжелой степени (коэффициент корреляции равен 0,53, p>0,05). У двоих пациентов с выраженной дисплазией из шести вообще кишечная метаплазия не была выявлена.
Таблица 3
Структура кишечной метаплазии СОЖ при оценке биопсии взятой по Kimura-Takemoto
№/п Характеристика КМ Колич. пациентов Доля пациентов с КМ Доля КМ
1 Отсутствие КМ 74 43,8 % 43,8 %
2 КМ легкой степени 42 24,8 % 56,2 %
3 Умеренная КМ 35 20,7 %
4 Выраженная КМ 18 10,7 %
5 ИТОГО 169 100 % 100 %
Таблица 4
Структура дисплазии СОЖ при оценке биопсии взятой по Kimura-Takemoto
№/п Характеристика дисплазии Колич. пациентов Доля пациентов с КМ Доля КМ
1 Отсутствие дисплазии 85 50,3 % 50,3 %
2 Дисплазия легкой степени 36 21,4 % 49,7 %
3 Умеренная дисплазия 42 24,8 %
4 Выраженная дисплазия 6 3,5 %
5 ИТОГО 169 100 % 100 %
Тяжелая степень дисплазии была установлена у трех пациентов с верифицированным раком желудка. К сожалению, эти больные впервые обратились и у них клинически был поставлен диагноз позднего рака. Они были переданы под наблюдение врача-онколога для палиативной терапии (возраст этих больных: 51, 70 и 76 лет). Еще трое больных с верифицированной диффузной атрофии СОЖ в ближайшее время умерли от сердечно-сосудистых заболеваний. Возраст их на момент выявления атрофического гастрита с тяжелой дисплазией составлял: 69, 87 и 79 лет.
Таблица 5
Распределение слабой и умеренной дисплазии СОЖ у пациентов с корпус-гастритом
Всего обследовано 169 человек Слабая и умеренная дисплазия СОЖ в сочетании с выраженной атрофией СОЖ Слабая и умеренная дисплазия СОЖ без наличия выраженной атрофии СОЖ Слабая и умеренная дисплазия СОЖ с наличием и без наличия выраженной атрофии СОЖ
Абсолютное число пациентов 62 16 78
Процент 80 % 20 % 100 %
В случае сочетания слабой и умеренной дисплазии (высокий риск) с выраженной атрофией (высокий риск) можно говорить об очень высоком риске желудочного рака. При наличии слабой и умеренной дисплазии без выраженной атрофии – высокий риск. В случаях выявления выраженной дисплазии, понятно, речь может идти о случаях диагностирования раннего желудочного рака.
Обсуждение результатов
Для реализации канцерпревенции желудка предложено достаточно большое количество методик. Они, как правило, состоят из двух последовательных этапов проведения профилактической работы для снижения заболеваемости злокачественными новообразованиями желудка, а также смертности от желудочного рака.
1) На первом этапе необходимо осуществить неинвазивный серологический скрининг атрофического гастрита среди населения.
2) На втором этапе следует верифицировать детально атрофический гастрит с обязательной детекцией степени выраженности атрофии в антральном сегменте и в корпусе желудка. Причем верификация должна основываться на предварительном эндоскопическом осмотре СОЖ.
Обязательно проводится оценка степени атрофии слизистой оболочки обоих сегментов желудка. Окончательное заключение по каждому пациенту надо формулировать на основании гистологических исследований биоптатов СОЖ антрального сегмента и желудочного корпуса.
Что касается серологического скрининга АГ, то следует выбрать методику, обладающую наибольшей чувствительностью и специфичностью. Связано это с тем, что диапазон колебаний этих критериев достаточно высок [19, 20].
Критерием оценки эффективности скрининговой и диагностической методики следует считать долю ложноотрицательных результатов. Чем меньше ложноотрицательных результатов, тем эффективнее метод выявления патологии [21]. Такой подход касается не только неинвазивных скрининговых методов выявления патологии, но он также важен на втором диагностическом этапе.
При морфологической верификации предраковых заболеваний, а также предраковых изменений СОЖ следует стремиться минимизировать количество «пропущенных» больных (ложноотрицательных) с АГ. Учитывая то, что риск злокачественных новообразований желудка напрямую связан со степенью выраженности атрофии СОЖ необходимо точно верифицировать степень тяжести атрофии слизистой оболочки антрального отдела или тела желудка [11]. Авторами киотского консенсуса предложено выделить две формы атрофического гастрита: 1 – тяжелый атрофический гастрит, 2 – слабый и умеренный атрофический гастрит.
Теперь следует отдельно остановиться на понятии выраженной атрофии СОЖ. Современное состояние этого понятия очень «размыто» и неконкретно. Наиболее полно данное понятие большинство авторов характеризуют термином мультифокальный АГ. Но понятие мультифокальности плохо согласуется с модифицированной Сиднейской классификацией, визуально-аналоговой шкалой, а также морфологическими диагностическими классификациями OLGA, OLGIM [22,23]. В рамках существующих современных классификаций АГ, основывающихся на морфологических признаках выраженной атрофии, кишечной метаплазии СОЖ не учитывается количество биоптатов имеющих такой признак. Положение 14А Киотского консенсуса утверждает, что риск развития злокачественных новообразований желудка коррелирует с тяжестью и степенью атрофического гастрита, при этом уровень рекомендации – сильный, уровень доказанности – высокий, уровень согласованности – 94,7% [11]. Как правило, такая оценка осуществляется по гистологическим критериям биопсии, взятой согласно протоколу в соответствии с модифицированной Сиднейской системой. По упомянутому протоколу необходимо брать пять биоптатов из двух желудочных отделов (antrum, corpus). Эти два отдела не сопоставимы по территории, а именно по площади СОЖ. В то же время, представлены практически равным количеством биоптатов. В этом смысле намного предпочтительнее визуальная оценка СОЖ в рамках эндоскопической классификации Kimura-Takemoto. Согласно этой оценке, площадь желудка делится авторами на шесть, примерно равных, участков. Наличие атрофии фиксируется визуально в антральном сегменте – С1. Корпус желудка оценивается визуально при гастроскопии на пяти участках, и атрофия в области этих желудочных участков обозначается как С2, С3, O1, O2, O3 [24].
При всех позитивных сторонах данного подхода, учитывая большую дозу субъективизма при визуальной оценке атрофических изменений СОЖ, визуальная эндоскопичекая методика не может быть положена в основу эффективной верификации уровня атрофии СОЖ. Предложенная нами методика гистологической оценки биоптатов, полученных в соответствии с принципиальным подходом Kimura и Takemoto, позволяет значительно объективизировать оценку атрофии СОЖ и определить точно её степень в конкретном участке желудочного корпуса. В этих условиях верификация степени выраженности атрофии СОЖ становиться на порядок точнее, а следовательно, значительно эффективнее.
При рассмотрении модели канцерогенеза мы исходили из аксиомы, что величина патогенного действия желудочного канцерогенеза не зависит от площади СОЖ, на которой последовательно развивается каскад Корреа. Принципиальное значение в данном случае имеет этап каскада, до которого доходит процесс развития злокачественного новообразования желудка даже на очень ограниченном участке СОЖ. Данный постулат особенно актуален для корпуса желудка, который превосходит по площади СОЖ антрального сегмента желудка
В два раза. Применительно к телу желудка можно сформулировать основную концепцию следующим образом: не важно в скольких биоптатах из пяти (C2, C3, O1, O2, O3) выявляется выраженная атрофия СОЖ, важнейшую роль при этом играет скорость последовательного преобразования канцерогенеза от одного этапа каскада Корреа до следующего. Определяющее значение в этой последовательности приобретают этапы атрофии
– выраженной атрофии – кишечной метаплазии – дисплазии и желудочного рака. Важ-ное звено в этой последовательности представляет собой переход от слабой и умеренной атрофии СОЖ к выраженной. Этот переход означает смену качества определенного этапа каскада Корреа. Именно рубеж между этими этапами имеет определяющее значение в прогнозировании дальнейшего течения болезни.
Заключение
Преимущества верификации степени тяжести, основанной на морфологической оценке атрофии, по модифицированной эндоскопической классификации Kimura-Takemoto очевидны. Основным моментом в повышении эффективности морфологической диагностики является увеличение количества биоптатов при выполнении методики морфологической оценки по предлагаемой нами модификации системы Kimura-Takemoto. Недостаточный уровень эффективности модифицированной Сиднейской системы в диагностике корпус-атрофического гастрита заключается в недостаточном количестве биоптатов приходящихся на этот сегмент желудка. Кроме того, два биоптата из передней и задней стенки корпуса желудка представляют один уровень распространения атрофии в этом сегменте. Распространение атрофии СОЖ по желудочному корпусу происходит от угла желудка до дна желудка через нижнюю, среднюю, верхнюю треть малой кривизны. Далее атрофия переходит на стенки желудка (передню и заднюю) и таким образом достигает верхней части дна желудка и большой кривизны.
Мы предложили осуществлять взятие биоптатов последовательно с каждой ступени (уровня) распространения атрофии по желудочному корпусу от угла до дна желудка. Таким образом, можно получить объективную картину о состоянии всего корпуса желудка. Для этого достаточно пяти биоптатов: С2, С3, О1, О2, О3. Недостаточно оценивать состояние СОЖ в этом сегменте по одному уровню (Сиднейская система).
Обнаруженная нами закономерность снижения количества пациентов с дополнительно выявляемой выраженной атрофией по мере добавления биоптатов от одного до пяти позволяет считать, что пять биоптатов, с каждого уровня по одному, является оптимальным. Если гипотетически предложить взятие одного биоптата дополнительно на одном из уровней, то это не улучшит существенно диагностику атрофии этого сегмента желудка, но при этом приведет к значительному усложнению выполнения диагностической процедуры. Поэтому можно признать, что наиболее оптимальной, с точки зрения выполнения и при этом максимально эффективной диагностической методикой, является морфологическая оценка гистологического исследования пяти биоптатов взятых с разных уровней последовательного распространения атрофии по телу желудка от угла до его дна. При помощи такой методики можно не только оценивать степень атрофии СОЖ в корпусе, но и эффективно оценивать регресс этой атрофии в динамике после проведенного специфического лечения. В совокупности такой подход, основанный на мониторинге атрофического гастрита, представляет собой прецизионную методику.
Как соотнести модифицированную верификацию степени тяжести атрофического гастрита по Kimura – Takemoto с морфологическим выявлением дисплазии и кишечной метаплазии? Отсутствие корреляции между уровнями кишечной метаплазии СОЖ и выраженности атрофии, а также дисплазии свидетельствует о том, что выявление кишечной метаплазии не может быть эффективно использовано для подтверждения тяжести атрофии СОЖ. Наличие же дисплазии представляет собой главный маркер высокого риска желудочного рака. В большой доле (20%) этот маркер удается выявить без сочетания с выраженной атрофией СОЖ.
В связи с таким обстоятельством, морфологическая оценка биоптатов должна проводиться по строгим правилам. Во-первых, если выявлена слабая или умеренная дисплазия необходимо оценивать риск, в данном случае, как высокий. Количество биоптатов в которых она обнаружена не определяет уровень риска. Достаточно присутствие дисплазии хотя бы в одном из них. Во-вторых, по этим же правилам необходимо оценивать выраженную атрофию СОЖ. В данном случае важна не количественная характеристика, а качественный показатель – интегральная диагностика мультифокального атрофического гастрита на основе оценки наибольшей выраженности дисплазии или уровня выраженной атрофии СОЖ в одном из биоптатов. Сочетание двух морфологических критериев мультифокального атрофического гастрита одновременно, а именно слабой, умеренной дисплазии и выраженной атрофии СОЖ позволит повысить эффективность последующей канцерпревенции. Выявление дисплазии тяжелой степени позволяет диагностировать ранний рак СОЖ со всеми необходимыми последствиями, предусматривающими применения радикальных методов лечения.
Полный текст статьи:
Список литературы:
1. Котелевец С. М. Морфофункциональные сопставления при развитии кишечной метаплазии в слизистой оболочке желудка // Рос. журн. гастроэнтер., гепатол., колопроктол. 2007. Т. 17. № 2. С. 80-83.
2. Мерабишвили В. М. Рак желудка: эпидемиология, профилактика, оценка эффективности лечения на популяционном уровне // Практ. онкология. 2001. № 3. С. 3-8.
3. Неинвазивная диагностика предраковых заболеваний желудка: учебное пособие / С.А. Курилович, О.В. Решетников, С.А. Кротов, А.В. Белковец. Новосибирск: Изд‐во НГТУ, 2013. 68 с.
[Non-invasive diagnosis of precancerous diseases of the stomach: a training manual / S.A. Kurilovich, O.V. Re-shetnikov, S.A. Krotov, A.V. Bel- kovets. Novosibirsk: Publ. NGTU, 2013. 68 p. (in Russ.)]
4. Новые методы серологической и эндоскопической диагностики хронического атрофического гастрита и раннего рака желудка / И.В. Маев, Е.В. Мельникова, Т.В. Крюкова [и др.] // Клинические перспективы гастроэнтерологии, гепатологии. 2009. № 6. С. 30-34.
5. Пасечников В. Д., Чуков С. З. Доказательства Hp- ассоциированного желудочного канцерогенеза и раз- работка стратегий профилактики рака желудка // Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. 2006. Т. 16. № 5. С. 82-90.
6. Пасечников В.Д., Чуков С.З. Эпидемиология рака желудка // Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. 2002. Т. 12, № 3. С. 18-26.
7. Хубиева, М. М. Возможности диагностики атрофии слизистой оболочки желудка и её обратного развития у больных с атрофическим гастритом: дис. к.м.н. Ставрополь, 2014. 145 с.
8. Чиссов В. И., Франк Г. А., Белоус Т. А Предрак желудка // Клинич. медицина. 1999. Т. 77. № 7. С. 23-26.
9. Correa, P. The new era of cancer epidemiology. Cancer. Epi-demiol Biomarkers Prev, 1991, 1, pp. 5-11.
10. Sipponen P., Kekki M., Haapakoski J. et al. Gastric cancer risk in chronic atrophic gastritis: statistical calculations of cross-sectional data. Int J Cancer, 1985, 35, pp. 173-7. DOI: 10.1002/ijc.2910350206
11. Sugano K., Tack J., Ernst J Kiupers et al. Kyoto global consensus report on Helicobacter pylori gastritis / Gat, 2015, 64 (9), pp. 1-15. http:// dx.doi.org/10.1136/gutjnl-2015-309252
12. Oderda, G. Forni M. et al. Campylobacter pylori a patologia gastro- duodenale nel bambino. Ped Med Chir, 1988, 10, pp. 19-24.
13. Caruso, M.L., Fucci L. Histological identification of Helicobacter pylori in early and advanced gastric cancer. J Clin Gastroenterol, 1990, 12 (5), pp. 601-2. PMID: 2103734
14. Genta, R.M. Can atrophic gastritis be diagnosed in the presence of Helicobacter pylori, infection? In: R.H. Hunt, G.N.J. Tytgat. (eds.) Helico- bacter pylori. Basic Mechanisms to Clinical Cure 2000. Dordrecht, Boston, London: Kluwer Academic Publishers. 2000, pp. 229-37.
15. Lee Y., Jeon Y.C., Koo T.Y. et al. Histological changes of gastric atro- phy and intestinal metaplasia after Helicobacter pylori eradication. Korean J Gastroenterol, 2007, 5 (50), pp. 299-305. PMID: 18159161
16. Takuji G., Yanagisawa A., Sasako M. et al. Incidence in lymph node metastasis from early gastric cancer: estimation with a large number of cases at two large centers. Gastric Cancer, 2000, pp. 219-25.
17. Nakagawa S., Kato M., Shimizu Y. et al. Relationship between histo- pathologic gastritis and mucosal microvascularity: observations with mag- nifying endoscopy. Gastrointest Endosc, 2003, 58, 71.
18. Kodama M., Okimoto T., Ogawa R. et al. Endoscopic atrophic clas- sification before and after H. pylori eradication is closely associated with histological atrophy and intestinal metaplasia. Endosc Int Open, 2015, 3(4), pp. E311–E317. DOI: 10.1055/s-0034-1392090
19. Leja M., Kupcinskas L., Funka K. et al. The validity of a biomarker method for inderect detection of castric mucosal atrophy versus standart histipathology. Dig Dis Sci, 2009, 54, pp. 2377-84.
20. Kotelevets S.M., Chekh S.A. Serological criteria for mild, moderate and severe atrophy in atrophic gastritis. Biology and Medicine, 2015, 7 (3), pp. 235-9.
21. Структурная динамика адгезивных клеток костного мозга при культивировании: первичный пассаж (часть 1) / Омельяненко Н. П., Ильина В. К., Ковалев А. В., Кальсин В. А., Родионов С. А. // Клеточная транс-плантология и тканевая инженерия. 2012. Т. 7. № 4. С. 28-37.
[Structural dynamics of adhesive bone marrow cells during cultivation: primary passage (part 1) / N.P. Omelianenko, V.K. Ilyina, A.V. Kovalev.,
V.A. Kalsin., S.A. Rodionov // Kletochnaya transplantologiya i tkanevaya inzheneriya. 2012. V. 7. No. 4. pp. 28-37. (in Russ.)]
22. Rugge M., Correa P., Di Mario F. et al. OLGA staging for gas- tritis: a tutorial. Dig Liver Dis, 2008, 40 (8), pp. 650-8. DOI: 10.1016/j. dld.2008.02.030.
23. Rugge M., Correa P., Dixon M.F. et al. Gastric mucosal atrophy: interobserver consistency using new criteria for classification and grading. Aliment Pharmacol Ther, 2002, 16 (7), pp. 1249-59. DOI: 10.1046/j.1365- 2036.2002.01301.x
24. Kimura K., Takemoto T. An endoscopic recognition of the atrophic border and its significance in chronic gastritis. Endoscopy, 1969, 3, pp.87-97
От редакции EndoExpert.ru
Благодарим администрацию и редакторов Московского Хирургического журнала, а также В.С. Фомина за возможность размещения статьи на портале ЭндоЭксперт.ру
Рекомендуемые статьи
Синдром Баррета
слизистая пищевода с островками эктопии цилиндрического эпителия, пептический эзофагит, аксиальная грыжа
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.














.jpg)





.png)


.jpg)














Комментарии