- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: ПЕРФОРАЦИЯ ПИЩЕВОДА У ДЕТЕЙ: ЭТИОЛОГИЯ, КЛИНИКА, ДИАГНОСТИКА, ЛЕЧЕНИЕ
| Авторы: | Е.А. Дробязгин 1 |
| Об авторах: |
1. Доктор медицинских наук, профессор кафедры госпитальной и детской хирургии НГМУ, заведующий отделения эндоскопии ГБУЗ НСО «ГНОКБ», врач-эндоскопист |
Аннотация:
Представлен обзор основных моментов диагностики и тактических аспектов при перфорации пищевода в педиатрии. Указана значимость эндоскопических методов лечения. Приведены особенности применения эндоскопических методов при лечении перфораций в зависимости от их протяженности и локализации. Показана значимость консервативных мероприятий при лечении и важность обеспечения энтерального питания.
Введение:
Перфорация пищевода у пациентов детского возраста — сложная проблема для диагностики и лечения. Причины тому анатомические: отсутствие серозной оболочки, кровоснабжение из различных источников, расположение пищевода в непосредственной близости к жизненно важным структурам — крупным кровеносным сосудам и трахее. Эти обстоятельства создают большие проблемы для диагностики и лечения перфорации [33].
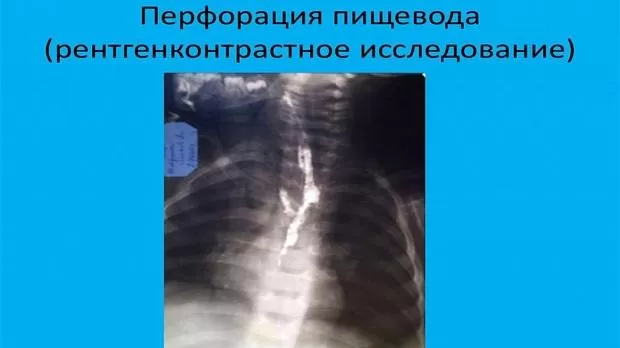
Полный текст статьи:
#перфорацияпищевода #диагностикаперфорациипищевода #инородныетелапищевода #лечениеперфорациипищевода #эндоскопия #экстракцияинородныхтел #гастроскопия #эзофагоскопия #энтеральноепитание #назогастральныйзонд
Перфорация пищевода – эндоскопия – педиатрия – лечение
Этиология. Основные причины повреждения пищевода у детей — тупая травма грудной клетки/шеи, установка назогастрального зонда, эндотрахеальная интубация, химические ожоги пищевода, инородные тела, эндоскопические исследования и интервенции. Среди инструментальных повреждений пищевода эндоскопические манипуляции — ведущие в этиологии [3, 4]. При этом интервенционное вмешательство увеличивает риск перфорации до 200 раз [1].
В целом диагностические эндоскопические исследования имеют низкий уровень осложнений по сравнению с интервенционной эндоскопией. Но, несмотря на существующее мнение о безопасности эндоскопических процедур, резкое увеличение числа эндоскопических исследований привело к увеличению частоты перфорации [3, 4]. В случае сложного проведения аппарата в пищевод даже простая диагностическая эндоскопия связана с высоким риском осложнений. Чрезмерное давление на аппарат при его проведении через верхний пищеводный сфинктер или чрезмерное разгибание шеи увеличивают риск перфорации пищевода. С появлением интервенционной эндоскопии риск перфораций увеличился. С различной частой осложнений связаны склерозирование варикозно расширенных вен пищевода, бужирование стриктур пищевода/кардиодилатация при ахалазии, удаление инородного тела, а также высокотехнологичные процедуры — пероральная эндоскопическая миотомия, подслизистая диссекция и резекция слизистой оболочки 2, 22, 23, 33].
Одна из основных причин перфорации пищевода — инородные тела (ИТ). Чаще большинство проглатываемых ИТ проходят через желудочно-кишечный тракт без осложнений и выводятся из организма естественным путем. В исключительных случаях проглатывание ИТ может привести к осложнениям. Наиболее частые места локализации инородных тел — истинные сужения: глоточно-пищеводный переход, средняя треть пищевода (аортальное сужение), пищеводно-желудочный переход, привратник, илеоцекальный угол [5]. При наличии фоновой патологии — трахеопищеводного свища, дивертикул, постожоговых сужений пищевода, эозинофильного эзофагита и т. д. — вероятность повреждения пищевода увеличивается. Важное значение имеет тип ИТ: острые предметы — рыбная кость, булавки, инородные тела с большой и нерегулярной поверхностью, плоские батарейки, двойные магниты — увеличивают риск повреждения пищевода и могут привести к нему. Частота осложнений увеличивается в зависимости от продолжительности нахождения ИТ в пищеводе (позднее обращение в стационар, задержка в постановке диагноза), его типа (острое инородное тело, батареи), локализации (например, нижняя треть пищевода), а также в случае патологии пищевода (стриктуры) [6,7]. Длительность нахождения ИТ в пищеводе — самый значимый фактор, влияющий на возникновение перфорации [8, 9, 10]. Частота перфорации пищевода, связанная с проглатыванием инородного тела, составляет приблизительно 2–15% [11].
Среди всех ИТ монеты — самые распространенные. На них приходится до 70% случаев проглатывания [12, 13]. Несмотря на то, что в большинстве случаев (84%) факт проглатывания инородного тела известен, обращение в стационар не всегда происходит вовремя [14], а риск осложнений выше при экстракции ИТ и может составлять до 18% [15]. При нахождении монеты в пищеводе более 24 часов места контакта слизистой с ребрами монеты могут подвергаться некрозу из-за давления инородного тела [16, 33].
Хотя большинство ИТ находится в непосредственной близости от глоточно-пищеводного перехода, частой зоной их локализации может быть и грудной отдел пищевода [9]. При внедрении инородного тела в стенку пищевода может произойти повреждение плевры, сосудистых структур средостения и трахеи. Длительное нахождение ИТ в пищеводе приводит к пролежню стенки и экстраэзофагеальной миграции, что влечет синдром «захороненного инородного тела» — часто является бессимптомным и не распознается на начальном этапе [10]. Это редкое осложнение, но тем не менее оно описано [21].
Для излечения ИТ из пищевода можно использовать как жесткую, так и гибкую эзофагоскопию [17, 18, 33]. Наиболее целесообразно извлечение инородного тела в течение первых 24 часов [19, 20].
Клиническая картина перфорации включает боль в шее или грудной клетке, подкожную эмфизему и рвоту. Дисфагия на уровне шеи, дисфония, охриплость и локализованная боль в шее указывают на перфорацию шейного отдела пищевода. Перфорация грудного отдела проявляется болью в спине, иррадиацией ее в спину или болями в грудной клетке. Появление болей в животе и клиники перитонита указывает на перфорацию абдоминальной части пищевода [24]. В условиях медиастинита и прогрессирующего сепсиса возникает тахикардия, а потом и лихорадка с ознобом [25]. Лихорадка считается поздним клиническим симптомом.
Но клинических симптомов может и не быть — особенно в первые часы после повреждения и особенно при перфорации грудного отдела пищевода [26]. Летальность при таком развитии событий может достигать 40% [24].
Диагностика. В 33% случаев при рентгенографии органов грудной клетки никаких признаков перфорации не обнаруживается. Использование спиральной компьютерной томографии может достоверно выявить место перфорации пищевода с указанием размеров и повреждения окружающих структур при условии, что ребенок достаточно стабилен, чтобы исследование могло быть выполнено [29].
Лечение. Выбор методик закрытия перфорации в случае ее обнаружения в ходе эндоскопического удаления ИТ зависит от навыков и опыта эндоскописта. Размер дефекта, его края и наличие кровотечения — ключевые факторы, которые необходимо оценить перед попыткой эндоскопического закрытия. Если размер дефекта мал, можно использовать тканевые герметики (фибриновый клей, цианоакрилат) и клипирование. Перфорации размером менее 10 мм считаются подходящими для эндоскопического лечения в соответствии с рекомендациями Европейского общества по гастроинтестинальной эндоскопии [20, 33]. При перфорации менее 2 см возможно применение клип-аппликаторов, проводимых как через канал эндоскопа, так и через системы Ovesco. В случае «завернутых» краев предпочтительны клипсы типа Ovesco. Если размер дефекта составляет от 30 до 70% диаметра просвета, то предпочтительно его перекрытие стентом. Полностью или частично покрытые саморасширяющиеся металлические стенты следует использовать при перфорациях длиной более 2 см или в условиях сужения пищевода [27]. Эффективность стентирования сомнительна, если дефект локализован в шейном отеле пищевода, в зоне пищеводно-желудочного перехода, и если его размер превышает 6 см, — вероятно, из-за риска миграции стента и неэффективного прикрытия дефекта. Тем не менее использование стента уменьшает вероятность затека в средостение, способствует заживлению слизистой оболочки, позволяет начать питание раньше и предупреждает формирование стриктуры пищевода [33].
Оптимальным является консервативное лечение. Важно учитывать клинический статус пациента, необходимость применения антибактериальной терапии, обеспечение питанием и хорошее дренирование зоны повреждения [31]. Хирургическое лечение показано в случаях неконтролируемого течения заболевания, в отсутствие эффекта от консервативных мероприятий [1, 4], при больших размерах дефекта и/или наличии трахеопищеводного свища [28–30, 33].
Изменение показаний в сторону консервативных мероприятий при перфорации пищевода у детей в настоящее время является нормой: считается, что перфорационное отверстие в большинстве случаев закрывается при условии, что клиренс сохранен, а также решена проблема с профилактикой инфекционных осложнений и решен вопрос питания. Однако при ухудшении состояния пациента не следует пренебрегать хирургическим лечением [15, 24, 25].
Парентеральное питание используется лишь у небольшого числа детей. В большинстве случае применяется энтеральное питание через назогастральный или назоеюнальный зонд. При этом возможен заброс нутриента или желудочного содержимого в средостение при наличии гастроэзофагеального рефлюкса [16, 19]. Нутритивная поддержка во время консервативного лечения играет важную роль в ускорении заживления перфоративного дефекта. Оптимально использование эндоскопической установки назоинтестинального зонда: это снижает частоту хирургического лечения, гастроэзофагеальный рефлюкс и, следовательно, контаминацию средостения [20, 23].
Прогностические факторы
Известно несколько благоприятных прогностических факторов при лечении перфорации пищевода независимо от выбора способа лечения [1, 8]:
· ранняя диагностика и начало лечения в течение 24 часов после возникновения перфорации;
· ятрогенная причина перфорации;
· отсутствие сопутствующих заболеваний;
· отсутствие заболевания пищевода;
· гемодинамическая стабильность;
· сохраненный нутритивный статус;
· локализация дефекта в шейном отделе пищевода;
· повреждение острым предметом.
Следует выделить специфические факторы, которые способствуют консервативному лечению в зависимости от времени, прошедшего после перфорации.
1. Ранняя диагностика (в течение 24 часов после обнаружения перфорации):
• отсутствие медиастинита;
• отсутствие загрязнения твердой пищей;
• свободное попадание контрастного вещества в дистальные отделы ЖКТ.
2. При позднем обнаружении перфорации:
• остаточное загрязнение;
• минимальный сепсис;
• никаких других факторов риска/болезней;
• возможность проведения энтерального/парентерального питания.
Список литературы:
2. Iqbal C.W., Askegard-Giesmann J.R., Pham T.H., Ishitani M.B., Moir C.R. Pediatric endoscopic injuries: incidence, management, and outcomes. J Pediatr Surg. 2008; 43: 911–915.
3. Gander J.W., Berdon W.E., Cowles R.A. Iatrogenic esophageal perforation in children. Pediatr Surg Int. 2009; 25: 395–401.
4. Vieira E., Cabral M.J., Gonсalves M. Esophageal perforation in children: a review of one pediatric surgery institution’s experience (16 years). Acta Med Port. 2013; 26: 102–106.
5. Garey C.L., Laituri C.A., Kaye A.J., Ostlie D.J., Snyder C.L., Holcomb G.W. 3rd, et al. Esophageal perforation in children: a review of one institution's experience. J Surg Res. 2010; 164: 13–17.
6. Orji F.T., Akpeh J.O., Okolugbo N.E. Management of esophageal foreign bodies: experience in a developing country. World J Surg. 2012; 36: 1083–1088.
7. Nadir A., Sahin E., Nadir I., Karadayi S., Kaptanoglu M. Esophageal foreign bodies: 177 cases. Dis Esophagus. 2011; 24: 6–9.
8. Sung S.H., Jeon S.W., Son H.S., Kim S.K., Jung M.K., Cho C.M., et al. Factors predictive of risk for complications in patients with oesophageal foreign bodies. Dig Liver Dis. 2011; 43: 632–635.
9. Peng A., Li Y., Xiao Z., Wu W. Study of clinical treatment of esophageal foreign body-induced esophageal perforation with lethal complications. Eur Arch Otorhinolaryngol. 2012; 269: 2027–2036.
10. Macpherson R.I., Hill J.G., Othersen H.B., Tagge E.P., Smith C.D. Esophageal foreign bodies in children: diagnosis, treatment, and complications. Am J Roentgenol. 1996; 166: 919–924.
11. Peters N.J., Mahajan J.K., Bawa M., Chabbra A., Garg R., Rao K.L. Esophageal perforations due to foreign body impaction in children. J Pediatr Surg. 2015; 50: 1260–1263.
12. Shivakumar A.M., Naik A.S., Prashanth K.B., Yogesh B.S., Hongal G.F. Foreign body in upper digestive tract. Indian J Pediatr. 2004; 71: 689–693.
13. Waltzman M.L., Baskin M., Wypij D., Mooney D., Jones D., Fleisher G. A randomized clinical trial of the management of esophageal coins in children. Pediatrics. 2005; 116: 614–619.
14. Rybojad B., Niedzielska G., Niedzielski A., Rudnicka-Drozak E., Rybojad P. Esophageal foreign bodies in pediatric patients: a thirteen-year retrospective study. Scientific World Journal. 2012; 2012: 102642.
15. Mishra B., Singhal S., Aggarwal D., Kumar N., Kumar S. Non operative management of traumatic esophageal perforation leading to esophagocutaneous fistula in pediatric age group: review and case report. World J Emerg Surg. 2015; 10: 19.
16. Martinez L., Rivas S., Hernandez F., Avila L.F., Lassaletta L., Murcia J., et al. Aggressive conservative treatment of esophageal perforations in children. J Pediatr Surg. 2003; 38: 685–689.
17. Chen T., Wu H.F., Shi Q., Zhou P.H., Chen S.Y., Xu M.D., et al. Endoscopic management of impacted esophageal foreign bodies. Dis Esophagus. 2013; 26: 799–806.
18. Gmeiner D., von Rahden B.H., Meco C., Hutter J., Oberascher G., Stein H.J. Flexible versus rigid endoscopy for treatment of foreign body impaction in the esophagus. Surg Endosc. 2007; 21: 2026–2029.
19. Soreide J.A., Viste A. Esophageal perforation: diagnostic work-up and clinical decision-making in the first 24 hours. Scand J Trauma Resusc Emerg Med. 201; 19: 66.
20. Paspatis G.A., Dumonceau J.M., Barthet M., Meisner S., Repici A., Saunders B.P., et al. Diagnosis and management of iatrogenic endoscopic perforations: European Society of Gastrointestinal Endoscopy (ESGE) Position Statement. Endoscopy. 2014; 46: 693–711.
21. Bakshi J., Verma R.K., Karuppiah S. Migratory foreign body of neck in a battered baby: a case report. Int J Pediatr Otorhinolaryngol. 2009; 73: 1814–1816.
22. Myer C.M. 3rd. Potential hazards of esophageal foreign body extraction. Pediatr Radiol. 1991; 21: 97–98.
23. Rogalski P., Daniluk J., Baniukiewicz A., Wroblewski E., Dabrowski A. Endoscopic management of gastrointestinal perforations, leaks and fistulas. World J Gastroenterol. 2015; 21: 10542–10552.
24. Jones W.G. 2nd, Ginsberg R.J. Esophageal perforation: a continuing challenge. Ann Thorac Surg. 1992; 53: 534–543.
25. Lyons W.S., Seremetis M.G., de Guzman V.C., Peabody J.W. Jr. Ruptures and perforations of the esophagus: the case for conservative supportive management. Ann Thorac Surg. 1978; 25: 346–350.
26. Cameron J.L., Kieffer R.F., Hendrix T.R., Mehigan D.G., Baker R.R. Selective nonoperative management of contained intrathoracic esophageal disruptions. Ann Thorac Surg. 1979; 27: 404–408.
27. van Boeckel P.G., Dua K.S., Weusten B.L., Schmits R.J., Surapaneni N., Timmer R., et al. Fully covered self-expandable metal stents (SEMS), partially covered SEMS and self-expandable plastic stents for the treatment of benign esophageal ruptures and anastomotic leaks. BMC Gastroenterol. 2012; 12: 19.
28. Kotzampassi K., Eleftheriadis E. Tissue sealants in endoscopic applications for anastomotic leakage during a 25-year period. Surgery. 2015; 157: 79–86.
29. Willingham F.F., Buscaglia J.M. Endoscopic management of gastrointestinal leaks and fistulae. Clin Gastroenterol Hepatol. 2015; 13: 1714–1721.
30. Kumar N., Thompson C.C. Endoscopic therapy for postoperative leaks and fistulae. Gastrointest Endosc Clin N Am. 2013; 23: 123–136.
31. Muir A.D., White J., McGuigan J.A., McManus K.G., Graham A.N. Treatment and outcomes of oesophageal perforation in a tertiary referral centre. Eur J Cardiothorac Surg. 2003; 23: 799–804.
32. Pall H., Lerner D., Khlevner J., Reynolds C., Kurowski J., Troendle D., et al. Developing the pediatric gastrointestinal endoscopy unit: a clinical report by the Endoscopy and Procedures Committee. J Pediatr Gastroenterol Nutr. 2016; 63: 295–306.
33. Govindarajan K.K. Esophageal perforation in children: etiology and management, with special reference to endoscopic esophageal perforation Korean J Pediatr. 2018 Jun; 61 (6): 175–179. DOI: 10.3345/kjp.2018.61.6.175.
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.















.jpg)




.png)














Комментарии