- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Рекомендации JGES по эндоскопической диагностике раннего рака желудка 2020
| Авторы: | Kenshi Yao Noriya Uedo Tomoari Kamada Toshiaki Hirasawa Takashi Nagahama Shigetaka Yoshinaga Masashi Oka Kazuhiko Inoue Katsuhiro Mabe Takashi Yao Masahiro Yoshida Isao Miyashiro Kazuma Fujimoto Hisao Tajiri 1 2020г. |
| Об авторах: |
1. All authors are belonging to Japan Gastroenterological Endoscopy Society Committee Guideline for Endoscopic Diagnosis of Early Gastric Cancer |
Аннотация:
Японское общество гастроэнтерологической эндоскопии разработало Руководство по эндоскопической диагностике раннего рака желудка на основе научных данных.







Полный текст статьи:
Таблица 1. Рекомендации по эндоскопической диагностике раннего рака желудка: список утверждений
|
Заявление № |
утверждение |
Сила рекомендации |
Уровень доказательности |
№ страницы |
|
[I] Стратификация риска рака желудка перед эндоскопическим исследованием. | ||||
|
1-1 |
Некоторые факторы, такие как инфекция Helicobacter pylori (H. pylori) , атрофия слизистой оболочки желудка, наследственные заболевания и курение, были названы очевидными факторами риска рака желудка. Другие факторы, указанные как возможные факторы риска, включают диету, предпочтения в образе жизни и вирусную инфекцию Эпштейна – Барра (EB). |
Жизненный опыт |
C |
6 |
|
1-2 |
Риск рака желудка можно стратифицировать перед эндоскопическим обследованием. От такой стратификации рисков можно ожидать положительного экономического эффекта. Однако вопросы об оптимальном методе остаются. |
Жизненный опыт |
C |
11 |
|
1–3 |
Комбинация сывороточного антитела H. pylori и сывороточного пепсиногена может быть полезной для стратификации риска рака желудка. Однако ложноотрицательные результаты могут быть получены в случаях тяжелой атрофии и перенесенной инфекции при измерении титра антител H. pylori и пороговом значении, интерпретации уровней пепсиногена (PG) и пороговом значении отношения PG I / PG II. |
2 |
C |
12 |
|
[II] Выявление раннего рака желудка | ||||
|
2-1 |
Следует рассмотреть возможность применения препаратов, ингибирующих перистальтику желудка, в случаях, когда наблюдение затруднено из-за интенсивной перистальтики. |
Никто |
D |
13 |
|
2-2 |
Настоятельно рекомендуется использование муколитических агентов для растворения и удаления слизистой оболочки желудка, а также пеногасителей, поскольку улучшенная видимость слизистой оболочки приводит к раннему выявлению рака желудка. |
1 |
D |
14 |
|
2–3 |
Седативные средства и анальгетики могут использоваться с осторожностью из-за возможных побочных реакций у субъектов, которые испытывают сильное беспокойство или наблюдение за которыми затруднено из-за рефлексов или движений тела. |
Никто |
D |
15 |
|
2-4 |
Продолжительность наблюдения за желудком связана с обнаружением раннего рака желудка. Наблюдать за желудком нужно достаточно времени. |
1 |
D |
16 |
|
2-5 |
Необходимо систематически наблюдать за желудком для выявления раннего рака желудка. |
1 |
D |
17 |
|
2-6 |
Обсуждается полезность эндоскопии с улучшенными изображениями для выявления рака желудка на ранних стадиях. |
Никто |
D |
18 |
|
[III] Качественная диагностика раннего рака желудка (дифференциальная диагностика рака и не раковых заболеваний) | ||||
|
3-1 |
Эндоскопия с улучшенным изображением полезна для качественной диагностики рака желудка на ранних стадиях; таким образом, его использование рекомендуется |
2 |
А |
20 |
|
[IV] Диагностика для выбора стратегии лечения рака желудка. | ||||
|
4-1 |
Тщательное эндоскопическое обследование перед лечением необходимо для определения терапевтической стратегии при раннем раке желудка. |
1 |
D |
25 |
|
4-2 |
Диагностика гистологического типа рака должна выполняться всесторонне путем эндоскопической диагностики и гистопатологической диагностики с использованием образцов биопсии. |
2 |
D |
26 |
|
4-3 |
Хотя приблизительную оценку размера поражения можно получить с помощью эндоскопии, эндоскопический диагноз следует ставить, исходя из того, что размер поражения должен быть окончательно оценен после получения гистопатологических результатов резецированного образца. |
Жизненный опыт |
D |
22 |
|
4-4 |
В принципе, для определения глубины инвазии рака желудка на ранней стадии следует использовать обычную эндоскопию в белом свете. Если это сложно, эндоскопическое ультразвуковое исследование может быть полезным дополнительным диагностическим инструментом. |
2 |
C |
27 |
|
4-5 |
В принципе, обычная эндоскопия в белом свете должна использоваться для определения наличия / отсутствия активных язв и язвенных шрамов, связанных с ранним раком желудка. |
2 |
D |
28 |
|
4-6 |
Эндоскопия с улучшенным изображением полезна для диагностики степени инвазии. |
1 |
B |
29 |
|
[V] Стратификация риска после эндоскопического исследования. | ||||
|
5-1 |
Атрофия, кишечная метаплазия, мурашки по коже, отек слизистой оболочки и ксантома желудка - это эндоскопические данные, связанные с риском рака желудка. |
Жизненный опыт |
B |
30 |
|
5-2 |
Стратификация риска рака желудка может быть осуществлена на основании результатов эндоскопии, подтверждающих наличие H. pylori- отрицательного статуса и атрофии слизистой оболочки желудка. Таким образом, предлагается стратификация риска по этим двум позициям. |
2 |
C |
32 |
|
[VI] Наблюдение за ранним раком желудка | ||||
|
6-1 |
Пациентам с факторами риска рака желудка рекомендуется контрольное эндоскопическое обследование (клинические и эндоскопические данные). |
1 |
B |
34 |
Вступление
Основные принципы необходимы для безопасного и точного выполнения эндоскопической диагностики рака желудка на ранних стадиях. Хотя к настоящему времени опубликованы рекомендации по эндоскопическому лечению рака желудка и скринингу на рак желудка, необязательно с использованием эндоскопии, никаких рекомендаций, специализированных для эндоскопической диагностики раннего рака желудка, разработано не было. На этом фоне Комитет по рекомендациям Японского общества гастроэнтерологической эндоскопии (JGES) решил разработать новое руководство по эндоскопической диагностике раннего рака желудка на основе научных данных. Это руководство применяется ко всем взрослым, которые могут пройти эндоскопическое обследование желудка, и направлено на облегчение точной диагностики рака желудка на ранних стадиях с помощью эндоскопии с целью повышения смертности и качества жизни (QOL) пациентов с раком желудка. С этой целью мы собрали и интерпретировали доступные доказательства, чтобы предоставить рекомендации для соответствующих клинических решений в соответствии с личными ценностями отдельных пациентов (Таблица 1 ).
Это руководство было подготовлено с использованием доказательной медицины (ДМ), общепринятого и международного стандартного метода. В частности, мы следовали Руководству Minds по разработке клинических рекомендаций 2014 1 (таблица 2 ). Руководство написано в виде отзывов с заявлениями. Поскольку в этой области не было достаточных доказательств высокого уровня, нам пришлось придавать значение консенсусным мнениям экспертов. Мы ожидаем, что это руководство послужит полезным стандартом для эндоскопической диагностики раннего рака желудка.
Таблица 2. Сила рекомендации и уровень доказательности
|
Сила рекомендации |
|
1: Настоятельно рекомендуется |
|
2: Слабо рекомендуется (предлагается) |
|
Нет: нельзя дать однозначную рекомендацию или определить ее силу. |
|
Уровень доказательности |
|
A: Основано на убедительных доказательствах |
|
B: Основано на умеренных доказательствах |
|
C: Основано на слабых доказательствах |
|
D: Основано на очень слабых доказательствах |
Разработка рекомендаций
Члены комитета
Комитет JGES по руководству по эндоскопической диагностике раннего рака желудка включал в себя группу разработчиков из шести гастроэнтерологических эндоскопистов, ответственных за разработку этого руководства. Также существовала внутренняя оценочная комиссия, в которую входили три гастроэнтерологических эндоскописта, один патолог, один врач, отвечающий за методологию разработки рекомендаций, и один эпидемиолог. Трем членам комиссии по внешней оценке также было предложено провести оценку (Таблица 3 ).
Таблица 3. Разработка рекомендаций Комитета по эндоскопической диагностике раннего рака желудка
|
Комитет по руководству JGES | |
|
Президент |
Хисао Тадзири (Департамент инновационных исследований в области интервенционной эндоскопии, Медицинский факультет Университета Джикей) |
|
Ответственный директор |
Казума Фудзимото (Кафедра внутренней медицины Медицинского факультета Международного университета здоровья и социального обеспечения) |
|
Председатель |
Казума Фудзимото (Кафедра внутренней медицины Медицинского факультета Международного университета здоровья и социального обеспечения) |
|
Комитет JGES по руководству по эндоскопической диагностике раннего рака желудка | |
|
Председатель |
Кенши Яо (отделение эндоскопии, больница Тикуши при университете Фукуока) |
|
Председатель комиссии по развитию |
Кенши Яо (отделение эндоскопии, больница Тикуши при университете Фукуока) |
|
Члены группы разработчиков |
Нория Уэдо (Отделение онкологии желудочно-кишечного тракта, Международный институт рака Осаки) |
|
Томоари Камада (Департамент медицины здравоохранения, Общий медицинский центр Медицинской школы Кавасаки) | |
|
Тошиаки Хирасава (отделение гастроэнтерологии больницы института рака Японского фонда исследований рака) | |
|
Такаши Нагахама (отделение гастроэнтерологии, больница Чикуши при университете Фукуока) | |
|
Шигетака Ёсинага (отделение эндоскопии, больница Национального онкологического центра) | |
|
Председатель оценочной комиссии |
Масаси Ока (отделение гастроэнтерологии и гепатологии, Медицинский центр Сайтама, Медицинский университет Сайтама) |
|
Члены оценочной комиссии |
Кадзухико Иноуэ (Больница долгой жизни Дзюнпукай) |
|
Кацухиро Мабе (отделение гастроэнтерологии, Национальная больничная организация, Национальная больница Хакодате) | |
|
Такаши Яо (Отделение патологии человека, Высшая школа медицины Университета Дзюнтендо) | |
|
Масахиро Йошида (отделение гемодиализа и хирургии, больница Итикава, Международный университет здоровья и социального обеспечения) | |
|
Исао Миясиро (Центр борьбы с раком, Международный институт рака Осаки) | |
|
Члены внешней оценочной комиссии |
Takeo Nakayama (Department of Health Informatics, Kyoto University Graduate School of Medicine and Public Health; specialized area: guideline development methodology) |
|
Shogo Kikuchi (Department of Public Health, Aichi Medical University School of Medicine. Specialized area: public health, screening, surveillance) | |
|
Hisao Tajiri (Department of Innovative Interventional Endoscopy Research, The Jikei University School of Medicine; specialized area: endoscopic medicine) | |
|
Collaborating societies |
Japanese Gastric Cancer Association, Japanese Society of Gastrointestinal Cancer Screening, Japanese Society of Gastroenterology, Japanese Gastroenterological Association, Japanese Society for Helicobacter Research, Japanese Society of Pathology, Japan Society of Ningen Dock |
- Помещения каждого члена были показаны в соответствии с информацией при разработке руководства.
Сила рекомендации, уровень доказательности и утверждения
Члены рабочей группы разработали следующие семь пунктов: определение раннего рака желудка и значение диагностики раннего рака желудка с помощью эндоскопии; стратификация риска рака желудка перед проведением эндоскопического исследования; выявление раннего рака желудка; качественная диагностика рака желудка на ранних стадиях (дифференциальная диагностика рака и не раковых заболеваний); диагностика для выбора терапевтической стратегии рака желудка; стратификация риска после эндоскопического исследования; и наблюдение за ранним раком желудка. Поскольку определение раннего рака желудка и важность диагностики раннего рака желудка с помощью эндоскопии представляют собой основную предпосылку, на которой сформулировано это руководство, этот пункт не представлен как утверждение, а скорее описан в преамбуле руководства. Как следствие, Клинические вопросы (CQ) были подготовлены для других шести пунктов, и были внесены изменения в связи с мнениями внутренней оценочной комиссии, чтобы сделать 19 утверждений. С другой стороны, основные вопросы, важные для понимания клинической практики пациентов с ранним раком желудка (такие как клинические и эпидемиологические особенности, патологические состояния, общий диагноз и курс лечения, а также существующие стандартные методы диагностики и лечения), решались отдельно. как «базовые знания». В частности, «базовые знания» включают самую последнюю информацию, тогда как CQ управлялись отдельно для разработки и представления рекомендаций посредством систематического обзора. Политика, лежащая в основе этого акта, была взята из «Предложения от разума: какие клинические вопросы содержатся в руководствах по клинической практике?» ( Какие клинические вопросы содержатся в руководствах по клинической практике? » (http://minds4.jcqhc.or.jp/minds/guideline/pdf/Proposal4_ver.1.0.pdf). Для каждого CQ был проведен систематический поиск литературы в PubMed, Cochrane и Igaku Chuo Zasshi с момента создания базы данных до февраля 2017 г. Для каждого утверждения было дано подробное описание ключевых слов и формул поиска. Кроме того, был проведен ручной поиск недостаточных исследований. Полученные статьи оценивались по типу: рандомизированные контролируемые испытания, обсервационные исследования (когортные исследования или исследования случай – контроль) и метаанализы. Если этих статей было недостаточно, также изучались тематические исследования. Эксперименты на животных и генетические исследования были исключены из этих статей, а заявление и пояснительный текст были подготовлены для каждого CQ.
На основе подготовленных заявлений и комментариев было разработано руководство в виде обзора. За предложенные утверждения в общей сложности 12 человек, включая членов комиссии по разработке и членов внутренней оценочной комиссии, проголосовали в соответствии с модифицированным методом Delphi, который использует систему баллов (1-3, отсутствие консенсуса; 4-6, неудовлетворенность). ; 7–9, консенсус), и предложенные утверждения были приняты как утверждения, когда оценка была 7 или выше. Предложенные утверждения с оценкой 6 или меньше были изменены или сила рекомендации была изменена путем обсуждения, и голосование повторялось до тех пор, пока не была получена оценка 7 или выше. Завершенный проект руководства был оценен членами внешней оценочной комиссии и передан членам JGES для получения комментариев общественности.
Цели
Предполагаемая цель этого руководства - медицинские работники (например, врачи, медсестры, клинические инженеры и техники), занимающиеся клинической практикой гастроэнтерологической эндоскопии. В этом руководстве представлены стандартные правила, которые следует гибко применять в зависимости от конкретного пациента, возраста пациента, осложнений, социальных ситуаций и условий учреждения.
Конфликт интересов авторов в связи с контекстом данной статьи
(1) Раскрытие информации: каждого из членов комиссии по разработке и оценке руководящих принципов попросили раскрыть все вопросы, относящиеся к следующему условию: относительно компаний или организаций, от которых член комиссии как физическое лицо получал какое-либо вознаграждение, такое как вознаграждение (1000000 иен). или более), прибыль от акций (1000000 иен [или 5%] или более), гонорар за патенты (1000000 иен или более), гонорары за выступления (500000 иен или более), гонорар за рукопись (500000 иен или более), исследовательский фонд или грант ( 1000000 иен или более), стипендия (поощрение) пожертвования (1000000 иен или более), пожертвованная лаборатория, предоставленная компанией (1000000 иен или более), и предложения, не имевшие прямого отношения к исследованию (50 000 иен или более).
Кенши Яо (гонорар за выступление: Olympus Corporation), Масаши Ока (гонорар за выступление: Mylan EPD), Кадзухико Иноуэ (гонорар за выступление: Takeda Pharmaceutical Company Limited; Eisai Co., Ltd .; AstraZeneca; Daiichi Sankyo Company, Limited; Otsuka Pharmaceutical Co. , Ltd.), Кацухиро Мабе (гонорар за выступление: Takeda Pharmaceutical Company Limited; Eisai, Co., Ltd.; и лаборатория пожертвованных средств: Eisai Co., Ltd.) и Такаши Яо (гонорар за выступление: Takeda Pharmaceutical Company Limited).
У других авторов нет ИСП для раскрытия.
(2) Руководство: для управления конфликтами интересов каждый член комиссии должен был раскрыть академические, а также вышеупомянутые финансовые конфликты интересов. Члены комиссии, у которых был конфликт интересов, воздержались от голосования по сильным сторонам рекомендаций.
Фонды
Затраты, связанные с разработкой этого руководства, были покрыты JGES.
Редакция
Это руководство будет пересмотрено примерно через 5 лет при центральной роли комитета по руководству JGES в свете накопления новых данных и достижений в области устройств и методов.
Руководство по эндоскопической диагностике раннего рака желудка
Преамбула к руководству; определение раннего рака желудка и важность диагностики раннего рака желудка эндоскопически
Ранний рак желудка определяется как рак желудка, возникающий в слизистой оболочке желудка и ограниченный слизистой или подслизистой оболочкой, независимо от метастазов в лимфатические узлы. 1
О том, может ли выявление рака желудка на ранних стадиях и его последующее лечение снизить уровень смертности, следует судить только по результатам обсервационных исследований, потому что практически невозможно провести рандомизированное контролируемое исследование для сравнения пациентов, которым проводится эндоскопия, и пациентов, не подвергающихся эндоскопии, с точки зрения смертности. как результат. Несмотря на то, что ни в каких отчетах напрямую не представлены доказательства того, что лечение эндоскопически обнаруженного рака желудка на ранней стадии может снизить смертность, это многообещающая идея, учитывая следующие имеющиеся доказательства: (i) популяционный эндоскопический скрининг эффективен для снижения уровня смертности от рака желудка (ранний и продвинутый), (ii) существует косвенный результат, заключающийся в том, что на ранний рак желудка приходится высокая доля среди случаев рака желудка, обнаруженных при популяционном скрининге,
- В результате поиска литературы с использованием PubMed для скрининга и уровня смертности от рака желудка были найдены статьи, документирующие два исследования «случай – контроль» 2 , 3 и два когортных исследования 4 , 5 . Согласно когортному исследованию субъектов, прошедших программу скрининга на рак желудка в Южной Корее, 6отношение шансов (OR) смерти от рака желудка среди субъектов, прошедших эндоскопическое обследование желудка, составило 0,53 (95% доверительный интервал [ДИ] 0,51–0,56), что позволяет предположить, что эндоскопический скрининг на рак желудка способствует снижению показателей смертности рак желудка. В другом исследовании «случай – контроль» было обнаружено 30% снижение OR у субъектов, прошедших эндоскопический скрининг желудка в течение 36 месяцев до постановки диагноза рака желудка, по сравнению с теми, кто не проходил такой скрининг. 2 В другом исследовании случай – контроль сообщалось, что OR смерти от рака желудка составлял 0,206 (95% ДИ 0,044–0,965) у субъектов, прошедших эндоскопический скрининг желудка, по сравнению с теми, кто не проходил такой скрининг. 3
- Хотя предвзятость заблаговременности должна приниматься во внимание, когда результат не является показателем смертности, метаанализ сравнительных исследований людей, прошедших скрининг на рак желудка, и тех, кто не прошел, показал, что процент раннего рака желудка для всех Рак желудка, обнаруженный у пациентов, прошедших скрининг, составил 73%, что значительно выше, чем соответствующий процент (43%), полученный у тех, кто не прошел скрининг. 7
- Что касается вопроса о том, снижает ли лечение рака желудка на ранних стадиях его смертность, ретроспективное обсервационное исследование показало, что коэффициент риска смертности от рака желудка у пациентов, получавших лечение, был 0,51, что ниже, чем у тех, кто не получал лечения. 8
Принимая во внимание результаты (1), (2) и (3), можно сделать вывод, что если лечить ранний рак желудка, обнаруженный с помощью эндоскопии, смертность от рака желудка снизится.
Что касается побочных эффектов эндоскопии, многоцентровое совместное проспективное исследование, проведенное JGES, показало, что частота случайных событий, связанных с эндоскопией верхних отделов желудочно-кишечного тракта, составила 0,171% среди 11081 эндоскопических наблюдений (0,667% среди 3447 случаев биопсии), но не было случаев смерти. 9 Недостаточно доказательств для сравнения риска и пользы. Воспринимаемая польза и предпочтение пациентами эндоскопических обследований у разных пациентов различаются, и тяжесть эндоскопического обследования также различается в зависимости от восприятия пациента. 10Ни в одном исследовании не сообщалось об экономике здравоохранения, связанной с эндоскопическим обнаружением раннего рака желудка у населения Японии в целом. Этот вопрос требует дальнейшего изучения. Однако в Японии эндоскопические обследования относительно недороги, покрываются медицинским страхованием и проводятся в форме популяционного скрининга; в этом смысле получается выгода, сопоставимая со стоимостью. Человеческие ресурсы считаются достаточными, поскольку количество членов JGES составляет 34 258 человек (по состоянию на февраль 2018 г.). Большое количество ранних форм рака желудка было обнаружено с помощью эндоскопии, оплачиваемой медицинским страхованием, которая проводится у пациентов с симптомами для других целей, кроме скрининга на рак желудка. Таким образом, эндоскопия, покрываемая медицинским страхованием, в настоящее время считается приемлемой для ресурсов. Недавно (в 2016 г.) были приняты обследования населения; поэтому в настоящее время оценка рабочей силы не подлежит.
Содержание этого руководства может варьироваться в зависимости от возраста пациента и частоты инфицирования H. pylori .
В данном руководстве прописаны следующие шесть основных пунктов в хронологическом порядке реальной клинической практики: [I] Стратификация риска рака желудка перед эндоскопическим исследованием, [II] Выявление рака желудка на ранней стадии, [III] Качественная диагностика рака желудка на ранней стадии (дифференциальная диагностика рак и не рак), [IV] Диагностика для выбора терапевтической стратегии при раке желудка, [V] Стратификация риска после эндоскопического исследования и [VI] Наблюдение за ранним раком желудка. Основная особенность этого руководства - это предложение алгоритма для эндоскопической практики диагностики раннего рака желудка, основанное на этих утверждениях.
[I] Стратификация риска рака желудка перед эндоскопическим исследованием.
Положение 1-1
Некоторые факторы, такие как инфекция H. pylori , атрофия слизистой оболочки желудка, наследственные заболевания и курение, были названы очевидными факторами риска рака желудка. Другие факторы, о которых сообщается как о возможных факторах риска, включают диету, предпочтения в образе жизни и вирусную инфекцию Эпштейна-Барра (EB).
Оценка модифицированным методом Delphi: не проводилась (базовые знания) Уровень доказательности: C
Комментарий
Известна тесная связь между инфекцией H. pylori и раком желудка; 1 , 2 Таким образом, Международное агентство по изучению рака (IARC) считает H. pylori канцерогеном группы 1. Распространенность инфекции H. pylori составляет более 50% всего населения в регионах Африки, Латинской Америки и Азии, а в Японии - 51,7%. 3 С другой стороны, в Европе, Северной Америке и Океании <50%. Некоторые виды H. pylori содержат патогенный белок CagA; метаанализ продемонстрировал сильную связь CagA с возникновением рака желудка. 4 , 5 Хотя соотношение междуЧастота инфицирования H. pylori и заболеваемость раком желудка различаются у разных рас, 6 причиной этого различия, по-видимому, является различие в типе CagA, которым обладает H. pylori . Распространенность рака желудка значительно выше у людей, инфицированных H. pylori с CagA восточноазиатского типа, чем у людей, инфицированных H. pylori с CagA не восточноазиатского типа. 7 Процент различных типов CagA у H. pylori варьируется среди разных рас в многоэтнических странах, таких как Малайзия 8, и среди разных азиатских стран. 9Эти данные могут объяснить различия в заболеваемости раком желудка у разных рас. Кроме того, наличие или отсутствие вакуолизирующего токсина VacA, который отвечает за вакуолярную дегенерацию эпителия слизистой оболочки желудка, вызванную H. pylori , по сообщениям, связано с возникновением рака желудка. 10 , 11 Подобно CagA, VacA имеет структурный полиморфизм; Комбинация VacA s1 / m1-типа и CagA тесно связана с возникновением рака желудка. 12 , 13
Наличие или отсутствие атрофии слизистой оболочки желудка тесно связано с возникновением рака желудка, подобного инфекции H. pylori . 14 - 16 Сывороточный пепсиноген (PG) используется как индикатор атрофического гастрита. В частности, соотношение PG I / PG II, т. Е. Соотношение PG I, продуцируемого только из области фундальной железы, к PG II, продуцируемому как фундальной, так и пилорической железами, коррелирует со степенью атрофии. 17 Долгосрочное проспективное крупномасштабное когортное исследование 18, систематический обзор 19 и метаанализ 20 показали, что низкие соотношения PG I / PG II (т.е. <3,0) коррелируют с возникновением рака желудка.
Когда рассматриваются другие факторы риска рака желудка, врожденные факторы включают полиморфизм генов, наследственные заболевания, пол и расу. Полиморфизм гена имеет как положительные, так и отрицательные данные, и его связь с раком желудка варьируется в зависимости от расы и гистологического типа, что требует дальнейших исследований. 21 - 24
Наследственные заболевания включают наследственный диффузный рак желудка (HDGC) и рак желудка, связанный с синдромом Линча, семейный аденоматозный полипоз (FAP), синдром Пейтца – Егерса и синдром Ли-Фраумени. 25 HDGC наследуется по аутосомно-доминантному наследованию, вызывая недифференцированный рак желудка. 25 , 26 Мутация CDH1 может наблюдаться в качестве причины. Наличие мутации этого гена приводит к развитию рака желудка в возрасте до 40 лет у большинства носителей. Кроме того, мутация генов репарации ошибочного спаривания ( MLH1 , MSH2 , MSH6 , PMS2) в линии половых клеток присутствует у пациентов с синдромом Линча, и их риск развития рака желудка составляет 6–13%. 27 Привычный аденоматозный полипоз входит в APC-ассоциированный полипоз, возникающий из-за мутации APC , а частота рака желудка у пациентов с FAP в 10 раз выше, чем в общей популяции в Японии и Южной Корее. 28 Риск развития рака желудка, как сообщается, также высок у пациентов с аналогичным заболеванием, аденокарциномой желудка и проксимальным полипозом желудка. 28Риск рака желудочно-кишечного тракта высок у пациентов с синдромом Пейтца-Егерса и синдромом Ли-Фраумени, и этот риск увеличивается в 1,5–3,5 раза при наличии в семейном анамнезе (особенно родственников первой степени родства) рака желудка. 29 - 31 Наличие или отсутствие семейного анамнеза, включая генетическую предрасположенность, считается важным фактором. Что касается пола, заболеваемость раком желудка у женщин выше, чем у мужчин 32, и высказывалась предположение о том, что эстроген у женщин снижает заболеваемость раком желудка. 33 Что касается расы, хотя рак желудка чаще встречается в Азии, особенно в Восточной Азии, 6проспективное когортное исследование Малайзия, многонациональная страна, показало, что рак желудка чаще встречается у жителей китайского происхождения, чем у жителей Индии, несмотря на высокий уровень инфекции H. pylori во всех этнических группах, что указывает на то, что заболеваемость желудком рак варьируется у разных рас даже в одном и том же географическом районе. 34
Факторы, указанные в качестве приобретенных факторов риска рака желудка, включают диету, предпочтения в образе жизни, болезни, лекарства, род занятий, физические упражнения и инфекцию H. pylori . Хотя время от времени сообщалось, что употребление фруктов и овощей снижает риск, 35 , 36 некоторые исследователи сообщают о вариациях такого эффекта в зависимости от типа фруктов или овощей, 37 - 39, в то время как другие сообщают об отрицательных результатах. 40 Таким образом, необходимы дальнейшие исследования. Связь между потреблением рыбы и риском рака желудка неясна, 41 в то время как возможность того, что потребление обработанного красного мяса увеличивает риск рака желудка, была высказана.42 Влияние потреблениявысоким содержанием жиров молочных продуктов является спорным; одни взгляды утверждают, что они увеличивают риск рака желудка, тогда как другие не признают такой корреляции. 35 , 43 Другой метаанализ показал, что потребление жиров может увеличить риск рака желудка. Однако в результатах анализа подгруппы также были несоответствия. В частности, насыщенные жирные кислоты увеличивали риск, полиненасыщенные жирные кислоты и растительные жиры снижали риск, а мононенасыщенные жирные кислоты и животные жиры не были связаны с риском. 44 Кроме того, метаанализ, касающийся приема пищи, консервированной с солью, и риска рака желудка показал, что риск рака желудка увеличился на 50%. 45В проспективном когортном исследовании, в котором изучалось потребление соли, была выявлена связь между потреблением соли и повышенным риском рака желудка, особенно у пациентов с атрофическим гастритом, сопровождающимся инфекцией H. pylori . 46 Что касается роли витамина С, то возможность того, что он способствует снижению риска рака желудка, была предложена в крупномасштабном международном многоцентровом исследовании 47, но разногласия по-прежнему остаются. 48 - 50 Что касается взаимосвязи между индексом массы тела (ИМТ) и раком желудка, метаанализ показал, что увеличение ИМТ было связано с повышенным риском рака желудка. 51С другой стороны, другой метаанализ обнаружил связь с раком сердца желудка, но не с раком вне сердца. 52 В отличие от сильной ассоциации между ИМТ и пищевода или желудка сердца рака, 53 этот вопрос остается спорным. Систематический обзор населения Японии и другой метаанализ не показали никакой связи между употреблением алкоголя и риском рака желудка, и в этом вопросе считается необходимым запланированное исследование с использованием стандартизированного метода. 54 , 55 Хотя некоторые исследователи отрицательно относятся к взаимосвязи между курением и повышенным риском рака желудка, 56 другие придерживаются положительной точки зрения, 57 , 58и IARC называет курение канцерогеном с достаточными доказательствами. Три метаанализа потребления кофе и риска рака желудка показали противоречивые результаты: один предположил, что потребление кофе связано со снижением риска рака желудка, 59 другой не показал корреляции, 60 и оставшийся не показал. корреляция, но предполагала участие в повышенном риске рака сердца желудка. 61 Аналогичные результаты были получены при употреблении зеленого чая. Систематический обзор показал возможность употребления зеленого чая снизить риск рака желудка у японских женщин 62, тогда как другие метаанализы не показали корреляции. 63 , 64Исследование случай-контроль, в ходе которого изучались образ жизни пациентов с раком желудка, а также субъекты, соответствующие возрасту, расе и полу, было обнаружено, что повышенный риск рака желудка был связан с продолжительностью времени до обеда менее 3 часов и отсутствием ходьбы. после еды, увеличиваются ожидания дальнейшего исследования. 65 Что касается взаимосвязи между раком желудка и другими заболеваниями, сахарный диабетом , как сообщается, тесно связан с повышенным риском рака желудка, 66 - 69 , хотя систематический обзор не показал такую ассоциации у мужчин. 66 Среди пероральных препаратов - нестероидные противовоспалительные препараты, 70 , 71особенно аспирин, как сообщается, снижает риск рака желудка. Однако доза не соответствовала различным исследованиям, что потребовало дальнейшего изучения. 72 , 73 Снижение риска рака желудка при применении статиновых препаратов также было подтверждено метаанализом, но необходимы дальнейшие исследования по этому вопросу, поскольку многие из них остаются неясными, например, с точки зрения различий, связанных с типом лекарственного средства и долгосрочным прогнозом. . 74 Кроме того, метаанализ показал, что профессиональное воздействие асбеста увеличивает риск рака желудка, 75 и IARC относит асбест к канцерогену группы 1, хотя доказательства ограничены. Вирус EB обнаружен примерно в 10% тканей рака желудка, 76 ,77 и его корреляция с риском рака желудка. 78 , 79 Однако, хотя сильная ассоциация была обнаружена с помощьюанализа гибридизации in situ, результаты одного только анализа полимеразной цепной реакции были неубедительными. 78 Более чем у 90% взрослых есть латентная вирусная инфекция EB, 77 и существует разница в фактических показателях положительности у пациентов с раком желудка. Таким образом, вирус EB считается канцерогеном при ограниченных доказательствах МАИР; все еще есть основания для аргументов в пользу его веса как фактора риска.
Таким образом, как описано выше, на риск рака желудка влияют различные факторы. Однако эти факторы связаны сложным образом, 40 , 43 , 51 , 80, и на сегодняшний день не удалось достичь определенного консенсуса, за исключением тесно связанных факторов, таких как инфекция H. pylori , атрофия слизистой оболочки желудка, генетическая предрасположенность и курение. Читателям рекомендуется обращаться к веб-сайтам МАИР и Национального онкологического центра, которые также предоставляют информацию о факторах риска рака желудка. 81 , 82
В базах данных Cochrane и PubMed был проведен поиск с использованием термина рак желудка в сочетании с другими ключевыми словами, такими как фактор риска, атрофия, курение, питье, алкоголь, соль, консервы, овощи, фрукты, CagA, гастрин 17, пол, возраст, семейный анамнез. , (анамнез, рак желудка), (анамнез, аденома желудка), (анамнез, рак пищевода), антитела к H. pylori , ( H. pyloriантитела, стратификация риска), сывороточный пепсиноген и (сывороточный пепсиноген, стратификация риска). В результате поиск дал 546 статей, включая 34 систематических обзора и 76 метаанализов (частично совпадающие). За исключением частично совпадающих, были процитированы девять систематических обзоров, 30 метаанализов и другие статьи, связанные с факторами риска рака желудка. Во время обсуждения в руководящем комитете из PubMed было извлечено 70 статей (частично совпадающих) с использованием термина «рак желудка» в сочетании с вирусом EB, систематического и метаанализа. За исключением перекрытия, были процитированы два систематических обзора, связанных с факторами риска рака желудка. Также была добавлена еще 21 статья, полученная из цитируемых ссылок в литературе и путем ручного поиска в PubMed.
Положение 1-2.
Риск рака желудка можно стратифицировать перед эндоскопическим обследованием. От такой стратификации рисков можно ожидать положительного экономического эффекта. Однако вопросы об оптимальном методе остаются.
Оценка модифицированным методом Delphi: не проводилась (базовые знания) Уровень доказательности: C
Комментарий
Вложенное исследование случай-контроль со стратификацией риска рака желудка с использованием сывороточного уровня PG и сывороточного титра антител к H. pylori было проведено в Японии 1, а крупномасштабное когортное исследование было выполнено со стратификацией риска с использованием сывороточного титра антител к H. pylori. , которое было многонациональным исследованием, включая Японию. 2 Возможность стратификации риска рака желудка с использованием сывороточного уровня PG и сывороточного титра антител к H. pylori была предложена метаанализом четырех когортных исследований, но конкретный метод стратификации риска остается неясным, поскольку существуют проблемы с группировкой. интерпретация и различие в методе измерения. 3В отчетах из Сингапура документально подтвержден значительный эффект снижения затрат от эндоскопического наблюдения в группах высокого и низкого риска пациентов с раком желудка. 4 , 5 Однако этот результат нельзя напрямую экстраполировать на стратификацию риска перед эндоскопическим обследованием в Японии из-за различий между Сингапуром и Японией в отношении распространенности рака желудка и частоты инфицирования H. pylori среди населения.
Для этого литературного поиска были процитированы пять статей, взятых из соответствующей литературы для утверждения 1-1 и извлеченных с помощью ручного поиска.
Положение 1-3.
Комбинация сывороточного антитела H. pylori и сывороточного пепсиногена может быть полезна для стратификации риска рака желудка. Однако ложноотрицательные результаты могут быть получены в случаях тяжелой атрофии и перенесенной инфекции. Кроме того, были исследованы пороговое значение и метод измерения титров антител к H. pylori , интерпретация уровня PG и пороговое значение отношения PG I / PG II.
Оценка модифицированным методом Дельфи: Медиана - 9; Минимум 7; Максимум, 9 Сила рекомендации: 2 Уровень доказательности: C
Комментарий
Учитывая доказательства, представленные в утверждениях 1-1 и 1-2, вполне вероятно, что определение статуса инфекции H. pylori и измерение сывороточного PG полезны для стратификации риска рака желудка. Для определения статуса инфекции H. pylori можно использовать метод посева, микроскопическое исследование и дыхательный тест на мочевину . Измерение титров антител к H. pylori в сыворотке просто и доказано, что полезно для стратификации риска рака желудка. 1 Уровень PG в сыворотке также доказал свою полезность для скрининга риска рака желудка 2 и так называемого скрининга ABC, с помощью которого субъекты делятся на четыре группы в соответствии с измерением уровня H. pylori в сыворотке.титр антител и уровень PG в сыворотке поддерживаются. 3 Используя этот метод скрининга, комбинация PG I и соотношения PG I / PG II, а также титр сывороточных антител H. pylori (Hp) используется для различения групп A [Hp (-)],), PG (- )], B [Hp (+), PG (-)],)], C [Hp (+), PG (+)] и D [Hp (-)],), PG (+)] для расслоения риск рака желудка. Предполагалось, что группа A никогда не была инфицирована H. pylori . Группы B, C и D были инфицированы H. pylori . Предполагалось, что группа B имеет легкую атрофию желудка, а группа C - тяжелую атрофию желудка. Предполагалось, что группа D имеет наиболее тяжелую атрофию желудка, а сыворотка H. pyloriантитела стали отрицательными из-за тяжелой атрофии или эрадикации. Полезность этого метода была доказана проспективным когортным исследованием, в котором риск развития рака желудка был в 6,0 раз выше в группе C и в 8,2 раза выше в группе D, чем в группе A. 3 Однако существует мнение, что риск развития рака желудка стратификация в популяции с высоким уровнем инфицирования H. pylori бесполезна. 4 Существуют также другие проблемы, такие как следующие: группа A включает случаи с предшествующей или текущей инфекцией H. pylori 5, в то время как систематический обзор показал, что разделение субъектов на три группы, то есть группы A, B и C + D, а не четыре, было бы более уместно. 6В этом контексте были исследованы пороговое значение и метод измерения титров антител к H. pylori , интерпретация уровня PG и пороговое значение соотношения PG I / PG II. 7 - 9
Среди факторов, указанных в утверждении 1-1, можно определить генетическую предрасположенность путем скрининга семейного анамнеза во всех случаях, кроме индексного. Следовательно, сбор семейного анамнеза может быть полезным для стратификации риска.
Для этого поиска литературы были использованы одна статья, полученная для утверждения 1-1, и восемь других статей, включающих соответствующие статьи, ссылки, процитированные для утверждения 1-2, и статьи, полученные с помощью ручного поиска.
[II] Выявление раннего рака желудка
Положение 2-1.
Использование спазмолитиков следует рассматривать в случаях, когда наблюдение затруднено из-за интенсивной перистальтики.
Оценка модифицированным методом Дельфи: Медиана, 8; Минимум 6; Максимум, 9 Сила рекомендации: Нет Уровень доказательности: D
Комментарий
Желудок выполняет активную перистальтику, особенно в антральном отделе, что может мешать эндоскопическому наблюдению. Следовательно, спазмолитики могут использоваться в качестве премедикации перед эндоскопическими исследованиями верхних отделов желудочно-кишечного тракта. 1 Спазмолитики включают инъекционные препараты (бутилскополамина бромид, 10–20 мг внутримышечно или внутривенно; глюкагон, 1 мг внутривенно) 2 и местные спреи (масло перечной мяты и его основной компонент, l-ментол, 20 мл 0,8% прямого распыления). 2 , 3 Hiki et al . показали ингибирующее действие l-ментола на перистальтику желудка в рандомизированном контролируемом исследовании. 3
Бутилскополамин бромид противопоказан пациентам с глаукомой, гиперплазией предстательной железы, серьезными сердечными заболеваниями и паралитической кишечной непроходимостью. Побочные реакции на бутилскополамин бромид включают сердцебиение, дизурию, жажду и нарушение зрительной аккомодации; поэтому применять этот препарат у пожилых людей затруднительно. 4 Глюкагон противопоказан пациентам с феохромоцитомой и неконтролируемым диабетом. Необходимо обратить внимание на возможную отсроченную гипогликемическую атаку как побочную реакцию. Глюкагон в меньшей степени влияет на сердечно-сосудистую систему, чем бромид бутилскополамина. 5 Масло перечной мяты и l-ментол не вызывают побочных реакций; таким образом, их можно использовать с относительной безопасностью. 2 , 3
Подавление перистальтики облегчает эндоскопические наблюдения, но ни одно исследование не показало, что спазмолитики способствуют раннему выявлению рака желудка. Однако, поскольку предполагается, что обеспечение лучшего поля зрения увеличивает частоту выявления раннего рака желудка, следует рассмотреть возможность использования спазмолитиков в случаях интенсивных перистальтических движений, затрудняющих наблюдение. Самая высокая стоимость препарата связана с глюкагоном, за ним следуют продукты с 1 ментолом и бромид бутилскополамина.
На совещании группы разработчиков рекомендаций по принятию решения использование спазмолитиков было слабо рекомендовано в тех случаях, когда наблюдение ограничено интенсивными перистальтическими движениями, а не силой рекомендации, которая не указывается.
Для этого поиска литературы использовались базы данных PubMed и Igaku Chuo Zasshi. Для PubMed была использована следующая формула поиска: (гастроскопия ИЛИ эзофагогастродуоденоскопия) И (противодиарейные ИЛИ антиперистальтические ИЛИ «холинергические антагонисты» ИЛИ «скополамина гидробромид» ИЛИ «скополамин бутилбромид» ИЛИ глюкагон ИЛИ мята перечная) Фильтры: Человек; Английский; Японский. Всего было извлечено 288 статей. Формула поиска, использованная для Igaku Chuo Zasshi, была следующей: ((((/ TH или 蠕動 運動 / AL) или (薄荷 / TH или ハ ッ カ / AL) или холинергический / AL и антагонисты / AL или («Скополамин гидробромид» / TH или скополамин / AL) или (глюкагон / TH или глюкагон / AL))) и ((内 視 鏡 / TH или 内 視 鏡 / AL) или 上部 消化管 内 視 鏡 検 査 / AL)) и (PT = 会議 録 除 く) , что на английском языке означает: ((((перистальтика / TH или перистальтическое движение / AL) или (мята перечная в кандзи / TH или мята в катакане/ AL) или холинергические / AL и антагонисты / AL или («Скополамин гидробромид» / TH или скополамин / AL) или (Глюкагон / TH или глюкагон / AL)) и ((эндоскопия / TH или эндоскопия / AL) или верхний отдел желудочно-кишечного тракта эндоскопическое исследование / AL)) и (PT = без учета материалов конференции). Всего было извлечено 153 статьи. Эти статьи были сужены до статей, относящихся к этому заявлению; были добавлены некоторые другие статьи, полученные в ручном поиске.
Положение 2-2.
Настоятельно рекомендуется использование муколитиков и пеногасителей, поскольку улучшенная видимость слизистой оболочки приводит к раннему обнаружению рака желудка.
Оценка модифицированным методом Дельфи: Медиана, 8; Минимум 7; Максимум, 9 Сила рекомендации: 1 Уровень доказательности: D
Комментарий
Пена и слизь, прикрепленные к поверхности слизистой оболочки, мешают эндоскопическому наблюдению и могут привести к упущению из виду мельчайших находок на слизистой оболочке. Поэтому муколитики и пеногасители часто используются в качестве препаратов для улучшения видимости слизистой оболочки. 1 Доступные муколитические агенты - проназа и N- ацетилцистеин. Проназа одобрена в качестве муколитического агента для растворения и удаления желудочной слизи при гастроскопии в Японии. Несколько рандомизированных контролируемых исследований показали улучшение видимости слизистой оболочки после введения проназы. 2 - 4 Этого агент , как сообщается , полезен для хромоэндоскопии и увеличительных изображений узкополосных (ЦКП) эндоскопии. 5 , 6
Диметикон используется для пеногашения. Рандомизированное контролируемое исследование, в котором сравнивали диметикон и плацебо, показало, что количество пены в желудке было значительно меньше после введения диметикона, а эффект пеногашения был особенно сильным у пациентов с остаточным желудком. 7 Администрации диметикон сообщениям сокращает время экспертизы 8 и улучшает эндоскопист удовлетворения. 9
Мета-анализ показал, что введение одного диметикона привело к лучшему улучшению эндоскопической видимости, чем применение только проназы или N- ацетилцистеина. Комбинированное использование диметикона с проназой или N- ацетилцистеином дало ограниченное улучшение эндоскопической видимости. 10
Ни одно исследование не показало, что муколитики или пеногасители способствуют раннему выявлению рака желудка. Однако в Японии настоятельно рекомендуется использование муколитиков и пеногасителей, поскольку предполагается, что улучшение видимости слизистой оболочки приводит к раннему обнаружению рака желудка. Диметикон и проназа являются легко используемыми лекарствами, поскольку они недорогие и вызывают низкую частоту побочных реакций. Однако проназа может привести к кровотечению из пораженного участка вместе с удалением слизи; поэтому он требует осторожного применения у пациентов с подозрением на внутрижелудочное кровотечение.
В Японии формула представляет собой 100 мл воды с 20 000 ед. Проназы (Kaken Pharmaceutical, Токио, Япония), 1 г бикарбоната натрия и 10 мл диметилполисилоксана (20 мг / мл; Horii Pharmaceutical, Осака, Япония). Однако, поскольку проназа недоступна во всем мире, альтернативной смесью является смесь 100 мл воды с 2 мл ацетилцистеина (200 мг / мл Parvolex; Celltech, Berkshire, UK или Mucomyst; Bristol-Myers Squibb, New York, NY, USA) и 0,5 мл (40 мг / мл) активированного диметикона (Infacol; Forest Laboratories, Дартфорд, Великобритания). 1 , 11
Группа по разработке рекомендаций определила, что следует настоятельно рекомендовать использование муколитических и пеногасителей из-за убедительных доказательств улучшения видимости слизистой оболочки, а также из-за того, что эти агенты недороги и легко доступны с минимальными побочными реакциями и низкой нагрузкой на пациентов, несмотря на отсутствие доказательств того, что они напрямую способствуют выявлению раннего рака желудка.
Был произведен поиск в базах данных PubMed и Igaku Chuo Zasshi. Поиск PubMed производился с использованием следующей формулы поиска: ((гастроскопия ИЛИ эзофагогастродуоденоскопия) И (отхаркивающие средства [pa] ИЛИ проназа ИЛИ «пеногасители» ИЛИ пеногаситель ИЛИ симетикон ИЛИ октоксинол)) Фильтры: люди; Английский; Японский. В результате было извлечено 93 статьи. Формула поиска, использованная для поиска Игаку Чуо Дзасси, была: (((内 視 鏡 / TH или 内 視 鏡 / AL) или 上部 消化管 内 視 鏡 検 査 / AL) и ((粘液 溶解 / AL или (去痰 剤 / TH или 去痰 剤 / AL) или (Pronase / TH или pronase / AL) или (Pronase / TH или プ ロ ナ ー ゼ / AL) или (消泡 剤 / TH или 消泡 剤 / AL))) и (PT = 会議 録 除 く) , что означает на английском языке: (((endoscopy / TH или endoscopy / AL) или эндоскопическое исследование верхних отделов желудочно-кишечного тракта / AL) и ((mucolysis / AL или (отхаркивающее / TH или отхаркивающее / AL) или (Pronase / TH или проназа / AL) или (Pronase / TH или пронаса в катакане/ AL) или (пеногаситель / TH или пеногаситель / AL))) и (PT = за исключением заседаний Конгресса). В итоге было найдено 130 статей. Эти статьи были сужены до статей, относящихся к этому заявлению; были добавлены некоторые другие статьи, полученные с помощью ручного поиска.
Положение 2-3.
Седативные средства и анальгетики можно использовать с осторожностью из-за возможных побочных реакций у пациентов с сильным беспокойством или у тех, у кого наблюдение затруднено из-за рефлексов или движений тела.
Оценка модифицированным методом Дельфи: Медиана, 8; Минимум 7; Максимум: 9 Сила рекомендации: Нет Уровень доказательности: D
Комментарий
Седативные средства уменьшают беспокойство и дискомфорт пациента, а анальгетики уменьшают боль без потери сознания. Седативные средства и анальгетики улучшают переносимость пациентами, а удовлетворенность эндоскопическими исследованиями увеличивают частоту запросов на повторное обследование. 1 - 5 Кроме того, для эндоскопистов эти препараты также полезны для улучшения качества эндоскопического обследования и удовлетворения эндоскопистов. 1 - 5Побочные реакции на седативные и анальгетические средства включают угнетение дыхания, угнетение кровообращения, брадикардию, аритмию, антероградную амнезию, растормаживание и икоту. Поскольку также сообщалось о серьезных несчастных случаях, включая смерть, важно обеспечить адекватное распределение персонала и условия практики, чтобы можно было контролировать использование седативных и анальгетических средств. Также необходимо продолжать наблюдение после эндоскопии, пока пациент не проснется. 1
На сегодняшний день ни одно исследование не показало, что седативные и анальгетические средства могут способствовать раннему выявлению рака желудка. Однако седативные и анальгетические средства могут использоваться у пациентов, которые испытывают сильное беспокойство или у которых боль или движения тела мешают наблюдению. При использовании седативных или анальгетических средств в учреждении должны быть предусмотрены меры противодействия вышеупомянутым побочным реакциям и случайным явлениям.
Группа по разработке рекомендаций первоначально опубликовала следующее заявление: «Использование седативных или анальгетических средств следует рассматривать с осторожностью в отношении побочных реакций у субъектов с сильным беспокойством или тех, наблюдение за которыми затруднено из-за рефлексов или движения тела». Однако голосование по модифицированному методу Delphi дало среднее значение 7 (диапазон 7–9); поэтому было проведено другое обсуждение. Следовательно, выражение «использование… следует рассматривать» было изменено на «может быть использовано», поскольку существуют ограничения в распределении персонала и условиях практики, которые позволяют использовать седативные и анальгетические средства по всей Японии, а также потому, что разработка эндоскопических инструментов, включая тонкие эндоскопы и достижения в области эндоскопических методов позволят сократить использование седативных и анальгетических средств.
Поскольку концепции и медицинские обстоятельства, касающиеся седации, различаются в зависимости от страны, района и общества, следует использовать соответствующие рекомендации (например, рекомендацию 1 JGES ) для использования седативных и анальгетических средств до эндоскопических исследований верхних отделов желудочно-кишечного тракта.
Между тем, для применения седативных и анальгетических средств перед эндоскопическими исследованиями верхних отделов желудочно-кишечного тракта следует обращаться к соответствующему руководству JGES. 1
Был произведен поиск в базах данных PubMed и Igaku Chuo Zasshi. Из PubMed было извлечено 42 статьи с использованием следующей формулы поиска: («новообразования желудка» И снотворные и седативные средства [фармакологическое действие]) Фильтры: люди; Английский; Японский. Еще 12 статей были извлечены с использованием следующей формулы: «новообразования желудка / диагноз» И анальгетики [Фармакологическое действие] Фильтры: люди; Английский; Японский. В случае с Игаку Чуо Засши 72 статьи были извлечены с использованием формулы: (((胃 腫 瘍 / TH или 胃 腫 瘍 / AL)) и ((催眠 剤 と 鎮静 剤 / TH или 催眠 剤 と 鎮静 剤 / AL)) ) и (PT = 会議 録 除 く), что означает на английском языке: (((опухоль желудка / TH или опухоль желудка / AL)) и ((седативное и обезболивающее / TH или седативное и обезболивающее / AL))) и (PT = исключая съезда). Еще 64 статьи были получены с использованием формулы: ((((胃 腫 瘍 / TH или 胃 腫 瘍 / AL)) и (((SH = 診断 的 的, 診断, 画像 診断, X 線 診断, 放射性 核 種 診断, 超音波 診断) или (診断 / TI)))) и ((鎮痛 剤 / TH или 鎮痛 剤 / AL))) и (PT = 会議 録 除 く), что на английском языке означает: ((((опухоль желудка / TH или опухоль желудка / AL)) и (((SH = диагностическое использование, диагностика, диагностическая визуализация, диагностическая радиография, диагностическая радионуклидная визуализация, диагностическое ультразвуковое исследование) или (диагностика / TI)))) и ((седативное средство / TH или анальгетик / AL) )) и (PT = за исключением заседаний конгресса). Ручной поиск в литературе не дал результатов исследования, посвященного влиянию седативных или анальгетических средств на раннее выявление рака желудка. диагностическое ультразвуковое исследование) или (диагностика / TI)))) и ((седативное средство / TH или обезболивающее / AL))) и (PT = за исключением материалов конгресса). Ручной поиск в литературе не дал результатов исследования, посвященного влиянию седативных или анальгетических средств на раннее выявление рака желудка. диагностическое ультразвуковое исследование) или (диагностика / TI)))) и ((седативное средство / TH или обезболивающее / AL))) и (PT = за исключением материалов конгресса). Ручной поиск в литературе не дал результатов исследования, посвященного влиянию седативных или анальгетических средств на раннее выявление рака желудка.
Положение 2-4.
Продолжительность наблюдения за желудком связана с обнаружением раннего рака желудка. Наблюдать за желудком нужно достаточно времени.
Оценка модифицированным методом Дельфи: Медиана, 8; Минимум 7; Максимум, 9 Сила рекомендации: 1 Уровень доказательности: D
Комментарий
На сегодняшний день опубликовано три исследования продолжительности эндоскопического обследования верхних отделов желудочно-кишечного тракта и выявления рака желудка на ранних стадиях. Teh et al . 1 сообщил, что в 837 случаях эндоскопического обследования эндоскописты, у которых от вставки эндоскопа до извлечения использовалось в среднем <7 минут, не выявляли ранний рак желудка, тогда как те, кто проводил в среднем 7 минут или более, обнаружили четыре (0,9%) очага поражения ранний рак желудка. Кавамура и др . 2 проанализировали 15 763 эндоскопических обследования и обнаружили, что частота выявления раннего рака желудка, как правило, была ниже среди эндоскопистов, которые взяли среднюю продолжительность обследования (от введения эндоскопа до удаления) <5 минут (0,2%), чем среди тех, кто взял среднее продолжительность 5 мин и более (0,4%). Частьи др . 3 классифицировали 111962 случая эндоскопического обследования на две группы в зависимости от того, составляла ли средняя чистая продолжительность наблюдения в желудке, исключая время введения в двенадцатиперстную кишку и очистки просвета, 3 минуты или меньше (группа быстрого эндоскописта) или более 3 минут. (группа медленных эндоскопистов). Частота выявления раннего рака желудка составила 0,06% в группе быстрого эндоскописта и 0,09% в группе медленного эндоскописта, что показывает значительно более высокий уровень выявления в группе медленного эндоскописта ( P = 0,0455). Средняя продолжительность обследования и наблюдения в этих трех исследованиях была рассчитана на основе данных у субъектов, которым не проводилась биопсия.
Таким образом, предполагается, что ложноотрицательные случаи часто встречаются среди эндоскопистов, которым требуется короткое время для обследования. Однако не было сделано однозначных выводов относительно точного времени, необходимого для наблюдения за отдельными субъектами.
Был произведен поиск в базах данных PubMed и Igaku Chuo Zasshi. При поиске в PubMed использовалась следующая формула: «новообразования желудка / диагноз» И («время обследования» [tiab] ИЛИ «время наблюдения» [tiab] ИЛИ «временные факторы») И (эндоскопия ИЛИ эндоскопия). В конечном итоге было извлечено 194 статьи. При поиске Игаку Чуо Дзасси использовалась следующая формула: ((((胃 腫 瘍 / TH или 胃 腫 瘍 / AL)) и (((SH = 診断 的 利用, 診断, 画像 診断, X 線 診断, 放射性 核 種 診断) , 超音波 診断) или (診断 / TI)))) и (((観 察 / TH или 観 察 / AL) или 経 過 観 察 / AL) и ((時間 / TH или 時間 / AL) или (時間 因子 / TH или時間 因子 / AL)))) и (PT = 会議 録 除 く), что означает на английском языке: ((((опухоль желудка / TH или опухоль желудка / AL)) и (((SH = диагностическое использование, диагностика, диагностическая визуализация, диагностическая рентгенография, диагностическая радионуклидная визуализация, диагностическое ультразвуковое исследование) или (диагностика / TI)))) и (((наблюдение / TH или наблюдение / AL) или последующее наблюдение / AL) и ((время / TH или время / AL) или (фактор времени / TH или фактор времени / AL)))) и (PT = исключая материалы конгресса). В итоге было извлечено 68 статей. Эти статьи были сужены до статей, относящихся к этому заявлению; были добавлены некоторые другие статьи, полученные с помощью ручного поиска.
Положение 2-5.
Необходимо систематически обследовать внутреннюю часть желудка для выявления раннего рака желудка.
Оценка модифицированным методом Дельфи: Медиана - 9; Минимум 7; Максимум: 9 Сила рекомендации: 1 Уровень доказательности: D
Комментарий
Hosokawa et al . определили ложноотрицательный случай как рак желудка, зарегистрированный в течение 3 лет после эндоскопического обследования, при котором рак не был обнаружен, и сообщили о частоте 25,8%. Кроме того, частота ложноотрицательных результатов среди эндоскопистов со стажем эндоскопии менее 10 лет составила 32,4%, тогда как соответствующая частота составила 19,5% среди тех, кто имел стаж 10 и более лет. Таким образом, у менее опытных эндоскопистов частота ложноотрицательных результатов была значительно выше. 1 Метаанализ, включая зарубежные исследования, показал 11,3% ложноотрицательных результатов на основе того же определения. 2 Таким образом, ложноотрицательные случаи составляют значительную часть эндоскопических исследований.
Причина упускать из виду рак желудка - недостаточное наблюдение за внутренней частью желудка. Поскольку желудок имеет широкий изогнутый просвет, даже при тщательном наблюдении остаются слепые зоны, что позволяет не заметить рак желудка. В частности, наблюдение, вероятно, будет затруднено в передней и задней стенках тела желудка в тангенциальном направлении и в области от угла до задней стенки антрального отдела желудка, что едва обеспечивает достаточное поле зрения из-за близости. Кроме того, меньшая кривизна кардии находится в тангенциальном направлении на антеградном обзоре и позади эндоскопа на ретрофлексном просмотре, что приводит к плохому наблюдению. 3При расширении следует наблюдать большую кривизну тела желудка, поскольку поражения могут оставаться скрытыми за складками при низком вдыхании воздуха.
Ни одно исследование не изучало метод эндоскопического наблюдения желудка и выявления рака желудка на ранних стадиях. Хотя в настоящее время методы наблюдения различаются в зависимости от учреждений и операторов, необходимо проводить тщательное и систематическое наблюдение за внутренней частью желудка, чтобы предотвратить возникновение ложноотрицательных случаев раннего рака желудка. Яо выступает за протокол систематического обследования желудка. 4 Также сообщалось, что обучение операторов повышает вероятность выявления рака желудка. 5 , 6 Следовательно, эндоскопистов необходимо пройти достаточное обучение.
Был произведен поиск в базах данных PubMed и Igaku Chuo Zasshi. Всего 176 статей было извлечено из PubMed с использованием следующей формулы поиска: «новообразования желудка / диагноз» [majr] И («слизистая оболочка желудка / патология» ИЛИ наблюдение * [tiab]) И (эндоскопия ИЛИ эндоскопия) И методы [sh] Фильтры: Люди; Английский; Японский. При поиске Игаку Чуо Дзасси использовалась следующая формула: ((((胃 腫 瘍 / TH или 胃 腫 瘍 / AL)) и (((SH = 診断 的 利用, 診断, 画像 診断, X 線 診断, 放射性 核 種 診断) , 超音波 診断) или (診断 / TI)))) и ((観 察 / TH или 観 察 / AL)) и ((内 視 鏡 / TH или 内 視 鏡 / AL)) и (((胃粘膜 / TH или 胃粘膜 / AL)) и (SH = 病理学))) и (PT = 会議 録 除 く), что на английском языке означает: ((((опухоль желудка / TH или опухоль желудка / AL)) и (((SH = диагностическое использование, диагностика, диагностическая визуализация, диагностическая радиография, диагностическая радионуклидная визуализация, диагностический ультразвук) или (диагностика / TI)))) и ((наблюдение / TH или наблюдение / AL)) и ((эндоскопия / TH или эндоскопия / AL)) и (((слизистая оболочка желудка / TH или слизистая оболочка желудка / AL) ) и (SH = патология))) и (PT = исключая материалы конгресса). В конечном итоге было извлечено 58 статей. Эти статьи были сужены до статей, относящихся к этому заявлению; были добавлены некоторые другие статьи, полученные с помощью ручного поиска.
Положение 2-6.
Обсуждается полезность эндоскопии с улучшенными изображениями для обнаружения рака желудка на ранних стадиях.
Оценка модифицированным методом Дельфи: Медиана, 8; Минимум 6; Максимум, 9 Сила рекомендации: Нет Уровень доказательности: D
Комментарий
Эндоскопическая визуализация в общих чертах подразделяется на: (i) обычное (белый свет), (ii) улучшенное изображение, (iii) увеличительное, (iv) микроскопическое и (v) томографическое. Эндоскопия с улучшенным изображением подразделяется на цифровые, оптико-цифровые и хромоэндоскопические методы в соответствии с методом улучшения изображения (рис. 1 ). 1 - 3
фигура 1
Классификация эндоскопических методов (адаптировано из [ 3 ]).
В хромоэндоскопии индигокармин используется для усиления контраста для эндоскопической диагностики раннего рака желудка. Индигокармин остается в углублениях на поверхности слизистой оболочки, тем самым улучшая мелкие углубления и выпуклости слизистой оболочки и улучшая видимость поражения. 4 Однако ни одно рандомизированное контролируемое исследование не показало полезность индигокармина для выявления рака желудка на ранних стадиях.
Цифровой метод включает улучшение изображения путем обработки сигнала и использования алгоритма обработки изображения. К этой категории относится система гибкого улучшения цвета спектрального изображения (FICE), i-scan. В системе FICE изображение на свободно выбранной длине волны получается из обычного изображения посредством компьютерной обработки. В некоторых исследованиях с использованием ультратонкой эндоскопии с FICE сообщалось о полезности раннего выявления рака желудка; 5 , 6, однако, ни одно рандомизированное контролируемое исследование не показало полезность FICE для выявления рака желудка на ранних стадиях. I-scan имеет три настраиваемых режима улучшения изображения: улучшение поверхности (SE), улучшение контраста (CE) и улучшение тона (TE). 7SE увеличивает контрастность светлого и темного, а CE в цифровом виде добавляет синий цвет к относительно темным областям, получая данные интенсивности яркости для каждого пикселя. TE анализирует отдельные красные, зеленые и синие компоненты нормального изображения и рекомбинирует цветовые частоты каждого компонента для улучшения мельчайших структур слизистой оболочки с тонкими изменениями цвета. Эффективность i-Scan над визуализацией в белом свете для выявления рака желудка не была продемонстрирована. 8
Метод узкополосного света использует излучающий свет с длинами волн, ограниченными определенной полосой. Он основан на том принципе, что глубина проникновения света зависит от длины волны. Этот метод включает узкополосную визуализацию (NBI), синюю лазерную визуализацию (BLI), связанную цветную визуализацию (LCI) и оптическое улучшение i-scan (OE). Система NBI включает фильтр NBI с узкой полосой пропускания (415 ± 30 нм, 540 ± 30 нм) в системе видеоэндоскопии. Эти две длины волны хорошо поглощаются гемоглобином, микрососудистая архитектура поверхности слизистой оболочки может быть легко визуализирована. 9Зарубежное многоцентровое рандомизированное контролируемое исследование, в котором изучали NBI без увеличения по сравнению с обычной эндоскопией в белом свете, показало, что частота выявления кишечной метаплазии была значительно выше для NBI без увеличения, но не было значительной разницы в выявлении рака желудка. 10 Аналогичное многоцентровое рандомизированное контролируемое исследование сейчас проводится в Японии (UMIN000014503). Система BLI включает в себя источник света, состоящий из двух типов лазеров с длинами волн 410 и 450 нм, и флуоресцентный свет, который полезен для получения информации о поверхности слизистой оболочки, такой как образцы поверхности кровеносных сосудов и структур. Комбинация двух лазеров и флуоресцентного света обеспечивает BLI, более яркий BLI (BLI-bright) и связанную цветовую визуализацию (LCI). 11 ,12 LCI - это технология улучшения цвета, которая обеспечивает небольшие различия в цвете слизистой оболочки, которые легко распознать с достаточной яркостью по сравнению с BLI. Рандомизированные контролируемые испытания по выявлению раннего рака желудка с использованием BLI и LCI также продолжаются (UMIN 000011324, UMIN000023863). У i-scan OE есть два режима: OE Mode 1 (OE1) и OE Mode 2 (OE2). В режиме OE1 используется световое излучение с длиной волны 415 и 540 нм, которые подходят для визуализации кровеносных сосудов на поверхности слизистой оболочки и в подслизистой оболочке соответственно. С другой стороны, режим OE Mode 2 (OE2) использует излучение красного света, а также излучение на 415 и 540 нм для увеличения общей яркости изображения. 13 OE1 имел значительное преимущество перед режимом белого света в демаркации раннего рака желудка; 14однако нет никаких доказательств обнаружения раннего рака желудка с помощью OE1. Частота выявления раннего рака желудка не имела существенной разницы между режимом OE2 и режимом белого света. 15
Автофлуоресцентная визуализация (AFI), оптико-цифровой метод, позволяет получать изображения с автофлуоресценцией, создаваемой воздействием возбуждающего света на слизистую оболочку, и обеспечивает псевдоцветные изображения. 16 Этот метод полезен для наблюдения плоских поражений или поражений с плохой изменчивостью цвета, которые, вероятно, не будут обнаружены при эндоскопии в белом свете. Однако, когда AFI используется отдельно, его клиническая полезность невысока, поскольку воспалительные и регенеративные изменения считаются ложноположительными результатами. 17 Сообщается, что использование эндоскопии в белом свете в сочетании с AFI и эндоскопией с увеличением NBI повышает точность диагностики опухоли желудка. 18
Эндоскопия в белом свете - текущий основной метод эндоскопического исследования желудка. Полезность эндоскопии с улучшенным изображением для выявления рака желудка на ранних стадиях в настоящее время остается неясной. Кроме того, эндоскопия с улучшенным изображением доступна не в каждом учреждении.
Был произведен поиск в базах данных PubMed и Igaku Chuo Zasshi. В ходе поиска PubMed использовалась следующая формула: «новообразования желудка / диагноз» [majr] И (усиленный ИЛИ лазер ИЛИ «связанный цвет» ИЛИ аутофлуоресцеин * ИЛИ «узкая полоса») И «чувствительность и специфичность» Фильтры: люди; Английский; Японский. В результате поиска было найдено 27 статей. При поиске Игаку Тюо Дзасси использовалась следующая формула поиска: ((((胃 腫 瘍 / TH или 胃 腫 瘍 / AL)) и (((SH = 診断 的 利用, 診断, 画像 診断, X 線 診断, 放射性 核 種)診断, 超音波 診断) или (診断 / TI)))) и ((内 視 鏡 法 / TH или 内 視 鏡 法 / AL)) и (強調 / AL или (蛍 光 / TH или 蛍 光 / AL) или (レ ー ザ ー / TH или レ ー ザ ー / AL)) и ((感 度 と 特異 度 / TH или 感 度 と 特異 度 / AL))) и (PT = 会議 録 除), что на английском языке означает: ((((опухоль желудка / TH или опухоль желудка / AL)) и ((SH = диагностическое использование, диагностика, диагностическая визуализация, диагностическая радиография, диагностическая радионуклидная визуализация, диагностический ультразвук) или (диагностика / TI)))) и ((эндоскопия / TH или эндоскопия / AL)) и (усиление / AL или (флуоресценция / TH или флуоресценция / AL) или (лазер / TH или лазер / AL)) и ((чувствительность и специфичность / TH или чувствительность и специфичность / AL))) и (PT = исключая материалы конгресса). В итоге было извлечено 22 статьи. Эти статьи были сужены до статей, относящихся к этому заявлению; были добавлены некоторые другие статьи, полученные с помощью ручного поиска.
[III] Качественная диагностика раннего рака желудка (дифференциальная диагностика рака и не раковых заболеваний)
Положение 3-1.
Эндоскопия с улучшенным изображением полезна для качественной диагностики рака желудка на ранних стадиях; таким образом, его использование рекомендуется.
Оценка модифицированным методом Дельфи: Медиана, 8; Минимум 7; Максимум, 9 Сила рекомендации: 2 Уровень доказательности: A
Комментарий
При обнаружении поражения необходимо провести качественный диагноз, чтобы различить рак и не рак. Для этой цели часто используется эндоскопия с улучшенным изображением, которая позволяет распознавать результаты, которые трудно наблюдать при эндоскопии в белом свете.
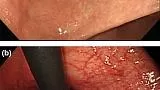
Хромоэндоскопия (метод контрастирования) с использованием индигокармина использовалась для ранней диагностики рака желудка. 1 Спрей с индигокармином часто используется для различения раковых и незлокачественных поражений, потому что он более явно обнаруживает находки в складках вокруг и границ поражения, а также изменения в структуре слизистой оболочки. Однако ни одно рандомизированное контролируемое исследование не показало полезности индигокармина в дифференциальной диагностике рака и не раковых заболеваний.
Иногда сообщалось, что узкополосная визуализация в сочетании с увеличительной эндоскопией может быть полезна для качественной диагностики рака желудка на ранних стадиях. 2 - 12 Ezoe et al . провели многоцентровое рандомизированное контролируемое исследование, чтобы различить депрессивный рак желудка и доброкачественные образования размером 1 см или менее, и сообщили, что показатели точной диагностики, чувствительности и специфичности увеличивающей эндоскопии NBI для небольших депрессивных поражений желудка составили 90,4%, 60,0% , и 94,3%, соответственно, при этом уровень точной диагностики и специфичности значительно выше, чем у эндоскопии в белом свете. 5Тем не менее, эндоскопии с увеличением NBI было трудно диагностировать недифференцированный рак с оставшимся доброкачественным эпителием на поверхности слизистой оболочки. 6 Сообщается, что эндоскопия с увеличением NBI также полезна для дифференциации рака от аденомы среди возвышенных поражений. 8 - 11 Мета-анализ , который по сравнению белого света эндоскопии и увеличительное НБИ эндоскопии в отношении способности качественной диагностики показали полезность увеличительным NBI эндоскопию. 12 Также сообщалось, что эндоскопия с увеличением BLI, другой метод узкополосного света, полезен для качественной диагностики рака желудка на ранней стадии, как и эндоскопия с увеличительным NBI. 13 , 14 Дохии др . 14 сообщили о проспективном многоцентровом исследовании по оценке 114 поражений желудка, изученных с использованием M-BLI, M-BLI-bright и M-NBI. Были определены демаркационная линия (DL), микрососудистый рисунок (MVP) и микроповерхностный рисунок (MSP). M-BLI, MBLI-bright и M-NBI выявили DL для 96,1%, 98,1% и 98,1% и нерегулярный MVP для 95,1%, 95,1% и 96,2% поражений, соответственно, без существенной разницы. Нерегулярная MSP наблюдалась с помощью M-BLI, M-BLI-bright и M-NBI в 97,1, 90,4% и 78,8% поражений, соответственно, со значительными различиями ( P <0,001). Они пришли к выводу, что M-BLI и M-BLI-bright обеспечивают отличную визуализацию микроструктур и микрососудов, аналогичную M-NBI. Нерегулярный MSP можно часто визуализировать с помощью M-BLI и M-BLI-bright по сравнению с использованием M-NBI.
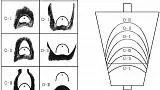
JGES, Японское общество гастроэнтерологов и Японская ассоциация рака желудка совместно выступают за простой диагностический алгоритм увеличительной эндоскопии для рака желудка (MESDA-G; рис. 2 ), основанный на системе классификации VS (сосуды плюс поверхность), системе классификации VS для анализ результатов эндоскопии с увеличением был разработан Yao et al . 4 , 15
фигура 2
Простой алгоритм диагностики рака желудка с помощью увеличительной эндоскопии (MESDA-G; адаптировано из [ 4 ]).
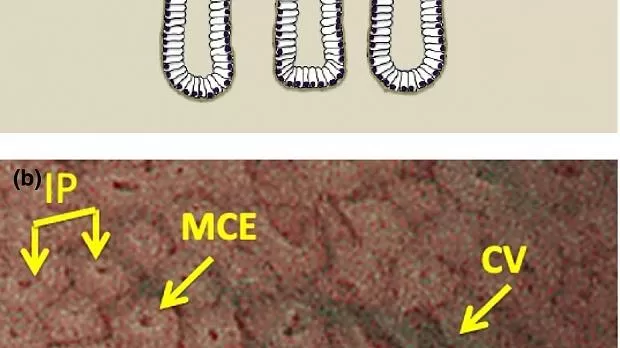
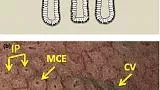
Анатомические термины используются для определения паттернов МК и МС, визуализированных с помощью увеличительной эндоскопии. Паттерн MV состоит из субэпителиального капилляра (SEC), собирающей венулы (CV) и патологических микрососудов (MV), тогда как паттерн MS идентифицируется по краевому эпителию крипты (MCE), отверстию крипты (CO) и промежуточная часть (ИП) между криптами (рис. 3 ). 15
Рисунок 3
(а) Корреляция между микроанатомией (нижний столбец) и эндоскопическими изображениями (верхний столбец) в поверхностной части слизистой оболочки фундальной железы желудка. СО, вскрытие склепа; IP, промежуточная часть между склепами; MCE, краевой эпителий крипты; SEC, субэпителиальный капилляр (адаптировано из [ 16 ]). (b) Микроанатомии, визуализируемые M-NBI. Картина MV: субэпителиальная капиллярная сеть (SECN), собирающая венула: (CV); Картина MS: краевой эпителий крипты (MCE), отверстие крипты (CO).
Согласно системе классификации VS, характеристиками, увеличивающими эндоскопические данные EGC, являются наличие четкого DL между доброкачественной и злокачественной слизистой оболочкой, а также наличие нерегулярной картины МК и / или нерегулярной картины МС внутри DL.
Соответственно, для постановки диагноза дисплазии высокой степени / EGC62 были установлены два критерия:
- Нерегулярный паттерн MV с DL и / или
- Нерегулярный паттерн MS с DL.
Если выполняется один или оба критерия, можно провести эндоскопический диагноз EGC. 14
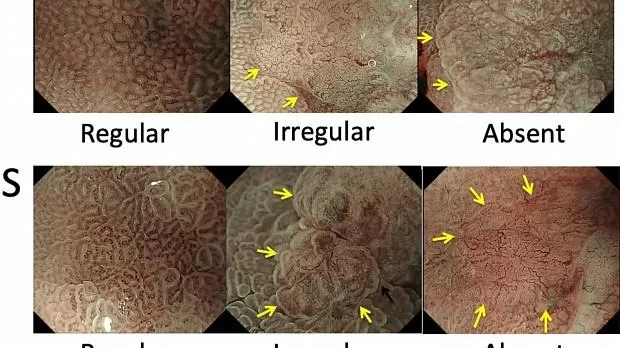
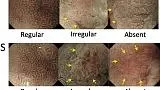
Определение DL - это граница между участками поражения и неповрежденными участками, различимая по резкому изменению паттернов MV и / или MS. 14 Выделяются три категории паттернов MV и MS: регулярные, нерегулярные и отсутствующие (рис. 4 ). 14 В принципе, диаграммы MV и MS необходимо определять отдельно. При регулярном паттерне МК (рис. 4 ) капилляры слизистой оболочки имеют замкнутую (многоугольную) или открытую петлю с однородной морфологией, симметричным распределением и регулярным расположением. На нерегулярной картине МВ (рис. 4)) микрососуды имеют замкнутую (многоугольную), открытую, извилистую, разветвленную или причудливую форму с неоднородной морфологией, асимметричным распределением и нерегулярным расположением. Если картина MV не полностью визуализируется из-за присутствия белого непрозрачного вещества (WOS), которое затемняет субэпителиальные микрососуды (рис. 4 ), картина MV описывается как отсутствующая. 11 В случаях, когда наблюдается WOS, а не оценка MVP, морфологический анализ WOS может быть альтернативным маркером паттерна MS. 11 В регулярном шаблоне MS (рис. 2 ) MCE представляет собой однородную изогнутую, овальную или круглую структуру с однородной морфологией, симметричным распределением и регулярным расположением. На нерегулярной картине МС (рис. 3 ) MCE демонстрирует неправильную изогнутую, овальную, круглую или ворсинчатую структуру с неоднородной морфологией, асимметричным распределением и неправильным расположением. Если паттерн МС отсутствует (рис. 4 ), ни эпителиальная структура краевого крипт, ни WOS не видны при увеличительной эндоскопии.
Рисунок 4
Классификация VS. Микрососудистый рисунок (V) классифицируется как регулярный / нерегулярный / отсутствующий; Рисунок микроповерхности (S) классифицируется как регулярный / нерегулярный / отсутствующий. (Стрелка показывает демаркационную линию; адаптировано из [ 4 ]).
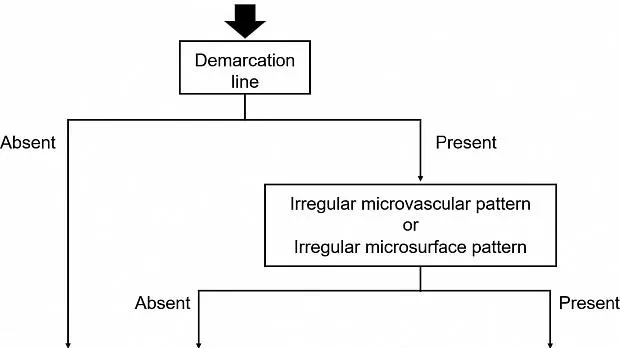
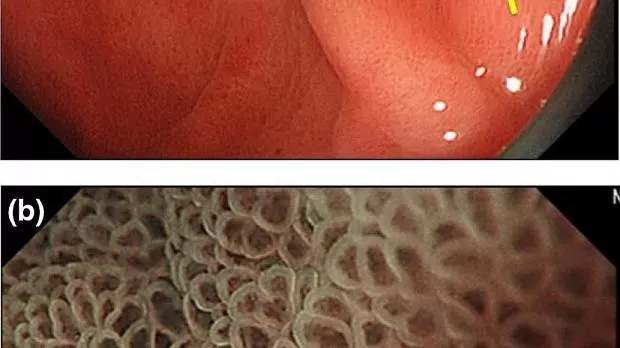
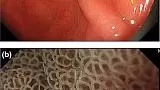
Что касается MESDA-G (рис. 2 ), нам сначала необходимо определить, присутствует ли DL между поражением слизистой оболочки и фоновой слизистой оболочкой. Если DL отсутствует, поражение считается доброкачественным (рис. 5 ). Если DL присутствует, мы должны затем оценить, присутствует ли нерегулярный шаблон MV и / или нерегулярный шаблон MS. Если и нерегулярный М.В. и нерегулярный МС отсутствует поражение диагностируется , как незлокачественные (рис. 6 ), Если нерегулярный М.В. и / или нерегулярный МС присутствует, поражение диагностировано как раковые (рис . 7 ).
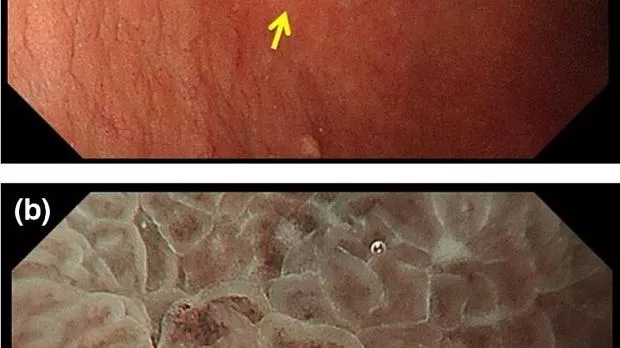
Рисунок 5
(а) Обычные эндоскопические данные с визуализацией в белом свете. В антральном отделе желудка отмечается слегка покрасневшее вдавленное поражение (стрелка). (По материалам [ 4 ]). (b) Увеличение результатов эндоскопии с помощью узкополосной визуализации. Когда мы наблюдаем за краевой частью поражения, демаркационной линии нет. Согласно диагностическому алгоритму, это поражение диагностируется как не канозное. (По материалам [ 4 ]).
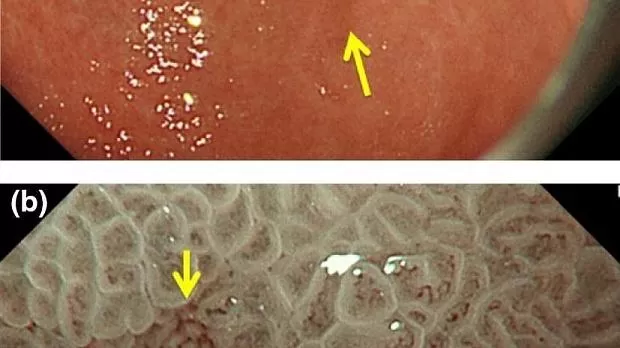
Рисунок 6
(а) Обычные эндоскопические данные с визуализацией в белом свете. В нижней части тела желудка обнаруживается слегка покрасневшее вдавленное поражение. (По материалам [ 4 ]). (b) Увеличение результатов эндоскопии с помощью узкополосной визуализации. Обнаруживается четкая демаркационная линия между фоновой слизистой оболочкой и поражением. Внутри демаркационной линии виден правильный узор микрососудов и правильный узор микроповерхности. Поскольку нет ни неправильного микроваскулярного, ни неправильного рисунка микроповерхности, это поражение диагностируется как нераковое. (По материалам [ 4 ]).
Рисунок 7
(а) Обычные эндоскопические данные с визуализацией в белом свете. На режущей кромке желудка отмечается слегка вдавленное поражение с некоторым изменением цвета (стрелка). (По материалам [ 4 ]). (b) Увеличение результатов эндоскопии с помощью узкополосной визуализации. Отмечается четкая демаркационная линия (стрелка) на краю поражения. Поскольку в пределах демаркационной линии присутствуют как неправильный микроваскулярный узор, так и неправильный узор микроповерхности, это поражение диагностируется как рак. (По материалам [ 4 ]).
Таким образом, увеличивающая эндоскопия с использованием улучшения изображения полезна для качественной диагностики рака желудка на ранних стадиях, и ожидается, что в качестве метода оптической биопсии она сократит количество выполняемых биопсий. 6 , 17 Однако возможности, в которых в настоящее время возможна эндоскопия с улучшенным изображением, ограничены, и желательно дальнейшее распространение этой техники.
Группа по разработке рекомендаций пришла к выводу, что сильной стороной рекомендации по эндоскопии с улучшенным изображением должно быть два, потому что этот метод применим в ограниченных условиях, несмотря на убедительные доказательства, подтверждающие его полезность для качественной диагностики раннего рака желудка.
Был произведен поиск в базах данных PubMed и Igaku Chuo Zasshi. Для PubMed использовалась формула поиска: «новообразования желудка / диагноз» И («улучшение изображения» ИЛИ «белый свет») И (качественное ИЛИ увеличение ИЛИ «синий лазер» ИЛИ «связанный цвет» ИЛИ автофлуоресценция ИЛИ «узкая полоса») Фильтры: Люди; Английский; Японский. Поиск дал 53 совпадения. Для Игаку Тюо Дзасси использовалась следующая формула: (((胃 腫 瘍 / TH или 胃 腫 瘍 / AL)) и ((画像 強調 / TH или 的 的 / AL)) и ((質 的 研究 / TH или 質研究 / AL) или 質 的 / AL)) и (PT = 会議 録 除 く), что на английском языке означает: (((опухоль желудка / TH или опухоль желудка / AL)) и ((улучшение изображения / TH или улучшение изображения / AL)) и ((качественное исследование / TH или качественное исследование / AL) или качественное / AL)) и (PT = исключая материалы конгресса). В конечном итоге было извлечено 24 статьи. Эти статьи были сужены до статей, относящихся к этому заявлению;
[IV] Диагностика для выбора стратегии лечения рака желудка
Положение 4-1.
Тщательное эндоскопическое обследование перед лечением необходимо для определения терапевтической стратегии при раннем раке желудка.
Оценка модифицированным методом Дельфи: Медиана - 9; Минимум 7; Максимум, 9 Сила рекомендации: 1 Уровень доказательности: D
Комментарий
Согласно пятому изданию Японских руководств по лечению рака желудка, эндоскопическое или хирургическое лечение должно проводиться при постановке диагноза рака желудка на ранней стадии. 1 Эндоскопическое лечение менее инвазивно и лучше сохраняет желудок, обеспечивая лучшее качество жизни пациента, чем хирургическое лечение. Поэтому, в принципе, эндоскопическое лечение используется для поражений, которые имеют чрезвычайно низкую вероятность метастазирования в лимфатические узлы. 1С этой точки зрения абсолютными показаниями для эндоскопической резекции слизистой оболочки / эндоскопической диссекции подслизистой оболочки (ESD) являются «макроскопический внутрислизистый рак размером 2 см или меньше с UL0 (cT1a)», а для ESD - «(i) cT1a размером более 2 см с UL0, дифференцированный рак, (ii) cT1a размером 3 см или меньше с UL1, дифференцированный рак и (iii) cT1a размером 2 см или меньше, недифференцированный рак ». 2 - 4 (Такидзава К, Ono Н, Н Hasuike и др. Нерандомизированное одноэтапное подтверждающее исследование эндоскопического расслоения подслизистой оболочки с целью расширения показаний для ITS при раннем недифференцированном раке желудка: Японское исследование группы клинической онкологии (JCOG1009 / 1010). Gastrointest Endosc. Принято к публикации. (Handsearch) (когортное исследование)). Следовательно, чтобы определить, показано ли эндоскопическое лечение для конкретного поражения, необходимо диагностировать (i) гистологический тип, (ii) размер, (iii) глубину инвазии и (iv) наличие или отсутствие язвы. В частности, поскольку боковой край резецированного образца с положительным результатом на раковые клетки указывает на неизлечительную резекцию, необходимо определить точную горизонтальную степень инвазии. 5 - 10Тщательное эндоскопическое обследование перед лечением должно проводиться одновременно с обнаружением рака желудка или в другом случае у специалиста, если только при обнаружении рака желудка будет получен недостаточный эндоскопический диагноз. Хотя влияние вмешательства путем тщательного эндоскопического обследования на радикальность лечения и уровень смертности от рака желудка остается неясным из-за отсутствия исследований, делается вывод, что точный эндоскопический диагноз способствует радикальности эндоскопического лечения, качеству жизни пациента и улучшению экономики медицины.
Поиск в PubMed производился с использованием следующей формулы поиска: («рак желудка» ИЛИ «новообразования желудка» ИЛИ «рак желудка») И (обнаружение ИЛИ диагноз) И («гистологический тип» ИЛИ нагрузка ИЛИ глубина ИЛИ инвазия ИЛИ рубец). В итоге было отобрано 30 статей на английском языке. Были добавлены некоторые другие соответствующие статьи, полученные с помощью ручного поиска.
Положение 4-2.
Диагностика гистологического типа раннего рака желудка должна выполняться комплексно путем эндоскопической диагностики и гистопатологической диагностики с использованием биоптатов.
Оценка модифицированным методом Дельфи: Медиана - 9; Минимум 8; Максимум, 9 Сила рекомендации: 2 Уровень доказательности: D
Комментарий
Морфологические различия между дифференцированным и недифференцированным раком желудка на ранней стадии, наблюдаемые при эндоскопии, были зарегистрированы давно, 1 , 2, и с тех пор эта классификация используется в клинической практике. Среди поражений макроскопического типа выступающие (0-I) и поверхностные возвышенные (0-IIa) поражения часто относятся к дифференцированным видам рака с низкой частотой недифференцированного рака. 2 Среди поверхностных депрессивных поражений (0-IIc) недифференцированные раковые поражения характеризуются четкими обрывистыми краями депрессивной области, гранулами различного размера, присутствующими в депрессивной области 2, и обесцвеченным оттенком. 1 , 3 , 4Поражения с концентрированными складками показывают резкое истончение и / или прекращение складок слизистой оболочки. 2 Кроме того, слизистая оболочка вокруг поражения обычно является кишечной метапластической слизистой оболочкой при дифференцированном раке, но часто является собственно железистой слизистой оболочкой желудка при недифференцированном раке. Следовательно, определение характера фона слизистой оболочки поражения помогает добиться гистологического диагноза. 2
В последние годы появились сообщения о характерных особенностях дифференцированного и недифференцированного рака желудка на ранней стадии при эндоскопии с увеличительным NBI. Дифференцированные раковые поражения имеют нерегулярный микроваскулярный паттерн с демаркационной линией 5, и часто присутствует тонко-сетчатый паттерн. 6 С другой стороны, недифференцированные поражения рака часто показывают уменьшить или устранить регулярный субэпителиальный шаблон капиллярной сети, которая присутствует вокруг раковой области, 5 нерегулярный штопор узора, 6 - 8 , и отсутствуют шаблон microsurface. 7 , 9
Однако все вышеупомянутые исследования были ретроспективными одноцентровыми исследованиями. Следовательно, доказательств достаточно высокого уровня для эндоскопической диагностики гистологического типа получено не было. Кроме того, в настоящее время существуют ограничения на эндоскопическую диагностику рака, имеющего как дифференцированные, так и недифференцированные элементы. Эндоскопическое исследование выгодно тем, что позволяет диагностировать поражение в целом. С другой стороны, гистопатологический диагноз с использованием образцов биопсии ограничивается тканью из определенного участка и не обязательно отражает гистологический тип всего поражения. Поэтому при диагностике гистологического типа ракового поражения
Поиск в PubMed проводился по следующей формуле: «новообразования / патология желудка» [majr] И ранние И (эндоскопия ИЛИ эндоскопия ИЛИ гастроскопия) И (гистолог * ИЛИ гистопатол *) Фильтры: люди; Английский; Японский. В конечном итоге было найдено 320 статей на английском и 16 на японском языках. Эти статьи были сужены до статей, имеющих отношение к этому заявлению, и были добавлены некоторые статьи, полученные с помощью ручного поиска.
Положение 4-3.
Хотя приблизительную оценку размера поражения можно получить с помощью эндоскопии, эндоскопический диагноз следует ставить исходя из предпосылки, что размер поражения должен быть окончательно оценен после получения гистопатологических данных резецированного образца.
Оценка модифицированным методом Delphi: не проводилась (исходные знания) Уровень доказательности: D
Комментарий
Ни в одном отчете не проводилась систематическая проверка диагностической точности размера поражения при раннем раке желудка. В реальной клинической практике размер поражения оценивается путем сравнения поражения и диаметра эндоскопа или щипцов для биопсии или путем измерения с помощью измерительного диска или измерительных щипцов. 1 - 5 Тем не менее, измерение язв с помощью биопсийных щипцов приводит к занижению размера повреждений на 26,5 ± 5,7% до 41,8 ± 3,3%. 2 Эндоскопические измерения поражения варьируются среди эндоскопистов и внутри них. 5 Таким образом, есть ошибки среди измерений размеров, полученных при эндоскопической визуальной оценке, в зависимости от расстояния и угла наблюдения. 1 - 5Диаметр опухоли, показанный для эндоскопического лечения, был назначен на основании гистопатологических данных. Следовательно, общее правило заключается в том, что использование эндоскопического лечения определяется в соответствии с эндоскопически оцененным размером поражения, но окончательное определение поражения должно производиться на основании гистопатологически определенного размера резецированного образца.
Поиск в PubMed проводился по следующей формуле: «заболевания желудка» [сетка] И (эндоскопия ИЛИ эндоскопия ИЛИ гастроскопия) И (измерение ИЛИ измерение ИЛИ размера) НЕ (резекция ИЛИ хирургия [sh]) Фильтры: Люди; Английский; Японский. В конечном итоге было найдено 752 статьи на английском языке, суженные до тех, которые имеют отношение к этому заявлению, и были добавлены некоторые другие статьи, полученные с помощью ручного поиска.
Положение 4-4.
В принципе, для определения глубины инвазии рака желудка на ранней стадии следует использовать обычную эндоскопию в белом свете. Если это сложно, эндоскопическое ультразвуковое исследование может быть полезным дополнительным диагностическим инструментом.
Оценка модифицированным методом Дельфи: Медиана, 8; Минимум 7; Максимум, 9 Сила рекомендации: 2 Уровень доказательности: C
Комментарий
Для выбора терапевтической стратегии при раннем раке желудка необходимо различать глубину инвазии рака слизистой (cT1a) и подслизистого (cT1b) рака. Обычная эндоскопия в белом свете - наиболее распространенное эндоскопическое исследование для определения глубины инвазии. Признаки рака не менее чем на 0,5 мм глубже от подслизистой оболочки (pT1b2) при эндоскопии в белом свете включают гипертрофию или слияние концентрированных складок, 1 , 2 размер опухоли не менее 30 мм, 3 выраженное покраснение, 3 неровную поверхность, 1 , 3 , 4 краевое возвышение, 2 приподнятый край подслизистой опухоли s , 3 ,4 и знак нераспространения (рис. 8 ). 5 , 6 Сообщается, что положительная прогностическая ценность для диагностики рака cT1b2 с использованием этих индикаторов составляет около 63–89%. 6 - 9 Ряд докладов показал полезность УЗИ (EUS) для определения глубины инвазии раннего рака желудка. 7 - 11 Темменее, в исследованиях наблюдений (не рандомизированных контролируемых исследований)которых сравнивали показатели точной диагностики глубины вторжения ЭУЗИ и традиционной эндоскопии, Choi и др . 2 отметили, что традиционная эндоскопия превосходит EUS (73,7% против 67,4%, P <0,001), тогда как Yanai et al . 12 не обнаружили значительной разницы в диагностической точности между двумя методами (63% против 71%, нет значимости). Поэтому предлагается выполнить обычную эндоскопию в белом свете для определения глубины инвазии раннего рака желудка и использовать EUS в качестве вспомогательного метода при поражениях, диагностированных как cT1b с помощью традиционной эндоскопии. 4 , 6 , 7
Рисунок 8
Пример хромоэндоскопических находок раннего рака желудка (поверхностный повышенный плюс депрессивный (0-IIc + IIa) тип), проникшего в более глубокую часть подслизистой оболочки (T1b2). Когда стенка желудка сильно расширяется за счет вдувания большого количества воздуха, рак T1b2 не расширяется и образует трапециевидное возвышение, складки слизистой оболочки сходятся и становятся приподнятыми в области рака T1b2 (стрелки). Это так называемый «признак отсутствия удлинения», характерный для рака T1b2. (По материалам [ 6 ]).
Поиск в PubMed проводился по следующей формуле: «новообразования желудка» [сетка] И ранние И («инвазивность новообразования» ИЛИ инвазия * ИЛИ глубина) И (эндоскопия ИЛИ эндоскопия) Фильтры: люди; Английский; Японский. В конечном итоге было найдено 887 статей на английском и 124 на японском языках. Эти статьи были сужены до статей, имеющих отношение к данному заявлению, и были добавлены некоторые другие статьи, полученные с помощью ручного поиска.
Положение 4-5.
В принципе, обычная эндоскопия в белом свете должна использоваться для определения наличия / отсутствия активных язв и язвенных шрамов, связанных с ранним раком желудка.
Оценка модифицированным методом Дельфи: Медиана, 8; Минимум 8; Максимум, 9 Сила рекомендации: 2 Уровень доказательности: D
Комментарий
Чтобы определить показания для эндоскопического лечения, необходимо до операции определить наличие или отсутствие язв (UL). В принципе, наличие / отсутствие UL следует определять в зависимости от того, есть ли признаки явной активности язвы или рубцевания в поражении при традиционной эндоскопии. Активная язва - это открытая язва, сопровождающаяся глубоким белым налетом с дефектом слизистой оболочки, исключающим неглубокую эрозию. Поскольку UL на стадиях заживления и рубцевания внутри поражения морфологически характеризуется конвергенцией складок, необходимо отличать эти складки от концентрированных складок, связанных с глубокой инвазией подслизистой оболочки. 1 Обычная эндоскопия в белом свете в сочетании с хромоэндоскопией (метод контраста индигокармином) позволяет более четко наблюдать мельчайшие сходящиеся складки.1 - 3 ЭУЗИкак сообщаетсяполезен для диагностики не только наличия / отсутствияно и глубины UL, которая связана с трудностями в ОУРАХ. 4
Поиск PubMed проводился по следующей формуле: «новообразования желудка» [majr] И («язва желудка» ИЛИ рубец ИЛИ рубец) И (эндоскопия ИЛИ эндоскопия) И патология [sh] Фильтры: люди; Английский; Японский. В конечном итоге было найдено 274 статьи на английском и 83 на японском языках. Эти статьи были сужены до статей, имеющих отношение к данному заявлению, и были добавлены некоторые другие статьи, полученные с помощью ручного поиска.
Положение 4-6.
Эндоскопия с улучшенным изображением полезна для диагностики степени инвазии.
Оценка модифицированным методом Дельфи: Медиана - 9; Минимум 8; Максимум, 9 Сила рекомендации: 1 Уровень доказательности: B
Комментарий
При хирургической или эндоскопической резекции рака желудка на ранних стадиях необходим точный диагноз степени инвазии, чтобы добиться локальной радикальности за счет исключения положительных боковых краев. 1 - 3 Белого свет эндоскопии в сочетании с индигокармином хромоэндоскопией широко используется для диагностики степени инвазии раннего рака желудка. Хромоэндоскопия индигокармином усиливает изменения поверхностной структуры эпителия слизистой оболочки желудка; следовательно, это полезно для определения границ между злокачественными и незлокачественными слизистыми оболочками. 4 , 5 Однако, по имеющимся данным, его нельзя использовать для определения периферических границ раннего рака желудка в 18,9–21,6% случаев. 6 - 9Следовательно, он не может диагностировать степень инвазии примерно в 20% случаев, даже если используется современная эндоскопия с высоким разрешением.
Недавно было сообщено , что система классификации С. 10 с помощью увеличительного NBI эндоскопии имеет высокую диагностическую способность для определения степени вторжения раннего рака желудка, 6 - 9 , 11 , 12 , показывающего точность в 72,6% поражениях , в которых не удались индигокармин хромоэндоскопия. 13 Среди различных исследований, которые напрямую сравнивали индигокарминовую хромоэндоскопию и увеличивающую эндоскопию NBI, рандомизированное одноцентровое контролируемое исследование, охватывающее только случаи ESD, показало значительно лучшие результаты с увеличивающей эндоскопией NBI (89,4% против 75,9%, P = 0,007) 6.в то время как рандомизированное многоцентровое контролируемое исследование, в котором изучались случаи ESD и хирургических вмешательств, не выявило преимущества эндоскопии с увеличительным NBI (88,0% против 85,7%, P = 0,63). 13
Поиск в PubMed проводился по следующей формуле: «новообразования желудка» [сетка] И ранние И («инвазивные новообразования» ИЛИ инвазии * ИЛИ протяженность ИЛИ границы ИЛИ по горизонтали) И (эндоскопия ИЛИ эндоскопическая ИЛИ гастроскопия) НЕ (хирургия [sh] ИЛИ резекция PR рассечение) Фильтры: Люди; Английский; Японский. В конечном итоге было найдено 265 статей на английском и 182 на японском языках. Эти статьи были сужены до статей, имеющих отношение к данному заявлению, и были добавлены некоторые другие статьи, полученные с помощью ручного поиска.
[V] Стратификация риска после эндоскопического исследования.
Положение 5-1.
Атрофия, кишечная метаплазия, узловатость, увеличенная складка и ксантома желудка - это эндоскопические данные, связанные с риском рака желудка.
Оценка модифицированным методом Delphi: не проводилась (базовые знания) Уровень доказательности: B
Комментарий
Хотя атрофия и кишечная метаплазия давно известна как факторы риска для дифференцированного рака желудка, большинство исследований по этому вопросу были основаны на гистологических, 1 - 4 , тогда как лишь немногие из них оценивали взаимосвязь между эндоскопическими находками и риском развития рака желудка. Uemura et al . 5 провели эндоскопические наблюдения у 1246 человек, инфицированных H. pylori.и 280 неинфицированных лиц в среднем в течение 7,8 лет и сообщили, что 36 случаев рака желудка произошли от инфицированных лиц, что свидетельствует о серьезной атрофии (эндоскопический диагноз), гастрите с преобладанием тела и кишечной метаплазии (гистологический диагноз). Что касается взаимосвязи между риском рака желудка и распространением эндоскопической атрофии слизистой оболочки желудка, оцененной по классификации Кимура-Такемото, сообщалось, что риск рака желудка увеличивается с прогрессированием атрофии; риск составлял 1,7 (95% ДИ 0,8–3,7) для случаев умеренной атрофии и 4,9 (95% ДИ 2,8–19,2) для случаев тяжелой атрофии, когда риск отсутствующей или легкой атрофии был установлен на уровне 1. Masuyama et al. . 6зарегистрировали 27 777 человек, которые прошли эндоскопическое обследование (в том числе 272 с ранним раком желудка и 135 с распространенным раком желудка), и ретроспективно проанализировали распространенность рака желудка и тяжесть эндоскопической атрофии слизистой оболочки желудка (CI-OIII). Распространенность рака желудка составляла 0% (0/4506) для CI 0,25% (9/3660) для CII, 0,71% (21/2960) для CIII, 1,32% (75/5684) для OI, 3,70% (140 / 3780) для OII и 5,33% (160/3004) для OIII. Таким образом, они сообщили, что частота рака желудка значительно увеличивалась с прогрессированием эндоскопической атрофии слизистой оболочки желудка, то же самое, что и Uemura et al.. В корейском исследовании ретроспективно были проанализированы эндоскопические данные у 75 пациентов с раком желудка, обнаруженные среди 60 261 пациента, перенесшего эндоскопию; Наблюдаемая эндоскопически атрофия (OR 8,47; 95% ДИ 4,65–15,40; P <0,001) и кишечная метаплазия (OR 5,80; 95% ДИ 3,24-10,35; P <0,001) были независимыми факторами риска при многофакторном анализе. 7 Sugimoto et al . 8 изучали 932 пациента с гастритом, вызванным H. pylori , 189 - с ранним раком желудка и 79 - с раком желудка после H. pylori.эрадикации и ретроспективно проанализировали взаимосвязь между раком желудка и атрофией, кишечной метаплазией, увеличенной складкой, узловатостью и диффузным покраснением в соответствии с эндоскопической шкалой Киотской классификации гастрита. 9 Они сообщили, что показатели атрофии и кишечной метаплазии при раннем раке желудка были значительно выше, чем при гастрите, вызванном H. pylori ; значимыми факторами риска, обнаруженными с помощью многофакторного анализа, были кишечная метаплазия (OR 4,453; 95% CI 3,332–5,950; P <0,001) и мужской пол.
Камада и др . 10 ретроспективно сравнили риск рака желудка у пациентов с узловым гастритом в возрасте 29 лет или младше и пациентов соответствующего пола и возраста с гастритом H. pylori (исследование случай – контроль). Частота выявления рака желудка у пациентов с узловым гастритом составила 4,7% (7/150), что было значительно выше, чем соответствующий показатель 0,08% (3/3939) среди контрольной группы (OR 64,2), что позволяет предположить, что узловой гастрит сильно выражен. связаны с недифференцированным раком желудка. В проспективном когортном исследовании Watanabe et al . 11обнаружили, что частота рака желудка среди пациентов с гастритом с увеличенной складкой желудка при эндоскопическом обследовании (1749 случаев / 100 000 населения / год) была значительно выше, чем соответствующая частота (43 случая / 100 000 населения / год) среди пациентов без увеличенной складки. В радиологическом исследовании желудка Nishibayashi et al . 12 обнаружили, что риск рака желудка был в 35,5 раз выше в случаях с шириной складки не менее 7 мм, чем в случаях с шириной складки 4 мм или меньше в теле желудка, и указали, что ширина складки в желудке corpus был фактором риска недифференцированного рака желудка, возникающего в теле желудка. Ямамичи и др . 13 также обнаружили появление пяти случаев рака желудка в 3-летнем проспективном наблюдении за 1253 пациентами с гастритом с увеличенной складкой желудка и сообщили, что увеличенная складка является предиктором рака желудка.
Sekikawa et al . 14 проспективно наблюдали за 1823 пациентами, которые прошли эндоскопическое обследование для определения связи между наличием / отсутствием ксантомы желудка и возникновением рака желудка. Они сообщили, что 29 случаев раннего рака желудка произошли среди субъектов в течение периода исследования и что эндоскопическая атрофия открытого типа (OR 7,19; 95% ДИ 2,50–20,83; P <0,0001) и ксантома (OR 5,85; 95% ДИ 2,67-12,82) ; P <0,0001) были независимыми факторами риска рака желудка.
Таким образом, эндоскопические данные, связанные с риском рака желудка, включают атрофию, кишечную метаплазию, увеличенную складку и ксантому. При проведении эндоскопических исследований важно полностью осознавать эти факторы риска рака желудка. Однако, хотя специфическая кишечная метаплазия может быть диагностирована с помощью эндоскопии в белом свете, неспецифическая кишечная метаплазия трудно диагностировать в белом свете. Напротив, эндоскопия с улучшенным изображением, особенно с помощью NBI 15 или LCI, 16 , полезна для диагностики неспецифической кишечной метаплазии.
В Европе используется оперативная ссылка на оценку гастрита, 17 которая всесторонне оценивает риск рака желудка с использованием комбинации степени тяжести гистологической атрофии биоптатов из фиксированных точек антрального отдела и тела желудка, а также оперативной ссылки на оценку кишечной метаплазии желудка , 18, который оценивает риск рака желудка на основе степени гистологической метаплазии кишечника, а не атрофии. В последние годы результаты эндоскопии с улучшенным изображением хорошо коррелируют с гистологически определенным риском. 19Если возможна стратификация риска рака желудка на основании результатов эндоскопии, это является преимуществом, поскольку может снизить стоимость множественных биопсий и риск кровотечения. С точки зрения возможности эндоскопии диагностировать гистологическую атрофию и кишечную метаплазию, важно сравнить эндоскопические и гистологические данные. Однако для подготовки этого заявления использовались только статьи, в которых изучалась взаимосвязь между результатами эндоскопии и возникновением рака желудка.
Поскольку это утверждение предоставлено в качестве базовых знаний, сила этой рекомендации не оценивалась.
Поиск в PubMed проводился по следующей формуле: («новообразования желудка / диагноз» [majr] ИЛИ гастрит [majr]) И («стратификация риска» ИЛИ «оценка риска») И (эндоскопия ИЛИ эндоскопия). В конечном итоге было извлечено 105 статей. Эти статьи были сужены до статей, имеющих отношение к данному заявлению, и были добавлены некоторые другие статьи, полученные с помощью ручного поиска.
Положение 5-2.
Стратификация риска рака желудка может быть осуществлена на основании результатов эндоскопии, подтверждающих наличие H. pylori- отрицательного статуса и атрофии слизистой оболочки желудка. Таким образом, предлагается стратификация риска по этим двум позициям.
Оценка модифицированным методом Дельфи: Медиана - 9; Минимум 7; Максимум, 9 Сила рекомендации: 2 Уровень доказательности: C
Комментарий
Стратификация риска рака желудка в настоящее время проводится с использованием комбинации сывороточного титра антител к H. pylori и уровня сывороточного PG. 1 Ставится под сомнение возможность применения стратификации риска на основе эндоскопических данных. Утверждение 5-1 описывает, что атрофия, кишечная метаплазия, узловатость, увеличенная складка и ксантома желудка связаны с риском рака желудка. Классификация Кимура-Такемото 2 оценивает степень атрофии слизистой оболочки желудка на основе появления видимых сетчатых или дендритных кровеносных сосудов и изменения цвета слизистой оболочки, наблюдаемого при эндоскопическом исследовании (рис. 9 ). Рисунок 10показана типичная эндоскопическая атрофия слизистой оболочки желудка. Однако вид видимых кровеносных сосудов зависит от степени вдыхания воздуха; следовательно, этот параметр не объективен. В утверждении 5-1 указано, что исследования Uemura et al . 3 и Masuyama et al . 4 показали, что стратификация риска рака желудка в некоторой степени практична путем оценки степени атрофии слизистой оболочки желудка с использованием следующей классификации Кимура-Такемото: CI-CII (легкая атрофия), CIII-OI (умеренная атрофия) и OII-OIII ( сильная атрофия). Что касается стратификации риска развития рака желудка в условиях кишечной метаплазии, все исследования были основаны на гистологических 5 - 8а не эндоскопические данные, потому что эндоскопия в белом свете не может способствовать точной диагностике кишечной метаплазии. Кроме того, в исследованиях не сообщалось о стратификации риска с использованием комбинации атрофии и кишечной метаплазии. Однако, поскольку эндоскопия с улучшенным изображением с использованием NBI 9 , 10 или LCI 11 облегчает диагностику кишечной метаплазии, стратификация риска рака желудка возможна на основе эндоскопических данных кишечной метаплазии. Ожидается дальнейшее расследование по этому поводу.
Рисунок 9
Иллюстрация к эндоскопической атрофии слизистой оболочки желудка (классификация Кимура-Такемото). Атрофическая слизистая оболочка ограничена антральным отделом в области C-I; ограничивается меньшей кривизной нижнего тела в C ‐ II; ограничивается верхним телом в C-III, ограничивается окружающей средой желудка в O-I, атрофия присутствует во всем желудке в O-III, а O-II является промежуточным типом между O-I и O- III. (По материалам [ 2 ]).
Рисунок 10
Эндоскопические картины атрофии слизистой оболочки желудка. (а) Закрытый тип (C-III): атрофическая обесцвеченная слизистая оболочка ограничена малой кривизной верхнего тела. (b) Открытый тип (O-II): видимые сосуды выходят за пределы малой кривизны кардии желудка к передней и задней стенкам. Однако складки большей кривизны на теле не исчезли.
Хотя наличие / отсутствие узловатости, 12- кратного увеличения 13 и ксантомы желудка были отдельно исследованы на предмет взаимосвязи с риском рака желудка 14, ни в каких отчетах эти данные не были подробно описаны в стратификации риска рака желудка. С другой стороны, регулярное расположение собирающих венул в теле желудка, как сообщается, указывает на статус неинфекции H. pylori , 15 то есть чрезвычайно низкий риск рака желудка. 1 Таким образом, предполагается, что использование находки H. pyloriНеинфекция и наблюдаемая эндоскопически атрофия слизистой оболочки желудка (классификация Кимура-Такемото) позволяет разделить риск рака желудка на низкий или высокий. В будущем ожидается получение достаточно высокого уровня доказательств.
Поиск в PubMed проводился по следующей формуле: («новообразования желудка» [majr] ИЛИ гастрит [majr]) И (эндоскопия ИЛИ эндоскопия) И результаты И «факторы риска» И «слизистая оболочка желудка / патология»). В итоге было найдено 188 статей. Эти статьи были сужены до статей, имеющих отношение к данному заявлению, а также были добавлены некоторые другие статьи, полученные с помощью ручного поиска.
[VI] Наблюдение за ранним раком желудка
Положение 6-1.
Пациентам с факторами риска (клиническими и эндоскопическими данными) рака желудка рекомендуется контрольное эндоскопическое обследование.
Оценка модифицированным методом Дельфи: Медиана - 9; Минимум 6; Максимум, 9 Сила рекомендации: 1 Уровень доказательности: B
Комментарий
Скрининг - это стратегия, используемая в популяции для выявления лиц с нераспознанным целевым заболеванием или прогнозирования развития целевого заболевания с помощью общих обследований, тогда как эпиднадзор - это стратегия, направленная на предотвращение и лечение определенного заболевания посредством непрерывных исследований и мониторинга его возникновения. .
Эффективность выявления заболевания с помощью обследования во многом связана с риском (предтестовой вероятностью) заболевания. Факторы риска, связанные с возникновением рака желудка, включают несколько эндоскопических (утверждение 5-1) и клинических (утверждение 1-1) результатов, а риск рака желудка у целевого пациента может быть определен после эндоскопического обследования на основе обоих результатов. Людям с факторами риска рака желудка (клинические и эндоскопические данные) рекомендуется продолжение эндоскопического обследования (контрольная эндоскопия) после первичной эндоскопии. В Японии процент инфицированных H. pylori среди тех, кто прошел эндоскопическое обследование, составлял 74,7% в 1970-х годах по сравнению с 35,1% в 2010-х. 1Наряду с этим снижением наблюдались аналогичные изменения в распространенности атрофии и кишечной метаплазии слизистой оболочки тела желудка, которые являются факторами высокого риска рака желудка; распространенность составляла 82% и 32% соответственно в 1970-е годы против 19% и 4,7% соответственно в 2010-х годах. 1 Таким образом, нынешнее население Японии не совсем относится к группе высокого риска рака желудка; скорее, он состоит из смеси групп высокого и низкого риска. Таким образом, рекомендация эндоскопического наблюдения для должным образом отобранной группы высокого риска может повысить эффективность выявления рака желудка и снизить вред, связанный с эндоскопией (стоимость, нагрузка, риск побочных эффектов).
Существует мало доказательств высокого уровня, которые прямо демонстрируют эффективность эпиднадзорной эндоскопии и соответствующих интервалов между ними для снижения показателей смертности от рака желудка в популяции с высоким риском развития рака желудка. В Японии и Южной Корее, где распространенность инфекции H. pylori высока и большинство (≥70%) инфицированных людей имеют изменения слизистой оболочки желудка с высоким риском, т. Е. Атрофию слизистой оболочки и кишечную метаплазию, 1Было рекомендовано осуществление общенациональной программы скрининга рака желудка. Результаты исследований, в которых изучалась связь между интервалами между скрининговыми эндоскопическими исследованиями и возникновением рака желудка в этих странах, могут предоставить полезную информацию об эффективности и соответствующих интервалах контрольной эндоскопии в группах высокого риска. Крупномасштабное исследование случай-контроль показало снижение смертности от рака желудка на 47% среди лиц, участвовавших в Корейской национальной программе скрининга рака желудка, а у людей в возрасте 40–69 лет наблюдалось статистически значимое снижение смертности даже при обследовании. интервал составлял 4 года и более. 2Японское исследование случай-контроль показало снижение смертности от рака желудка на 30% у лиц, прошедших эндоскопический скрининг в течение последних 2–4 лет, но статистически значимый эффект наблюдался только у тех, кто прошел эндоскопическое обследование в течение последних 3 лет. лет. 3 Южнокорейское перекрестное исследование изучало связь между интервалом между эндоскопическим обследованием и стадией обнаруженного рака желудка, и процент диагнозов стадии I стабильно составлял около 70%, когда интервал между обследованиями составлял 1–3 года, тогда как он был значительно ниже - 60%, когда интервал между обследованиями составлял 4 года и более. 4Также сообщалось, что доля внутрислизистой карциномы составляла 75% среди тех, кто проходил ежегодное эндоскопическое обследование, тогда как среди тех, кто проходил обследование два раза в год, он был значительно ниже - 57%. 5 Таким образом, подходящий интервал наблюдения за эндоскопическим обследованием для лиц с высоким риском рака желудка предлагается составлять 1-3 года, учитывая ингибирующий эффект на смертность от рака желудка, но более короткие интервалы предпочтительны, если обнаружение эндоскопически резектабельного рака желудка предназначены. Однако необходимы дальнейшие исследования оптимального интервала между эндоскопическими обследованиями с точки зрения цели обследования (снижение смертности или избежание хирургического вмешательства на желудке) и экономической эффективности.
В японском когортном исследовании (1603 пациента с язвенной болезнью, полипом желудка, функциональной диспепсией, наблюдаемые в среднем в течение 7,8 лет) не было случаев рака желудка среди 280 пациентов без инфекции H. pylori . 6 Кроме того, поперечное исследование 3161 пациента с раком желудка показало, что 0,66% были инфицированы H. pylori . 7 Эти данные указывают на то, что заболеваемость раком желудка среди H. Pylori -uninfected лиц была крайне низкой , даже в Японии, которая известна своей высокой заболеваемости раком желудка. Учитывая возможности обработки, стоимость, нагрузку и потенциальный риск нежелательных явлений, эндоскопия для наблюдения за H. pylori не рекомендуется.-Неинфицированные лица без структурных нарушений. Однако эта рекомендация не должна противоречить выполнению популяционного скрининга или эндоскопических исследований у пациентов с симптомами. Требуются дальнейшие исследования факторов риска рака желудка, отличных от инфекции H. pylori (аутоиммунный гастрит, вирусная инфекция EB, наследственный диффузный рак желудка). 8
Среди пациентов, получавших эндоскопическое лечение рака желудка на ранней стадии, часто встречается метахронный множественный рак желудка (совокупная заболеваемость за 3 года, 5,9%). Поскольку его частота остается неизменной даже через 5 лет 9, незаменима эндоскопия длительного наблюдения. В японском когортном исследовании сообщается, что ежегодная контрольная эндоскопия приводила к эндоскопической радикальной резекции почти во всех (≥95%) случаях обнаруженного метахронного рака желудка. 9 Однако в последующем исследовании большого количества пациентов в том же учреждении сообщалось о случаях смерти от метахронного множественного рака желудка, что указывает на необходимость долгосрочных тщательных обследований. 10
Поиск в PubMed и Кокрановской библиотеке проводился с использованием следующей формулы: («рак желудка» ИЛИ «новообразования желудка» ИЛИ «рак желудка») И (эндоскопия ИЛИ эндоскопия) И наблюдение И (период ИЛИ интервал). В конечном итоге была извлечена 61 статья, а затем они сужены до 15, имеющих отношение к этому заявлению; были также добавлены некоторые другие статьи, полученные с помощью ручного поиска.
Алгоритм эндоскопической диагностики EGC предлагается на основе положений этого руководства (рис. 10 ).
Рисунок 11
Алгоритм диагностической и терапевтической стратегии при раннем раке желудка. У каждого субъекта перед эндоскопическим обследованием оценивается риск рака желудка на основе клинической информации [I]. При соответствующей подготовке и методике наблюдения обнаруживаются подозрительные на рак желудка поражения [II]. Обнаруженные поражения дифференцируются, являются ли они злокачественными или незлокачественными, по результатам эндоскопии [III]. Дифференциальный диагноз должен быть подтвержден прицельной биопсией. Раковые поражения дополнительно исследуются на гистологический тип, размер, глубину инвазии и наличие или отсутствие язвы / рубца, чтобы определить показания к лечению, включая эндоскопическую резекцию [IV]. Риск рака желудка снова оценивается в соответствии с результатами эндоскопии [V], а эндоскопия рекомендуется в соответствии с риском [VI].
.
Фрагмент конференции Науково-практична конференція з міжнародною участю «Актуальні питання ендоскопії» 15 октября 2020 г.
Лектор: Владимир Иванович Никишаев - Заслуженный врач Украины, д.м.н., ст.науч.с., зав. отделением эндоскопической диагностики и малоинвазивной хирургии Киевской городской клинической больницы скорой медицинской помощи, главный научный сотрудник Украинского научно-практического центра экстренной медицинской помощи и медицины катастроф
Список литературы:
ter pylori infection and atrophic gastritis over 40 years in
Japan. Helicobacter 2015; 20: 192–8.
2 Jun JK, Choi KS, Lee HY et al. Effectiveness of the Korean
National Cancer Screening Program in reducing gastric cancer
mortality. Gastroenterology 2017; 152: 1319–28.e7.
3 Hamashima C, Ogoshi K, Okamoto M et al. A community-
based, case-control study evaluating mortality reduction from
gastric cancer by endoscopic screening in Japan. PLoS ONE
2013; 8: e79088.
4 Nam JH, Choi IJ, Cho SJ et al. Association of the
interval between endoscopies with gastric cancer stage at
diagnosis in a region of high prevalence. Cancer 2012; 118:
4953–60.
5 Chung SJ, Park MJ, Kang SJ et al. Effect of annual
endoscopic screening on clinicopathologic characteristics and
treatment modality of gastric cancer in a high-incidence region
of Korea. Int J Cancer 2012; 131: 2376–84.
6 Uemura N, Okamoto S, Yamamoto S et al. Helicobacter
pylori infection and the development of gastric cancer. N Engl
J Med 2001; 345: 784–9.
7 Matsuo T, Ito M, Takata S et al. Low prevalence of
Helicobacter pylori-negative gastric cancer among Japanese.
Helicobacter 2011; 16: 415–9.
8 Shaw D, Blair V, Framp A et al. Chromoendoscopic surveil-
lance in hereditary diffuse gastric cancer: an alternative to
prophylactic gastrectomy? Gut 2005; 54: 461–8.
9 Nakajima T, Oda I, Gotoda T et al. Metachronous gastric
cancers after endoscopic resection: how effective is annual
endoscopic surveillance? Gastric Cancer 2006; 9: 93–8.
10 Abe S, Oda I, Suzuki H et al. Long-term surveillance and treatment
outcomes of metachronous gastric cancer occurring after curative
endoscopic submucosal dissection. Endoscopy 2015; 47: 1113–8.
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.














.jpg)





.png)

.jpg)

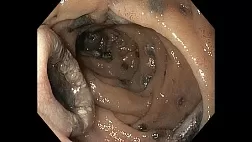













Комментарии