- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Руководство по диагностики и лечению гепатоцеллюлярной карциномы у взрослых
| Авторы: | Ryder S. D. (Рекомендации Британской Гастроэнтерологической Ассоциации) 2002г. |
Аннотация:
Этот документ, посвященный диагностике и лечению пациентов с гепатоцеллюлярной карциномой (HCC), был подготовлен по заказу Британской Гастроэнтерологической ассоциации, в рамках более широкой программы создания клинических руководств.
Борьба с раком находится в сфере пристального внимания медицинской общественности, а подготовка руководств по его лечению является одной из мер направленных на снижение смертности от злокачественных заболеваний в UK. Существуют веские предположения, что HCC в течение нескольких последующих лет будет встречаться все более часто, в основном из-за эпидемии гепатита С. Ранее HCC была редкой в UK опухолью и основные данные по ее диагностике и лечению получены из исследований выполненных за пределами страны. Из-за отсутствия скрининговых программ и того факта, что большинство случаев НСС у пациентов ранее не страдавших патологией печени выявляется на стадии заболевания с явными симптомами, чаще, в связи с запущенностью патологии, применяются не хирургические методы лечения. Существует большое количество факторов влияющих на прогноз заболевания, основные из которых это стадия фонового заболевания печени и размер опухоли на момент диагностики. Оценка этих факторов сложна и они оказывают воздействие на уровень смертности в рандомизированных контролируемых исследованиях посвященных лечению этой опухоли. Однако существует достаточное количество данных, которые могут служить базой для обоснования диагностической и лечебной тактики при НСС. Руководства это не жесткие протоколы и не должны мешать клиническому мышлению. Следовательно, они не являются директивой предписывающей то или иное действие, но представляют собой базис, на основе которого, врачи могут более ясно представить все имеющиеся тактические подходы.
Введение:

Полный текст статьи:
Разработка руководства
Группами специалистов и экспертами был выполнен систематический обзор литературы с суммированием доступных данных и последующей их тщательной оценкой. На этом этапе в черновое руководство были внесены ряд поправок. «Сила» использованных доказательств оценивалась согласно рекомендациям северо-английского проекта по разработке клинических руководств.
Категории доказательств
- Ia: Данные мета-анализов рандомизированных, контролируемых исследований.
- Ib: Данные по крайней мере одного рандомизированного исследования.
- IIa: Данные полученные из по крайней мере одного хорошо подготовленного контролируемого исследования без рандомизации.
- IIb: Данные полученные из по крайней мере одного квази-экспериментального исследования другого типа.
- III: Данные полученные из хорошо подготовленных, не экспериментальных описательных исследований, как сравнительные исследования, корреляционные исследования и частные исследования.
- IV: Данные полученные из сообщений или мнений экспертных комитетов или клинического опыта признанных авторитетов в данной области.
Градация рекомендаций
Рекомендации основываются на «силе» доказательств и ранжируются соответственно.
- Степень A: Требует наличия хотя бы одного рандомизированного контролируемого исследования хорошего качества посвященного предмету рекомендации.
- Степень B: Требует наличия по данной проблеме клинических исследований без рандомизации.
- Степень C: Требует наличия доказательств категории IV в отсутствии применимых клинических исследований.
Краткое изложение рекомендаций
- Наблюдение с использованием УЗИ брюшной полости и определением уровня альфа-фетопротеина позволяет диагностировать НСС меньшего размера, чем таковые обнаруживаемые без скрининга (доказательство IIa).
- Возможность радикального лечения зависит только от размера выявленной HCC (доказательство IIa).
- Несмотря на вышесказанное, не существует данных подтверждающих, что эти преимущества раннего выявления опухоли приводят к увеличению 5 летней выживаемости или уменьшению стоимости лечения (доказательство IIa).
- Возможность наблюдения по поводу гепатоцеллюлярной карциномы должна рассматриваться у следующих групп пациентов высокого риска:
- Мужчины и женщины с диагностированным циррозом вызванным вирусом гепатита В (HBV), в особенности у таковых с продолжающейся репликацией вируса (доказательство степени III, рекомендация степени B).
- Мужчины и женщины с диагностированным циррозом вызванным вирусом гепатита С (HCV) (доказательство степени III, рекомендация степени B).
- Мужчины с алкогольным циррозом печени, которые воздерживаются от приема алкоголя или вероятно будут участвовать в лечении (доказательство степени III, рекомендация степени B).
- Мужчины с циррозом печени, вызванным первичным билиарным циррозом (доказательство степени III, рекомендация степени B).
- Риск развития НСС при циррозе, вызванном аутоиммунным гепатитом, первичным склерозирующем холангитом у лиц обоего пола и алкогольном и первичном билиарном циррозе у женщин обычно низок. Не-цирротическая форма НСС может развиваться при циррозе вирусной природы, но абсолютный риск этого низок (доказательство IIb).
- Наблюдение должно включать УЗИ брюшной полости каждые 6 месяцев в сочетании с оценкой сывороточного содержания AFP (доказательство степени III, рекомендация степени B). УЗИ брюшной полости должно проводиться с использованием соответствующей аппаратуры и врачом опытным в обследовании пациентов с циррозом (доказательство степени IIb, рекомендация степени B).
- При проведении наблюдения пациент должен быть поставлен в известность о значении ранней диагностики и отсутствии доказанных преимуществ в выживаемости.
Диагностика НСС
- Очаговые изменения в печени у пациента с циррозом с высокой вероятностью являются HCC (доказательства степени IIa).
- Первичным методом диагностики должна быть спиральная компьютерная томография (СТ) печени (для оценки местного распространения) и грудной клетки (метастазы) (доказательство степени IIа, рекомендация степени B).
- Магнитно-резонансная томография (MRI) с контрастным усилением или ангиография с введением липидола и последующей СТ могут улучшить точность диагностики других видов патологии печени (доказательство степени III, рекомендация степени C).
- Биопсия редко необходима для диагностики НСС, а рассеивание клеток опухоли по ходу иглы встречается в 1-3 % случаев. Выполнение биопсии потенциально операбельных опухолей должно избегаться по мере возможности (доказательство степени IIa, рекомендация степени B).
Лечение НСС
Единственным потенциально радикальным методом лечения НСС остается хирургический, либо резекция печени, либо пересадка печени. Пациенты с одиночным мелким очагом НСС ( 5 cm) или с не более чем тремя очагами 3 cm должны рассматриваться в качестве кандидатов на такое лечение.
- Возможность пересадки печени должна рассматриваться у любого пациента с циррозом и маленькой (5 см или менее при одиночной опухоли не более чем тремя очагами размером 3 см или менее) HCC (доказательство степени IIa, рекомендация степени B).
- Пациенты с HBV в стадии репликации имеют худший прогноз из-за рецидива HBV и ранее не рассматривались в качестве кандидатов на трансплантацию. В настоящее время существует эффективная антивирусная терапия и такие пациенты с маленькой НСС, согласно данному выше определению, должны рассматриваться в качестве кандидатов на трансплантацию (доказательство степени IIa, рекомендация степени B).
- Резекция печени должна рассматриваться в качестве первичного метода лечения у любого пациента с НСС и отсутствием цирроза печени (включая фиброламеллярный вариант) (доказательство степени IIa, рекомендация степени B).
- Резекция может быть произведена у избранной группы пациентов с циррозом и хорошо сохранившейся функцией печени (Чайлд-Пью A), которые не подходят для пересадки печени. Такие операции несут в себе высокий риск послеоперационной декомпенсации и должны проводиться в отделениях с опытом в выполнении резекции печени и лечении печеночной недостаточности (доказательство степени IIa, рекомендация степени B).
Не хирургическое лечение
Не хирургическое лечение должно использоваться только когда хирургическое лечение не возможно.
- Чрескожное введение этанола (PEI) вызывает некроз мелких очагов HCC. Оно лучше всего подходит для периферически-расположенных очагов менее 3 см в диаметре (доказательство степени IIb, рекомендация степени B). Радиочастотная абляция может быть хорошей альтернативой введению этанола, но в настоящее время существуют ограниченные данные по ее использованию (доказательство степени IIb).
- Хемоэмболизация может вызвать некроз опухоли и, как было продемонстрировано, положительно влияет на выживаемость в избранной группе пациентов с хорошими резервными возможностями печени. Хемоэмболизация с использованием липидола является эффективной терапией болевого синдрома или кровотечения ассоциированных с НСС (доказательство степени IIa, рекомендация степени B).
- Системная химиотерапия стандартными препаратами дает плохие результаты и должна использоваться только при испытании новых препаратов (доказательство степени I, рекомендация степени А).
- Гормонотерапия тамоксифеном не продемонстрировала повышение выживаемости при проведении контролируемых исследований (доказательство степени I, рекомендация степени А).
Базовые данные
Эпидемиология НСС
НСС является причиной примерно 1500 смертей в год в UK. Существуют надежные данные из США, о росте частоты встречаемости НСС [1]. Национальный институт рака, на основе данных девяти центров регистрации рака, сообщает о 41 % росте смертности от первичного печеночно-клеточного рака в период между 1980 и 1995 годом, в сочетании с ростом частоты его встречаемости на 70 %. Сходные, хотя и менее «сильные» доказательства этого появляются и в UK [2]. HCC является необычным представителем рака у человека т.к. при нем этиологический момент ответственный за развитие болезни обычно легко определяется. Распространение НСС в мире находится в параллельных взаимоотношениях с распространенностью вирусных гепатитов и большинство ее случаев связанно с HBV и HCV. Увеличение частоты НСС в развитых странах, вероятно, является прямым результатом эпидемии HCV произошедшей в данной популяции 20-30 лет назад [5]. Другими этиологическими факторами являются алкоголь, наследственный гемахроматоз и редко, первичный билиарный цирроз. У до 40 % пациентов в UK НСС диагностируется как первое проявление лежащей в ее основе болезни печени, тогда как в Японии 80 % НСС диагностируется на бессимптомной стадии путем скрининга пациентов с ранее диагностированным циррозом [4].
Факторы риска развития НСС
Пол
Риск развития НСС гораздо больше у мужчин при большинстве этиологических факторов [5]. Это не зависит от факта, что мужчины имеют большую вероятность развития хронического HBV, чем женщины. Инфекция HCV является относительным исключением из этого правила т.к. при ней соотношении мужчин и женщин составляет 1,2:1 по сравнению с 1,9:1 для HBV. Причины этого не ясны [6].
Возраст
Средний возраст возникновения НСС в UK составляет 66 лет, что, возможно, отражает медленное развитие большинства приводящих к появлению опухоли заболеваний. Эта опухоль редко встречается в возрасте моложе 45 лет в регионах с низким уровнем HBV инфекции. В областях с высоким уровнем HBV гепатоцеллюлярная карцинома имеет бимодальное распределение по возрасту, с пиками в 45 и 65 лет [7].
Наличие цирроза печени
Цирроз встречается у подавляющего большинства пациентов с НСС: Его частота оценивается в 90-95 % [8,9]. Не ясно является ли цирроз сам по себе биологически важной стадией в процессе туморогенеза или развитие опухоли и фиброгенез происходят одновременно, но для развития фиброза требуется меньший период времени. Нецирротическая НСС возникает у молодых пациентов (фиброламеллярный вариант) и у очень пожилых (явный de novo HCC). Фиброламеллярный вариант HCC имеет одинаковое распространение среди мужчин и женщин и диагностируется, в среднем, в возрасте 30 лет [10]. Нецирротический НСС развивается у пациентов с вирусными заболеваниями печени, в особенности HBV [11], когда определенную роль играет прямая интеграция вируса в ДНК хозяина [12]. Нецирротическая HCC описана и у больных с HCV [13] или гемахроматозом [14], но встречается редко.
Этиология заболевания печени
Наблюдение за пациентами с циррозом печени различной этиологии продемонстрировало значительную разницу в степени риска развития НСС. Вирусная инфекция HBV или HCV связанна с высоким риском НСС, у пациентов с циррозом вследствие любой из этих инфекций примерный риск развития НСС составляет 3-5 % в год [15,16]. Некоторые исследования показали даже более высокую степень риска, до 12 %, у пациентов с HBV инфекцией [17], но эти цифры могут отражать особенности отбора больных, таковые с более тяжелым заболеванием печени имеют и большую степень риска. Существуют убедительные доказательства, что при HCV инфекции НСС развивается с высокой частотой на далеко зашедших стадиях лежащего в основе ее возникновения заболевания печени [18]. У до 30 % пациентов подвергшихся пересадки печени по поводу HCV цирроза конечной стадии в удаленной печени выявлена не диагностированная НСС [19].
При циррозе не вирусной этиологии степень риска возникновения НСС также зависит от его причины. Пациенты с циррозом в результате наследственного гемахроматоза и высокой концентрацией железа имеют очень высокий риск развития НСС (7-9 %) в год [20]. Риск снижается при проведении венсекции (1-3 % в год), но не до базового уровня [21]. В отличие от этого, пациенты с циррозом в результате аутоиммунного гепатита имеют очень низкий риск развития НСС. Описания НСС в этой группе больных встречается в литературе редко, несмотря на значительное количество пациентов с циррозом находящимся под длительным наблюдением. В случаях, когда развитие НСС все же описано, коинфекция HCV может рассматриваться в качестве важного дополнительного фактора [22]. Алкогольный цирроз связан с повышенным риском развития НСС. Степень этого риска трудно установить т.к. смертность от продолжения приема алкоголя и сердечно-сосудистых заболеваний в этой группе больных очень высока. Доступные данные показывают, что воздержания от алкоголя (после развития цирроза) не снижает риск возникновения НСС и развитие опухоли наблюдается с частотой 1-4 % в год у мужчин с циррозом данной этиологии, что сходно с уровнем отмеченным при HBV или HCV инфекции [23,24]. Риск возникновения НСС у женщин с циррозом алкогольной этиологии трудней установить, но согласно нескольким сообщениям в литературе он значительно ниже [24]. Первичный билиарный цирроз несет в себе риск развития НСС, но исследования, посвященные количественной его оценки редки. В любом случае, доступные данные свидетельствуют, что женщины, даже с диагностированным циррозом имеют низкий риск НСС, но у мужчин риск соответствует такому при алкогольном циррозе [25,26]. Болезнь Вильсона встречается редко, но все больше пациентов доживают до взрослого возраста с уже существующим циррозом печени. Случаи развития НСС при данной патологии широко описаны, несмотря на адекватную терапию, направленную на снижение уровня меди, хотя действительный уровень риска сложно установить [27].
Естественное течение НСС
НСС развивается как мелкие узлы. Больший период их развития происходит в бессимптомную фазу, которая может занимать несколько лет. Оценочное время удвоения размеров опухоли при НСС варьирует от 1 до 19 месяцев [28,29] и в среднем составляет 6 месяцев. Есть предположения, что опухоли определенной этиологии могут иметь более агрессивную модель роста, но данных подтверждающих это недостаточно. Данные, посвященные выживаемости не леченых пациентов с НСС, показывают, что основными факторами, влияющими на выживаемость, являются тяжесть фоновой патологии печени и размер опухоли на момент диагностики. Между 50 % и 90 % больных с циррозом степени А по Чайлду-Пью без лечения выживают год, по сравнению с только 20 % при степени С [29-31]. Маленькие НСС на момент диагностики имеют относительно меньшую скорость удвоения размеров опухоли и выживаемость без лечения при опухолях менее 5 см в течение года составляет 81–100%, а в течение 3-х лет 17–21% [29,32]. Этот факт свидетельствует, что ранняя диагностика дает больше возможностей для лечения.
Потенциальные скрининговые тесты для НСС
AFP, нормальный протеин сыворотки синтезируемый эмбриональными клетками печени и клетками желтого мешка, является наиболее изученным скрининговым тестом, используемым в качестве опухолевого маркера на НСС. Нормальным уровнем AFP является 10–20 ng/ml и уровень выше 400 ng/ml обычно рассматривается как диагностический. Однако при 2/3 НСС размером меньше 4 см уровень AFP ниже 200 ng/ml и до 20 % НСС не продуцируют AFP, даже когда достигают крупных размеров [33]. При НСС может происходить модификация AFP за счет различных карбогидратных соединений, что может быть выявлено за счет измененной структуры связей лектина. Эти изменения обусловили разработку альтернативных диагностических тестов [34], но не один из них не является широко доступным или показавшим значительные диагностические преимущества над AFP. Дез-гамма-карбокси протромбин используется в качестве альтернативного опухолевого маркера при НСС, у 67 % пациентов с НСС наблюдается повышение его уровня, но он повышен только в 8 % случаев маленьких (менее 2-х см) опухолей [35] за счет чего этот тест не получил широкого распространения. При проведении теста с помощью AFP могут наблюдаться и ложно положительные результаты, его уровень в пределах 20–250 ng/ml часто встречается при регенеративных узлах при циррозе вирусной этиологии [36]. Повышение AFP в течение длительного периода времени является важным диагностическим показателем, даже если его уровень не достигает 400 ng/ml.
УЗИ при крупных НСС обладает высокой диагностической чувствительностью и специфичностью. Оно хуже выявляет более мелкие опухоли, обнаружение которых необходимо для проведения имеющих лучший прогноз лечебных вмешательств. Опыт врача и наличие необходимой аппаратуры являются важными факторами позволяющими улучшить диагностический потенциал УЗИ и где вышеперечисленное доступно ультрасонография выявляет 85-95 % патологических очагов 3-5 см в диаметре и может достигать 60-80 % чувствительности в выявлении опухолей менее 1 см [37,38]. В настоящее время в UK выявление патологических очагов размером менее 2х см на УЗИ встречается редко.
Комбинированное использование AFP и УЗИ улучшает диагностику. Изначально УЗИ скрининг планировался проводиться с частотой один раз в 6 месяцев, основываясь на времени удвоения размеров опухоли. Существуют доказательства, что более частое обследование может повысить чувствительность метода, но за счет роста числа ложно положительных результатов [39,40]. Пациенты с отрицательными данными УЗИ и повышенным, но не до диагностического уровня AFP являются группой высокого риска и более частое выполнение УЗИ в этой группе, возможно с частотой 3 раза в месяц, может улучшить качество диагностики [38].
Исследования скрининга при НСС
Не существует рандомизированных контролируемых исследований скрининга НСС развивающейся при циррозе любой этиологии. Очень маловероятно, что какое-либо рандомизированное исследован такого типа может быть предпринято в настоящее время т.к. наблюдение за пациентами с циррозом является широко принятым подходом и было бы практически невозможным найти больных в группу не проходящих скрининг в таком исследовании.
В отсутствии таких данных практические подходы базируются на результатах не рандомизированных исследований скрининга в популяции высокого риска или данных госпитальных исследований.
Существует несколько работ демонстрирующих скрининговые возможности применения либо только AFP или, более часто, комбинации AFP и УЗИ. Наиболее крупное исследование методов скрининга было проведено среди населения Аляски, где наблюдается высокий уровень HBV. Скринингу подвергались все члены популяции с положительным тестом на поверхностный антиген гепатита В (HBsAg), вне зависимости от наличия репликации вируса. Результаты этого исследования показали, что с 1982 по 1998 было проведено 18 299 тестов на AFP у 2230 индивидуумов с положительным HBsAg. У 20 пациентов развилась НСС, пять из них были неоперабельны на момент диагностики, у 14 выполнена резекция печени, но у 6 возник рецидив [41]. Похожее исследование у больных с HBV, у только 4 % из которых был доказанный цирроз, выявило 14 случаев рака среди 1069 пациентов подвергавшихся скринингу, у 6 из которых были выполнены радикальные хирургические вмешательства [42]. Проведенные проспективные исследования пациентов с циррозом вирусной этиологии с использованием УЗИ и определения уровня AFP показали, что 64–87% выявленных опухолей было одиночными и 43–75% были равны или менее 3 см в диаметре [43, 46]. В этих исследованиях, в 29–66% случаях выявленного рака, было проведено хирургическое вмешательство с радикальной целью. Эти исследования не вполне соответствуют ситуации в UK т.к. только небольшое количество центров имеют возможность выполнять пересадку печени как один из лечебных подходов.
Диагностические тесты на НСС
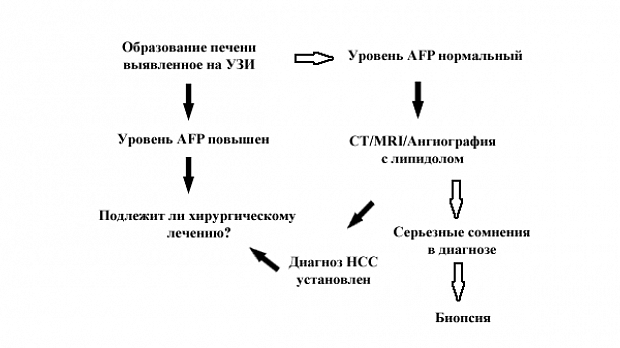
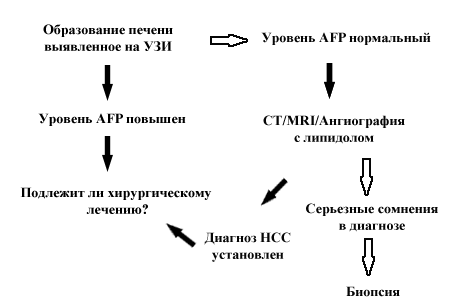
Когда у пациента выявляется образование печени, вне зависимости от скрининга, необходимо установить диагноз и стадию заболевания. Наиболее частым клиническим сценарием является обнаружение образования печени на УЗИ при повышенном или нормальном уровне AFP. Если известно, что у пациента есть цирроз печени и образование больше 2 см в диаметре, то шансы на то, что оно является НСС достигают 95 % [47, 48]. Если уровень AFP также повышен, это подтверждает диагноз и дальнейшие исследования требуются только для установления наиболее рационального терапевтического подхода (рис. 1).
Если уровень AFP нормальный то дальнейшее обследование с помощью СТ, MRI или ангиографии с последующей СТ обычно позволяет поставить точный диагноз [49-51] и перейти к определению тактики лечения без необходимости в выполнении биопсии. В небольшом числе случаев, когда присутствуют реальные диагностические сомнения, может быть показана биопсия. В редкой ситуации, когда выявляется маленькое образование (менее 2-х см в диаметре) на УЗИ уровень уверенности, что оно является НСС меньше, возможно 75 % таких образований оказывается НСС [52]. Опять, другие радиологические исследования или повышенный уровень AFP могут помочь в установлении диагноза. Если вышеназванные методы не помогают, то показаны либо повторное обследование с целью выявления роста образования, или чреcкожная аспирационная биопсия тонкой иглой, или биопсия [53]. Риск рассеивания клеток НСС (при проведении биопсии) похоже, не зависит от размера опухоли [54] и при операбельности больного выполнение биопсии должно по возможности избегаться.
У пациента без цирроза, когда обычно первичной находкой является образование печени, начальным диагностическим тестом должно быть определение уровня АFP. Его повышение, при отсутствии первичной опухоли яичек, подтверждает диагноз. Если опухоль потенциально операбельна, то может потребоваться биопсия печени вне опухоли для определения дальнейшей тактики. Если уровень AFP нормальный, то поиск других причин (внепеченочная первичная опухоль) и дальнейшее радиологическое обследование являются оправданными. Если результаты обследования указывают на НСС, биопсия печени вне опухоли поможет определению типа планируемой операции. Радиологические исследования могут исключить доброкачественное поражение печени с большим уровнем чувствительности и специфичности [51, 52, 54]. Только в ситуациях, когда существует высокий уровень сомнений в диагнозе, показана биопсия опухоли.
Радиологические исследования включающие УЗИ, СТ и ангиографию обычно устанавливают более низкую (чем в реальности) стадию заболевания [54, 55, 56]. Это, однако, имеет небольшое значение при отборе пациентов для трансплантации печени т.к. не смотря на такое недостадирование, исследования показали, что прогноз связан с результатами предоперационного радиологического обследования опухоли более чем с действительной стадией заболевания установленной при исследовании удаленного органа [55,56]. Однако, в отношении резекции печени ситуация сложней т.к. более крупная опухоль не может быть вылечена более обширной резекцией.
Появление контрастных агентов применяемых при УЗИ и улучшение технологии выполнения MRI с использованием контрастных агентов на основе железа или gadolinium может улучшить диагностику сателитных или вторичных отдаленных патологических очагов в печени [57, 58]. Точная роль этих видов исследования в планировании лечения не ясна и тем временем как в ближайшем будущем они могут вызвать значительные сдвиги в радиологической диагностике НСС, в настоящий момент их использование должно рассматриваться как экспериментальное.
Пересадка печени или резекция для пациентов с НСС и циррозом
Не существует рандомизированных контролируемых исследований сравнивающих результаты резекции и пересадки печени при НСС. Оба технических подхода были в основном изучены на основе пациентов с маленькой унифокальной опухолью и только небольшая часть пациентов с НСС в UK будут подходить для любого из этих потенциально радикальных лечебных подходов. Решение о том, какой вид операции выбрать зависит от местной доступности и индивидуальных свойств опухоли.
Ранние результаты трасплантации печени по поводу НСС были плохими [59-61] с цифрами пятилетней выживаемости значительно ниже 50 %, в основном из-за рецидива опухоли. В настоящее время ясно, что это было обусловлено не правильным отбором пациентов на трансплантацию. Точно установлено, что больные с одиночным патологическим очагом до 5 см в диаметре или тремя очагами менее 3 см в отсутствии сосудистой инвазии, по данным визуальных методов исследования, имеют практически нулевой уровень рецидива НСС. После трансплантации прогноз у них сходен с таковым у больных подвергшихся трасплантации по поводу цирроза печени без НСС [62,63,64].
Резекция печени при НСС является хорошей альтернативой с цифрами непосредственной выживаемости очень сходными с таковыми при трансплантации [60,61,65-69]. Однако после трех лет наблюдения отмечается явное преимущество трансплантации в отношении выживаемости без рецидива опухоли [66,69]. Резекция применима только у пациентов с отличной функцией печени (Чайлд-Пью A) из-за риска послеоперационной декомпенсации. Смертность в ранние сроки после операции, выполненной в центрах обладающих большим опытом, колеблется от 6 % до 20 % в зависимости от объема резекции и тяжести нарушения функций печени перед операцией [70-73]. Большинство случаев ранней смертности связанно с печеночной недостаточностью. Оставшаяся после резекции часть печени продолжает нести в себе злокачественный потенциал. Уровень рецидива через 5 лет наблюдения после резекции в 50-60 % обычен [74,75] и большинство случаев этих рецидивов являются внутрипеченочными, представляя собой либо сателитные узлы, либо возникшую do novo вторую опухоль. Маленькие сателитные узлы обычно не выявляются при проведении предоперационного обследования и УЗИ во время операции может помочь в их выявлении и определении границ резекции [76].
Фиброламеллярный вариант HCC имеет совершенно отличную биологию и развивается в не цирротической печени. Следовательно, резекция печени по поводу этого типа опухоли менее вероятно вызовет печеночную недостаточность. Общая пятилетняя выживаемость для фиброламеллярной гепатомы составляет 25–36% [77,78]. Т.к. она возникает без предшествующего заболевания печени, фиброламеллярная гепатома обычно выявляется уже на уровне появления симптомов и, хотя резекция и может быть предпринята, часто наблюдается сосудистая инвазия или вовлечение в процесс диафрагмы. Уровень выживаемости после резекции варьирует от 65 % до 12,5 % [79,80]. Пересадка печени, выполненная по поводу фиброламеллярной гепатомы, дает уровень пятилетней выживаемости в 28-49 % [81,82]. Однако рецидив опухоли встречается относительно часто, и резекция печени остается основным методом лечения этой редко встречающейся патологии, в особенности в регионах, где наблюдается нехватка донорских органов.
Около 7 % гепатоцеллюлярного рака, исключая фиброламеллярный вариант развивается без цирроза. Как и в случае фиброламеллярной опухоли эти образования обычно диагностируются на симптомной, запущенной стадии. Общая выживаемость при них имеет тенденцию быть более продолжительной, чем при опухолях развивающихся на фоне цирроза и пятилетняя выживаемость после резекции печени составляет около 25 % [83]. Пересадка печени предпринимается при крупных опухолях, когда выполнение резекции невозможно, но ее результаты неудовлетворительны. В обзоре, включавшем 77 пациентов подвергшихся пересадки печени по поводу нецирротической НСС сообщалось об уровне пятилетней выживаемости в 11 % [84]. Такие плохие цифры выживаемости указывают на то, что резекция печени должна оставаться основным методом лечения, а трансплантация в этих условиях может применяться только в редких случаях.
Вероятно, у пациентов с циррозом свою роль имеют как резекция, так и трансплантация печени. В регионах мира, где снабжение донорскими органами не может удовлетворить существующие потребности резекция может широко использоваться. Трансплантация возможно дает лучшие шансы на извлечение больным с маленькими опухолями на фоне цирроза и следовательно является терапией выбора, даже при циррозе А по Чайлду-Пью. В UK в настоящее время пациенты, нуждающиеся в трансплантации, получают это лечение без значительных задержек и, следовательно, возможность трансплантации должна рассматриваться во всех подходящих случаях. Любой пациент с одиночной маленькой опухолью (5 cм или менее) должен быт обследован в хирургическом центре где возможно выполнение резекции или трансплантации печени.
Абляция
Несколько не оперативных методик используются в клинических условиях для лечения НСС – чрескожная абляционная терапия широко описана и наиболее часто проводиться с помощью введения этанола. Радиочастотная абляция является относительно новым техническим подходом, при котором высокочастотный ультразвуковой зонд, обычно под УЗИ контролем, вводиться в образование печени. Ряд исследований показали, что некроз опухоли может быть достигнут с использованием обоих технических подходов с низким уровнем смертности и осложнений. Не существует рандомизированных контролируемых исследований сравнивающих введение алкоголя и радиочастотную абляцию или любой из этих подходов с хирургическим лечением и оценка литературных данных проводиться на основе сравнения исследований посвященных каждой методики в отдельности.
Хотя не найдены рандомизированные контролируемые исследования посвященные PEI существует обширная литература по использованию этой методики при НСС. В крупных работах полное разрушение опухолей размером менее 3-х см было достигнуто в 75 % случаев с пятилетней выживаемостью в 35-75 % [85-88]. Эти исследования обычно выполнялись у пациентов с хорошо сохранившейся функцией печени. В крупнейшей из этих работ (746 больных) сообщалось о трехлетней выживаемости в 79 % и пятилетней в 47 % у больных с циррозом степени А по Чайлду-Пью (239 человек) и в 63 % и 29 % соответственно у больных с циррозом степени В по Чайлду-Пью (149 человек) [88]. Это исследование было ограничено пациентами с диаметром опухоли менее 5 см. В работах выполненных в Европе и Азии наблюдался схожий уровень выживаемости. Существует одна проблема в интерпретации данных этих исследований – игольная или аспирационная биопсия не была выполнена во всех из них. Этот факт мог внести существенную ошибку в результаты работ с большим количеством опухолей менее 2 см в диаметре, из-за ошибки в диагностике. Возможно и лечение более крупных и множественных патологических очагов, но это часто требует нескольких сеансов вмешательства под общей анестезией, однако в этом случае рецидив возникает в более чем 50 % случаев в сроки до одного года и только 10 % опухолей размером 3-4 удается полностью разрушить [89]. Этот вариант лечения очень сложен при опухолях поражающих задние сегменты печени [90]. Осложнения редки, но рассеивание клеток опухоли по ходу иглы происходит в 3 % случаев [91], а серьезные повреждения желчевыводящих путей в 1 % случаев [86,92]. Наиболее крупная работа, в которой сообщалось о наличии осложнений, включала 1066 больных [92]. Среднее число процедур необходимое для достижения деструкции НСС составляло 6,7. Сообщалось об одной смерти (0,09%) и 34 осложнениях (3,2 %) включающих 8 кровотечений и 7 случаев рассеивания опухолевых клеток. Боль после инъекции этанола требующая прекратить лечение возникла в 3,2 % случаев.
Сравнение с другими методами лечения сложно. В большинстве опубликованных работ, в которых проводилось сравнение с предшествующими результатами, была продемонстрирована незначительная разница в 5 летней выживаемости между больными после резекции или трансплантации печени и чрескожного введения алкоголя (при опухолях менее 3х см в диаметре). Исследование включавшее 260 опухолей размером менее 5 см и циррозом степени А по Чайлду-Пью продемонстрировало 3 летнюю выживаемость в 79 % при использовании хирургического лечения и 71 % при проведении PEI по сравнению с только 26 % у пациентов не получавших лечение [93]. В других клиниках были получены сходные результаты [94]. В большинстве клиник хирургическое вмешательство все еще рассматривается в качестве терапии выбора т.к. оно дает шанс на полное излечение, но PEI является наилучшим лечением для маленьких неоперабельных НСС.
Были выполнены экспериментальные работы, в которых для разрушения опухоли использовались другие агенты (цис-платина, холодная уксусная кислота), но по настоящее время не одно из них не показало убедительных преимуществ перед этанолом [95,96].
Радиочастотная абляция НСС является относительно новым техническим подходом, который заключается в установке ультразвукового зонда в опухолевую ткань, обычно через кожу, затем генерируется высокочастотная ультразвуковая волна, вызывающая нагревание кончика зонда и разрушение тканей [97-100]. Одиночный зонд может быть использован для разрушения опухоли до 3 см в диаметре, а многоконечные зонды использовались для деструкции опухолей до 6 см в диаметре. В работе включавшей 149 опухолей пролеченных чрескожно или путем открытой операции при среднем диаметре опухоли в 3,5 см уровень местного рецидива на 19-й месяц после вмешательства составил 3,6 %, причем изначально все узлы были полностью разрушены [101]. Отдаленные метастазы или развитие второй опухоли произошло в 46 % случаев. Более крупные опухоли также могут подвергаться радиочастотной абляции – в наиболее крупном исследовании, включавшем 126 пациентов с НСС более 3 см в диаметре, полный некроз опухоли достигнут в 47 % случаев [102]. Данных об отдаленных результатах у больных с более крупными опухолями недостаточно.
Сравнение результатов у 112 пациентов пролеченных чрескожным введением этанола или радиочастотной абляцией показало, что у 47 из 52 больных из группы радиочастотной абляции наблюдался полный некроз опухоли, что потребовало, в среднем, проведения 1,2 процедуры, по сравнению с 48 из 60 и 4,8 процедуры при инъекции алкоголя [103]. Авторы считают, что радиочастотная абляция более эффективна, но и имеет больший процент осложнений. Не опубликованные данные указывают на возможно более высокий уровень рассеивания опухолевых клеток. Необходимы рандомизированные исследования сравнивающие введение алкоголя с радиочастотной абляцией.
Эмболизация/хемоэмболизация
Хемоэмболезация широко используется в качестве основной терапии при неоперабельной НСС. Литературу по данному вопросу сложно интерпретировать и сравнивать т.к. используются различные технические подходы и пациенты получающие данное лечение часто находятся на очень запущенных стадиях заболевания когда как риск так и возможный положительный эффект терапии могут быть наиболее выражены.
Начальный интерес к радиологическим методикам, позволяющим деваскулирезировать опухоль, возник в 1970-х [104]. Существуют надежные доказательства, что деваскуляризация может уменьшать размер опухоли [105, 106] и использоваться для лечения кровотечения или болевого синдрома при НСС [107,108]. Все 6 ранних рандомизированных исследования посвященных хемоэмболизации в качестве первичного лечения НСС [109-114] не продемонстрировали увеличение выживаемости, хотя наблюдалось уменьшение размеров опухоли.
Все эти исследования включали в основном пациентов с крупными опухолями и тяжелым фоновым заболеванием печени, которое возможно маскировала преимущества лечения. Существуют свидетельства, полученные из не контролируемых исследований, что НСС более мелкого размера лучше отвечают на хемоэмболизацию [106]. Это было недавно подтверждено в работе изучавшей использование повторной хемолэмболизации липидолом и доксирубицином по сравнению с артериальной эмболизации без химиотерапии у пациентов с маленькой опухолью и хорошей функцией печени [115]. У 38 пациентов получавших хемоэмболизацию выживаемость была 63 % через два года после вмешательства по сравнению с 50 % (n=34) в группе эмболизации и 27 % (n=35) в группе лиц не получавших лечение. Это исследование подтвердило роль хемоэмболизации в лечении НСС, но его результаты применимы только к относительно небольшой группе пациентов, при подготовки исследования были обследованы 903 человека, а включено в него только 107 [112]. Это было подвержено в дальнейших рандомизированных исследованиях [116]. Также ясно, что пациенты с хорошим ответом на повторную хемоэмболизацию вероятнее всего имеют высокие шансы хорошего ответа и на абляционную терапию и, следовательно, в настоящее время требуются рандомизированные исследования, сравнивающие эти два подхода.
Побочными эффектами хемоэмболизации являются таковые используемых химиопрепаратов (обычно доксирубицин) в дополнении к осложнениям эмболизации артерии (боль, лихорадка, декомпенсация функций печени и, редко, инфаркт других органов) [117,118]. Серьезные осложнения возникают у 3-5 % пациентов. В небольшом числе работ комбинировались химиоэмболизация и введение этанола [119-121]. В настоящее время не существует данных позволяющих поддержать эту комбинацию.
Гормональное лечение тамоксифеном являлось предметом рандомизированных исследований. Начальные данные о положительном влиянии такого лечения на выживаемость у пациентов с неоперабельной НСС [122,123] не подтвердились в более крупных рандомизированных исследованиях [124-126]. Другие гормональные агенты (stilbestrol и flutamide) так же использовались при НСС, но доказательств их эффективности не существует. Некоторые авторы полагают, что гормонотерапия может быть эффективна в случае известного статуса эстрогеновых рецепторов [127-129] это вопрос является областью, в которой необходимы дальнейшие клинические испытания.
Внутривенная химиотерапия имеет очень ограниченную роль при лечении НСС. Наилучшей мототерапией является лечение доксирубицином с уровнем ответа в 10-15 % [130,131]. Более агрессивные режимы химиотерапии не только не улучшают результат, но и могут даже вызвать уменьшение сроков выживаемости пациентов [132, 133]. Все препараты, применяемые для химиотерапии при НСС, должны назначаться только в условиях клинических испытаний.
Терапия интерфероном может играть определенную роль в профилактике НСС у больных с циррозом вызванным гепатитом С. Существует теоретическая основа для такого лечения т.к. интерферон альфа имеет широкий спектр противоопухолевой активности и является апробированным методом лечения некоторых онкологических заболеваний крови. Первые работы, как из Японии так и Европы, продемонстрировали меньший риск развития НСС в группе пациентов с циррозом на фоне гепатита С получавших лечение интерфероном по сравнению с не леченными больными [134-137]. Этот результат был не зависим от антивирусного эффекта интерферона альфа, и уже наблюдался при сроках лечения в 3 месяца. Эти исследования не являлись рандомизированными и контролируемыми и носили в себе некоторую предвзятость. Существуют другие данные об отсутствии влияния интерферона на частоту развития опухоли [138, 139] и такая терапия, направленная на предупреждение развития опухоли в настоящее время может быть рекомендована только в качестве клинических испытаний. Используются и два других подхода к предупреждению развития опухоли – ретинойды и адаптивная иммунотерапия. Оба эти подхода использовались с целью предупреждения развития второй опухоли после резекции первичной опухоли или абляционной терапии. Адоптивная иммунотерапия с использование периферических лимфоцитов позволила значительно увеличить время выживания без рецидива [140]. Ретинойды и соединения участвующие в метаболизме витамина А являются веществами индуцирующими дифференцировку и обладающими гипопролиферативным эффектом. Одиночное исследование, посвященное использованию ретинола, продемонстрировало 20 % снижение в частоте развития вторичной опухоли у пациентов пролеченных чрескожным введением этанола [141]. Необходимы дальнейшие исследования в этой области.
Интерферон использовался и для лечения НСС, а не лежащей в основе вирусной инфекции. В первом рандомизированном исследовании использование высоких доз интерферона альфа привело к улучшению показателей выживаемости [142], но более свежее рандомизированное исследование с применением более привычных дозировок интерферона альфа не продемонстрировало повышение выживаемости и сопровождалось высокой частотой возникновения побочных эффектов [143].
Одиночное рандомизированное исследование терапии октреотидом при НСС показало повышение выживаемости [144]. 58 пациентов были рандомизированны на октреотид 250 µg два раза в день или отсутствие лечения. Средняя продолжительность жизни в группе получавшей лечение составило 13 месяцев по сравнению с 4 в контрольной группе. Так же наблюдался значительный эффект на уровень AFP. Последующее исследование, включавшее 70 пациентов получавших октреотид длительного времени действия, не продемонстрировало достоверного увеличения выживаемости, повышения качества жизни или влияния на уровень AFP [145]. Необходимо продолжить изучение октреотида и его аналогов длительного действия при НСС.
Список литературы:
- El-Serag HB, Mason AC. Rising incidence of hepatocellular carcinoma in the United States. N Engl J Med 1999;340:745–50.
- Taylor-Robinson SD, Foster GR, Arora S, et al. Increase in primary liver cell cancer in the UK, 1979–1994. Lancet 1997;350:1142–3.
- Okuda K, Fujimoto I, Hanai A, et al. Changing incidence of hepatocellular carcinoma in Japan. Cancer Res 1987;47:4967–72.
- Okuda K. Clinical presentation and natural history of hepatocellular carcinoma and other liver cancers. In: Okuda K, Tabor E, eds. Liver Cancer. New York: Churchill Livingstone, 1997:1–12.
- Bosch FX, Munoz N. Hepatocellular carcinoma in the world: epidemiological questions. In: Tabor E, Di Bisceglie AM, Purcell RH , eds. Etiology, Pathology and Treatment of Hepatocellular Carcinoma. The Woodlands, Texas: Portfolio, 1991.
- Lee CM, Lu SN, Changchien CS, et al. Age, gender, and local geographic variations of viral etiology of hepatocellular carcinoma in a hyperendemic area for hepatitis B virus infection. Cancer 1999;86:1143–50.
- Lee HS, Han CJ, Kim CY. Predominant etiologic association of hepatitis C virus with hepatocellular carcinoma compared with hepatitis B virus in elderly patients in a hepatitis B endemic area. Cancer 1993;72:2564–7.
- The Cancer of the Liver Italian Program (CLIP) Investigators. A new prognostic system for hepatocellular carcinoma: A retrospective study of 435 patients. Hepatology 1998;28:751–5.
- Grando-Lemaire V, Guettier C, Chevret S, et al. Hepatocellular carcinoma without cirrhosis in the West: epidemiological factors and histopathology of the non-tumorous liver. Groupe d’Etude et de Traitement du Carcinome Hepatocellulaire. J Hepatol 1999;31:508–13.
- Craig JR, Peters RL, Edmondson HA, et al. Fibrolamellar carcinoma of the liver: a tumour of adolescents and young adults with distinct clinicopathological features. Cancer 1980;46:372–9.
- Okuda K, Nakashima T, Sakamoto K. Hepatocellular carcinoma arising in noncirrhotic and highly cirrhotic livers: a comparative study of histopathology and frequency of hepatitis B markers. Cancer 1982;49:450–5.
- Chen DS, Hoyer BH, Nelson J. Detection and properties of hepatitis B viral DNA in liver tissues from patients with hepatocellular carcinoma. Hepatology 1982;2:42–6S.
- De Mitri MS, Puossin K, Baccarini P, et al. HCV-associated liver cancer without cirrhosis. Lancet 1995;345:413–15.
- Goh J, Callagy G, McEntee G, et al. Hepatocellular carcinoma arising in the absence of cirrhosis in genetic haemochromatosis: three case reports and review of literature. Eur J Gastroenterol Hepatol 1999;11:915–19.
- Sakuma K, Saito N, Kasai M, et al. Relative risks of death due to liver disease among Japanese male adults having various statuses for hepatitis B s and e antigen/antibody in serum: a prospective study. Hepatology 1988;8:1642–6.
- Tsukuma H, Hiyami T, Tanaka S, et al. Risk factors for hepatocellular carcinoma among patients with chronic liver disease. N Engl J Med 1993;328:1797–801.
- Tagger A, Donato F, Ribero ML, et al. Case-control study on hepatitis C virus (HCV) as a risk factor for hepatocellular carcinoma: the role of HCV genotypes and the synergism with hepatitis B virus and alcohol. Brescia HCC Study. Int J Cancer 1999;81:695–9.
- Shiratori Y, Shiina S, Imamura M. Characteristic difference of hepatocellular carcinoma between hepatitis B and C-viral infection in Japan. Hepatology 1995;22:1027–33.
- Faivre J, Forman D, Esteve J, et al. Survival of patients with primary liver cancer, pancreatic cancer and biliary tract cancer in Europe. EUROCARE Working Group. Eur J Cancer 1998;34:1103–9.
- Yang Q, McDonnell SM, Khoury MJ, et al. Hemochromatosis-associated mortality in the United States from 1979 to 1992: an analysis of Multiple-Cause Mortality Data. Ann Intern Med 1998;129:946–53.
- Niederau C, Fischer R, Purschel A, et al. Long-term survival in patients with hereditary hemochromatosis. Gastroenterology 1996;110:1107–19.
- Ryder SD, Koskinas J, Rizzi PM, et al. Hepatocellular carinoma complicating autoimmune hepatitis: role of hepatitis C virus. Hepatology 1995;22:718–22.
- Lee F. Cirrhosis and hepatoma in alcoholics. Gut 1996;7:77–85.
- Miyakawa H, Izumi N, Marumo F, et al. Roles of alcohol, hepatitis virus infection, and gender in the development of hepatocellular carcinoma in patients with liver cirrhosis. Alcohol Clin Exp Res 1996;20:91–4A.
- Loof L, Adami HO, Sparen P, et al. Cancer risk in primary biliary cirrhosis: a population-based study from Sweden. Hepatology 1994;20:101–4.
- Howel D, Metcalf JV, Gray J, et al. Cancer risk in primary biliary cirrhosis: a study in northern England. Gut 1999;45:756–60.
- Polio J, Enriquez RE, Chow A, et al. Hepatocellular carcinoma in Wilson’s disease. Case report and review of the literature. J Clin Gastroenterol 1989;11:220–4.
- Sheu JC, Sung JL, Chen DS. Growth rate of asymptomatic hepatocellular carcinoma and its clinical implications. Gastroenterology 1985;89:259–66.
- Barbara L, Benzi G, Galani S. Natural history of small untreated hepatocellular carcinoma in cirrhosis; a multivariate analysis of prognostic factors of tumour growth rate and patient survival. Hepatology 1992;16:132–7.
- Cottone M, Viridone R, Fusco G, et al. Asymptomatic HCC in Childs A cirrhosis. Gastroenterology 1989;96:1566–71.
- Columbo M, Sangiovanni A. The natural history of hepatocellular carcinoma. Ital J Gastroenterol 1992;24:95–9.
- Okazaki N, Yoshino M, Yoshida T, et al. Evaluation of the prognosis for small hepatocellular carcinoma based on tumour volume doubling time. Cancer 1989;63:2207–10.
- Alpert E. Human alpha-1 fetoprotein. In: Okuda K, Peters RL, eds. Hepatocellular Carcinoma. New York: Wiley, 1976:353–67.
- Taketa K, Endo Y, Sekiya C. A collaborative study for the evaluation of lectin-reactive alpfa-fetoprotein in early detection of hepatocellular carcinoma. Cancer Res 1993;53:5419–23.
- Leibman HA, Furie BC, Tong MJ. Des-gamma-carboxy (abnormal) prothrombin as a serum marker of primary hepatocellular carcinoma. N Engl J Med 1984;310:1427–31.
- Lok ASF, Lai CL. Alpha-fetoprotein monitoring in Chinese patients with chronic hepatitis B virus infection: role in the early detection of hepatocellular carcinoma. Hepatology 1989;9:110–15.
- Columbo M, de Franchis R, Del Ninnno E. Hepatocellular carcinoma in Italian patients with cirrhosis. N Engl J Med 1991;325:675–80.
- Okuda K. Early recognition of hepatocellular carcinoma. Hepatology 1986;6:729–38.
- Oka H, Kuriola N, Kim K. Prospective study of early detection of hepatocellular carcinoma in patients with cirrhosis. Hepatology 1990;12:680–7.
- Mima S, Sekiya C, Kanagawa H. Mass screening for hepatocellular carcinoma: experience in Hokkaido, Japan. J Gastroenterol Hepatol 1994;9:361–5.
- McMahon BJ, Alberts SR, Wainwright RB, et al. Hepatitis B-related sequelae. Prospective study of 1400 hepatitis B surface antigen positive Alaskan native carriers. Arch Int Med 1990;150:1051–4.
- Sherman M, Peltkian KM, Lee C. Screening for hepatocellular carcinoma in chronic carriers of hepatitis B virus: incidence and prevalence of hepatocellular carcinoma in a North American urban population. Hepatology 1995;22:432–8.
- Liaw Y-F, Tai D-I, Chu C-M, et al. Early detection of hepatocellular carcinoma in patients with chronic type B hepatitis. Gastroenterology 1986;90:263–6.
- Tanake S, Kitamura T, Nakanishi K, et al. Effectiveness of periodic checkup by ultrasonography for the early diagnosis of hepatocellular carcinoma. Cancer 1990;66:2210–14.
- Sheu J-C, Sung J-L, Chen D-S, et al. Early detection of hepatocellular carcinoma by real time ultrasonography. A prospective study. Cancer 1985;56:660–6.
- Solmi L, Primerano AMM, Gandolfi L. Ultrasound follow-up of patients at risk of hepatocellular carcinoma: results of a prospective study in 360 cases. Am J Gastroenterol 1996;91:1189–93.
- Frazer C. Imaging of hepatocellular carcinoma. J Gastroenterol Hepatol 1999;14:750–6.
- Kanematsu T, Sonoda T, Takenaka K, et al. The value of ultrasound in the diagnosis and treatment of small hepatocellular carcinoma. Br J Surg 1985;72:23–5.
- Bartolozzi C, Lencioni R, Caramella D, et al. Small hepatocellular carcinoma. Detection with US, CT, MR imaging, DSA, and Lipiodol-CT. Acta Radiol 1996;37:69–74.
- Saada J, Bhattacharya S, Dhillon AP, et al. Detection of small hepatocellular carcinomas in cirrhotic livers using iodised oil computed tomography. Gut 1997;41:404–7.
- Bizollon T, Rode A, Bancel B, et al. Diagnostic value and tolerance of lipiodol-computed tomography for the detection of small hepatocellular carcinoma: correlation with pathologic examination of explanted livers. J Hepatol 1998;28:491–6.
- Horigome H, Nomura T, Saso K, et al. Limitations of imaging diagnosis for small hepatocellular carcinoma: comparison with histological findings. J Gastroenterol Hepatol 1999;14:559–65.
- Das DK. Cytodiagnosis of hepatocellular carcinoma in fine-needle aspirates of the liver: its differentiation from reactive hepatocytes and metastatic adenocarcinoma. Diagn Cytopathol 1999;21:370–7.
- Huang GT, Sheu JC, Yang PM, et al. Ultrasound-guided cutting biopsy for the diagnosis of hepatocellular carcinoma-a study based on 420 patients. J Hepatol 1996;25:334–8.
- Rizzi PM, Kane PA, Ryder SD, et al. Accuracy of radiology in detection of hepatocellular carcinoma before liver transplantation. Gastroenterology 1994;107:1425–9.
- Achkar JP, Araya V, Baron RL, et al. Undetected hepatocellular carcinoma: clinical features and outcome after liver transplantation. Liver Transpl Surg 1998;4:477–82.
- Kanematsu M, Hoshi H, Yamada T, et al. Small hepatic nodules in cirrhosis: ultrasonographic, CT, and MR imaging findings. Abdom Imaging 1999;24:47–55.
- Tang Y, Yamashita Y, Arakawa A, et al. Detection of hepatocellular carcinoma arising in cirrhotic livers: comparison of gadolinium- and ferumoxides-enhanced MR imaging. AJR Am J Roentgenol 1999;172:1547–54.
- O’Grady JG, Polson RJ, Rolles K, et al. Liver transplantation for malignant disease: results in 93 consecutive patients. Ann Surg 1988;207:373–9.
- Iwatsuki S, Starzl TE, Sheahan DC, et al. Hepatic resection versus transplantation for hepatocellular carcinoma. Ann Surg 1991;214:221–9.
- Bismuth H, Chiche L, Adam R, et al. Liver resection versus transplantation for hepatocellular carcinoma in cirrhotic patients. Ann Surg 1993;218:145–51.
- Mazzaferro V, Regalia E, Doci R, et al. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med 1996;14:728–9S.
- McPeake JR, O’Grady JG, Zaman S, et al. Liver transplantation for primary hepatocellular carcinoma: tumour size and number determine outcome. J Hepatol 1993;18:226–34.
- Lovet JM, Bruix J, Fuster J, et al. Liver transplantation for small hepatocellular carcinoma: the tumour-node metastasis classification does not have prognostic power. Hepatology 1998;27:1572–7.
- Ringe B, Pichlmayer R, Witelkind C, et al. Surgical treatment of hepatocellular carcinoma: experience with liver resection and transplantation in 198 patients. World J Surg 1991;15:270–85.
- Tan KC, Rela M, Ryder S, et al. Experience of orhotopic liver transplantation and hepatic resection for hepatocellular carcinoma of less than 8cm in patients with cirrhosis. Br J Surg 1995;82:253–6.
- Michel J, Suc B, Fourtainier G, et al. Recurrence of hepatocellular carcinoma in cirrotic patients after liver resection or transplantation. Transplant Proc 1995;27:1799–800.
- Otto G, Heuschen U, Hoffman WJ, et al. Survival and recurrence after liver transplantation versus liver resection for hepatocellular carcinoma. Ann Surg 1998;227:424–32.
- Llovet JM, Fuster J, Bruix J. Intention to treat analysis of surgical treatment for early hepatocellular carcinoma: resection versus transplantation. Hepatology 1999;30:1434–40.
- Lai E, Fan S-T, Chu K-M, et al. Hepatic resection for hepatocellular carcinoma: an audit of 343 patients. Ann Surg 1995;221:291–8.
- Franco D, Capussotti L, Smadja C, et al. Resection of hepatocellular carcinomas. Results in 72 European patients with cirrhosis. Gastroenterology 1990;98:733–8.
- Kanematsu T, Takenada K, Matsumata T, et al. Limited hepatic resection effective for selected cirrhotic patients with primary liver cancer. Ann Sur 1984;199:51–6.
- Fan S-T, Lo C-M, Lai E, et al. Perioperative nutritional support in patients undergoing hepatectomy for hepatocellular carcinoma. N Engl J Med 1994;331:1547–52.
- Ouchi K, Matsubara S, Fukahara K, et al. Recurrence of hepatocellular carcinoma in the liver remnant after hepatic resection. Am J Surg 1993;166:270–3.
- Adachi E, Maneda T, Matsumata T, et al. Risk factors for intrahepatic recurrence in human small hepatocellular carcinoma. Gastroenterology 1995;108:768–75.
- Gouillat C, Manganas D, Berard P. Ultrasonically guided hepatic tumourectomy. J Am Coll Surg 1995;180:617–18.
- Wood WJ, Rawlings M, Evans H, et al. Hepatocellular carcinoma: importance of histologic classification as a prognostic factor. Am J Surg 1988;155:663–6.
- Soreide O, Czemiak A, Bradpiece H, et al. Characteristics of fibrolamellar hepatocellular carcinoma. A study of nine cases and a review of the literature. Am J Surg 1986;151:518–23.
- Nagorney DM, Adson MA, Weiland LH, et al. Fibrolamellar hepatoma. Am J Surg 1985;149:113–19.
- Vauthey J-N, Klimstra D, Franceschi D, et al. Factors affecting long-term outcome after surgical resection for hepatocellular carcinoma. Am J Surg 1995;169:28–35.
- Ringe B, Wittekind C, Weinmann A, et al. Results of hepatic resection and transplantation for fibrolamellar carcinoma. Surg Gynecol Obstet 1992;175:299–305.
- Pinna AD, Iwatsuki S, Lee RG, et al. Treatment of fibrolamellar hepatoma with subtotal hepatectomy or transplantation. Hepatology 1997;26:877–83.
- Iwatsuki S, Starzl TE. Personal experience with 411 hepatic resections. Ann Surg 1988;208:421–34.
- Houben KW, McCall JL. Liver transplantation for hepatocellular carcinoma in patients without underlying liver disease: a systematic review. Liver Transpl Surg 1999;5:91–5.
- Livraghi T, Bolondi L, Lazzaroni S, et al. Percutaneous ethanol injection in the treatment of hepatocellular carcinoma in cirrhosis. A study on 207 patients. Cancer 1992;69:925–9.
- Lin SM, Lin DY, Lin CJ. Percutaneous ethanol injection therapy in 47 cirrhotic patients with hepatocellular carcinoma 5 cm or less: a long-term result. Int J Clin Pract 1999;53:257–62.
- Lencioni R, Pinto F, Armillotta N, et al. Long-term results of percutaneous ethanol injection therapy for hepatocellular carcinoma in cirrhosis: a European experience. Eur Radiol 1997;7:514–19.
- Livraghi T, Giorgio A, Marin G, et al. Hepatocellular carcinoma and cirrhosis in 746 patients: long-term results of percutaneous ethanol injection. Radiology 1995;197:101–8.
- Vilana R, Bruix J, Bru C, et al. Tumor size determines the efficacy of percutaneous ethanol injection for the treatment of small hepatocellular carcinoma. Hepatology 1992;16:353–7.
- Shibata T, Kojima N, Tabuchi T, et al. Transthoracic percutaneous ethanol injection therapy for hepatocellular carcinomas located beneath the diaphragm. J Vasc Interv Radiol 1998;9:97–100.
- Ishii H, Okada S, Okusaka T, et al. Needle tract implantation of hepatocellular carcinoma after percutaneous ethanol injection. Cancer 1998;82:1638–42.
- Di Stasi M, Buscarini L, Livraghi T, et al. Percutaneous ethanol injection in the treatment of hepatocellular carcinoma. A multicenter survey of evaluation practices and complication rates. Scand J Gastroenterol 1997;32:1168–73.
- Livraghi T, Bolondi L, Buscarini L, et al. No treatment, resection and ethanol injection in hepatocellular carcinoma: a retrospective analysis of survival in 391 patients with cirrhosis. Italian Cooperative HCC Study Group. J Hepatol 1995;22:522–6.
- Castells A, Bruix J, Bru C, et al. Treatment of small hepatocellular carcinoma in cirrhotic patients: a cohort study comparing surgical resection and percutaneous ethanol injection. Hepatology 1993;18:1121–6.
- Ohnishi K. Comparison of percutaneous acetic acid injection and percutaneous ethanol injection for small hepatocellular carcinoma. Hepatogastroenterology 1998;45 (suppl 3):1254–8.
- Ohnishi K, Yoshioka H, Ito S, et al. Prospective randomized controlled trial comparing percutaneous acetic acid injection and percutaneous ethanol injection for small hepatocellular carcinoma. Hepatology 1998;27:67–72.
- Ohmoto K, Yamamoto S. Percutaneous microwave coagulation therapy for superficial hepatocellular carcinoma on the liver surface. Am J Gastroenterol 2000;95:2401–3.
- Francica G, Marone G. Ultrasound-guided percutaneous treatment of hepatocellular carcinoma byradiofrequency hyperthermia with a ‘cooled-tip needle’. A preliminary clinical experience. Eur J Ultrasound 1999;9:145–53.
- Allgaier HP, Deibert P, Zuber I, et al. Percutaneous radiofrequency interstitial thermal ablation of small hepatocellular carcinoma. Lancet 1999;353:1676–7.
- Morris DE, Abouljoud M. Short-term results of radiofrequency ablation in liver tumors. Am J Surg 2000;179:527.
- Curley SA, Izzo F, Ellis LM, et al. Radiofrequency ablation of hepatocellular cancer in 110 patients with cirrhosis. Ann Surg 2000;232:381–91.
- Livraghi T, Goldberg SN, Lazzaroni S, et al. Hepatocellular carcinoma: radio-frequency ablation of medium and large lesions. Radiology 2000;214:761–8.
- Livraghi T, Goldberg SN, Lazzaroni S, et al. Small hepatocellular carcinoma: treatment with radio-frequency ablation versus ethanol injection. Radiology 1999;210:655–61.
- Dyon D, Mouzon A, Jourde AN, et al. L’embolisation arterielle hepatique dans les tumeurs malignes du foie. Ann Radiol 1974;17:593–603.
- Sasaki Y, Imaoka S, Kasugai H, et al. A new approach to chemoembolisation therapy for hepatoma using ethodized oil, cisplatin, and gelatin sponge. Cancer 1987;60:1194–203.
- Ryder SD, Rizzi PM, Metivier E, et al. Chemoembolisation with lipiodol and doxorubicin: applicability in British patients with hepatocellular carcinoma. Gut 1996;38:125–8.
- Okazaki M, Higashihara H, Koganemaru F, et al. Intraperitoneal haemorrhage from hepatocellular carcinoma: emergency chemoembolisation or embolization. Radiology 1991;180:647–51.
- Shibata J, Fujiyama S, Sato T, et al. Hepatic arterial injection chemotherapy with cisplatin suspended in an oily lymphographic agent for hepatocellular carcinoma. Cancer 1989;64:1586–94.
- Lin DY, Liaw YF, Lee TY, et al. Hepatic arterial embolization in patients with unresectable hepatocellular carcinoma—a randomized controlled trial. Gastroenterology 1988;94:453–6.
- Pelletier G, Ducreux M, Gay F, et al. Treatment of unresectable hepatocellular carcinoma with lipiodol chemoembolization: a multicenter randomized trial. Groupe CHC. J Hepatol 1998;29:129–34.
- Bruix J, Llovet JM, Castells A, et al. Transarterial embolization versus symptomatic treatment in patients with advanced hepatocellular carcinoma: results of a randomised controlled trial in a single institution. Hepatology 1998;27:1578–83.
- Madden MV, Krige JEJ, Bailey S, et al. Randomised trial of targeted chemotherapy with lipiodol and 5-epidoxorubicin compared with symptomatic treatment for hepatoma. Gut 1993;34:1598–600.
- Pelletier G, Roche A, Ink O, et al. A randomised trial of hepatic arterial chemoembolisation in patients with unresectable hepatocellular carcinoma. J Hepatol 1990;11:181–4.
- Group d’Etude et de Traitment de Carcinome Hepatocellulaire. A comparison of lipiodol chemoembolization and conservative treatment for unresectable hepatocellular carcinoma. N Engl J Med 1995;332:1256–61.
- Llovet JM, Real MI, Montana X, et al. Aterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: a randomised controlled trial. Lancet 2002;359:1734–9.
- Lo CM, Ngan H, Tso WK, et al. Randomized controlled trial of transarterial lipiodol chemoembolization for unresectable hepatocellular carcinoma. Hepatology 2002;35:1164–71.
- Kasugai H, Kojima J, Tatsuta M, et al. Treatment of hepatocellular carcinoma by transcatheter arterial embolization combined with intrarterial infusion of a mixture of cisplatin and ethodised oil. Gastroenterology 1989;97:965–71.
- Kuroda C, Iwasaki M, Tanaka T, et al. Gallbladder infarction following hepatic transcatheter arterial embolisation: angiographic study. Radiology 1983;149:85–9.
- Lencioni R, Vignali C, Caramella D, et al. Transcatheter arterial embolization followed by percutaneous ethanol injection in the treatment of hepatocellular carcinoma. Cardiovasc Intervent Radiol 1994;17:70–5.
- Yamamoto K, Masuzawa M, Kato M, et al. Evaluation of combined therapy with chemoembolization and ethanol injection for advanced hepatocellular carcinoma. Semin Oncol 1997;24(suppl 6):50–5.
- Bartolozzi C, Lencioni R, Caramella D, et al. Treatment of large HCC: transcatheter arterial chemoembolization combined with percutaneous ethanol injection versus repeated transcatheter arterial chemoembolization. Radiology 1995;197:812–8.
- Elba S, Giannuzzi V, Misciagna G, et al. Randomized controlled trial of tamoxifen versus placebo in inoperable hepatocellular carcinoma. Ital J Gastroenterol 1994;26:66–8.
- Farinati F, De Maria N, Fornasiero A, et al. Prospective controlled trial with antiestrogen drug tamoxifen in patients with unresectable hepatocellular carcinoma. Dig Dis Sci 1992;37:659–62.
- Castells A, Bruix J, Bru C, et al. Treatment of hepatocellular carcinoma with tamoxifen: a double-blind placebo-controlled trial in 120 patients. Gastroenterology 1995;109:917–22.
- Martinez Cerezo FJ, Tomas A, et al. Controlled trial of tamoxifen in patients with advanced hepatocellular carcinoma. J Hepatol 1994;20:702–6.
- Riestra S, Rodriguez M, Delgado M, et al. Tamoxifen does not improve survival of patients with advanced hepatocellular carcinoma. J Clin Gastroenterol 1998;26:200–3.
- Villa E, Moles A, Ferretti I, et al. Natural history of inoperable hepatocellular carcinoma: estrogen receptors’status in the tumor is the strongest prognostic factor for survival. Hepatology 2000;32:233–8.
- Liu CL, Fan ST, Ng IO, et al. Treatment of advanced hepatocellular carcinoma with tamoxifen and the correlation with expression of hormone receptors: a prospective randomized study. Am J Gastroenterol 2000;95:218–22.
- Villa E, Dugani A, Fantoni E, et al Type of estrogen receptor determines response to antiestrogen therapy. Cancer Res 1996;56:3883–5.
- Schachschal G, Lochs H, Plauth M. Controlled clinical trial of doxorubicin and tamoxifen versus tamoxifen monotherapy in hepatocellular carcinoma. Eur J Gastroenterol Hepatol 2000;12:281–4.
- Halm U, Etzrodt G, Schiefke I, et al. A phase II study of pegylated liposomal doxorubicin for treatment of advanced hepatocellular carcinoma. Ann Oncol 2000;11:113–4.
- Gebbia V, Maiello E, Serravezza G, et al. 5-Fluorouracil plus high dose levofolinic acid and oral hydroxyurea for the treatment of primary hepatocellular carcinomas: results of a phase II multicenter study of the Southern Italy Oncology Group (G.O.I.M.). Anticancer Res 1999;19:1407–10.
- Simonetti RG, Liberati A, Angiolini C, et al. Treatment of hepatocellular carcinoma: a systematic review of randomized controlled trials. Ann Oncol 1997;8:117–36.
- Miyajima I, Sata M, Kumashiro R, et al. The incidence of hepatocellular carcinoma in patients with chronic hepatitis C after interferon treatment. Oncol Rep 1998;5:201–4.
- Tanaka H, Tsukuma H, Kasahara A, et al. Effect of interferon therapy on the incidence of hepatocellular carcinoma and mortality of patients with chronic hepatitis C: a retrospective cohort study of 738 patients. Int J Cancer 2000;87:741–9.
- Nishiguchi S, Kuroki T, Nakatani S, et al. Randomised trial of effects of interferon-alpha on incidence of hepatocellular carcinoma in chronic active hepatitis C with cirrhosis. Lancet 1995;346:1051–5.
- Inoue A, Tsukuma H, Oshima A, et al. Effectiveness of interferon therapy for reducing the incidence of hepatocellular carcinoma among patients with type C chronic hepatitis. J Epidemiol 2000;10:234–40.
- Kowdley KV. Does interferon therapy prevent hepatocellular carcinoma in patients with chronic hepatitis C? Gastroenterology 1999;117:738–9.
- Kasahara A, Hayashi N, Mochizuki K, et al. Risk factors for hepatocellular carcinoma and its incidence after interferon treatment in patients with chronic hepatitis C. Osaka Liver Disease Study Group. Hepatology 1998;27:1394–402.
- Takayama T, Sekine T, Makuuchi M, et al. Adoptive immunotherapy to lower postsurgical recurrence rates of hepatocellular carcinoma: a randomised trial. Lancet 2000;356:802–7.
- Muto Y, Moriwaki H, Saito A. Prevention of second primary tumors by an acyclic retinoid in patients with hepatocellular carcinoma. N Engl J Med 1999;340:1046–7.
- Lai CL, Lau JY, Wu PC, et al. Recombinant interferon-alpha in inoperable hepatocellular carcinoma: a randomized controlled trial. Hepatology 1993;17:389–94.
- Llovet JM, Sala M, Castells L, et al. Randomized controlled trial of interferon treatment for advanced hepatocellular carcinoma. Hepatology 2000;31:54–8.
- Kouroumalis E, Skordilis P, Thermos K, et al. Treatment of hepatocellular carcinoma with octreotide: a randomised controlled study. Gut 1998;42:442–7.
- Yuen MF, Poon RT, Lai CL, et al. A randomized placebo-controlled study of long-acting octreotide for the treatment of advanced hepatocellular carcinoma. Hepatology 2002;36:687–91.
Статьи по теме
Рекомендуемые статьи
Синдром Бурхаве
Спонтанный разрыв пищевода - характеризуется спонтанным разрывом всех слоев стенки пищевода. Первое описание данного состояния дано голландским врачом Германом Бурхаве (Hermann Boerhaave) в 1724 г.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.















.jpg)





.png)















Комментарии