РОССИЙСКОЕ ОБЩЕСТВО ХИРУРГОВ
НАЦИОНАЛЬНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
«ОСТРАЯ НЕОПУХОЛЕВАЯ КИШЕЧНАЯ НЕПРОХОДИМОСТЬ»
Приняты на XII Съезде хирургов России «Актуальные вопросы хирургии» (г. Ростов-на-Дону, 7-9 октября 2015 г.)
СОКРАЩЕНИЯ
ДИ – доверительный интервал.
РКИ – рандомизированное контролируемое исследование.
СР – степень рекомендаций.
УД – уровень доказательности.
ОКН – острая кишечная непроходимость.
УЗИ – ультразвуковое исследование ЭНИД – эндоскопическая назоинтестинальная декомпрессия МРТ – магнитно-резонансная томография
Настоящие рекомендации разработаны рабочей группой в составе: 1. Шаповальянц Сергей Георгиевич Москва 2. Ларичев Сергей Евгеньевич Москва3. Сажин Александр Вячеславович Москва 4. Щеголев Александр Андреевич Москва 5. Гуляев Андрей Андреевич Москва 6. Бебуришвили Андрей Георгиевич Волгоград 7. ПрудковМихаил Иосифович Екатеринбург 8. Шулутко Александр Михайлович Москва 9. Дарвин Владимир Васильевич Сургут
1. МЕТОДОЛОГИЯ.
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме (таблица №1).
Таблица 1. Классификация уровней доказательств Оксфордского центра доказательной медицины[1]:
Уровень Исследование методов лечения
Исследование методов диагностики
1а Систематический обзор гомогенных рандомизированных клинических исследований (РКИ)
Систематический обзор гомогенных диагностических исследований 1 уровня
1b Отдельное РКИ (с узким доверительным индексом) Валидизирующее когортное исследование с качественным «золотым» стандартом 1с Исследование «Все или ничего»
Специфичность или чувствительность столь высоки, что положительный или отрицательный результат позволяет исключить/установить диагноз 2а Систематический обзор (гомогенных) когортных исследований
Систематический обзор гомогенных диагностических исследований >2 уровня 2b Отдельное когортное исследование (включая РКИ низкого качества; т.е. с <80% пациентов, прошедших контрольное наблюдение)
Разведочное когортное исследование с качественным «золотым» стандартом
2с Исследование «исходов»; экологические исследования
нет
3а Систематический обзор гомогенных исследований «случай-контроль»
Систематический обзор гомогенных исследований уровня 3B и выше
3b Отдельное исследование «случай-контроль»
Исследование с непоследовательным набором или без проведения исследования «золотого» стандарта у всех испытуемых
4 Серия случаев (и когортные исследования или исследования «случай-контроль» низкого качества)
Исследование случай-контроль или исследование с некачественным или зависимым «золотым» стандартом
5 Мнение экспертов без тщательной критической оценки, лабораторные исследования на животных или разработка «первых принципов»
Мнение экспертов без тщательной критической оценки или основанное на физиологии, лабораторные исследования на животных или разработка «первых принципов» Степени рекомендаций:
A
Подтверждены систематическим обзором и (или) как минимум двумя РКИ высокого качества.
Уровень доказательства 1a, 1b.
B
Подтверждены групповыми исследованиями или исследованиями типа случай-контроль хорошего качества Уровень доказательства 2a, 2b.
C
Подтверждены исследованиями серий случаев, групповыми исследованиями низкого качества и (или) изучением «исходов».
Уровень доказательства 2c, 3.
D
Мнение эксперта, согласованное решение комитета Уровень доказательства 4.
2. ОПРЕДЕЛЕНИЕ.
Острая кишечная непроходимость (ОКН) – синдром,объединяющий различные заболевания, приводящие к нарушению пассажа по кишке, вследствие механического препятствия, либо недостаточности двигательной функции кишки.
3. Код МКБ 10 - К 56
К 56.0 – паралитический илеус К56.2 – заворот кишок К56.3 – илеус, вызванный желчным камнем
К56.4 – другой вид закрытия просвета кишечника К56.5 – кишечные сращения [спайки] с непроходимостью К56.6 – другая и неуточненная кишечная непроходимость
4. Эпидемиология
В России частота острой кишечной непроходимости составляет около 5 заболевших на 100 тысяч человек, являясь причиной от 3 до 5% поступлений больных в хирургические стационары [2,3]. Это в целом соответствует данным зарубежных коллег [4,5]. Среди всех больных с механической кишечной непроходимостью острая тонкокишечная непроходимость составляет от 64,3 до 80% случаев и отличается более тяжелым клиническим течением и худшим прогнозом заболевания. Это обуславливают сохраняющуюся высокую летальность при данной патологии. По свидетельству разных авторов она составляет от 5,1 до 8,4%, занимая ведущее место среди всех ургентных заболеваний [6,7,8,9,10,11,12,13,14, 15].
Экономическая значимость лечения данной патологии наглядно иллюстрируется следующим сравнением: прямые затраты системы здравоохранения на лечение пациентов с острой тонкокишечной непроходимостью в Финляндии примерно равны затратам на лечение больных с раком желудка и раком прямой кишки [16]. А по данным N.F.
Ray et al. (1994) [17], в Соединенных Штатах ежегодно оперируется более чем 300.000 пациентов по поводу спаечной кишечной непроходимости, что требует финансовых затрат в объеме 1,3 миллиарда долларов.
5. ЭТИОЛОГИЯ
1. Механическая: спайки (80 - 91%), болезнь Крона(0,7-3%), заворот (4-6%), инвагинация (3-5%), безоар (1,2-4%), желчные камни (0,5-6%), инородные тела (0,2-1%), прочие причины (0,5-3%) [2,18,19]
2. Динамическая (Функциональная) кишечная непроходимость – это вид непроходимости, который требует уточнения причины. Чаще всего под маской этого синдрома скрываются воспалительные внутрибрюшные осложнения (перитонит, неспецифический язвенный колит и т.д.), метаболические нарушения (уремия, сахарный диабет, гипотиреоз, гипокалемия, нарушение обмена Ca++, Mg++), нейрогенные (повреждение спинного мозга, опухоль, гематома, флегмона забрюшинного пространства, почечная колика), передозировка лекарственных средств (опиоидов, холинолитиков, психотропных, антигистаминных препаратов), либо нарушения мезентериального кровотока.
6. Классификация
Наиболее важным в тактическом плане является разделение больных на 2 формы заболевания – странгуляционную и обтурационную[18, 20,21,22,23] (СР-А). Нецелесообразным отдельно выделять, так называемую смешанную форму, которая имеет признаки как странгуляционной, так и обтурационной непроходимости. Это вносит неопределенность, как в терминологическом, так и в тактическом плане, не позволяя обеспечить своевременное лечение пациентов. 1. Обтурация - нарушение пассажа по различным отделам кишечника без нарушения кровоснабжения органа. Чаще всего причиной такой формы являются спайки брюшной полости, желчные камни, безоары. 2. Странгуляция – нарушение кровоснабжения кишки в месте нарушения пассажа, встречается при спайках брюшной полости (как правило, это единичный штранг), инвагинации, завороте и узлообразовании. Это наиболее опасная форма и она может протекать:
7. Патогенез заболевания
Развитие ОКН запускает целый каскад многообразных патологических процессов, затрагивающих все органы и системы. Однако центральным звеном при развитии непроходимости является непосредственно сама тонкая кишка, представляя собой первичный и основной источник эндогенной интоксикации. Прогрессирующее перерастяжение кишечных петель и нарушение кишечной микроциркуляции, приводит к угнетению всех функций тонкой кишки (моторной, секреторной, всасывательной), и в конечном итоге расстройству гомеостаза. Гипоксическое повреждение и интрамуральная ишемия стенки кишки приводит к нарушению барьерной функции слизистой и как следствие, транслокации бактерий и продуктов их жизнедеятельности в систему воротной вены и лимфатические сосуды.
Тонкая кишка при ОКН, становится мощным источником интоксикации усугубляя гомеостатические нарушения и декомпенсируя функциональные кишечные нарушения тем самым замыкая «порочный круг». Это способствует развитию тяжелых интраабдоминальных осложнений, а частота их напрямую связана с выраженностью и длительностью ОКН, особенно у больных пожилого и старческого возраста.
Патофизиологические изменения при ОКН особенно выражены при странгуляционной форме кишечной непроходимости. На первый план выступают гемодинамические расстройства, обусловленные сокращением артериального притока и нарушением венозного оттока за счет компрессии сосудов брыжейки кишки. Высвобождающиеся тканевые кинины, а также гистамин нарушают проницаемость сосудистой стенки. Это способствует появлению интерстициального отека, усугубляемого расстройством коллоидно-осмотических и ионно-электролитных взаимоотношений плазмы и интерстициальной жидкости. и только затем появляются признаки нарушения пассажа по кишке с секверстрацией жидкости и волемическими нарушениями. На этом фоне под влиянием выраженной ишемии, дополнительного воздействия микробных и тканевых эндотоксинов возникает деструкция кишечной стенки. При странгуляционной непроходимости нарушение барьерной функции слизистой происходит в более ранние сроки, а транслокация бактериальной флоры наступает даже при отсутствии некроза кишки [24].
При желчнокаменной непроходимости течение заболевания носит отчетливый реметиррующий характер с бурными клиническими проявлениями, чередующимися относительно длительными (2-6 часов) периодами «мнимого благополучия».
Инвагинация чаще всего встречается у детей и лиц среднего возраста. Патогенез заболевания достаточно сложен и малоизучен.
Чаще всего (90% случаев) инвагинация развивается у пациентов с врожденными анатомическими особенностями строения кишки или наличием органической патологии – эпителиальные или подслизистые образования, воспалительные изменения, наличие язв кишки.
Образование инвагината происходит вследствие нарушения моторной функции и нарушения координации перистальтики различных отделов кишки на фоне провоцирующих факторов – погрешности в диете, травма и т.д. По локализации различают илеоцекальную (45-68%), тонкокишечную (10-18%), толстокишечную (8-15%) инвагинацию[1,19].
Предрасполагающим фактором развития заворота кишки и узлообразования являются врожденные аномалии, длинная брыжейка кишки, наличие спаек брюшной полости. Из производящих причин наибольшее значение принадлежит погрешности в диете, переедание, повышение внутрибрюшного давления. Выраженность нарушений и клинических проявлений напрямую зависит от степени заворота. Так при ротации кишки на 180о заболевание в большей степени соответствует обтурационной непроходимости с минимальными признаками нарушения питания кишки. В то время как при завороте более 270о отмечается выраженная ишемия органа с бурным течением заболевания и ранним развитием некроза кишки. По локализации наиболее часто имеет место заворот сигмовидной (60-75%), реже слепой (20-35%), тонкой (7-18%) и поперечно-ободочной кишки (3-5%). Наиболее тяжело протекает узлообразование, которое встречается относительно редко – в 3-5% случаев [1,19]. Как правило, в процессе задействован большой участок тонкой кишки с выраженными некробиотическими изменениями и тяжелыми гемодинамическими и системными нарушениями.
8. ДИАГНОСТИКА
Многообразие форм, патогенетических особенностей ОКН, обусловливает полиморфизм клинической симптоматики и создает почву для диагностических трудностей и несвоевременного лечения.
Главными задачами в диагностике ОКН являются:
Клиническая диагностика
1. Оцениваются жалобы и анамнез заболевания. Выясняется характер болей, их интенсивность, фиксируется наличие рвоты; ее частота, объем и характер рвотных масс, отхождение стула, газов. Важно определить длительность заболевания, наличие аналогичных эпизодов ранее.
Перенесенные ранние операции позволяют заподозрить спаечный характер непроходимости. А наличие воспалительных кишечных заболеваний, желчнокаменной болезни, выполненной ваготомии, позволяют заподозрить иные причины тонкокишечной непроходимости. 2. Проводится физикальное обследование - аускультация, перкуссия и пальпация живота. Определяется наличие, локализация и характер послеоперационных рубцов. Целенаправленно обследуются места типичного расположения грыж брюшной стенки. Оценивается степень обезвоживания – тургор кожи, сухость языка, наличие жажды; измерение пульса, артериального давления 3. Выполняется термометрия 4. Обязательным является пальцевое ректальное исследование, у женщин дополнительно проводят вагинальное исследование. 5. Зондирование желудка и оценка количества и характера отделяемого.
Характер, выраженность клинических проявлений и тяжесть расстройств во многом зависят от причины, формы и уровня ОКН. Для неопухолевой ОКН типично острое начало заболевания - внезапное появление схваткообразной боли в животе, рвоты, вздутие живота и отсутствие стула и неотхождение газов[19](СР-D). Если в первые часы нет нарушений водно-электролитного баланса и признаков эндотоксикоза, то в последующем перерастяжение петель тонкой кишки, нарастающая внутрипросветная секвестрация жидкости приводит к развитию метаболических нарушений, сопровождающихся жаждой, сухостью кожи, адинамией, тахикардией, гипотензией.
Крайним проявлением непроходимости является присоединение паралитического компонента, что проявляется изменением характера боли - они становятся постоянными, урежаются схватки. Рвота становится обильной застойным содержимым («каловая» рвота), появляется интоксикация.
Особым течением отличается странгуляционная форма непроходимости. В классическом понимании клиническая картина характеризуется тяжелым течением и быстрым развитием осложнений
– некроза кишки и перитонита. Наиболее характерны следующие клинические признаки этой формы заболевания: острое начало (срок заболевания менее 12 часов), жестокий болевой синдром, постоянного характера, ослабление или отсутствие перистальтики, тахикардия, иногда лихорадка и быстрое ухудшение общего состояния больного. (20.22.23.25)(CР- В)
Однако типичные проявления странгуляции далеко не всегда встречаются в клинической практике. Нередко клиническое течение носит стертый характер. Морфологически это связано с умеренным ущемлением брыжейки, когда происходит сдавление вен без выраженного нарушения артериального кровотока.
Нередко нарушение кровоснабжения кишки возникает в далеко запущенных случаях обтурационной непроходимости. Значительное повышение внутрипросветного давления приводит к сдавлению сосудов, нарушении микроциркуляции в стенке кишки, что приводит к развитию вторичной ишемии. Малая выраженность местной симптоматики, отсутствие признаков раздражения брюшины маскируется снижением предшествующих схваткообразных болей и появлением эндотоксикоза.
Особенностью клинической картины при высоком уровне непроходимости – это большие потери желудочного, панкреатического секрета, желчи вследствие обильной многократной рвоты и быстрое развитие водно-электролитных нарушений (гипогидротации, метаболичического алкалоза, гипокалемии, гипохлоремии, гипонатремии). При этом, как правило, отсутствует выраженное вздутие живота, в течение некоторого времени еще отмечается отхождение газов и наличие стула [1,19](СР D).
В то время как при низкой непроходимости на первый план выступают признаки нарушения пассажа по тонкой кишке - болевой синдром, отмечается выраженное вздутие живота, при этом рвота встречается реже, и быстро прогрессируют явления эндотоксикоза. В дальнейшем по мере прогрессирования процесса отмечается перерастяжение кишечной стенки и присоединяется ишемический компонент, увеличивается проницаемость кишечной стенки.
Вероятность развития инфекционных осложнений гораздо выше при низкой чем при высокой тонкокишечной непроходимости. [1,19](СР D)
Лабораторная диагностика
Данные лабораторной диагностики не играют значимой роли в констатации факта непроходимости, но помогают определить наличие и выраженность метаболических нарушений, кислотно-щелочного состояния и признаков странгуляционной непроходимости.
Всем больным, поступающим в стационар выполняется:
Наличие лейкоцитоза более 14х109л, появление ацидоза, амилаземии с большой вероятностью свидетельствует о наличии странгуляциии. [20,22,23,25](СP-C).
Рентгенологическое полипозиционное исследование
Исследование позволяет в кратчайшие сроки и с высокой эффективностью констатировать непроходимость и в ряде случаев диагностировать ее причину. Эффективность метода высока и по данным многочисленных исследований достигает 87% в констатации факта и уровня непроходимости [26.27] (СР-B). Обзорная рентгенография выполняется стоя, либо в латеропозиции (в положении на левом боку) у тяжелых пациентов. Для тонкокишечной непроходимости типично наличие раздутых более 3 см. петель кишки выше препятствия, содержащих газ и уровни жидкости (чаши Клойбера) и отсутствие содержимого в толстой кишке. Горизонтальныке уровни жидкости обычно широкие с невысоким газовым пузырем. Отмечается поперечная исчерченность, соответствующая складкам Керкринга. [1,19](CP-D).
Определение уровня непроходимости базируется на визуализации расширенных петель тонкой кишки в различных анатомических областях брюшной полости. Локализации уровней в правых отделах брюшной полости в большей степени соответствует высокой непроходимости. В то время как при локализации препятствия на уровне подвздошной кишки, количество чащ увеличивается и они локализуются во всех отделах брюшной полости. Чувствительность метода в решении этой диагностической задачи составляет 65,4 - 82 % [18, 26,27](СР-B).
При завороте толстой кишки определяется выраженная дилятация толстой кишки с характерным симптомом «автомобильной камеры». Ось баллоннообразно раздутой кишки направлена от левой подвздошной области к правому подреберью при завороте сигмовидной и от правой подвздошной области к левому подреберью при завороте слепой кишки [28.29] (СР-D).
При обтурации кишки желчным камнем, наряду с типичными признаками кишечной непроходимости, нередко визуализируется крупный конкремент, находящийся вне проекции гепатобилиарной зоны, характерно наличие газа в желчных протоках или желчном пузыре (аэрохолия).
Энтерография - динамическое рентгенологическое исследование с оценкой пассажа контраста по тонкой кишке.
Исследование показано во всех случаях тонкокишечной непроходимости при отсутствии признаков странгуляции и перитонита.
Метод позволяет с высокой точностью подтвердить факт кишечной непроходимости, определить выраженность, уровень препятствия (высокий, низкий), характер кишечной непроходимости (механический, функциональный) и динамику течения заболевания [1,18]. В качестве контрастного вещества целесообразно использовать водорастворимые препараты, которые имеет значительное преимущество перед бариевой взвесью (не замедляет перистальтику, хорошо элиминируется из организма, в случае попадании в брюшную полость легко удаляется) при сравнимой диагностической эффективности [30]. Более того, препарат за счет гипоосмолярности обладает лечебным действием позволяя повысить эффект консервативной терапии до 89,4% [31.32.33.34.35.36] (СР-В).
Доставляется контрастное вещество в желудочно-кишечный тракт через назогастральный зонд или непосредственно в тощую кишку через эндоскопически установленный назоинтестинальный зонд. Последний способ введения контрастного вещества является наиболее предпочтительным – это дает возможность миновать задержку контраста в желудке [37.38]. Далее с интервалами в 4 часа производятся рентгенограммы брюшной полсти с оценкой состояния тонкой кишки на конкретном временном этапе исследования.
Данные динамической зондовой энтерографии, являются наиболее достоверными и объективными критериями оценки эффективности консервативной терапии, направленной на разрешение острой тонкокишечной непроходимости. К ним относятся: уменьшение количества горизонтальных уровней жидкости и чаш Клойбера, диаметра тонкой кишки, появление пневмотоза толстой кишки, и, самое главное, поступление контрастного вещества в толстую кишку.
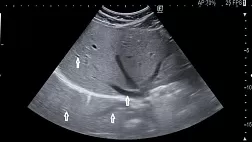
УЗИ органов брюшной полости.
Метод позволяет эффективно дополнить диагностическую программу и констатировать ОКН у 72-94% больных, ее уровень у 66,7-80%, причину у 48-63% больных и оценить функциональное состояние кишки [6,8,18,26,39] (СР-С). Типичными ультразвуковыми признакам кишечной непроходимости являются: 1) расширение диаметра кишки более 25 мм, связанное с депонированием жидкости в ее просвете; 2) утолщение стенки кишки за счет ее отека; 3) визуализация складок слизистой тонкой кишки; 4) наличие свободной жидкости в брюшной полости; 5) маятникообразное движение содержимого кишки (СР–В).
Серьезным преимуществом УЗИ является возможность более достоверно определить форму непроходимости (странгуляционная, обтурационная). Признаками нарушения кровоснабжения в стенке кишки являются: наличие расширенной «изолированной петли» тонкой кишки с жидкостью, утолщение, неоднородность стенки в сочетании с ее акинезией, и скопление свободной жидкости в брюшной полости. Эффективность УЗИ в диагностики странгуляции составляет 53,3 - 87% [26,74,75] (СР-С). Для повышения эффективности ультразвуковой диагностики исследование целесообразно дополнить допплерографией сосудов тонкой кишки (в т.ч. внутристеночных) с целью верификации странгуляционного характера непроходимости [40,41,42] (CР - В).
Колоноскопия.
Метод используется для дифференциальной диагностики при толстокишечной непроходимости (особенно при подозрении на заворот сигмовидной кишки). Для заворота характерен «симптом водоворота» – спирально суженный сегмент толстой кишки [43.44.45].
Дополнительные методы исследования:
Диагностическая лапароскопия.
Выполнение исследования ограничено из-за возможности повреждения внутренних органов в условиях спаечного процесса брюшной полости и расширенных петлях тонкой кишки. Показанием к нему является, прежде всего, необходимость дифференциального диагноза с другими хирургическими и гинекологическими заболеваниями. Кроме этого, лапароскопия позволяет оценить состояние брюшной полости, распространенность спаечного процесса и определить возможность проведения лапароскопического рассечения спаек (адгезиолизиса) как малоинвазивного способа разрешения ОКН.
Общими противопоказаниями к проведению диагностической лапапроскопии являются: сердечно-легочные заболевания в стадии декомпенсации, ожирение IV степени, нарушения свертывающей системы крови, беременность более 16 недель. Местные противопоказания: перенесенные в анамнезе травматичные или множественные (более 3) операции на брюшной полости, запущенная ОКН, с выраженным расширением петель кишки (более 4 см), которая требует глубокой интубации и декомпрессии тонкой кишки, большие невправимые и гигантские грыжи передней, брюшной стенки, наличие множественных свищей на передней брюшной стенке (18, 46,47,48) (CР-B).
Компьютерная томография с двойным (пероральным и внутривенным) контрастированием динамично развивающийся и перспективный метод диагностики ОКН. Метод позволяет определить локализацию и причину обструкции, диаметр и пневмотоз кишки, наличие и количество выпота в брюшной полости, оценить артериальное кровоснабжение органа (чревный ствол, верхнебрыжеечная артерия, нижнебрыжеечная артерия), диагностировать другую патологию брюшной полости. По данным разных авторов точность метода в дифференциальной диагностике механической и динамической непроходимости составляет – 83-94%, причины обструкции у 85-87%, уровня непроходимости у 93%, а странгуляции 43-85%. [49,50,51,52,53] (CР-C).
Магнитно-резонансная томография.
Метод пока не нашел определенного места в диагностическом алгоритме при ОКН. По мнению некоторых исследователей сравним по эффективности с компьютерной томографией и УЗИ - чувствительность в констатации ОКН составляет - 86-100%, а специфичность - 90-100% [54,55,56,57]. Несколько ниже эффективность исследования в выявлении причины - 60-73% [55,57] и уровня непроходимости - 63% [57] (СР-D).
Главным достоинством метода является его высокая разрешающая способность, возможность улавливать морфологические изменения в стенке тонкой кишки, характерные для опухоли, воспаления, ишемии и некроза, а также определять моторную активность тонкой кишки [54,58,59]. Однако МРТ, несмотря на свою малую инвазивность и потенциально высокую эффективность в диагностике ОКН, до сих пор не нашел широкого применения в клинической практике. Это связано не только с высокой стоимостью аппаратуры и самого исследования, сложностью его проведения в ургентной ситуации, но и, самое главное, отсутствием достаточного клинического материала и опыта, которые позволили бы определить место этих исследований в диагностическом алгоритме при кишечной непроходимости.
3. Хирургическая тактика и лечебная программа
Хирургическая тактика при неопухолевой непроходимости зависит, прежде всего, от причины, формы непроходимости и ее выраженности.
Экстренные операции показаны при: 1. Странгуляционной форме острой кишечной непроходимости (инвагинация, спаечный процесс, заворот, узлообразование).
Задержка операции в такой ситуации недопустима. Вмешательство проводится в течение 2-х часов от поступления из-за опасности развития некроза органа и перитонита [18,55,60,61] (СР- B). При завороте толстой кишки, небольшом сроке заболевания и отсутствии признаков некроза кишки возможно проведение консервативных мероприятий, направленных на разрешение непроходимости (сифонная клизма, лечебная колоноскопия) [45,62]. 2. Запущенной стадии ОКН с тяжелыми вводно-электролитными нарушениями, выраженными зондовыми потерями (более 1000 мл), значительной дилятацией тонкой кишки (более 5 см) и большими сроками (более 36 часов) от начала заболевания. В этой группе больных наиболее целесообразно экстренное оперативное вмешательство, после полноценной предоперационной подготовки в течение 4–6 часов, направленной на коррекцию метаболических нарушений и органной недостаточности. Попытки разрешения непроходимости в такой ситуации малоэффективны. Объем и время предоперационной подготовки определяется в консилиуме хирурга, анестезиолога и терапевта (по показаниям). В качестве подготовки используется инфузионая терапия (кристаллоидные, коллоидные, гликозированные растворы), декомпрессия верхних отделов желудочно-кишечного тракта (назогастральный зонд), симптоматическая терапия.
Консервативная терапия, направленная на разрешение ОКН, проводится у больных с обтурационной формой ОКН при отсутствии выраженных вводно-электролитных нарушений и небольших (до 36 часов) сроках заболевания. Характер консервативной терапии, ее длительность зависят от причины, тяжести заболевания уровня непроходимости, особенностей клинической картины.
При обтурационной тонкокишечной непроходимости вследствие желчных камней, безоара эффективность консервативных мероприятий невелика. Следует помнить, что особенностью течения этих заболеваний является ремитирующий характер непроходимости с эпизодами «мнимого благополучия». Это нередко приводит к задержке операции и усугублению состояния. По мере установки диагноза целесообразно оперировать пациентов в ближайшие 6 часов не надеясь на полноценное восстановление пассажа по тонкой кишке.
В случае спаечной тонкокишечной непроходимости, учитывая патогенетические особенности заболевания, надежды на консервативное разрешение значительно выше. Отсюда и правомерность интенсивного лечения, направленного на устранение непроходимости. Наиболее оптимально проведение консервативной терапии в течение 12 часов. [18,37,60,61,63] (СР–B). Этот срок достаточен для выявления тенденции к разрешению непроходимости или, при отсутствии таковой, для адекватной подготовки к срочному вмешательству .
Комплекс консервативного лечения включает в себя:
[63]контролируемые рандомизированные исследования, доказали достоверно более быстрое разрешение непроходимости по сравнению с плацебо у пациентов с острой спаечной тонкокишечной непроходимостью (СР – B).
Важен всесторонний и тщательный контроль над течением кишечной непроходимости, который осуществляется на основании комплекса параметров: 1) клинических данных (болевой синдром, вздутие живота, отхождение стула, газов, рвоты, динамика зондового отделяемого); 2) лабораторных показателей, свидетельствующих о водно-электролитном балансе и 3)рентгенологической оценки пассажа контрастного вещества (водорастворимые препараты, сульфат бария) по желудочно-кишечному тракту.
Признаками неразрешающейся острой тонкокишечной непроходимости являются: сохранение\рецидив болей в животе, рвоты, появление мышечного напряжения, свободной жидкости в брюшной полости при КТ или УЗИ, зондовое отделяемое более 500 мл/сут [76,77,78] (СР-С), отсутствие динамики продвижения контрастного вещества по тонкой кишке и поступления его в толстую кишку [18,76] (СР-B). В этой ситуации принимается решение о срочном оперативном вмешательстве, а проводимые консервативные мероприятия расцениваются как элементы предоперационной подготовки.
Оперативное вмешательство.
Выбор способа оперативного вмешательства (лапароскопия, лапаротомия) зависит от причины нарушения пассажа по кишке, выраженности спаечного процесса и непроходимости, состояния кишки.
При острой спаечной тонкокишечной непроходимости целесообразно выполнение малоинвазивного вмешательства - лапароскопического адгезиолизиса, которое менее травматично, сопровождается меньшим числом послеоперационных осложнений и летальных исходов, уменьшает риск спайкообразования, позволяет быстрей реабилитировать пациентов [5, 67,68,69] (СР-С). Однако применение лапароскопии при спаечной кишечной непроходимости возможно у ограниченного числа больных. Это связано с высокой вероятностью интраоперационных повреждений кишки, на фоне спаечного процесса в брюшной полости и расширения петель тонкой кишки, которое встречается у 3-17% больных [5,18,47,68,70,71].
В то же время, метод, несмотря на малую инвазивность, имеет ограничения в применении из-за риска повреждения кишки.
Противопоказанием к ее выполнению являются: наличие более 3-х и более операций в анамнезе, расширение тонкой кишки более 4 см, некроза кишки или перитонита [18, 46,47,48,72](СР-С). В некоторых «неосложненных» ситуациях, когда жизнеспособность кишки сомнительна, допустимо наблюдение за пациентами с выполнением операций «повторного взгляда» через 12 часов.
Опасность лапароскопического доступа при спаечном процессе в брюшной полости и непроходимости высока. Поэтому этот этап необходимо выполнять в наиболее удаленных точках от послеоперационных рубцов с учетом конституциональных особенностей пациента и с учетом выявления «акустических окон» по данным дооперационного ультразвукового сканирования висцеропариетальных сращений брюшной полости. Декомпрессия желудочно-кишечного тракта после лапароскопических вмешательств по поводу ОКН чаще всего осуществляется с помощью назогастрального зонда. Однако в ситуациях, когда кишечная непроходимость выражена, сопровождается расширением тонкой кишки более 40 мм, большим количеством зондового отделяемого, необходимо выполнять интраоперационную интубацию тонкой кишки с помощью эндоскопа на протяжении 30-50 см ниже связки Трейца.
Полнота адгезиолизиса и адекватность лапароскопического разрешения кишечной непроходимости в обязательном порядке должна подтверждаться послеоперационной контрастной энтерографией.
Задержка поступления контрастного вещества в толстую кишку более 20 часов свидетельствует о сохраняющемся нарушении пассажа по тонкой кишке.
В остальных ситуациях (многократные лапаротомии, непроходимость несвязанная со спаечным процессом, выраженные водно-электролитные нарушения, странгуляционная форма ОСТКН с некрозом кишки) показано хирургическое вмешательство – лапаротомия.
Этапы операции:
1. Ревизия брюшной полости, идентификации патоморфологического субстрата непроходимости. Взятие экссудата брюшной полости на бактериологическое исследование. 2. Определение жизнеспособности кишки в зоне препятствия и определение показаний к ее резекции. При определении показаний к резекции кишки используются визуальные признаки (цвет, перистальтика, пульсация и кровенаполнение пристеночных сосудов), а также динамика этих признаков после введения в брыжейку кишки раствора местного анестетика и «согревания» кишки теплыми салфетками, смоченными физраствором (1,2) (СР-D). Для объективной оценки кровоснабжения возможно также использование лазерной допплеровской флоуметрии, регионарной трансиллюминационной ангиотензометрии внутристеночных сосудов тонкой кишки [67](СР-В). В некоторых ситуациях при сомнениях в жизнеспособности кишки на большом ее протяжении допустимо отложить решение вопроса о резекции, используя запрограммированную релапаротомию или лапароскопию через 12 часов. 3. При некрозе кишки производят резекцию в пределах жизнеспособных тканей, отступя от зоны некроза в приводящем отделе на 30-40 см, в отводящем на 15-20 см. Исключение составляют резекции вблизи связки Трейца или илеоцекального угла, где допускается ограничение указанных требований при благоприятных визуальных характеристиках кишки в зоне предполагаемого пересечения. При этом, обязательно используются контрольные показатели: кровотечение из сосудов стенки при ее пересечении и состояния слизистой оболочки. 4. Учитывая наличие перепада диаметров тонкой кишки, предпочтительно наложение тонко-тонкокишечного анастомоза «бок в бок». При резекции толстой кишки операцию заканчивают наложением колостомы. При правосторонней гемиколэктомии допустимо наложение илео-трансверзоанастомоза. 5. Проведение назоинтестинального зонда для декомпрессии тонкой кишки обязательно, за исключением случаев ОКН без выраженного расширения петель кишки (до 30 мм), небольшого количества зондового отделяемого (до 500 мл), отсутствие выраженного спаечного процесса и необходимости резекции кишки. В таких ситуациях допустимо назогастральная декомпрессия. 6. В большинстве случаев дренирование тонкой кишки необходимо выполнять на протяжении 50-100 см от связки Трейца двухпросветным зондам для проведения в послеоперационном периоде декомпрессии и энетротерапии [18, 67, 73]. Тотальная интубация тонкой кишки ввиду большой травматичности рекомендуется только при выраженном спаечном процессе, для обеспечения каркасной функции и более адекватной ее декомпресссии. При невозможности провести зонд в тонкую кишку, из-за выраженного спаечного процесса в верхнем этаже брюшной полости, используют интраоперационное эндоскопическое пособие для установки назоеюнального зонда. От проведения открытой декомпрессии тонкой кишки (путем энтеро-, цеко-, аппендикостомии и др.) следует воздержаться из-за недостаточной надежности и опасности инфицирования брюшной полости. 7. В случаях, когда ОКН осложнена распространённым перитонитом и высоким внутрибрюшным давлением вследствие выраженного расширения тонкой кишки, для профилактики развития компартмент-синдрома следует ушить лапаротомную рану одним из декомпрессионных способов.
Особенности лечения ОКН при других причинах заболевания.
При заворотах слепой кишки без некроза: 1) резекция кишки с анастомозом; 2) деторзия заворота и цекопексия. При некрозе слепой кишки: 3) резекция с илеотрасверзоанастомозом; 4) при выраженнной непроходимости, перитоните резекция с илео- или трансверзостомой В случаях заворота поперечно-ободочной кишки, независимо от наличия или отсутствия некроза: сегментарная резекция поперечно-ободочной кишки или расширенная гемиколэктомия с выведением колостомы. При правосторонней гемиколэктомии допустимо наложение илеотрасверзоанастомоза.
При завороте тонкой кишки без некроза выполняется деторзия заворота, пликация брыжейки тонкой кишки на длинном назоинтестинальном зонде. При завороте с некрозом тонкой кишки производится резекция тонкой кишки с наложением анастомоза бок-в-бок, назоинтестинальная декомпрессия.
При узлообразовании кишечника расправление узла производится в исключительных случаях – небольшом сроке от чала заболевания (до 4 часов) и явной жизнеспособности органа. В противном случае расправление узла опасно резорбцией и развитием выраженного эндотоксикоза и сопровождается более высокой летальностью, чем после резекции конгломерата. В этой связи в подавляющем большинстве случаев выполняют резекцию кишки.
Сначала производится дезинвагинация. Она заключается в острожном проталкивании головки инвагината в проксимальном направлении. Недопустимо вытягивать внедрившейся участок кишки. Оценивается жизнеспособность и решается вопрос о резекции кишки. При неудачной попытке дезинвагинации, наличии некроза или органической причины инвагинации выполняется резекция кишки.
5. Послеоперационный период.
Кишечная непроходимость запускает целый каскад многообразных патологических процессов, затрагивающих все органы и системы, но в центре событий находится сама тонкая кишка, являясь первичным и основным источником эндогенной интоксикации. Тяжелые гомеостатические нарушения и морфологические изменения тонкой кишки сохраняются даже после успешного оперативного разрешения непроходимости, что является причиной развития послеоперационных осложнений. Эти обстоятельства обосновывают необходимость интенсивной послеоперационной терапии, основные компоненты которой включают следующие мероприятия: 1. Инфузионная терапия для коррекции метаболических нарушений (коллоидные, кристалоидные, гликозированные, белковые растворы); 2. Парэнтеральное питание (со вторых суток послеоперационного периода и до момента перехода на самостоятельное пероральное или полное энтеральное питание); 3. Перидуральная анестезия с целью адекватного обезболивания и стимуляции моторики кишечника; 4. Антибиотикотерапия препаратами широкого спектра (Цефалоспорины 3 поколения, фторхинолоны, метранидазол, карбапенемы), введение которых продолжается до 7-9 суток послеоперационного периода; 5. У пациентов с изначально тяжелой непроходимостью проводят энтеротерапию через установленный назоинтестинальный двухпросветный зонд. Задачи этого лечения включают: детоксикацию, раннее восстановление функции тонкой кишки и нутритивную поддержку это позволяет снизить частоту послеоперационных осложнений и провести раннюю реабилитацию больных [18,67,73] (СР-С). Основными этапами энтеротерапии являются: декомпрессия тонкой кишки, ее лаваж глюкозо-электролитными растворами (со 2-х суток), введение олигопептидных средств с 3-х суток послеоперационного периода, с целью постепенного восстановления функций тонкой кишки и в последующем введение полисубстратных питательных смесей; 6. Симптоматическая терапия; Важным моментом послеоперационного ведения пациентов с ОКН является тщательный мониторинг состояния с целью ранней диагностики послеоперационных хирургических осложнений. Для этого наряду с оценкой клинической ситуации обязательно проведение ежесуточного лабораторного контроля (общий анализ крови, КЩС, биохимический анализ крови, электролиты крови) и контрольное УЗИ брюшной полости включая допплерографию внутристеночных сосудов тонкой кишки с целью оценки состояния тонкой кишки (ее диаметр, перистальтика, толщина стенки, кровоток) и наличия выпота в брюшной полости. Динамику восстановления функции тонкой кишки следует оценивать по следующим показателям [18] (СР – С):
1) Клиническим:
При неэффективности консервативной терапии пареза ЖКТ в течение 24 –
48 часов ставится вопрос о ревизии брюшной полости (лапароскопия, релапаротомия) в связи возможным развитием внутрибрюшных осложнений.
Список литературы
1. Group O.L.o.E.W. "The Oxford 2011 Levels of Evidence" // Oxford Centre for Evidence-Based Medicine. 2011. 2. Ерюхин И.А., Петров В.П. Ханевич М.Д., Кишечная непроходимость.
Руководство для врачей. – М.: Медицина, 1999. – С. 443. 3. Савельев, В. С. Руководство по неотложной хирургии. – М., 2004. – С. 640. 4. Menzies D., Ellis H. Intestinal obstruction from adhesions – how big is the problem? // Annals of the Royal College of Surgeons of England. – 1990. – Vol. 72. – N 1. – P. 60–63. 5. Wang Q., Hu Z.Q., Wang W.J., Zhang J., Wang Y., Ruan C.P. Laparoscopic management of recurrent adhesive small-bowel obstruction: Long-term follow-up // Surg Today. – 2009. – N 39(6). – P. 493–499. 6. Андрейцев И.Л. Острая спаечная кишечная непроходимость. Диагностика и лечение // Автореферат дисс. … докт. мед. наук. – М., 2005. – 43 с. 7. Багненко С.Ф., Синенчснко Г.И., Повзун С.А., и др. «Ишемические и реперфузионные повреждения тонкой кишки при странгуляционной кишечной непроходимости» // Материалы научно-практической конференции хирургов РФ «Сложные и нерешенные вопросы диагностики и лечения острого аппендицита, острой кишечной непроходимости и сочетанной травмы». – СПб., 2004 // Скорая медицинская помощь. – 2004. – № 5. – С. 1–266. 8. Кригер А.Г., Андрейцев И.Л., Горский В.А., и др. Диагностика и лечение острой спаечной тонкокишечной непроходимости // Хирургия. – 2001. – № 7. – С. 25–29. 9. Лебелев А.Г., Пахомова Г.В., Утешев Н.С. Желудочно-кишечная интубация при острой тонкокишечной непроходимости // Материалы научно-практической конференции хирургов РФ «Сложные и нерешенные вопросы диагностики и лечения острого аппендицита, острой кишечной непроходимости и сочетанной травмы». – СПб., 2004 // Скорая медицинская помощь. – 2004. – № 5. – С. 1–266. 10. Майоров М.И. Клинические аспекты острой кишечной непроходимости. Автореф. дисс. ... докт. мед. наук. – М., 2003. – 30 с. 11. Тотиков В.3., Калицова M.B., Aмриллаева В.M. Лечебно-диагностическая программа при острой спаечной обтурационной тонкокишечной непроходимости // Хирургия (журнал им. Н.И. Пирогова). – 2006. – № 2. – С. 38–43. 12. Чернов А.В. Криоденервация тонкой кишки в комплексном лечении острой кишечной непроходимости. Автореферат дисс. … канд. мед. наук. – Екатеренбург, 2006. 13. Gowen, G.F. Rapid resolution of small-bowel obstruction with the long tube, endoscopically advanced into the jejunum // Am J Surg. – 2007. – Vol. 193. – N. 2. – P. 184– 189.
14. Uludag M., Agkun I., Yetkin G., et al. Factors affecting morbidity and mortality in mechanical intestinal obstruction // Ulus Trauma Derg. – 2004. – Vol. 10. – P. 177–184. 15. Teixeira P.G., Karamanos E. Talving P. et al. Early operation is associated with a survival benefit for patients with adhesive bowel obstruction., Annals of surgery 2013, Sep;258(3):459-65 16. Kössi J., Salminen P., Laato M. The epidemiology and treatment patterns of postoperative adhesion induced intestinal obstruction in Varsinais-Suomi Hospital District // Scand J Surg. – 2004. – N 93(1). – P. 68–72. 17. Ray N.F., Denton W.G., Thamer M. et al. Abdominal adhesiolysis: inpatient care and expenditures in the United States in 1994 // J Am Coll Surg. – 1998. – Vol. 186. – P. 1–9. 18. Ларичев С.Е. «Пути улучшения результатов лечения острой спаечной тонкокишечной непроходимости» автореферат… доктора медицинских наук.,2013,- 47 с. 19. Mulholland, Michael W., Lillemoe, et al. «Greenfield's Surgery: SCIENTIFIC PRINCIPLES AND PRACTICE, 4th Edition» 2006, Lippincott Williams & Wilkins, p.2210 20. Fevang BT, Jensen D, Svanes K, Viste A. Early operation or conservative management of patients with small bowel obstruction? Eur J Surg. 2002;168:475– 481. 21. Maung A.A., Johnson D.C., Piper G.L. et al.. Evaluation and management of small-bowel obstruction: an Eastern Association for the Surgery of Trauma practice management guideline // J Trauma Acute Care Surg. 2012. Т. 73. № 5 Suppl 4. — C. S362-9. 22. Takeuchi K, Tsuzuki Y, Ando T, et al. Clinical studies of strangulating small bowel obstruction. Am Surg. 2004;70:40–44.
23. Tsumura H, Ichikawa T, Hiyama E, Murakami Y, Sueda T. Systemic inflammatory response syndrome (SIRS) as a predictor of strangulated small bowel obstruction.
Hepatogastroenterology. 2004;51:1393–1396. 24. Галеев Ю.М. и соав. Морфофункциональная оценка тонкой кишки при механической непроходимости кишечника // Гастроэнтерол, гепатол, колопроктол. – 2008. – Т. 28. – № 5. – С. 45–53.
25. Шаповальянц С.Г., Ларичев С.Е., И.В.Бабкова и др. Дифференциальная диагностика форм острой спаечной тонкокишечной непроходимости./ // Московский хирургический журнал.– №3.– 2013.– с.35–44 26. Ступин В.А. Михайлусов С.В. Мударисов Р.Р. и др., Ультразвуковая диагностика кишечной непроходимости // Вестник РГМУ. – 2007. – № 5(58). –С. 13–19. 27. Maglinte DD, Reyes BL, Harmon BH, et al. Reliability and role of plain film radiography and CT in the diagnosis of small-bowel obstruction. AJR Am J Roentgenol. 1996;167:1451–1455.
28. Щербатенко М.К., Береснева Э.А. Неотложная рентгенодиагностика острых заболеваний и повреждений органов брюшной полости. – М.: Медицина, 1977. – 207 с. 29. Кайзер Андреас М. Колоректальная хирургия Пер. с англ. Под ред. Ю.А.
Шелыгина, С.Е. Урядова. – М.: Издательство Панфилова; БИНОМ, Лаборатория знаний, 2011, - 751 с. 30. Sandikcioglu TG, Torp-Madsen S, Pedersen IK, Raaschou K, Mygind T, Thomsen S.
Contrast radiography in small bowel obstruction. A randomized trial of barium sulfate and a nonionic low-osmolar contrast medium. Acta Radiol. 1994;35:62– 64. 31. Biondo S, Pare´s D, Mora L, Martı´ Rague´ J, Kreisler E, Jaurrieta E. Randomized clinical study of Gastrografin administration in patients with adhesive small bowel obstruction.
Br J Surg. 2003; 90:542–546. 32. Choi HK, Chu KW, Law WL. Therapeutic value of gastrografin in adhesive small bowel obstruction after unsuccessful conservative treatment: a prospective randomized trial.
Ann Surg. 2002;236:1– 6.
33. Di Saverio S, Catena F, Ansaloni L, Gavioli M, Valentino M, Pinna AD./ Water-soluble contrast medium (gastrografin) value in adhesive small intestine obstruction (ASIO): a prospective, randomized, controlled, clinical trial.// World J Surg. 2008 Oct;32(10):2293-304. doi: 10.1007/s00268-008-9694-6. 34. Farid M, Fikry A, El Nakeeb A, Fouda E, Elmetwally T, Yousef M, Omar W./ Clinical impacts of oral gastrografin follow-through in adhesive small bowel obstruction (SBO). //J Surg Res. 2010 Aug;162(2):170-6. doi: 10.1016/j.jss.2009.03.092. Epub 2009 May 8. 35. Wadani H AI, Ibrahim N Al Awad, Hassan K A, et al., Role of Water Soluble Contrast Agents in Assigning Patients to a Non-Operative Course in Adhesive Small Bowel Obstruction,// Oman Medical Journal (2011) Vol. 26, No. 6:454-456 36. Yagci G, Kaymakcioglu N, Can MF, Peker Y, Cetiner S, Tufan T. Comparison of urografin versus standard therapy in postoperative small bowel obstruction. J Invest Surg. 2005;18:315–320.
37. Пахомова Г.В. Ярцев П.А, Гуляев А.А. и соавт. Совершенствование методов лечения кишечной непроходимости // Омский научный вестник. – Март 2004. – С. 99– 102.
38. Guo SB, Duan ZJ. Decompression of the small bowel by endoscopic long-tube placement // World J Gastroenterol. – 2012. – N 18(15). – Р. 1822–1826. 39. Schmutz GR, Benko A, Fournier L, Peron JM, Morel E, Chiche L. Small bowel obstruction: role and contribution of sonography. Eur Radiol. 1997;7:1054–1058. 40. Кунцевич Г.И. Ультразвуковая диагностика в абдоминальной и сосудистой хирургии. – М., 1999. 41. Ларичев С.Е., Мишукова Л.Б., Бабкова И.В.. Ультразвуковая диагностика нарушений внутристеночного кровотока приострой тонкокишечной непроходимости с помощью допплерографии // Медицинская визуализация. – 2002. – № 3. – С. 5–9. 42. Hamada T., Yamauchi M., Tanaka M., Hashimoto Y., Nakai K., Suenaga K.
Prospective evaluation of contrast-enhanced ultrasonography with advanced dynamic flow for the diagnosis of intestinal ischemia // The British Journal of Radiology. – 2007. – N 80. – Р. 603–608.
43. Huang JC, Shin JS, Huang YT, Chao CJ, et al. Small bowel volvulus among adults.// J Gastroenterol Hepatol. 2005 Dec;20(12):1906-12.
44. Ruiz-Tovar J, Morales V, Sanjuanbenito A, et al. Volvulus of the small bowel in adults.// Am Surg. 2009 Dec;75(12):1179-82. 45. Sugimoto S, Hosoe N, Mizukami T. Effectiveness and clinical results of endoscopic management of sigmoid volvulus using unsedated water-immersion colonoscopy.// Dig Endosc. 2014 Jul;26(4):564-8. doi: 10.1111/den.12235. Epub 2014 Feb 17. 46. Grafen F C, Neuhaus V, Schöb O, Turina M. Management of acute small bowel obstruction from intestinal adhesions: indications for laparoscopic surgery in a community teaching hospital // Langenbecks Arch Surg. – 2010 Jan. – N 395(1). – Р. 57–63. 47. Van Der Krabben A., Dijkstra F.R., Nieuwenhuijzen M. et al. Morbidity and mortality of inadvertent enterotomy during adhesiotomy // Br J Surg. – 2000. – Vol. 87. – P. 467–471. 48. Wullstein C., Gross E. Laparoscopic compared with conventional treatment of acute adhesive small bowel obstruction // Br J Surg. – 2003. – N 90(9). – P. 1147–1151. 49. Obuz F., Terzi C, Sökmen S, et al. The efficacy of helical CT in the diagnosis of small bowel obstruction. Eur J Radiol. 2003;48:299 –304. 50. Taourel P.G. Fabre JM, Pradel JA, et al. Value of CT in the diagnosis and management of patients with suspected acute small-bowel obstruction. AJR Am J Roentgenol. 1995;165:1187–1192.
51. Kim J.H., Ha HK, Kim JK, et al Usefulness of known computed tomography and clinical criteria for diagnosing strangulation in small-bowel obstruction: analysis of true and false interpretation groups in computed tomography. World J Surg. 2004;28:63– 68 52. Lazarus DE, Slywotsky C, Bennett GL, Megibow AJ, Macari M. Frequency and relevance of the “small-bowel feces” sign on CT in patients with small-bowel obstruction. AJR Am J Roentgenol. 2004; 183:1361–1366. 53. Jaffe TA, Martin LC, Thomas J, Adamson AR, DeLong DM, Paulson EK. Small-bowel obstruction: coronal reformations from isotropic voxels at 16-section multi-detector row CT.
Radiology. 2006;238:135–142. 54. Beall DP, Fortman BJ, Lawler BC, Regan F. Imaging bowel obstruction: a comparison between fast magnetic resonance imaging and helical computed tomography. Clin Radiol. 2002; 57:719 –724.
55. Kim JH, Ha HK, Sohn MJ, et al. Usefulness of MR imaging for diseases of the small intestine: comparison with CT. Korean J Radiol. 2000;1:43–50. 56. Lee JK, Marcos HB, Semelka RC. MR imaging of the small bowel using the HASTE sequence. AJR Am J Roentgenol. 1998;170:1457–1463.
57. Regan F, Beall DP, Bohlman ME, Khazan R, Sufi A, Schaefer DC. Fast MR imaging and the detection of small-bowel obstruction. AJR Am J Roentgenol. 1998;170:1465–1469. 58. Rollandi G.A. Magnetic resonance imaging of the small intestine and colon in Crohn’s disease // Radiol. Med. (Torino). – 1996. – Vol. 91. – N 1–2. – P. 81–85. 59. Sato A. Ischemic injury of the small intestine sdudied by 31P-MRS // J. Surg. Res. – 1996. – Vol. 61. – N 2. – P. 373–378. 60. Ермолов А.С., Утешев Н.С., Пахомова Г.В., Лебедев А.Г. Острая тонкокишечная непроходимость // Всероссийская конференция хирургов. Пятигорск, 1997. – С. 77–79. 61. Утешев Н.С., Гурчумелидзе Т.П., Романов Л.В., Карасев Н.А. Спаечная тонкокишечная непроходимость у больных пожилого и старческого возраста. Общая и неотложная хирургия // Респ. межведомственный сб. – Киев: Здоров'я, 1990. № 20. –С. 115–119.
62. Sugimoto S., Mizukami T., Ito T., et al. Endoscopic detorsion for sigmoid volvulus using unsedated water-immersion colonoscopy //Endoscopy 2013; 45(S 02): E263-E264 63. Burge J, Abbas SM, Roadley G, Donald J, Connolly A, Bissett IP, Hill AG.
Randomized controlled trial of Gastrografin in adhesive small bowel obstruction // ANZ J Surg. – 2005 Aug;75(8):672-4. 64. Шаповальянц С.Г., Ларичев С.Е., Жемухова З.А., и др. Прогнозирование эффективности консервативной терапии при острой спаечной тонкокишечной непроходимости // РЖГГК. – 2011. – № 1. – С. 57–62. 65. Chen Xiao-Li, Ji Feng, Lin Qi, et al. «A prospective randomized trial of transnasal ileus tube vs nasogastric tube for adhesive small bowel obstruction» World J Gastroenterol 2012 April 28; 18(16): 1968-1974. 66. Kanno Y., Hirasawa D., Fujita N., et al. Long intestinal tube insertion with the ropeway method facilitated by a guidewire placed by transnasal ultrathin endoscopy for bowel obstruction. Dig Endosc 2009. – N 21. – P. 196–200. 67. Чуприс В.Г. Острая тонкокишечная непроходимость неопухолевого генеза (патогенез, диагностика, лечение). Автореферат дисс. … докт. мед. наук. – СПб., 2009. 68. Zerey M., Sechrist C.W., Kercher K.W., Sing R.F., Matthews B.D., Heniford B.T.
Laparoscopic management of adhesive small bowel obstruction // Am Surg. – 2007 Aug. – N 73(8). – P. 773–778
69. Cirocchi R, Abraha I, Farinella E, Montedori A, Sciannameo F. Laparoscopic versus open surgery in small bowel obstruction. Cochrane Database Syst Rev. 2010 Feb 17;(2):CD007511. doi: 10.1002/14651858.CD007511.pub2.
70. Ghosheh B, Salameh JR. Laparoscopic approach to acute small bowel obstruction: review of 1061 cases // Surg Endosc. – 2007 Nov. – N 21(11). – Р. 1945–1949; Epub 2007 Sep 19.
71. Nagle A., Ujiki M., Denham W. et al. Laparoscopic adhesiolysis for small bowel obstruction // Am J Surg. – 2004. – N 187. – P. 464–470. 72. Suter M., Zermatten P., Halkic N., Martinet O., Bettschart V. Laparoscopic management of mechanical small bowel obstruction: are there predictors of success or failure? // Surg Endosc. – 2000 May. – N 14(5). – P. 478–483. 73. Попова Т.С., Баклыкова Н.М., Шрамко Л.У. и др. Теоретические основы энтерального питания при хирургической патологии органов брюшной полости // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 1995. – Т. 5. – № 4.
74. Grassi R., Romano S., D’Amario F. et al. The relevance of free fluid between intestinal loops detected by sonography in the clinical assessment of small bowel obstruction in adults // Eur J Radiol. – 2004. – Vol. 50(1). – Р. 5–14. 75. Czechowski J. Conventional radiography and ultrasonography in the diagnosis of small bowel obstruction and strangulation // Acta Radiol. – 1996. – Vol. 37. – N 2. – P. 186– 189.
76. Catena F. Di Saverio S., Kelly M. D. et al. Bologna Guidelines for Diagnosis and Management of Adhesive Small Bowel Obstruction (ASBO): 2010 Evidence-Based Guidelines of the World Society of Emergency Surgery. World Journal of Emergency Surgery 2011; 6:5.
77. Sakakibara T, Harada A, Yaguchi T, Koike M, Fujiwara M, Kodera Y, Nakao A: The indicator for surgery in adhesive small bowel obstruction patient managed with long tube.
Hepatogastroenterology 2007, 54(75):787-90. 78. Komatsu Issei, Tokuda Yasuharu, Shimada Gen, Jacobs Joshua L: Hisashi Onodera Development of a simple model for predicting need for surgery in patients who initially undergo conservative management for adhesive small bowel. The American Journal of Surgery August 2010, 200(2):215-223.

















.jpg)




.png)
















Комментарии