- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Ахалазия кардии
| Авторы: | М. П. Королев, д. м. н., профессор Л. Е. Федотов, д. м. н., профессор А. Л. Оглоблин, к. м. н., доцент А. В. Климов, к. м. н. Р. М. Лукьянчук Ш. Д. Мамедов Б. Л. Федотов 2016г. |
Полный текст статьи:
Методическое пособие для клинических интернов, клинических ординаторов, врачей-эндоскопистов и хирургов
Глава 1 НОРМАЛЬНАЯ АНАТОМИЯ ПИЩЕВОДА
Пищевод (esophagus) имеет вид трубки, соединяющей глотку с желудком. Место перехода глотки в пищевод у взрослого соответствует уровню VI шейного позвонка или нижнему краю перстневидного хряща. Место перехода в желудок проецируется на уровне XI грудного позвонка. У новорожденных начало пищевода находится на уровне IV–V шейных позвонков. У живого человека эти границы могут изменятся при запрокидывании головы, глубоком вдохе или опущении желудка. Длина пищевода у новорожденных достигает 8–12 см, к двум годам — 20 см, а у взрослого — до 25 см.
Залегая небольшой частью в области шеи, пищевод через apertura thoracis superior опускается в грудную полость, а затем, пройдя последнюю, через hiatus esophagus диафрагмы проникает в полость живота, переходя в кардиальную часть желудка. В связи с этим в пищеводе различают три отдела: шейную часть (pars cervicalis), грудную часть (pars thoracica) и брюшную часть (pars abdominalis).
Шейный отдел пищевода простирается от уровня VI шейного позвонка до I–II грудных. Длина его колеблется от 5 до 8 см.
Грудной отдел имеет наибольшую длину — 15–18 см и заканчивается на уровне X–XI грудных позвонков, т. е. у места вхождения в hiatus esophageus.
Брюшной отдел пищевода наиболее короткий, достигает в длину 1–3 см. У места перехода в желудок несколько расширяется.
Пищевод лежит впереди позвоночного столба и на своем пути имеет 4 изгиба: два — в сагиттальной и два во фронтальных плоскостях. Начальный отдел пищевода располагается почти строго по срединной линии. На уровне II грудного позвонка он отклоняется влево, занимая в области III–IV позвонков крайнее левое положение. Затем на уровне V-го он вновь залегает по средней линии, а ниже несколько вправо от нее, будучи оттеснен аортой. Изгиб вправо простирается до уровня VII грудного позвонка. Направляясь книзу, пищевод от VIII–X позвонков снова переходит на левую сторону. Описанные два изгиба лежат во фронтальной плоскости. Первый изгиб в сагиттальной плоскости залегает ниже бифуркации трахеи. Второй сагиттальный изгиб отмечается несколько ниже, на уровне VIII–IX позвонков, соответственно месту перехода через диафрагму.
По своему ходу пищевод примыкает к ряду органов. Шейная часть пищевода своей задней поверхностью лежит на lamina prevertebralis, соединяясь с ней рыхлой клетчаткой, а передняя поверхность прилегает к paries membranaceus трахеи. С боков к пищеводу в этом отделе близко подходят общие сонные артерии и возвратные гортанные нервы.
Грудной отдел пищевода своей задней поверхностью также залегает вдоль позвоночника, а передней в области верхней трети прилегает к перепончатой стенке трахеи, затем на уровне IV–V позвонков он пересекает дугу аорты, а ниже последней примыкает к задней поверхности левого бронха, соединяясь с ним при помощи слаборазвитой бронхопищеводной мышцы, m. bronchoesophageus. В нижней трети пищевод касается участка перикарда, соответствующего левому предсердию и левому желудочку, и, направляясь вниз, спирально огибает аорту, переходя в брюшную часть. Последняя перекрыта спереди левой долей печени (рис. 1).
Стенка пищевода имеет три оболочки: слизистую, мышечную и адвентициальную; брюшная часть кроме этого покрыта серозной оболочкой.
Слизистая оболочка (tunica mucosa) покрыта многослойным плоским неороговевающим эпителием. В абдоминальном отделе может встречаться призматический эпителий. Толщина слизистого слоя образована «клеточным слоем» и развитой lamina muscularis mucosae, состоящей из гладких волокон, роль которых сводится к сокращению слизистой оболочки при уменьшении просвета пищевода.
На поперечном срезе просвет пищевода имеет вид звездчатой щели благодаря сжатым стенкам и хорошо выраженным продольным складкам. Величина последних связана со значительным развитием рыхлой соединительной ткани, образующей подслизистую основу, tela submucosa, залегающую между слизистой и мышечной оболочками. В подслизистом слое располагается множество сосудов, слизистых пищеводных желез (gll. еsophagea) протоки которых открываются на поверхности слизистой оболочки, и одиночные лимфатические фолликулы.
Мышечные слои развиты неравномерно. Так, продольная мускулатура складывается из продольных волокон, обособляющихся в верхней части пищевода в два тяжа, которые прикрепляются к перстневидному хрящу гортани. Поэтому в начальной части пищевода остается участок без продольного слоя. Циркулярный слой стенки пищевода в верхних отделах связан с мускулатурой глотки, а внизу переходит в циркулярные и косые волокна мышечной стенки желудка. На протяжении органа местами можно видеть слаборазвитый продольный слой, залегающий кнутри от циркулярного. По пути мышечная оболочка посылает отростки, которые в виде тяжей подвешивают пищевод к окружающим органам. В том месте, где пищевод проходит через диафрагму, его мышечные пучки тесно соединены с ее мышечными пучками, которые образуют вокруг пищевода круговую мышцу, напоминающую собой жом.
Адвентициальная оболочка (tunica adventicia) пищевода образована рыхлой соединительной тканью, содержащей незначительное количество эластических волокон. При посредстве этой оболочки пищевод фиксируется к другим органам, залегающим вокруг него в заднем средостении. В толще этой оболочки проходят основные кровеносные сосуды, осуществляющие кровоснабжение пищевода, лимфатические сосуды, несущие лимфу от стенок пищевода, а также нервные стволы, образующие здесь сплетения.
Кровоснабжение пищевода осуществляется из нескольких источников, причем питающие его артерии образуют между собой обильные анастомозы. Аа. oesophageae к pars cervicalis пищевода происходят из a. thyroidea inferior. Pars thoracica получает несколько веточек непосредственно из aorta thoracica, pars abdominalis питается из aa. phrenicae inferiores и gastricae sinistrae. Венозный отток из шейной части пищевода происходит в v. brachiocephalis, из грудного отдела — в vv. azygos et hemiazygos, из брюшного — в притоки воротной вены.
От шейного и верхней трети грудного отдела пищевода лимфатические сосуды идут к глубоким шейным узлам, предтрахеальным и паратрахеальным, трахеобрахеальным и задним средостенным узлам. От средней трети грудного отдела восходящие сосуды достигают названных узлов грудной клетки и шеи, а нисходящие (через hiatus esophageus) — узлов брюшной полости: желудочных, пилорических и панкреатодуоденальных. В названные узлы впадают сосуды, идущие и от остальной части пищевода (наддиафрагмального и брюшного отделов его) [18].
Иннервация пищевода сложна и своеобразна. Парасимпатическая иннервация осуществляется через блуждающие и возвратные нервы, симпатическая — через узлы пограничного и аортального сплетений, ветви легочного и кардиального сплетений, а также волокна солнечного сплетения ганглиев субкардии. Многочисленные нервные ветви образуют поверхностные переднее и заднее сплетения пищевода. Переднее сформировано в основном волокнами правого блуждающего нерва, а заднее — левого. Существует множество анастомозов между нервными структурами в сплетениях.
Интрамуральный нервный аппарат состоит из трех тесно связанных друг с другом сплетений — адвентициального, межмышечного (Ауэрбахово сплетение) и подслизистого (Мейснеровское сплетение). В этих нервных образованиях есть ганглиозные клетки Догеля, обусловливающие автономную внутреннюю иннервацию и местную регуляцию двигательной функции пищевода. Блуждающие нервы своими мякотными волокнами связаны с интрамуральными сплетениями, а безмякотными — с другими внутристеночными сплетениями. Часть безмякотных волокон заканчивается на мышечных клетках. Таким образом, пищевод имеет как бы свою собственную автономную нервную систему. Рефлекторная саморегуляция осуществляется в основном интрамуральными сплетениями.
Шейная часть пищевода иннервируется возвратным нервом, грудная — ветвями блуждающего и симпатического нервов, нижним чревным нервом. Волокна возвратного нерва иннервируют поперечнополосатую мускулатуру, симпатического — гладкую мускулатуру пищевода. Эфферентные нервные волокна, кроме мышц, иннервируют железы пищевода, а афферентные волокна (ThV–ThVII) осуществляют сенсорную иннервацию.
Слизистая оболочка пищевода чувствительна к тепловым, болевым раздражениям, наличию и задержке содержимого, причем наиболее восприимчивы дистальные сегменты и кардия. К механическому раздражению наиболее чувствительны область устья пищевода и места физиологических сужений. Сенсорная иннервация осуществляется блуждающим нервом. Симпатическая нервная система контролирует тонус пищевода. Таким образом, пищевод и кардия содержат собственный интрамуральный нервно-мышечный аппарат, регулируемый центральной и вегетативной нервной системой.
Иннервацию ножек диафрагмы, особенно правой, обеспечивают ветви диафрагмальных нервов [19].
Перистальтика пищевода и расслабление нижнего пищеводного сфинктера контролируются энтеральной нервной системой, представляющей собой сложную сеть нервов и сплетений, работу которых координируют ЦНС и ядра блуждающего нерва, расположенные в дне IV желудочка. Нейроны, входящие в состав энтеральной нервной системы, контролируют двигательную активность желудочно-кишечноготракта и располагаются в Ауэрбаховом межмышечном нервном сплетении. Существуют два основных типа нейронов: тормозящие, нейротрансмиттерами которых являются оксид азота (NO) и вазоактивный интестинальный пептид, и возбуждающие, медиатором которых является ацетилхолин [41].
Глава 2 ФИЗИОЛОГИЯ
Целью данной главы является ознакомление читателя с нормальной физиологией пищевода для того, чтобы приблизиться к пониманию патофизиологических механизмов развития ахалазии.
Глотание — нейромышечная реакция с произвольным и непроизвольным компонентами. В среднем человек глотает 600 раз в сутки (200 раз во время еды,
50 раз во время сна, 350 раз в остальное время), преимущественно бессознательно. Процесс глотания можно разделить на две фазы: ротовую и глоточную. Ротовая фаза преимущественно произвольная. Полость рта закрывается спереди губами, по центру языка формируется пищевой комок, и далее происходит проталкивание назад до твердого неба. При этом в процессе глотания язык обеспечивает до 80 % энергии, требуемой для транспорта пищевого комка до пищевода. С задней поверхности языка пищевым комком запускается рефлекторный ответ глотки, и последующие движения являются преимущественно непроизвольными. Рефлекторный ответ глотки состоит из 5 фаз и происходит в течение 1 секунды. Первая фаза — закрытие носоглотки в результате сокращения мягкого неба. Это предотвращает попадание комка в носовую полость и способствует его эффективному продвижению в нижние отделы глотки. Вторая фаза — передневерхнее смещение гортани, предупреждает аспирацию. Третья фаза — исключат попадание пищи в гортань, последняя закрывается надгортанником, истинными и ложными голосовыми складками. Расслабление верхнего пищеводного сфинктера происходит после закрытия и смещения гортани и составляет четвертую фазу. Последней фазой глотания является стимуляция сокращения глотки с последующим пассажем комка в открытый пищевод.
Все стадии глотания зависят от характера пищевого комка. Для твердой пищи требуется большее открытие верхнего пищеводного сфинктера и более сильное сокращение глотки. Для жидкой пищи — меньшее открытие верхнего пищеводного сфинктера и меньшая степень сокращения глотки. Кроме того, от размера и консистенции пищевого комка зависит продолжительность открывания сфинктера. Для прохождения большого и твердого комка необходимо большее время открытия. Закрытие сфинктера совпадает с распространением сокращения по глотке, и тонус верхнего пищеводного сфинктера после глотка больше, чем его исходный тонус, что предотвращает ретроградный пассаж пищевых масс. Ретроградный выход газов (отрыжка) запускает расслабление сфинктера растяжением тела пищевода, и продолжительность расслабления соответствует времени полного прохождения газов.
Перистальтика пищевода возникает сразу после того, как сокращение, начинающееся с глотки, пройдет через верхний пищеводный сфинктер. Средняя скорость перистальтики — 2–4 см/с. Первичная перистальтика стимулируется глотанием, в то время как вторичная — запускается растяжением пищевода. Перистальтика в отсутствии внешней иннервации называется автономной, предполагая тем самым, что она может инициироваться только на интрамуральном уровне.
Другая особенность механизма перистальтики — способность угнетаться при глотании. Второй глоток полностью угнетает прохождение первого, если начинается до того, как первый глоток проходит часть пищевода, имеющую поперечнополосатую мускулатуру. Если первый глоток достигает дистальных отделов пищевода в момент второго глотка, то перистальтика первого глотка угнетается только частично. Короткие повторные глотательные движения вызывают полное угнетение пищевода с расслаблением нижнего пищеводного сфинктера. Нормальная перистальтика возможна лишь при медленных глотках и полном освобождении пищевода от предыдущего пищевого комка.
Физиологические механизмы контроля над сокращением поперечнополосатой мускулатуры пищевода осуществляются главным образом возбуждающим действием блуждающего нерва, последовательная иннервация стимулирует нормальный процесс перистальтики. При прохождении через пищевод большого или твердого пищевого комка афферентные волокна, идущие от пищевода, повышают активность блуждающего нерва. Это подтверждает, что поперчнополосатый мышечный слой пищевода управляется центральными нервными структурами аналогично мускулатуре верхних отделов глотки.
Перистальтика гладкой мускулатуры пищевода отличается от перистальтики поперечнополосатой за счет различий в иннервации для каждой группы мышц. В основном поперечнополосатые мышцы иннервируются блуждающим нервом без участия регуляции интрамуральными сплетениями. Регуляция сокращения поперечнополосатых мышц берет начало в центральных структурах нервной системы. Хотя центральный механизм отсутствует в регуляции гладких мышц, полная центральная денервация не прекращает перистальтику. Вагусная регуляция является важной для изменения реакции через чувствительные окончания, вызывая более сильные перистальтические волны, если пищевой комок большой или плотный. Вторичная перистальтика вызывается растяжением и регулируется с помощью афферентной регуляции через блуждающий нерв, поэтому при его перерезке этот вид перистальтики нарушается.
Внутренний контроль перистальтики гладкой мускулатуры осуществляется разветвленной интрамуральной сетью. Ее участие в регуляции перистальтики подтверждается тем, что после перерезки блуждающего нерва перистальтика органа сохраняется. Эта сеть содержит как возбуждающие, так и угнетающие нейроны. Возбуждающие нейроны стимулируют сокращение продольных и циркулярных мышечных слоев через холинергические М2- рецепторы. Ингибирующие нейроны преимущественно локализуются в циркулярном мышечном слое и угнетают сокращение через нехолинергические и неадренергические нейротрансмиттеры. Основными тормозными нейротрансмиттерами считаются вазоактивный интерстициальный пептид и оксид азота. Холинергическая стимуляция возбуждающих нейронов происходит через никотиновые рецепторы, в то время как нехолинергическое и неадренергическое возбуждение может осуществляться через никотиновые и мускариновые М1-рецепторы. Оба типа нейронов иннервируют тело пищевода и нижний пищеводный сфинктер. Более тонкие механизмы, ответственные за перистальтику пищевода, до сих пор неизвестны.
Нижний пищеводный сфинктер представлен толстым мышечным кольцом, которое направлено косо вверх от малой к большой кривизне желудка. Средняя длина этого кольца составляет 31 мм. Оно соответствует зоне пищевода, в которой давление, измеренное манометрически, достигает максимальных значений. Кроме того, в сфинктерный аппарат входит часть правой ножки диафрагмы. Доказано, что сокращение правой ножки диафрагмы — главный механизм поддержки тонуса нижнего пищеводного сфинктера при повышении давления в брюшной полости, что предотвращает обратный рефлюкс.
Тонус нижнего пищеводного сфинктера у здоровых людей в состоянии покоя составляет 10–30 мм рт ст. Минимальное давление сфинктера определяется после приема пищи, максимальное — ночью. Тонус его преимущественно миогенный, так как он в эксперименте не нарушается препаратом ингибирующим активность нейронов. Но тонус снижается под действиеам атропина, что говорить о нейрональной регуляции. Кроме того при голодании и при приеме пищи на миогенные свойства гладких мышц сфинктера влияют гормоны и другие вещества.
Базальный тонус нижнего пищеводного сфинктера угнетается при глотании, когда происходит расслабление всей гладкой мускулатуры пищевода. Расслабление сфинктера стимулируется блуждающим нервом через преганглионарные холинергические волокна и постганглионарные нехолинергические и неадренергические нервные волокна. Механизмы, способствующие расслаблению сфинктера идентичны тем, что угнетают всю гладкую мускулатуру пищевода. Нехолинергический и неадрнергический нейротрансмитер, передающий этот сигнал еще не известен, но предполагается, что им могут быть вазоактивный интестинальный полипептид, пептид гистидинизолейцин и оксид азота. Учитывая, что все три вещества потенциально участвуют во многих механизмах, действие каждого из них или их сочетанное действие может быть очень важным. Роль дафрагмы в расслаблении нижнего пищеводного сфинктера также очень важна, поскольку во время расслабления сфинктера волокна ножки диафрагмы не проявляют электрическую активность, в то время как купол диафрагмы сохранят свой тонус. Рефлекс угнетения ножек диафрагмыисчезает при ваготомии.
Таким образом, сложная иннервация пищевода обуславливает трудности в понимании причины нервномышечных заболеваний органа, что требует дальнейшего изучения [29, 35, 36].
2.1 Определение
Ахалазия кардии — врожденное или приобретенное расстройство моторики органа, проявляющееся нарушением прохождения пищи в желудок в результате недостаточного рефлекторного раскрытия нижнего сфинктера пищевода при глотании и беспорядочной перистальтики вышележащих отделов пищеводной трубки [5].
Впервые заболевание, сходное с ахалазией кардии, описал Thomas Willis в 1679 г. в работе «Parmaceutice rationalis» [72]. В 1882 г. Mikulicz в качестве этиологического фактора заболевания указал спазм кардии, развившийся под влиянием внутренних или внешних факторов. Исходя из этого механизма, он предложил название — кардиоспазм [46].
Термин «ахалазия» принадлежит С. Perry, в клиническую практику его ввел Hurts в 1914 г. как понятие, обозначающее отсутствие расслабления кардии при глотании. Факт отсутствия раскрытия нижнего пищеводного сфинктера при акте глотания и дал название болезни (лат. a — отсутствие, chalasia — расслабление), а затем Rake на основании гистологических исследований показал, что при кардиоспазме в области кардии наблюдается дегенерация нервных клеток интрамуральных нервных сплетений. На основании полученных данных сформировалось предположение, что в основе кардиоспазма лежит не спазм кардии, а утрата ею способности к раскрытию в ответ на акт глотания. В связи с этим было предложено более точное название — ахалазия кардии [43].
Также часто встречаются следующие термины: мегаэзофагус, долихоэзофагус, идиопатическое расширение пищевода, френоспазм.
Существует мнение, что кардиоспазм и ахалазия кардии — два разных заболевания, основанное на том, что при кардиоспазме поражается центральная иннервация (преганглионарные нейроны дорсальных ядер блуждающих нервов), в результате чего мускулатура нижнего пищеводного сфинктера становится более, чем обычно, чувствительна к эндогенному гастрину, и, таким образом, наблюдается истинный спазм кардии. При ахалазии кардии преимущественно поражаются постганглионарные нейроны, в результате чего выпадает рефлекс раскрытия кардии на глоток [24].
Несмотря на такое спорное деление на кардиоспазм и ахалазию кардии, термин «ахалазия кардии» признан и зарегистрирован в Международной классификации болезней (МКБ‑10; К‑22.0 Ахалазия кардиальной части).
Во многих зарубежных источниках встречается термин «идиопатическая ахалазия кардии». В ряде публикаций в определении заболевания подчеркивается роль воспалительного процесса в зоне кардиального жома. Идиопатическая ахалазия — это воспалительное заболевание неизвестной этиологии, характеризующееся отсутствием перистальтики пищевода и неспособностью нижнего пищеводного сфинктера к расслаблению вследствие потери ингибиторных нейронов в пищеводном межмышечном сплетении [75].
Глава 3 ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
В настоящее время нет четкого представления об этиологии и патогенезе ахалазии кардии, поэтому существует множество гипотез, теорий и патогенетических механизмов заболевания.
Существует генетическая гипотеза: у детей самой частой причиной ахалазии кардии является мутация гена ALADIN 12q13, которая приводит к развитию аутосомнорецессивного заболевания, так называемого синдрома Allgrove, или синдрома ААА (adrenal insufficiency, achalasia and alcrima), характеризующегося развитием ахалазии кардии, алакримии и болезни Аддисона [68]. Сейчас известно, что это связано с мутацией в АААS-гене [47]. Эти находки побудили к более детальному обследованию больных ахалазией кардии с целью выявления генной патологии. B. Zilberstein (2005) описывает четыре случая генетически обусловленной ахалазии кардии без мультисистемных нарушений, как при синдроме Allgrove [75]. Однако несмотря на небольшое количество публикаций, указывающих на связь мутации АААS- гена и развития ахалазии кардии, встречаются единичные публикации, опровергающие это положение [37].
Риск развития ахалазии повышен и у детей с трисомией 21-й хромосомы (болезнью Дауна). Примерно 75 % таких пациентов имеют заболевания желудочно-кишечного тракта и у 2 % развивается ахалазия кардии [50]. Риск ахалазии кардии у детей с синдромом Дауна выше в 200 раз, чем в общей популяции [76]. Есть редкое наблюдение развития ахалазии кардии у ребенка в возрасте 5 лет с синдромом Дауна [57].
Еще одна теория, указывающая на роль генетических факторов в развитии ахалазии кардии, связана с полиморфизмом гена IL23R, локализованного в хромосоме Ip31. Она находит свое подтверждение в исследовании, проведенном в Испании, в ходе которого изучался полиморфизм гена IL23R Arg381 Gln у 262 пациентов с ахалазией кардии и 802 здоровых людей. Установлено, что у мужчин младше 40 лет с ахалазией кардии достоверно чаще встречается полиморфизм данного гена, что позволяет сделать вывод о важной роли IL23R как предрасполагающего фактора в развитии ахалазии кардии [38]. Найдена также ассоциация между ахалазией кардии и специфическим HLA-генотипом. Исследование, проведенное в 2002 г., изучавшее уровень циркулирующих аутоантител с HLA DQA1- и DQB 1-аллелями у пациентов с ахалазией кардии и здоровых лиц, показало, что у всех женщин и 66,7 % мужчин с ахалазией и DQA1-0103 и DQB 1-0603-аллелями выявлены аутоантитела к межмышечным сплетениям [63].
Заслуживает внимания теория о полиморфизме NO-синтазы (NOS), которая представляет собой фермент, катализирующий образование NO из аргинина, кислорода и NADPH. Существуют три типа NOS: нейрональная (nNOS), индуцибельная (iNOS) и эндотелиальная (eNOS). Ответственные за них гены локализуются в хромосомах: 12q24.2, 17q11.2q12 и 7q36. В ряде работ показан полиморфизм всех трех генов у пациентов с ахалазией кардии. При этом чаще всего выявлялся полиморфизм iNOS 22-A/Ab и eNOS‑4a4a [51, 70]. В настоящее время установлена зависимость интрамурального нервного аппарата пищевода от дефицита оксида азота (NO), который является главным неадренергическим, нехолинергическим ингибиторным нейротрансмиттером в гастроинтестинальном тракте. NO высвобождается в ответ на нервную стимуляцию межмышечного сплетения и приводит к расслаблению гладкой мускулатуры и регулирует мышечный тонус нижнего пищеводного сфинктера, привратника, сфинктера Одди, ануса, а также перистальтический рефлекс кишечника [58, 69].
Кроме оксида азота, вторым нейротрансмиттером тормозящих нейронов является вазоактивный интестинальный пептид. Одним из его рецепторов является рецептор 1, который принадлежит к семейству секретиновых и экспрессируется различными иммунными клетками, такими как Т-лимфоциты, макрофаги и дендритные клетки [59]. Полиморфизм этого гена (VIPR 1) также может играть роль в развитии ахалазии кардии. VIPR 1-ген локализуется в хромосоме 3p22, и в ходе некоторых исследований были показаны 5 его простых нуклеотидных вариаций, таких как (rs421558) Intron‑1, (rs437876) Intron‑4, (rs417387) Intron‑6, rs896 и rs9677 (3’UTR) [59, 60].
Аутоиммунная теория в патогенезе ахалазии кардии заслуживает отдельного внимания. Интересен тот факт, что одинаковые аутоантитела могут встречаться как при паранеопластических, так и идиопатических нарушениях моторики желудочно-кишечного тракта [48]. Примером может служить частое обнаружение антинейрональных нуклеарных антител (ANNA‑1) при мелкоклеточном раке легких и антител к клеткам Пуркинье (PCA‑1) при карциноме яичников и молочных желез, при сопутствующих им нарушениях двигательной функции пищевода [49, 52].
Как установлено в ряде работ, в популяции пациентов с ахалазией кардии возрастает риск развития аутоиммунных заболеваний. Так, проведенное в Канаде исследование, включавшее 193 пациента с диагнозом ахалазия кардии, показало повышенный риск развития некоторых аутоиммунных заболеваний у этих больных в сравнении с контрольной группой: сахарного диабета 1-го типа в 5,4 раза, гипотиреоза в 8,5 раза, синдрома Шегрена в 37 раз, системной красной волчанки в 43 раза и увеита в 259 раз, что в общем дает повышение риска аутоиммунных заболеваний у пациентов с ахалазией кардии в 3,6 раза [30].
W. B. Storch (2002) c коллегами провели исследование по обнаружению иммунных комплексов, иммуноглобулинов (G, A, M) у больных ахалазией кардии, в результате которого у всех больных с ахалазией кардии, в отличие от контрольной группы, были выявлены антитела к Ауэрбаховому сплетению, что говорит о роли аутоиммунных процессов в патогенезе ахалазии кардии. Однако тригерные механизмы остаются неясными. R. de Giorgio (2004) предположил в качестве возможной причины развития нейромышечных заболеваний пищеварительного тракта (ахалазия кардии, гастропарез, мегаколон) энтеральный ганглионит. Клиническая картина заболевания часто развивается после ОРВИ. Иммунный ответ в ганглиях приводит к дисфункции и дегенерации, а иногда и полной потере энтеральных нейронов. Диагноз энтерального ганглиона основывается на определении циркулирующих в крови антинейронных антител против молекулярных цепей, включая Н и Y протеины, рецепторы нейротрансмиттеров и ионных каналов. В работе P. L. Moses c соавторами высказывается предположение о том, что тригерным механизмом для выработки антител может служить гастроэзофагеальная рефлюксная болезнь. В некоторых исследованиях доказано сочетание ахалазии кардии и тиреоидной патологии. Так, в исследовании, проведенном в Иране в 2007 г., среди 30 пациентов с ахалазией кардии у 23,2 % выявлена патология щитовидной железы, из них у 13,3 % — гипотиреоз, у 6,6 % — гипертиреоз и у 3,3 % — эутиреоидный зоб [39].
Одной из причин являются инфекционные заболевания. В течение многих лет болезнь Чагаса рассматривают как один из этиологических факторов в развитии ахалазии кардии. Это заболевание, называемое также американским трипаносомозом, вызывается микроорганизмом Trypanosoma cruzi и встречается в странах Латинской Америки. Заболевание протекает в две фазы. Первая является острой и связана с циркуляцией паразитов в крови. Вторая фаза проявляется в проникновении трипаносом в миокард и мышечный слой пищевода, где и происходит их кумуляция. Процесс сопровождается в основном поражением межмышечных сплетений пищевода, что приводит к последующим дегенеративным изменениям в них и нарушению двигательной функции пищевода. Именно в эту фазу происходит нарушение расслабления нижнего пищеводного сфинктера и развивается атония пищевода, которые проявляются дисфагией, срыгиванием и болью по ходу пищевода при проглатывании пищи [31]. В ходе поисков возможных этиологических факторов ахалазии кардии высказывается также предположение о вирусной природе заболевания. Так, существует некая корреляция между ахалазией кардии и предшествующими инфекционными заболеваниями, в частности корью и опоясывающим лишаем, возбудителем которого является Herpes zoster [56]. Однако отсутствие четких клинико-эпидемиологических данных о заболевании ахалазией кардии не позволяет создать законченную инфекционную теорию происхождения этого заболевания. В пользу инфекционной теории свидетельствуют гистологические изменения воспалительного характера в области кардии у соответствующих больных. В зоне пищеводно-желудочного перехода наблюдались разрастания соединительной ткани, появление вокруг кровеносных сосудов очагов лимфоидноклеточной инфильтрации, гиалиноз капилляров, картины гипертрофии или же, наоборот, атрофии мышечных волокон с явлениями их вакуольной дистрофии [22].
В 60–80-е годы ХХ века подчеркивалась роль нервно-психических заболеваний в развитии ахалазии кардии. Так, многие авторы (напр. В. П. Воробьева, Н. Н. Еланский. Б. В. Петровский) в большом числе наблюдений отмечают начало развития заболевания после эмоционального стресса [2, 6, 17]. Подтверждением этих взглядов явились результаты наблюдений S. Wolf и T. Almy, которые у здоровых людей в стрессовых состояниях рентгенологически доказали развитие спастических явлений в нижней трети пищевода, весьма сходных с рентгенологической картиной, наблюдающейся при ахалазии кардии.
Однако частота развития ахалазии кардии при психической травме разными авторами оценивается с большой вариабельностью. Так, Б. В. Петровский психическую травму в качестве этиологического момента описывает в 78,1 % случаев [35], А. З. Моргенштерн — в 94 % [12], в то время как К. Н. Зиверт — только в 12 % [7]. Выяснению роли центральной нервной системы в развитии ахалазии кардии посвящены исследования В. В. Уткина [21] и Г. А. Янковского [27], в которых больным выполняли электроэнцефалографию (ЭЭГ) и исследовали реакцию вегетативной нервной системы в ответ на введение адреналина. Было доказано, что у всех больных ахалазией кардии ЭЭГ имела патологический характер (нерегулярный α-ритм), а подкожное введение атропина восстанавливало регулярность ритма и нормализовывало ЭЭГ. При адреналовом тесте в 85,7 % случаев наблюдали патологическую реакцию (артериальное давление или снижалось на 5–10 мм рт. ст. или не изменялось). Было предположено, что ахалазия кардии является первичным функциональным расстройством, развивающимся на фоне корковой нейродинамики, с явлениями дисфункции вегетативной нервной системы. Однако не всегда прослеживается связь заболевания с психологический травмой. В настоящее время многие авторы не признают нарушение корковой или подкорковой нейродинамики ведущей причиной болезни, хотя астеноневротический фон и значительные изменения ЭЭГ выявляются у большинства больных. В работах В. Т. Ивашкина и А. С. Трухманова при тестировании больных ахалазией кардии с использованием методики многостороннего исследования личности (MMPI) не было выявлено отклонений в целом по группе. Более того, при сравнении соответствующих показателей больных ахалазией кардии отмечена меньшая степень невротизации, чем, например, у больных язвенной болезнью. Это, по мнению исследователей, свидетельствует о том, что особенности поведения больных ахалазией кардии вторичны и связаны с психотравмирующей ситуацией, которую создает сама болезнь [8].
О значении дисфункции вегетативной нервной системы может свидетельствовать и частое сочетание ахалазии кардии с другими заболеваниями. Так, сочетание ахалазии кардии с язвенной болезнью желудка и двенадцатиперстной кишки наблюдается в 14–24 %, при язвенной болезни желудка некоторые жалобы схожи с таковыми при ахалазии кардии [11].
Ахалазия кардии может возникнуть в результате диффузного эзофагоспазма. S. S. Khatami et al. (2005) наблюдали 12 больных с диффузным эзофагоспазмом на протяжении длительного времени (в среднем 4,8 года), в результате только у одного больного (8 %) был диагностирован переход диффузного эзофагоспазма в ахалазию кардии. У 7 пациентов (58 %) сохранился эзофагоспазм, у 3 пациентов (25 %) моторика пищевода нормализовалась. По данному исследованию можно предположить, что эзофагоспазм в качестве этиологического фактора развития ахалазии кардии не может рассматриваться как основной.
Таким образом, этиология и патогенез ахалазии кардии остаются неясными. В настоящее время принято считать, что ключевую роль в патогенезе играет повреждение межмышечного нервного сплетения пищевода и как следствие длительное спастическое закрытие кардии, которое вызывает ишемию тканей пищевода, в первую очередь нервных окончаний и рецепторов, как наиболее чувствительных. Развивающиеся вслед за этим дистрофические изменения как в афферентных, так затем и в преганглионарных волокнах эфферентной части рефлекторной дуги приводят к разобщению последней. При этом развивается автономная деятельность местного нервного сплетения, что приводит к усилению гипоксического состояния тканей; в результате этого развивается интерстициальный отек, асептический воспалительный процесс, приводящий к склерозу кардии, дегенерации и даже гибели ганглионарных клеток интрамуральных нервных сплетений, т. е. к конечному итогу, который наблюдается в выраженных стадиях кардиоспазма [21].
J. C. Rudler сообщил, что в 25 % изученных им гистологически случаев ахалазии кардии он выявил отчетливую картину интерстициального и дегенеративного миозита. Т. Ueda c соавторами (1958) рассматривали эти гистологические изменения как результат подострого воспалительного процесса в области кардии.
Следует упомянуть о таком понятии как вторичная ахалазия кардии, причинами которой являются рак желудка, дистального отдела пищевода, рак легких, амилоидоз, лимфома желудка и пищевода, лейомиома пищевода, гепатоцеллюлярный рак, эозинофильный эзофагит, болезнь Ходжкина, саркоидоз, мезотелиома, рак предстательной железы, ложные кисты поджелудочной железы [1, 17]. Имеются сообщения о развитии ахалазии кардии после ваготомии при операциях на легких и на желудке при язвенной болезни [2].
Такое разнообразие теорий этиологии и патогенеза ахалазии кардии обусловлено отсутствием четкого представления о механизме развития заболевания и убедительных доказательств в пользу какой-либо одной. По всей видимости, ахалазия кардии является полиэтиологичным заболеванием, и все вышеописанные этиологические факторы и механизмы развития заболевания могут наблюдаться в практике.
Глава 4 КЛИНИКА
Клиника определяется стадией заболевания и характеризуется, как правило, триадой симптомов — дисфагия, боль и регургитация. Но только один симптом — дисфагия — является постоянным и отмечается в любой стадии заболевания. Временной интервал между появлением клинических симптомов заболевания и первичным обращением к врачу варьирует в пределах от 1 года до 12 лет.
Дисфагия у 2/3 больных развивается постепенно, а у 1/3 внезапно среди полного здоровья, что обычно связывают с эмоциональным стрессом.
Одновременно у большинства больных с ахалазией выявляют своеобразный порочный круг — волнения, отрицательные эмоции усиливают дисфагию, а дисфагия в свою очередь травмирует нервно-психическую сферу больного. Дисфагия часто имеет интермиттирующее течение: может усиливаться после нервного возбуждения, может зависеть от температуры принимаемой еды, теплая пища проходит свободно, холодная — с трудом или не проходит вовсе, может приобретать парадоксальный характер — хорошо проходит твердая пища, а жидкость задерживается (так называемая парадоксальная дисфагия). Пациенты отмечают необходимость запивания пищи большим количеством жидкости или необходимость применения других приемов: повторные глотательные движения, заглатывание воздуха, гимнастические упражнения, увеличение времени приема пищи.
В нашей клинике мы пользуемся классификацией дисфагии S. G. Bown [32].
Шкала Bown для определения степени дисфагии:
• 0 баллов — нормальное глотание;
• 1 балл — периодические затруднения при прохождении твердой пищи;
• 2 балла — питание полужидкой пищей;
• 3 балла — питание только жидкой пищей;
• 4 балла — невозможность проглатывать слюну.
Боль в грудной клетке и изжога встречаются с одинаковой частотой — в 18–60 % случаев. Боли локализуются за грудиной, могут приобретать сдавливающий, сжимающий характер, иррадиировать в шею, нижнюю челюсть или спину. На начальных стадиях заболевания, когда тонус стенок пищевода сохранен, перистальтические сокращения пищевода усиливаются для преодоления функционального барьера, а затем трансформируются в спастические. Такой спазм мускулатуры пищевода проявляется загрудинной болью. Боль, возникающая при переполнении пищевода, исчезает после срыгивания или прохождения пищи в желудок. Иногда боль возникает натощак или после рвоты и ослабевает после приема жидкости или пищи. Для трети больных ахалазией кардии характерна жгучая боль по ходу пищевода, возникающая вследствие прямого раздражающего действия на пищевод остатков задерживающейся пищи и лактата, продукция которого повышена при избыточной бактериальной ферментации сохраняющихся в пищеводе углеводов [64].
Характерным симптомом у пациентов с ахалазией кардии является регургитация остатков пищи без примеси желчи и желудочного сока вследствие застоя её в пищеводе. Способствуют возникновению регургитации наклоны туловища вперед, горизонтальное положение и другие движения, ведущие к повышению внутрибрюшного давления. Больные рассказывают случаи пробуждения ночью от кашля или удушья, возникающих после эпизода регургитации. Характерен симптом «мокрой подушки». Регургитация небольшими порциями наблюдается в начальных стадиях заболевания, объясняется спастическими сокращениями стенок пищевода, а обильное срыгивание полным ртом (пищеводная рвота) наблюдается в запущенных случаях болезни, вследствие переполнения органа до аортального сегмента. Раздражение рецепторов этой области вызывает антиперистальтику, что приводит к опорожнению пищевода. Надо отметить, что ночной кашель, наряду с симптомом «мокрой подушки», свидетельствует о декомпенсации ахалазии кардии [20].
В ряде случаев в клинике заболевания превалируют нарушения со стороны дыхательной системы (кашель, диспноэ, хронический бронхит, псевдоастматический синдром, рецидивирующие пневмонии), затрудняющие диагностику ахалазии кардии. G. Mincewicz (2004) наблюдал пациентку, длительно лечившуюся от бронхиальной астмы, у которой при компьютерной томографии был обнаружен дилатированный пищевод. После хирургического лечения астматические симптомы купировались.
У 8 % пациентов отмечается икота, основной причиной которой является длительная обструкция дистального отдела пищевода, приводящая к раздражению диафрагмального нерва [65].
Характерным признаком ахалазии является потеря массы тела, что диагностируется в 61–85 % случаев и коррелирует с тяжестью течения заболевания [23]. Средняя потеря массы тела составляет 5–10 кг [4].
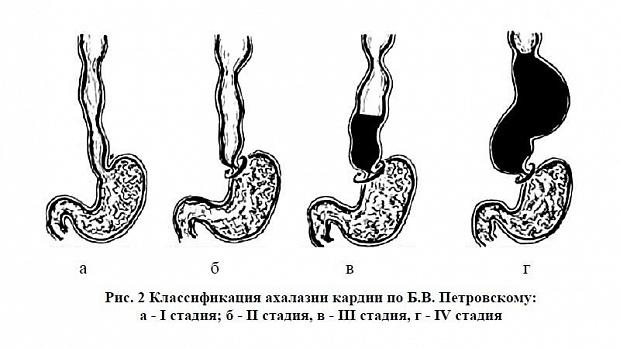
Развитие заболевания в динамике наиболее отчетливо можно проследить, если рассмотреть клинику ахалазии кардии по стадиям, предложенным и описанным Б. В. Петровским.
В I стадии состояние больных не страдает. Задержка пищи кратковременная, больные могут ощущать переход ее в желудок как
«проваливание». Может быть аэрофагия. Эвакуация из пищевода замедленная, но полная, регургитации не наблюдается. Боль наблюдается при наличии сопутствующего эзофагита.
II стадия характеризуется более выраженной дисфагией. Эвакуация из пищевода замедляется настолько, что в нем уже задерживаются пищевые массы. При умеренном расширении пищевода перистальтика усиливается, появляется антиперистальтика, ведущая к регургитации во время еды. Для улучшения прохождения пищи возникает необходимость в ее запивании (гидрофагия). Отмечаются давящие боли за грудиной, обусловленные задержкой в пищеводе пищевых масс, исчезающие после опорожнения пищевода. У отдельных больных может несколько снижаться масса тела, появляются признаки неврастении.
В III стадии присоединяются органические изменения в виде сужения кардиального канала вследствие воспалительного и фиброзно-рубцового процесса и гипертрофии мышечного аппарата пищевода. В этот период дисфагия резко выражена в связи с длительным закрытием кардии, и при ее раскрытии проходят только незначительные порции содержимого. Моторика пищевода существенно усилена, наблюдается сегментирующая перистальтика. В пищеводе накапливается большое количество пищи, секрета, что приводит к его расширению и искривлению. Регургитация возникает не только во время еды, но и ночью. Боли за грудиной более выражены. Существенно страдает общее состояние больных: увеличивается потеря массы тела, нарушается трудоспособность.
В IV стадии нарастают органические изменения. Пищевод максимально расширен, удлинен, иногда имеет несколько изгибов. Кардиальный канал резко сужен, а стенка пищевода истончена, атонична, не перистальтирует. Пища задерживается в пищеводе на много часов, разлагаясь, она усиливает воспалительные изменения в слизистой оболочке пищевода, приводит к образованию эрозий и язв. Воспалительный процесс, распространяясь, может вызвать периэзофагит и медиастенит. В этот период клинические проявления болезни особенно выражены. Длительное нарушение питания приводит к значительному похуданию или истощению, снижению или утрате трудоспособности, а также к ярким психоэмоциональным расстройствам. В наибольшей степени выражена регургитация.
Характерной клинической особенностью ахалазии является прогрессирующий характер заболевания. Оно, как правило, развивается в течение нескольких лет. Мы в клинике нередко наблюдали больных с длительным анамнезом заболевания, при поступлении в стационар испытывающих полную дисфагию и имеющих выраженные изменения в пищеводе. Наряду с подобными клиническими случаями наблюдали пациентов с очень коротким анамнезом заболевания и имеющих IV стадию болезни.
В развитии ахалазии, хотя и редко, бывают периоды необъяснимой длительной стабилизации. Ремиссия ахалазии кардии может продолжаться от одного до десяти лет с дальнейшим быстро прогрессирующим обострением.
Глава 5 ДИАГНОСТИКА
Диагностика ахалазии кардии, как правило, не вызывает затруднений, при наличии у больного характерных жалоб, для уточнения диагноза применяются инструментальные методы исследования. Основная роль в диагностике ахалазии кардии принадлежит рентгенологическому исследованию пищевода с контрастным веществом, в подавляющим большинстве случаев позволяющему установить стадию заболевания.
Рентгенологический метод исследования лег в основу широко используемой в нашей стране классификации ахалазии кардии, предложенной Б. В. Петровским в 1962 г. (рис. 2, 3).
I стадия (начальная) — пищевод не изменен, сохранена продольная складчатость слизистой оболочки. В области кардии отмечаются спазмы, из-за которых происходит временная задержка контраста, но при раскрытии нижнего пищеводного сфинктера на глоток контраст свободно поступает в желудок. Газовый пузырь желудка сохранен.
II стадия — рефлекс раскрытия кардии отсутствует, наблюдается незначительное расширение пищевода с сохранением тонуса стенок и перистальтики, однако спазм кардии носит постоянный характер. Отмечается симптом «мышиного хвоста».
III стадия — значительное расширение пищевода до 6–8 см, задержка в нем пищи и жидкости, отсутствие пропульсивной моторики.
IV стадия — резкое расширение, удлинение и искривление пищевода с атонией стенок, длительной задержкой жидкости и пищи [17].
Для ахалазии характерна положительная проба Хурста, когда начало опорожнения пищевода происходит вне акта глотания и зависит от высоты столба бариевой взвеси, при этом при повышении показателя гидростатического давления нижний пищеводный сфинктер раскрывается и контрастное вещество «проваливается» в желудок.
В нашей клинике с целью уточнения диагноза, определения протяженности спазмированного сегмента пищевода и проведения дифференциального диагноза с органическими заболеваниями мы применяем многослойную компьютерную томографию (рис. 4).
Особое диагностическое значение принадлежит эндоскопии. Изменения, характерные для ахалазии кардии, при эндоскопическом осмотре подробно описаны Ю. И. Галлингером и Э. А. Годжелло (1999). При выполнении исследования обращается внимание на степень дилатации и девиации просвета пищевода, наличие в нем остатков пищи, принятой накануне, жидкости и слизи. Одновременно определяются состояние слизистой оболочки пищевода, ее толщина, цвет, блеск, наличие перистальтики. После визуализации кардии (что не всегда бывает просто) отмечают ее положение относительно оси пищевода, наличие воспалительных и рубцовых изменений, эластичность стенок, равномерность раскрытия кардии при инсуффляции воздуха и возможность проведения эндоскопа в желудок. Заключительный этап эндоскопического исследования включает тщательный осмотр желудка, двенадцатиперстной кишки и обязательный ретроградный осмотр кардии.
При I стадии ахалазии кардии изменений просвета пищевода, перистальтики, состояния слизистой оболочки, положения кардии и ее открытия при эзофагоскопии не выявляется.
При II стадии эндоскопически определяется незначительное (до 3–4 см) расширение просвета пищевода, в то же время остатков пищи, жидкости или слизи в пищеводе, как правило, нет. Складки слизистой расположены продольно, слизистая гладкая, ровная, блестящая, кардия расположена по центру, обычно сомкнута, но достаточно легко раскрывается при небольшой инсуффляции воздуха. При ретроградном осмотре складки в области пищеводно-желудочного перехода плотно охватывают эндоскоп, слизистая оболочка мягкая и эластичная.
При III стадии болезни пищевод расширен до 5–7 см, в просвете его имеются остатки жидкой и плотной пищи, много слизи. В дистальном отделе пищевода отмечается начинающаяся S-образная деформация, за счет чего кардия расположена эксцентрично и, как правило, сомкнута. Слизистая оболочка пищевода несколько отечная за счет задержки пищи, может быть гиперемирована в дистальном отделе.
При IV стадии ахалазии кардии просвет пищевода резко расширен (часто более 7–10 см), извит, содержит большое количество жидкости и остатков пищи, слизистая оболочка отечная, рыхлая, местами имеет крупноячеистый вид, отмечается поперечная складчатость слизистой пищевода за счет его удлинения и растяжения. Часто пищевод заканчивается слепым мешком, заполненным остатками пищи, а кардия резко смещена в сторону и, как правило, находится выше дна этого мешка. Кардия может быть сомкнута неплотно и рубцово изменена.
Визуализация кардии при III и особенно IV стадиях ахалазии может быть затруднена из-за содержимого в пищеводе и резкой деформации его просвета. В таких ситуациях может быть полезным изменение положения тела больного — поворот его на правый бок (жидкость из дистального отдела пищевода перетекает в вышележащие отделы). Необходимо отметить, что при любой стадии ахалазии кардии, в отличие от органического стеноза, злокачественной опухоли или рубцовой стриктуры, как правило, удается пройти эндоскопом в желудок. Необходимым условием безопасности исследования является выполнение его под визуальным контролем, исключая проведение аппарата «вслепую» через остатки пищи и слизь [3].
Последние 10–15 лет для изучения ахалазии кардии применяют эндоскопическую ультрасонографию (рис. 5). Изучая структуру стенки пищевода на уровне кардии, исследователи отмечают утолщение мышечного слоя. В ряде исследований толщина мышечного слоя согласуется с длительностью процесса, а корреляцию между толщиной мышечного слоя и выраженностью клинических проявлений, давлением в нижнем пищеводном сфинктере, рентгенологической картиной, данными манометрии и степенью дегенерации Ауэрбахового сплетения выявить не удалось. Имеются сообщения о ценности эндоскопической ультрасонографии в диагностике вторичной ахалазии кардии и других заболеваний пищевода, имитирующих данный процесс, утолщение мышечного слоя пищевода было выявлено у 24 % пациентов с дисфункцией пищевода, имевших нормальные показатели манометрического исследования. К сложностям применения данного метода диагностики относят трудность точного определения толщины слоя и частое наличие артефактов в зоне кардии, что может привести к ложному диагнозу псевдоахалазии. Все же, несмотря на доказанную диагностическую ценность эндоскопической ультрасонографии, многие авторы сходятся во мнении, что данная методика при исследовании пациентов с диагнозом ахалазия кардии не может быть рутинным исследованием.
Другим инструментальным методом диагностики ахалазии кардии является эзофагоманометрия (водно-перфузионная манометрия) — метод, позволяющий объективно оценить моторику и тонус пищевода, давление в зоне кардии, наличие или отсутствие раскрытия нижнего пищеводного сфинктера в ответ на глоток. Основными манометрическими признаками являются отсутствие рефлекса глотательного раскрытия кардии (регистрируется прямая линия с наложением на нее дыхательных колебаний вместо характерной волны, направленной вниз), повышение тонуса нижнего пищеводного сфинктера, а также нарушения перистальтики грудной части пищевода. Эзофагограмма при ахалазии кардии имеет характерный вид: кривая постепенно поднимается вверх («открытый катетер» движется по пищеводу в каудальном направлении), а когда кончик катетера выходит из кардии, кривая манометрии резко падает [13].
В настоящее время в практику внедряются современные высокотехнологичные методы — манометрия высокой разрешающей способности (high resolution manometry, HRM) и объемная 3D-манометрия, имеющие ряд явных преимуществ по сравнению с манометрией, выполняемой 4- или 8-канальным водно-перфузионным катетером. При расположении датчиков давления на расстоянии 5 см друг от друга большие участки перистальтической волны грудного отдела пищевода «выпадают» из анализа.
Например, подтягивание нижнего пищеводного сфинктера и укорочение дистального отдела пищевода у больных с ахалазией кардии часто принимают за истинное, хотя и недостаточное, расслабление сфинктера («псевдорелаксация»). Использование многоканальных катетеров при манометрии высокой разрешающей способности позволяет избежать подобных ошибок.
При анализе результатов исследования пациентов с ахалазией кардии, полученных методом HRM, следует учитывать Чикагскую классификацию нарушений моторики пищевода, созданную в 2008 г. (последний пересмотр в Асконе в 2011 г.) — таблица 1.
Таблица 1. Чикагская классификация нарушений моторики пищевода
|
Ахалазия |
Тип I Тип II Тип III Нарушение проходимости кардии |
|
1 |
2 |
|
Заболевания, связанные с нарушением моторики |
|
|
Изменения перистальтики |
|
В зависимости от выявленных изменений двигательной активности грудного отдела пищевода применение HRM позволило выделить три типа ахалазии кардии. Для всех типов заболевания характерно повышение суммарного давления расслабления (IRP4, integrated relaxation pressure) выше 15 мм рт. ст. и отсутствие перистальтической волны сокращения грудного отдела пищевода. При этом давление покоя (resting pressure) может быть как повышено, так и в пределах нормальных значений (норма 10–35 мм рт. ст.).
При I типе ахалазии кардии (классическая ахалазия) в 100 % глотков с водой отсутствует любая перистальтика грудного отдела пищевода. При II типе отсутствует нормальная перистальтическая волна сокращения, однако наблюдается равномерное спастическое сокращение умеренной интенсивности по всей длине пищевода от верхнего до нижнего пищеводного сфинктера (panesophageal pressurization) более чем в 20 % глотков с водой. III тип характеризуется отсутствием нормальной перистальтической волны, наличием отдельных эпизодов перистальтики в дистальном отделе пищевода или преждевременными спастическими сокращениями (дистальный эзофагоспазм), зарегистрированными более чем в 20 % глотков с водой [20].
5.1 Дифференциальная диагностика
Дифференциальную диагностику ахалазии кардии проводят со следующими заболеваниями:
1. Сужение пищевода вследствие опухолевого поражения нижнего пищеводного сфинктера характеризуется прогрессирующим симптомом дисфагии, как и при истинной ахалазии. Однако быстро прогрессирующая потеря массы тела и пожилой возраст пациентов говорят именно в пользу злокачественного поражения. При физикальном осмотре можно выявить пальпируемое образование в брюшной полости и лимфоаденопатию в надключичной области слева. Для точного установления диагноза необходимо проведение эзофагогастродуоденоскопии [9].
2. Пептическая стриктура, как правило, является осложнением аксиальной грыжи пищеводного отверстия диафрагмы, основным симптомом которой является изжога. Для нее также характерна дисфагия, однако отмечается затруднение прохождения по пищеводу только твердой пищи. В плане дифференциальной диагностики важно проведение манометрии и рентгенографии пищевода, по данным которых не отмечается расширения просвета пищевода, а при вертикальном положении тела контраст в отличие от ахалазии не задерживается в просвете органа. При эндоскопии возможно выявление эрозий и участков пищевода Барретта. Надо сказать, что потеря массы тела не характерна для пептической стриктуры в отличие от ахалазии.
3. При ишемической болезни сердца основным клиническим проявлением является боль в грудной клетке. Этот симптом практически невозможно отличить от такового при ахалазии кардии, особенно если стенокардия провоцируется приемом пищи. Не помогает в дифференциальной диагностике и положительный эффект от приема нитроглицерина, так как боли при ахалазии, как и при ишемической болезни сердца, купируются после его приема. Электрокардиография также не всегда вносит ясность в диагноз, поскольку при ахалазии могут регистрироваться неспецифические изменения конечной части желудочкового комплекса, а ишемия миокарда, в свою очередь, может носить скрытый характер и выявляться на ЭКГ лишь при физической нагрузке. Поэтому в спорных ситуациях необходимо проводить комплексное кардиологическое исследование, включающее велоэргометрию или трэдмил-тест, эхокардиографию и комбинированное исследование — суточное холтеровское мониторирование и 24-часовую манометрию пищевода.
4. Врожденные мембраны и кольца слизистой оболочки пищевода при их небольшом размере часто остаются бессимптомными и манифестируют после введения в рацион ребенка твердой пищи такими симптомами, как дисфагия и срыгивание во время или после кормления. У детей более старшего возраста возникает характерная для идиопатической ахалазии рвота пищеводным содержимым, что затрудняет постановку правильного диагноза [44].
5. Неврогенная анорексия обычно возникает у молодых женщин в отличие от ахалазии, которая встречается в одинаковой мере у мужчин и женщин, и характеризуется развитием дисфагии и рвоты желудочным содержимым, которые часто провоцируются психотравмирующими ситуациями. Для данного заболевания также характерно похудание [20].
Глава 6 ЛЕЧЕНИЕ
Известны три направления лечения ахалазии кардии: медикаментозное, эндоскопические методы (баллонная дилатация, инъекции ботулинического токсина, склеротерапия, пероральная эндоскопическая миотомия) и хирургическое лечение, включающее более 60 способов, что подтверждает сложность данной проблемы.
Медикаментозное лечение ахалазии кардии
Десятки лет изучалась возможность консервативного лечения ахалазии кардии, эффективность которого часто не оправдывала ожиданий. В настоящее время этому направлению уделяется меньше внимания, чем другим видам лечения. Все же на ранних стадиях заболевания медикаментозная терапия может быть оправданной. Медикаментозное лечение основывается на патогенезе заболевания — известно, что у больных с ахалазией кардии имеется дефицит специфического нейротрансмиттера NO, а также существуют изменения внутриклеточного Ca2+. Регуляция уровня NO — одно из самых перспективных направлений в фармакотерапии дискинетических нарушений желудочно- кишечного тракта. Создание специализированных препаратов, в первую очередь нитратов — доноров NO и антагонистов кальция, позволяет решить данную проблему [10].
Еще в 1940 году Zdansky и Bruke отметили, что нитроглицерин у больных ахалазией кардии способствует кратковременному ее раскрытию. С тех пор опубликовано множество сообщений о снижении тонуса кардии при приеме нитропрепаратов. В настоящее время предложено большое количество нитропрепаратов, среди которых предпочтение следует отдавать лекарственным средствам пролонгированного действия, с высокой биодоступностью. Таким требованиям отвечает изосорбид мононитрат («Моно Мак», «Моночинкве», «Оликард», «Моносан», «Пектрол», «Эфокс»), однако его таблетированая форма не применима в условиях дисфагии.
В публикациях последних лет появились данные о результатах исследований действия сильденафила («Виагра») у больных с ахалазией кардии. Сильденафил — мощный и селективный ингибитор цГМФ-специфической фосфодиэстеразы типа 5 (ФДЭ5). Оксид азота активирует фермент гуанилатциклазу, что приводит к повышению уровня циклического гуанозинмонофосфата (цГМФ), расслаблению гладких мышц. Сильденафил активно усиливает расслабляющий эффект NO на ткань посредством ингибитора ФДЭ5, которая ответственна за распад цГМФ. A. J. Eherer c коллегами (2002) сообщает о рандомизированном двойном слепом исследовании применения сильденафила у пациентов с ахалазией кардии, в котором достоверно отмечено снижение тонуса нижнего пищеводного сфинктера и увеличение пропульсивной силы в нижней трети пищевода как у здоровых людей, так и у пациентов с ахалазией кардии до восьми часов после приема препарата. Авторы указывают на возможное применение сильденафила в лечении пациентов с ахалазией кардии, однако лимитирующим фактором применения являются побочные эффекты, наиболее частые из них: головная боль — у 16 %, приливы — у 10 %, диспепсия — 7 %.
Ионы Са2+ вызывают сужение сосудов и повышение тонуса органов желудочно-кишечного тракта. При патологических состояниях, таких как ишемия, гипоксия, ионы Са2+, особенно при повышенной их концентрации, могут чрезмерно усиливать процессы клеточного метаболизма, повышая потребность тканей в кислороде, и вызывать различные деструктивные процессы. В этих условиях, которые наблюдаются в области кардии у больных с ахалазией кардии, антагонисты ионов кальция могут оказывать патогенетический, фармакотерапевтический эффект. Среди блокаторов Са2+, назначаемых пациентам, предпочтение следует отдавать подгруппе дигидропиридинов («Нифедипин», «Амлодипин»), так как они не оказывают угнетающего влияния на проводящую систему сердца и обладают слабой антиаритмической активностью. Однако антагонисты ионов кальция обладают гипотензивным действием, а у пациентов с ахалазией кардии нередко отмечается низкое артериальное давление. В результате приема блокаторов Са2+ больные могут предъявлять жалобы, связанные с низким артериальным давлением (головокружение и слабость) [33].
В случаях, когда тонус пищевода снижен и перистальтика недостаточная (после эффективно проведенной баллонной дилатации кардии), целесообразно назначение прокинетиков: домперидон («Мотилиум»), цизаприд («Координакс», «Перистил») и метоклопрамид («Церукал»). Наиболее эффективным прокинетиком является гастроинтерстинальный прокинетик «Координакс». В основе его эффекта лежит связывание с 5-гидрокситриптаминовыми рецепторами. Он блокирует 5-НТ‑3-рецепторы и стимулирует 5-НТ‑4-рецепторы в пресинаптических нервных окончаниях, тем самым он оказывает непрямое холинэргическое действие на нейромышечный аппарат всего желудочно- кишечного тракта.
Оценить роль медикаментозной терапии в лечении пациентов с ахалазией кардии довольно сложно из-за недостатка литературных данных. Вероятно, отсутствие внимания к данному вопросу обусловлено тем, что при назначении больным ахалазией кардии только медикаментозной терапии положительный эффект наблюдался исключительно в I стадии заболевания, в то же время врачи редко сталкиваются с этой категорией пациентов. В настоящее время медикаментозная терапия назначается только как дополнение к другим, более радикальным методам лечения [25].
Хирургическое лечение
Учитывая наш опыт, в настоящее время показанием к хирургическому лечению мы считаем ахалазию кардии IV стадии, ранее перенесенные неэффективные операции по поводу ахалазии кардии, а также разрывы стенки пищевода, возникшие при баллонной дилатации.
В основе всех используемых операций при лечении ахалазии кардии лежит внеслизистая эзофагокардиомиотомия по методике Геллера. В качестве операционного доступа используют левостороннюю торакотомию в седьмом — восьмом межреберье или верхнюю срединную лапаротомию. После мобилизации дистального отдела пищевода из окружающих тканей рассекают в продольном направлении мышечную оболочку его до слизистой. Длина разреза должна составлять не менее 8–10 см, причем в дистальном направлении его необходимо продолжить и на мышечную оболочку кардиальной части желудка.
По результатам разных авторов летальность при данном типе операции составляет в среднем 1,5–3 %. У большинства больных удается добиться отличных и хороших результатов. Недостатком операции Геллера является развитие у значительной части оперированных рефлюкс-эзофагита за счет снижения внутрипросветного давления в зоне нижнего пищеводного сфинктера. Кроме того, у некоторых больных отмечается развитие дивертикулов пищевода в зоне рассеченных мышц. При неполном пересечении мышечных пучков очень высока частота рецидивов ахалазии кардии.
Для предотвращения вышеуказанных нежелательных последствий данного типа вмешательства был предложен целый ряд хирургических приемов: закрытие дефекта в мышечной оболочке пищевода прядью большого сальника на ножке, лоскутом, выкроенным из диафрагмы, сшивание рассеченной мышечной оболочки в поперечном направлении, подшивание к дефекту в мышечной оболочке пищевода лоскута из передней стенки проксимального отдела желудка. Следует отметить, что их эффективность в плане предотвращения развития после эзофагокардиомиотомии желудочно- пищеводного рефлюкса оказалась недостаточно высокой.
Весьма эффективным способом хирургического лечения ахалазии кардии является сочетание операции Геллера с разными видами фундопликаций. Это позволяет не только ликвидировать ахалазию, но и надежно предотвратить рефлюкс-эзофагит и образование дивертикула пищевода. При сочетании ахалазии кардии с язвенной болезнью двенадцатиперстной кишки наряду с данным оперативным вмешательством производят селективную проксимальную ваготомию. Однако при данной операции у ряда больных наблюдается развитие дисфагии, что может быть связано с «гиперфункцией» фундопликационного клапана. В этих ситуациях целесообразно выполнять кардиодилатацию. Раньше в нашей клинике мы использовали операцию Геллера в модификации проф. А. А. Русанова.
Особенно большие трудности встречаются при сочетании ахалазии кардии IV стадии с тяжелым эрозивно-язвенным эзофагитом и выраженной атонией пищевода. В этих случаях выполняется субтотальная резекция пищевода с одномоментной эзофагопластикой желудочной трубкой с возможным наложением анастомоза на шее (уровень поперечнополосатых мышц пищевода) (рис. 6). Прочие типы оперативных вмешательств в подобной ситуации, как правило, малоэффективны.
Длительно применявшаяся при запущенных формах ахалазии кардии эзофагофундостомия по методике Гейровского в настоящее время практически полностью оставлена в связи с высокой частотой развития тяжелого рефлюкс- эзофагита [25, 26].
Эндоскопические методы лечения
Следует указать, что перед выполнением эндоскопических манипуляций необходимо обеспечить хорошую визуализацию пищевода. Для этого больной за 2–3 дня до исследования принимает только жидкую пищу, а накануне с помощью желудочного зонда большого диаметра необходимо промыть пищевод для удаления остатков еды.
Эндоскопическая интрамуральная инъекция ботулинического токсина
Применение ботулинического токсина при нейромышечных заболеваниях пищевода началось в 1993 г., когда P. J. Pasricha в экспериментальном исследовании продемонстрировал, что локальное введение препарата приводит к снижению тонуса нижнего пищеводного сфинктера. Новый метод лечения ахалазии кардии привлек внимание, вследствие чего в настоящее время опубликовано большое количество статей, посвященных данному методу лечения ахалазии кардии [14].
Существует семь антигенно отличающихся видов ботулинического токсина — А, B, C, D, E, F и G. В практике применяется стерильная лиофилизированная форма ботулинического токсина типа А. Ботулинический токсин типа А является препаратом локального действия, который не обладает выраженным системным эффектом. Основной механизм действия ботулотоксина заключается в блокировании на уровне пресинапса поступления ацетилхолина, который выделяется в ответ на электрический импульс в межсинаптическую щель [14]. Поскольку при лечении ахалазии кардии вводят небольшое количество препарата, то эффекта со стороны скелетной мускулатуры не отмечается [15, 16]. В настоящее время в России зарегистрированы два препарата ботулинического токсина: «Диспорт» Ipsen Biopharm Ltd. и «Ботокс» Allergan Inc (рис. 7).
Оба препарата дозируются в m. u. (mouse units — «мышиные единицы»), однако при этом они обладают разной активностью, что обусловлено использованием различных биоактивных технологий. Приблизительно клинически эквивалентное соотношение единиц препаратов «Диспорт» и
«Ботокс» составляет соответственно 3 : 1 [28].
Для получения клинического эффекта используется 80–100 ЕД препарата
«Ботокс» или 250 ЕД препарата «Диспорт» Клинический эффект наступает, как правило, в первые сутки, но иногда этот период пролонгируется до 72 часов.
Это время необходимо для диффузии препарата в мышечную ткань, расщепления токсина и блокады пресинаптической мембраны. При отсутствии клинического улучшения через 1 месяц процедуру повторяют. Хороший непосредственный эффект наблюдается в 75–93 % случаев [66]. Некоторые пациенты (18–87 %) после введения токсина периодически ощущают боль в эпигастрии, которая самостоятельно купируется в течение 2–4 дней, также в 14–28 % случаев может развиваться гастроэзофагеальный рефлюкс [73].
Серьезные осложнения при эндоскопической инъекции ботулинического токсина крайне редки. В доступной литературе удалось найти описание пневмоторокса, развившегося после введения «Ботокса» в стенку пищевода при его резком расширении. Из побочных реакций описываются: диплопия (двоение в глазах), сыпь на коже, сердцебиение, слабость, кратковременное повышение температуры тела [73]. Генерализованной аллергической реакции на введение препаратов ботулинического токсина не описано. В работах R. M. Siatkowski (1993) и K. S. Schwartz (1990) отмечено появление антител к ботулиническому токсину при повторных инъекциях, что не влияло на клинический ответ.
Несмотря на простоту, данный метод лечения обладает существенным недостатком — короткой продолжительностью действия. Большинство исследователей сообщают о рецидиве болезни в течение 12 месяцев, потребовавшем повторения процедуры [62]. Это связано с тем, что в области заблокированного нервно-мышечного соединения после введения ботулотоксина взамен выведенных из «строя» нервно-мышечных соединений формируются новые. Время, в течение которого это происходит, и определяет длительность терапевтического действия препарата. В большинстве случаев она составляет от 3 до 12 месяцев. В определенной степени эффект от введения токсина можно предсказать; так, отмечено, что более выраженный и длительный эффект наступает у пациентов старших возрастных групп (> 50 лет), более чувствительны к ботулиническому токсину женщины [77]. Neubrand и соавторы (2002) неблагоприятным прогностическим фактором считают высокое давление нижнего пищеводного сфинктера, превышающее норму более чем на 50 %.
У нас в стране отрицательным моментом лечения ахалазии кардии ботулиническим токсином является высокая стоимость препарата. Несмотря на то, что цена препаратов «Диспорт» и «Ботокс» ниже, чем цена баллона для кардиодилатации, из-за более частого рецидива заболевания через 6–18 месяцев материальные затраты превышают таковые при баллонной кардиодилатации [53].
С другой стороны, данная методика обладает целым рядом преимуществ: короткий койко-день, низкий риск осложнений, безболезненность, однократное введение препарата за одну госпитализацию. Применение ботулинического токсина оправдано у пожилых пациентов и больных с тяжелой сопутствующей патологией в силу высокого анастезиологического риска и риска осложнений при кардиодилатации.
Возможно применение данного метода лечения в комбинации с баллонной кардиодилатацией. J. Mikaeli (2004) указывает на большую эффективность лечения в группе с комбинированной методикой (продолжительность эффекта составила 25,6 месяца против 12,6 месяца при пневмодилатации кардии), что позволило отказаться от перехода у данных пациентов на баллоны большего диаметра [54]. Однако в 2006 г. J. Mikaeli сообщает об отсутствии отличий у двух групп пациентов: 1-я — инъекция ботулинического токсина в комбинации с пневмодилатацией и 2-я группа — только пневмодилатация (77 % и 62 % ремиссии через год соответственно). Однако среди пациентов старше 40 лет различие между группами более заметно: ремиссия через год в 1-й группе наблюдалась у 91 % больных (10/11 пациентов), а во 2-й группе — только в 55% случаев (5/9 пациентов) [55].
Таким образом, при наличии существенных недостатков, таких как короткий терапевтический эффект и высокая стоимость лечения, данный метод обладает рядом преимуществ по сравнению с другими вариантами лечения ахалазии кардии. У пожилых пациентов и у пациентов с тяжелой сопутствующей патологией лечение ботулиническим токсином может являться методом выбора.
Склерозирование кардии
При исследовании моторики пищевода у пациентов после склерозирования вен пищевода отмечено снижение давления в области нижнего пищеводного сфинктера и появление гастроэзофагеального рефлюкса. На основании этих данных было предположено, что вследствие частичного замещения слоя мышечной соединительной ткани сократительная функция в области нижнего пищеводного сфинктера снижается. На основании данного принципа в 1996 году М. Moreto et al. предложили новый метод лечения ахалазии кардии — эндоскопическое склерозирование.
В область нижнего пищеводного сфинктера вводится 2 мл 2 % раствора
«Лидокаина» для аналгезии. Затем под углом к стенке через эндоскопический инъектор вводится 5 мл 5 % раствора «Этаноламина олеата» (А. Саunedo предлагает использовать 1 % «Полидоканол»). На первом этапе авторы выполняли инъекцию из четырех точек, в позднем периоде в 20 % случаев сформировалась рубцовая стриктура, в связи с чем в дальнейшем инъекции выполняли в двух противоположных точках, что позволило избежать формирования стриктур. Интервал между вмешательствами составлял 2 недели.
У всех пациентов был достигнут хороший результат. При выполнении склерозирования отмечены следующие осложнения: в 100 % случаев наблюдалась боль за грудиной, купировавшаяся самостоятельно; в 20 % случаев сформировалась рубцовая стриктура, потребовавшая выполнения баллонной дилатации, однако после изменения методики данное осложнение не наблюдалось. В группе пациентов, у которых выполняли введение склерозанта из четырех точек, у 25 % больных развился рефлюкс-эзофагит, после модификации метода это осложнение наблюдалось в 8 % случаев [42].
В работе M. Moreto (1990) приводятся обнадеживающие данные о результатах этого метода — у всех пациентов удалось добиться хороших результатов, период без клинических проявлений составил более 2 лет. Однако в исследовании A. Caunedo (2003) у 44 % пациентов потребовалось применение других методов лечения.
Сегодня данные об этом методе лечения ахалазии кардии скудны и противоречивы, но по мере накопления опыта он может представлять альтернативу другим, более распространенным малоинвазивным методам лечения у определенной группы больных, например, при сочетании ахалазии кардии с варикозным расширением вен пищевода.
Баллонная кардиодилатация
В настоящее время баллонная кардиодилатация является основным методом лечения ахалазии кардии [3, 24]. На протяжении сотен лет исследователи продолжали попытки механического расширения кардии. В трактате Т. Willis (1679) впервые встречается описание ахалазии кардии и указывается лечение при помощи бужирования [72]. После изобретения в 1906 г. H. Plammer гидростатического дилататора новый метод получил признание наряду с хирургическим лечением.
В России наибольшее распространение получило устройство, предложенное Starck в 1924 г., которое являлось жестким механическим кардиодилататором с металлическими лопастями. Применение этого прибора было связано с высоким риском травмы слизистой оболочки и перфорации пищевода. В настоящее время наиболее широко используются силиконовые и пластиковые баллонные дилататоры с двухпросветным катетером (рис. 8), где один канал служит для проведения струны-проводника, а другой — для заполнения полости баллона жидкостью или воздухом.
Дилататоры различаются диаметром баллона (при лечении ахалазии кардии используются баллоны 25–40 мм), длиной (от 8 до 16 см), наличием или отсутствием «талии» для фиксации в кардии. В литературе описаны 3 способа баллонной кардиодилатации.
Первый способ — дилатация по струне-проводнику. Включает проведение по инструментальному каналу эндоскопа в желудок струны-проводника, затем по ней в кардию проводится дилататор так, чтобы середина баллона находилась в суженной части нижнего пищеводного сфинктера. Далее параллельно дилататору в пищевод проводится гастроскоп, благодаря чему возможна коррекция положения баллона (рис. 9).
Последнее является необходимым условием выполнения манипуляции, так как при повышении давления в баллоне возможно его смещение, что ведет к неэффективности процедуры и увеличению риска осложнений. При расправлении баллона производится манометрический контроль. Отечественные авторы Ю. И. Галлингер и А. Ф. Черноусов считают необходимым повышение давления в баллоне до 300 мм рт. ст., однако следует отметить, что современные баллоны сохраняют заданную форму и диаметр независимо от величины давления, а при достижении критической величины (указанной производителем) происходит разрыв баллона по длине. После извлечения баллона выполняется оценка состояния зоны пищеводно-желудочного перехода для исключения повреждения слизистой оболочки и кровотечения.
К недостаткам дилатации по струне-проводнику относятся слабая фиксация баллона в кардии, смещение его в область с более низким давлением.
Второй способ заключается в использовании баллонного дилататора, фиксирующегося на эндоскопе так, чтобы середина баллона располагалась на расстоянии 20 см от торца аппарата. Гастроскоп проводится в желудок, после чего дистальный конец аппарата сгибается на 180° для визуализации свода желудка и коррекции положения баллона. Баллон расправляется под манометрическим контролем. В отличие от дилатации по струне-проводнику при этом способе исключено смещение баллона. Слабой стороной метода является недостаточный диаметр (< 30 мм) доступных на сегодняшний день баллонов ОПМПИ (Н. Новгород).
Третий способ заключается в проведении баллонного дилататора по инструментальному каналу эндоскопа. В остальном все действия повторяют ранее описанные. Недостатком способа является использование одноразовых баллонов TTS (trough the scope), которые имеют высокую стоимость.
Достижение клинического эффекта не зависит от выбранного метода дилатации. Целью баллонной кардиодилатации является дозированное растяжение мышечного слоя пищевода в области пищеводно-желудочного перехода. Для этого необходимо иметь баллоны диаметром 30 мм, 35 мм и 40 мм. Многими авторами описана неэффективность использования баллона малого диаметра (30 мм). По данным K. Farhoomand (2004) при использовании
30 мм баллона эффект дилатации на протяжении 3 лет сохранялся у 37 % пациентов, в то время как при использовании 40 мм баллона — у 88 %.
Оригинальная методика предполагает форсированное раздувание баллона в течение 1 мин. до 600 мм рт. ст. В этом случае требуется меньшее число сеансов дилатации (часто достаточно однократного применения) для достижения клинического эффекта, однако отмечается достаточно высокая частота перфорации пищевода (от 0 до 9,5 %, в среднем около 2 %). В связи с этим ряд авторов предлагает более медленное нагнетание давления в баллон (в течение 5– 6 мин.) до 300 мм рт. ст., что позволяет снизить частоту осложнений [3, 24, 54]. По данным J. Mikaeli (2004), риск перфорации увеличивается при увеличении диаметра баллона и форсированном нагнетании давления и не зависит от давления в баллоне. Помимо перфорации при баллонной кардиодилатации могут возникать надрывы слизистой оболочки, которые сопровождаются незначительным кровотечением, не требующим дополнительного воздействия [54]. После первого сеанса кардиодилатации эффект достигается у 58–79 % пациентов [11]. В остальных случаях возникает необходимость в повторном сеансе, позволяющем получить стойкий результат у 72–95 %. Четких критериев успеха манипуляции на сегодняшний день не существует. В основном оценивается клинический эффект (уменьшение или устранение дисфагии, прибавление массы тела). J. M. Guardino (2004) использует термин «симптоматический» и «физиологический» успех, подразумевая положительную динамику на основании объективных методов исследования. Подчеркивается, что необходимо добиваться физиологического эффекта, оценивая время опорожнения пищевода и степень расширения кардии при рентгенологическом исследовании и снижение степени давления в нижнем пищеводном сфинктере до и после кардиодилатации, используя эзофагоманометрию [40]. Некоторые авторы оценивают эффективность лечения заболевания только по данным эзофагоманометрии, считая, что для достижения стойкого эффекта необходимо добиваться снижения давления в нижнем пищеводном сфинктере на > 50 % независимо от исходного показателя, а по данным V. F. Eckardt (2004), давление в нижнем пищеводном сфинктере после кардиодилатации не должно превышать 10 мм рт. ст. [67].
Учитывая результаты манометрии высокой разрешающей способности, наилучшие результаты лечения достигаются у пациентов со II типом ахалазии кардии, в то время как отсутствие перистальтики (I тип) или выраженная гипермоторная дискинезия грудного отдела пищевода (III тип) могут рассматриваться в качестве прогностических критериев большого процента рецидива ахалазии после кардиодилатации.
В ряде исследований отмечены предикторы неэффективности кардиодилатации: молодой возраст < 40 лет, мужской пол, пульмонарные симптомы (ночной кашель, частые инфекционные заболевания респираторной системы), отсутствие загрудинной боли и отсутствие снижения давления в нижнем пищеводном сфинктере более 50 %.
Ряд авторов к относительным противопоказаниям для баллонной кардиодилатации относят IV стадию заболевания, так как из-за выраженного рубцового процесса и S-образного искривления пищевода возрастает риск его перфорации. При IV стадии выраженная атония и провисание стенок препятствуют адекватному пассажу пищи, а после выполнения кардиодилатации, вследствие замещения мышечной ткани соединительной, развивается недостаточность кардии. Несмотря на описанные случаи успешной дилатации при ахалазии кардии IV стадии, большинство авторов сходится во мнении, что в данной группе пациентов хирургическое лечение более предпочтительно.
Неблагоприятными для дилатации кардии являются сочетания ахалазии кардии с грыжей пищеводного отверстия диафрагмы и с эпифренальным дивертикулом, что может рассматриваться как показания к хиругическому лечению или интрамуральной инъекции ботулинического токсина [74, 45].
Пероральная эндоскопическая миотомия
В настоящее время в лечение ахалазии кардии широко внедряется новый метод эндоскопический миотомии — пероральная эндоскопическая миотомия (Peroral Endoscopic Myotomy (РОЕМ)).
До настоящего времени эти оперативные вмешательства выполнялись через открытый доступ, что имело свои серьезные последствия. Пациенты, ослабленные из-за плохого питания, тяжело переносили операцию, развивались осложнения в виде кровотечений, нагноений послеоперационной раны, медиастинитов и т. д.
Первый клинический вариант пероральной эндоскопической миотомии у человека разработал и впервые в мире выполнил 8 сентября 2008 г. японский профессор H. Inoue. Клинические испытания данного метода показали высокую его эффективность в сочетании с низкой вероятностью развития тяжелых осложнений. Методика заключается в формировании канала в подслизистом слое, в зоне повышенного тонуса пищевода и рассечении циркулярного мышечного слоя. Схема выполнения метода представлена на рисунках 10, 11.
В первых публикациях H. Inoue 2010 г. и Von Rentelnetal 2012 г. представлены результаты лечения 17 и 16 пациентов соответственно [45, 71]. Положительный результат — отсутствие дисфагии — достигнут у всех пациентов, что подтверждено данными внутрипросветной манометрии пищевода. Отмечено снижение давления в области нижнего пищеводного сфинктера от 52 до 19 мм рт. ст. В каждом из исследований отмечено по одному больному с явлениями рефлюкс-эзофагита после операции. Выраженность эзофагита была оценена как ст. А и ст. В по Лос-Анджелесской классификации.
В нашей практике для проведения РОЕМ мы используем различные эндоскопы фирм Olympus и Pentax. На дистальный конец аппарата обязательно фиксируем дистальный прозрачный колпачок. Эндоскопическая операция выполняется только с инсуффляцией газа CO2. Применяем инсуфлятор фирмы Olympus CO2UCRO (рис. 12).
После визуального определения повышенного тонуса пищевода на расстоянии примерно 20–25 см от верхних резцов по задней стенке пищевода при помощи Triangle Tip Knife (рис. 13) (также можно применять нож Dual Knife (рис. 14) выполняем рассечение слизистой оболочки на протяжении 1,5 см, после чего эндоскоп вводится в подслизистый слой органа.Полученные результаты обнадеживают и дают основания полагать, что найден новый эффективный способ лечения ахалазии кардии.
Слизистая оболочка и мышечный слой при этом хорошо дифференцируются. Для более четкой визуализации подслизистого слоя при гидропрепаровке используем раствор препарата «Тетраспан» 10 % (гидроксиэтилкрахмал, средняя молекулярная масса 130 000 дальтон) окрашенный «Индигокармином». Канал в подслизистом слое следует формировать на 1,5–3,0 см дистальнее пищеводно-желудочного перехода (42–44 см от верхних резцов). Далее на расстоянии 30 см от резцов производим порционное рассечение циркулярного мышечного слоя ножом Нооk Knife (рис.15) до появления продольных мышечных волокон на всем протяжении сформированного подслизистого канала. После рассечения нижнего пищеводного сфинктера визуально отмечается расширение просвета тоннеля в области спазмированного сегмента пищевода. При контрольном осмотре аппарат свободно проходит через пищеводно-желудочный переход.
Дефект слизистой оболочки, сквозь который вводился аппарат в подслизистый слой, сшиваем клипсами фирмы Olympus HX‑610-135L (рис. 16).
Для коагуляции сосудов в подслизистом пространстве и остановки кровотечения применяем одноразовые электрохирургические гемостатические шипцы Coagrasper FD‑410LR (рис. 17).
В работе используем электрохирургический блок ERBE APC 300 (рис. 18).
Как и у всех эндоскопических манипуляций, при проведении РОЕМ тоже имеются нежелательные явления. Такими нежелательными явлениями в нашем личном опыте были: гиперкапния, карбоксиперитонеум, перфорация слизистой оболочки в области пищеводно-желудочного перехода и кровотечение во время рассечения циркулярных мышц пищевода.
Гиперкапния (др.-греч. ὑπερ- — чрезмерно; καπνός — дым) — состояние, вызванное избыточным количеством CO2 в крови; причиной данного состояния во время манипуляции служила инсуффляция углекислого газа в подслизистый слой органа и всасывание его в общий кровоток. Увеличение концентрации CO2 в газовой смеси до 53–58 мм рт. ст. по показаниям капнографа регистрировалось на 40–60-й минуте проведения манипуляции. Это сопровождалось увеличением частоты сердечных сокращений и повышением артериального давления, что требовало дополнительных анестезиологических мероприятий: гипервентиляции, увеличения минутного объема, увеличения процента кислорода во вдыхаемой газовой смеси и прекращения подачи углекислого газа. Эти мероприятия проводились до стабилизации показателей гемодинамики и снижения концентрации CO2 ниже 46 мм рт. ст. Следует с большим вниманием относиться к больным пожилого и старческого возраста, страдающим гипертонической болезнью, во время проведения манипуляции и в послеоперационном периоде, так как бывает довольно трудно корригировать артериальную гипертензию на фоне возникающего ацидоза.
Напряженный карбоксиперитонеум (давление в брюшной полости свыше 15 мм рт. ст.) представлен на рисунке 19.
Карбоксиперитонеум был разрешен проведением лапароцентеза иглой «Вереша» во время операции (рис. 20).
Кровотечение во время рассечения циркулярных мышц произошло у двух больных и было остановлено коагуляцией с использованием одноразовых электрохирургических гемостатических щипцов Coagrasper FD-410LR (рис. 21).
Массивное кровотечение может возникать вследствие неверно выбранного режима резания и коагуляции, а также при рассечении большой порции мышечной ткани. Кровотечение часто наблюдается у больных, длительное время страдающих ахалазией кардии, из-за изменений структуры мышечной ткани и воспалительного процесса во всей стенке пищевода. Гемостатические клипсы не используются, так как они остаются в подслизистом пространстве и могут вызывать гнойные осложнения.
Перфорация слизистой оболочки в области пищеводно-желудочного перехода, как правило, возникает при формировании тоннеля или рассечении циркулярных мышц, вследствие «соскальзывания» инструмента с ткани и ранения слизистой оболочки органа (рис. 22).
Еще одной причиной может быть щелевидный просвет формируемого канала за счет гипертонуса мышц нижнего пищеводного сфинктера и некоторая визуальная дезориентация в рассекаемых тканях. Перфоративное отверстие сшиваем клипсами фирмы Olympus HX‑610135L. С осторожностью следует работать в зоне пищеводно-желудочного перехода у больных с ранее выполнявшимися баллонными дилатациями кардии, в связи со склеротическими изменениями в подслизистой оболочке пищевода.
Клинический пример
Больной К. 31 года, поступил в клинику с жалобами на невозможность прохождения твердой и особенно кашицеобразной и жидкой пищи, снижение массы тела и общую слабость.
Считает себя больным в течение трех лет, когда после «нервного стресса» отметил появление чувства дисфагии. Вначале дисфагия была эпизодической, а потом постоянной. Лечился амбулаторно. В последнее время появилась регургитация в ночное время (начал беспокоить кашель в ночное время, а утром указывал на мокрую подушку). Похудел за время болезни на 8–10 кг.
Объективно: кожные покровы чистые, розового цвета, тургор сохранен, отеков нет. Органы грудной клетки и брюшной полости без особенностей. Пульс 89 уд./мин., ритмичный. АД 110/70 мм рт. ст. Клинический, биохимический анализ крови и общий анализ мочи без патологических изменений. Обследован, выполнено рутинное рентгенологическое исследование пищевода, КТ органов грудной клетки и верхнего этажа брюшной полости и эндоскопическое исследование. Установлен клинический диагноз: ахалазия кардии III стадии, дисфагия 2–3 балла.
Выполнена эндоскопическая манипуляция — пероральная эндоскопическая миотомия. Послеоперационный период протекал без осложнений. Проходимость пищи по пищеводу восстановлена полностью.
Следует указать, что больной начал получать пищу через рот на третьи сутки. Выписан в удовлетворительном состоянии на 10-е сутки стационарного лечения. Через шесть месяцев при контрольном осмотре свободно принимает жидкую и твердую пищу. Прибавил в массе тела 4 кг.
На рисунке 23 представлены рентгенограммы пищевода до операции и после операции.
Вывод:
На сегодняшний день этиология и патогенез ахалазии кардии остаются неясными. Существующие генетическая гипотеза, аутоиммунная теория, теории инфекционных и психических заболеваний так или иначе представляют ключевую роль в развитии повреждения межмышечного нервного сплетения пищевода, приводящего к развитию автономной его деятельности. В то же время имеются исследования, показывающие, что ахалазия кардии является первичным функциональным расстройством, развивающимся на фоне нарушенной корковой нейродинамики, с явлениями дисфункции вегетативной нервной системы. Немаловажную роль играет зависимость интрамурального нервного аппарата пищевода от дефицита оксида азота, который приводит к расслаблению гладкой мускулатуры и регулирует мышечный тонус нижнего пищеводного сфинктера. По всей видимости, ахалазия кардии является полиэтиологичным заболеванием, и все этиологические факторы и механизмы развития заболевания могут наблюдаться в практике.
В лечении заболевания имеется три основных направления: это медикаментозное, эндоскопическое и хирургическое лечение. Изолированное медикаментозное лечение не оправдывает ожиданий. Все же на ранних стадиях заболевания и в сочетании с другими методами лечения медикаментозная терапия может быть результативной.
Основным методом лечения заболевания является эндоскопия.
Применение ботулинического токсина, локальное его введение приводит к снижению тонуса нижнего пищеводного сфинктера. Несмотря на простоту, данный метод лечения обладает существенным недостатком — коротким терапевтическим эффектом. В большинстве случаев он составляет от 3 до 12 месяцев. Немаловажным отрицательным моментом лечения ахалазии кардии ботулиническим токсином является высокая стоимость препарата. Из-за более частого рецидива заболевания препарат приходится вводить повторно. С другой стороны, данная методика обладает целым рядом преимуществ: короткий койко- день, низкий риск осложнений, безболезненность, однократное введение препарата за одну госпитализацию. Применение ботулинического токсина оправдано у пожилых пациентов и больных с тяжелой сопутствующей соматической патологией в силу высокого анестезиологического риска и риска осложнений при кардиодилатации.
В нашей клинике метод склерозирования кардии мы не используем по причине развивающихся склеротических изменений в области пищеводно- желудочного перехода, приводящих к усугублению заболевания и ограничению использования других эндоскопических методов лечения ахалазии кардии. Между тем следует указать эффективность этого метода при сочетании ахалазии с варикозным расширением вен пищевода.
Безусловно, баллонная кардиодилатация является основным методом лечения ахалазии кардии. Целью метода является дозированное растяжение мышечного слоя пищевода в области пищеводно-желудочного перехода. Оригинальная методика предполагает форсированное раздувание баллона. В этом случае требуется меньшее число сеансов дилатации для достижения клинического эффекта, однако отмечается достаточно высокая частота перфорации пищевода. В связи с этим мы предлагаем более медленное нагнетание давления в баллон, что позволяет снизить частоту осложнений и способствует планомерному растяжению мышц кардии, предотвращая их разрыв.
Четких критериев успеха манипуляции на сегодняшний день не существует. Мы придерживаемся позиции оценки клинического эффекта и рентгенологической оценки времени опорожнения пищевода от контрастного вещества, степени раскрытия кардии и появления газового пузыря желудка. Считаем эти критерии наиболее приемлемыми в общей клинической практике.
Несмотря на некоторые успешные случаи дилатации при ахалазии кардии IV стадии, считаем, что для данной группы пациентов хирургическое лечение более предпочтительно.
Конечно, большой интерес для эндоскопистов-хирургов представляет пероральная эндоскопическая миотомия как новый метод лечения.
В основе метода лежит операция Геллера. Но при формировании канала в подслизистом слое мы всегда можем выбрать протяженность рассечения циркулярного мышечного слоя пищевода и мышц кардиального отдела желудка, что играет немаловажную роль в эффективности метода лечения. Метод может нести в себе нежелательные явления, такие как гиперкапния, карбоксиперитонеум, перфорация слизистой оболочки пищевода, кровотечение из сосудов подслизистого слоя и мышц, которые можно устранить во время проведения эндоскопической манипуляции, а также различные осложнения, описанные в литературе, которые требуют выполнения хирургической объемной операции.
Очевидно, что способ пероральной эндоскопической миотомии является новым высокоэффективным методом лечения у больных, страдающих I–II–III стадией заболевания.
Беря во внимание наш многолетний опыт, в настоящее время показанием к хирургическому лечению мы считаем ахалазию кардии IV стадии, ранее перенесенные неэффективные операции по поводу ахалазии кардии, а также разрывы стенки пищевода, возникшие при баллонной дилатации.
В клинике мы применяем операцию Геллера в модификации проф. А. А. Русанова. Это позволяет не только ликвидировать замыкательную функцию кардии, но и надежно предотвратить рефлюкс-эзофагит и образование дивертикула пищевода. При сочетании ахалазии кардии IV стадии с тяжелым эрозивно-язвенным эзофагитом и выраженной атонией пищевода выполняем субтотальную резекцию пищевода с одномоментной эзофагопластикой желудочной трубкой с возможным наложением анастомоза на шее (уровень поперечнополосатых мышц пищевода). Прочие типы оперативных вмешательств в подобной ситуации, как правило, малоэффективны.Список литературы:
1. Василенко В. Х., Суворова Т. А., Гребенев А. Л. Ахалазия кардии. — М.: Медицина, 1976.
2. Воробьева В. П. К вопросу о патогенезе спазмов пищевода // Вопросы клинической отоларингологии. — Ижевск, 1963. — С. 150–153.
3. Галлингер Ю. И., Годжелло Э. А. Оперативная эндоскопия пищевода. — М., 1999. — С. 273.
4. Гребенев А. Л. Ахалазия кардии (Клиника, диагностика, лечение): Дис. ... д-ра мед. наук. — М., 1969.
5. Денисов И. Н., Шевченко Ю. Л. Справочник-путеводитель практикующего врача. 2000 болезней от А до Я. — М.: Гэотар-Медиа, 2008.
6. Еланский Н. Н. К вопросу о патогенезе и лечении кардиоспазма // Хирургия. — 1956. — № 4. — С. 33–40.
7. Зиверт К. Н. Спазм и стеноз кардии // Труды XXVII Всесоюзного съезда хирургов. — М.: Медгиз, 1962.
8. Ивашкин В. Т., Трухманов А. С. Болезни пищевода. Патологическая физиология, клиника, диагностика, лечение. — М., 2000 — С. 184.
9. Ивашкина В. Т. Гастроэнтерология: Национальное руководство / Под ред. В. Т. Ивашкина, Т. Л. Лапиной. — М.: ГЭОТАР-Медиа, 2011. — С. 480.
10. Ивашкин В. Т., Трухманов А. С. Болезни пищевода. Патологическая физиология, клиника, диагностика, лечение. — М., 2000. — С. 184
11. Иорданская Н. И. Нарушение функции блуждающих нервов при кардиоспазме // Вестник хирургии им. И. И. Грекова. — 1962. — № 2. — С. 24–28.
12. Морганштерн А. З. Ахалазия пищевода / Под ред. проф. С. А. Рейнберга. — М.: Медицина, 1968. — С. 160.
13. Муравьев В. Ю., Сагитов И. Т., Сигал Е. И., Бурмистров М. В. Диагностика и эндоскопическое лечение ахалазии кардии // Практическая медицина. — 2008. — № 26. — С. 20–22.
14. Орлова О. Р. Возможности и перспективы использования ботулотоксина в клинической практике // Русский медицинский журнал. — 2006. — № 23. — С. 3–10.
15. Орлова О. Р., Артемьева Д. В. Лечение токсином ботулизма фокальных дистоний и лицевых гиперкинезов // Неврологический журнал. — 1998. — № 3. — С. 28–33.
16. Орлова О. Р., Яхно Н. Н. Применение Ботокса (токсина ботулизма типа А) в клинической практике. — М.: Каталог, 2001. — С. 123.
17. Петровский Б. В. Кардиоспазм и его хирургическое значение // Труды 27-го Всесоюзного съезда хирургов. — М., 1962.
18. Синельников Р. Д. Атлас анатомии человека. Т. 2. — М., 1978. — С. 47–50.
19. Сторонова О. А., Трухманов А. С. Методика изучения двигательной функции пищевода / Под ред. ак. РАМН, проф. В. Т. Ивашкина — М., 2011. — С. 7.
20. Трухманов А. С. Тактика комплексного лечения ахалазии кардии: Автореф. дис. ... канд. мед. наук. — М., 1995. — С. 24.
21. Уткин В. В. Кардиоспазм. — Рига: Зинатне, 1966.
22. Федорова О. Д. Кардиоспазм. — М.: Медицина, 1973.
23. Хайман Н. М. Лечение дистонии и спастичности ботулиническим токсином. — СПб.: Чегевара, 2000. — С. 25.
24. Черноусов А. Ф., Богопольский П. М., Курбанов Ф. С. Хирургия пищевода: Руководство для врачей. — М.: Медицина, 2000.
25. Черноусов А.Ф., Гаджиев А. Н., Шестаков А. Л. Лечение кардиоспазма и ахалазии кардии пневмокардиодилатацией // Анналы хирургии. — 2000. — № 3. — С. 46–50.
26. Черноусов А. Ф., Богопольский П. М., Курбанов Ф. С. Хирургия пищевода. — М.: Медицина, 2000. — С. 350.
27. Янковский Г. А. Остеорецепция. — Рига, 1982.
28. Annese V., Bassotti G., Coccia G., D’onofrio V., Gatto G., Repici A., Andriulli A. Comparison of two different formulations of botulinum toxin A for the treatment of oesophageal achalasia. The Gismad Achalasia Study Group // Aliment Pharmacol. Ther. — 1999. — Oct. 13. — (10) : 1347–1350.
29. Biancani P., Behar J. Esophageal motor funcion // Textbook of Gastroenterology, eds. / In: Yamada T., Alpers D. H., Owyang C., Powell D. W., Silverstein F. E. — Philadelphia: J. B. Lippinccott, 1991. — P. 119.
30. Booy J. D., Takata J., Tomlinson G., Urbach D. R. The prevalence of autoimmune disease in patients with esophageal achalasia // Dis Esophagus, 2012. — 25 (3) : 209–213.
31. Batista A. M., Aguiar C., Almeida E. A., Guariento M. E., Wanderley J. S., Costa
S. C. Evidence of Chagas disease in seronegative Brazilian patients with megaesophagus // Int. J. Infect. Dis. — 2010. — 14 (11) : 974–977.
32. Bown S. G. Palliation of malignant dysphaqia: surgery, radiotherapy, laser, intubation alone or in combination // Gut. — 1991. — Vol. 32. — № 8. — P. 841– 844.
33. Bortolotti M., Mari C., Lopilato C., Porrazzo G., Miglioli M. Effects of sildenafil on esophageal motility of patients with idiopathic achalasia // Gastroenterology. — 2000, Feb. — 118 (2) : 253–257.
34. Brant C., Moraes-Filho J. P., Siqueira E., Nasi A., Libera E., Morais M., Rohr M., Macedo E. P., Alonso G., Ferrari A. P. Intrasphincteric botulinum toxin injection in the treatment of chagasic achalasia // Dis Esophagus. — 2003. — 16 (1) : 33–38.
35. Castel D. O. Approach to the patient with dysphagia. In: Yamada T., Alpers D. H., Owyang C., Howell W., Silverstein F. E., eds. // Textbook of Gastroenterology. — Philadelphia: J. B. Lippincott, 1991. — P. 562.
36. Castell D. O., ed. The Esophagus. — Boston: Little Brown, 1992.
37. Di Nardo G., Tullio-Pelet A., Annese V. Idiopathic achalasia is not allelic to alacrima achalasia adrenal insufficiency syndrome at the ALADIN locus // Digestive and liver disease: official journal of the Italian Society of Gastroenterology and the Italian Association for the Study of the Liver. — 2005. — 37 (5) : 312–315.
38. De León A. R., de la Serna J. P., Santiago J. L., Sevilla C., Fernández-Arquero M., de la Concha E. G., Nuñez C., Urcelay E., Vigo A. G. Association between idiopathic achalasia and IL23R gene // Neurogastroenterol. Motil. — 2010. — 22 (7) : 734–738.
39. Emami M. H., Raisi M., Amini J., Daghaghzadeh H. Achalasia and thyroid disease // World J. Gastroenterol. — 2007. — 13 (4) : 594–599.
40. Eckardt V. F., Gockel I., Bernhard G. Pneumatic dilation for achalasia: late results of a prospective follow up investigation // Gut. — 2004. — May. — 53 (5) : 629– 633.
41. Gockel I., Milller M., Schumacher J. Achalasia — a disease of unknown cause that is often diagnosed too late // Dtsch. Arztebl. Int. — 2012. — 109 (12) : 209–214.
42. Guardino J. M., Vela M. F., Connor J. T., Richter J. E. Pneumatic dilation for the treatment of achalasia in untreated patients and patients with failed Heller myotomy // J. Clin. Gastroenterol. — 2004. — Nov-Dec. — 38 (10) : 855–560.
43. Hurst A. F., Rake G. W. Achalasia of the cardia // Q. S. Med. — 1930. — 23 : 491– 507.
44. Hallal C., Kieling C. O., Nunes D. L., Ferreira C. T., Peterson G., Barros S. G., Arruda C. A., Fraga J. C., Goldani H. A. Diagnosis, misdiagnosis, and associated diseases of achalasia in children and adolescents: a twelveyear single center experience // Pediatr. Surg. Int. — 2012. — 28 (12) : 1211–1217.
45. Inoue H., Minami H., Kobayashi Y., Sato Y., Kaga M., Suzuki M., Satodate H., Odaka N., Itoh H., Kudo S. Peroral endoscopic myotomy (POEM) for esophageal achalasia // Endoscopy. — 2010. — Apr. — 42 (4) : 265–271. — doi: 10.1055/s‑0029-1244080. — Epub 2010. — Mar. 30.
46. Mikulicz-Radecki J. Handdb. der praktischen Chirurgie. — 2-е изд., 4 т. — Штутг., 1902.
47. Kinjo S., Takemoto M., Miyako K. et al. Two cases of Allgrove syndrome with mutations in the AAAS gene // Endocr. J. — 2004. — Vol. 51. — P. 473–477.
48. Kashyap P., Farrugia G. Enteric autoantibodies and gut motility disorders // Gastroenterol. Clin. North. Am. — 2008. — 37 (2) : 397–410.
49. Lee H. R., Lennon V. A., Camilleri M. et al. Paraneoplastic gastrointestinal motor dysfunction: clinical and laboratory characteristics // Am. J. Gastroenterol. — 2001. — 96 (2) : 373–379.
50. Moore S. W. Down syndrome and the enteric nervous system // Pediatr. Surg. Int. — 2008. — 24 : 873–883.
51. Mearin F., García-González M. A., Strunk M. et al. Association between achalasia and nitric oxide synthase gene polymorphisms // Am. J. Gastroenterol. — 2006. — 101 : 1979–1984.
52. Moskovitz D. N., Robb K. V. Small cell lung cancer with positive anti-Hu antibodies presenting as gastroparesis // Can. J. Gastroenterol. — 2002. — 16 (3) : 171–174.
53. Mikaeli J., Yaghoobi M., Montazeri G., Ansari R., Bishehsari F., Malekzadeh R. Efficacy of botulinum toxin injection before pneumatic dilatation in patients with idiopathic achalasia // Dis. Esophagus. — 2004. — 17 (3) : 213–217.
54. Mikaeli J., Yaghoobi M., Montazeri G., Ansari R., Bishehsari F., Malekzadeh R. Efficacy of botulinum toxin injection before pneumatic dilatation in patients with idiopathic achalasia // Dis. Esophagus. — 2004. — 17 (3) : 213–217.
55. Moretó M., Ojembarrena E., Rodríguez M. L. Endoscopic injection of ethanolamine as a treatment for achalasia: a first report // Endoscopy. — 1996. — Sep. — 28 (7) : 539–545.
56. Niwamoto H., Okamoto E., Fujimoto J., Takeuchi M., Furuyama J., Yamamoto Y. Are human herpes viruses or measles virus associated with esophageal achalasia? // Dig. Dis. Sci. — 1995. — 40 (4) : 859–864.
57. Okawada M., Okazaki T., Yamataka A. et al. Down’s syndrome and esophageal achalasia. — 2005.
58. Osuka K., Watanabe Y., Usuda N., Nakazawa A., Fukunaga K., Miyamoto E., Takayasu M., Tokuda M., Yoshida J. Phosphorylation of neuronal nitric oxide synthase at Ser847 by CaM-KII in the hippocampus of rat brain after transient forebrain ischemia // J. Cereb. Blood Flow Metab. — 2002. — Sep. — 22 (9) : 1098–1106.
59. Paladini F., Cocco E., Cauli A., Cascino I., Vacca A., Belfiore F., Fiorillo M. T., Mathieu A., Sorrentino R. A functional polymorphism of the vasoactive intestinal peptide receptor 1 gene correlates with the presence of HLA-B*2705 in Sardinia // Genes. Immun. — 2008. — 9 : 659–667.
60. Paladini F., Cocco E., Cascino L, Belfiore F., Badiali D., Piretta L., Alghisi F., Anzini F., Fiorillo M. T., Corazziari E. et al. Age-dependent associa tion of idiopathic achalasia with vasoactive intestinal peptide receptor 1 gene // Neurogastroenterol. Motil. — 2009. — 21 : 597–602.
61. Pasricha P. J., Ravich W.J., Kalloo A. N. Effects of intrasphincteric botulinum toxin on the lower esophageal sphincter in piglets // Gastroenterology. — 1993. — Oct. — 105 (4) : 1045–1049.
62. Pasricha P. J., Rai R., Ravich W. J., Hendrix T. R., Kalloo A. N. Botulinum toxin for achalasia: long-term outcome and predictors of response // Gastroenterology. — 1996. — May. — 110 (5) : 1410–1415.
63. Ruiz-de-León A., Mendoza J., Sevilla-Mantilla C. et al. Myenteric antiplexus antibodies and class II HLA in achalasia // Dig. Dis. Sci. — 2002. — 47 : 15–19.
64. Spechler S. J., Souza R. F., Rosenberg S. J., Ruben R. A., Goyal R. K. Heartburn in patients with achalasia // Gut. — 1995. — 37 : 305–8.
65. Seeman H., Traube M. Hiccups and achalasia // Ann. Intern. Med. — 1991. — 115
: 711–2.
66. Sławek J., Madaliński M. H., Maciag-Tymecka I., Duzyński W. Frequency of side effects after botulinum toxin A injections in neurology, rehabilitation and gastroenterology // Pol. Merkur. Lekarski. — 2005. — Mar. — 18 (105) : 298–302.
67. Salis G. B., Mazzadi S. A., García A. O., Chiocca J. C. Pneumatic dilatation in achalasia of the esophagus: a report from Argentina // Dis. Esophagus. — 2004. — 17 (2) : 124–128.
68. Tullio-Pelet A., Salomon R., Hadj-Rabia S. et al. Mutant WD-repeat protein in triple-A syndrome // Nat. Genet. — 2000. — 26 : 332–325.
69. Takahashi T. Pathophysiological significance of neuronal nitric oxide synthase in the gastrointestinal tract // Journal of Gastroenterology. — May 2003. — 38 (5) : 421–430.
70. Vigo A. G., Martínez A., de la Concha E. G., Urcelay E., Ruiz de León A. Suggested association of NOS 2A polymorphism in idiopathic achalasia: no evidence in a large case-control study // Am. J. Gastroenterol. — 2009. — 104 : 1326–1327.
71. von Renteln D., Inoue H., Minami H., Werner Y. B., Pace A., Kersten J. F., Much C. C., Schachschal G., Mann O., Keller J., Fuchs K. H., Rösch T. Peroral endoscopic myotomy for the treatment of achalasia: a prospective single center study // Am. J. Gastroenterol. — 2012 Mar. — 107 (3) : 411–417. — doi: 10.1038/ajg.2011.388. Epub 2011. — Nov 8.
72. Willis T. Pharmaceutice ratioalis sive diatribe de medicamentarum operationibus in humano corpore. — London: Hagia Comitis, 1674.
73. Weusten B. L., Samsom M., Smout A. J. Pneumothorax complicating botulinum toxin injection in the body of a dilated oesophagus in achalasia // Eur. J. Gastroenterol. Hepatol. — 2003. — May. — 15 (5) : 561–564.
74. Wehrmann T., Kokabpick H., Jacobi V., Seifert H., Lembcke B., Caspary W. F. Longterm results of endoscopic injection of botulinum toxin in elderly achalasic patients with tortuous megaesophagus or epiphrenic diverticulum // Endoscopy. — 1999. — Jun. — 31 (5) : 352–358.
75. Zilberstein B., de Cleva R., Gabriel A. G., Neto S. G., Gama-Rodriques J. J. Conqenital achalasia: facts and fantasies // Dis. Esophaqus. — 2005. — 18 (5).
76. Zarate N., Mearin F., Gil-Vernet J. M., Camarasa F., Malagelada J. R. Achalasia and Down’s syndrome: coincidental association or something else? // Am. J. Gastroenterol. — 1999. — 94 : 1674–1677.
77. Zaninotto G., Vergadoro V., Annese V., Costantini M., Costantino M., Molena D., Rizzetto C., Epifani M., Ruoi A., Nicoletti L., Ancona E. Botulinum toxin injection versus laparoscopic myotomy for the treatment of esophageal achalasia: economic analysis of a randomized trail // Surg. Endosc. — 2004. — Apr. — 18 (4) : 691– 695. —Epub 2004. — Mar. 19.
Статьи по теме
Рекомендуемые статьи
Синдром Крона
неспецифические гранулёмы в пищеводе.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.

















.jpg)





.png)


















Комментарии