- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: ДИАГНОСТИКА И ЛЕЧЕНИЕ ЛЕГОЧНЫХ КРОВОТЕЧЕНИЙ. Методические рекомендации № 25 2017г
НОРМАТИВНЫЕ ССЫЛКИ
В настоящем документе использованы ссылки на следующие нормативные документы (стандарты):
Клинические рекомендации по тактике лечения больных с легочным кровотечением. Утверждены на общем собрании Ассоциации торакальных хирургов России на V Международном конгрессе «Актуальные направления современной кардиоторакальной хирургии» 26.06.2014, Санкт-Петербург.
СПИСОК СОКРАЩЕНИЙ:
БА бронхиальная артерия
БАГ – бронхиальная артериография ИВЛ искусственная вентиляция легких ЛК легочное кровотечение
ОЦК объем циркулирующей крови
СКТ спиральная компьютерная томография ФБС фибробронхоскопия
ЭОБА эндоваскулярная окклюзия бронхиальных артерий
PVA поливинилалкоголь
ВВЕДЕНИЕ
Легочное кровотечение (ЛК) – излияние крови в просвет трахеобронхиального дерева в результате патологического процесса, затрагивающего бронхолегочные структуры, его удельный вес составляет 1–4% от общего количества всех кровотечений [3, 5, 11]. ЛК относится к жизнеугрожающим неотложным состояниям, летальность достигает 30–50%, а при массивном кровотечении – превышает 50% [3, 5, 13, 17, 18]. В то же время летальные исходы при ЛК, как правило, обусловлены не объемом кровопотери, а асфиксией [10].
Чаще всего этиологическую основу ЛК составляют: хронические гнойные и воспалительные заболевания (бронхоэктатическая болезнь, абсцесс легкого, туберкулез, аспергиллез и другие грибковые поражения легких), рак легкого и механические повреждения груди [2, 4, 12, 14].
Одна из причин ЛК – механические повреждения легких и бронхов в результате проникающих колото-резаных и огнестрельных ранений и закрытой травмы груди [1, 6, 12, 16]. В то же время вопросы диагностики и лечения травматического ЛК недостаточно известны широкому кругу практических врачей. При ранениях груди ЛК возникает вследствие непосредственного повреждения ткани и сосудов легкого по ходу раневого канала. При закрытой травме груди чаще возникают ушибы и разрывы легкого (17–55%), значительно реже (0,5–2%) образуются полости в легком, заполненные кровью и/или газом.
При механических повреждениях груди следует дифференцировать такие понятия, как ЛК и легочное кровоизлияние [1].
Помимо травмы груди причиной ЛК нередко являются аневризмы ветвей бронхиальной (БА) и легочной артерий [11, 13], которые чаще всего развиваются в результате хронических воспалительных бронхолегочных процессов, атеросклероза, повреждений, при синдроме Рандю–Ослера.
Следует отметить, что не всегда удается выяснить причину ЛК, что расценивается как идиопатическое или криптогенное ЛК. По данным ряда авторов, в 7–22% наблюдений не удается идентифицировать генез кровотечения, когда отсутствуют какие-либо эндобронхиальные или паренхиматозные изменения [4, 7, 8, 9, 13, 17].
В основу методических рекомендаций положен анализ результатов диагностики и лечения 134 пациентов с ЛК различной этиологии в НИИ скорой помощи им. Н.В. Склифосовского в период с 2014 по 2016 г.
КЛАССИФИКАЦИЯ ЛЕГОЧНЫХ КРОВОТЕЧЕНИЙ
Существует множество классификаций в отечественной литературе, учитывающих как объем ЛК, так и реакцию организма на кровопотерю.
С учетом накопленного клинического опыта мы рекомендуем модифицированную нами (предложенную И.Ю. Коржевой, 2012) эндоскопическую классификацию ЛК по аналогии с существующей классификацией желудочно-кишечных кровотечений язвенной этиологии (Forrest et al., 1974).
Согласно модифицированной классификации, продолжающееся ЛК соответствует 1-й степени:
1a – профузное продолжающееся ЛК;
1b – массивное продолжающееся кровотечение из-под выполняющего бронх тромба.
Признаки состоявшегося ЛК – 2-я степень, а интенсивность кровотечения расположилась по убыванию:
2a – в бронхах обоих легких имелись жидкая кровь и сгустки; 2b – наличие крови во всех бронхах одного легкого с преобла-
данием ее в том или ином участке;
2с – в просвете одного долевого или сегментарного бронха видна жидкая кровь или сгустки.
Признаком ЛК является кашель с мокротой и примесью алой пенистой крови. Возможно поступление крови изо рта и носа одновременно. При этом у больного отмечаются одышка, хрипы при аускультации.
В отличие от ЛК при носовых кровотечениях кровь выделяется без кашля, а при кровотечениях из пищевода, желудка – при рвоте или позыве на рвоту.
Гемодинамика и содержание гемоглобина в крови у пациентов с ЛК нетравматической этиологии страдают незначительно.
При ЛК травматической этиологии нарушения гемодинамики и признаки острой анемии в подавляющем большинстве наблюдений связаны не с объемом ЛК, а с общей тяжестью повреждений.
ДИАГНОСТИКА ЛЕГОЧНЫХ КРОВОТЕЧЕНИЙ
Диагностика ЛК требует комплексного подхода с определенной последовательностью действий неотложного характера:
– установление самого факта ЛК с исключением кровотечения из желудочно-кишечного тракта, носоглотки и ротоглотки;
– быстрая верификация источника кровотечения;
– определение характера и распространенности патологического процесса в легких;
– оценка объема кровопотери;
– оценка характера изменений свертывающей системы крови. Комплексный подход предполагает использование рентгенологического метода, компьютерной томографии, фибробронхоскопии (ФБС) и ангиографии.
Рентгенологическое исследование
При стабильном состоянии рентгенографию груди следует выполнять всем пациентам с ЛК независимо от этиологии патологического процесса. Результаты исследования наиболее информативны при травматическом ЛК. При этом патологические тени в легком выявляются у 62,3% пострадавших от общего числа пациентов с закрытой травмой и ранениями груди, что позволяет заподозрить локализацию источника кровотечения (рис. 1, 2, с. 13). В 19% наблюдений при отсутствии патологических теней в легком о стороне ЛК косвенно свидетельствуют такие признаки, как переломы ребер и/ или гидропневмоторакс.
При закрытых повреждениях легких выявляется негомогенное затенение легочной ткани с нечеткими контурами (кровоизлияние в легкое по типу пропитывания). При этом интенсивность затенения нарастает от периферии к центру при массивных повреждениях легочной ткани. В то же время при массивных повреждениях легкого затенение легочной ткани может быть обусловлено суммацией теней внутрилегочной гематомы и признаков аспирации крови. Гомогенное затенение легочного поля свидетельствует о наличии жидкости в плевральной полости, что может маскировать изменения в легочной ткани, особенно в горизонтальном положении больного.
При огнестрельных ранениях легкого отмечается негомогенная инфильтрация по ходу раневого канала (контузия легочной ткани). Подобные изменения при колото-резаных ранениях имеются лишь в 28,5%. Наличие пневмогидроторакса позволяет косвенно судить о стороне ЛК.
Среди пациентов с бронхолегочной сосудистой патологией изменения при рентгенографии выявляются в 18,2% случаев. Изменения легких носят характер «матового стекла», что может свидетельствовать о гемоаспирации.
При новообразованиях легкого локализацию источника кровотечения предполагают при наличии округлой гомогенной тени с четкими неровными контурами (рис. 3, с. 14.). Подобная картина наблюдается в 80% случаев.
Рентгенологическая картина при ЛК на фоне хронических воспалительных заболеваний легких не демонстративна и заключается в наличии умеренно выраженного диффузного пневмосклероза.
У пациентов с идиопатическим ЛК специфических рентгенологических признаков, указывающих на локализацию источника кровотечения, не отмечено.
У пациентов с ЛК после ранее перенесенной тромбоэмболии легочной артерии достоверных признаков, указывающих на локализацию источника, также не выявлено.
Таким образом, данные первичного рентгенологического исследования косвенно свидетельствуют о локализации источника ЛК в 41% наблюдений. При травматическом ЛК этот показатель составляет 62,3%, при нетравматическом характере кровотечения – 27,2%.
Спиральная компьютерная томография
Спиральную компьютерную томографию (СКТ) груди производят пациентам, у которых при клиническом и рентгенологическом исследованиях отмечены признаки ЛК.
Противопоказаниями к СКТ являются нестабильная гемодинамика, необходимость выполнения экстренного оперативного вмешательства (дренирование плевральной полости при гемоили пневмотораксе, лапаротомия при продолжающемся внутрибрюшном кровотечении), а также не иммобилизованные переломы костей таза, конечностей. ИВЛ не является противопоказанием к СКТ. После нативного сканирования проводят СКТ с болюсным контрастным усилением.
У пациентов с повреждениями груди при закрытой травме и ранениях очаги ушиба, в том числе в сочетании с разрывом легкого и образованием травматических полостей, обнаруживают в 93% наблюдений (рис. 4, 5, с. 15), однако при наличии обширных и двусторонних повреждений судить о локализации источника ЛК не представляется возможным.
Что касается нетравматического ЛК, то при СКТ с болюсным усилением у 50% пациентов с бронхолегочной сосудистой патологией выявляются внутридолевая секвестрация, сосудистые мальформации и новообразования сосудистого характера.
У больных с новообразованиями легких объемные образования легких различной локализации наблюдаются в 87% случаев.
Среди пациентов с воспалительными процессами, включая туберкулез, СКТ выявляет патологические изменения в легких в 100% случаев. У больных с туберкулезом, кроме этого, отмечаются признаки инфильтративного и фиброзного заболевания в активной стадии.
Таким образом, СКТ позволяет выявить наличие патологического процесса в легких у 70% пострадавших и больных с ЛК, что косвенно указывает на локализацию источника кровотечения. Однако, если при травматическом ЛК данные СКТ дают возможность заподозрить источник в 93% случаев, то при нетравматическом характере кровотечения – только в 54%. Кроме того, исследование позволяет установить характер патологического процесса: ушиб легкого и травматические полости, патология сосудов, новообразования легких, деструкция легочной ткани, бронхоэктазы.
Эндоскопическое исследование
Эндоскопическое исследование необходимо выполнять всем пациентам с ЛК независимо от объема кровотечения и характера патологического процесса.
При ФБС у больных с продолжающимся ЛК кровь в трахеобронхиальном дереве обнаруживают в 100% случаев. Помимо общепринятого эндоскопического признака в виде струйного поступления крови из долевого бронха к признакам продолжающегося ЛК относятся: формирование дорожки крови из сегментарного или долевого бронха, в том числе из-под выполняющего их тромба; наличие выполняющего бронх тромба с большим количеством следов крови в нижеи вышележащих отделах бронхиального дерева.
При сопоставлении рентгенологических и эндоскопических данных у пациентов с травматическим ЛК совпадение источника в пределах доли легкого отмечается в 43,4% случаев. При эндоскопической верификации данных СКТ у пациентов с травматическим ЛК совпадение источника в пределах доли легкого отмечено в 69%.
Что касается нетравматического ЛК, то выявленные при рентгенографии груди очаговые изменения легких по локализации источника соответствуют данным эндоскопии в 27,2% наблюдений. При сопоставлении результатов СКТ и эндоскопического исследования совпадение по локализации источника отмечается в 95%.
Следует отметить, что верификация локализации источника кровотечения существенно разнится при продолжающемся и состоявшемся кровотечении. Локализация источника кровотечения (в пределах доли легкого) верифицируется в 95% наблюдений продолжающегося ЛК, в то время как среди пациентов с состоявшимся ЛК – только в 57%.
Кроме того, ФБС позволяет выявить повреждения бронхов, новообразования и деструктивные изменения бронхиального дерева.
Эндоваскулярное исследование
У пострадавших с травмой груди и ЛК ангиографию не применяют ввиду повреждения сосудов малого круга кровообращения, эмболизация которых нецелесообразна в связи с риском развития инфаркта легкого и легочной гипертензии.
При эндоваскулярном исследовании у пациентов с ЛК нетравматической этиологии, наиболее частыми, подтверждающими источник ЛК являются следующие косвенные признаки: гиперваскуляризация, извитость и дилатация БА, в то время как прямые признаки кровотечения определяются довольно редко [4].
Анализ ангиограмм, выполненных пациентам с ЛК, дает возможность определить прямые и косвенные признаки ЛК. Экстравазация, периартериальная и перибронхиальная диффузия контрастного вещества, тромбоз ветвей БА, являясь прямыми признаками продолжающегося и состоявшегося ЛК, позволяют достоверно локализовать кровоточащий сосуд. В то же время надо отметить, что это достаточно редкие ангиографические признаки.
Отсутствие патологических изменений со стороны БА служит показанием к контрастированию экстрабронхиальных системных (в том числе межреберных, внутренних грудных) артерий и ветвей легочной артерии. При этом обнаруживают патологические системно-легочные шунты из межреберных артерий, расширение реберношейного артериального ствола.
ЛЕЧЕНИЕ ПАЦИЕНТОВ С ЛЕГОЧНЫМ КРОВОТЕЧЕНИЕМ
Для пациентов с ЛК травматической и нетравматической этиологии должен использоваться различный диагностический и лечебный алгоритм (схемы 1, 2).
Клинический осмотр пациента в сочетании с инструментальным (рентгенологическим, компьютерно-томографическим, эндоскопическим) исследованием позволяет отнести его к травматическому или нетравматическому характеру патологии, выявить локализацию источника кровотечения с возможной окклюзией кровоточащего сосуда.
Травматический характер ЛК отмечается при закрытых повреждениях и ранениях груди.
К нетравматическим относятся наблюдения ЛК при бронхолегочной сосудистой патологии, новообразованиях легких, неспецифических и специфических воспалительных заболеваниях, идиопатическое ЛК, легочная гипертензия вследствие ранее перенесенной тромбоэмболии легочной артерии и редкие наблюдения коагулопатического и катамениального ЛК.
Схема 1 – Алгоритм действий при легочном кровотечении травматической этиологии. Интенсивность легочного кровотечения определена согласно модифицированной нами эндоскопической классификации легочного кровотечения
Схема 2 – Алгоритм действий при легочном кровотечении нетравматической этиологии
Примечание: БАГ – бронхиальная артериография; ЭОБА –эндоваскулярная окклюзия бронхиальных артерий.
Рисунок 1 – Ушиб правого легкого
Рисунок 2 – Ушиб и гематома левого легкого
Рисунок 3 – Новообразование левого легкого
Рисунок 4 – Спиральная компьютерная томография при закрытой травме груди: а – определяются массивные ушибы легочной ткани с обеих сторон, слева имеется разрыв легочной ткани с образованием обширных полостей, заполненных преимущественно газом; б – то же наблюдение: мультипланарная реконструкция в коронарной плоскости
Рисунок 5 – Огнестрельное ранение груди: а – в проекции IV, VI, VIII сегментов правого легкого определяются включения металлической плотности размерами от 2–12 мм. В IV–VI, VIII–X сегментах правого легкого отмечается повышение плотности легочной паренхимы до значений мягких тканей (до 37 едН), на фоне чего прослеживаются просветы бронхов; б – то же наблюдение: мультипланарная реконструкция в сагиттальной проекции. В мягких тканях грудной стенки на уровне переднего отрезка III ребра справа имеется инородное тело металлической плотности
Рисунок 6 – Клапанная бронхоблокация при ЛК: а – пациенту с закрытой травмой груди и ЛК 1а степени в правый нижнедолевой бронх установлен эндобронхиальный клапан; б – то же наблюдение через 5 мин: достигнут гемостаз
Рисунок 7 – Ангиограмма правой бронхиальной артерии: а – пропитывание периваскулярной и перибронхиальной клетчатки контрастным веществом; б – состояние после эмболизации микроэмболами
Консервативное лечение
Предупреждение асфиксии:
– восстановление проходимости дыхательных путей, в том числе интубация трахеи;
– возвышенное положение тела, положение пациента на больном боку;
– нормализация газообмена: оксигенотерапия при гипоксемии;
– искусственная вентиляция легких (ИВЛ) при наличии остройдыхательной недостаточности (гипоксемия, гиперкапния, респираторный ацидоз). Массивное ЛК является показанием для эндобронхиальной интубации.
Управляемая гипотензия
Считается, что более 90% летальных исходов при ЛК связано с гипертензией в малом круге кровообращения. В связи с этим важнейшим компонентом патогенетического лечения пациентов с ЛК является управляемая гипотония. Наибольшей эффективностью обладают ганглиоблокаторы, механизм действия которых – депрессорное влияние на кровообращение в целом, выражающееся в торможении передачи вазоконстрикторной импульсации из сосудистого центра, снижении секреции катехоламинов и прямом влиянии некоторых ганглиоблокаторов на сосудистую стенку.
Для управляемой гипотензии используют ряд препаратов, оказывающих прямое сосудорасширяющее действие, в том числе венозные вазодилататоры (гидралазин, изофлюран, нитропруссид натрия, нитроглицерин, аденозин и аденозинтрифосфат), бетаадреноблокаторы (пиндолол, целипролол, небиволол).
Коррекция факторов свертывания
Рекомбинантный активированный фактор VII (препараты
«НовоСэвен», «Коагил-VII») является универсальным гемостатическим средством при различных кровотечениях. При ЛК начинать введение эптакога альфа следует с первых признаков кровотечения.
Препарат вводят в/в струйно, 1 доза составляет 90 мкг/кг массы тела. Препарат следует вводить каждые 2–3 ч до достижения гемостаза. Длительность лечения и интервал между введениями препарата определяются тяжестью кровотечения или характером хирургического вмешательства. Значительно медленнее действуют витамин К и его синтетические аналоги, поскольку их действие опосредовано через синтез печенью II, VII, IX и X факторов свертывания. Гемостатический эффект проявляется лишь через 12–18 ч после внутримышечного введения. Десмопрессин – препарат, ускоряющий свертывание крови, синтетический аналог антидиуретического гормона, который стимулирует высвобождение предшественника фактора фон Виллебранда и фактора VIII. Свежезамороженная плазма содержит все плазменные факторы.
Криопреципитат – концентрированный VIII фактор, который вводят при фибриногене ниже 100 мг%. PPSB – препарат, содержащий четыре фактора (IX, X, VII, II) свертывающей системы, концентрация которых в 6–10 раз больше, чем в плазме здоровых доноров. Тромбоцитопения с уровнем менее 50 000 х 109/л требует переливания тромбоцитарной массы.
Коррекция фибринолиза
Для коррекции повышенного фибринолиза при ЛК применяют широкий спектр лекарственных препаратов, включая эпсилонаминокапроновую и транексамовую кислоты, механизм действия которых заключается в ингибировании активации плазминогена и его превращении в плазмин. Эти препараты оказывают специфическое местное и системное гемостатическое действие при кровотечениях, связанных с повышением фибринолиза. При фибринолитических кровотечениях применяют апротинин (гордокс, контрикал, трасилол) – полипептид, получаемый из легких крупного рогатого скота. Он блокирует калликреин-кининовую систему, ингибирует как суммарную протеолитическую активность, так и активность отдельных протеолитических ферментов и является поливалентным ингибитором протеаз.
Инфузионно-трансфузионная терапия
Острая кровопотеря остается одной из самых первоочередных проблем у пациентов с травматическим ЛК. В связи с этим наряду с адекватным обезболиванием сразу же при поступлении в стационар этим больным проводят интенсивную инфузионно-трансфузионную терапию, основными целями которой являются: коррекция анемии и обеспечение эффективного транспорта кислорода, поддержание водно-электролитного баланса и восстановление нарушений кислотно-основного состояния, улучшение микроциркуляции крови.
ЛК, вызывающее постгеморрагическую анемию, служит показанием к заместительной трансфузии эритроцитарной массы. Восполнение объема циркулирующей крови (ОЦК) проводят препаратами с высоким волемическим коэффициентом. Эффективность
лечения острой кровопотери зависит как от средств ее возмещения, так и от объема трансфузионной терапии.
Кислородную емкость крови обеспечивают поддержанием уровня гемоглобина не ниже 90 г/л. При кровопотере до 20% ОЦК гемотрансфузия вообще не требуется, и кровезамещение проводят коллоидными и кристаллоидными растворами в соотношении 1:2. В случае кровопотери более 20% ОЦК, в том числе при массивных кровопотерях, главной задачей является не столько коррекция анемии, сколько компенсация объема циркулирующей жидкости, необходимого для поддержания нормальной гемодинамики и предотвращения коагулопатии.
У пациентов с сопутствующей тяжелой кардиальной патологией ограничивают объем инфузии во избежание перегрузки малого круга кровообращения.
Коррекция дыхательных нарушений и респираторная поддержка
Прогрессирующая дыхательная недостаточность с развитием гипоксии и гиперкапнии у больных с продолжающимся или рецидивирующим ЛК является показанием к эндобронхиальной интубации. Именно эндобронхиальную, а не эндотрахеальную интубацию следует осуществлять, чтобы предотвратить затекание крови в противоположное легкое и проводить адекватную вентиляцию одного легкого. Оптимальной при массивном и профузном ЛК является раздельная интубация главных бронхов, которая по сравнению с другими методами имеет ряд преимуществ:
– позволяет поддерживать адекватную вентиляцию при хирургических вмешательствах, надежно изолирует пораженное легкое от здорового при патологических процессах, осложненных кровотечением, выделением большого количества гноя, мокроты; обеспечивает условия для того, чтобы непрерывно осуществлять аспирацию из трахеобронхиального дерева одного легкого, не прекращая вентиляции другого;
– позволяет полностью или частично выключать оперируемое легкое из вентиляции, проводить независимую вентиляцию каждого легкого, при необходимости быстро переходить от однолегочной вентиляции к двулегочной;
– создает максимальные удобства для выполнения операции путем изменения степени коллабирования легкого.
Раздельную интубацию бронхов производят с помощью специальных эндобронхиальных трубок. Наиболее распространены и хорошо зарекомендовали себя в практической работе двухпросветные трубки для раздельной интубации – Карленса, Уайта и Роберт Шоу.
Основными целями респираторной поддержки являются: обеспечение достаточной оксигенации, обеспечение нормокапнии, увлажнение и очищение вдыхаемой газовой смеси, дыхательный мониторинг.
У пострадавших с ЛК в раннем послеоперационном периоде в связи со значительными нарушениями газообмена необходима респираторная поддержка с использованием различных режимов вентиляции, что позволяет улучшить функцию дыхания, уменьшить проявления рестриктивных нарушений и обеспечить перевод больных на самостоятельное дыхание. Основным принципом проведения вентиляции является соблюдение концепции «безопасной ИВЛ», включающей следующие компоненты: пиковое давление в дыхательных путях – не более 35 см вод.ст.; дыхательный объем – 8–10 мл/кг массы тела в случае отсутствия признаков острого повреждения легких, 6 мл/кг массы тела при наличии острого респираторного дистресс-синдрома; частота дыхания и минутный объем вентиляции – минимально необходимые для поддержания РаСО2 на уровне 30–40 мм рт.ст.; скорость пикового инспираторного потока – в диапазоне от 30–40 до 70–80 л/мин; FiО2 – минимально необходимая для поддержания достаточного уровня PaО2 и транспорта кислорода к тканям; выбор PEEP – в соответствии с концепцией «оптимального РЕЕР», при котором транспорт кислорода к тканям максимальный; продолжительность инспираторной паузы – не более 30% от продолжительности инспираторной части дыхательного цикла; оптимальное соотношение вдох/выдох (I:Е) 1:2–1:1,5.
Основной целью неинвазивной вентиляции легких является обеспечение адекватной оксигенации или элиминации CO2 благодаря реверсированию ателектазированных участков легких или созданию условий для восстановления функции дыхательной мускулатуры.
Эндоскопическое лечение
Показанием к лечебным эндоскопическим исследованиям является состоявшееся или продолжающееся ЛК. Используют санационную бронхоскопию и окклюзию бронхов.
В соответствии с модифицированной нами эндоскопической классификацией ЛК 1-й степени интенсивности встречается в 30% наблюдений, 2-й степени – в 70%.
Всем пациентам с ЛК при ФБС помимо установления локализации источника проводят санацию трахеобронхиального дерева.
Показаниями к повторным ФБС служат повторные эпизоды ЛК, отсутствие стабильного гемостаза на предыдущем исследовании у пациентов, находящихся на ИВЛ, наличие фиксированных сгустков крови в бронхах, не позволяющих уточнить диагноз, в том числе разрывы бронхов, новообразования.
Клапанную бронхоблокацию выполняют у пациентов с продолжающимся ЛК 1а, b степени (рис. 6, с. 16). Эндобронхиальный клапан (Medlung) устанавливают в долевые бронхи.
Интенсивность ЛК иногда требует выполнения ригидной бронхоскопии под высокочастотной вентиляцией легких. Через тубус бронхоскопа в просвет кровоточащего бронха вводят катетер для аспирации крови, что позволяет безопасно установить эндобронхиальный клапан и добиться временного гемостаза. Кроме этого, при ЛК добиться гемостаза можно путем тампонирования кровоточащего бронха поролоновой губкой.
Таким образом, при клапанной бронхоблокации гемостаз достигается в 100% случаев. Это позволяет в спокойных условиях выполнить дополнительные исследования и определить дальнейшую тактику лечения. В то же время, понимая механизм достижения гемостаза при клапанной бронхоблокации за счет ателектаза и снижения кровотока в блокированной доле легкого, допускается вероятность рецидива кровотечения. Поэтому после установки клапана у пациентов с ЛК 1а, b степени интенсивности проводят эндоскопическое наблюдение в течение 5–10 мин для коррекции положения клапана в случае его смещения или пломбировки кровоточащего бронха при неэффективности бронхоблокации.
Эндоваскулярное лечение
Известно, что БА ответственны за развитие нетравматического ЛК в 90% наблюдений. БАГ и ЭОБА являются мини-инвазивными и наиболее эффективными методами диагностики и остановки ЛК, которые в отличие от эндоскопического метода позволяют локализовать непосредственно кровоточащий сосуд, провести остановку кровотечения, стабилизировать и подготовить пациента к операции по поводу основного заболевания.
БАГ в подавляющем большинстве наблюдений трансформируется в лечебное вмешательство с проведением ЭОБА.
Для катетеризации устьев бронхиальных артерий используют катетеры Simmons 1, Cobra, Hook размером 5–6F, прямые и J-проводники 0,035 производства фирм Cordis и Cook (США).
После катетеризации бедренной артерии по проводнику под контролем рентгеноскопии катетер поднимают до уровня нисходящего отдела грудной аорты. Тщательно обследуют все стенки аорты от уровня Тh3 до Тh10 для поиска устьев БА и межреберных артерий. Для контроля положения катетера и идентификации сосуда вводят 1–2 мл рентгеноконтрастного вещества, затем выполняют ангиографию путем ручного введения 6–8 мл рентгеноконтрастного вещества.
В качестве эмболизирующего материала используют множество материалов: металлические спирали, желатиновую губку, поливинилалкоголь (PVA) и клеи. PVA с размером частиц 350– 500 мкм является рекомендованным, наиболее часто применяемым в мире эмболизатом, так как не проникает через небольшие бронхолегочные анастомозы, размер которых составляет около 325 мкм. Проксимальная эмболизация гипертрофированных, увеличенных в диаметре БА или аберрантов с использованием только металлических спиралей связана с риском “потери” дистальных коллатералей, которые, развившись, могут явиться причиной рецидива ЛК. Поэтому спиральная эмболизация при ЛК, как правило, сочетается с дозированным применением PVA. Окклюзию проводят под тщательным рентгеноскопическим контролем, периодически вводя в артерию рентгеноконтрастное вещество. При наступлении окклюзии сосуда введение эмболов прекращают. Через 5 мин выполняют контрольную ангиографию. При сохранении окклюзии эмболизацию прекращают, после чего продолжают поиск дополнительных источников кровоснабжения патологически измененного участка легкого.
Если на контрольной ангиограмме выявляют значительный сброс рентгеноконтрастного вещества в аорту, а полной окклюзии БА достичь не удается, введение эмболов прекращают. Положительным результатом вмешательства считается прекращение контрастирования БА. Противопоказаниями для вмешательства являются нестабильная позиция катетера в БА, риск эмболизации спинальных артерий.
Непосредственная эффективность ЭОБА составляет 97% (рис. 7, с. 16). Рецидив ЛК в течение первых 2 мес отмечен в 12,5% случаев. Таким образом, в большинстве наблюдений ЛК нетравматичес-
кой этиологии при БАГ удается верифицировать источник кровотечения и выполнить эффективную окклюзию кровоточащего сосуда, что позволяет избежать неотложных операций на высоте кровотечения. При этом обязательным является выключение всех БА и других системных артерий, принимающих участие в кровоснабжении патологической зоны. В противном случае вероятен рецидив ЛК за счет реваскуляризации или поражения патологическим процессом ранее неокклюзированных ветвей.
Хирургическое лечение легочного кровотечения
Число хирургических вмешательств при ЛК неуклонно снижается с момента первой успешной ЭОБА [15]. В отличие от ЛК нетравматической этиологии, при котором источником кровотечения чаще всего является БА, а золотым стандартом лечения – ЭОБА, при повреждениях груди источником продолжающегося кровотечения служат легочные сосуды, эмболизация которых чаще всего невыполнима. В связи с этим показания к экстренным операциям на высоте кровотечения при травме груди возникают чаще, чем при нетравматическом ЛК.
Показанием к экстренной торакотомии в ранние сроки после травмы является продолжающееся ЛК, в том числе после клапанной бронхоблокации. Другими показаниями к вынужденным неотложным операциям служат разрывы бронхов, однако в большинстве этих наблюдений ЛК носит состоявшийся характер.
В зависимости от повреждения выполняют лобэктомию, билобэктомию, формирование трахеобронхиального и межбронхиального анастомозов, ушивание разрывов бронхов, хирургическую обработку глубоких разрывов и раневых каналов в легком.
У пострадавших с профузным кровотечением целесообразно проведение пломбировки главного бронха, что делает возможным осуществление экстренной торакотомии.
Хирургические вмешательства при нетравматическом ЛК производят на фоне достижения временного гемостаза, в том числе в результате ЭОБА и клапанной бронхоблокации. Объем хирургического вмешательства заключается в лобэктомии, билобэктомии или пневмонэктомии.
Данные рентгенологического исследования косвенно свидетельствуют о локализации источника в 41% наблюдений ЛК в целом, в том числе в 62,3% при травматической и в 27,2% – нетравматической этиологии кровотечения. Компьютерная томография позволяет выявить наличие патологического процесса в легких в 70,7% наблюдений (в 93% – при травматическом и в 54% – нетравматическом характере патологии), что также косвенно свидетельствует о локализации источника кровотечения.
Усовершенствованная эндоскопическая классификация ЛК, учитывающая интенсивность кровотечения, позволяет обосновать дифференцированную лечебную тактику.
При ФБС удается верифицировать локализацию источника продолжающегося кровотечения в 95% наблюдений и состоявшегося – в 57,3% .
Клапанная бронхоблокация при продолжающемся ЛК дает возможность добиться гемостаза и сократить число хирургических операций на высоте кровотечения в 94% случаев.
БАГ позволяет верифицировать непосредственно источник ЛК нетравматической этиологии, осуществить окклюзию сосудов, участвующих в кровоснабжении патологической зоны. Непосредственная эффективность эндоваскулярных методов лечения нетравматического ЛК составляет 97%. При ЛК травматической этиологии эндоваскулярные технологии не могли быть использованы ввиду того, что источником ЛК при этом чаще всего служат сосуды малого круга кровообращения, эмболизация которых нецелесообразна и чревата серьезными осложнениями.
В лечении пациентов с ЛК необходим дифференциальный подход к методам гемостаза в зависимости от этиологии патологического процесса.
Полный текст статьи:
Список литературы:
2. Левин А.В., Цеймах Е.А., Зимонин П.Е. Лечение легочных кровотечений. Ч. 1. Этиология, патогенез, консервативное лечение, коллапсотерапия, эндоскопические методы // Проблемы клиничес- кой медицины. – 2008. – № 1. – С. 90–95.
3. Стручков В.И., Недвецкая Л.М., Долина О.А., Бирюков Ю.В. Хронические нагноительные заболевания легких, осложненные кровотечением. – М.: Медицина, 1985. – 256 с.
4. Квашин А.И., Атаманов С.А., Мельник А.В., Быков А.О., Помкин А.А., Ширкин И.Г., Портнягин А.Ф., Пачерских Ф.Н., Григорьев Е.Г. Эндоваскулярный гемостаз при легочном кровотече- нии // Международный журнал интервенционной кардиоангиологии
– 2012. – № 31. – С. 8–18.
5. Яковлев В.Н., Марченков Ю.В., Коржева И.Ю., Алексеев В.Г., Мороз В.В. Современные методы диагностики и лечения легоч- ных кровотечений // Пульмонология. – 2013. – № 4. – С. 5–12.
6. Chiarelli M., Gerosa M., Guttadauro A., Gabrielli F., Vertemati G., Cazzaniga M., Fumagalli L., De Simone M., Cioffi U. Urgent pulmonary lobectomy for blunt chest trauma: report of three cases without mortality. J. Thorac. Dis. 2016; 8(7): 1825–1829. doi: 10.21037/jtd. 2016.06.10.
7. Chun J.Y., Belli A.M. Immediate and long-term outcomes of bronchial and non-bronchial systemic artery embolisation for the management of haemoptysis. Eur. Radiol. 2010; 20(3): 558–665. doi: 10.1007/s00330–009–1591–3.
8. Delage A., Tillie-Leblond I., Cavestri B., Wallaert B., Marquette
C.H. Cryptogenic hemoptysis in chronic obstructive pulmonary disease: characteristics and outcome. Respiration. 2010; 80(5): 387–392. doi: 10.1159/000264921.
9. Garcia-Olivé I., Sanz-Santos J., Centeno C., Radua J., Andreo F., Sampere J., Michavila J.M., Muchart J., Stojanovic Z., Ruiz Manzano J. Predictors of recanalization in patients with life-threatening hemoptysis requiring artery embolization. Arch. Bronconeumol. 2014; 50(2): 51–56. doi: 10.1016/j.arbres.2013.06.003.
10. Jean-Baptiste E. Clinical assessment and management of massive hemoptysis. Crit. Care Med. 2000; 28(5):1642–1647. PMID:10834728.
11. Jougon J., Ballester M., Delcambre F., Mac Bride T., Valat P., Gomez F., Laurent F., Velly J.F. Massive hemoptysis: what place for medical and surgical treatment. Eur. J. Cardiothorac. Surg. 2002; 22(3): 345–351. PMID:12204721.
12. Karmy-Jones R.,Jurkovich G.J.,Shatz D.V.,Shatz D.V.,Brundage S., Wall MJ Jr, Engelhardt S., Hoyt D.B., Holcroft J., Knudson M.M. Management of traumatic lung injury: a Western Trauma Association Multicenter review. J. Trauma. 2001; 51(6):1049–1053. PMID:11740249.
13. Kervancioglu S., Bayram N., Gelebek Yilmaz F., Sanli M., Sirikci
A. Radiological findings and outcomes of bronchial artery embolization in cryptogenic hemoptysis. J. Korean Med. Sci. 2015; 30(5): 591–597. doi: 10.3346/jkms.2015.30.5.591.
14. Larici A.R., Franchi P., Occhipinti M., Contegiacomo A., del Ciello A., Calandriello L., Storto M.L., Marano R., Bonomo L. Diagnosis and management of hemoptysis. Diagn. Interv. Radiol. 2014; 20(4): 299– 309. doi: 10.5152/dir.2014.13426.
15. Remy J., Arnaud A., Fardou H., Giraud R., Voisin C. Treatment of hemoptysis by embolisation of bronchial arteries. Radiology. 1977; 122(1): 33–37. doi:10.1148/122.1.33.
16. Sachithanandan A., Fahmi P.A., Faisal I., Balaji B., Abdul Muis J., Mohd Arif M.N. Emergency thoracotomy and major lung resection for penetrating chest trauma: Lessons learnt from a review of three cases. Med. J. Malaysia. 2013; 68(3): 227–230. PMID:23749011.
17. Swanson K.L., Johnson C.M., Prakash U.B., McKusick M.A., Andrews J.C., Stanson A.W. Bronchial artery embolization: experience with 54 patients. Chest. 2002; 121(3): 789–795. PMID:11888961.
18. Yendamuri S. Massive Airway Hemorrhage. Thorac. Surg. Clin. 2015; 25(3): 255–260. doi: 10.1016/j.thorsurg.2015.04.009.
Рекомендуемые статьи
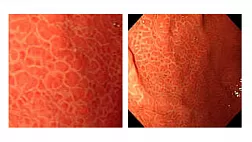
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.














.jpg)





.png)


.jpg)
















Комментарии