- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Эндоскопическая диагностика и лечение пациента с кардиоэзофагеальным раком через 3 месяца после гастрошунтирующей операции.
| Авторы: | Соколов Сергей Александрович 1 Ленский БС, Москалец М.В., Каннер Д.Ю., Фёдоров Е.Д. 2 |
| Об авторах: |
1. ГБУЗ г. Москвы "Московская городская онкологическая больница №62 ДЗ г. Москвы", врач-эндоскопист 2. ГБУЗ г. Москвы "Московская городская онкологическая больница №62 ДЗ г. Москвы" |




Полный текст статьи:
ЭНДОСКОПИЧЕСКАЯ ДИАГНОСТИКА И ЛЕЧЕНИЕ ПАЦИЕНТА С КАРДИОЭЗОФАГЕАЛЬНЫМ РАКОМ ЧЕРЕЗ 3 МЕСЯЦА ПОСЛЕ ГАСТРОШУНТИРУЮЩЕЙ ОПЕРАЦИИ.
Соколов С.А., Ленский Б.С., Москалец М.В., Каннер Д.Ю., Федоров Е.Д.
Государственное бюджетное учреждение здравоохранения города Москвы «Московская городская онкологическая больница № 62 Департамента здравоохранения города Москвы»
Введение.
Возникновение рака в шунтированном желудке после бариатрической операции, выполненной по поводу морбидного ожирения, - редкое, но встречающееся явление. В мировой литературе, с момента предложенной в 1997 г. американским хирургом R. Routledge мини-гастрошунтирующей операции и до настоящего времени, зарегистрировано до 10 таких случаев [1, 2, 3]. Интервалы между шунтирующими операциями и развитием рака в «отключенном» желудке составляют от одного до двадцати двух лет, а своевременная диагностика онкопроцесса зависит от наличия, либо напротив, отсутствия эффективных инструментов для мониторинга [2, 3]. Существует несколько методов оценки состояния «отключенного» желудка: рентгенологический, включающий чрескожное введение контраста в шунтированный желудок, ретроградный осмотр педиатрическим колоноскопом или энтероскопом [1, 5].
Неоспорим тот факт, что отдаленные результаты бариатрической операции зависят и от качества эндоскопического осмотра пищевода, желудка и двенадцатиперстной кишки выполненного перед хирургическим вмешательством. Рак, выявленный в «отключенном» желудке через год после шунтирующей операции, напрямую связан с недостаточным предоперационным эндоскопическим осмотром [2, 4].
В настоящей статье рассмотрено нетипичное для общей практики клиническое наблюдение - эндоскопическая диагностика и удаление аденокарциномы кардии у пациента с морбидным ожирением через три месяца после гастрошунтирующей операции, а также методика эндоскопического осмотра «отключенного» желудка с использованием однобаллонного энтероскопа.
Клинический случай.
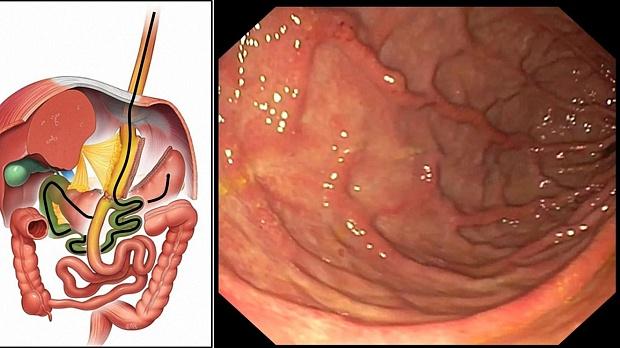
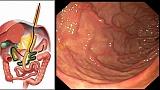
Мужчина 55 лет, обратился в нашу клинику в сентябре 2019 года для проведения уточняющей диагностики и лечения по поводу рака кардиоэзофагельного перехода. На момент обращения присутствовали жалобы на незначительные, периодически возникающие боли в эпигастрии. Из анамнеза известно, что на протяжении многих лет пациент страдал морбидным ожирением (индекс массы тела 49,4), имел характерную для метаболического синдрома сопутствующую патологию (сахарный диабет II типа, инсулинпотребный, субкомпенсация; диабетическая ангиопатия, полинейропатия; гипертоническая болезнь III ст., 2 ст.). Консервативные методы лечения были неэффективными, в связи с чем 10 июня 2019г., в одном из Московских центров бариатрической хирургии, пациенту была проведена лапароскопическая операция – минигастрошунтирование («Mini-Gastric Bypass»). Суть операции состояла в формировании и изоляции «малого желудочка» от «отключенного» желудка с наложением гастроэнтероанастомоза с «малым желудочком» по типу Бильрот-II на длинной (не менее 200 см) приводящей петле (рис. 1).
За 3 дня до операции, в этом же центре пациенту была выполнена эзофагогастродуоденоскопия, по результатам которой в области розетки кардии была выявлена «гиперемия и отечность слизистой оболочки», расцененная как «эрозивный эзофагит на фоне недостаточности кардии» (рис. 2). Вопреки существующим клиническим рекомендациям из «зоны отека слизистой оболочки» была произведена биопсия, а плановая бариатрическая операция была выполнена до получения результатов гистологического исследования. Компьютерная томография органов грудной и брюшной полости перед операцией не проводилась.
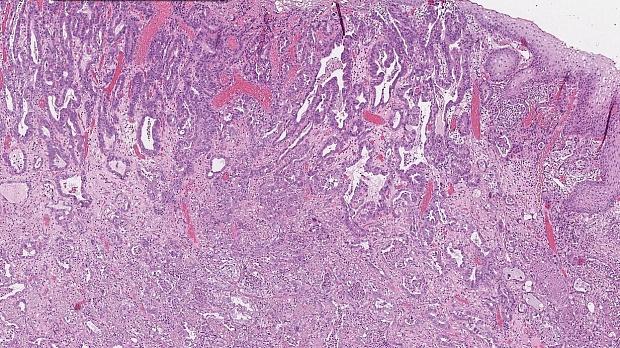
Через 7 дней после бариатрической операции (17.06.2019г.) стал известен результат планового гистологического исследования биоптатов: умеренно-дифференцированная аденокарцинома кардии. Оперирующим хирургом было рекомендовано пересмотреть стекла и блоки в онкологическом учреждении.
Послеоперационный период у пациента сопровождался длительно незаживающими язвами по нижней полуокружности гастроэнтеро-анастомоза, в связи с чем на протяжении трех месяцев в амбулаторном режиме проводилась противоязвенная, противовоспалительная, корригирующая терапия. За это время вес пациента уменьшился на 30 килограммов (со 160 до 130 кг), нормализовался уровень глюкозы крови (с 16 до 8 ммоль/л).
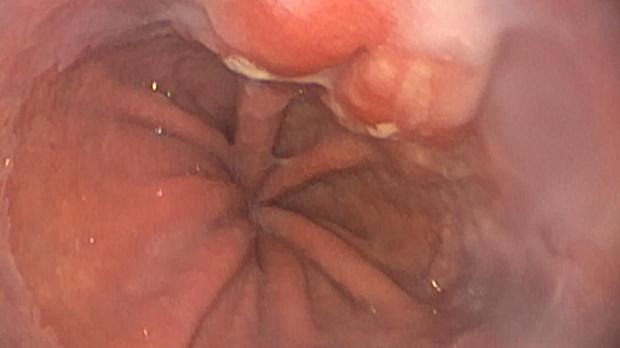
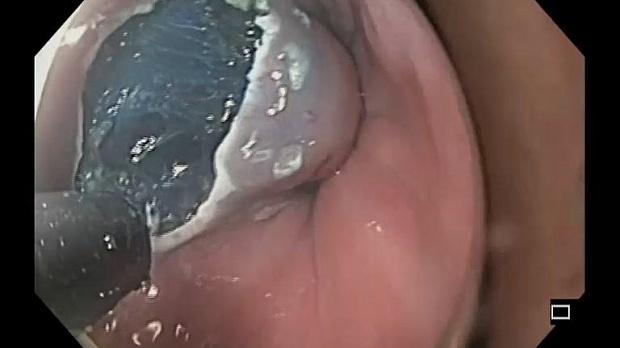
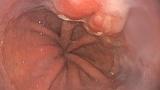
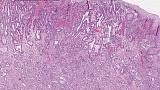
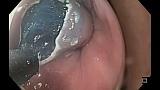
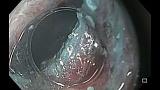
При поступлении в нашу клинику, по результатам пересмотра предоставленного гистологического материала был подтверждён диагноз аденокарциномы (рис. 3). При повторной эзофагогастродуоденоскопии в области кардиоэзофагеального перехода было обнаружено эпителиальное образование Is типа, размерами до 15 х 20 мм, высотой до 8 мм. При осмотре в узком спектре света (NBI) с использованием функции двойного фокуса имелась отчётливая демаркационная линия между новообразованием и окружающей его слизистой оболочкой, а в его центральной части микрососудистый рисунок имел нерегулярный характер, ямочный рисунок поверхности эпителия был разрушен, что согласно VS-классификации K.Yao характерно для неопластических изменений (рис. 4 a, b). Просвет «малого» вновь сформированного желудка расправлялся не полностью, складки были утолщены, слизистая оболочка отечная, гиперемирована. Гастроэнтероанастомоз широкий, эластичный, слизистая оболочка его отечная, незначительно гиперемирована, без язв и эрозий. Слизистая оболочка анастомозированной тонкой кишки без особенностей.
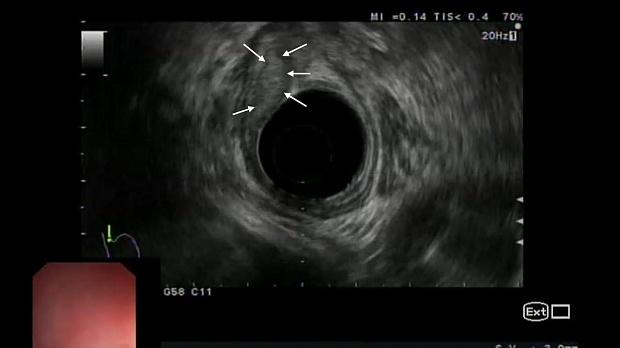
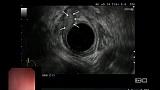
Для оценки глубины инвазии опухоли в стенку пищевода и желудка, а также для характеристики регионарных лимфоузлов была выполнена ультрасонография эхоэндоскопом с радиальным УЗ-датчиком (частота 5-10 МГц). По результатам исследования в области кардиоэзофагеального перехода по передней полуокружности определялось гипоэхогенное образование до 15 х 20 мм, исходящее из слизистого слоя стенки, подслизистый слой прослеживался фрагментарно, мышечный слой был сохранен, интактен, наружный контур стенки пищевода и желудка ровный, четкий (рис. 5). Увеличенные и патологически измененные лимфатические узлы не определялись.
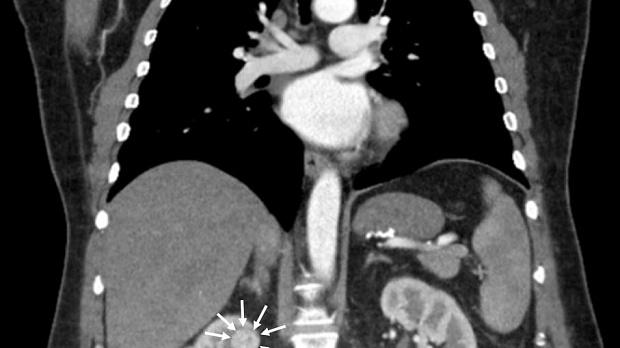
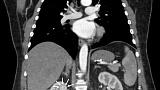
По данным компьютерной томографии органов грудной клетки и брюшной полости с контрастным усилением: состояние после гастрошунтирующей операции, умеренно выраженная внутрибрюшная и забрюшинная лимфаденопатия (лимфоузлы до 10 мм), в верхнем полюсе правой почки опухоль до двух сантиметров в диаметре (рис. 6).
На основании жалоб, анамнеза, данных осмотра и обследований был сформулирован предварительный диагноз: "Первично-множественное синхронное злокачественное заболевание: 1) рак кардиального отдела желудка, стадия I, сT1N0M0, Siewert II. Гастрошунтирующая операция по поводу морбидного ожирения от 10.06.2019г. (центр бариатрической хирургии); 2) рак правой почки, стадия I, сT1аN0M0".
Общебольничный онко-консилиум принял решение на первом этапе удалить опухоль кардии методом резекции слизистой оболочки с диссекцией подслизистого слоя. Вторым этапом, с целью исключения мультицентричного опухолевого поражения, осмотреть «отключенный» желудок. По результатам проведенных вмешательств определить дальнейшую тактику. В случае радикально выполненной диссекции в кардии и отсутствии синхронных опухолей в «отключенном» желудке, третьим этапом выполнить удаление опухоли правой почки.
Эндоскопическая операция была выполнена 26.09.2019г. в условиях эндотрахеального наркоза с использованием помпы для подачи воды в дополнительный канал эндоскопа GIF-H-180J (Олимпас, Япония) и инсуффляцией углекислого газа. Точечная маркировка слизистой оболочки (отступя от видимых краев опухоли 4-5 мм), циркулярный разрез слизистой оболочки вокруг опухоли (отступя от эндоскопических меток 3-4 мм) и диссекция подслизистого слоя выполнялись эндоскопическим ножом Triangle Knife (Олимпас, Япония). При создании тоннеля под опухолью в подслизистый слой вводился раствор гиалуроновой кислоты с индигокармином (рис. 7 a, b). В связи с хирургически измененной анатомией и ограниченным «малым желудочком» пространством во время операции возникали сложности в позиционировании и с навигацией. Это не изменило план операции; опухоль была удалена единым блоком. Гемостаз видимых сосудов в ложе удаленной опухоли был осуществлён коагуляционным зажимом «Coagrasper» (Олимпас, Япония). По окончании операции признаков перфорации, кровотечения не выявлено. Продолжительность операции составила 190 минут. Операционный препарат (40 х 50 мм) был извлечен, фиксирован на планшете и погружен в забуференный формалин (рис. 8).
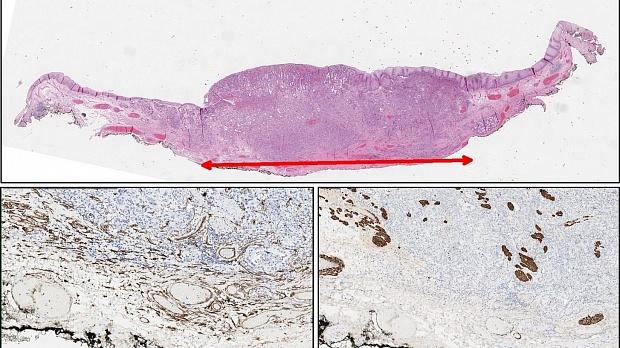
Морфологическое и иммуногистохимическое заключение: тубулярная аденокарцинома пищеводно‑желудочного перехода, grade I. Опухоль прорастает в верхнюю треть подслизистого слоя (sm1), pT1b. Васкулярной инвазии не выявлено (Ly «-», V «-»), в краях препарата признаков опухолевого роста не выявлено (LM «-», VM «-»), R0 (рис. 9).
Послеоперационный период протекал без осложнений, пациент получал ингибиторы протонной помпы в дозировке 40 мг 2 раза в день внутривенно на протяжении 3 дней, далее по стандартной схеме. При контрольном эндоскопическом осмотре через 3 и 6 месяцев после диссекции в области кардии определялся гладкий белесоватый рубец, без признаков резидуальной/рецидивной опухоли (рис. 10 a, b).
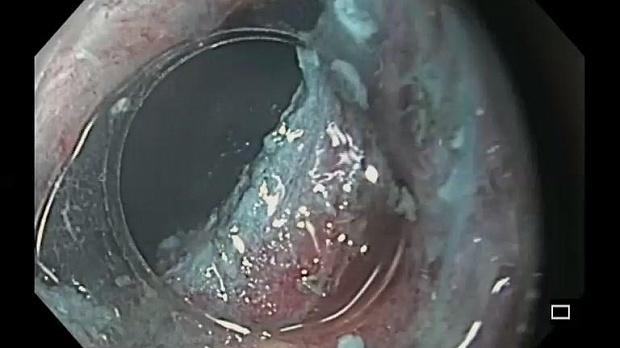
Вторым этапом пациенту был выполнен осмотр «отключенного» желудка. Исследование проводилось в условиях эндотрахеального наркоза. Использовался однобаллонный энтероскоп SIF Q180 (Олимпас, Япония), с помощью которого были осмотрены все 200 сантиметров приводящей петли тощей кишки и осуществлен последовательный ретроградный осмотр двенадцатиперстной кишки и «отключенной» части желудка (рис. 11). Общее время исследования составило 60 минут. Осмотр слизистой оболочки проводился в белом свете и режиме NBI, после продолжительного тщательного отмывания большого количества вязкого слизистого секрета раствором ацетилцистеина. Опухолевых поражений культи желудка выявлено не было. В ретропилорической части луковицы двенадцатиперстной кишки определялись инвагинированные в просвет кишки утолщенные желудочные складки, многочисленные участки утолщенной слизистой оболочки округлой и овальной формы из которых была взята биопсия. По результатам гистологического исследования – морфологическая картина хронического умеренно выраженного дуоденита с очагами гиперплазии эпителия.
Учитывая анамнез, результаты обследования, интраоперационную картину, результаты морфологического и иммуногистохимического исследований, решением общебольничного онко-консилиума дополнительного противоопухолевого лечения по поводу рака желудка пациенту назначено не было.
Третьим этапом, как и было запланировано, 24 апреля 2020г. в МНИОИ им. П.А. Герцена пациенту была выполнена лапароскопическая резекция правой почки. Гистологическое исследование операционного материала: светлоклеточный почечноклеточный рак, G 2, с участками кровоизлияний, очагами инвазии капсулы почки, без распространения в паранефральную клетчатку, в крае резекции почки опухолевого роста нет, pT1aN0. Пациент оставлен под динамический контроль.
Заключение. Публикуя данное клиническое наблюдение, мы хотели бы ещё раз подчеркнуть две важные доктрины нашей специальности: «Диагностировать и лечить не болезнь, а больного» и «В первую очередь руководствоваться в своей деятельности интересами здоровья пациента». В данном случае составляющими этих многократно проверенных положений могли бы стать полноценное и качественное предоперационное обследование, в том числе - скрупулёзный эндоскопический осмотр с грамотной интерпретацией обнаруженных изменений; следование клиническим рекомендациям, которые призывают не выполнять плановую операцию не дождавшись результатов морфологического исследования, даже если это диктуется финансовыми интересами учреждения по выполнению плана высокотехнологичной медицинской помощи. Несомненно, сама по себе мини-гастрошунтирующая операция имела должный эффект в виде снижения веса и лечения сахарного диабета у пациента, но и создала значительные технические трудности для эндоскопического удаления аденокарциномы кардиоэзофагеального перехода через эндоскоп, а также затруднила пожизненный контроль «отключенного» желудка, который отныне будет требовать использования тубус-ассистированной энтероскопии с общим обезболиванием.
По теме:
видеодемонстрация клинического случая с Первенства России по эндоскопии.
Список литературы:
2. Harper JL, Beech D, Tichansky DS et al., «Cancer in the bypassed stomach presenting early after gastric bypass», Obes Surg 2007; 17: 1268–1271.
3. Khitin L, Roses R, Birkett D., «Cancer in the gastric remnant after gastric bypass», Curr Surg 2003; 60: 521–523.
4. R. Kassir, P. Lointier, C. Breton, P. Blanc, «Postoperative finding of gastric neuroendocrine tumor in a patient undergoing a mini gastric bypass: points to consider», Surgery for Obesity and Related Diseases, Sep-Oct 2014; 10(5):1009-11. doi: 10.1016/j.soard.2014.03.008.
5. P. Sakai, R. Kuga, A. V. Safatle-Ribeiro, J. Faintuch, J. J. Gama-Rodrigues, R. K. Ishida, C. K. Furuya Jr, H. Yamamoto, S. Ishioka, «Is it feasible to reach the bypassed stomach after Roux-en-Y gastric bypass for morbid obesity? The use of the double-balloon enteroscope», Endoscopy, 2005 Jun; 37(6):566-9. doi: 10.1055/s-2005-861444.
Рекомендуемые статьи
Синдром Бернара-Горнера
птоз, миоз и энофтальм при повреждении симпатического нерва (С7—Тh11) при осложненных дивертикулах, опухолях пищевода или метастазах в позвоночник.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.















.jpg)





.png)
















Комментарии