- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Эндоскопическое протезирование стенозов пищевода и кардии саморасправляющимися металлическими стентами
| Авторы: | Э.А. Годжелло 1 М.В. Хрусталева 2 Ю.И. Галлингер 3 2016г. |
| Об авторах: |
1. д.м.н., главный научный сотрудник эндоскопического отделения ФГБНУ «Российский научный центр хирургии имени академика Б.В. Петровского» 2. д.м.н., руководитель эндоскопического отделения ФГБНУ «Российский научный центр хирургии имени академика Б.В. Петровского» 3. д.м.н., научный консультант эндоскопического отделения ФГБНУ «Российский научный центр хирургии имени академика Б.В. Петровского» |
Введение:

Полный текст статьи:
1. ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К ЭНДОСКОПИЧЕСКОМУ СТЕНТИРОВАНИЮ
Перед стентированием проводится тщательное обследование пациента для подтверждения распространенности процесса и нецелесообразности хирургического лечения. Среди наиболее часто применяемых специальных методов обследования - рентгенография с бариевой взвесью или водорастворимым контрастным веществом, эндоскопическое исследование с биопсией, ультразвуковое исследование брюшной полости, компьютерная томография или магнитно-резонансная томография, а в ряде случаев и позитронноэмиссионная томография, эндосонография.
1.1. Злокачественные поражения
Основную группу больных, которым показано применение эндоскопических вмешательств, составляют пациенты со злокачественным стенозом пищевода, у которых хирургическое лечение не предпринимается в связи с распространенностью процесса или высоким операционно-анестезиологическим риском из-за преклонного возраста и тяжелых сопутствующих заболеваний. Причинами злокачественной обструкции являются следующие состояния: рак пищевода, кардиоэзофагеальный рак, рак желудка с переходом на пищевод, сдавление пищевода извне. Еще одной причиной нарушения нормального пассажа пищи являются злокачественные пищеводно-респираторные свищи.
Рак пищевода. Введение эндопротеза можно считать показанным во всех случаях циркулярного бластоматозного стеноза пищевода. При нерезко выраженном сужении, когда исследование может быть выполнено гастроинтестинальным эндоскопом среднего диаметра, нециркулярном опухолевом росте, слишком мягкой консистенции бластоматозного поражения, обширном некрозе опухоли, легком расширении просвета пищевода до диаметра 13-15 мм с помощью бужей или баллонных дилататоров выполнение эндопротезирования может быть нецелесообразным, поскольку в этих случаях высока вероятность смещения стента.
Особое место занимают опухоли, локализующиеся в непосредственной близости от верхнего пищеводного сфинктера (менее 2 см от глоточно-пищеводного перехода), и опухоли нижней трети пищевода с переходом на кардию или желудок без ограничения по протяженности вовлечения в процесс желудка. Опухоли шейного отдела пищевода, составляющие 7-10% от всех раков пищевода, традиционно являются очень сложной областью для вмешательств, будь то хирургическая операция, рентгенотерапия, лазерное воздействие или фотодинамическая терапия. Долгое время опухоли этой локализации являлись относительным противопоказанием для стентирования из-за повышенного риска перфорации в связи с изгибом шейного отдела позвоночника, аспирации слюны, слизи и пищевых масс в дыхательные пути во время вмешательства, сдавления дыхательных путей стентом, миграции протеза в гипофарингс и, вероятно, наиболее важным противопоказанием являлась непереносимость инородного тела, особенно если опухоли располагались ближе чем на 2 см к верхнему пищеводному сфинктеру. После внедрения в клиническую практику специально разработанных стентов с укороченной до 7-10 мм верхней манжеткой (Shim C.S. et al., 2001) проблема возможности эндопротезирования при опухолях верхней трети пищевода, казалось, была во многом решена [61]. Однако частая миграция так называемых шейных или асимметричных стентов из-за того, что нижележащий большой массив опухоли «стягивает» протез вниз, заставляет искать другие технические варианты стентирования. Поскольку при высоком расположении верхней границы стеноза мы считаем показанным введение стента под двойным - визуальным и рентгенологическим - контролем, то установка верхней воронки протеза по верхней границе поражения или на 0,5-1 см выше нее позволяет в таких ситуациях использовать и стандартные стенты с длиной воронки 2 см, которые лучше фиксируются в этой зоне. Безусловно, в этих случаях приходится пренебрегать опасностью обрастания верхней воронки стента за счет продолженного роста опухоли в краниальном направлении.
При стентировании нерезектабельных опухолей дистального отдела пище- вода и кардии возникает ряд проблем. По сравнению с установкой стентов в вышележащие отделы пищевода эта процедура обеспечивает меньший паллиативный эффект и сопровождается большей частотой осложнений. Это связано с тем, что опухоли в этой зоне часто имеют извитой ход с образованием острого угла, поэтому необходимо, чтобы стент был более гибким. Кроме того, при стентировании этой зоны возникает значимый гастроэзофагеальный рефлюкс, который может свести на нет все преимущества восстановленного просвета и существенно ухудшить качество жизни пациента. Для решения этой проблемы были созданы стенты с антирефлюксными клапанами. Следует отметить, что фирма Boston Sci- entific принципиально не использует антирефлюксные клапаны, полагая, что возникающую изжогу можно легко купировать приемом антисекреторных препаратов, в, частности, ингибиторов протонной помпы. Следует отметить, что по нашему опыту это не совсем так.
Кардиоэзофагеальный рак. Точного определения этого термина нет. А.Ф. Черноусов и соавт. в монографии «Хирургия рака желудка» (2004) предлагают считать, что кардия - это цилиндрический сегмент пищеварительной трубки, границы которого расположены на 2 см выше и на 2 см ниже «идеальной» зубчатой линии, совпадающей с пищеводно-желудочным переходом, а субкардия - область стенки желудка по малой кривизне, начинающаяся от нижней возможной границы кардии, т.е. на 2 см ниже зубчатой линии, и занимающая по протяженности около 3 см, т.е. не выходящая за пределы 5 см ниже linea serrata [27]. Таким образом, можно, по-видимому, считать, что кардиоэзофагеальный рак - это опухоль, распространение которой на пищевод не превышает по протяженности 2 см, а на желудок - 5 см. Все проблемы, возникающие при стентировании опухолей нижней трети пищевода с переходом на кардию, справедливы и для кардиоэзофагеального рака.
Рак желудка с переходом на пищевод. При этой локализации опухоли во- влечение в процесс как желудка, так и пищевода может быть довольно значимым по протяженности. О таком типе поражения следует говорить, прежде всего, в том случае, когда опухоль помимо кардии и субкардии распространяется и на другие отделы желудка.
Сдавление пищевода извне. Это состояние возникает за счет злокачественного поражения соседних органов (легкие, средостение, метастазы в лимфоузлы средостения). Кроме того, после оперативного лечения рака пищевода, в том числе с вовлечением желудка дисфагия может быть вызвана не только рецидивом опухоли в области анастомоза, но и сдавлением зоны соустья, выше- и ниже- лежащих отделов пищеварительного тракта. Ригидность сужения за счет плотного опухолевого конгломерата, находящегося снаружи, нециркулярность поражения, гладкие стенки в зоне стеноза из-за отсутствия экзофитного компонента, в ряде случаев - мультицентрическое поражение органа, чередующееся с непораженными участками, - все это обуславливает определенные технические сложности на этапе стентирования и непредсказуемость конечного результата. Кроме того, ожидаемая очень короткая продолжительность жизни больного при достаточно высокой стоимости саморасправляющихся эндопротезов также является причи- ной размышлений о целесообразности стентирования у данной категории инкурабельных больных. Следует отметить, что этой проблеме не уделено должного внимания ни в России, ни за рубежом. Первым значимым исследованием на эту тему стала работа N.C.M. van Heel и соавт. (2010), в которой проанализированы результаты стентирования, выполненного в одном медицинском центре у 50 пациентов со сдавлением пищевода извне за период с 1995 по 2009 гг. [46]. Согласно нашим собственным данным, несмотря на небольшую продолжительность жизни пациентов (в среднем около 3 месяцев), эндопротезирование саморасправляющимися стентами при злокачественной компрессии пищевода и пищеводных анастомозов извне позволяет кардинально улучшить качество жизни больных, наиболее быстро, щадяще и эффективно восстанавливая пероральное питание. Частота осложнений невелика, возникшие осложнения могут быть купированы эндоскопическими методами [12].
Злокачественные пищеводно-респираторные свищи. Фистулы между пищеварительной трубкой и дыхательными путями встречаются примерно у 5-15% больных раком пищевода, раком легкого или опухолями средостения. Любые внутрипросветные вмешательства, направленные на уменьшение дисфагии, такие как лазерная деструкция опухоли, локальная гипертермия, брахитерапия, фотодинамическая терапия увеличивают риск развития фистулы. Пищеводно-респираторные свищи быстро ухудшают общее состояние пациента, и последствия могут быть весьма драматическими, так как повторные аспирации и связанные с этим заболевания, а также нарушения питания могут привести в итоге к летальному исходу. Поскольку в таких случаях опухоль, как правило, распространенная и ожидаемая продолжительность жизни небольшая, наибольший интерес представляют те лечебные процедуры, которые приведут к быстрому и успешному временному устранению симптомов, уменьшив длительность пребывания больного в стационаре. Целью эндопротезирования покрытыми саморасправляющимися стентами в этом случае является не только восстановление перорального питания, но и разобщение пищевода и дыхательных путей. Непокрытые стенты для этой цели не годятся, так как содержимое пищевода может легко проваливаться в трахею через сетку. У ряда больных раком пищевода и пищеводно-респираторным свищом рекомендовано параллельное стентирование пищевода и трахеи для одномоментного уменьшения дисфагии, диспноэ и кашля [17, 24, 33, 45, 50, 66 и др.].
Вторую группу представляют оперированные пациенты, у которых причинами дисфагии являются:
- рецидив или продолженный рост опухоли в зоне пищеводно-желудочных и пищеводно-тонкокишечных анастомозов после операции Льюиса, резекции проксимального отдела желудка или гастрэктомии, а также на шее после экстирпации пищевода с эзофагопластикой;
- рецидив или продолженный рост опухоли в трансплантате после эзофагопластики.
В подобных ситуациях могут возникать определенные сложности при эндоскопическом стентировании, связанные с «косым» расположением соустья как при кардиоэзофагеальном бластоматозном поражении, высокой локализацией шейных анастомозов и необходимостью установить эндопротез таким образом, чтобы его дистальный конец не упирался в стенку поданастомозного отдела.
1.2. Доброкачественные поражения
Доброкачественные поражения пищевода как показание к стентированию являются на сегодняшний день одним из самых дискутабельных вопросов. Это связано с несколькими причинами:
- эта категория больных может быть радикально оперирована, поскольку имеет несравненно лучший прогноз, касающийся продолжительности и качества жизни, по сравнению с онкологическими больными;
- в отличие от пациентов со злокачественными поражениями, для которых эндопротезирование, как правило, является последним этапом лечения, и стент им устанавливается пожизненно, для больных с доброкачественными заболеваниями стентирование однозначно должно являться временной процедурой. В соответствии с этим стенты должны быть удалимы, а польза от временного эндопротезирования должна быть большей, чем риск возникновения осложнений или развития негативных последствий стентирования, что может повлечь за собой нежелательное (незапланированное) хирургическое вмешательство, объем которого может быть достаточно большим, а исход непредсказуемым.
Основными неопухолевыми состояниями (заболеваниями), при которых в настоящее время ограниченно выполняется стентирование, являются недостаточность швов пищеводных анастомозов, ятрогенные повреждения пищевода, рубцовые стриктуры пищевода, спонтанный разрыв пищевода, доброкачественные пищеводно-респираторные свищи, неконтролируемое кровотечение из варикозно расширенных вен пищевода, кардиоспазм и ахалазия кардии. В пределах данного методического пособия мы рассмотрим в качестве показаний к стентированию только доброкачественные рубцовые стенозы, так как именно при них стентирование выполняют чаще всего, при этом несоблюдение протокола приводит к развитию тяжелейших осложнений.
Рубцовые стриктуры пищевода различной этиологии. Доброкачественные стенозы пищевода - очень спорное показание к стентированию по нескольким причинам. Во-первых, многие металлические стенты не могут быть удалены нехирургическим путем и, следовательно, не могут быть рекомендованы для временной установки, что требуется у этой категории больных. Во-вторых, последствия длительного стояния металлических стентов пока детально не изучены. В-третьих, результаты исследований на животных, равно как и опыт, полученный от использования металлических стентов при других доброкачественных стриктурах желудочно-кишечного тракта, подтверждают, что гиперплазия слизистой может в конечном итоге окклюзировать просвет стента в ряде случаев. И, наконец, этим больным, общее состояние которых, как правило, существенно лучше, чем у пациентов с распространенным раком пищевода, и ожидаемая продолжительность жизни гораздо больше, может быть выполнено более агрессивное и радикальное хирургическое вмешательство, такое как экстирпация или резекция пищевода. Тем не менее, имеется ряд работ об использовании как саморасправляющихся металлических, так и саморасправляющихся пластмассовых и биодеградирующих стентов у пациентов с доброкачественными стриктурами пищевода с различными, иногда диаметрально противоположными результатами [13, 30, 34, 36, 40, 59 и др.]. Так что этот вопрос более, чем какой-либо другой, является дискутабельным.
Хотелось бы еще раз подчеркнуть, что кардиоспазм и ахалазия кардии представляют собой функциональную, а не органическую непроходимость пищеводно-желудочного перехода за счет повышения давления в области нижнего пищеводного сфинктера и несогласованности его открытия в ответ на глоток, в основе которой лежат нейромышечные нарушения. Отсутствие фактического сужения в кардии, если речь не идет о развившейся в результате множественных и грубых дилатаций рубцовой стриктуре, имеющийся при III-IV стадиях болезни S-образный изгиб в нижней трети пищевода и пищеводно-желудочного перехода ставят, на наш взгляд, под сомнение полезность этого вмешательства у данной категории больных.
1.3. Противопоказания к стентированию пищевода и кардии
Противопоказанием к применению эндоскопических методов восстановления проходимости пищевода может являться общее тяжелое состояние пациентов, не позволяющее выполнить эндоскопическое исследование и вмешательство, тяжелая коагулопатия, а также ожидаемая очень короткая продолжительность жизни больного.
Относительным противопоказанием являются злокачественные или доброкачественные стенозы в верхней части пищевода вблизи перстневидно-глоточной мышцы (в пределах 2 см). Возможность выполнения вмешательства и его результат в большой степени определяются опытом врача.
Относительным противопоказанием является невозможность расширения стриктуры пищевода до минимального диаметра 8-10 мм (до диаметра доставочного устройства большинства стентов) - в этих случаях необходимо подбирать стент меньшего диаметра или с меньшим диаметром интродьюсера (Boston Scientific - 16 Fr, т.е. 5,3 мм) либо использовать стенты, изначально не предназначенные для пищевода (трахеальные, билиарные).
При вовлечении в онкологический процесс трахеи и бронхов введение стента в пищевод должно выполняться с осторожностью и готовностью к немедленному извлечению протеза или экстренному одновременному стентированию трахеи, так как вмешательство может вызвать острое, полное блокирование доступа воздуха в дыхательные пути. Если помощь в таком объеме в лечебном учреждении не может быть оказана, такие состояния следует считать противопоказанием для стентирования пищевода.
Следует с осторожностью использовать модели стентов с антирефлюксным клапаном, выходящим за пределы дистального конца протеза (ELLA-CS, например), у пациентов, перенесших резекцию желудка. Это связано с тем, что дистальный конец стента даже при частичной миграции может упереться в стенку желудка и в результате перекрыть клапан.
2. АППАРАТУРА, ИНСТРУМЕНТЫ И РАСХОДНЫЕ МАТЕРИАЛЫ
В арсенале отделения, в котором выполняется стентирование саморасправляющимися металлическими стентами при злокачественных стенозах пищевода и кардии или планируется внедрение этой методики, должны быть различные модели гастроинтестинальных эндоскопов среднего (8,2-9,8 мм) диаметра любого производителя («Olympus», «Fujifilm», «Pentax»). Иногда может потребоваться эндоскоп с широким инструментальным каналом, если по каким-либо причинам потребуется стентирование пилородуоденальными или колоректальными стентами. Примеры таких ситуаций мы приведем ниже. Но мы считаем принципиальным использование у этой категории пациентов малокалиберных гастроскопов диаметром от 4,8 мм до 5,6 мм, позиционируемых как трансназальные, но основным предназначением которых, по нашему глубокому убеждению, является исследование у больных со стенозами различной этиологии и у детей. В наших наблюдениях такие типы эндоскопов понадобились более чем в половине случаев. При отсутствии малокалиберного гастроскопа исследование может быть выполнено бронхоскопом или уретерореноскопом, в которых подача воздуха осуществляется с помощью груши, присоединенной к инструментальному каналу.
В подавляющем большинстве случаев первым этапом стентирования является расширение просвета опухолевого стеноза путем бужирования. Для безопасного проведения бужей необходимы направляющие струны, имеющие атравматический дистальный кончик. Эти же струны используются и непосредственно на этапе стентирования:
- жесткие - монофиламентные стальные струны с мягким пружинным наконечником на дистальном конце для предотвращения травмы стенки или слизистой оболочки типа Savary-Gilliard (COOK) длиной 200 или 250 см;
- мягкие (билиарные) - типа ST Wire Guides, Metro, Fusion и прочие, диаметром 0,035ʺ, длиной 180-260 см (рис. 1 а, б).
Бужирование удобнее осуществлять именно по жесткой струне, которая дает большую опору для бужа, особенно при ригидных, плотных сужениях, в частности, инфильтративных стенозах и в ряде случаев при сдавлении извне. Она не позволяет бужу отклониться в сторону от сохранившегося просвета в зоне сужения. Для выполнения бужирования необходимы следующие инструменты:
- полая трубка-буж диаметром 3-3,5 мм, длиной 70-80 см, с зауженным дистальным концом для замены мягкой струны на жесткую. Главное требование к внутреннему диаметру - возможность свободного проведения пружинки жесткой струны. Для этой цели можно использовать самый большой билиарный буж Soe- hendra диаметром 11,5 Fr, предварительно обрезав узкий дистальный кончик выше рентгеноконтрастной метки;
- билиарные бужи Soehendra (COOK) диаметром 6, 7, 8,5, 10, 11,5 Fr (от 2 до 4 мм) с каналом для направляющей струны (рис. 2 а);
- эластичные бужи Savary-Gilliard (COOK) диаметром 15-60 Fr (от 5 до 20 мм) с каналом для направляющей струны (рис. 2 б).
Для маркировки границ опухолевого поражения используются клипатор и клипсы любого производителя, а для введения контрастного вещества в подслизистый слой - стандартная игла для инъекционного гемостаза.
Пищеводные стенты
Имеется очень большое число разновидностей металлических стентов, отличающихся друг от друга по материалу изготовления (стальные, нитиноловые), конструкции, жесткости, гибкости, радиальной расправляющей силе, степени укорочения при расправлении, рентгеноконтрастным меткам и типу интродьюсера (доставочного устройства, или устройства для введения стента), а также ценовому диапазону. Стенты могут быть непокрытыми или покрытыми полиуретаном или силиконом. В настоящее время на российском рынке имеется множество металлических саморасправляющихся стентов, однако чаще всего используются модели следующих производителей - M.I. Tech (Ю. Корея). ELLA-CS (Чехия), COOK (США), Boston Scientific (США). Ниже мы приведем краткую характеристику или особенности некоторых из них.
M.I. Tech (Ю. Корея)
Нитиноловый Choostent (модель NES) - основная базовая модель современных корейских пищеводных стентов. Имеет форму гантели за счет расширений на обоих концах. Диаметр рабочей части - 18 мм, диаметр воронки - 24 мм. Состоит из сегментов длиной 20 мм, между которыми имеются трехмиллиметровые промежутки для обеспечения гибкости по длине. Каждый сегмент сетчатого каркаса присоединен к силиконовой мембране шестью нитиноловыми струнами. За счет нескольких соединенных между собой сетчатых фрагментов создается протез необходимой длины (от 80 до 170 мм). На обоих концах стента имеется нить с несколькими узелками, прикрепленная к краю воронки (лассо), для извлечения или перемещения стента в просвете пищевода при неадекватной установке. Для этого надо биопсийными щипцами захватить не саму нить, а узлы на петле. Дополни- тельная рентгеноконтрастность обеспечивается 12 золотыми метками. Стент покрыт полиуретаном за исключением верхней воронки, которая покрыта лишь частично для лучшей фиксации в слизистой пищевода (рис. 3).
За счет частичного покрытия верхней воронки стент может быть использован в сложных случаях - предпочтительно в тех ситуациях, когда вероятность миграции высока: при коротких стриктурах (менее 5 см длиной), при мягких рыхлых опухолях, нерезко выраженных стенозах, не требующих дополнительной дилатации перед установкой, трахеопищеводных свищах. Стенты с прерывистой металлической конструкцией, сохраняя высокую радиальную упругость, обладают наилучшей гибкостью и могут повторять сложные изгибы опухолевых стриктур пищевода и зон послеоперационных анастомозов. Подобный дизайн уменьшает ощущение инородного тела в пищеводе. Однако прочность соединительных секций меньше, чем сетчатых, поэтому в этих местах стент может сломаться и фрагментироваться на отдельные сегменты, если растяжение или давление на стент будет превышено.
Помимо стандартной модели имеется еще несколько подтипов. Шейные (NESC) и асимметричные (NESA) Choostent с укороченной до 7 или 10 мм верхней манжеткой и стандартной нижней воронкой (20 мм длиной) полностью по- крыты полиуретаном и предназначены для протезирования опухолей верхней трети пищевода в непосредственной близости от верхнего пищеводного сфинктера (рис. 4).
Модель Choostent диаметром 22 мм и воронками диаметром 28 мм является частично покрытой за счет непокрытого полиуретаном участка длиной 1 см в области верхней воронки для лучшей фиксации в слизистой пищевода. Дополнительно для предупреждения ранней миграции к верхнему краю стента прикреплена шелковая нить (рис. 5), которая с помощью специального крючка выводится через носовой ход и фиксируется вокруг ушной раковины пациента (технология предложена C.S. Shim et al., 2001) [61]. Эти стенты имеют диаметр 22 мм, диаметр воронки - 28 мм, длина их составляет 90, 120 и 160 мм.
Нами также широко используются протезы модификации Hanarostent. В начале нашей работы они были аналогичны по конструкции Choostent, имели диаметр 18 и 22 мм в области тела и 25-28 мм по краям воронок, но были полностью покрыты, снабжены двумя лассо для коррекции положения стента или его извлечения и дополнены антирефлюксным клапаном (модель HEV) - длинным (70 мм) лепестком, свернутым в форме буквы S и прикрепленным изнутри к стенкам протеза (рис. 6), что позволяло применять эти разновидности стентов при опухолях нижней трети пищевода и кардиоэзофагеальной зоны.
Однако в связи с появившимися в литературе сообщениями о таком позднем осложнении стентирования как фрагментация сегментарных протезов (и наш собственный опыт это подтвердил) конструкция их была пересмотрена. В настоящее время фирма M.I. Tech выпускает модифицированные цельноплетеные пищеводные Hanarostent как с антирефлюксным клапаном (модель HESV) (рис. 7), так и без него (вариант HES). По остальным параметрам они полностью аналогичны модели HEV.
Цельноплетеные Hanarostent, как и Choostent, выпускаются также в вариантах шейной и асимметричной моделей, а также с антимиграционной технологией Shim’а.
ELLA-CS (Чехия)
Стент Boubella изготовлен из нержавеющей стальной проволоки, покрыт двойным слоем полиуретана (снаружи и изнутри), что обеспечивает защиту от прорастания опухоли и позволяет использовать стент при пищеводно-респираторных фистулах. Проксимальные 5 см стента состоят из двух антимиграционных сегментов, верхний из которых представляет собой традиционную воронку с максимальным диаметром 30 мм, нижний имеет форму неправильного ромба (рис. 8).
Дистальная часть стента состоит из различного числа сегментов и не имеет расширения. На обоих концах имеется лассо, а для лучшей визуализации - три рентгеноконтрастные метки. Стенты выпускаются в двух вариантах - с антирефлюксным клапаном и без него. Антирефлюксный клапан - это мягкий полиэтиленовый рукав длиной 4 см, который начинается от дистального края стента. Имеются стенты максимальной длины - 180 и 195 мм, что в ряде случаев требуется при протяженных поражениях, когда нет возможности по тем или иным причинам установить два стента, перекрывающих друг друга по длине.
Стент Boubella-E - экономическая серия - отличается антимиграционным механизмом, представленным одной расширяющейся кверху воронкой длиной 25 мм, поверхность которой является частично непокрытой (рис. 9 а, б). Как и в предыдущем варианте, имеется модель с антирефлюксным клапаном.
Стент REF HV- это полностью покрытый нитиноловый стент особого плетения, обеспечивающего атравматичность его концов. Стент цельный, что предотвращает фрагментацию. Материал, из которого изготовлен стент, устойчив к так называемой «усталости» металла. Помимо отличной гибкости используемые материалы обеспечивают достаточную расширяющую способность стента. Оболочка изготовлена из полиэфирного волокна. На проксимальном конце протеза имеется антимиграционный «воротник», который разворачивается при начавшемся смещении и приобретает форму расширяющейся кверху воронки (рис. 10 а, б).
Имеется модель с антирефлюксным клапаном, чтобы предотвратить выброс желудочного сока в пищевод.
COOK (США)
Саморасправляющийся нитиноловый стент Evolution - диаметр 18-20 мм, максимальная длина - 120 мм, антирефлюксного клапана нет. Наиболее интересная особенность данного стента - это процесс стягивания оболочки и раскрытия стента, а также возможность при необходимости вновь собрать стент и убрать его обратно в футляр, для чего фирма COOK предложила оригинальную конструкцию рукоятки в форме пистолета с курком. Каждое нажатие на курок равномерно стягивает оболочку, постепенно освобождая стент с дистального конца (рис. 11).
Если в процессе установки стента становится понятно, что стент позиционируется неточно и требуется коррекция его положения, то до прохождения так называемой «пороговой» отметки на рукоятке можно вновь его закрыть. «Пороговая» точка соответствует раскрытию стента примерно наполовину. Для обратной сборки стента в футляр нужно нажать на кнопку, расположенную на рукоятке, и выдавить ее на противоположную сторону. После этого, продолжая нажимать на триггер, можно вновь надеть уже частично снятую оболочку на стент (рис. 12).
Boston Scientific (США)
Сверхгибкий нитиноловый протез Ultraflex (Microvasive, Boston Scientific, Ireland Ltd, Galway, Ireland) представляет собой сетчатую трубку из монофиламентной струны диаметром 0,15 мм, имеют проксимальный конец в форме тюльпана. Выпускаются в двух вариантах - полностью непокрытые и с полиуретановым покрытием в средней части и без него на протяжении 1,5 см на обоих концах. Имеют два размера: проксимальная воронка диаметром 28 мм и 23 мм, при этом диаметр дистального конца составляет 23 мм и 18 мм соответственно. Нижней воронки и антирефлюксного клапана нет. Как мы указывали выше, это принципиальная позиция фирмы Boston Scientific. Диаметр доставочного устройства составляет всего 16 Fr (5,3 мм) в отличие от стентов фирм M.I. Tech (8 и 10 мм в зависимости от наличия антирефлюксного клапана), ELLA-CS (10 мм) и COOK (8 мм). Общий вид стента в собранном состоянии приведен на рис. 13.
Радиальная сила стентов Ultraflex меньше по сравнению с другими основными типами протезов. Раскрытие стента осуществляется за счет постепенного раскручивания витков удерживающей стент в сложенном состоянии нити путем подтягивания за кольцо на рукоятке.
Все вышеперечисленные модели стентов раскрываются с дистального конца, но существуют модели стентов Ultraflex с проксимальным раскрытием, что оказывается очень удобным, если точное положение верхней границы протеза оказывается важнее, чем нижней, например, при стентировании опухолевых стенозов вблизи верхнего пищеводного сфинктера.
3. ЭТАП ПОДГОТОВКИ К СТЕНТИРОВАНИЮ
Всем больным перед стентированием необходимо выполнить диагностическое эндоскопическое исследование верхних отделов желудочно-кишечного тракта. С этой целью используются стандартные и малокалиберные гастроинтестинальные эндоскопы диаметром 5,3-5,6 мм или бронхоскоп, а при необходимости - уретерореноскоп диаметром 3,7 мм для того, чтобы: а) определить причину, степень, протяженность бластоматозного стеноза, а при необходимости морфологи- ческой верификации выполнить биопсию; б) оценить состояние нижележащих отделов желудочно-кишечного тракта для выявления прямых или косвенных при- знаков другого препятствия, особенно если речь идет о ранее оперированных больных; в) при необходимости промаркировать нижнюю границу стеноза; г) надежно установить направляющую струну.
При невозможности провести ни один из эндоскопов в нижележащие отделы считаем необходимым вначале провести через сужение по каналу эндоскопа мягкую билиарную струну-проводник либо по мануальным ощущениям, либо при необходимости (особенно на этапах освоения методики) - под рентгенологическим контролем. Затем по установленной струне нужно выполнить расширение опухолевого стеноза бужами Soehendra диаметром от 2 до 4 мм (6-11,5 Fr), после которых можно использовать эластичные рентгеноконтрастные бужи Savary-Gilliard (COOK, США). Для комфортного выполнения диагностического исследования достаточно провести через сужение бужи №№21-24 (7-8 мм), после чего возможен полноценный эндоскопический осмотр эндоскопом малого диаметра и подбор стента.
Если расширение злокачественного стеноза пищевода или анастомозов выполняется непосредственно перед введением стента, то вмешательство целесообразно завершать бужами Savary-Gilliard №№27-30 (9-10 мм) для предупреждения перфорации, уменьшения риска последующей миграции стента, облегчения как процесса установки, так и ускорения раскрытия стента. В принципе, необходимость и степень предшествующей дилатации опухолевого стеноза определяется силой расширения стента. Дилатация стеноза самим доставочным устройством возможна, но довольно груба.
У тех пациентов, у которых просвет в зоне бластоматозного поражения составляет 8-10 мм, предварительную дилатацию выполнять не следует. Решение вопроса о своевременности стентирования в такой ситуации следует принимать индивидуально в каждом конкретном случае.
4. ПРИНЦИПЫ ПОДБОРА СТЕНТОВ
При выборе стента у больных с бластоматозными стенозами пищевода, кардии и пищеводных анастомозов следует учитывать технические параметры эндопротеза и характеристику сужения. К первой группе факторов относятся:
1) материал, из которого изготовлен стент (стальной или нитиноловый); 2) особенности конструкции (наличие или отсутствие покрытия и антирефлюксного клапана, эффективность антимиграционных механизмов, сегментарная или цельноплетеная структура); 3) диаметр и длина стента. Во второй группе имеют значение: 1) этиология стеноза (первичная опухоль, рецидив, сдавление извне или комбинация причин); 2) локализация поражения; 3) протяженность участка, подлежащего стентированию; 4) выраженность стеноза; 5) характер сужения (инфильтративный или экзофитный рост, циркулярное или нециркулярное поражение, наличие полостей распада, свищей и т.д.) и его ригидность (плотность).
1. Определяющим фактором при выборе материала, из которого изготовлен стент, является плотность стеноза. При бластоматозных сужениях различной плотности сила расширения протеза является критерием выбора типа стента. Следует отметить, что стальные стенты по сравнению с нитиноловыми более жесткие. В большинстве случаев за счет особенностей конструкции, обеспечивающей большую радиальную силу, они практически полностью расправляются уже в процессе установки или в ближайшие несколько часов. Стенты из никель-титанового сплава (нитинола) возвращаются к исходной форме под воздействием температуры. Они более мягкие и гибкие по сравнению со стальными, а за счет меньшей расправляющей силы оказывают меньшее давление на стенку органа. Основными показаниями для имплантации стальных эндопротезов могут быть протяженные плотные стенозы или, напротив, нециркулярные поражения, при которых частота миграции выше, а также пищеводно-респираторные свищи, поскольку эти стенты имеют двойное полиуретановое покрытие - изнутри и снаружи. Мы использовали стальные протезы на начальных этапах работы, не отметив при этом существенных различий в выраженности болевого синдрома и частоте осложнений по сравнению с нитиноловыми стентами. Однако в связи с появлением на рынке современных моделей нитиноловых протезов - цельноплетеных и с дополнительными антимиграционными механизмами, мы с 2010 г. используем только нитиноловые.
2. Выбор типа стента (покрытые, частично покрытые, непокрытые) определяют этиология и характер стеноза - циркулярное или нециркулярное поражение; экзофитный, инфильтративный или смешанный характер роста. Согласно многочисленным публикациям, при использовании непокрытых стентов часто отмечается прорастание опухолевых масс в просвет стента и рецидив дисфагии, а наиболее частым осложнением стентирования с помощью покрытых эндопротезов является миграция. Поскольку в большинстве наблюдений первичные или рецидивные опухоли пищевода и анастомозов характеризуются экзофитной или смешанной формой роста, то вероятность прорастания опухолевых тканей в просвет стента значительно выше, чем возможность смещения. Кроме того, у ряда пациентов имеются пищеводно-респираторные свищи или есть обоснованное подозрение на наличие фистулы. В этих случаях следует устанавливать стенты, полностью покрытые различными синтетическими материалами.
Непокрытые или частично покрытые стенты следует использовать у пациентов, у которых вероятность миграции заведомо выше, чем риск прорастания опухоли в просвет эндопротеза - нерезко выраженный стеноз (8-10 мм), небольшая протяженность сужения (менее 5 см), нециркулярное поражение, мягкая консистенция опухоли. Непокрытые стенты целесообразно использовать также при необходимости адекватного дренирования некротических полостей, особенно при их сообщении со средостением для предотвращения задержки содержимого в полости распада при закупорке ее полностью покрытым протезом, если он плотно прилежит к стенкам пищевода. Это может усилить интоксикацию за счет всасывания продуктов распада опухоли, привести к абсцедированию, медиастиниту и быстрому летальному исходу. При отсутствии в арсенале непокрытых или частично покрытых пищеводных стентов можно использовать непокрытые пилородуоденальные и колоректальные стенты.
Отдельную проблему представляют пациенты с компрессией пищевода извне. Во-первых, сдавливающие пищевод опухолевые массы обычно достаточно плотные, что не позволяет адекватно расширить просвет пищевода в зоне сужения. Как правило, после извлечения бужа восстанавливается практически исходное состояние просвета. Это может затруднить использование стандартных пищеводных стентов диаметром 18-20 мм и вынудить прибегнуть к введению трахеальных или билиарных протезов, имеющих меньший диаметр, либо следует быть готовым к тому, что эзофагеальный стент неполностью раскроется в зоне сужения. Во-вторых, в опухолевый процесс, как правило, вовлечены нервные стволы, что вызывает выраженный болевой синдром при стентировании и непреходящее ощущение инородного тела. В-третьих, экстраэзофагеальные опухоли или лимфо- узлы чаще всего охватывают пищевод нециркулярно, за счет чего раскрытие стента может происходить неравномерно - по большей части в здоровую сторону. В-четвертых, высок риск миграции стента, поскольку на слизистой пищевода нет экзофитных разрастаний, за счет которых стент более прочно удерживается на месте. Последнее обстоятельство предрасполагает к установке у этой группы пациентов непокрытых или частично покрытых стентов. Однако при этом отмечается быстрое врастание сетки протеза в стенку пищевода с бурным ростом грануляционной ткани, что приводит к обструкции просвета стента и рецидиву дисфагии. Кроме того, в подобных ситуациях возрастает вероятность развития пролежня при сильном давлении протеза на стенку пищевода с формированием, например, пищеводно-аортального свища со всеми вытекающими фатальными последствиями. Удаление такого стента либо невозможно, либо сопровождается большими техническими трудностями с высоким риском развития осложнений. Поэтому, по нашему мнению, у этих пациентов можно использовать только полностью покрытые стенты, так как миграция является значительно меньшим злом.
Как и при компрессии извне, у пациентов с доброкачественными рубцовыми сужениями пищевода при рефрактерности стеноза к традиционным методам расширения просвета и попытке добиться более устойчивых результатов путем стентирования могут быть использованы только полностью покрытые эндопротезы. Вмешательство может быть предпринято при условии установки стента на короткий срок (не более 4-6 недель) с обязательным эндоскопическим мониторингом каждые 2 недели и немедленным извлечением стента при признаках роста грануляций.
3. Определяющий фактор выбора стента с клапаном на дистальном конце - локализация поражения. Их целесообразно использовать при вовлечении в процесс нижней трети пищевода, кардиоэзофагеального перехода, низких пищеводно-желудочных и пищеводно-тонкокишечных анастомозов. Клапан обеспечивает профилактику рефлюкса содержимого из нижележащих отделов в пищевод.
4. При подборе диаметра стента следует руководствоваться исходной степенью злокачественных стенозов пищевода, кардиоэзофагеальной зоны и пищеводных анастомозов, а также принимать во внимание распространение поражения по окружности пищевода, тип опухолевого роста, рыхлость опухолевых тканей, ригидность стенки в зоне стеноза, выраженность экстраэзофагеального компонента и причину, вызвавшую дисфагию. При плотных и узких стенозах достаточным является диаметр стента 18 мм, тогда как у пациентов с большей вероятностью миграции, причины которой мы обсудили выше, целесообразно использовать стенты диаметром от 20-22 мм до 25 мм, возможно, с технологией Shim'a для лучшей фиксации эндопротеза, хотя это тоже не является панацеей против смещения. Однако необходимо помнить, что частота перфораций при использовании стентов большого диаметра выше, а боли могут быть достаточно интенсивными и длительными. В ряде случаев при очень плотном опухолевом или компрессион- ном стенозе можно использовать трахеобронхиальные или билиарные стенты диаметром 10-14 мм, для того чтобы избежать выраженного болевого синдрома.
5. Правильное определение длины стента является одним из основных факторов не только технического, но и клинического успеха стентирования. Для этого надо учитывать протяженность стеноза, локализацию нижней границы поражения и методику установки эндопротеза, а также тот факт, что все металлические протезы в той или иной степени укорачиваются при расправлении. Большинство стентов расправляются достаточно медленно, достигая заданного диаметра в среднем через 24-72 часа, за счет чего может быть выполнена коррекция положения протеза.
Общепризнано, что стент должен быть длиннее стеноза минимум на 4 см, но в целом ряде случаев лучше, если его длина превышает протяженность участка, подлежащего стентированию, на 6 см. Например, если по расчету нижний край стента оказывается над кардией или в зоне пищеводно-желудочного перехода, целесообразно установить более длинный стент с антирефлюксным клапаном, чтобы его нижняя воронка находилась в желудке. Это позволяет избежать нарушения замыкательного механизма кардии из-за постоянного раздражения нижнего пищеводного сфинктера концом стента, что приводит к изжоге и отрыжке. Эти симптомы могут быть довольно выраженными и не всегда купируются антисекреторными препаратами.
Эндопротез также может быть существенно длиннее, чем непосредственная зона опухолевого поражения, если необходимо перекрыть значимый функциональный изгиб, например, в пищеводно-желудочном переходе или в тонкой кишке у пациентов после гастрэктомии. При недостаточной длине стента может быть выполнено протезирование «стент в стент» с использованием двух протезов, начиная с дистальной части поражения.
При подборе длины стента помимо локализации поражения имеет значение и способ установки протеза (под рентгенологическим, визуальным или двойным контролем, что будет обсуждено ниже). Так, при использовании рентгенологического или двойного контроля, можно использовать стент, длина которого превышает протяженность стеноза на 4 см (по 2 см выше и ниже границ стеноза), поскольку маркеры (анатомические или предустановленные) позволяют установить эндопротез в точно заданных границах. Но и при этих способах имплантации следует принимать во внимание положение нижнего края поражения по отношению к пищеводно-желудочному переходу. При введении стента под визуальным контролем положение его нижнего края определить невозможно. Поэтому в настоящее время для уверенного перекрывания всей зоны стеноза при отсутствии кон- троля положения нижней воронки протеза и для предотвращения гастроэзофагеального рефлюкса при расположении нижней границы поражения в нижней трети пищевода мы предпочитаем использовать протезы, длина которых превосходит протяженность зоны стеноза на 6 см, а иногда и более. С другой стороны, слишком длинный стент может ухудшить перистальтику еще функционирующего отдела пищевода, плохо прилегать к неизмененным стенкам и создавать возможность для попадания пищи между ним и стенкой, а также перегнуться в желудке. Это может быть причиной плохого функционирования стента и возникновения дисфагии и даже привести к поломке протеза - перелому или частичной фрагментации. Поэтому для подбора оптимального эндопротеза следует принимать во внимание все вышеперечисленные факторы.
6. Для стенозов сложной конфигурации были предложены протезы, имеющие сегментарную конструкцию, для того чтобы обеспечить их большую гибкость. Однако места соединения сегментов оказались слабым местом, именно в этих зонах при нагрузке стенты фрагментировались частично или с полным отрывом 1-2 секций. После появления сообщений о таком осложнении стентирования как перелом стентов были разработаны цельноплетеные эндопротезы с теми же характеристиками, что и сегментарные, и сейчас на рынке в основном представлены эти модели, хотя сегментарные также сохранились.
5. ТЕХНИКА СТЕНТИРОВАНИЯ
Существуют три варианта методики имплантации стентов: под рентгенологическим контролем с использованием эндоскопической техники, только под визуальным контролем и под одновременным двойным - эндоскопическим и рентгенологическим - контролем.
Этапы стентирования под рентгенологическим контролем с использованием эндоскопической техники.
1. Маркировка верхней и при необходимости нижней границы поражения с помощью клипс, введения водорастворимого контрастного вещества в подслизистый слой или наружных меток (рис. 14 а-в). В ряде случаев ориентиром для правильного позиционирования стента служат анатомические ориентиры - купол диафрагмы, позвонок, грудино-ключичное сочленение.
2. Установка жесткой направляющей струны в желудок, двенадцатиперстную или тонкую кишку.
3. Введение доставочного устройства со стентом по струне (рис. 15) и выравнивание его под рентгенологическим контролем относительно меток.
4. Постепенное освобождение стента от оболочки с постоянным контролем его положения относительно меток (рис. 16), при необходимости - коррекция.
5. Извлечение струны, оливы и доставочного устройства через просвет частично или полностью расправленного стента (рис. 17). При недостаточно быстром раскрытии эндопротеза из-за ригидности сужения существует реальная опасность задержки оливы в зоне стеноза, при этом использование рентгенологического контроля позволяет оценить просвет в самом узком месте и избежать вклинения оливы.
6. Рентгенологический контроль положения стента (рис. 18 а), а затем эндоскопический осмотр с помощью малокалиберного эндоскопа (рис. 18 б, в) и при неточном позиционировании воронок стента относительно границ поражения - коррекция его положения за лассо.
Этапы стентирования под визуальным контролем положения верхней воронки протеза относительно верхней границы поражения
После освоения методики стентирования под рентгенологическим контролем независимо от характера поражения и его локализации в ФГБНУ «РНЦХ им. акад. Б.В. Петровского» стали применять введение стентов под визуальным контролем, а в анатомически сложных случаях или при технических трудностях, возникающих при имплантации стентов под визуальным контролем верхнего края поражения, использовать двойной контроль. Обе методики начали внедрять с ноября 2008 г. Это позволило нам в подавляющем большинстве случаев отказаться от маркировки границ поражения, сократив количество этапов стентирования, и значимо снизить лучевую нагрузку на пациента и медицинский персонал. В настоящее время основным способом имплантации стентов становится их введение под контролем зрения, этапы которого изложены ниже.
1. Введение направляющей струны в желудок, двенадцатиперстную или тонкую кишку.
2. Нанесение дополнительной метки маркером на наружную поверхность доставочного устройства на границе толкателя и стента для лучшей визуализации верхнего края воронки протеза (рис. 19). Такую же «подсказку» предпочитают использовать некоторые зарубежные коллеги [41, 56].
3. Введение доставочного устройства со стентом по струне на глубину, соответствующую расстоянию от резцов до желаемого положения верхней воронки протеза относительно верхней границы опухоли, ориентируясь на метки в сантиметрах на наружной поверхности катетера. Предварительная маркировка границ опухоли не требуется.
4. Введение малокалиберного эндоскопа в пищевод параллельно доставочному устройству, коррекция положения стента.
5. Постепенное стягивание оболочки доставочного устройства, удерживая в поле зрения верхний край воронки протеза (рис. 20 а-в).
6. Удаление струны и доставочного устройства, визуальный контроль положения верхнего и нижнего краев стента (рис. 21 а, б).
Этапы стентирования под двойным - эндоскопическим и рентгенологическим - контролем
В этих случаях подразумевается комбинация последовательности действий, необходимых при использовании и первого, и второго алгоритмов. Учитывая сложность анатомической ситуации, требующей двойного контроля при введении стента, во всех случаях производится маркировка верхнего края поражения, как правило, путем наложения клипсы.
Следует отметить, что при любом способе стентирования в процессе установки эндопротезы могут быть неточно позиционированы, то есть установлены выше или ниже предполагаемого уровня. По нашему мнению, одной из основных причин смещения стента вниз является большая опухолевая масса, которая «стягивает» неполностью раскрывшуюся в процессе освобождения из доставки и поэтому не прилегающую плотно к стенкам пищевода верхнюю часть эндопротеза. Таким образом, укорочение стента происходит не равномерно с обоих концов к середине, а сверху вниз, к уже раскрывшейся в свободном пространстве нижней воронке. Факт «перетягивания» стента вниз, на наш взгляд, является еще одним аргументом в пользу того, что длина эндопротеза должна быть больше протяженности стенозированного участка не на 4 см, как рекомендовано в литературе, а на 5-6 см.
Чтобы избежать неточного позиционирования, нужно удерживать верхний край стента в доставочном устройстве на 1,5-2 см выше намеченного уровня, при необходимости немного подтягивая всю конструкцию вверх и таким образом препятствуя смещению раскрывающегося протеза вниз или случайному «сталкиванию» его толкателем при стягивании оболочки, удерживающей стент в сложенном состоянии. Точной установке также может помочь использование стентов с проксимальным раскрытием (Boston Scientific, США), когда положение верхнего края эндопротеза сразу четко позиционируется и раскрывающийся стент занимает весь предоставленный ему просвет пищевода и не может быть легко «стянут» вниз. Эндопротезы такого типа особенно удобны при высоких поражениях, когда положение верхнего края стента должно быть рассчитано до миллиметров. Однако, следует помнить, что все стенты производства Boston Scientific имеют непокрытый участок вверху и внизу как минимум на протяжении 1 см, даже те, которые позиционируются как полностью покрытые (fully covered).
Если все же стент оказался установленным неточно, то его можно подтянуть за верхнее лассо вверх после сосборивания верхней воронки (рис.22 а, б) или сместить вниз за нижнее лассо, сосборив нижнюю воронку. Удобнее, когда этот процесс контролируется рентгенологически. При отсутствии лассо изменить положение уже открывшегося эндопротеза непросто, так как при подтягивании за край стент деформируется.
Выбор метода имплантации эндопротеза
Выбор метода имплантации эндопротеза определяется локализацией верхней границы поражения и протяженностью сужения.
1. Стентирование пищевода и анастомозов под рентгенологическим контролем может быть выполнено при любой локализации патологического процесса и наиболее целесообразно в начале освоения методики. Впоследствии это может оказаться полезным при протяженных сужениях, особенно с вовлечением желудка или тонкой кишки.
2. После приобретения опыта эндопротезирования под рентгенологическим контролем имплантация стента под визуальным контролем является методом выбора при поражениях пищевода, кардии, пищеводных анастомозов после резекции проксимального отдела желудка или гастрэктомии либо желудочного трансплантата любой локализации за исключением первых 3 см от входа в пищевод и протяженного бластоматозного поражения желудка. Этот способ применим в тех случаях, когда четкое положение нижнего края стента не является значимым, то есть его длина заведомо достаточна для полного перекрывания зоны опухолевого стеноза, а вероятность подтягивания струны выше нижней границы поражения невелика.
3. Стентирование под двойным контролем необходимо в анатомически сложных ситуациях: при локализации верхней границы стеноза в пределах 3 см от глоточно-пищеводного перехода, когда особенно важным является положение верхнего края воронки стента по отношению ко входу в пищевод, чтобы пациент впоследствии мог нормально глотать, не испытывая чувства инородного тела в глотке, и не страдать от связанных с этим повышенной саливации, рефлекторного кашля, вынужденного положения головы и пр. Кроме того, двойной контроль целесообразно применять при большой протяженности бластоматозного стеноза с вовлечением пищевода и более двух отделов желудка. В этих случаях положение верхнего края протеза контролируется визуально, а трудности на этапе введения стента и освобождения его от доставочного устройства из-за перегибов нивелируются за счет рентгенологического контроля положения струны и дистального конца стента.
6. ОСЛОЖНЕНИЯ ЭНДОСКОПИЧЕСКОГО СТЕНТИРОВАНИЯ ЗЛОКАЧЕСТВЕННЫХ СТЕНОЗОВ ПИЩЕВОДА И КАРДИИ И МЕТОДЫ ИХ КОРРЕКЦИИ
Осложнения и летальные исходы, непосредственно связанные с вмешательством, встречаются нечасто и в большинстве случаев обусловлены нарушением техники стентирования, профузным кровотечением или аспирацией. В нашей серии наблюдений на этом этапе технических неудач и осложнений не было.
Осложнения, развившиеся в сроки до 7 суток после выполнения стентирования саморасправляющимися эндопротезами, мы предлагаем считать ранними, в более поздние сроки - поздними. Среди ранних осложнений нами отмечены: дислокация стента вниз, которая у 1 пациента привела к сдавлению трахеи, кровотечение из опухоли, обтурация просвета стента пищей при несоблюдении рекомендаций по питанию. Гемостаз был достигнут консервативным путем, во всех остальных случаях осложнения были излечены эндоскопическими методами. Были выполнены:
1) коррекция положения стента за лассо;
2) эндопротезирование пищевода «стент в стент» с фиксацией эндопротеза к ушной раковине (технология Shim’a) из-за повторной дислокации (рис. 23 а-в);
3) экстренное эндопротезирование трахеи стентом Дюмона;
4) эндоскопическое удаление пищевого комка, обтурировавшего стент.
Безусловно, сдавление дыхательных путей является одним из самых опасных ранних осложнений стентирования пищевода, что требует экстренного вмешательства. Для восстановления самостоятельного дыхания в этих случаях могут быть применены следующие методы:
1) извлечение пищеводного стента;
2) параллельное трахеобронхиальное стентирование, которое может дополняться лазерной резекцией трахеальной или эндобронхиальной части опухоли;
3) гормонотерапия.
Как правило, подобное осложнение чаще развивается у пациентов, у которых имеется распространение опухолевого процесса на окружающие органы и ткани, в частности, инфильтрация стенок трахеи и главных бронхов либо сдавление дыхательных путей извне. Поэтому пациентам с локализацией опухоли в верхней и частично средней трети пищевода необходимо в комплекс обследования до стентирования обязательно включать бронхоскопию.
При смещении стента выше опухоли в одном случае мы не отметили каких-либо изменений со стороны слизистой оболочки пищевода, в другом случае под верхним краем имелся неглубокий дефект, впоследствии на этом месте сформировался тонкий поперечный рубец без сужения просвета пищевода. На основании нашего небольшого опыта на сегодняшний день мы полагаем, что при миграции стента вверх его проще и безопаснее извлечь, чем низвести вниз в первоначальную позицию. При миграции эндопротеза в желудок вопрос о целесообразности его извлечения следует решать индивидуально.
Примерно в 1-4% случаев возникают перелом, фрагментация стента или отслойка его покрытия [1, 7, 16, 26, 47]. Если разрушение стента происходит на небольшом протяжении и клинически незначимо, то это осложнение можно выявить лишь при плановом обследовании пациента. При более значимых нарушениях целостности стента могут быть жалобы на примесь крови в слюне за счет ее пропотевания через дефект в покрытии протеза, на усилившееся чувство инородного тела в пищеводе, слюнотечение и т.д. В наших наблюдениях разрушение покрытия стентов и/или их фрагментация были диагностированы в сроки от 2 месяцев после стентирования до года.
Одним из серьезных осложнений стентирования пищевода является формирование пищеводно-респираторных свищей, о чем сообщает ряд исследователей. Полагают, что они возникают вследствие некроза стенки пищевода от чрезмерного давления на нее проксимальной воронки стента, особенно если она имеет достаточно большой диаметр. К сожалению, в нашей серии наблюдений мы также отметили формирование пищеводно-трахеального свища у 3 пациентов, у двух из них верхняя воронка стента пролабировала через свищ в трахею, вызывая нарушение дыхания (рис. 25).
По нашему мнению, в раннем периоде после стентирования пациенты нуждаются в тщательном наблюдении, рентгенологическом контроле положения и степени расправления стента на следующие сутки, а при неполном раскрытии - дольше. При локализации верхнего края поражения в верхней трети пищевода вмешательство следует выполнять в стационаре, учитывая возможность развития опасных и даже угрожающих жизни осложнений.
Жалобы, которые предъявляют пациенты в поздние сроки после стентирования, в подавляющем большинстве неспецифичны для выполненной манипуляции, а отражают клиническую картину опухолевой прогрессии. Они изменяются на протяжении срока наблюдения, и не всегда можно дифференцировать, являются ли симптомы следствием давления стента на окружающие органы и ткани или это проявления опухолевого процесса. Поэтому считаем чрезвычайно важным подчеркнуть, что после стентирования больные нуждаются в регулярном динамическом наблюдении хотя бы в форме односторонних контактов по телефону в направлении «врач - пациент» или «врач - родственник больного». При качественном изменении характера жалоб можно предположить развитие поздних осложнений, выполнить рентгенологическое и эндоскопическое исследования и провести коррекцию возникших нарушений, что продлит жизнь пациента при достаточно высоком ее качестве. Поэтому в нашем отделении все пациенты, которым было выполнено стентирование пищевода, и их родственники имеют контактные телефоны для связи с сотрудниками.
В поздние сроки достаточно частым осложнением эндопротезирования являются дислокация (частичное смещение относительно первичных границ) или миграция (полное смещение из зоны стеноза) протезов. Несмотря на то, что по данным литературы миграция чаще всего возникает в первый месяц после стентирования, в наших наблюдениях это осложнение в основном развивалось в более поздние сроки - от 57 до 277 дней после первичного стентирования. Во всей исследуемой группе пациентов миграция эндопротезов произошла в 4,9% наблюдений, дислокация (с учетом смещения в ранние сроки) - в 6,9% случаев, а в целом частота нарушения положения стента, приводящая к рецидиву дисфагии, составила 11,8%. Однако следует принимать во внимание, что в случае бессимптомного смещения стента из адекватной позиции точное время возникшего осложнения оценить бывает достаточно трудно - только по появлению каких-либо клинических симптомов, например, дисфагии, связанной с прогрессированием основного заболевания после смещения стента, либо при плановом обследовании пациента. Основными факторами, влияющими на частоту возникновения миграции, являются: 1) применение покрытых стентов; 2) предшествующая фотодинамическая, лучевая и химиотерапия; 3) предшествующая дилатация, термическая абляция; 4) стентирование через зону пищеводно-желудочного перехода [31, 42, 52, 54, 57]. В отличие от данных, приводимых в литературе, мы не отметили значимой разницы в частоте смещения при имплантации стентов через зону пищеводно-желудочного перехода по сравнению с установленными в пределах пищевода (при опухолях и сдавлении извне): 10,1% и 13,3% соответственно.
Мигрировавшие стенты заслуживают особого внимания. До настоящего времени нет однозначной концепции по поводу того, что безопаснее: оставлять их или извлекать? После миграции стентов в желудок они могут либо оставаться в этом отделе, не вызывая беспокойства у пациента, либо мигрировать дальше и без каких-либо клинических проявлений дойти до прямой кишки [42, 60] или явиться причиной кишечной непроходимости на разных уровнях, перфорации тонкой и толстой кишок, кровотечения из прямой кишки [32, 42, 43, 53, 67].
В наших наблюдениях из 9 мигрировавших стентов в 2 наблюдениях стенты были оставлены в желудке без каких-либо последствий (рис. 24 а), в остальных - извлечены. Следует отметить, что во всех случаях миграции стента в желудок или желудочный трансплантат мы не отметили каких-либо изменений со стороны слизистой оболочки вокруг мигрировавших стентов (рис. 24 б, в). Все эндопротеы находились в проксимальных отделах желудка и не отмечалось тенденции к смещению в антральный отдел даже во время выполнения эндоскопического исследования с инсуффляцией воздуха. Более того, даже при попытке сместить стент в антральный отдел биопсийными щипцами, чтобы улучшить позицию для захвата протеза за лассо, он стремился вернуться в исходную позицию.
Очень грозным, но, к счастью, достаточно редким осложнением является формирование пищеводно-аортальной фистулы. В нашей серии наблюдений одно подобное осложнение развилось через 8 месяцев после стентирования пищевода и пищеводно-тонкокишечного анастомоза непокрытым нитиноловым эндопротезом диаметром 22 мм по поводу компрессии извне. У пациентки также был отмечен бурный рост грануляционной ткани, вызывавшей дисфагию (рис. 26 а-в).
В позднем периоде после стентирования могут развиваться рубцовые стриктуры выше эндопротеза или обструкция просвета стента за счет продолжающегося роста опухоли, грануляций или плотными пищевыми массами, что требует повторных вмешательств.
Из 214 больных, которым в эндоскопическом отделении ФГБНУ «РНЦХ им. акад. Б.В. Петровского» было выполнено стентирование по поводу злокачественных стенозов пищевода, кардии и пищеводных анастомозов, поздние осложнения в сроки от 2 недель до 1 года развились у 25 (11,7%) пациентов (таблица 1). При этом у 14 больных было несколько осложнений, развившихся одновременно или последовательно.
Таблица 1.
Поздние осложнения стентирования
|
Характер осложнения |
Число больных |
|
Миграция или дислокация стента вниз или вверх |
10+10 |
|
Фрагментация или разрушение покрытия стента |
4+6 |
|
Продолженный рост опухоли и/или сдавление пищевода извне над стентом |
5 |
|
Рубцовая стриктура пищевода выше/ниже стента |
3 |
|
Грануляции по краям стента (бурный рост) |
3 |
|
Выраженный болевой синдром |
3 |
|
Кровотечение из опухоли |
2 |
|
Прорастание опухоли в трахеобронхиальное дерево, в т.ч. с образованием
|
3 |
|
Пищеводно-аортальная фистула |
1 |
|
Рост опухоли в дистальном направлении до панкреатобилиарной зоны |
1 |
Все возникшие поздние осложнения были корригированы с помощью эндоскопической техники, за исключением фатального кровотечения из пищеводно-аортального свища (таблица 2).
Способы эндоскопической коррекции поздних осложнений
|
Способы эндоскопической коррекции |
Число больных |
|
Эндопротезирование «стент в стент» |
8 |
|
Рестентирование |
7 |
|
Эндоскопическое бужирование через стент |
6 |
|
Эндоскопическая коррекция положения стента |
5 (6) |
|
Эндоскопическое удаление стента или его фрагментов без рестентирования |
5 |
|
Стентирование других зон (трахеобронхиальное дерево, пилоробульбарная зона) |
2+2 |
|
Проведение зонда для питания через просвет стента |
2 |
|
Удаление грануляций (полипэктомической петлей, АПК) |
2 |
|
Удаление сгустков крови ловушкой |
1 |
Следует отметить, что эндопротезрование «стент в стент» эффективно при фрагментации стента, нарушении целостности или отслойке покрытия, врастании опухоли в просвет стента, продолженном росте или компрессии извне выше или ниже стента, бурном росте грануляций, в ряде случаев - при дислокации стента.
Для полного представления способов эндоскопической коррекции ранних и поздних осложнений, а также нарушений, связанных с прогрессированием опухолевого процесса, с целью восстановления перорального питания мы сформулировали оптимальную (по нашему мнению) последовательность выполнения вмешательств в зависимости от вида развившихся нарушений.
Фрагментация или разрушение покрытия стента
1. При разрушении и полном отрыве верхней части стента - извлечение свободных фрагментов, при риске повреждения пищевода - использование шинирующей трубки (рис. 27 а, б).
2. При необходимости - бужирование по струне до 36-45 бужа через просвет оставшейся части стента для временной коррекции деформации его просвета.
3. Введение зонда для энтерального питания через просвет деформированного стента, в том числе при прорастании в него опухоли: а) временно, если сразу или в ближайший период не выполняется эндопротезирование «стент в стент»; б) постоянно - при ожидаемой очень короткой продолжительности жизни больного или отказе пациента от повторного стентирования либо наложения стомы (рис. 28).
4. Эндопротезирование «стент в стент» (может быть выполнено без предварительного бужирования или введения зонда) (рис. 29).
5. При частичном или полном отрыве нижней секции с наличием диастаза между фрагментами стента, отслоении или разрушении его покрытия единственным вмешательством может быть эндопротезирование «стент в стент».
Миграция или дислокация стента выше стеноза
1 вариант
1. Удаление стента за верхнее лассо или с помощью полипэктомической петли после ее наложения на наиболее широкую часть протеза с целью уменьшения его диаметра.
2. Бужирование по струне (при необходимости).
3. Временное введение зонда для энтерального питания (необязательно при выполнении рестентирования сразу или через короткий промежуток времени).
4. Рестентирование.
2 вариант
Низведение стента в адекватную позицию за нижнее лассо (может потребоваться предварительное бужирование опухолевого стеноза через стент) - технически вмешательство может оказаться более сложным и опасным, чем удаление протеза.
Миграция или дислокация стентов ниже стеноза
1 вариант (миграция)
1. Оставление стента в желудке (wait and see).
2. Бужирование по струне (при необходимости). При удовлетворительном функциональном результате бужирование может быть вариантом окончательной реканализации.
3. Рестентирование.
2 вариант (миграция)
1. Бужирование по струне (при необходимости).
2. Удаление стента за лассо или с помощью полипэктомической петли после ее наложения на наиболее широкую часть протеза с целью уменьшения его диаметра. При необходимости (например, при обрыве лассо) стент может быть развернут в желудке (рис. 30).
3. Рестентирование.
3 вариант (дислокация)
Перемещение стента в первоначальную позицию за лассо.
4 вариант (дислокация)
При технических сложностях (врастание в стенку циркулярно или с одной стороны, формирование «козырька» из опухолевой или грануляционной ткани над стентом), высокой вероятности повторного смещения или риске возникновения осложнений во время подтягивания стента (кровотечение, перфорация) - эндопротезирование «стент в стент».
Стеноз выше стента (компрессия извне, продолженный рост опухоли в краниальном направлении, рост грануляций)
1. Бужирование по струне (при необходимости).
2. Эндопротезирование «стент в стент»
Стеноз ниже стента (компрессия извне, продолженный рост опухоли в дистальном направлении, рост грануляций)
1. Бужирование по струне (при необходимости).
2. Эндопротезирование «стент в стент»
3. При развитии непроходимости в зоне, удаленной от первичного поражения, - двойное стентирование: введение второго протеза в нижележащие отделы (например, пилоробульбарную зону) через просвет ранее установленного стента.
Рубцовая стриктура выше или ниже стента
1. Бужирование по струне через стент. При удовлетворительном функциональном результате вмешательство может быть вариантом окончательной реканализации.
2. Эндопротезирование «стент в стент».
Во всех случаях отказа пациента от рестентирования или эндопротезирования «стент в стент» - кормление через назогастральный или назоэнтеральный зонд либо наложение стомы для питания.
Вовлечение в опухолевый процесс дыхательных путей - пищеводно-респираторный свищ, сдавление трахеи
1. Экстренное эндопротезирование трахеи предпочтительно саморасправляющимся стентом, при отсутствии - стентом Дюмона или интубация на бронхоскопе для восстановления дыхания.
2. При выраженной компрессии трахеи возможно удаление пищеводного стента.
3. В случае удаления пищеводного стента - введение зонда для энтерального питания.
7. ОСЛОЖНЕНИЯ ЭНДОСКОПИЧЕСКОГО СТЕНТИРОВАНИЯ ДОБРОКАЧЕСТВЕННЫХ СТЕНОЗОВ ПИЩЕВОДА
Результаты стентирования доброкачественных рубцовых стриктур пищевода, которые приводят в основном зарубежные исследователи уже на протяжении 20 лет, нельзя назвать удовлетворительными. Данные о высокой частоте формирования новых стриктур (до 50%) и бурном развитии грануляционной ткани как выше, так и ниже краев саморасправляющихся металлических стентов у больных с доброкачественными стриктурами пищевода приводят W. Cwikiel и соавт. (1993) [34]. G.S. Sandha и N. Marcon (1999) сообщили о результатах лечения 29 больных с рубцовыми стриктурами пищевода (8 серий наблюдений из разных центров и собственный опыт), у которых были использованы металлические стенты. Они полагают, что их применение у данной группы пациентов нецелесообразно в связи с высокой частотой развития осложнений, которая в целом достигала 80%. Среди осложнений отмечено формирование новых стриктур в 41% наблюдений, миграция стентов - в 31%, загрудинные боли или рефлюкс - в 21% случаев, развитие трахеопищеводных свищей - у 6% больных и анемия - у 3% пациентов [59]. По мнению R. Ackroyd и коллег (2001), саморасправляющиеся металлические стенты не должны применяться при лечении доброкачественных стриктур пищевода вообще, так как результаты лечения плохие, а частота ранних и поздних осложнений высока. Эндоскопически удалить подобные стенты сложно, а в ряде случаев невозможно из-за обрастания протеза разрастаниями грануляционной ткани, а также из-за формирования новых стриктур [30].
H. Lang и соавт. (2005) сообщили о том, что крупный доброкачественный пищеводно-респираторный свищ не только не закрылся после многократных попыток стентирования различными моделями саморасправляющихся стентов, последний из которых находился в пищеводе более 3 лет (!), но это привело к глубокому внедрению сетки эндопротеза в стенку пищевода с перфорацией трахеи несколькими нитями. Эндоскопическое извлечение протеза путем разрезания ни- тей было невозможным, поэтому была выполнена эзофагэктомия и закрытие дефекта трахеи. Во время операции несколько нитей стента были извлечены из трахеи, легкого и средостения [51].
Все эти наблюдения свидетельствуют, что применение саморасправляющихся металлических стентов для лечения рефрактерных доброкачественных рубцовых стриктур пищевода на длительный срок нецелесообразно. Однако на XXIII Европейской гастроэнтерологической неделе (24-28 октября 2015 г., г. Барселона, Испания) E.E. van Halsema, J.E. van Hooft (2015) привели результаты анализа 8 проспективных мультицентровых исследований за период 2000-2014 гг., в которые были включены 232 пациента. Согласно этим данным, даже при соблюдении сроков стентирования доброкачественных рубцовых стрик- тур различными типами эндопротезов, частота осложнений в целом составила 31,0%, из них серьезных - 17,7%. Более подробные данные приведены в табл. 3.
Осложнения стентирования доброкачественных рубцовых стриктур при соблюдении сроков (n=232)
|
Виды осложнений в зависимости от типов эндопротезов |
Частота |
|
Саморасправляющиеся металлические полностью покрытые стенты |
10,6% |
|
- выраженная загрудинная боль
|
5,9%
|
|
Биодеградирующие стенты |
28,6% |
|
- выраженная загрудинная боль |
13,0% |
|
- гиперплазия, индуцирующая стеноз |
6,5% |
|
- кровотечение |
6,5% |
|
- выраженная тошнота и рвота |
3,9% |
|
Саморасправляющиеся пластиковые стенты |
14,3% |
|
- выраженная загрудинная боль |
5,7% |
|
- перфорация |
4,3% |
|
- кровотечение |
2,9% |
Таким образом, какого-либо значимого улучшения результатов даже с учетом использования теоретически более щадящих саморасправляющихся пластиковых и биодеградирующих стентов не произошло.
Обладая большим собственным опытом эндоскопического лечения доброкачественных рубцовых стенозов пищевода и пищеводных анастомозов, основой которого является бужирование по направляющей струне, а для профилактики рестеноза - длительное плановое поддерживающее бужирование по разработанному протоколу, мы особенно негативно относимся к неграмотному и бесконтрольному применению стентирования металлическими эндопротезами у этой категории больных, следствием которого являются тяжелые осложнения, требующие серьезного хирургического лечения [4, 8, 9].
В ФГБНУ «РНЦХ им. акад Б.В. Петровского» находились на обследовании и лечении 10 пациентов, которым в других лечебных учреждениях России было выполнено стентирование саморасправляющимися металлическими стентами по поводу доброкачественных сужений пищевода (табл. 4), и у которых возникли различные осложнения данного вмешательства.
Показания к стентированию при доброкачественных заболеваниях, выполненному в других лечебных учреждениях (n=10)
|
Показания и сроки стентирования |
Число больных |
|
Ожоговая стриктура пищевода (сроки стентирования 13 и 16 месяцев) |
2 |
|
Пищеводно-трахеальный свищ (срок стентирования 7 месяцев) |
2 |
|
Пептическая стриктура пищевода (срок стентирования 6 месяцев) |
1 |
|
Пептическая стриктура пищевода и стеноз постбульбарного перехода
|
1 |
|
Рубцовая стриктура пищеводно-тонкокишечного анастомоза 2 степени
|
1 |
|
Рубцовая стриктура пищеводно-желудочного анастомоза после операции |
1 |
|
Льюиса (сроки стентирования 13 и 5 месяцев) |
|
|
Несостоятельность пищеводно-тонкокишечного анастомоза
|
1 |
|
Дисфагия предположительно за счет сдавления извне, не подтвержденного при обследовании (срок стентирования 4 месяца) |
1 |
У 1 пациента, у которого стентирование было выполнено по поводу несостоятельности анастомоза, через 6 месяцев стент был удален по месту жительства, и в Центр хирургии он обратился уже с последствиями предпринятого лечения - протяженной (8 см) рубцовой стриктурой нижней трети пищевода, эзофагоэнтероанастомоза и тонкой кишки ниже него. У остальных 9 пациентов при эндоскопическом исследовании были выявлены следующие осложнения: рубцовая стриктура пищевода диаметром от 2 до 5 мм или его полная облитерация выше и/или ниже стента (5), значимые грануляции по краям стента (4), врастание стента в стенку пищевода (4), отслойка внутреннего покрытия стента с частичным нарушением его просвета (2), фрагментация стента (2), пищеводно-трахеальный свищ (2) и свищ между желудочным трансплантатом и бронхом (1), обструкция протеза пищевыми массами (2), дислокация стента (1) (рис. 31 а-е).
Несколько больных имели более одного осложнения. Например, у последней обратившейся к нам с полной дисфагией пациентки 58 лет, перенесшей двустороннюю мастэктомию в 2001 и 2011 гг., курсы лучевой терапии (2001) и полихимиотерапии (2011, 2013-2014 гг.) 30.06.15 г. было выполнено стентирование саморасправляющимся частично покрытым металлическим стентом Wallflex (Bos- ton Scientific) 18х153 мм по поводу неподтвержденной компрессии средней трети пищевода извне. Через 4 месяца стояния стента в нашем отделении была диагностирована критическая рубцовая стриктура выше стента (2 мм). После бужирования стриктуры выявлена дислокация стента ниже сужения, врастание непокрытой верхней воронки протеза в стенку пищевода с формированием глубокого язвенного дефекта и массивным ростом грануляций (рис. 32 а, б). По данным компьютер- ной томографии от 24.11.2015 г. выявлено «наползание» слизистой на верхнюю часть стента на протяжении 16 мм без каких либо данных о прогрессии заболевания (рис. 32 в).
Необходимо отметить, что в данном случае были нарушены как минимум два правила при выборе стента. Во-первых, длина установленного стента была чрезмерной (153 мм) - протяженность сужения, на уровне которого в настоящий момент имеется рубцовая стриктура, составляет всего 1 см! Во-вторых, устанавливать стент с непокрытыми элементами металлической конструкции или полностью непокрытый стент можно лишь в случаях полной уверенности, что его не придется удалять из-за плохой переносимости или неправильно оцененной ожидаемой продолжительности жизни пациента.
Спектр эндоскопических и хирургических вмешательств, выполненных по поводу осложнений стентирования, представлен в таблице 5.
Вмешательства по поводу осложнений стентирования при доброкачественных заболеваниях пищевода, выполненные в РНЦХ
|
Виды операций |
Число больных |
|
Эндоскопическое бужирование протяженной рубцовой стриктуры в течение года |
1 |
|
Эндоскопическое извлечение стента, длительное бужирование рецидивирующей пептической стриктуры, фундопликация в модификации РНЦХ |
1 |
|
Эндоскопическое бужирование критической короткой рубцовой стриктуры над стентом - 6 сеансов, склонность к быстрому рестенозу. Протезирование «стент в стент» протезом большего диаметра с последующей попыткой извлечения обоих стентов, при неудаче или осложнении - экстирпация пищевода с одномоментной или отсроченной эзофагопластикой желудочной трубкой |
1 |
|
Эндоскопическое извлечение стента и хирургическое разобщение большого пищеводно-трахеального свища |
1 |
|
Хирургическое извлечение стента и разобщение пищеводно-трахеального свища |
1 |
|
Экстирпация пищевода с одномоментной или отсроченной эзофагопластикой желудочной трубкой или толстой кишкой, при необходимости с ушиванием дефектов трахеи |
5 |
Таким образом, методически неверный подход к лечению пациентов с доброкачественными заболеваниями пищевода, имплантация металлических стентов на длительный срок без какого-либо контроля со стороны специалистов учреждения, где это вмешательство было выполнено, приводит к возникновению серьезных осложнений, которые в большинстве случаев невозможно корригировать эндоскопическими методами в отличие от осложнений при стентировании злокачественных стенозов. В итоге пациенты вынужденно подвергаются тяжелейшим операциям, часто приводящим к инвалидности.
Выделение пищевода с длительно стоящими стентами является чрезвычайно сложной и травматичной процедурой. Во время операции, как правило, выявляется, что пищевод трубкообразно сужен, его мышечный слой истончен, пищевод спаян с аортой и другими окружающими структурами средостения за счет выраженного фиброза (рис. 33 а-в).
Металлические струны стентов, которые к тому же часто разрушаются в процессе длительного стояния, глубоко внедряются в стенку пищевода и окружающие структуры, чаще всего в трахею (рис. 34 а-в). Результатом внедрения стента является интенсивное развитие рубцовых тканей и рост грануляций.
При микроскопическом исследовании удаленных пищеводов выявляются распространенный некроз слизистой оболочки, эрозии и язвы в местах контакта со стентом. Большая часть мышечной оболочки замещается фиброзными тканями за счет вторичной ишемии в результате давления стента. Отмечается разрастание грануляционной ткани, выраженная атрофия и дегенерация мышечного слоя, массивная мононуклеарноклеточная инфильтрация и десквамация эпителия.
По теме:
Вывод:
В настоящее время не вызывает сомнения, что использование саморасправляющихся металлических стентов для паллиативного лечения злокачественной обструкции верхних отделов желудочно-кишечного тракта с вовлечением пищеводно-желудочного перехода, рецидиве опухолевого роста в зоне пищеводных анастомозов является методом выбора. Наш опыт свидетельствует о высокой эффективности и безопасности подобных вмешательств; они позволяют восстановить проходимость желудочно-кишечного тракта и улучшить качество жизни инкурабельных больных. Требуется дальнейшее накопление опыта для оценки результатов паллиативного лечения путем стентирования у больных с компрессией пищевода, кардии или пищеводного анастомоза извне.
Наибольшее значение в выборе эндопротеза играют степень выраженности стеноза, протяженность поражения, его локализация и связанные с этим конструктивные особенности стента наличие или отсутствие покрытия, антирефлюксного клапана, сегментарная или цельноплетеная структура.
При выборе методики стентирования при злокачественной обструкции пищевода, кардиоэзофагеальной зоны, желудка с переходом на пищевод и пищеводных анастомозов следует руководствоваться строгими показаниями, основанными, прежде всего, на локализации патологического процесса и его протяженности. Характер поражения не влияет на выбор способа имплантации эндопротеза с помощью эндоскопической техники.
Пациенты после стентирования подлежат обязательному активному мониторингу, так как в отдаленном периоде у части из них развиваются осложнения либо клинические симптомы прогрессирования опухолевого процесса, которые в целом ряде случаев могут быть успешно корригированы эндоскопическими методами.
При доброкачественных заболеваниях пищевода стентирование саморасправляющимися металлическими эндопротезами на длительный срок сопровождается тяжелыми осложнениями, поэтому его допустимо выполнять при резистентности сужения к традиционным методам дилатации на короткий срок, не превышающий, по данным литературы, 4-6 недель с эндоскопическим контролем каждые 2 недели и своевременным извлечением стента.
Список литературы:
1. Бурдюков М.С., Юричев И.Н., Нечипай А.М. и др. Стентирование стенотиче- ских стриктур верхних отделов желудочно-кишечного тракта // Сборник тезисов 13-го Московского международного конгресса по эндоскопической хирургии, 22-24 апреля 2009 г., Москва, с. 63-64.
2. Владыко А.К., Каспаров Э.В., Шульмин А.В. Эндопротезирование пищевода. Особеннности стентирования онкобольных с несостоятельностью эзофагоэн- тероанастомозов // Сборник тезисов 16-го Московского международного конгресса по эндоскопической хирургии, 18-20 апреля 2012 г., Москва, с. 42-43.
3. Галлингер Ю.И., Годжелло Э.А. Оперативная эндоскопия пищевода. - Москва, 1999 г., 273 с.
4. Галлингер Ю.И., Годжелло Э.А. Эндоскопические методы дилатации и стен- тирования при стенозирующих заболеваниях пищеварительного тракта. - В кн. "Интервенционная медицина/Под ред. Г.И. Назаренко: Руководство для вра- чей". - М.: ОАО "Издательство "Медицина", 2012. - 808 с.: ил. Разд. V "Совре- менные эндоскопические методы интервенционной гастроэнтерологии", гл.3, с. 510-525.
5. Галлингер Ю.И., Годжелло Э.А. Эндоскопические методы лечения при раке пищевода // Российский журнал гастроэнтерологии, гепатологии и колопроктологии, 2001, №6, с. 75-78.
6. Галлингер Ю.И., Годжелло Э.А. Эндоскопические методы реканализации бластоматозных поражений пищевода и пищеводных анастомозов // Материалы 3-й Российской гастроэнтерологической недели, 17-21 ноября 1997 г., Москва. Российский журнал гастроэнтерологии, гепатологии и колопроктологии, 1997, том VII, №5, абстракт №600, с.244.
7. Галлингер Ю.И., Годжелло Э.А., Хрусталева М.В., Амелина М.А. Первый опыт применения саморасправляющихся металлических стентов при инкурабельных поражениях пищевода и пищеводных анастомозов // Сборник тезисов 12-го Московского международного конгресса по эндоскопической хирургии, 23-25 апреля 2008 г., Москва, с. 108-111.
8. Годжелло Э.А., Галлингер Ю.И., Хрусталева М.В., Евдокимова Е.В., Ходаков- ская Ю.А. - Современная концепция эндоскопического лечения рубцовых стриктур пищевода и пищеводных анастомозов (обобщение 25-летнего опы- та). - Хирургия. Журнал им. Н.И. Пирогова. - 2013. - №2. - с. 97-104.
9. Годжелло Э.А., Хрусталева М.В., Галлингер Ю.И. Методические и тактиче- ские аспекты внутрипросветного эндоскопического лечения доброкачествен- ных стриктур пищевода и анастомозов. - Методические рекомендации для врачей. - Российское эндоскопическое общество, г. Москва. - 2014. - 36 с.
11.Годжелло Э.А., Хрусталева М.В., Пермяков В.Б., Галлингер Ю.И. - Отдаленные результаты эндоскопического стентирования бластоматозных стенозов пищевода, желудка с вовлечением кардии и пищеводных анастомозов саморасправляющимися эндопротезами. - Вестник хирургической гастроэнтерологии. - 2012. - №3. - с.33-40.
12.Годжелло Э.А., Хрусталева М.В., Пермяков В.Б., Галлингер Ю.И. Эндоскопическое стентирование пищевода и пищеводных анастомозов саморасправяющимися эндопротезами при сдавлении извне. - Вестник хирургической гастроэнтерологии, 2011, №4, с. 22-29
13.Климашевич А.В. Современные технологии профилактики и лечения после- ожоговых рубцовых стриктур пищевода. - // Автореф. дис. ... докт. мед. наук : Пенза, 2014. – 48 с.
14.Климов А.Е., Фёдоров А.Г., Давыдова С.В., Водолеев А.С. Эндопротезирование верхних отделов пищеварительного тракта // Тихоокеанский медицинский журнал. - 2008.- №4. - Приложение. - с. 6-12.
15.Королев М.П., Роман Л.Д., Федотов Л.Е. и др. Осложнения эндоскопического стентирования пищевода: методика контроля, причины возникновения, эффективная коррекция // Сборник тезисов 16-го Московского международного конгресса по эндоскопической хирургии, 18-20 апреля 2012 г., Москва, с. 113- 115.
16.Королев М.П., Федотов Л.Е., Смирнов А.А. и др. Осложнения эндоскопического стентирования стриктур пищевода // Клин. эндоскопия, 2009, №3 (20), с. 14-19.
17.Ложкина Н.В., Новиков В.Н., Нагаев А.С. Эндопротезирование при сочетанном неопластическом стенозе трахеи и пищевода // Сборник тезисов 13-го Московского международного конгресса по эндоскопической хирургии, 22-24 апреля 2009 г., Москва, с. 188-190.
18.Малихова О.А., Поддубный Б.К., Кувшинов Ю.П. и др. Эффективность эндоскопического стентирования у больных неоперабельным раком пищевода и желудка // Сборник тезисов 12-го Московского международного конгресса по эндоскопической хирургии, 23-25 апреля 2008 г., Москва, с. 261-263.
19.Муравьев В.Ю., Иванов А.И. Стентирование пищевода при злокачественных стенозах и эзофаго-респираторных свищах // Клин эндоскопия 2008; 2 (15): 12-15.
20.Муравьев В.Ю., Иванов А.И., Максимов П.А., Муравьева Е.В. Эндопротезирование при заболеваниях пищевода и трахеи // Сборник тезисов симпозиума «Эндоскопическое протезирование» под редакцией проф. Ю.И. Галлингера, 16 ноября 2006 г, Москва, с. 43-49.
22.Павлов П.В., Соколов В.В., Карпова Е.С. и др. Эндоскопическое лечение при стенозирующем раке верхних отделов желудочно-кишечного тракта: выбор стента, методик реканализации и стентирования, профилактика и лечение осложнений // Сборник тезисов 16-го Московского международного конгресса по эндоскопической хирургии, 18-20 апреля 2012 г., Москва, с. 143-145.
23.Рабкин И.Х., Мамонтов А.С., Прозоров С.А. и др. Первый опыт клинического применения рентгеноэндоэзофагеального протезирования // Новые технологии в рентгенохирургии. Тезисы IX Всесоюзного симпозиума, Москва 1989: 39-40.
24.Соколов В.В., Карпова Е.С., Павлов П.В. Методы эндоскопического лечения больных с опухолевой стриктурой пищевода и желудка // Эндоскопическая секция хирургического общества Пирогова. Мастер-класс 19-20 июня 2008 го- да. Сборник тезисов. - 2008. - С. 5-13 (www.nwendoscopy.ru/science/master- class.html).
25.Соколов В.В., Филоненко Е.В., Карпова Е.С. и др. Эндоскопическая реканализация и стентирование при раке пищевода у больных с дисфагией III-IV степени // Вестник Московского Онкологического общества 2004: №12, с. 7.
26.Соколов В.В., Филоненко Е.В., Карпова Е.С. и др. Эндоскопическое протезирование при злокачественной стриктуре пищевода // Сборник тезисов симпозиума «Эндоскопическое протезирование» под редакцией проф. Ю.И. Галлингера, 16 ноября 2006 г, Москва, с. 63-90.
27.Черноусов А.Ф., Поликарпов С.А., Черноусов Ф.А. Хирургия рака желудка // М.: ИздАТ, 2004, 506 с.
28.Чиссов В.И., Соколов В.В., Филоненко Е.В. и др. Стенозирующий первичный и рецидивный рак пищевода и желудка: эндоскопическое лечение и протезирование // Материалы VI Всероссийского съезда онкологов, Ростов-на Дону, 2005 г., том 2, стр 78-80.
29. Aabakken L. Endoscopic Tumor Diagnosis and Treatment // Endoscopy 2005; 37: 1079-1083.
30. Ackroyd R., Watson D.I., Devitt P.G., Jamieson G.G. Expandable metallic stents should not be used in the treatment of benign esophageal strictures // J Gastroenterol Hepatol 2001; 16: 484-487
31. Bartelsman J.F.W., Bruno M.J., Jensema A.J. et al. Palliation of patients with esoph- agogastric neoplasms by insertion of a covered expandable Gianturco-Z endopros- thesis: experiences in 153 patients // Gastrointest Endosc 2000; 51: 134-138.
32. Begbie S., Briggs G., Levi J. A late complication of palliative stenting of malignant esophageal obstruction // Aust N Z Med 1996; 26: 115
33. Chung F.T., Lin H.C., Chou C.L. et al. Airway ultraflex stenting in esophageal can- cer with esophagorespiratory fistula // Am. J. Med. Sci. 2012; 344(2); 105-9.
35. Dorta G., Binek J., Blum A.L. et al. Comparison between esophageal wallstents and ultraflex stents in the treatment of malignant stenoses of the esophagus and cardia // Endoscopy 1997; 29: 149-154.
36. Dua A., Kozarek R., Kim J. et al. Self-expanding metal esophageal stent with anti- reflux mechanism // Gastrointest Endosc 2001; 53: 603-613.
37. Ell C., May A. Self-Expanding Metal Stents for Palliation of Stenosing Tumors of the Esophagus and Cardia: A Critical review // Endoscopy 1997; 29: 392-398.
38. Ell C., May A., Hahn E.G. Gianturco-Z stents in the palliative treatment of malig- nant esophageal obstruction and esophagotracheal fistulas // Endoscopy 1995; 27: 495-500.
39. Frimberger E. Expanding spiral: a new type of prosthesis for the palliative treatment of malignant esophageal stenoses // Endoscopy 1983; 15: 213-214.
40. Fiorini A., Fleischer D., Valero J. et al. Self-expandable metal coil stents in the treatment of benign esophageal strictures refractory to conventional therapy: a case series // Gastrointest Endosc 2000; 52: 259-262.
41. Garcia-Cano J. Esophageal Insertion of Polyflex Stents without Fluoroscopy in Pep- tic Strictures // Endoscopy 2007; 39: E133.
42. Giovanni D., De Palma G.D., Iovino P., Catanzano C. Distally migrated esophageal self-expanding metal stents: wait and see or remove? // Gastrointest Endoscopy 2001; 53: 96-98.
43. Grimley C.E., Bowling T.E. Oesophageal metallic stent dysfunction: first reported case of stent fracture and separation // Endoscopy 1999; 31: S45.
44. Grund K.E., Storek D., Becker H.D. Higly flexible self-expanding meshed metal stents for palliation of malignant esophagogastric obstruction // Endoscopy 1995; 27: 486-494.
45. Hamai Y., Hihara J., Emi M. et al. Airway stenting for malignant respiratory com- plications in esophageal cancer // Anticancer Res. 2012; 32(5); 1785-90.
46. van Heel N.C.M., Haringsma J., Spaander M.C.W. et al. Esophageal stents for the relief of malignant dysphagia due to extrinsic compression // Endoscopy 2010; 42 (7): 536-540.
47. Homs M.Y.V., Steyerberg E.W., Kuipers E.J. et al. Causes and Treatment of Rec- curent Dysphagia after Self-Expandable Metal Stent Placement for Palliation of Esophageal Carcinoma // Endoscopy 2004; 36 (10): 880-886.
48. Lambert R. Endoscopic treatment of esophagogastric tumors // Endoscopy 1994; 26: 28-35.
49. Lambert R. Endoscopic treatment of esophagogastric tumors // Endoscopy 1996; 28: 27-37.
50. Lanfranco A.R., Haas A., Sterman D. et al. Airway stenting for malignant aerodiges- tive fistulae: A critical review of the literature and treatment recommendations // Techniques in Gastrointestinal Endoscopy (2009) 11, 118-126.
52. Ludwig D., Dehne A., Burmaster E. et al. Treatment of unresectable carcinomas of the esophagus or the gastroesophageal junction by mech stents with or without radi- ochemotherapy // Int О Oncol 1998; 13: 583-8.
53. MacDonald A. J., Drummond R. J., Wright D. M. Migration of a metal esophageal stent presenting as obstruction at the ileocecal valve 2 years postinsertion// Endoscopy 2007; 39: E190.
54. Maier A., Pinter H., Friehs G.B. et al. Self-expandable coated stents after untralu- minal treatment of oesophageal cancer: a risky procedure // Ann Thorac Surg 1999; 67:781-4.
55. Parker R.K., White R.E., Topazian M. et al. Stents for proximal esophageal cancer: a case-control study // Gastrointest Endosc 2011; vol.73, No. 6: 1098-1105.
56. Petruzziello L., Tringali A., Riccioni M.E. et al. Successful early treatment of Boer- haave’s syndrome by endoscopic placement of a temporary self-expandable plastic stent without fluoroscopy // Gastrointest Endosc 2003; 58: 608-612.
57. Ramirez F.C., Dennert B., Zierer S.T., Sanowski R.A. Esophageal self-expandable metallic stent - indications, practice, techniques, and complications: results of a na- tional survey // Gastrointest Endosc 1997; 45: 360-363.
58. Rosch T., Allescher H.D. DDW Congress Report 1995, San Diego, 14-17 May 1995 // Endoscopy 1995; 27: 516-560.
59. Sandha G.S., Marcon N.E. Expandable metal stents for benign esophageal obstruc- tion // Gastrointest Endosc Clin N Am 1999; 9: 437-446.
60. Siersema P.D., Dees J., van Blankenstein M. Palliation of malignant dysphagia from oesophageal cancer // Scand J 1998; 33: 75-84.
61. Shim C.S., Cho Y.D., Moon J.H. et al. Fixation of a Modified Covered Esophageal Stent: Its Clinical Usefulness for Preventing Stent Migration // Endoscopy 2001; 33 (10): 843-848.
62. Shim C.S., Jung I.S., Cheon Y.K. et al. Management of Malignant Stricture of the Esophagogastric Junction with a Newly Designed Self-Expanding Metal Stent with an Antireflux Mechanism // Endoscopy 2005; 37 (4): 335-339.
63. Tietjen T.G., Pasricha P.J., Kaloo A. Management of malignant esophageal stricture with esophageal dilation and esophageal stents // Gastrointest Endosc Clin North Am 1994; 4: 851-862.
64. Tytgat G.N.J. Endoscopic therapy of esophageal cancer: possibilities and limita- tions // Endoscopy 1990; 22: 263-267.
65. Vermeijden J.R., Bartelsman J.F., Meijer R.C., Tytgat G.N. Self-expanding metal stents for palliation of esophagocardial malignancies // Gastrointest Endoscopy 1995; 41: 58-63.
66. Wang C.Y., Chou C.H., Wang H.P. et al. Successful treatment of bronchoesophage- al fistula with esophageal and bronchial stenting // Med. Assoc. 2011; 110(4); 270-2.
Статьи по теме
Рекомендуемые статьи
Синдром Крона
неспецифические гранулёмы в пищеводе.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.

















.jpg)





.png)



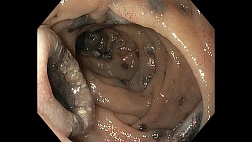
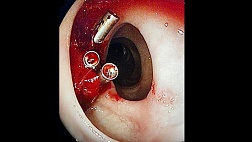











Комментарии