Введение
Микроскопический колит (МК) - это все более узнаваемое воспалительное заболевание кишечника, связанное со значительным бременем симптомов и ухудшением качества жизни, связанного со здоровьем (HRQoL). Клиническое течение MC варьируется, с хроническими или рецидивирующими симптомами от легкой до тяжелой, сохраняющимися от месяцев до лет. Распространенность MC существенно варьируется в зависимости от географического региона. Двумя основными гистологическими подтипами являются коллагеновый колит (CC) и лимфоцитарный колит (LC), но могут возникать неполные формы (неполный MC (MCi)). Диагноз MC основывается на гистологическом исследовании биопсии толстой кишки и требует специализированных гастроэнтерологов, эндоскопистов и гистопатологов.
Было опубликовано несколько обзорных статей по различным диагностическим и терапевтическим аспектам MC. 1- 5 В 2012 году Европейская группа по микроскопическим колитам (EMCG) предложила свои первые рекомендации по диагностике и лечению МК. 6 В 2013 г. MC был включен в Европейский консенсус по гистопатологии воспалительных заболеваний кишечника, опубликованный от имени Европейского общества патологов и Европейской организации по болезни Крона и колита. 7В соответствии с этим конкретным руководством MC определяется как «клиническое патологическое состояние, характеризующееся хронической водянистой (не кровянистой) диареей, нормальным или почти нормальным эндоскопическим видом толстой кишки и отчетливой гистологической картиной коллагенового колита или лимфоцитарного колита». Это включает в себя то, что другие причины хронической диареи, такие как инфекции или другие экзогенные факторы, были исключены рутинными клиническими процедурами. Совсем недавно Испанская группа по микроскопическому колиту и Американская ассоциация гастроэнтерологов опубликовали первые основанные на фактах утверждения и рекомендации с использованием методологии GRADE (Grading of Recommended Assessment, Development and Evaluation), которая теперь считается стандартным инструментом для развития клинической практики. гиды. 8 , 9
В условиях постоянных неопределенностей и новых разработок в клиническом ведении MC, Объединенная европейская гастроэнтерология (UEG) и EMCG определили необходимость разработки обновленных клинических практических рекомендаций для повышения осведомленности о MC и поддержки клиницистов в улучшении клинического ухода за пациентами с MC в повседневной жизни. рутинная практика.
Методология
Рабочая группа по руководству
Всем членам EMCG было предложено принять участие, и открытое приглашение было размещено на веб-сайте UEG за несколько месяцев до первого собрания группы, которое состоялось в Вене в октябре 2018 года. Наконец, вся группа состояла из 32 врачей и исследователей из 14 европейских стран. включая гастроэнтерологов, патологов и ученых-фундаменталов, обладающих опытом в научной методологии, доказательной медицине и клиническом и терапевтическом лечении МК. Всего было создано пять рабочих групп (1: Эпидемиология, факторы риска; 2: Патогенез; 3: Клинические проявления, качество жизни; 4: Диагностика, мониторинг; 5; Лечение), каждая из которых состоит из руководителя рабочей группы и от пяти до семь членов группы. Был создан руководящий комитет, состоящий из двух координаторов (SM, AMü) и руководителей рабочих групп (DG, YZ, GET, AMKF, SW). Первый, Список тем и исследовательских вопросов, которые должны быть охвачены руководством, был создан руководящим комитетом на основе обсуждений с членами рабочей группы их актуальности и потенциального воздействия на клиническую практику. Окончательный список вопросов исследования был отформатирован в рамках PICO (пациент, вмешательство, контроль, результат), когда это было необходимо.
Литературный поиск и оценка доказательств
Официальный систематический обзор литературы проводился по каждому вопросу исследования с использованием MEDLINE (доступ через PubMed), электронных баз данных EMBASE и Кокрановской базы данных систематических обзоров (Кокрановская библиотека) и Кокрановского центрального реестра контролируемых испытаний с момента создания до июля 2019 г. без ограничения языков и периодически обновляется. Стратегию поиска и процесс отбора исследований, разбитые на категории по вопросам исследования, можно найти в онлайн-приложении A (дополнительные материалы). Также был проведен обзор цитат для выявления потенциально релевантных статей. Это включало систематические обзоры и другие документы, предлагающие критический синтез научной литературы, а также рандомизированные клинические испытания, когда это возможно.
Данные по эпидемиологии, патогенезу, клиническим проявлениям, диагностике и лечению СК были критически проанализированы, и, если применимо, были проведены метаанализы. Рабочие группы следовали методологии GRADE ( https://www.gradeworkinggroup.org/ ) для оценки качества доказательств утверждений / рекомендаций и классифицировали рекомендации для различных клинических сценариев на четыре заключительные категории: сильная рекомендация по вмешательству ( подразумевает сделать это), слабая рекомендация по вмешательству (подразумевая, что, вероятно, делать это), слабая против вмешательства (подразумевая, что, вероятно, не делать этого) и сильная против вмешательства(подразумевая не делать этого). Сила рекомендации (GR: сильная или слабая) с использованием подхода GRADE была дана только для исследований точности диагностических процедур и оценки эффективности лечения.
Уровень доказательств (УД) был разделен на четыре категории: высокое, среднее, низкое или очень низкое качество на основе строгой оценки качества доказательств. Качество доказательств может быть снижено в результате ограничений в дизайне исследования или его реализации, неточности оценок, вариативности результатов, косвенности доказательств или предвзятости публикации; или повышен из-за очень большой величины эффектов, градиента доза-ответ или если все правдоподобные смещения уменьшат очевидный эффект лечения. Более того, рекомендации также основывались на некоторых других факторах, таких как желательные и нежелательные последствия альтернативных стратегий управления, изменчивость ценностей и предпочтений, а также использование ресурсов (затрат).
Эволюция заявлений / рекомендаций
Основываясь на обзоре литературы и оценке доказательств, рабочие группы составили проекты первоначальных заявлений и рекомендаций, которые впоследствии прошли процесс голосования всей группой по составлению рекомендаций с использованием метода Дельфи. Участники оценили утверждение / рекомендацию на основе пятибалльной шкалы Лайкерта (1: категорически не согласен; 2: не согласен; 3: нейтрально; 4: согласен; 5: полностью согласен) и предложили изменения или даже новые. После этого заявления и рекомендации были пересмотрены рабочими группами. При необходимости они были изменены, и за них снова проголосовали во время финальной очной встречи по достижению консенсуса, состоявшейся в Барселоне в октябре 2019 года. Заявления и рекомендации были одобрены, если с ними согласились 75% или более участников (оценка Лайкерта 4 или 5; От 75% до 94%: консенсус, от 95% до 100%: сильный консенсус). Каждое заявление и рекомендация сопровождается LE (высокий, средний, низкий, очень низкий), степенью рекомендации, результатом голосования (процентное согласие) на консенсусной встрече и обсуждением соответствующих доказательств. Группа по составлению рекомендаций сформулировала в общей сложности 39 утверждений и рекомендаций (Таблица 1 ).
Таблица 1. Сводка заявлений и рекомендаций UEG / EMCG для MC.
Эпидемиология и факторы риска МК
Какая заболеваемость MC?
Утверждение 1.1: Суммарный общий уровень заболеваемости МК оценивается в 11,4 (95% доверительный интервал (ДИ): 9,2–13,6) случая на 100 000 человеко-лет. Заболеваемость CC и LC колеблется от 0,6 до 16,4 случаев на 100 000 человеко-лет и от 0,6 до 16,0 случаев на 100 000 человеко-лет, соответственно.
LE: высокий; GR: не применимо; согласие: 100%, устойчивый консенсус
Резюме доказательств: эпидемиологические исследования документально подтвердили рост заболеваемости MC в западных странах. Общий объединенный коэффициент заболеваемости в 11,4 (95% ДИ: 9,2–13,6, I 2 = 99,72%) случаев MC на 100 000 человеко-лет был рассчитан на основе исследований, предоставляющих данные для населения. 10- 31 Несколько исследований из Северной Америки 20 , 27 и Европы 14 , 16- 18 , 25 , 26 , 29 сообщили об изменении показателей заболеваемости за 10-летний период в одном и том же регионе. Все они показали рост заболеваемости в первые годы, которая достигла плато. 32 Совокупный уровень заболеваемости CC 10 , 11 , 13- 24 , 26- 31 , 33- 36 было 4,9 (95% ДИ: 4,2–5,7, I 2 = 98,3%) случаев на 100 000 человеко-лет. Общий коэффициент заболеваемости ЦП составил 5,0 (95% ДИ: 4,0–6,1, I 2 98,75%) случаев на 100 000 человеко-лет. 10- Сообщалось о 31 географических вариациях заболеваемости MC; однако ограниченное количество исследований из Южной Европы по сравнению с Северной Европой и отсутствие прямых сравнительных исследований из разных стран за один и тот же период времени не позволяет сделать окончательные выводы по этому поводу.
Заболеваемость MC выше у пожилых людей. Предыдущий метаанализ показал, что средний возраст пациентов на момент постановки диагноза был старше 60 лет (CC: 64,9, CI: 57,03–72,78; LC: 62,2, CI: 54,0–70,4 года). 32 Тем не менее, до 25% пациентов с диагнозом КК были моложе 45 лет 33, а случаи СС были описаны даже у детей. 37- 40
Какая распространенность MC?
Утверждение 1.2: Суммарная общая распространенность МК оценивается в 119 (95% ДИ: 73–166) на 100 000 человек, при общей распространенности 50,1 на 100 000 человеко-год для CC и 61,7 на 100 000 человек для LC.
LE: высокий; GR: нет данных; согласие: 94%, консенсус
Резюме доказательств: пять популяционных исследований, проведенных в Испании 21 , 41 Северной Америке 20 , 27 и Швеции 30 , оценили распространенность MC и предоставили широкий диапазон от 47,5 до 219 случаев на 100 000 человек. Эти исследования были объединены, чтобы обеспечить общую распространенность МК на уровне 119,4 (95% ДИ: 72,9–165,9, I 2 = 97,08%) случая на 100 000 человек. Для CC объединенная распространенность была оценена в 50,1 (95% ДИ: 13,69–76,5, I 2 = 98,37%) случая на 100 000 человек. 20 , 21 , 27 , 30 , 33 , 41Расчетная объединенная распространенность ЦП составила 61,7 (95% ДИ: 48,2–75,3, I 2 = 80,56%) на 100 000 человек. 20 , 21 , 27 , 30 , 41 В некоторых исследованиях сообщалось, что увеличение возраста является фактором риска развития MC, 20 , 33 , 41 с вероятностью MC в 5,25 (95% ДИ: 3,81–7,24) раза выше у людей старше 65 лет. возраста. 41 год
Какова частота МК при хронической диарее?
Утверждение 1.3. Суммарная частота MC у пациентов с необъяснимой хронической водянистой диареей составляет 12,8% (95% ДИ: 10–16) со значительной неоднородностью ( I 2 = 93,6%).
УЭ: умеренный; GR: нет данных; согласие: 100%, устойчивый консенсус
Резюме доказательств: частота MC у пациентов с хронической или перемежающейся водянистой диареей и макроскопически нормальной (или почти нормальной) толстой кишкой оценивалась в нескольких исследованиях. 17 , 18 , 21 , 26 , 27 , 42- 72 На основании исследований среднего или высокого качества и размера выборки ≥100 пациентов, 17 , 18 , 21 , 26 , 27 , 42 , 43 , 45- 47 , 49 , 52 , 54 , 56 , 59 , 60 объединенная общая частота MC была оценена в 12,8% (95% ДИ: 9,9–15,9, I 2 = 93,6%). Совокупная частота CC и LC составила 4,96% (95% ДИ: 3,6–6,5, I 2 = 85,2%) 17 , 18 , 21 , 26 , 27 , 42 , 43 , 45 , 47 , 49 , 52 , 54 , 56. , 60и 8,2% (95% ДИ: 6,0–10,8, I 2 = 92,0%), 17 , 18 , 21 , 26 , 27 , 42 , 43 , 45 , 47 , 49 , 52 , 54 , 56 , 60 соответственно (см. также Приложение D, дополнительный материал). Данные продемонстрировали высокую гетерогенность и не могут быть напрямую сопоставимы, учитывая различный географический и генетический фон, различные используемые определения хронической водянистой диареи, отсутствие четко описанных диагностических критериев для MC и диагностического обследования перед колоноскопией.
Является ли курение фактором риска MC?
Утверждение 1.4: Прежнее, но особенно нынешнее курение связано с повышенным риском как CC, так и LC.
УЭ: умеренный; GR: нет данных; согласие: 100%, устойчивый консенсус
Резюме доказательств: распространенность текущего курения среди пациентов с MC варьировалась от 15,3% до 40,7% (CC: 13,6–37,1%; LC: 13,2–26,0%) по сравнению с 5,0–28,2% в контрольных группах без MC. 28 , 43 , 73- 82 Согласно недавнему метаанализу, 83 курильщика, которые курили в настоящее время, имели значительно повышенный риск MC по сравнению с никогда не курившими (отношение шансов (OR) 2,99; 95% ДИ: 2,15–4,15). 83 Текущее курение было более тесно связано с CC, чем LC (OR 5,5, 95% ДИ: 3,4–8,9; OR 2,96, 95% ДИ: 2,0–4,3, соответственно). 83 Прежнее курение также было связано с повышенным риском (OR 1,6, 95% CI: 1,4–1,9). 83 Однако гетерогенность между исследованиями была высокой или умеренной для всех анализов. Статус курения часто оценивался с помощью анкет, заполняемых самостоятельно, или обзора медицинских карт, и не было однородного определения курения.
Является ли женский пол фактором риска MC?
Утверждение 1.5: Риск развития СС или ЦП у женщин выше, чем у мужчин.
LE: высокий; GR: нет данных; согласие: 100%, устойчивый консенсус
Резюме доказательств: частота MC выше у женщин, чем у мужчин, как сообщалось в предыдущем метаанализе, опубликованном в 2015 году. 32 Фактически, анализ подгрупп по заболеваемости MC по полу был возможен в 19 исследованиях. 10 , 12- 24 , 26- 30 Женский пол был значимо связан с MC (объединенный OR 2,52, 95% ДИ: 2,28–2,79, I 2 89%), без различий между исследованиями из Северной Европы (объединенный OR 2,48, 95% ДИ: 2,22–2,78, I 2 90%), Южной Европы (объединенный OR 2,53, 95% ДИ: 1,63–3,94, I 2 62%) и Северной Америки (объединенный OR 2,77, 95% CI: 2,02–3,81, I 2 37%). Подгрупповые анализы CC ( n = 18 исследований) 10 , 12- 19 , 23 , 26- 30 , 33 , 35 , 36 и LC ( n = 15 исследований) 10 , 12- 19 , 23 , 26- 30 воспроизвели эти результаты с объединенным OR 3,24 (95% ДИ: 3,03–3,47, I 2 = 35%) в CC и 2,06 (95% ДИ: 1,84–2,31, I 2 = 78%) в LC (см. также Приложение D, дополнительный материал). Доля женщин среди популяций МС была описана в диапазоне от 52% до 86% (см. Дополнительные материалы, стр. 28). В трех крупнейших исследованиях из Швеции 12, Дании 14 и Нидерландов 29 средняя доля женщин составляла примерно 72%.
Влияет ли отказ от курения на течение болезни MC?
Утверждение 1.6 . Недостаточно данных для оценки влияния отказа от курения на течение болезни.
УЭ: низкий; GR: нет данных; согласие: 78%, консенсус
Резюме доказательств: нет исследований, непосредственно оценивающих влияние отказа от курения на течение заболевания. В одном исследовании риск развития MC значительно снизился с течением времени ( P = 0,017), что привело к снижению риска через пять лет после прекращения курения. 73 Однако, по сравнению с курильщиками, у бывших курильщиков риск MC не значительно ниже (OR 1,44; 95% CI: 0,76–2,72). 73- 76 , 78 , 80 , 82 В двух исследованиях у нынешних курильщиков MC развился более чем на десять лет раньше, чем у бывших или никогда не куривших. 77 , 84 Большинство исследований не показали различий в отношении клинических проявлений реакции на лечение, частоты спонтанных ремиссий и рецидивов заболевания или необходимости поддерживающего лечения 73 , 75 , 77 , 78 , 81 , 84- 89 (см. Также Приложение D, дополнительный материал). Только в ретроспективном анализе объединенных данных двух рандомизированных контролируемых испытаний (РКИ) текущее курение было связано со снижением способности достигать клинической ремиссии при лечении кортикостероидами (OR 0,31; 95% CI: 0,10–0,98). 90
Связано ли употребление наркотиков со значительным повышенным риском MC?
Положение 1.7. Хроническое или частое употребление ингибиторов протонной помпы (ИПП), нестероидных противовоспалительных препаратов (НПВП) или селективных ингибиторов обратного захвата серотонина (СИОЗС) связано с повышенным риском MC. Однако это не подразумевает причинно-следственной связи.
УЭ: низкий; GR: нет данных; согласие: 94%, консенсус
Резюме доказательств: лекарственно-индуцированная МК рассматривалась в ретроспективных исследованиях случай-контроль 54 , 81 , 82 , 91- 100, показывающее связь с использованием НПВП, ИПП и СИОЗС. Использование PPI было тесно связано с MC (OR 2,95, 95% CI: 1,82–4,80, I 2 = 99%), 54 , 81 , 82 , 91- 96 , 98- 100, особенно при непрерывном использовании в течение 4–12 месяцев (ОШ 4,69, 95% ДИ: 3,58–6,13). 98 Воздействие НПВП также было связано с повышенным риском MC (OR 2,40, 95% ДИ: 1,99–2,89, I 2 = 88%). 54 , 82 , 91- 95 , 97- 99 Комбинированное применение с ИПП может еще больше увеличить этот риск. 98 MC также были связаны с воздействием СИОЗС (OR 2,98, 95% ДИ: 2,35–3,78, I 2 = 90%) 54 , 81 , 82 , 91- 93 , 95 , 96 , 98 , 99 (см. Также Приложение D, дополнительный материал). Следует подчеркнуть, что применялись разные критерии «воздействия наркотиков» и рассматривались разные контрольные группы населения. Более того, в исследованиях отсутствует информация об эволюции клинических симптомов после воздействия препарата, отмены или повторного заражения, что затрудняет оценку причинной связи.
Следует ли отменить какой-либо препарат, потенциально связанный с началом МК?
Рекомендация 1.8: Мы предлагаем рассмотреть возможность отмены любых лекарств, у которых есть подозрение на хронологическую взаимосвязь между введением лекарств и началом диареи.
LE: очень низкий; GR: слабая в пользу; согласие: 97%, твердый консенсус
Резюме доказательств: всего 62 описания случаев и 13 исследований случай-контроль 97 , 101- 159 описаний MC, вызванных лекарством, были проанализированы для расчета так называемой «оценки вменяемости», описывающей вероятность причинно-следственной связи между воздействием лекарства и MC. ИПП были лекарствами, о которых чаще всего сообщали в отношении MC. Разрешение диареи и гистологическая нормализация после отмены ИПП сообщалось в четырех случаях при применении омепразола, 156 , 157 в 16 случаях при применении лансопразола 111- 113 , 119 , 123 , 124 , 129 , 138 , 141 , 142 , 146 , 150 , 153 , 154 , 160 и в одном случае с использованием эзомепразола. 157 Для рабепразола был опубликован только один случай клинического улучшения без гистологического контроля. 139 В 10 случаях 111 , 112 , 138 , 153 , 154 , 156 , 157 , 160переход на другой ИПП не привел к рецидиву диареи, что противоречит предположению о классовом эффекте ИПП. Одно исследование случай-контроль ясно продемонстрировало, что текущее и недавнее использование НПВП и ИПП было связано с повышенным риском MC по сравнению с никогда и прошлым использованием, особенно в случае непрерывного воздействия в течение 4–12 месяцев. 98 Это наблюдение подчеркивает клиническую значимость предполагаемой хронологической связи между употреблением наркотиков и началом МК.
Требуется ли у пациентов с МК специальная программа колоноскопического наблюдения, чтобы исключить колоректальный рак по сравнению с населением в целом?
Рекомендация 1.9: МК не увеличивает риск колоректального рака или аденомы. Специальная программа контрольной колоноскопии не рекомендуется.
УЭ: низкий; GR: сильно за; согласие: 100%, устойчивый консенсус
Резюме доказательств: только несколько исследований изучали, связано ли стойкое хроническое воспаление при MC с повышенным риском колоректального рака (CRC) или аденом. 60 , 71 , 80 , 161- 169 Метаанализ пяти исследований случай-контроль показал, что MC ассоциировался со сниженным риском CRC или аденомы по сравнению с контролем (объединенное OR 0,65, 95% CI: 0,33–1,28, I 2 = 19%; и OR 0,49). , 95% ДИ: 0,30–0,81, I 2 = 92% соответственно). В более крупной ретроспективной когорте 547 пациентов с MC (171 CC и 376 LC) CRC был обнаружен у пяти пациентов с CC (2,82%) и пяти пациентов с LC (1,33%). 163 MC был отрицательно связан с риском CRC и аденомы (OR 0,34, 95% ДИ: 0,16–0,73, p = 0,006; и OR 0,52, 95% ДИ: 0,50–0,76, p <0,001, соответственно) в течение среднего срок наблюдения 4,63 года. 163
Патогенез MC
Утверждение 2.1. Патогенез МК сложен и многофакторен. Он может включать люминальные факторы, нарушение иммунной регуляции и генетическую предрасположенность.
УЭ: низкий; GR: нет данных; согласие: 100%, устойчивый консенсус
Резюме доказательств: механизмы, участвующие в развитии MC, плохо изучены, а LE мало. Подробная информация по этому вопросу не входит в объем данного руководства. Текущие знания задействованных факторов кратко изложены в Приложении C (дополнительный материал).
Клинические проявления и качество жизни
Каковы наиболее частые симптомы MC?
Утверждение 3.1. Наиболее распространенным симптомом MC является хроническая водянистая диарея без крови, которая часто связана с сопутствующими симптомами, включая позывы на позывы к фекалии, ночной стул и недержание кала.
УЭ: умеренный; GR: нет данных; согласие: 97%, твердый консенсус
Резюме доказательств: преобладающим симптомом MC является хроническая водянистая некровавая диарея, о которой сообщили 84–100% пациентов в 22 исследованиях. В трети случаев начало диареи носило острый характер, 170- 173 и согласно европейскому проспективному регистру 174, сохраняется в течение шести месяцев до постановки диагноза у 43%. Такие симптомы, как частота стула, консистенция стула и общая продолжительность диареи, описаны в ряде исследований, включая крупное датское исследование с участием 539 пациентов, 13 в котором сообщалось в среднем о 6–7 испражнениях в день. Общие сопутствующие симптомы включали позывы к фекалии (55%), ночной стул (35,3%) и недержание кала (26,3%). Менее частыми жалобами с разной степенью распространенности среди исследований являются боли в животе, потеря веса и вздутие живота. 172 , 173 , 175 Шведское исследование 2004 г. с участием 199 пациентов с ЦП 173сообщили о средней потере веса 5 (4-8) кг; однако ранние исследования могли включать избранную популяцию, поскольку осведомленность о МК была ниже.
Следует ли исключать МК у пациентов, соответствующих критериям функционального заболевания кишечника с преобладающим подтипом диареи?
Положение 3.2: Диагноз MC следует исключать у пациентов, соответствующих критериям функционального заболевания кишечника, особенно при наличии факторов риска MC и / или при отсутствии ответа на терапию СРК (синдром раздраженного кишечника).
УЭ: умеренный; GR: нет данных; согласие: 93%, консенсус
Резюме имеющихся данных: MC имеет сходные симптомы и эндоскопические результаты с функциональными расстройствами кишечника, особенно при синдроме раздраженного кишечника с преобладанием диареи и хронической функциональной диарее. 176- 179 В двух метаанализах выявление основного диагноза MC было зарегистрировано у 9% (95% ДИ: 4,5–14,9%) среди пациентов с функциональными расстройствами с преобладанием диареи. 176 , 178 Однако не во всех исследованиях использовались общепринятые в настоящее время диагностические критерии MC, а также использовались разные критерии для определения функциональных расстройств кишечника, что привело к высокой гетерогенности результатов.
Нарушается ли качество жизни пациента, связанное со здоровьем (HRQoL), из-за МК?
Положение 3.3: HRQoL ухудшается у пациентов с MC в зависимости от активности и тяжести заболевания и сопутствующих сопутствующих заболеваний.
УЭ: умеренный; GR: нет данных; согласие: 100%, устойчивый консенсус
Резюме доказательств: MC может серьезно повлиять на качество жизни сердца, при этом исходный уровень качества жизни ниже, чем у пациентов с другими кишечными и проктологическими расстройствами. 180 Нарушение HRQoL было продемонстрировано как при активном CC, так и при LC, включая влияние на повседневную жизнь, беспокойство и благополучие, связанные с заболеванием. 2 , 8 , 181- 183 Однако HRQoL также может быть нарушен у пациентов с MC, достигших клинической ремиссии. 89 , 184 , 185
В популяционном исследовании 116 пациентов с активным КК имели снижение качества жизни HRQoL по сравнению с фоновой популяцией, тогда как пациенты с ремиссией получили аналогичные оценки. 186 HRQoL было нарушено у тех, у кого в среднем ≥3 стула / день или ≥1 водянистый стул / день. Таким образом, было предложено, чтобы ремиссия при CC должна определяться как в среднем <3 стула в день и в среднем <1 жидкий стул в день в течение одной недели регистрации. 187
В исследовании «случай-контроль», включавшем 212 пациентов с MC, все четыре измерения HRQoL (тяжесть симптомов, социальная функция, беспокойство, связанное с болезнью, общее самочувствие) были нарушены у пациентов с активным CC и LC. 184 При поперечном исследовании 151 пациента с MC 52 (34,4%) сообщили о симптомах типа СРК и имели более высокий уровень тревоги, депрессии и соматизации, а также снижение качества жизни. 179 В другом поперечном обследовании 129 пациентов с новым диагнозом MC было выявлено, что тяжесть утомляемости связана с симптомами типа СРК, психологической коморбидностью и ухудшением качества жизни с отрицательной корреляцией в показателях КЖС. 188В поперечном исследовании с участием 158 пациенток с MC женщины с сопутствующими симптомами СРК (55%) испытали худшее психологическое благополучие, чем те, у кого их не было. Кроме того, курение и ИПП были связаны с желудочно-кишечными симптомами и ухудшением психологического благополучия у пациентов с MC. 89 HRQoL оценивали в пяти РКИ, включая пациентов с РС 189- 194 и в двух РКИ, включая пациентов с ЦП. 192 , 195 Во всех семи РКИ HRQoL было заметно изменено на исходном уровне у пациентов как с CC, так и с LC, и улучшилось после лечения будесонидом. 196- 198
Существуют ли установленные показатели для измерения активности заболевания и клинической ремиссии при МК?
Положение 3.4: При отсутствии официально утвержденного показателя активности заболевания, активность заболевания и клиническую ремиссию при МК следует оценивать по критериям Хьортсванга (клиническая ремиссия: в среднем <3 стула в день и в среднем <1 жидкий стул в день в течение недельная регистрация).
УЭ: умеренный; GR: нет данных; согласие: 100%, устойчивый консенсус
Резюме доказательств: в отсутствие надежного биомаркера определение активности заболевания основывается на клинической активности заболевания. В клинических испытаниях MC использовались различные определения рецидива или клинической ремиссии, в основном основанные на частоте стула 191 , 199- 204 и табурет вес. 200 , 202 Уменьшение воспаления слизистой оболочки или истончение слоя коллагена также использовалось для оценки гистопатологического ответа в исследованиях, 195 , 199- 201 , 203, но корреляция между гистологией и клиническими симптомами слабая. 205
В шведском популяционном обследовании пациенты с РС, у которых в среднем <3 стула в день и в среднем <1 водянистый стул в день в течение одной недели регистрации симптомов, не оказывали или оказывали лишь незначительное влияние на их КЖ, и, следовательно, были определяется как находящийся в стадии ремиссии. 187 Напротив, пациенты с РС или ≥3 стула / день или ≥1 водянистый стул / день оказали значительное влияние на их КЖСР и, таким образом, были определены как имеющие активное заболевание. Это определение часто называют «критерием Хьортсванга» для активности заболевания.
Индекс активности болезни MC (MCDAI) был предложен на основе тех же методологических принципов, которые когда-то использовались для разработки индекса активности болезни Крона. 206 В общей сложности 162 пациента с МС заполнили анкету по симптомам и анкету HRQoL по воспалительному заболеванию кишечника (IBDQ). 180 Один исследователь поставил общую оценку тяжести заболевания (PGA) врачом по 10-балльной шкале на основе результатов опроса пациентов. Множественные линейные регрессии определили следующие симптомы, позволяющие лучше всего предсказать PGA: количество несформированного стула в день , наличие ночного стула , боли в животе , потеря веса , срочность фекалий инедержание кала . Затем эти симптомы были объединены во взвешенную формулу для создания MCDAI. MCDAI был умеренно связан с IBDQ (r = -0,62, p <0,001).
Ни «критерии Hjortswang», ни MCDAI не прошли формальную проспективную валидацию и не соответствуют новым требованиям Управления по санитарному надзору за качеством пищевых продуктов и медикаментов в отношении результатов клинических испытаний, сообщенных пациентом. 207 Однако «критерии Hjortswang» использовались в семи опубликованных клинических исследованиях, три из которых были РКИ, 193 , 195 , 203, которые представляют собой реальную внешнюю и проспективную проверку оценки в клинической практике.
Диагностика MC
Каков эндоскопический вид МК?
Положение 4.1. Эндоскопические данные все чаще обнаруживаются у пациентов с MC; однако они не являются конкретными.
УЭ: низкий; GR: нет данных; согласие: 95%, твердый консенсус
Резюме доказательств: в общей сложности было идентифицировано 80 информативных статей, в том числе 1582 пациента с эндоскопическими находками в MC, в том числе 756 пациентов с CC, 779 пациентов с LC и 47 пациентов с MC. 19 , 23 , 166 , 208 Макроскопически видимые поражения или изменения были зарегистрированы у 38,8% пациентов в различных частях толстой кишки, включая изолированные линейные изъязвления, псевдомембраны, нерегулярные сосудистые узоры, разрывы слизистой оболочки, эритему, отек, узловатость и поверхностные структурные изменения.
Несмотря на то, что существует большее количество публикаций по CC, количество опубликованных пациентов с CC и LC очень похоже. 208 Следовательно, нельзя сделать окончательного утверждения относительно того, могут ли результаты эндоскопии (и какие) быть более частыми для того или иного гистологического подтипа.
Каковы критерии гистологического диагноза СС?
Положение 4.2. Гистопатологическими критериями КК являются утолщенная субэпителиальная коллагеновая полоса размером ≥10 мкм в сочетании с увеличенным воспалительным инфильтратом в собственной пластинке. Критерии применимы к предметным стеклам, окрашенным гематоксилином и эозином (HE).
УЭ: умеренный; GR: нет данных; согласие: 89%, консенсус
Резюме доказательств: первоначальные гистологические критерии СС не оспаривались, но были разработаны некоторыми другими. 209 Наиболее характерной особенностью является утолщенная субэпителиальная коллагеновая полоса, превышающая 10 мкм. 210- 214 Повязка часто имеет неправильный более глубокий край и может содержать захваченные капилляры, эритроциты и воспалительные клетки. Очаговое повреждение поверхностного эпителия, включая отслоение от базальной мембраны, уплощение и истощение муцина, 205 , 210 , 212 , 215- 220, а также повышенное количество интраэпителиальных лимфоцитов (IEL). 210 , 211 , 215- 223 Это должно сочетаться с воспалительным инфильтратом собственной пластинки от легкой до умеренной степени, в котором преобладают плазматические клетки и лимфоциты, но также включают эозинофилы, 205 , 210 , 213- 217 , 219 , 223- 225 тучных клеток 213 и реже нейтрофилов. 212 , 214- 216 , 219- 221 , 224 , 226 Можно увидеть метаплазию клеток Панета 205 , 210 , 221 , 224 и иногда криптит. 212 , 216 , 220 , 221 , 224 , 227 Биопсии следует ориентировать вертикально, поскольку тангенциальное сечение может имитировать утолщение коллагеновой полосы. 228
Гистологические критерии основаны на окрашенных НЕ срезах. Дополнительные красители, такие как Van Gieson, Masson Trichrome или Sirius red, 219 , 220 , 229, могут быть полезны, поскольку подсвечивается коллагеновая полоса. Воспроизводимость гистологического диагноза CC у разных наблюдателей хорошая. 230 , 231
Каковы критерии гистологического диагноза ЦП?
Положение 4.3. Гистопатологическими критериями LC являются повышенное количество IEL ≥20 на 100 поверхностных эпителиальных клеток в сочетании с повышенным воспалительным инфильтратом в собственной пластинке и незначительным утолщением коллагеновой полосы (<10 мкм). Критерии применимы к предметным стеклам, окрашенным HE.
УЭ: умеренный; GR: нет данных; согласие: 100%, устойчивый консенсус
Резюме доказательств: LC был первоначально назван в 1989 г. 217, хотя был описан под названием MC в 1980 г. 232 Критерии были основаны на предметных стеклах, окрашенных HE. 217 Наиболее характерной особенностью LC является повышенное количество IEL в поверхностном эпителии ≥20 на 100 эпителиальных клеток. 1 , 3 , 4 , 7 , 233- 244 Подсчет следует проводить в поверхностном эпителии, и следует избегать участков, тесно связанных с лимфоидными агрегатами в собственной пластинке. 1 Видны очаговые и легкие повреждения поверхностного эпителия, включая уплощение, истощение муцина и вакуолизацию, хотя и не так заметно, как при CC. 1 , 3 , 167 , 218 , 220 , 236 , 237 , 240 , 242 , 245- 248 Это должно сочетаться с воспалительным инфильтратом в собственной пластинке слизистой оболочки от легкой до умеренной степени, в котором преобладают плазматические клетки и лимфоциты, 3 , 4 , 167 , 217 , 218 , 220 , 233 , 236 , 238 , 239 , 241 , 242 , 246- 254, но может также включать меньше эозинофилов и нейтрофилов. 3 , 217 , 220 , 248 , 250 , 254 , 255 Иногда наблюдается криптит 217 , 220 , 221 , 249 , 252 , 256 или метаплазия клеток Панета. 221 , 236 , 241 , 250 , 252
Дополнительное иммуногистохимическое окрашивание может быть полезным, особенно в пограничных случаях, поскольку выделение лимфоцитов облегчает подсчет. 1 , 3 , 6 , 244 , 257 Это может привести к чрезмерной диагностике, и было предложено использовать более высокие пороговые значения, когда подсчет выполняется на слайдах, окрашенных CD3. 258
Каковы критерии гистологического диагноза MCi ?
Положение 4.4: MCi включает неполный CC (CCi; определяется утолщенной субэпителиальной коллагеновой полосой> 5 мкм, но <10 мкм) и неполный LC (LCi; определяется> 10 IEL, но <20 IEL и нормальной коллагеновой полосой). У обоих типов наблюдается легкий воспалительный инфильтрат в собственной пластинке. Критерии применимы к предметным стеклам, окрашенным HE.
УЭ: низкий; GR: нет данных; согласие: 95%, твердый консенсус
Резюме доказательств: пациенты с симптомами MC, не полностью удовлетворяющими гистологическим критериям CC или LC, могут быть классифицированы как CCi или LCi. 1 , 6 , 237 Используются различные термины, включая MC, если не указано иное, 224 , 259 , 260 MC без обозначения, 261 пограничный LC 217 и малоклеточный LC. 251 , 262 Хотя клинические характеристики MC и MCi кажутся неразличимыми, 13 , 263 , 264 в одном исследовании сообщается, что у большей части пациентов с MCi наблюдается спонтанная ремиссия. 263При CCi субэпителиальная коллагеновая полоса составляет> 5 мкм, но <10 мкм. В LCi требуется от> 10 до <20 IEL. Воспалительный инфильтрат в собственной пластинке обычно мягкий, но состоит из клеток того же типа, что и в CC и LC.
В пограничных случаях рекомендуется использовать дополнительное специальное окрашивание или процедуру иммуногистохимического окрашивания в дополнение к окрашиванию HE. 265
Где следует брать биопсию у пациентов с подозрением на MC?
Рекомендация 4.5: Мы рекомендуем илеоколоноскопию с биопсией по крайней мере правой и левой части толстой кишки.
LE: высокий; GR: сильно за; согласие: 100%, устойчивый консенсус
Резюме доказательств: исследования, включающие большое количество пациентов с одновременной биопсией правой и левой толстой кишки, показывают характерные гистологические изменения MC с обеих сторон в 95–98%. 13 , 23 , 263 Точно так же небольшие исследования показали высокую согласованность. 18 , 45 , 46 , 205 , 211 , 266- 270 В исследованиях без строгого протокола биопсии сообщалось о меньшем количестве диагностических биопсий левой толстой кишки. 214 , 219 , 229 , 243 Одной биопсии из прямой кишки недостаточно. 10 , 214 , 215 , 219 , 220
Однако, поскольку полная илеоколоноскопия показана практически всем пациентам с хронической диареей, рекомендуется брать биопсию с правой и левой стороны толстой кишки.
Может быть целесообразно отправлять их в отдельно маркированных контейнерах, поскольку количество воспалительных клеток в нормальном поверхностном эпителии и собственной пластинке больше в правой толстой кишке. 233 , 271 Точно так же нормальная коллагеновая полоса, как сообщается, толще в сигмовидной и прямой кишках. 226 , 227 Особенно в пограничных случаях это может помочь патологам узнать, что биопсии взяты, например, с левой стороны, где клеточность обычно ниже, потому что это подтвердит диагноз, если патолог сомневается. По этим причинам экспертное мнение патологов, участвовавших в этом руководстве, склонялось к разделению контейнеров, хотя нет убедительных доказательств, подтверждающих это.
Необходим ли гистологический мониторинг у пациентов с MC?
Рекомендация 4.6: Мы не рекомендуем гистологический мониторинг пациентов с MC.
LE: очень низкий; GR: сильно за; согласие: 100%, устойчивый консенсус
Резюме доказательств: гистология постдиагностической активности заболевания описана, но гистологическая оценка ремиссии и рецидива не стандартизирована 171 , 195 , 199 , 203 , 215 , 241 , 247 , 263 , 272- 276, а корреляция между клинической активностью заболевания и гистологическими признаками очень слабая. 171 , 195 , 199 , 203 , 215 , 241 , 247 , 263 , 272- 276 В некоторых исследованиях происходит преобразование CC и LC. 263 , 273 , 275 В исследовании 283 пациентов гистологические особенности сохранялись в постдиагностических биопсиях до одного года у 77% с CC, 64% с LC и 45% с MCi, из которых 6%, 9% и 18 % соответственно преобразованы в другой подтип. Гистологические признаки нормализовались примерно у 10% и сохранялись в течение первого года у значительного числа пациентов, включая тех, у которых диарея разрешилась и не рецидивировала. 263
Полезен ли фекальный кальпротектин при MC?
Положение 4.7: Кальпротектин в фекалиях бесполезен для исключения или мониторинга MC.
УЭ: умеренный; GR: нет данных; согласие: 100%, устойчивый консенсус
Резюме данных: небольшие исследования продемонстрировали, что кальпротектин в фекалиях был немного, хотя и значительно, выше у пациентов с MC по сравнению с пациентами без органической причины диареи 277 и IBS. 278 Прогностическая ценность была низкой из-за большого совпадения. Wildt et al. продемонстрировали, что уровень кальпротектина в фекалиях был повышен у некоторых, но не у всех 21 пациента с активным КХ, и перекрывался между пациентами с активным и спокойным заболеванием и нормальным контролем. 279 Дальнейшие исследования продемонстрировали перекрывающиеся значения других фекальных биомаркеров, включая фекальный эозинофильный белок и катионный белок эозинофилов, 63 фекальный лактоферрин, 279 , 280 альфа-1-антитриптин, 281и триптаза, эозинофильный протеин X и миелопероксидаза. 282 Совершенно очевидно, что необходимы дополнительные исследования фекальных биомаркеров в МК, включая кальпротектин.
Следует ли обследовать пациентов с МК на целиакию?
Рекомендация 4.8: Мы рекомендуем скрининг на целиакию у пациентов с MC.
LE: высокий; GR: сильно за; согласие: 100%, устойчивый консенсус
Резюме доказательств: одно большое проспективное исследование продемонстрировало частоту глютеновой болезни у 3,3% пациентов с MC по сравнению с 0,4% в контрольной группе. 283 Показатели заболеваемости составляли от 2% до 4% в крупных когортных исследованиях, 13 , 284 в исследовании случай-контроль 76 и в одном патологическом реестре, включающем 3456 пациентов с MC, перенесших и гастроскопию, и нижнюю эндоскопию с биопсией. 285 Эти оценки больше, чем в фоновых популяциях, хотя и ниже, чем сообщалось в многочисленных ретроспективных исследованиях, в основном в более старых сериях случаев и неполных когортах. 28 , 88 , 163 , 166 , 170 , 172 ,173 , 286- 290 Целиакия в основном диагностировалась с помощью биохимических исследований, а не гистологии, и в большинстве исследований проводился скрининг только примерно половины пациентов. Развитие MC не было связано с потреблением глютена. 291
Следует ли обследовать пациентов с МК на диарею желчных кислот?
Положение 4.9. Обследование на диарею с желчными кислотами не является частью рутинного диагностического обследования пациентов с MC.
УЭ: низкий; GR: нет данных; согласие: 83%, консенсус
Рекомендация 4.10: Тестирование на диарею желчных кислот может быть рассмотрено у пациентов, у которых отсутствует ответ на лечение будесонидом.
УЭ: низкий; GR: сильно за; согласие: 82%, консенсус
Резюме доказательств: симптомы MC и диареи с желчью неразличимы, и эти два состояния сосуществуют. 13 , 292 , 293 Диагноз диареи желчной кислоты основывается на анализе таурина 75 гомотаурохолевой кислоты селеновой метки (SeHCAT) с радиоактивной меткой. SeHCAT для был проведен у 181 из 539 пациентов, включенных в большую когорту заболеваемости, а удержание (<10%) было снижено у 125. 13 Небольшие серии случаев, сообщающие о высокой частоте диареи желчной кислоты, вероятно, были смещены из-за направления. 292 , 293 Активный CC был связан с уменьшением обратного захвата желчных кислот подвздошной кишкой и нормализацией активности заболевания, увеличением удержания и нормализацией синтеза желчных кислот. 294Остается выяснить, является ли диарея желчной кислотой следствием воспаления в правой толстой кишке или даже терминальной подвздошной кишки или просто сопутствующим заболеванием как таковым. Экспрессия основного рецептора желчной кислоты была снижена в биоптатах толстой кишки пациентов с MC. 295 MC не был связан с предшествующей холецистэктомией. 296
Лечение
Эффективен ли будесонид для приема внутрь при ремиссии ССЗ?
Рекомендация 5.1.1: Мы рекомендуем пероральный будесонид для достижения ремиссии у пациентов с ХК.
УЭ: умеренный; GR: сильно за; согласие: 100%, устойчивый консенсус
Резюме доказательств:
Клинический ответ
Метаанализ, проведенный в 2017 году197, включал четыре рандомизированных плацебо-контролируемых исследования с участием 161 пациента с КК. 199- 201 , 203 После шести-восьми недель лечения объединенный анализ показал, что 81% (62/77) пациентов, получавших будесонид в дозе 9 мг / сут, достигли клинического ответа по сравнению с 36% (30/84) пациентов, получавших плацебо ( относительный риск (ОР) 2,98, 95% ДИ: 1,14–7,75; случайные эффекты). Этот анализ был статистически значимым для неоднородности ( p = 0,001, I 2 = 81%). После исключения выброса с необычно высокой скоростью реакции на плацебо, 203 я 2 статистики снизилась до 0% , а соответствующие клинические показатели ответа были 81% (38/47) и 17% (8/47) (ОР 4,56, 95% ДИ: 2,43–8,55). Вторичные конечные точки в этом исследовании 203включала оценку клинической ремиссии через восемь недель в соответствии с критериями активности болезни Hjortswang (в среднем <3 стула в день, с <1 водянистым стулом в день). Включение этого исследования в метаанализ с использованием этих данных привело к объединенной клинической ремиссии 81% (62/77) для будесонида по сравнению с 26% (22/84) для группы плацебо (ОР 3,10, 95% ДИ: 1,8. –5.3; случайные эффекты). Не было значительной неоднородности ( p = 0,186; I 2 = 37,7%) (см. Также Приложение D, дополнительный материал).
Гистологический ответ
Объединенный анализ гистологического ответа четырех исследований 197 включал в общей сложности 161 пациента с гистологической ремиссией, наступившей у 60/77 (78%) и 27/84 (32%) пациентов, получавших будесонид и плацебо, соответственно (ОР 2,68, 95 % ДИ: 1,37–5,24), которые продемонстрировали статистически значимый ответ.
Качество жизни
В одном исследовании, 201 подтвержденные желудочно - кишечный тракт Индекса качество жизни (GIQLI) было использовано для измерения качества жизни на исходном уровне и после шести недель лечения с Будесонидами или плацебо. Полная оценка качества жизни была рассчитана для 29 участников испытания (будесонид: n = 17; плацебо: n = 12). Средний исходный показатель GIQLI составлял 67 в группе будесонида и 86 в группе плацебо. После шести недель лечения средний показатель GIQLI не изменился в группе плацебо (с 86 до 88), но значительно увеличился в группе будесонида (с 67 до 92; p <0,001).
Эффективен ли будесонид для приема внутрь при ремиссии ЦП?
Рекомендация 5.1.2: Мы рекомендуем пероральный будесонид для достижения ремиссии у пациентов с ЦП.
УЭ: низкий; GR: сильно за; согласие: 100%, устойчивый консенсус
Резюме доказательств:
Клинический ответ
Объединенный анализ клинического ответа в трех исследованиях 192 , 195 , 297 показывает статистически значимое преимущество будесонида по сравнению с плацебо. Клиническая ремиссия была отмечена у 84% (43/51) пациентов с будесонидом и 43% (19/44) пациентов, получавших плацебо (ОР 1,89, 95% ДИ: 1,3–2,7), без гетерогенности ( I 2 = 0%) (см. также Приложение D, дополнительный материал).
Гистологический ответ
Объединенный анализ гистологического ответа показал статистически значимое преимущество будесонида по сравнению с плацебо. Гистологический ответ был отмечен у 78% пациентов с будесонидом по сравнению с 33% пациентов, получавших плацебо (два исследования; 39 участников; ОР 2,44, 95% ДИ: 1,13–5,28, I 2 = 0%). 196
Качество жизни
В кратком опросе о состоянии здоровья, состоящем из 36 пунктов, исходные показатели были снижены по сравнению с нормальными значениями как для физического, так и для психического здоровья. В группе будесонида средний суммарный физический балл увеличился с 42,0 на исходном уровне до 49,7 после шести недель лечения, в то время как средний умственный суммарный балл не изменился со значением 46,5 на исходном уровне и 46,9 после шести недель 192 В группе плацебо, средний балл по сумме физических упражнений увеличился с 44,1 на исходном уровне до 48,0 после шести недель лечения, в то время как средний балл по сумме умственных способностей не изменился, со значением 49,0 на исходном уровне и 49,1 после шести недель. 192
Эффективен ли будесонид для приема внутрь для поддержания ремиссии ССЗ?
Рекомендация 5.2.1: Мы рекомендуем пероральный будесонид для поддержания ремиссии у пациентов с ХК.
УЭ: умеренный; GR: сильно за; согласие: 94%, консенсус
Резюме доказательств:
Поддержание клинического ответа
В трех исследованиях 191 , 193 , 272 пациента с ХК, достигшие клинического ответа на открытый будесонид, были рандомизированы для непрерывного лечения будесонидом или плацебо. Объединенный анализ трех исследований показал, что 68% (57/84) пациентов, получавших будесонид, сохраняли ремиссию в соответствующих конечных точках исследования, тогда как только 20% (18/88) пациентов, получавших плацебо, сохраняли ремиссию (ОР 3,30, 95% ДИ : 2.13–5.09). 197По истечении шести месяцев больше пациентов, получавших будесонид, чем плацебо, сохранили свой клинический ответ (75% против 25%). Результаты двух рандомизированных клинических испытаний показали, что поддерживающая терапия будесонидом 6 мг в день в течение шести месяцев приводила к снижению риска клинического рецидива (ОР 0,34, 95% ДИ: 0,19–0,6). 197 Более низкая доза будесонида (3 мг в день, чередуя с 6 мг в день) в течение 12 месяцев показала аналогичную эффективность в поддержании клинического ответа (см. Также Приложение D, дополнительный материал). В ретроспективном исследовании 75 пациентов с ХК только 20% требовались дозы будесонида 6 мг / сут или более для поддержания клинической ремиссии. 85
Поддержание гистологического ответа
В двух исследованиях 191 , 272, 25 пациентов, получавших будесонид с сохраненным клиническим ответом, прошли контрольную колоноскопию или ректороманоскопию в конце шести месяцев лечения. Из них 19 пациентов также сохранили свой гистологический ответ, что составляет 48% (19/40) исходной когорты пациентов, рандомизированных для приема будесонида. Для сравнения, 19 пациентов, получавших плацебо с сохраненным клиническим ответом, также прошли контрольную колоноскопию или ректороманоскопию в конце шести месяцев лечения. Шесть из этих пациентов, представляющих 15% (6/40) исходной когорты пациентов, рандомизированных для приема плацебо, имели устойчивый гистологический ответ. Объединенный ОР для поддержания гистологического ответа составил 3,17 (95% ДИ: 1,44–6,95). Это не было значимым для неоднородности (p = 0,60, I 2 = 0%). 197
Эффективен ли будесонид перорально для поддержания ремиссии ЦП?
Рекомендация 5.2.2: Мы предлагаем пероральный будесонид для поддержания ремиссии у пациентов с ЦП.
LE: очень низкий; GR: слабая в пользу; согласие: 84%, консенсус
Резюме доказательств: нет РКИ, оценивающих эффективность будесонида для поддержания ремиссии при ЦП. Однако, учитывая сходство этого заболевания с CC, будесонид использовался для поддержания ремиссии при LC в клинической практике. Мнение специалистов свидетельствует в пользу использования этого препарата для поддержания клинической ремиссии при ЦП.
Безопасен ли будесонид при лечении МК?
Положение 5.3.1. При приеме будесонида в MC нет повышенного риска серьезных нежелательных явлений.
УЭ: низкий; GR: нет данных; согласие: 100%, устойчивый консенсус
Резюме доказательств: пять из семи РКИ CC сообщили о доле пациентов, у которых возникло хотя бы одно нежелательное явление. 191 , 193 , 201 , 203 , 272 Объединенные данные о нежелательных явлениях, независимо от того, было ли исследование индукционным или поддерживающим, не показали статистически значимых различий в частоте нежелательных явлений между будесонидом и плацебо. 197Сорок девять процентов (68/140) пациентов, получавших будесонид, и 42% (63/150) пациентов, получавших плацебо, испытали по крайней мере одно нежелательное явление (пять исследований, 290 пациентов; ОР 1,18, 95% ДИ: 0,92–1,51) . Семь процентов (10/140) и 7% (11/150) пациентов, которым вводили будесонид и плацебо, соответственно, прекратили лечение из-за побочных эффектов (пять исследований, 290 пациентов; ОР 0,97, 95% ДИ: 0,43–2,17). Серьезные побочные эффекты наблюдались редко: 1% (1/84) пациентов, получавших будесонид, и 1% (1/91) пациентов, получавших плацебо, испытывали одно (четыре исследования, 175 пациентов; ОР 1,11, 95% ДИ: 0,15–8,01) .
О нежелательных явлениях сообщалось в двух РКИ LC. 192 , 195 В одном исследовании шесть нежелательных явлений произошли у двух пациентов (10%) в группе будесонида по сравнению с девятью нежелательными явлениями у трех пациентов (15%) в группе плацебо (ОР 0,63, 95% ДИ: 0,12–3,41. ). 192 В другом РКИ у 47,4% (9 из 19) в группе будесонида и у 42,1% (8 из 19) в группе плацебо наблюдались нежелательные явления. 195
Связано ли длительное применение будесонида внутрь при МК с повышенным риском остеопороза?
Положение 5.3.2. Риск остеопоротических переломов костей, по-видимому, не увеличивается у пациентов с МК, получавших будесонид, хотя длительное применение может быть связано со снижением минеральной плотности костей.
УЭ: низкий; GR: нет данных; согласие: 97%, твердый консенсус
Резюме доказательств: данные о влиянии будесонида на минеральную плотность костной ткани в течение длительного времени получены в результате его использования при других заболеваниях. Средняя доза будесонида 8,5 мг / день (диапазон от 6 до 9 мг / день) в течение двух лет вызвала больше изменений минеральной плотности костей (потеря> 2% в год), чем отсутствие лечения кортикостероидами у пациентов с болезнью Крона в стадии ремиссии. . 298 Однако в исследовании случай-контроль лечение будесонидом в дозе около 3 мг / день не было связано с повышенным риском перелома. 299 Пероральный будесонид (6 мг / сут в течение трех лет) плюс урсодезоксихолевая кислота для лечения пациентов с первичным билиарным циррозом также ассоциировался со снижением плотности костной массы, независимо от стадии заболевания печени. 300
Одно исследование с участием пациентов с MC ( n = 50) не показало значимых различий в минеральной плотности костной ткани по сравнению с контрольной группой ( n = 49) того же возраста и пола: 58% остеопороза и остеопении в MC по сравнению с 39% в контрольной группе. 79 Однако размер выборки был недостаточным, а статистическая мощность - низкой. Кумулятивная доза будесонида была связана с более низкой минеральной плотностью костей и Т-показателем в области бедра, с пороговым значением 2500 мг будесонида для прогнозирования остеопении. Маркеры образования кости P1NP (Pro-N-концевой пептид проколлаген типа 1) и костная щелочная фосфатаза были ниже у пациентов с MC, чем в контрольной группе, что свидетельствует о дисфункции остеобластов из-за системного действия будесонида или самого заболевания. В недавнем исследовании случай-контроль301 не наблюдалось увеличения числа остеопоротических переломов в целом, но наблюдалось умеренное изолированное влияние будесонида на риск переломов позвоночника, в основном у более молодых пациентов.
Эффективен ли месалазин при МК?
Рекомендация 5.4: Мы не рекомендуем лечение месалазином у пациентов с МК для индукции ремиссии. Нет исследований на техническое обслуживание.
УЭ: низкий; GR: сильный против; согласие: 94%, консенсус
Резюме доказательств: в плацебо-контролируемых рандомизированных исследованиях было показано, что месалазин неэффективен и уступает лечению будесонидом в CC 203 и LC. 195 Частота ремиссии составила 80%, 44% и 38% после восьми недель лечения будесонидом, месалазином и плацебо, соответственно, у пациентов с CC, 203 и 79%, 63% и 42%, соответственно, у пациентов с LC. 195 Эти результаты подтверждаются реальным опытом более крупных когорт, сообщавших о клиническом ответе на месалазин у 4/28 с CC, 1/9 с LC и 1/6 с MCi 13 из 15 из 33 с LC 170 и у 12 из 31 с CC. 173В других сериях случаев сообщалось об ответе на месалазин примерно у половины пациентов с ХК и ЦП. 272 , 302- 304 Напротив, месалазин был эффективен почти у всех пациентов в открытом исследовании месалазина +/- холестирамина. 305
Есть ли роль субсалицилата висмута в MC?
Рекомендация 5.5. Недостаточно доказательств, чтобы рекомендовать субсалицилат висмута пациентам с MC.
LE: очень низкий; GR: сильный против; согласие: 92%, консенсус
Резюме доказательств: эффект лечения субсалицилатом висмута в течение восьми недель изучался в одном открытом исследовании с 13 пациентами с LC или CC. 274 Клиническая ремиссия была зарегистрирована у 11, а гистологические аномалии разрешились у девяти из 13. В ретроспективно собранном случае сообщалось о влиянии висмута у 10 из 55 пациентов с ЦП (45,5%) и у 21 из 76 пациентов с ХК (63,6%). серии. 302 В общей сложности 23% из 22 пациентов с ЦП определили, что ретроспективно сообщили о прекращении диареи, 288 но гистологические критерии составляли 10 IEL на 100 эпителиальных клеток.
Есть ли роль лоперамида в MC?
Рекомендация 5.6. Недостаточно доказательств, чтобы рекомендовать использование лоперамида при MC. Учитывая документально подтвержденный эффект у пациентов с хронической диареей, экспертное мнение благоприятствует применению этого препарата при легких формах заболевания.
LE: очень низкий; GR: сильно за; согласие: 100%, устойчивый консенсус
Резюме доказательств: две большие ретроспективные серии случаев сообщили об ответе или ремиссии у 49 из 69 пациентов с CC 173 и у 47 из 67 пациентов с LC. 170 Большая ретроспективная когорта из 539 пациентов с MC сообщила о субъективном эффекте лоперамида у 46/77 пациентов с MC. 13 В нескольких когортах или меньших сериях сообщалось о полном или почти полном купировании диареи у 18–57% пациентов с MC, получавших лоперамид. 288 , 304 Лоперамид доказал свою эффективность и безопасность в нескольких рандомизированных плацебо-контролируемых исследованиях у пациентов с хронической диареей, в частности, при отмене недержания кала. 306- 309
Эффективны ли связывающие желчные кислоты агенты при MC?
Рекомендация 5.7: Пациентам с МК и диареей желчных кислот мы предлагаем лечение препаратами, связывающими желчные кислоты.
LE: очень низкий; GR: слабая в пользу; согласие: 100%, устойчивый консенсус
Резюме доказательств: большое проспективное когортное исследование продемонстрировало, что желчная кислотная диарея с диагнозом SeHCAT сосуществует с MC с предполагаемой распространенностью примерно 14%, и 84 из 167 пациентов, получавших холестирамин, сообщили о субъективном прекращении диареи. 13 Это согласуется с двумя большими сериями случаев, в которых сообщается об эффекте холестирамина у 26 из 44 пациентов с CC 170 и у 26 из 46 пациентов с LC. 173 Открытое контролируемое испытание продемонстрировало очень высокий уровень ответа на холестирамин 305, как и Ung et al. у пациентов с КК как с сопутствующей диареей желчных кислот, так и без нее. 293 О влиянии холестирамина также сообщалось в других небольших сериях случаев. 273 , г.288 , 302 Таким образом, имеющиеся данные показывают, что диарея желчных кислот сосуществует с MC у значительного числа пациентов, и что холестирамин может быть эффективным у пациентов с сосуществующими MC и диареей желчных кислот.
Есть ли роль антибиотиков в MC?
Рекомендация 5.9. Недостаточно доказательств, чтобы рекомендовать антибиотики для лечения МК.
LE: очень низкий; GR: сильный против; согласие: 100%, устойчивый консенсус
Резюме доказательств: антибиотики для индукции и поддержания ремиссии MC не исследовались в контролируемых исследованиях. Лишь в нескольких ретроспективных сериях случаев сообщалось об исходах MC после лечения антибиотиками. В ретроспективной серии из 161 пациента с РС эффективность различных антибиотиков (метронидазол, эритромицин и пенициллин) составила до 60%. 170 В другой ретроспективной когортной серии из 199 пациентов с ЦП 14/23 и 2/5 ответили на метронидазол и норфлоксацин. 173В обоих исследованиях не сообщалось об определении ответа, сопутствующем лечении, дозировке или частоте рецидивов. Наконец, в большой последовательной когорте из 539 пациентов с MC, 6/33 пациентов ответили на антибиотики; однако измерение эффекта не было определено, а продолжительность лечения и выбранные антибиотики не сообщались. 13
Есть ли роль пробиотиков в MC?
Рекомендация 5.10: Мы не рекомендуем использовать пробиотики для лечения MC.
УЭ: низкий; GR: сильный против; согласие: 100%, устойчивый консенсус
Резюме доказательств: было опубликовано только одно плацебо-контролируемое испытание пробиотиков в сравнении с плацебо. В индукционном исследовании с размером выборки 29, Lactobacillus acidophilus и Bifidobacterium animalis subs Lactis не превзошли плацебо. 194 В другом рандомизированном, но открытом исследовании изучали эффект пробиотика VSL # 3 по сравнению с месалазином. Двадцать четыре пациента выполнили исследование. В группе VSL # 3 было продемонстрировано значительное снижение массы стула через восемь недель ( p = 0,03), но не наблюдалось изменений в частоте стула. 310
Есть ли роль преднизолона в MC?
Рекомендация 5.11: Мы не рекомендуем использовать преднизолон или другие кортикостероиды, кроме будесонида, для лечения МК.
УЭ: низкий; GR: сильный против; согласие: 100%, устойчивый консенсус
Резюме доказательств: существует только одно плацебо-контролируемое исследование преднизолона. Продолжительность лечения была очень короткой, размер выборки был небольшим (12 пациентов), а преднизолон не имел значимого эффекта. 202 В одном открытом небольшом испытании и в нескольких ретроспективных когортных исследованиях сообщалось о положительном эффекте преднизолона; однако частота рецидивов была высокой. 170 , 173 , 288 , 311 , 312 В открытом ретроспективном исследовании беклометазона дипропионат изучался как синтетический кортикостероид с местным высвобождением толстой кишки у 30 пациентов с MC, показав уровень ответа 80% и уровень ремиссии 67%. 313
Есть ли роль иммуномодуляторов и биопрепаратов в лечении пациентов с MC?
Рекомендация 5.12: Мы рекомендуем лечение тиопуринами, препаратами противоопухолевого фактора некоза (TNF) или ведолизумабом у отдельных пациентов с MC, которые не реагируют на будесонид, чтобы вызвать и поддерживать клиническую ремиссию. Мы не рекомендуем использовать метотрексат пациентам с MC.
УЭ: низкий; GR: сильный; согласие: 97%, твердый консенсус
Резюме доказательств:
Азатиоприн / 6-меркаптопурин
Эффект тиопуринов на MC был оценен в нескольких ретроспективных сериях случаев, включая от девяти до 49 пациентов MC, которые обычно были стероидозависимыми или рефрактерными. Сообщенные показатели долгосрочного ответа, позволяющие прекратить прием кортикостероидов, варьировались от 28% до 89%. 314- 316
Ретроспективный анализ 49 пациентов (43 на азатиоприне и шесть на меркаптопурине) продемонстрировал полный или частичный ответ у 43% и 22%, соответственно, тогда как прекращение терапии из-за побочных эффектов произошло у 17 пациентов (35%). 317
Метотрексат
Метотрексат был оценен в ретроспективном анализе с участием 19 пациентов с MC, из которых 16 (84%) показали полный или частичный клинический ответ. 318 Другая серия из 12 пациентов сообщила о полном ответе у семи, частичном ответе у двух пациентов и отсутствии ответа у трех пациентов. 317 Только в одном исследовании проспективно оценивалось влияние метотрексата у пациентов с непереносимостью будесонида или невосприимчивыми к нему. Здесь ни один из девяти включенных пациентов не достиг клинической ремиссии. 319
Биологические препараты
Агенты против TNF при MC были изучены в небольших сериях 320 , 321 и единичных случаях. 322- 324 У четырех пациентов с МК с тяжелыми симптомами, не поддающимися стандартной медикаментозной терапии, инфликсимаб или адалимумаб привели к длительной клинической ремиссии в трех случаях (два - адалимумаб и один - инфликсимаб). Один пациент, получавший адалимумаб, рано потерял ответ и был направлен на колэктомию. 320 Münch et al. сообщили о трех пациентах с КК, получающих адалимумаб в качестве терапии третьей линии. 321 Двое из них достигли клинической ремиссии на шестой неделе, а одному пришлось прекратить прием из-за побочных эффектов, несмотря на клинический ответ. Самая большая серия включала 18 пациентов (16 CC, два LC), получавших адалимумаб или инфликсимаб. 323 На 12-й неделе девять пациентов достигли ремиссии и шесть ответили на лечение.
Ведолизумаб изучался на международной серии клинических случаев с участием 11 пациентов (пять LC, шесть CC), которые не ответили на другие методы лечения, включая агенты против TNF. 325 После трех инфузий клиническая ремиссия наблюдалась у пяти пациентов (два LC и три CC), из которых три оставались хорошо на поддерживающей терапии в течение средней продолжительности 13 месяцев. В других сериях случаев сообщалось об успешном применении ведолизумаба для вызывания ремиссии MC. 326- 328
Есть ли роль в хирургии MC?
Рекомендация 5.13: Хирургическое вмешательство можно рассматривать у отдельных пациентов как последний вариант, если вся медикаментозная терапия не дает результатов.
LE: очень низкий; GR: слабый; согласие: 100%, устойчивый консенсус
Резюме доказательств: научные данные о хирургическом лечении МК получены только из нескольких отчетов о случаях. 329- 332 В одной серии случаев, опубликованной в 1995 г., сообщалось о девяти пациентках с РС, которые не ответили на лечение (ни одна из них не получала будесонид, иммуномодуляторы или биопрепараты). Илеостомия была выполнена восьми пациентам, а сигмоидостомия - одному пациенту. В послеоперационном периоде диарея прекратилась у всех пациентов; однако клинические симптомы возобновились после восстановления непрерывности кишечника.
В сообщении о клиническом случае в 2000 г. описан пациент с РС, который успешно прошел курс тотального проктоколэктомии и анального анастомоза подвздошной кишки. 332 В двух отчетах о случаях, когда пациенты с РС не отвечали на будесонид 331 или адалимумаб, 330 симптомов улучшились после временной петлевой илеостомии, но возобновились после восстановления непрерывности кишечника. В одном отчете о клиническом случае описан пациент с РС, перенесший колэктомию после неэффективности адалимумаба, но о результатах не сообщалось. 320
Терапевтическое ведение МК
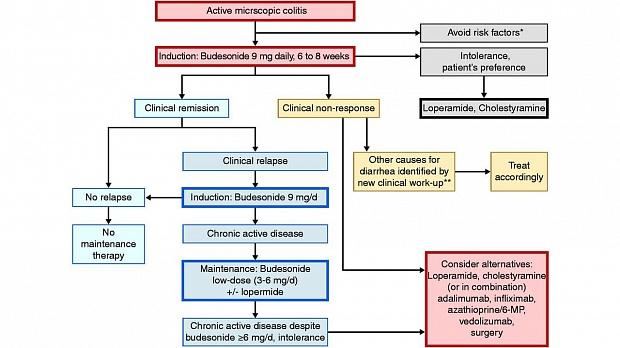
На основании имеющихся данных и мнений экспертов предложен алгоритм лечения МК ( рис.). Этот алгоритм подтверждается высоким уровнем согласия среди группы рекомендаций (полностью согласны 64,3%, согласны 35,7%). Для пациентов с активной MC пероральный будесонид, который в настоящее время является единственным лицензированным препаратом для лечения MC, должен быть медикаментозной терапией выбора. В случае хронического активного заболевания рекомендуется длительное лечение будесонидом перорально с минимально возможной дозой до тех пор, пока это необходимо. Вопрос о отмене будесонида следует обсудить с пациентом и решить в индивидуальном порядке. В случае длительного лечения будесонидом, добавление кальция / витамина D и мониторинг минеральной плотности костей можно рассматривать в индивидуальном порядке, особенно у пациентов с дополнительными факторами риска остеопороза. При необходимости можно использовать лоперамид.
Рис. 1. Лечебный алгоритм микроскопического колита в клинической практике.
* Курение, НПВП, ИПП.
** Например, диарея с желчью, глютеновая болезнь.
Выводы и перспективы на будущее
Эти руководящие принципы EMCG / UEG содержат утверждения и рекомендации, основанные на фактических данных, по основным аспектам клинического ведения MC. Основная цель и потенциал этих рекомендаций - повысить осведомленность о предположительно недооцененном состоянии здоровья и улучшить медицинское обслуживание и результаты лечения пациентов. Необходимо широкое распространение этих рекомендаций для облегчения их широкого использования и внедрения в клиническую практику. Было выявлено несколько неудовлетворенных потребностей, в том числе лучшее понимание естественного течения и патофизиологических механизмов заболевания, надежные неинвазивные биомаркеры, проверенные инструменты для оценки активности заболевания и новые методы лечения. Эти пробелы должны быть устранены с помощью высококачественных фундаментальных исследований и хорошо спланированных клинических испытаний.
Благодарности
Руководящий комитет (SM, AMü, DG, YZ, GET, AMK, SW) организовал рабочие группы и разработал предварительный список тем для обсуждения. Все авторы систематически анализировали литературу, составляли утверждения и рекомендации, а также давали оценки GRADE. Все авторы и члены консенсусной группы проголосовали за заявления и рекомендации. Затем руководящий комитет подготовил первоначальный вариант рукописи, который был рассмотрен, отредактирован и одобрен всеми авторами и членами консенсусной группы. Впоследствии он был предоставлен всем членам для окончательных комментариев перед отправкой для публикации. Соавторы: Nadine Steubesand и Franziska Dambon, Clinical Guideline Services, Киль, Германия. Эти руководящие принципы были разработаны с разумной тщательностью и с учетом всех имеющихся у авторов знаний на момент подготовки. Они предназначены для оказания помощи медицинским работникам и смежным профессионалам в области здравоохранения в качестве образовательного инструмента для предоставления информации, которая может помочь им в оказании помощи пациентам. Пациенты или другие члены сообщества, использующие эти рекомендации, должны делать это только после консультации со специалистом в области здравоохранения и не должны принимать эти рекомендации за профессиональные медицинские рекомендации. Эти рекомендации не должны заменять обращение к профессиональному врачу и специалисту по здоровью. Эти рекомендации могут применяться не ко всем ситуациям, и их следует интерпретировать в свете конкретных клинических ситуаций и наличия ресурсов. Каждый врач должен адаптировать эти рекомендации к местным нормам и индивидуальным условиям и потребностям каждого пациента. Информация, содержащаяся в этих рекомендациях, не считается полной, актуальной или точной, а также не может рассматриваться как включающая все надлежащие методы лечения или методы ухода или как юридический стандарт ухода. UEG не дает никаких гарантий, явных или подразумеваемых, в отношении этих руководящих принципов и не может нести ответственность за любой ущерб, возникший в результате применения этих руководящих принципов, в частности, за любые убытки или ущерб (прямые или косвенные), возникшие в результате лечения, основанного на руководство, данное здесь. UEG не несет ответственности в максимальной степени, допустимой в соответствии с применимыми законами, за любой контент, доступный на таких внешних веб-сайтах, к которому можно получить доступ, используя ссылки, указанные в данном документе.
.













.jpg)





.png)

















Комментарии