- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Эзофагит, вызванный вирусом простого герпеса (герпетический эзофагит, герпес-эзофагит) классификация
Анонс:
-min.jpg)
Полный текст статьи:
Этиология:
Как правило, этиологический фактор – ВПГ (вирус простого герпеса) типа 1, хотя сообщалось и о ВПГ типа 2.
Факторы риска:
- · Нарушения иммунитета,
- · Трансплантации органов,
- · Пересадка костного мозга [5, 10].
Патогенез:
Герпетический эзофагит является в основном следствием реактивации ВПГ с распространением вируса в пищевод:
- · через блуждающий нерв или
- · путем прямого проникновения инфекции из полости рта в пищевод.
Клиническая картина:
- · Одинофагия и/или дисфагия,
- · Лихорадка и загрудинная боль - в 50% случаев,
- · Возможны сопутствующие herpes labialis или язвы ротоглотки.
Диагностика:
Диагноз герпетического эзофагита основывается, как правило, на заключении эндоскопического исследования, выводы которого подтверждаются гистологически.
Эндоскопическая диагностика:
- · Поражения, обычно в виде неглубоких изъязвлений менее 2 см в диаметре, вовлекают слизистую оболочку средне- и нижнегрудного отделов пищевода.
- · Эти язвы четко отграничены от окружающей слизистой оболочки и имеют вид «кратера», покрытого желтоватым налетом, могут располагаться цепочкой; кроме того, может выявляться циркулярный эрозивный эзофагит.
Патоморфологическая диагностика:
- · Биоптаты должны быть взяты из края изъязвления, где скорее всего будут наблюдаться признаки вирусного цитопатического действия.
- · При гистологическом исследовании отмечаются многоядерные гигантские клетки с ядрами в виде «матового стекла» и эозинофильными включениями.
- · Дополнительное обследование может предусматривать иммуногистохимический анализ на гликопротеины ВПГ [6].
Эндоскопическая классификация герпес-эзофагита:
-min.png) | 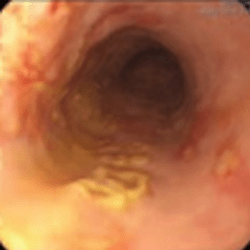 |
I степень
Описание: мелкие штампованные дефекты с приподнятыми краями и желтоватым налетом
-min-min.jpg)
Локализация: средняя и нижняя трети пищевода |
 | -min.png) |
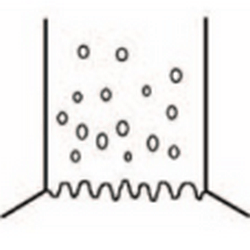
II степень
Описание: мелкие штампованные дефекты без приподнятых краев и без характерного желтоватого оттенка

Локализация: средняя и нижняя трети пищевода |
 | -min.png) |
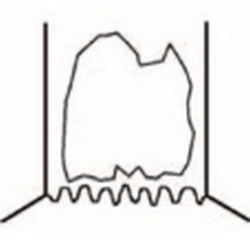
III степень
Описание: множественные сливающиеся язвенные дефекты
Локализация: протяженное поражение пищевода |
Лечение:
Лечение при ВПГ-эзофагите зависит от патологии, лежащей в основе иммунного дефицита.
Пациенты без нарушения иммунитета:
Спонтанное выздоровление чаще всего наблюдается в течение 1–2 недель у больных без нарушения иммунитета, хотя некоторые из них могут реагировать более быстро, если приступить к терапии с короткого курса перорального применения ацикловира 200 мг 5 раз в сутки или по 400 мг 3 раза в день в течение 1–2 недель [6, 11].
Пациенты с нарушениями иммунитета:
- · Такие пациенты должны получать лечение, начиная с курса перорального приема ацикловира 400 мг 5 раз в день в течение 2–3 недель.
- · Может быть также назначен фамицикловир 500 мг 3 раза в день или
- · валацикловир по 1 г 3 раза в сутки.
- · Больным с тяжелой одинофагией может потребоваться госпитализация для парентерального введения ацикловира 5 мг/кг 3 раза в день в течение 1–2 недель. Тех, кто демонстрирует быстрое улучшение, можно перевести на пероральную терапию.
Отсутствие эффекта от вышеописанного лечение:
Пациенты, которые не реагируют на лечение, вероятно, заражены штаммом вируса, устойчивого к воздействию ацикловира в результате мутаций в генах тимидинкиназы или ДНК-полимеразы ВПГ. Вирусы с мутациями тимидинкиназы, как правило, обладают перекрестной устойчивостью к другим препаратам этого класса. В этом случае вариантом может быть терапия фоскарнетом [6].
 Вам может быть интересно:
Вам может быть интересно:Список литературы:
Статьи по теме
Рекомендуемые статьи
Эластография при эндосонографии (ЭУС или эндоУЗИ)
Эластография (эластосонография) – метод виртуальной пальпации (технология улучшенной визуализации при ЭУС диагностике), позволяющий дифференцировать злокачественные и доброкачественные поражения лимфоузлов. Основана на принципе, что более мягкие ткани при сжатии легче деформируются, это позволяет объективно оценить консистенцию ткани, показать различия в плотности между нормальными и патологически измененными тканями.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.













.jpg)





.png)
















Комментарии