- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Изменения слизистой оболочки желудка, связанные с применением ингибиторов протонной помпы
Полный текст статьи:
Изменения слизистой оболочки желудка, связанные с применением ингибиторов протонной помпы
Цитирование: Kim GH. Proton Pump Inhibitor-Related Gastric Mucosal Changes. Gut Liver. 2021 Sep 15;15(5):646-652. doi: 10.5009/gnl20036. PMID: 32327613; PMCID: PMC8444106.
ВВЕДЕНИЕ
Ингибиторы протонной помпы (ИПП) с момента их появления в конце 1980-х годов используются во всем мире для лечения кислотозависимых заболеваний ЖКТ, таких как гастроэзофагеальная рефлюксная болезнь (ГЭРБ) и пептическая язва. Их также применяют профилактически для предотвращения повреждения слизистой оболочки желудка и двенадцатиперстной кишки, вызванного приемом нестероидных противовоспалительных препаратов (НПВП). ИПП являются наиболее мощными ингибиторами секреции желудочного сока, доступными в настоящее время. Высокая эффективность и низкая токсичность ИПП в сочетании с высокой распространенностью ГЭРБ и НПВП-ассоциированных повреждений ЖКТ привели к тому, что они стали одними из наиболее часто назначаемых препаратов1. ГЭРБ является хроническим заболеванием, и у большинства больных наблюдается симптоматическое течение, рецидивирующее в случае прекращения терапии ИПП. Таким образом, многим пациентам с ГЭРБ требуется постоянная поддерживающая терапия ИПП2.
Важная проблема при длительном применении ИПП заключается в том, что эти препараты повышают уровень пептидного гормона гастрина3 в результате компенсаторного ответа G-клеток антрального отдела на пониженную кислотность желудочного сока. Гастрин оказывает трофическое действие на всю ткань желудочно-кишечного тракта, в том числе как на париетальные, так и на энтерохромаффиноподобные (ECL) клетки, распределенные по всей кислотопродуцирующей слизистой оболочке4. Сообщалось, что длительное применение ИПП также вызывает гистопатологические изменения, такие как протрузия (выпячивание) париетальных клеток в просвет железы и кистозное расширение фундальных желез желудка5-8 . Недавно были зарегистрированы эндоскопические признаки, характерные для длительного приема ИПП, такие как образование полипов фундальных желез, гиперпластические полипы, множественные белые плоские приподнятые поражения (MWFL), слизистая оболочка, булыжная слизистая, и черные пятна (Таблица 1)9-12. В клинических условиях важно знать эндоскопические особенности желудка, связанные с длительным приемом ИПП. И наоборот, также важно идентифицировать пациентов, длительное время принимающих ИПП на основании результатов эндоскопического исследования. В этом обзоре последних сообщений по данной теме суммированы гистопатологические и эндоскопические данные.
Таблица 1. Краткая характеристика изменений слизистой оболочки желудка, связанных с применением ингибиторов протонной помпы.
|
Эндоскопические данные |
Заболеваемость, % |
Сопутствующие гистологические особенности |
Другие факторы риска |
|
Полипы фундальных желез |
9-36 |
Выпячивание (протрузия) париетальных клеток и кистозное расширение фундальных желез. |
Отсутствие инфекции H.Pylori. Отсутствие атрофического гастрита. Женский пол. |
|
Гиперпластические полипы |
8.9 |
Фовеолярная эпителиальная гиперплазия |
H.Pylori |
|
Множественные белые плоские приподнятые поражения (MWFL) |
14.3-26.3 |
Фовеолярная эпителиальная гиперплазия |
Эрадикация H.Pylori. Атрофический гастрит. Женский пол. Старение. |
|
Булыжная слизистая |
9.1-35.1 |
Выпячивание (протрузия) париетальных клеток и кистозное расширение фундальных желез. |
Отсутствие атрофического гастрита. Мужской пол. Старение. Сахарный диабет. |
|
Черные пятна |
0.2-6.2 |
Коричневое вещество в кистах фундальных желез |
Эрадикация H. Pylori. Низкий индекс массы тела. |
Рис. 1. Гистопатологические особенности изменений слизистой оболочки желудка, связанные с ингибиторами протонной помпы. (A) Кислотопродуцирующая слизистая оболочка с протрузиями париетальных клеток (H&E, ×200). (Б) Кистозные изменения фундальных желез (H&E, ×200). (C) Фовеолярная эпителиальная гиперплазия (H&E, ×40).
ГИСТОПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ СЛИЗИСТОЙ ЖЕЛУДКА, СВЯЗАННЫЕ С ПРИЕМОМ ИПП
Длительный прием ИПП связан с изменениями в морфологии париетальных клеток желудка, включающими увеличение размера и количества клеток, а также с пролиферацией энтерохромаффиноподобных клеток в слизистой оболочке желудка13. Гистопатологически увеличение париетальных клеток может легко идентифицировано как набухание и выпячивание апикальной мембраны в просвет кислотопродуцирующих желез. Это так называемая протрузия париетальных клеток (ППК), которая определяет зубчатый контур внутренней поверхности желез (рис. 1А)7,13. Соляная кислота желудка накапливается в париетальных клетках вследствие ингибирования ее активного высвобождения из секреторных канальцев, которое приводит к ППК13. Развитие этой аберрантной клеточной морфологии положительно коррелирует с гипергатринемией13. ППК также наблюдается при других состояниях, вызывающих гипергастринемию, таких как гастрит, вызванный Helicobacter pylori, пептическая язва или синдром Золлингера-Эллисона14. Поэтому ППК не является уникальным явлением, связанным с кислотосупрессивной терапией, и может быть в некоторой степени связан с увеличением концентрации гастрина в сыворотке крови13.
ППК также приводит к кистозному расширению фундальных желез и цитоплазматической вакуолизации (рис. 1В)15. Кистозное расширение фундальных желез может быть результатом обструкции протока железы. Которая возникает в связи с закупоркой просвета железы из-за выпячивания париетальных клеток и закупорки слизью, секретируемой фовеолярными (поверхностными слизистыми) клетками, пролиферация которых является вторичной по отношению к гипергастринемии, вызванной приемом ИПП16,17. Возникающее в результате кистозное расширение железы, прогрессируя может приводить к образованию полипа фундальной железы18. В предыдущих исследованиях сообщалось, что расширение фундальной железы происходило в период от 8 до 60 месяцев после начала приема ИПП7,19, в то время как в недавнем метаанализе авторы пришли к выводу, что длительный прием ИПП (≥1 года) был связан с повышенным риском образования полипов фундальных желез18 .
Несколько исследований показали, что полипы фундальных желез наблюдаются, в частности, у пациентов без сопутствующей инфекции H. Pylori13,20. Ферментативная деградация желудочной слизи протеазой H. pylori может способствовать лучшему оттоку секрета желез, таким образом защищая желудочные железы от задержки кислоты и кистозного расширения21. Хотя мутации гена β-катенина были обнаружены у 64–91% пациентов со спорадическими полипами фундальных желез, эти мутации не были обнаружены у пациентов, у которых эти полипы развивались после лечения ИПП22. При гистологическом анализе ППК была обнаружена у 9,2% и 64,4% полипов фундальных желез у пациентов, не принимающих ИПП, и у принимающих препараты соответственно. Максимальный диаметр кист фундальной железы внутри полипов фундальной железы был больше у пациентов, получавших лечение ИПП, чем у тех, кто не получал препараты22. Ретроспективное исследование выявило три типа полипов желудка, связанных с длительным приемом ИПП: (1) фундально-железистый тип, (2) гиперпластический тип и (3) воспалительный тип23. Однако, отличаются ли эти полипы от полипов, возникающих спорадически в общей популяции, до сих пор неясно.
Гипергастринемия, вызванная ИПП, возможно, также вызывает фовеолярную эпителиальную гиперплазию (рис. 1C), которая обычно проявляется в виде гиперпластических полипов24. Но также может проявляться в виде множественных белых плоских приподнятых поражений12,25. Следовательно, гиперпластические полипы и множественные белые плоские приподнятые поражения рассматриваются как эндоскопические признаки фовеолярной эпителиальной гиперплазии, вызванной длительным приемом ИПП.
ЭНДОСКОПИЧЕСКИЕ ИЗМЕНЕНИЯ СЛИЗИСТОЙ ЖЕЛУДКА, СВЯЗАННЫЕ С ПРИЕМОМ ИПП
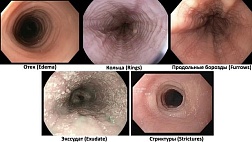
Рис. 2. Эндоскопические особенности изменений слизистой оболочки желудка, вызванных ингибиторами протонной помпы. (А) Полипы фундальных желез. (Б) Гиперпластический полип. (C, D) Множественные белые плоские приподнятые очаги(MWFL). (E) Булыжная слизистая. (F) Черные пятна.
1 Полипы фундальных желез
Полипы фундальных желез обычно обнаруживаются в теле и на дне желудка, чаще множественные, мелкие (<1 см), возвышающееся, белесовато-розового цвета, с гладкой, полу-прозрачной поверхностью (рис. 2А). В 1992 году Graham26 впервые сообщил, что полипы фундальных желез возникают во время лечения омепразолом. В проспективном исследовании 191 человека, длительно принимающих ИПП, полипы фундальной железы были выявлены у 13,6% пациентов, причем частота встречаемости у H. pylori-положительных пациентов была значительно ниже, чем у H. pylori-отрицательных пациентов (отношение рисков, 0,29; 95% доверительный интервал [ДИ], от 0,11 до 0,76); большинство полипов фундальных желез возникало в течение 2 лет после начала лечения ИПП24. Другие исследования долгосрочной терапии ИПП сообщили о частоте образования новых полипов фундальной железы в 9,27% случаев9,27. В недавнем метаанализе из 12 исследований также было обнаружено, что использование ИПП в значительной степени связано с увеличением распространенности полипов фундальных желез (отношение шансов [ОШ] 2,4; 95% ДИ от 1,42 до 4,27). временной интервал воздействия ИПП (для ≥6 месяцев: ОШ 4,71; 95% ДИ от 2,22 до 9,99 и в течение 12 месяцев: ОШ 5,32; 95% ДИ от 2,58 до 10,99)28. Помимо появления новых полипов фундальных желез, размер существующих полипов часто увеличивался при приеме ИПП. И наоборот, полипы фундальных желез также уменьшались в размерах или полностью регрессировали после прекращения приема ИПП. Нет необходимости удалять полипы фундальных желез, поскольку они практически не имеют злокачественного потенциала в общей популяции29,30. Однако в отчете о серии случаев документально подтверждена очень редкая аденокарцинома желудка исходящая из фундальной железы31. Недавнее перекрестное секционное исследование показало, что возникновение полипов фундальных желез коррелирует с женским полом (ОШ 1,77; 95% ДИ от 1,31 до 2,39) и атрофическим гастритом (ОШ 0,12; 95% ДИ от 0,08 до 0,18)12.
2 Гиперпластические полипы
Сообщалось о случаях образования гиперпластических полипов в результате длительного приема ИПП, особенно в условиях гипергастринемии и сопутствующей инфекцией H. pylori (рис. 2Б)11,23,24. В проспективном исследовании гиперпластический полипы были выявлены у 8,9% пациентов, длительно принимавших ИПП. Развитие новых гиперпластических полипов наблюдалось у 6% и 22% пациентов с существующими полипами фундальных желез и гиперпластическими полипами соответственно в течение 2-летнего периода применения ИПП24. Кроме того, частота образования гиперпластических полипов имела тенденцию к увеличению у пациентов инфицированных H.pylori, относительно H. pylori-отрицательных пациентов24.
Хотя точный патофизиологический механизм образования гиперпластических полипов неясен, рецепторы гастрина, как сообщается, экспрессируются на фовеолярном эпителии гиперпластических полипов32. Гастрин индуцирует пролиферацию слизистой оболочки желудка, что, в свою очередь, усиливает эффекты факторов роста, таких как семейство эпидермального фактора роста и фактора роста опухоли-α, тем самым способствуя пролиферации эпителиальных клеток крипт21. Таким образом, считается, что ИПП-индуцированная гипергастринемия вызывает гиперплазию фовеолярного эпителия желудка, что приводит к образованию гиперпластических полипов.
3 Множественные белые плоские приподнятые очаги (MWFL)
Множественные белые плоские приподнятые очаги определяются как четко отграниченные белые, круглые и слегка приподнятые участки слизистой оболочки с гладкой поверхностью (рис. 2C)12,25. Эти поражения обычно обнаруживаются в верхних отделах тела желудка и в дне желудка, а тщательный осмотр позволяет идентифицировать трубчатые структуры на их поверхности (рис. 2Г). Расширенные сосуды, обычно наблюдаемые при полипах фундальных желез, отсутствуют25. Частота обнаружения этих характерных поражений может быть увеличена при использовании методов улучшения визуализации, например узкоспектрального режима. Эти поражения были зарегистрированы у 14,3–26,3% пациентов, принимающих ИПП10,33. В наблюдательных исследованиях было обнаружено, что множественные белые и плоские приподнятые поражения в значительной степени связаны с применением ИПП (ОШ, 3,58; 95% ДИ, от 1,94 до 6,61), эрадикационной терапией H. pylori (ОШ, 2,11; 95% ДИ, 1,08–4,11), женским полом (ОШ, 1,92; 95% ДИ, 1,19–3,12), старением (ОШ, 1,05; 95% ДИ, 1,02– 1,08) и атрофическим гастритом от умеренной до тяжелой степени (ОШ 2,63; 95% ДИ от 1,52 до 5,63)12,33-35. Эти поражения также связаны с назначением антагонистов гистаминовых рецепторов и эрадикацией H. pylori, и поэтому связь их возникновения с длительным приемом ИПП неоднозначна. Кроме того, эти поражения могут быть ошибочно приняты за кишечную метаплазию. Дифференциальные признаки следующие: (1) в верхней трети тела и дне желудка появляются множественные белые плоские приподнятые очаги (кишечная метаплазия в антральном отделе часто проявляется в виде белесых приподнятых пятен, тогда как кишечная метаплазия в теле обычно плоская) и (2) множественные белые плоские очаги имеют ребристую или папиллярную структуру поверхности без голубого гребня при эндоскопическом осмотре с увеличением и узкополосной визуализацией36.
4 Булыжная слизистая
Булыжная слизистая, определяется как многочисленные, размером примерно от 3 до 5 мм, неровные, приподнятые участки слизистой оболочки в теле желудка (рис. 2E)12,25. Булыжная слизистая имеет неизмененный цвет. Изменения обычно наблюдается между складками желудка и формируют вид неровной поверхности. Эндоскопия с увеличением и узкополосной визуализацией показывает расширение устьев крипт и промежуточной части11. Несколько обсервационных исследований методом «случай-контроль» показали, что данные изменения слизистой оболочки в значительной степени связаны с приемом ИПП с частотой от 9,1% до 35,1% среди пациентов, длительно принимающих препараты данной группы10,37,38. Хотя между пациентами с булыжной слизистой и без нее не было выявлено различий в отношении таких факторов, как возраст, пол, продолжительность приема и эрадикация H. pylori, характерны вид слизистой оболочки наблюдался чаще у пациентов без атрофического гастрита38. В одном исследовании многомерный анализ показал, что появление булыжной слизистой было связано с применением ИПП (ОШ, 4,57; 95% ДИ, от 2,34 до 9,96) и сахарным диабетом. (ОШ, 3,41; 95% ДИ, 1,47–7,91)12. Проспективное многоцентровое исследование также показало, что вид булыжной слизистой был связан с использованием ИПП (ОШ, 13,72; 95% ДИ, 5,49–35,28), полом (женщины: ОШ 0,32; 95% ДИ от 0,09 до 0,89) и возрастом пациентов (≥50 лет: ОШ 4,46, 95% ДИ от 1,15 до 29,49)10.
Булыжный вид слизистой, гистопатологически характеризуется ППК и кистозным расширением фундальных желез, и эти изменения особенно выражены в неатрофических областях желудка с обильным количеством фундальных желез39. Когда булыжная слизистая наблюдается при атрофическим гастрите, оставшаяся слизистая желудка с сохранившимися фундальными железами имеет характерный красноватый возвышающийся вид на фоне обесцвеченной атрофичной слизистой оболочки.
5 Черные пятна
Черные пятна определяются как пигментация черного цвета на слизистой оболочке желудка при обычной эндоскопии и локализуются на теле и дне желудка, где содержатся фундальные железы40 . На первый взгляд они выглядят как точечные геморрагии, но слизистая оболочка над ними имеет плоский вид (рис.2F). Они обычно множественные (примерно у 65% пациентов)40 и иногда наблюдаются внутри полипов фундальных желез (рис. 2А). Тем не менее, трудно обнаружить черные пятна при эндоскопии без детального осмотра. Наблюдательные исследования показали, что частота появления черных пятен составляет от 0,2% до 6,2%.10,12,40. По данным многофакторного анализа, черные пятна были связаны с использованием ИПП (ОШ, 2,94; 95% ДИ, от 1,66 до 5,21), эрадикационной терапией H.Pylori (ОШ, 3,01; 95% ДИ, 1,73–5,24) и более низким индексом массы тела (ОШ, 0,89 на кг/м2; 95% ДИ, 0,82–0,96)12. Частота появления черных пятен составила 14 % в группе с эрадикацией H. pylori или среди пациентов принимающих ИПП, в то время как в группе без эрадикации H. pylori и в группе, не принимавшей ИПП, этот показатель составлял <5% в каждой группе12. Гистопатологически черные пятна, по-видимому, содержат коричневое вещество и/или эозинофильный экссудат в кистах фундальных желез, который, как полагают, представлен в виде скопления секрета клеток, выстилающих кисты фундальных желез12. Однако состав содержимого черных пятен и механизм их образования еще предстоит выяснить.
Рис. 3. Предполагаемые механизмы изменений слизистой оболочки желудка, связанных с применением ингибиторов протонной помпы (ИПП).
ВЫВОДЫ
У пациентов длительно применяющих ИПП при эндоскопическом осмотре можно наблюдать характерные изменения слизистой оболочки, такие как полипы фундальных желез, гиперпластические полипы, множественные белые плоские приподнятые очаги, булыжную слизистую и черные пятна. Гистопатологической причиной развития полипов фундальных желез, булыжной слизистой и черных пятен считается ППК и кистозное расширение фундальных желез, образование гиперпластических полипов и множественных белых плоских приподнятых поражений объясняется фовеолярной гиперплазией эпителия (рис. 3). Учитывая постоянно растущее число людей, принимающих ИПП, важна эндоскопическая идентификация этих изменений слизистой оболочки. Недавно появились и были введены в клиническую практику калий-конкурентные блокаторы соляной кислоты/протонной помпы (К-КБК)(P-CAB), новый класс средств, подавляющих кислотопродукцию, которые ингибируют активность H+/K+-АТФазы желудка посредством обратимого и K+-конкурентного ионного связывания с ферментом и оказывают более сильное ингибирующее действие на секрецию желудочной кислоты, чем ИПП. Хотя связь между вышеупомянутыми изменениями и применением P-CAB еще не установлена. Как видно из таблицы, существует вероятность того, что длительный прием P-CAB может провоцировать аналогичные изменения слизистой оболочки желудка. Необходимы дальнейшие долгосрочные проспективные исследования, изучающие изменения, характерные для приема ИПП и P-CAB, чтобы определить связь с гистопатологическими изменениями и установить их клиническую значимость.
ЛИТЕРАТУРА
1. Heidelbaugh JJ, Kim AH, Chang R, Walker PC. Overutiliza- tion of proton-pump inhibitors: what the clinician needs to know. Therap Adv Gastroenterol 2012;5:219-232.
2. Nocon M, Labenz J, Jaspersen D, et al. Long-term treatment of patients with gastro-oesophageal reflux disease in routine care: results from the ProGERD study. Aliment Pharmacol Ther 2007;25:715-722.
3. Pounder R, Smith J. Drug-induced changes of plasma gastrin concentration. Gastroenterol Clin North Am 1990;19:141- 153.
4. Wang TC, Koh TJ, Varro A, et al. Processing and prolifera- tive effects of human progastrin in transgenic mice. J Clin Invest 1996;98:1918-1929.
5. Graham DY, Genta RM. Long-term proton pump inhibi- tor use and gastrointestinal cancer. Curr Gastroenterol Rep 2008;10:543-547.
6. Kamada T, Haruma K, Inoue K, Shiotani A. Helicobacter pylori infection and endoscopic gastritis: Kyoto classification of gastritis. Nihon Shokakibyo Gakkai Zasshi 2015;112:982-993
7. Stolte M, Bethke B, Rühl G, Ritter M. Omeprazole-induced pseudohypertrophy of gastric parietal cells. Z Gastroenterol 1992;30:134-138.
8. Declich P, Ambrosiani L, Bellone S, et al. Parietal cell hyper- plasia with deep cystic dilations: a lesion closely mimicking fundic gland polyps. Am J Gastroenterol 2000;95:566-568.
9. Jalving M, Koornstra JJ, Wesseling J, Boezen HM, DE Jong S, Kleibeuker JH. Increased risk of fundic gland polyps during long-term proton pump inhibitor therapy. Aliment Pharma- col Ther 2006;24:1341-1348.
10. Kiso M, Ito M, Boda T, et al. Endoscopic findings of the gas- tric mucosa during long-term use of proton pump inhibitor: a multicenter study. Scand J Gastroenterol 2017;52:828-832.
11. Miyamoto S, Kato M, Matsuda K, et al. Gastric hyperplastic polyps associated with proton pump inhibitor use in a case without a history of Helicobacter pylori infection. Intern Med 2017;56:1825-1829.
12. Hatano Y, Haruma K, Kamada T, et al. Factors associated with gastric black spot, white flat elevated mucosa, and cobblestone-like mucosa: a cross-sectional study. Digestion 2018;98:185-193.
13. Cats A, Schenk BE, Bloemena E, et al. Parietal cell protru- sions and fundic gland cysts during omeprazole mainte- nance treatment. Hum Pathol 2000;31:684-690.
14. Krishnamurthy S, Dayal Y. Parietal cell protrusions in gastric ulcer disease. Hum Pathol 1997;28:1126-1130.
15. Ang ST, Lieberman DA, Ippoliti AF, et al. Long-term omeprazole therapy in patients with Barrett’s esophagus is associated with parietal cell hyperplasia. Gastroenterology 1994;106:A1016.
16. Shiotani A, Katsumata R, Gouda K, et al. Hypergastrinemia in long-term use of proton pump inhibitors. Digestion 2018; 97:154-162.
17. Synnerstad I, Holm L. Omeprazole induces high intraglan- dular pressure in the rat gastric mucosa. Gastroenterology 1997;112:1221-1230.
18. Tran-Duy A, Spaetgens B, Hoes AW, de Wit NJ, Stehouwer CD. Use of proton pump inhibitors and risks of fundic gland polyps and gastric cancer: systematic review and meta- analysis. Clin Gastroenterol Hepatol 2016;14:1706-1719.
19. Stolte M, Bethke B, Seifert E, et al. Observation of gastric glandular cysts in the corpus mucosa of the stomach under omeprazole treatment. Z Gastroenterol 1995;33:146-149.
20. el-Zimaity HM, Jackson FW, Graham DY. Fundic gland pol- yps developing during omeprazole therapy. Am J Gastroen- terol 1997;92:1858-1860.
21. Dockray GJ. Topical review: gastrin and gastric epithelial physiology. J Physiol 1999;518(Pt 2):315-324.
22. Fukuda M, Ishigaki H, Sugimoto M, et al. Histological analy sis of fundic gland polyps secondary to PPI therapy. Histo-
pathology 2019;75:537-545.
23. Choudhry U, Boyce HW Jr, Coppola D. Proton pump inhib-
itor-associated gastric polyps: a retrospective analysis of their frequency, and endoscopic, histologic, and ultrastructural characteristics. Am J Clin Pathol 1998;110:615-621.
24. Hongo M, Fujimoto K; Gastric Polyps Study Group. Inci- dence and risk factor of fundic gland polyp and hyperplastic polyp in long-term proton pump inhibitor therapy: a pro- spective study in Japan. J Gastroenterol 2010;45:618-624.
25. Haruma K, Kato M, Inoue K, Murakami M, Kamada T. Kyoto classification of gastritis. 2nd ed. Tokyo: Nihon Medi- cal Center, 2019.
26. Graham JR. Gastric polyposis: onset during long-term therapy with omeprazole. Med J Aust 1992;157:287-288.
27. Mogadam M, Houk RR. Long-term use of omeprazole is associated with development of benign epithelial gastric pol- yps. Am J Gastroenterol 1996;91:A151.
28. Martin FC, Chenevix-Trench G, Yeomans ND. Systematic review with meta-analysis: fundic gland polyps and proton pump inhibitors. Aliment Pharmacol Ther 2016;44:915-925.
29. Kato K, Iwasaki Y, Taniguchi M, et al. Successful treatment of proton pump inhibitor induced sporadic fundic gland polyps with an argon plasma coagulator in a patient with polycythaemia vera. Int J Surg Case Rep 2017;33:75-78.
30. Park YJ, Kim GH. Proton pump inhibitor-induced fundic gland polyposis. Korean J Intern Med 2017;32:197-198.
31. Nakagawa M, Abe M, Takada S, et al. Endoscopic features of gastric adenocarcinoma of fundic gland type. Stomach Intes- tine 2015;50:1521-1531.
32. Takamura A, Ito M, Boda T, et al. High expression of gastrin receptor protein in injured mucosa of Helicobacter pylori- positive gastritis. Dig Dis Sci 2013;58:634-640.
33. Majima K, Muraki Y, Shimamoto T. Multiple white and flat elevated lesions observed in the stomach: a prospective study of clinical characteristics and risk factors. Intern Med 2018; 57:2613-2619.
34. Hasegawa R, Yao K, Ihara S, et al. Magnified endoscopic findings of multiple white flat lesions: a new subtype of gas- tric hyperplastic polyps in the stomach. Clin Endosc 2018; 51:558-562.
35. Adachi K, Mishiro T, Okada M, Kinoshita Y. Prevalence of multiple white and flat elevated lesions in individuals under- going a medical checkup. Intern Med 2018;57:1213-1218.
36. Uedo N, Yamaoka R, Yao K. Multiple white flat lesions in the gastric corpus are not intestinal metaplasia. Endoscopy 2017; 49:615-616.
37. Miyamoto S, Kato M, Tsuda M, et al. Gastric mucosal cracked and cobblestone-like changes resulting from proton pump inhibitor use. Dig Endosc 2017;29:307-313.
38. Takahari K, Haruma K, Ohtani H, et al. Proton pump inhibi- tor induction of gastric cobblestone-like lesions in the stom- ach. Intern Med 2017;56:2699-2703.
39. Miyamoto S, Kudo T, Kato M, et al. Endoscopic ultrasonog- raphy features of gastric mucosal cobblestone-like changes from a proton-pump inhibitor. Clin J Gastroenterol 2017;10: 220-223.
40. Hatano Y, Haruma K, Ayaki M, et al. Black spot, a novel gas- tric finding potentially induced by proton pump inhibitors. Intern Med 2016;55:3079-3084.
ПЕРЕВОД: КОЙКОВ Н.В
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.















.jpg)




.png)

















Комментарии