- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Хирургическое лечение грыж пищеводного отверстия диафрагмы и возможности новых эндоскопических процедур
| Авторы: | Е.Л. НИКОНОВ 1 2018г. |
| Об авторах: |
1. ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова», Москва, Россия |
Полный текст статьи:
Грыжа пищеводного отверстия диафрагмы (ГПОД) ― это состояние, вызванное смещением органов брюшной полости в средостение через пищеводное отверстие диафрагмы.
Предполагается, что ГПОД занимают одно из первых мест в структуре заболеваний органов пищеварения, хотя их истинную распространенность оценить невозможно в связи с часто бессимптомным течением и субъективностью диагностических критериев. Это приводит к очень большим различиям в оценках распространенности ГПОД. Например, в США в разных исследованиях они варьируют от 10 до 80% [1], но, как правило, коррелируя с ожирением и возрастом.
Хотя в большинстве случаев ГПОД остаются бессимптомными и диагностируются случайно, они часто связаны с гастроэзофагеальной рефлюксной болезнью (ГЭРБ), поскольку некомпетентность нижнего сфинктера пищевода может быть следствием ГПОД. Параэзофагеальные грыжи с клиническими проявлениями могут прогрессировать и вызывать такие серьезные осложнения, как рефлюкс-эзофагит, пептическая язва пищевода, перфорация и стриктура пищевода, пищеводное кровотечение, ущемленная грыжа. Выявление и лечение бессимптомных ГПОД не показаны, но при развитии клинических проявлений заболевания они требуют обследования и возможного хирургического вмешательства.
Изданные в 2013 г. рекомендации Американской ассоциации гастроэнтерологических и эндоскопических хирургов (SAGES) по лечению ГПОД [2] предусматривают классификацию, включающую 4 типа ГПОД.
Грыжи I типа ― скользящие ГПОД, при которых пищеводно-желудочное соединение смещается выше диафрагмы [3], но желудок сохраняет обычное продольное положение [4], а его дно остается ниже пищеводно-желудочного соединения. Для ГПОД I типа характерны слабость и удлинение пищеводно-диафрагмальной связки, играющей важную роль в поддержании нормального внутрибрюшного положения пищеводно-желудочного перехода. Эта слабость связочного аппарата приводит к различной степени миграции пищеводно-желудочного перехода через расширенное диафрагмальное отверстие.
Грыжи II типа ― истинные параэзофагеальные грыжи (ПЭГ), при которых пищеводно-желудочное соединение остается в нормальном анатомическом положении, но часть дна желудка смещается через диафрагмальное отверстие вверх вдоль пищевода.
Грыжи III типа представляют собой комбинацию I и II типов, когда как пищеводно-желудочное соединение, так и дно желудка, смещаются вверх через диафрагмальное отверстие. При этом дно желудка располагается выше пищеводно-желудочного перехода.
Грыжи IV типа характеризуются наличием в грыжевом мешке не желудка, а других органов брюшной полости, таких как сальник, толстая кишка, тонкая кишка или селезенка.
Более 95% ГПОД относятся к типу I. Как группа, II―IV типы представляют собой ПЭГ и отличаются от грыж I типа относительной сохранностью заднелатеральных пищеводно-диафрагмальных связок вокруг пищеводно-желудочного перехода [5]. Среди ПЭГ более 90% относятся к III типу, а наименее распространенным является II тип [6].
В литературе часто встречается термин «гигантская параэзофагеальная грыжа», хотя его общепринятого определения не существует. Некоторые авторы предлагают считать гигантской ПЭГ все грыжи III и IV типов [9], но большинство исследователей относят к ней ПЭГ, при которой в средостении находится от 1/3 до ½ желудка [7―10].
Причиной развития ГПОД считаются слабость пищеводно-диафрагмальной связки Лаймера и расширение ножек диафрагмы [11]. Ослабление пищеводно-диафрагмальной связки происходит в результате ее растяжения из-за уменьшения содержания эластиновых волокон [12]. В большинстве случаев ГПОД являются приобретенными, хотя в очень небольшом числе случаев определенную роль может играть многофакторное семейное наследование [13].
Хирургическое лечение ГПОД
Показания к хирургическому лечению
ГПОД I типа. Основное клиническое значение ГПОД I типа заключается в их взаимосвязи с ГЭРБ, при которой антирефлюксные операции являются одним из методов лечения независимо от наличия или отсутствия ГПОД. Поэтому хирургические вмешательства по поводу ГПОД I типа в сочетании с ГЭРБ должны обязательно включать фундопликацию [14] как антирефлюксную процедуру.
В отсутствие ГЭРБ скользящие грыжи не вызывают каких-либо последствий, хотя есть отдельные сообщения о связанных с ними осложнениях [15―17]. В редких случаях при ГПОД I типа могут возникать дисфагия или язвы желудка, но, как правило, в отсутствие ГЭРБ они не требуют хирургического лечения [18].
Параэзофагеальные грыжи. Полностью бессимптомные ПЭГ встречаются очень редко и, как правило, не сопровождаются клиническими проявлениями. [8]. Обычно симптоматика выражена незначительно, поэтому чаще всего ПЭГ обнаруживаются случайно на рентгенограмме грудной клетки, выполненной по другой причине [20, 21].
При тщательном расспросе пациентов с ПЭГ можно выявить такие симптомы, как чувство тяжести в грудной клетке или затрудненное дыхание, возникающие после приема пищи. Симптомы рефлюкса при ПЭГ встречаются редко. Вполне вероятно, что некоторые ПЭГ развиваются из небольших ГПОД. Другие могут возникать в результате анатомических изменений в позвоночнике, например, при кифозе и дегенеративных заболеваниях межпозвонковых дисков [22].
По мере того как все большая часть желудка перемещается в грудную полость, он вызывает компрессию легких и сокращение их жизненной емкости, в результате чего в клинической картине начинают преобладать расстройства дыхания [8, 23]. Кроме того, ПЭГ могут сопровождаться рецидивирующими аспирационными пневмониями [21]. Позже, в результате ущемления, развивается ишемия слизистой оболочки желудка, вызывая ее изъязвления, кровотечение и анемию. У 50% пациентов с ПЭГ наблюдается железодефицитная анемия [23].
Обструктивные симптомы варьируют от легкой тошноты, вздутия живота или чувства переполнения после еды до дисфагии и рвоты. Боли часто описываются как чувство тяжести в эпигастрии или боли в животе после еды, которые часто облегчаются рвотой.
Недостаточно изученным остается естественное течение ГПОД. Из немногих доступных данных следует, что риск развития острых состояний, особенно обструкции, ассоциируется только с грыжами, при которых дно желудка мигрировало выше диафрагмы, т. е. с ПЭГ. Предполагается, что риск прогрессирования от бессимптомной до клинически проявляющейся ПЭГ составляет примерно 14% в год [24, 25].
Поэтому, а также с учетом высокой смертности, связанной с данными осложнениями, в частности с некрозом желудка, было принято считать, что все ПЭГ требуют планового хирургического лечения [46, 47]. Это особенно важно при клинически проявляющихся грыжах, которые сопровождаются более высоким риском развития осложнений [26]. При этом возраст не должен рассматриваться как противопоказание к операции [27].
Однако более поздние исследования показали, что смертность после неотложных операций по поводу осложнений ПЭГ значительно ниже, чем предполагалось ранее (5,4% против 17%) [25, 28]. Кроме того, риск развития неотложных состояний, требующих экстренного хирургического вмешательства, не превышает 2% в год [29―32].
Анализ современных исследований позволяет сделать вывод о том, что хирургическое лечение полностью бессимптомных ПЭГ не обязательно. В этих случаях выжидательная тактика является безопасной альтернативой хирургическим вмешательствам, которые должны применяться в основном у пациентов с симптомами обструкции, тяжелой и осложненной ГЭРБ, анемией и признаками ущемления желудка [29―33].
Кроме того, анализ этих исследований показал, что плановые лапароскопические вмешательства по поводу бессимптомных ПЭГ могут фактически снизить ожидаемую продолжительность жизни с поправкой на качество жизни (QALE) у пациентов в возрасте 65 лет и старше.
Ущемление, перегиб или заворот желудка в грыжевом мешке при ПЭГ могут приводить к ишемическим повреждениям, некрозу и перфорациям. При развитии этих осложнений требуется хирургическое вмешательство с низведением желудка и частичной резекцией в случае некроза.
Таким образом, с учетом изложенного показания к хирургическому лечению ГПОД должны основываться на следующих рекомендациях.
― Хирургическое лечение ГПОД I типа в отсутствие ГЭРБ не показано.
― Показанием к операции при ГПОД I типа является тяжелая или осложненная ГЭРБ, не поддающаяся консервативной терапии. Фундопликация при хирургическом лечении ГЭРБ является обязательной.
― Все симптоматические ПЭГ требуют хирургического лечения, особенно при развитии острой непроходимости или ущемления.
― Хирургическое лечение полностью бессимптомных ПЭГ не всегда показано. При рассмотрении показаний к вмешательствам по поводу ПЭГ с бессимптомным течением следует учитывать возраст пациентов и сопутствующие заболевания.
― Острый заворот и ущемление желудка в грыжевом мешке при ПЭГ требуют расправления желудка и при необходимости — частичной резекции.
Лапароскопические и открытые операции
Хирургические вмешательства по устранению ГПОД обычно включают 4 этапа: иссечение и резекцию грыжевого мешка, мобилизацию пищевода, пластику ножек диафрагмы и фундопликацию [34―36]. Эти операции могут выполняться с использованием как открытого (абдоминального или торакального), так и лапароскопического доступа.
Хотя лапароскопические операции становятся все более популярными, хирургическое лечение ГПОД с использованием открытого доступа пока остается преобладающим. Результаты анализа почти 38 тыс. хирургических вмешательств по поводу ГПОД, проведенных в США с 1999 по 2008 г., свидетельствуют о том, что 91% операций были открытыми (74,4% с абдоминальным и 17% торакальным доступом). На долю лапароскопических операций пришлось только 9% [37].
Послеоперационная летальность составила 1,1% и не зависела от типа операционного доступа, но при лапароскопических операциях длительность пребывания в стационаре была наименьшей (4,5 дня против 7,8 дня при трансторакальных операциях). Обзор литературы [38] также показал, что, хотя рандомизированных исследований, сравнивающих лапароскопические и открытые операции при ГПОД, не проводилось, лапароскопические вмешательства сопровождаются меньшим количеством осложнений, таких как пневмония, тромбоз, кровоизлияние, инфекции мочевых путей и раневые инфекции. Кроме того, небольшие разрезы при малоинвазивных вмешательствах снижают риск возникновения послеоперационных грыж [39].
Несколько сообщений о лапароскопических операциях по поводу гигантских ПЭГ также показали отличные результаты [40].
В то же время определенную озабоченность вызывала более высокая частота рецидивов после лапароскопической коррекции ГПОД. В исследовании результатов 60 операций по поводу ПЭГ [41] частота рецидивов после лапароскопических вмешательств составила 44% по сравнению с 23% после операций, выполненных открытым доступом, хотя это различие не было статистически значимым.
В другом исследовании сообщалось о том, что на начальных этапах внедрения лапароскопической коррекции ГПОД частота рецидивов достигала 44% по сравнению с 15% после открытых операций, однако по мере накопления опыта она снизилась до уровня, наблюдавшегося после открытых вмешательств [42].
Кроме того, имеются данные о том, что рецидивы после лапароскопических операций чаще всего клинически малозначимы или бессимптомны и обычно связаны с наличием короткого пищевода или натяжением ножек диафрагмы при их пластике [43].
Конверсия лапароскопической операции в открытую иногда бывает необходимой по таким причинам, как кровотечение, травма селезенки или наличие плотных спаек. Поэтому важно, чтобы хирурги, выполняющие лапароскопическую коррекцию ГПОД, имели достаточные навыки и опыт проведения открытых операций.
Согласно рекомендациям SAGES по лечению ГПОД [2], в большинстве случаев ГПОД, требующих хирургического лечения, лапароскопический метод их коррекции является предпочтительным, так как он сопровождается меньшим числом послеоперационных осложнений и более короткими сроками пребывания в стационаре по сравнению с открытыми операциями.
Трансторакальные и трансабдоминальные операции
В настоящее время отсутствуют данные о проведении контролируемых рандомизированных исследований, непосредственно сравнивающих результаты хирургического лечения ГПОД с применением трансторакального и трансабдоминального доступов. Кроме того, нет данных по оценке малоинвазивных трансторакальных вмешательств. Хотя трансторакальный доступ обеспечивает отличную визуализацию пищеводного отверстия диафрагмы и позволяет максимально мобилизовать пищевод, этот метод применяется все реже из-за более тяжелого течения послеоперационного периода, большего числа осложнений и длительного пребывания в стационаре. Тем не менее одним из преимуществ трансторакального доступа является возможность более широкой мобилизации пищевода [44].
Открытые трансабдоминальные операции являются методом выбора при экстренных хирургических вмешательствах в связи с осложнениями ГПОД, когда имеется перитонеальное загрязнение или некроз желудка [45].
A. Geha и соавт. [46] сообщили о результатах хирургического лечения 100 пациентов с гигантскими ГПОД. У 2 из 18 больных, оперированных с применением трансторакального доступа, потребовалось повторное открытое трансабдоминальное вмешательство в связи с развитием у них перекручивания желудка вокруг его оси. Остальные 82 пациента были прооперированы открытым трансабдоминальным доступом. У всех этих больных проведена пластика пищеводного отверстия диафрагмы, фундопликация выполнена у 32 больных, 2 пациентам потребовалась гастропластика Коллиса (Collis gastroplasty) для увеличения длины пищевода. Рецидивов не было во всей когорте.
Другие современные авторы, сравнивавшие трансабдоминальный и трансторакальный доступы при хирургическом лечении ПЭГ, пришли к выводу, что их результаты эквивалентны [47].
Антирефлюксные процедуры
Фундопликация является стандартным компонентом хирургических методов коррекции ГПОД. Суть фундопликации по Ниссену заключается в формировании из верхней части дна желудка циркулярной манжетки вокруг нижней части пищевода с целью повышения давления в нижнем пищеводном сфинктере для предотвращения рефлюкса.
В 1973 г. были опубликованы результаты 20-летнего ретроспективного исследования хирургического лечения 95 пациентов с ПЭГ без фундопликации, в котором частота рентгенологически подтвержденных рецидивов составила 33% [48]. Это послужило основанием считать фундопликацию необходимым компонентом хирургического лечения ПЭГ.
В 2011 г. опубликовано исследование, в котором сравнивались результаты лечения ПЭГ с фундопликацией (n=35) и без нее (n=25) [49]. Фундопликация применялась у пациентов при наличии ГЭРБ. Среди 25 пациентов, у которых фундопликация не применялась, у 28% после операции развился эзофагит, и у 39% отмечался аномальный заброс содержимого желудка в пищевод. Авторы пришли к выводу, что фундопликация должна быть рутинной частью операций по коррекции ПЭГ. Изучение результатов хирургических вмешательств с использованием фундопликации у 4 пациентов с ГПОД II типа и 11 пациентов с ГПОД III типа показало, что через 1 год после операции у всех пациентов не было симптомов, дисфагии или рефлюкса. Авторы предположили, что фундопликация восстанавливает функцию нижнего сфинктера пищевода и предупреждает рефлюкс в послеоперационном периоде. Кроме того, фундопликация закрепляет желудок под диафрагмой, предотвращая рецидивы грыж [50].
Рекомендации SAGES по лечению ГПОД [2] предусматривают необходимость выполнения фундопликации при хирургическом лечении как скользящих грыж, так и ПЭГ.
Гастропексия
Согласно рекомендациям SAGES по лечению ГПОД [2], гастропексию можно использовать в дополнение к пластике ГПОД как дополнительную меру по удержанию кардии ниже диафрагмы для профилактики рецидивов. Установка гастростомической трубки в этих случаях может облегчить течение послеоперационного периода у отдельных пациентов.
Хирургическое лечение грыжи с помощью только гастропексии без укрепления пищеводного отверстия диафрагмы является безопасной альтернативой у пациентов с высоким хирургическим риском, но может сопровождаться более частыми рецидивами. Стандартная пластика является предпочтительной.
В одном из первых исследований применения гасторопексии с целью уменьшения частоты рецидивов после лапароскопических операций по поводу ГПОД изучались результаты лечения 28 пациентов, которым в дополнение к удалению грыжи и грыжевого мешка, круропластике и фундопликации производилась гастропексия [51]. В исследование не включались больные с грыжами I типа. При оценке результатов установлено, что в течение 2 лет после операции не произошло ни одного рецидива.
Аналогичные результаты были получены в другом исследовании, включавшем 89 пациентов, которым проводилась лапароскопическая коррекция больших ГПОД. Здесь также было показано, что добавление гастропексии к коррекции грыжевого дефекта значительно уменьшает частоту рецидивов [52].
В то же время в похожем исследовании применения гастропексии в дополнение к лапароскопическим вмешательствам при ПЭГ у 116 пациентов существенной разницы в частоте рецидивов выявлено не было [53].
Установка гастростомической трубки для декомпрессии и энтерального питания/введения лекарственных препаратов изучалась в ретроспективном исследовании результатов лечения ГПОД с интраторакальным расположением желудка у 73 пациентов. В 60% случаев этой серии во время операции была установлена гастростомическая трубка, которая требовалась после операции для декомпрессии и/или введения лекарственных препаратов [54].
Некоторые авторы описали низведение грыжи и гастропексию без крурорафии и удаления грыжевого мешка, в частности у пациентов с выраженной симптоматикой [55, 56]. Летальность и частота развития осложнений были низкими, но через 3 мес рентгенологический рецидив был выявлен у 22% больных. Результаты такого подхода уступают стандартным оперативным методикам по коррекции ГПОД, и поэтому изолированную гастропексию следует рассматривать как упрощенный запасной вариант у пациентов с высоким хирургическим риском.
Удаление грыжевого мешка
Рекомендации SAGES по лечению ГПОД [2] предполагают, что во время хирургических вмешательств по поводу ПЭГ грыжевой мешок должен быть отделен от средостенных структур, а затем удален. Если грыжевой мешок не удается удалить полностью, он должен быть удален хотя бы частично для того, чтобы при фундопликации не оставалось его избыточной массы.
Предполагается, что удаление грыжевого мешка в процессе хирургической коррекции ПЭГ позволяет мобилизовать пищевод, облегчает низведение грыжевого содержимого в брюшную полость и снижает риск раннего рецидива, а также защищает пищевод от ятрогенного повреждения [57, 58].
Наблюдения, свидетельствующие в пользу удаления грыжевого мешка [59], ограничиваются небольшим числом пациентов с различными типами ГПОД и разной хирургической техникой. В этом исследовании в течение 38 мес наблюдения рецидив развился в 5 из 25 случаев вмешательств без удаления грыжевого мешка, все от 1 до 8 нед после операции. В то же время у 30 пациентов, у которых операция включала удаление грыжевого мешка, в течение 15 мес после операции не возникло ни одного рецидива.
Иногда удаление грыжевого мешка может быть довольно сложным, особенно при больших грыжах. В частности, при наличии таких трудностей иссечение грыжевого мешка повышает риск травмы блуждающего нерва. По мнению экспертов, в такой ситуации можно ограничиться выделением грыжевого мешка и отделением его от ножек диафрагмы, но полное его удаление не обязательно [58, 60].
В ретроспективном исследовании с небольшим числом случаев по сравнению такого подхода с полным удалением грыжевого мешка выявлена тенденция к более частым рецидивам при неполном удалении грыжевого мешка, но статистически значимых различий между группами не было [61].
Некоторые исследователи считают, что имеющихся в настоящее время доказательств недостаточно для выводов о влиянии удаления грыжевого мешка на исходы хирургического лечения ГПОД, и что давать рекомендации по его удалению преждевременно [62].
Применение имплантатов
В течение многих лет основным способом укрепления грыжевых ворот при закрытии грыжевого дефекта была пластика пищеводного отверстия диафрагмы путем сшивания ножек диафрагмы (передняя и задняя крурорафия). После этих операций частота рецидивов достигала 42% при открытом доступе и была еще выше при лапароскопических вмешательствах [63, 64].
Основной причиной развития рецидивов ГПОД после крурорафии при большом размере пищеводного отверстия являются расхождение ножек диафрагмы в результате прорезывания швов из-за избыточного натяжения при их сшивании, а также гипотрофия или фиброзное перерождение мышечных ножек диафрагмы [65, 66].
Это побудило многих авторов к поиску новых способов укрепления пищеводного отверстия диафрагмы. Хотя были разработаны некоторые методы пластики пищеводного отверстия диафрагмы собственными тканями пациента, такими как круглая связка печени [67] или левая доля печени [68], большее распространение получило использование для этой цели пластики различными имплантатами (протезами, заплатами).
В качестве материалов для изготовления имплантатов применяются как синтетические ткани (полиэстер, полипропилен, политетрафлюороэтилен ― PTFE), так и биоматериалы ― подслизистый слой тонкой кишки (SIS), бесклеточный аллотрансплантат из дермы человека (AHD) и др. [69, 70].
В настоящее время наиболее распространенным видом заплат, применяемых в хирургии ГПОД, являются абсорбируемые сетчатые имплантаты (Vicryl) [71].
Оптимальная техника протезирующей пластики и идеальная разновидность сетчатого имплантата на данный момент остаются неизвестными. Чаще всего сетка применяется в качестве накладки после первичного сшивания ножек диафрагмы. Кроме того, нашла применение крурорафия с использованием подкладок из тефлона под швы при сшивании ножек диафрагмы для предупреждения их прорезывания [72]. При невозможности сближения и сшивания ножек диафрагмы имплантаты применяются в качестве вставки или моста [73].
В последние годы были опубликованы несколько относительно крупных исследований по оценке результатов применения сетчатых имплантатов, но они не внесли полной ясности в проблемы, связанные с их использованием.
В недавно опубликованном метаанализе J. Huddy и соавт. [74], объединявшем 9 исследований, сравнивались результаты 3 методов лапароскопической коррекции ГПОД: крурорафии (n=310), пластики имплантатами из синтетических материалов (n=214) и биоматериалов (n=152).
По результатам метаанализа установлено отсутствие различий в частоте развития осложнений после крурорафии и пластики имплантатами обеих разновидностей.
Общая частота рецидивов после пластики имплантатами обоих видов была статистически значимо ниже, чем при крурорафии: 14,5% против 24,5%; отношение шансов (ОШ) 0,36 (95% доверительный интервал ― ДИ 0,17―0,77; p=0,009). Кроме того, после применения синтетических сеток рецидивы возникали реже, чем после имплантатов из биоматериалов: 12,6% против 17,1%; ОШ 0,30 (95% ДИ 0,12―0,73; p=0,008). Проведенный в рамках этого метаанализа опрос 503 хирургов показал, что их предпочтения в выборе метода пластики для коррекции ГПОД и хирургическая техника значительно варьировали.
Авторы метаанализа заключили, что по сравнению с крурорафией применение как синтетических материалов, так и биопротезов снижает частоту рецидивов, но синтетические имплантаты эффективнее биопротезов. Данных для определения оптимальной хирургической техники недостаточно.
В другом метаанализе, включавшем 13 исследований, сравнивались результаты лапароскопических операций при больших ГПОД (1194 пациента, 521 операция с крурорафией и 673 с сетчатыми имплантатами). В большинстве включенных в метаанализ исследований сообщалось о значительном симптоматическом улучшении. Применение сетчатых имплантатов сопровождалось меньшим числом рецидивов (ОШ 0,51; 95% ДИ 0,30―0,87; p=0,014), но различия в необходимости повторных вмешательств были статистически незначимыми (ОШ 0,42; 95% ДИ 0,13―1,37; p=0,15). Авторы пришли к выводу о недостаточности доказательств в пользу сетчатых имплантатов.
И, наконец, рандомизированное контролируемое испытание (РКИ), проведенное D. Watson и соавт. [75], показало, что крурорафия и пластика сетчатыми имплантатами при больших ГПОД дают одинаковые результаты.
В этом многоцентровом проспективном двойном слепом РКИ сравнивались 3 метода пластики пищеводного отверстия диафрагмы: крурорафия (n=43), пластика абсорбируемой сеткой (n=41) и неабсорбируемой сеткой (n=42). Первичным изучаемым клиническим исходом был рецидив грыжи в первые 6 мес после операции. Вторичным изучаемым исходом были клинические показатели (отрыжка, изжога, одинофагия и др.) через 1, 3, 6 и 12 мес после операции.
Рецидивы грыж после крурорафии, пластики абсорбируемой сеткой и неабсорбируемой сеткой были идентифицированы у 23,1, 30,8 и 12,8% пациентов соответственно (р=0,161). Различия в клинических показателях были незначительными.
Таким образом, в данном РКИ не было выявлено существенных различий в результатах применения этих методов закрытия грыжевого дефекта при ГПОД как в частоте рецидивов ГПОД, так и в клинических показателях.
Важной проблемой остается ограниченность данных о долгосрочной безопасности различных типов сетчатых протезов и техники их применения, так как большинство исследований на эту тему представляют собой небольшие серии случаев с медианой периода наблюдения менее 3 лет. В литературе описаны осложнения имплантатов всех разновидностей, как синтетических, так и биологических, а также различных конфигураций.
Хотя наиболее опасным осложнением применения синтетических имплантатов являются пролежни пищевода, могут возникать и другие осложнения, такие как формирование грубой рубцовой ткани вокруг пищевода с развитием его стеноза, миграция имплантата или образование выпота [76―80] и перикардиальная тампонада [81].
Согласно заключению авторов рекомендаций SAGES по лечению ГПОД [2], использование сетчатых имплантатов для укрепления грыжевых ворот при хирургическом лечении больших ГПОД приводит к снижению частоты рецидивов в раннем послеоперационном периоде. Однако отдаленные последствия их применения еще недостаточно хорошо изучены, в связи с чем невозможно прийти к определенной рекомендации за или против их использования.
Новые эндоскопические антирефлюксные процедуры
Эндоскопическая антирефлюксная терапия (EART) является относительно новой концепцией в лечении ГЭРБ, в том числе при наличии ГПОД. Применение EART направлено на решение 3 ключевых вопросов:
― лечение рефрактерной ГЭРБ, т. е. устранение симптомов, которые не удается полностью контролировать с помощью медикаментозной терапии;
― прекращение долгосрочного приема ингибиторов протонной помпы (ИПП) пациентами с медикаментозно контролируемой ГЭРБ, которые хотят от них отказаться;
― сведение к минимуму необходимости в хирургическом лечении ГПОД [82].
В настоящее время существуют 2 разновидности эндоскопических антирефлюксных процедур для лечения ГЭРБ, которые могут применяться в лечении небольших ГПОД:
― радиочастотная терапия пищеводно-желудочного перехода с помощью катетера Stretta;
― трансоральная неинвазивная фундопликация (TIF).
Радиочастотная терапия пищеводно-желудочного перехода
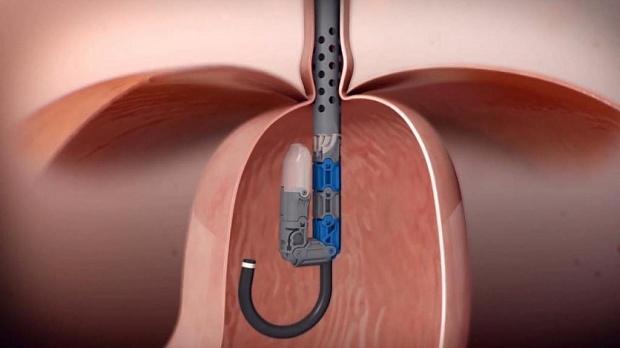
Радиочастотная терапия пищеводно-желудочного перехода с помощью катетера Stretta («Curon Medical», США) применяется довольно давно и имеет существенную доказательную базу [83, 84]. В США Stretta была одобрена Управлением по надзору за качеством пищевых продуктов и лекарственных средств (FDA) для лечения ГЭРБ в 2000 г. (рис. 1.)
Рис. 1. Катетер Stretta. а ― общий вид; б ― введение после раздувания баллона 4 игл в мышечный слой пищеводно-желудочного перехода с последующим воздействием радиочастотной энергией.
Суть метода состоит в циркулярном воздействии радиочастотным датчиком на область пищеводно-желудочного перехода. Длительность процедуры в среднем составляет 40—60 мин [85].
По сравнению с хирургическими методами лечения ГПОД Stretta является гораздо менее инвазивной амбулаторной процедурой и имеет меньше побочных эффектов и осложнений, не требует общей анестезии; обычно во время ее проведения используется только умеренная седация.
Вся процедура длится менее 40 мин и не требует длительного наблюдения по ее окончании. На следующий день большинство пациентов возобновляют свою обычную деятельность.
Побочные эффекты включают незначительные боли в горле и грудной клетке, которые могут возникать в течение короткого периода времени сразу после процедуры.
В экспериментальных и клинических исследованиях установлено, что радиочастотное воздействие на область нижнего пищеводного сфинктера способствует повышению его тонуса и уменьшению числа транзиторных расслаблений [86].
Этот метод наиболее эффективен у пациентов без ГПОД, и поэтому наличие ГПОД более 2 см является противопоказанием к применению. Вместе с тем имеются данные о положительных результатах применения метода при ГПОД менее 2 см.
В рандомизированном плацебо-контролируемом исследовании D. Corley и соавт. [87] участвовали 64 пациента с ГЭРБ. У 35 из 64 больных проводилась радиочастотная терапия с помощью катетера Stretta, а у 29 ― симуляция этой процедуры. В этих группах у 14 (40%) и 12 (41%) больных соответственно имелись ГПОД более 2 см. Первичными изучаемыми клиническими исходами были изменение в симптоматике ГЭРБ и качество жизни по опроснику GERD-HRQL (Gastroesophageal Reflux Disease — Health Related Quality of Life Scale).
Через 6 мес после лечения у пациентов из группы активного лечения существенно и статистически значимо по сравнению с пациентами группы симуляции вмешательства уменьшились клинические проявления ГЭРБ, и улучшилось качество жизни.
В группе активного лечения по сравнению с группой симуляции у большего числа пациентов отсутствовала ежедневная изжога (n=19 (61%) против n=7 (33%); p=0,05), и у большего числа балльная оценка качества жизни по опроснику GERD-HRQL улучшилась более чем на 50% (n=19 (61%) против n=6 (30%); p=0,03). Эти положительные изменения сохранялись через 12 мес после лечения. В то же время через 6 мес после лечения между группами не выявлено различий в снижении ежедневного употребления лекарственных препаратов и во времени воздействия кислоты на пищевод.
В другом РКИ [88] 36 пациентов c ГЭРБ были рандомизированы в 3 группы. В группах, А и С по 12 пациентов прошли однократную и двукратную процедуру радиочастотной терапии катетером Stretta соответственно. В группе B 12 пациентам проводилась симуляция данной процедуры. В этих группах 6 (50%), 7 (58%) и 9 (75%) пациентов соответственно имели ГПОД менее 2 см.
Через 12 мес наблюдалось значительное улучшение симптоматики ГЭРБ в обеих группах активного лечения, в то время как в группе симуляции вмешательства изменения были незначительными. Кроме того, в группах активного лечения в большей степени улучшилось качество жизни по опроснику GERD-HRQL, уменьшились использование ИПП, время воздействия кислоты на пищевод при рН-мониторинге и степень выраженности эзофагита.
Трансоральная неинвазивная фундопликация
Трансоральные (эндолюминальные) вмешательства по коррекции ГПОД разрабатываются в рамках концепции эндоскопической хирургии через естественные отверстия (Natural Orifice Transluminal Endoscopic Surgery ― NOTES). К трансоральным методам лечения ГЭРБ и в отдельных случаях ГПОД относится трансоральная неинвазивная фундопликация (Transoral Incisionless Fundoplication ― TIF). Основными представителями этой новой технологии являются системы Esophyx («Endogastric Solutions», США) и MUSE™ («Medigus», Израиль), которые применяются для минимально инвазивной полнослойной фундопликации (рис. 2)
Рис. 2. Система Esophyx. а ― общий вид; б ― создание фундопликационной манжетки с помощью Esophyx.
[89]. Процедуры с применением этих методов обычно выполняются под общей анестезией и продолжаются около 1 ч.
В США система Esophyx была одобрена FDA для лечения ГЭРБ в 2007 г. При использовании системы Esophyx полнослойная эзофагогастральная фундопликационная манжетка с окутыванием на 270° пищевода дном желудка создается с помощью специального устройства, встроенного в дистальный конец эндоскопа. Сформированная манжетка фиксируется продольными полипропиленовыми швами длиной около 3,5 см.
1. ПЕРВЫЙ ОПЫТ ВНУТРИПРОСВЕТНОЙ ФУНДОПЛИКАЦИИ ESOPHYX.
Фёдоров А.В¹., Сажин А.В.², Старков Ю.Г¹., Солодонина Е.Н.¹, Сажин В.П.³, Климов Д.Е.³ Савельев В.М.³, Извеков А.А.4, Кряжев Д.Ю. 41,2,4) Москва, 3) Новомосковск
1) НИИ хирургии им А.В. Вишневского, 2) Кафедра общей хирургии педиатрического факультета РГМУ, 3) МУЗ «Новомосковская городская клиническая больница», 4) ГКБ №4 ДЗ г.Москвы
В работе предсавлены результаты 4 транслюминальных операций по поводу гастроэзофагеальной рефлюксной болезни.
Известно, что решающую роль в возникновении гастро-эзофагеального рефлюкса играет дисфункция пищеводно-желудочного клапана. Большинство разработанных хирургических методик направлено на воссоздание замыкательной функции пищеводно-желудочного перехода. Важным аспектом эндоскопической хирургии через естественные отверстия (N.O.T.E.S.) являются трансгастральные вмешательства, в частности коррекция пищеводно-желудочного перехода. В мировой литературе (по состоянию на июнь 2008 г ) сообщено о 450 таких операциях.
В 2008 т было выполнено 4 внутрипросветные фундопликации с использованием системы EsophyX™. Все пациенты были женского пола, в возрасте от 38 до 53 лет. Больные отмечали симптомы гастроэзофагеальной рефлюксной болезни длительное время (свыше 3 лет), у всех пациенток рентгенологически подтверждалось наличие диафрагмальной грыжи не более 4 см в диаметре. Показанием к операции служило отсутствие эффекта от медикаментозной терапии блокаторами протоновой помпы в течение года.
Процедура выполнялась под тотальной внутривенной анестезией с ИВЛ в положении больного на левом боку. Система EsophyX™ вводилась в желудок на видеогастроскопе. По большой кривизне, сразу ниже Z-линии формировалась складка слизистой пищеводно-желудочного перехода, которая прошивалась Н-образными скобками. Данная процедура выполнялась поэтапно по всей большой кривизне с переходом на переднюю и заднюю стенки желудка, таким образом, создавалась складка от 180 до 270 градусов, длинною до 4 см. Клипсы накладывались в два ряда, производилось от 14 до 18 прошиваний.
Интраоперационных осложнений не отмечено. Кровопотеря не превышала 20 30 мл. Среднее время операций составило 112 мин. Больные активизировались в день операции, на 1-е сутки приступали к кормлению жидкой пищей. У одной пациентки в послеоперационном периоде развилась левосторонняя нижнедолевая пневмония. Послеоперационный койко-день составил 9,3, однако, у 3 больных необходимость стационарного пребывания диктовалась исключительно научными интересами.
Сроки наблюдения составляют 7 месяцев. Симптомов рефлюкса не отмечает ни одна пациентка, от медикаметнозной терапии отказались. На ЭГДС сохраняется созданная складка желудочно-пищеводного перехода, симптомы рефлюкс-эзофагита отсутствуют.
Таким образом, методика является адекватным способом устранения гастроэзофагеального рефлюкса, занимая промежуточное положение между медикаментозной терапией и лапароскопической операцией.
Траслюминальная хирургия (N.O.T.E.S.) TIF
2. Видео TIF (transoral incisionless fundoplication)
3. Видео применение на практике TIF с устройством EsophyX
.
У правильно отобранных пациентов применение трансоральной фундопликации приводит к устойчивому уменьшению размера грыж и эффективному восстановлению антирефлюксного механизма пищеводно-желудочного перехода.
Эффективность системы Esophyx изучалась в плацебо-контролируемом РКИ при участии 44 пациентов с ГЭРБ, которые были рандомизированы в группу трансоральной фундопликации (n=22) и в группу с симуляцией применения Esophyx (n=22) [90]. Критериями исключения были индекс массы тела (ИМТ) >35 кг/м2, IV степень состояния гастроэзофагеального створчатого клапана (ГЭСК) по классификации L. Hill и ГПОД более 3 см. По 17 пациентов в каждой группе имели ГПОД размером не более 3 см. Первичным изучаемым исходом была частота достижения ремиссии ГЭРБ через 6 мес после вмешательства. Вторичными исходами были применение ИПП, время воздействия кислоты на пищевод при рН-мониторинге, качество жизни по опроснику GERD-HRQL и излечение рефлюкс-эзофагита.
Через 6 мес после вмешательства у 13 (59%) больных из группы активного лечения сохранялась клиническая ремиссия без применения ИПП, в то время как в группе симуляции лечения ремиссия достигнута только у 4 (18%) пациентов. Результаты оценки всех вторичных исходов также были в пользу трансоральной фундопликации.
Исходя из полученных данных, авторы РКИ пришли к выводу, что идеальными кандидатами для трансоральной фундопликации являются пациенты с персистирующими симптомами ГЭРБ и со следующими анатомическими характеристиками:
― ГПОД <2 см без расширения диафрагмального отверстия;
― нормальная подвижность пищевода;
― отклонения в результатах длительной рН-метрии или наличие рефлюкс-эзофагита при эндоскопии или биопсии;
― II―III степень состояния ГЭСК по классификации L. Hill.
Долгосрочные результаты применения системы Esophyx были недавно представлены в исследовании G. Stefanidis и соавт. [91]. У 13 (29%) из 45 включенных в него пациентов с ГЭРБ были выявлены ГПОД размером 1―2 см. По результатам контроля при медиане периода наблюдения 59 мес после вмешательства фундопликация с помощью системы Esophyx привела к исчезновению симптомов рефлюкса у 72,7% пациентов с ГЭРБ, чувствительных к ИПП. Что касается ГПОД, то при эндоскопическом контроле через 3 мес после вмешательства у 8 (61,5%) пациентов из 13 с размером грыжи 1―2 см она уменьшилась до 0―1 см.
Результаты применения трансоральной фундопликации системой MUSE изучались в проспективном многоцентровом исследовании, включавшем 69 пациентов с ГЭРБ; исключались больные с ИМТ ≥35 кг/м2, множественной тяжелой сопутствующей патологией, ГПОД ≥3 см и эзофагитом Барретта [92].
Эффективность лечения оценивалась через 6 мес после процедуры по сравнению с исходными данными. Первичным клиническим исходом в исследовании было улучшение качества жизни по опроснику GERD-HRQL более чем на 50%. Вторичными конечными исходами были прекращение или более чем 50% снижение дозы ИПП и сокращение времени воздействия кислоты на пищевод при рН-мониторинге.
Исследование завершили 66 пациентов. Через 6 мес после процедуры оценка по шкале GERD-HRQL улучшилась более чем на 50% у 48 (73%) пациентов из 66 (95% ДИ 60―83%). Прекратили ежедневный прием ИПП 42 (64,6%) пациента. Из 23 пациентов, которые продолжали принимать ИПП после процедуры, 13 (56,5%) сообщили о более чем 50% снижении дозы.
За 6 мес среднее значение общего времени воздействия кислоты на пищевод с рН<4,0 статистически значимо снизилось по сравнению с исходными показателями (p<0,001). Наиболее распространенными побочными эффектами была боль в грудной клетке у 16 (22%) и в горле у 15 (21%) из 72 пациентов. Серьезные осложнения, требующие вмешательства (эмпиема плевры с пневмотораксом и желудочное кровотечение), отмечались у первых 24 субъектов. Летальных исходов не было.
Аналогичные результаты были получены в другом проспективном многоцентровом исследовании трансоральной фундопликации с помощью системы MUSE с 4-летним периодом наблюдения [93]. В этом исследовании у 21,6% пациентов ГЭРБ сопутствовали ГПОД.
Подводя итоги обзора доказательной базы новых эндоскопических антирефлюксных процедур в лечении ГПОД, следует отметить, что, являясь достаточно обоснованными методами лечения ГЭРБ, эти процедуры должны рассматриваться как экспериментальные вмешательства в терапии небольших ГПОД I типа у больных с ГЭРБ и не могут применяться при ПЭГ.
Никонов Е.Л. Хирургическое лечение грыж пищеводного отверстия диафрагмы и возможности новых эндоскопических процедур. Хирургия. Журнал им. Н.И. Пирогова. 2018;(5):96-105. https://doi.org/10.17116/hirurgia2018596-105
Список литературы:
2. Kohn GP, Price RR, DeMeester SR, Zehetner J, Muensterer OJ, Awad Z, Mittal SK, Richardson WS. SAGES Guidelines Committee. Guidelines for the management of hiatal hernia. Surgical Endoscopy. 2013;27(12):4409-4428. https://doi.org/10.1007/s00464-013-3173-3
3. Kavic SM, Segan RD, George IM, Turner PL, Roth JS, Park A. Classification of hiatal hernias using dynamic three-dimensional reconstruction. Surgical Innovation. 2006;13(1):49-52. https://doi.org/10.1177/155335060601300108
4. Hutter MM, Rattner DW. Paraesophageal and other complex diaphragmatic hernias. In: Yeo CJ (ed) Shackelford’s surgery of the alimentary tract. Philadelphia: Saunders Elsevier; 2007
5. Landreneau RJ, Del Pino M, Santos R. Management of paraesophageal hernias. Surgical Clinics of North America. 2005;85(3):411-432. https://doi.org/10.1016/j.suc.2005.01.006
6. Hutter MM, Rattner DW. Paraesophageal and other complex diaphragmatic hernias. In: Yeo CJ (ed) Shackelford’s surgery of the alimentary tract. Philadelphia: Saunders Elsevier; 2007.
7. Morino M, Giaccone C, Pellegrino L, Rebecchi F. Laparoscopic management of giant hiatal hernia: factors influencing long-term outcome. Surgical Endoscopy. 2006;20(7):1011-1016. https://doi.org/10.1007/s00464-005-0550-6
8. Awais O, Luketich JD. Management of giant paraesophageal hernia. Minerva chirurgica. 2009;64:159-168.
9. Litle VR, Buenaventura PO, Luketich JD. Laparoscopic repair of giant paraesophageal hernia. Advances in Surgery. 2001;35:21-38.
10. Mitiek MO, Andrade RS. Giant hiatal hernia. Annals of Thoracic Surgery. 2010;89(6):2168-2173. https://doi.org/10.1016/j.athoracsur.2010.03.022
11. Van Herwaarden MA, Samsom M, Smout AJPM. The role of hiatus hernia in gastro-oesophageal reflux disease. European Journal of Gastroenterology & Hepatology. 2004;16(9):831-835. https://doi.org/10.1097/00042737-200409000-00003
12. Curci JA, Melman LM, Thompson RW, Soper NJ, Matthews BD. Elastic fiber depletion in the supporting ligaments of the gastroesophageal junction: a structural basis for the development of hiatal hernia. Journal of the American College of Surgeons. 2008;207(2):191-196. https://doi.org/10.1016/j.jamcollsurg.2008.02.036
13. Baglaj SM, Noblett HR. Paraoesophageal hernia in children: familial occurrence and review of the literature. Pediatric Surgery International. 1999;15(2):85-87. https://doi.org/10.1007/s003830050522
14. Stefanidis D, Hope WW, Kohn GP, Reardon PR, Richardson WS, Fanelli RD. Guidelines for surgical treatment of gastroesophageal reflux disease. Surgical Endoscopy. 2010;24(11):2647-2669. https://doi.org/10.1007/s00464-010-1267-8
15. Al-Tashi M, Rejchrt S, Kopacova M, Tycova V, Siroky M, Repak R, Tacheci I, Douda T. Hiatal hernia and Barrett’s oesophagus impact on symptoms occurrence and complications. Casopis Lékaru Ceských. 2008;147:564-568.
16. Fujiwara Y, Nakao K, Inoue T, Koishi K, Nishio Y, Yagyu R, Nakagawa K, Yamamura T. Clinical significance of hiatal hernia in the development of gastroesophageal reflux after distal gastrectomy for cancer of the stomach. Journal of Gastroenterology and Hepatology. 2006;21(7):1103-1107. https://doi.org/10.1111/j.1440-1746.2006.04135.x
17. Siu CW, Jim MH, Ho HH, Chu F, Chan HW, Lau CP, Tse HF. Recurrent acute heart failure caused by sliding hiatus hernia. Postgraduate Medical Journal. 2005;81(954):268-269. https://doi.org/10.1136/pgmj.2004.023416
18. Gordon C, Kang JY, Neild PJ, Maxwell JD. The role of the hiatus hernia in gastro-oesophageal reflux disease. Alimentary Pharmacology & Therapeutics. 2004;20(7):719-732. https://doi.org/10.1111/j.1365-2036.2004.02149.x
19. Awais О, Luketich JD. Management of giant paraesophageal hernia. Minerva Chir. 2009;64:159-168.
20. Landreneau RJ, Del Pino M, Santos R. Management of paraesophageal hernias. Surgical Clinics of North America. 2005;85(3):411-432. https://doi.org/10.1016/j.suc.2005.01.006
21. Hashemi M, Sillin LF, Peters JH. Current concepts in the management of paraesophageal hiatal hernia. Journal of Clinical Gastroenterology. 1999;29(1):8-13. https://doi.org/10.1097/00004836-199907000-00005
22. Polomsky M, Siddall KA, Salvador R, Dubecz A, Donahue LA, Raymond D, Jones C, Watson TJ, Peters JH. Association of kyphosis and spinal skeletal abnormalities with intrathoracic stomach: a link toward understanding its pathogenesis. Journal of the American College of Surgeons. 2009;208(4):562-569. https://doi.org/10.1016/j.jamcollsurg.2009.01.004
23. Low DE, Simchuk EJ. Effect of paraesophageal hernia repair on pulmonary function. Annals of Thoracic Surgery. 2002;74(2):333-337. https://doi.org/10.1016/s0003-4975(02)03718-9
24. Treacy PJ, Jamieson GG. An approach to the management of para-oesophageal hiatus hernias. The Australian and New Zealand journal of surgery. 1987;57:813-817. https://doi.org/10.1111/j.1445-2197.1987.tb01271.x
25. Stylopoulos N, Gazelle GS, Rattner DW. Paraesophageal hernias: operation or observation? Annals of Surgery. 2002;236(4):492-501. https://doi.org/10.1097/00000658-200210000-00012
26. Harriss DR, Graham TR, Galea M, Salama FD. Paraoesophageal hiatal hernias: when to operate. Journal of the Royal College of Surgeons of Edinburgh. 1992;37:97-98.
27. Louie BE, Blitz M, Farivar AS, Orlina J, Aye RW. Repair of symptomatic giant paraesophageal hernias in elderly (>70 years) patients results in improved quality of life. Journal of Gastrointestinal Surgery. 2011;15(3):389-396. https://doi.org/10.1007/s11605-010-1324-6
28. Bawahab M, Mitchell P, Church N, Debru E. Management of acute paraesophageal hernia. Surgical Endoscopy. 2008;23(2):255-259. https://doi.org/10.1007/s00464-008-0190-8
29. Allen MS, Trastek VF, Deschamps C, Pairolero PC. Intrathoracic stomach. Presentation and results of operation. Journal of Thoracic and Cardiovascular Surgery. 1993;105:253-258.
30. Hallissey MT, Ratliff DA, Temple JG. Paraoesophageal hiatus hernia: surgery for all ages. Annals of the Royal College of Surgeons of England. 1992;74:23-25.
31. Pitcher DE, Curet MJ, Martin DT, Vogt DM, Mason J, Zucker KA. Successful laparoscopic repair of paraesophageal hernia. Archives of Surgery. 1995;130(6):590-596. https://doi.org/10.1001/archsurg.1995.01430060028006
32. Gantert WA, Patti MG, Arcerito M, Feo C, Stewart L, DcPinto M, Bhoyrul S, Rangel S. Laparoscopic repair of paraesophageal hiatal hernias. Journal of the American College of Surgeons. 1998;186(4):428-432. https://doi.org/10.1016/s1072-7515(98)00061-1
33. Carlson MA, Condon RE, Ludwig KA, Schulte WJ. Management of intrathoracic stomach with polypropylene mesh prosthesis reinforced transabdominal hiatus hernia repair. Journal of the American College of Surgeons. 1998;187(3):227-230. https://doi.org/10.1016/s1072-7515(98)00162-8
34. Fisichella PM. A synopsis of techniques for paraesophageal hernia repair: Different approaches to current controversies. Surgical Laparoscopy Endoscopy & Percutaneous Techniques. 2013;23(5):423-424. https://doi.org/10.1097/sle.0b013e3182a11f67
35. Fisichella PM, Patti MG. Laparoscopic repair of paraesophageal hiatal hernias. Journal of Laparoendoscopic & Advanced Surgical Techniques. 2008;18(4):629-632. https://doi.org/10.1089/lap.2007.0235
36. Patti MG, Fisichella PM. Laparoscopic paraesophageal hernia repair. I low I do it. Journal of Gastrointestinal Surgery. 2009;13(9):1728-1732. https://doi.org/10.1007/s11605-008-0745-y
37. Paul S, Nasar A, Port JL, Lee PC, Stiles BC, Nguyen AB, Altorki NK, Sedrakyan A. Comparative analysis of diaphragmatic hernia repair outcomes using the nationwide inpatient sample database. Archives of Surgery. 2012;147(7):607-612. https://doi.org/10.1001/archsurg.2012.127
38. Draaisma WA, Gooszen HG, Tournoji E, Broeders LA. Controversies in paraesophageal hernia repair: a review of literature. Surgical Endoscopy. 2005;19(10):1300-1308. https://doi.org/10.1007/s00464-004-2275-3
39. Chrysos E, Tsiaoussis J, Athanasakis E, Zoras O, Vassilakis JS, Xynos E. Laparoscopic vs open approach for Nissen fundoplication. A comparative study. Surgical Endoscopy. 2002;16(12):1679-1684. https://doi.org/10.1007/s00464-001-9101-y
40. Luketich ID, Nason KS, Christie NA, Pennathur A, Jobe BA, Landreneau RJ, Schuchert MJ. Outcomes after a decade of laparoscopic giant paraesophageal hernia repair. Journal of Thoracic and Cardiovascular Surgery. 2010;139(2):395-404. https://doi.org/10.1016/j.jtcvs.2009.10.005
41. Ferri LE, Feldman LS, Stanbridge D, Mayrand S, Stein L, Fried GM. Should laparoscopic paraesophageal hernia repair be abandoned in favor of the open approach? Surgical Endoscopy. 2005;19(1):4-8. https://doi.org/10.1007/s00464-004-8903-0
42. Zehetner J, Demeester SR, Ayazi S, Kilday P, Augustin F, Hagen A, Lipham JC, Sohn HJ. Laparoscopic versus open repair of paraesophageal hernia: the second decade. Journal of the American College of Surgeons. 2011;212(5):813-820. https://doi.org/10.1016/j.jamcollsurg.2011.01.060
43. Swanstrom LL, Marcus DR, Galloway GQ. Laparoscopic Collis gastroplasty is the treatment of choice for the shortened esophagus. American Journal of Surgery. 1996;171(5):477-481. https://doi.org/10.1016/s0002-9610(96)00008-6
44. DeMeester SR, Sillin LF, Lin HW, Gurski RR. Increasing esophageal length: a comparison of laparoscopic versus transthoracic esophageal mobilization with and without vagal trunk division in pigs. Journal of the American College of Surgeons. 2003;197(4):558-564. https://doi.org/10.1016/s1072-7515(03)00481-2
45. Bawahab M, Mitchell P, Church N, Debru E. Management of acute paraesophageal hernia. Surgical Endoscopy. 2008;23(2):255-259. https://doi.org/10.1007/s00464-008-0190-8
46. Geha AS, Massad MG, Snow NJ, Baue AЕ. A 32-year experience in 100 patients with giant paraesophageal hernia: the case for abdominal approach and selective antireflux repair. Surgery. 2000;128(4):623-630. https://doi.org/10.1067/msy.2000.108425
47. Haider M, Iqbal A, Salinas V, Karu A, Mittal SK, Filipi CJ. Surgical repair of recurrent hiatal hernia. Hernia. 2006;10(1):13-19. https://doi.org/10.1007/s10029-005-0034-6
48. Allison PR. Hiatus hernia: a 20-year retrospective survey. Annals of Surgery. 1973;178:273-276. https://doi.org/10.1097/00000658-197309000-00006
49. Furnee EJ, Draaisma WA, Gooszen HG, Hazebroek EJ, Smout AJ, Broeders IA. Tailored or routine addition of an antireflux fundoplication in laparoscopic large hiatal hernia repair: a comparative cohort study. World Journal of Surgery. 2011;35(1):78-84. https://doi.org/10.1007/s00268-010-0814-8
50. Casabella F, Sinanan M, Horgan S, Pellegrini CA. Systematic use of gastric fundoplication in laparoscopic repair of paraesophageal hernias. American Journal of Surgery. 1996;171(5):485-489. https://doi.org/10.1016/s0002-9610(97)89609-2
51. Ponsky J, Rosen M, Fanning A, Malm J. Anterior gastropexy may reduce the recurrence rate after laparoscopic paraesophageal hernia repair. Surgical Endoscopy. 2003;17(7):1036-1041. https://doi.org/10.1007/s00464-002-8765-2
52. Poncet G, Robert M, Roman S, Boulez JC. Laparoscopic repair of large hiatal hernia without prosthetic reinforcement: late results and relevance of anterior gastropexy. Journal of Gastrointestinal Surgery. 2010;14(12):1910-1916. https://doi.org/10.1007/s11605-010-1308-6
53. Diaz S, Brunt LM, Klingensmith ME, Frisella PM, Soper NJ. Laparoscopic paraesophageal hernia repair, a challenging operation: medium-term outcome of 116 patients. Journal of Gastrointestinal Surgery. 2003;7(1):59-67. https://doi.org/10.1016/s1091-255x(02)00151-8
54. Mittal SK, Bikhchandani J, Gurney O, Yano F, Lee T. Outcomes after repair of the intrathoracic stomach: objective follow-up of up to 5 years. Surgical Endoscopy. 2011;25(2):556-566. https://doi.org/10.1007/s00464-010-1219-3
55. Rosenberg J, Jacobsen B, Fischer A. Fast-track giant paraoesophageal hernia repair using a simplified laparoscopic technique. Langenbeck’s Archives of Surgery. 2006;391(1):38-42. https://doi.org/10.1007/s00423-005-0008-2
56. Agwunobi AO, Bancewicz J, Attwood SE. Simple laparoscopic gastropexy as the initial treatment of paraoesophageal hiatal hernia. British Journal of Surgery. 1998;85(5):604-606. https://doi.org/10.1046/j.1365-2168.1998.00639.x
57. Edye MB, Canin-Endres J, Gattomo F, Salky BA. Durability of laparoscopic repair of paraesophageal hernia. Annals of Surgery. 1998;228(4):528-535. https://doi.org/10.1097/00000658-199810000-00009
58. Watson DI, Davies N, Devitt PG, Jamieson GG. Importance of dissection of the hernial sac in laparoscopic surgery for large hiatal hernias. Archives of Surgery. 1999;134(10):1069-1073. https://doi.org/10.1001/archsurg.134.10.1069
59. Edye M, Salky B, Posner A, Fierer A. Sac excision is essential to adequate laparoscopic repair of paraesophageal hernia. Surgical Endoscopy. 1998;12(10):1259-1263. https://doi.org/10.1007/s004649900832
60. Trus TL, Bax T, Richardson WS, Branum GD, Mauren SJ, Swanstrom LL, Hunter JG. Complications of laparoscopic paraesophageal hernia repair. Journal of Gastrointestinal Surgery. 1997;1(3):221-228. https://doi.org/10.1016/s1091-255x(97)80113-8
61. Leeder PC, Smith G, Dehn TC. Laparoscopic management of large paraesophageal hiatal hernia. Surgical Endoscopy. 2003;17:1372-1375. https://doi.org/10.1007/s00464-002-9192-0
62. Peters JH. SAGES guidelines for the management of hiatal hernia. Surgical Endoscopy. 2013;27(12):4407-4408. https://doi.org/10.1007/s00464-013-3212-0
63. Hashemi M, Peters JH, DeMeester TR, Huprich JE, Quck M, Hagen JA, Crookes PF, Theisen J. Laparoscopic repair of large type III hiatal hernia: objective followup reveals high recurrence rate. Journal of the American College of Surgeons. 2000;190(5):553-560. https://doi.org/10.1016/s1072-7515(00)00260-x
64. Wiechmann RJ, Ferguson MK, Naunheim KS, McKesey P, Hazelrigg SJ, Santucci TS, Macherey RS, Landreneau RJ. Laparoscopic management of giant paraesophageal herniation. Annals of Thoracic Surgery. 2001;71(4):1080-1086. https://doi.org/10.1016/s0003-4975(00)01229-7
65. Granderath FA, Kamolz Th, Pointner R. Gastroesophageal Reflux Disease. Wien: Springer-Verlag; 2006. https://doi.org/10.1007/3-211-32317-1
66. Tatum R, Shalltub S, Oelschlager B, Pellegrini C. Complications of PTFE mesh at the diaphragmatic hiatus. Journal of Gastrointestinal Surgery. 2007;12(5):953-957. https://doi.org/10.1007/s11605-007-0316-7
67. Varga G, Cseke L, Kalmar K, Horvath OP. Laparoscopic repair of large hiatal hernia with teres ligament: midterm followup: a new surgical procedure. Surgical Endoscopy. 2007;22(4):881-884. https://doi.org/10.1007/s00464-007-9648-3
68. Quilici PJ, McVay C, Tovar A. Laparoscopic antireflux procedures with hepatic shoulder technique for the surgical management of large paraesophageal hernias and gastroesophageal reflux disease. Surgical Endoscopy. 2009;23(11):2620-2623. https://doi.org/10.1007/s00464-009-0452-0
69. Oelschlager В, Pellegrini С, Hunter J. Biologic prosthesis reduces recurrence after laparoscopic paraesophageal hernia repair: a multicenter, prospective, randomized trial. Annals of Surgery. 2006;244:4:481-490. https://doi.org/10.1016/j.ysur.2011.12.002
70. Varela J, Jacks S. Laparoscopic circular biomesh hiatoplasty during paraesophageal hernia repair. Surgical Innovation. 2009;16(2):124-128. https://doi.org/10.1177/1553350609336420
71. Zehetner J, Lipham J, Ayazi S, Oezcelik A, Abate E, ChenW, DeMeester SR, Sohnet HJ. A simplified technique for in-trathoracic stomach repair: laparoscopic fundoplication with Vicryl mesh and BioGlue crural reinforcement. Surgical Endoscopy. 2009;24(3):675-679. https://doi.org/10.1007/s00464-009-0662-5
72. Ochsner JL, Hughes JP, Mills NL. Repair of hiatal hernia: description and long-term results of a technique. American Journal of Surgery. 1965;41:626-631.
73. El Sherif A, Yano F, Mittal S, Filipi CJ. Collagen metabolism and recurrent hiatal hernia: cause and effect? Hernia. 2006;10(6):511-520. https://doi.org/10.1007/s10029-006-0152-9
74. Huddy JR, Markar SR, Ni MZ. Laparoscopic repair of hiatus hernia: Does mesh type influence outcome? A meta-analysis and European survey study. Surgical Endoscopy. 2016;30(12):5209-5221. https://doi.org/10.1007/s00464-016-4900-3
75. Watson DI, Thompson SK, Devitt PG. Laparoscopic repair of very large hiatus hernia with sutures versus absorbable mesh versus nonabsorbable mesh: A randomized controlled trial. Annals of Surgery. 2015;261(2):282-289. https://doi.org/10.1097/sla.0000000000000842
76. Griffith PS, Valenti V, Qurashi K, Martinez-Isla A. Rejection of goretex mesh used in prosthetic cruroplasty: a case series. International Journal of Surgery. 2008;6(2):106-109. https://doi.org/10.1016/j.ijsu.2007.12.004
77. Stadlhuber R, Sherif A, Mittal S. Mesh complications after prosthetic reinforcement of hiatal closure: a 28-case series. Surgical Endoscopy. 2008;23(6):1219-1226. https://doi.org/10.1007/s00464-008-0205-5
78. Rumstadt B, Kahler G, Mickisch O, Schilling D. Gastric mesh erosion after hiatoplasty for recurrent paraesophageal hernia. Endoscopy. 2008;40(2):70. https://doi.org/10.1055/s-2007-995332
79. Diwan TS, Ujiki MB, Dunst CM, Swanstrom LL. Biomesh placement in laparoscopic repair of paraesophageal hernias. Surgical Innovation. 2008;15(3):184-187. https://doi.org/10.1177/1553350608323062
80. Jansen M, Otto J, Jansen PL, Anurov M, Titkova S, Willis S, Rosch R, Ottinger A. Mesh migration into the esophageal wall after mesh hiatoplasty: comparison of two alloplastic materials. Surgical Endoscopy. 2007;21(12):2298-2303. https://doi.org/10.1007/s00464-007-9514-3
81. Kemppainen E, Kiviluoto T. Fatal cardiac tamponade after emergency tension-free repair of a large paraesophageal hernia. Surgical Endoscopy. 2000;14:593.
82. Triadafilopoulos G. Endoscopic options for gastroesophageal reflux: where are we now and what does the future hold? Current Gastroenterology Reports. 2016;18(9):47. https://doi.org/10.1007/s11894-016-0521-1
83. Triadafilopoulos G. Stretta: a valuable endoscopic treatment modality for gastroesophageal reflux disease. World Journal of Gastroenterology. 2014;20(24):7730-7738. https://doi.org/10.3748/wjg.v20.i24.7730
84. Noar M, Squires P, Noar E, Lee M. Long-term maintenance effect of radiofrequency energy delivery for refractory GERD: a decade later. Surgical Endoscopy. 2014;28(8):2323-2333. https://doi.org/10.1007/s00464-014-3461-6
85. Utley DS, Kim M, Vierra MA, Triadafilopoulos G. Augmentation of lower esophageal sphincter pressure and gastric yield pressure after radiofrequency energy delivery to the gastroesophageal junction: a porcine model. Gastrointestinal Endoscopy. 2000;52(1):81-86. https://doi.org/10.1067/mge.2000.105981
86. Arts J, Bisschops R, Blondeau K, Farre R, Vos R, Holvoet L, Caenepeel P, Lerut A. A double-blind sham-controlled study of the effect of radiofrequency energy on symptoms and distensibility of the gastro-esophageal junction in GERD. American Journal of Gastroenterology. 2011;107(2):222-230. https://doi.org/10.1038/ajg.2011.395
87. Corley DA, Katz P, Wo JM. Improvement of gastroesophageal reflux symptoms after radiofrequency energy: a randomized, sham-controlled trial. Gastroenterology. 2003;125(3):668-676. https://doi.org/10.1016/s0016-5085(03)01052-7
88. Aziz AM, El-Khayat HR, Sadek A, Mattar SG, McNulty G, Kongkam P, Guda MF, Lehman GA. A prospective randomized trial of sham, single-dose Stretta, and double-dose Stretta for the treatment of gastroesophageal reflux disease. Surgical Endoscopy. 2009;24(4):818-825. https://doi.org/10.1007/s00464-009-0671-4
89. Testoni PA, Mazzoleni G, Testoni SG. Transoral incisionless fundoplication for gastro-esophageal reflux disease: Techniques and outcomes. World Journal of Gastrointestinal Pharmacology and Therapeutics. 2016;6:7(2):179-189. https://doi.org/10.4292/wjgpt.v7.i2.179
90. Hakansson В, Montgomery M, Cadiere GB. Randomised clinical trial: transoral incisionless fundoplication vs. sham intervention to control chronic GERD. Alimentary Pharmacology & Therapeutics. 2015;42:1261-1270. https://doi.org/10.1111/apt.13427
91. Stefanidis G, Viazis N, Kotsikoros N, Tsoukalas N, Lala E, Theocharis L, Fassaris A, Manolakopoulos S. Long-term benefit of transoral incisionless fundoplication using the esophyx device for the management of gastroesophageal reflux disease responsive to medical therapy. Diseases of the Esophagus. 2016;30(3):1-8. https://doi.org/10.1111/dote.12525
92. Zacherl J, Roy-Shapira A, Bonavina L, Bapaye A, Kiesslich R, Schoppmann SF, Kessler WR, Selzer DJ. Endoscopic anterior fundoplication with the Medigus Ultrasonic Surgical Endostapler (MUSE™) for gastroesophageal reflux disease: 6-month results from a multi-center prospective trial. Surgical Endoscopy. 2014;29(1):220-229. https://doi.org/10.1007/s00464-014-3731-3
93. Kim HJ, Kwon CI, Kessler WR, Selzer DJ, McNulty G, Bapaye A, Bonavina L, Lehman GA. Long-term follow-up results of endoscopic treatment of gastroesophageal reflux disease with the MUSE™ endoscopic stapling device. Surgical Endoscopy. 2015;30(8):3402-3408. https://doi.org/10.1007/s00464-015-4622-y
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.















.jpg)




.png)















Комментарии