- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Дайджест
- QuaCol
- Разделы
- Пациентy
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Неотложные состояния пищевода: рекомендации WSES (Всемирного общества экстренной хирургии)
Аннотация:
Пищевод проходит через три отдела тела (шею, грудную клетку и брюшную полость) и на каждом уровне окружен жизненно важными органами.
Ключевые слова: перфорация пищевода, проглатывание каустика, неотложная помощь, проглатывание инородного тела, травма пищевода.
Полный текст статьи:
Травмы пищевода представляют собой редкое, но потенциально летальное клиническое состояние. Управление чрезвычайными ситуациями является сложной задачей, и уровень смертности остается высоким. Своевременное и надлежащее лечение травм пищевода (ЭП) является наиболее важным фактором, определяющим исход лечения пациентов. Лечение является междисциплинарным и включает в себя врачей неотложной помощи, травматологов, общих и торакальных хирургов, анестезиологов, оториноларингологов, гастроэнтерологов и радиологов. Из-за редкости этих травм у большинства врачей будет ограниченный личный опыт лечения ЭИ. Терапия ЭИ основана на локализации (шея, грудная клетка, живот), причине и степени поражения пищевода. Задержка в предоставлении соответствующего лечения остается доминирующим фактором риска смерти.
Цель настоящего обзора - предоставить практикующим специалистам, которые могут быть привлечены для оказания экстренной помощи при EI, легкодоступный комплексный инструмент для помощи в процессе принятия решений.
Материалы и методы:
Для целей статьи мы использовали этиологическую классификацию повреждений пищевода: (1) заглатывание инородного тела, (2) проглатывание едкого вещества, (3) перфорация пищевода (ятрогенная и спонтанная) и (4) травма пищевода. Ведущим специалистам в этой области было предложено провести тщательный поиск в MEDLINE и EMBASE соответствующих статей по каждой из этих тем в период с 1985 по июнь 2018 года. Их попросили сфокусировать свой поиск, чтобы предоставить основанные на фактах ответы на соответствующие вопросы с немедленным практическим применением. применение. Темы были представлены и открыты для обсуждения на 5-м конгрессе WSES в Бертиноро, Италия, 28–30 июня 2018 г. Уровень доказательности для каждого утверждения рекомендации был определен с использованием системы оценок, предложенной Оксфордским центром доказательной медицины [ 1 ].
В конце концов, были разработаны научно обоснованные руководства по ведению ЭИ с изложением клинических рекомендаций.
Проглатывание инородного тела
В США заглатывание инородных тел пищевода (FB) составляет более 100 000 случаев в год. У детей обычное явление - случайное проглатывание монет, батареек, игрушек и магнитов. Случайное проглатывание также происходит у взрослых, часто в связи с интоксикацией, или у пожилых людей с когнитивными нарушениями; намеренный прием пищи у пациентов с психическими расстройствами или заключенными не нечастыми [ 2 - 4 ]. Поражение ПБ пищевода зависит от размера и формы ПБ. Падение обычно происходит на уровне гипофаринкса или в верхнем отделе грудного отдела пищевода по анатомическим (перстневидный глоток, дуга аорты) и физиологическим причинам (зона низкого давления в точке перехода между поперечнополосатыми и гладкими мышечными волокнами) [ 5 , 6]. Взрослые без нарушений и дети старшего возраста обычно могут идентифицировать проглатывание инородного тела и могут указывать на определенную область дискомфорта. Однако дети и умственно отсталые взрослые могут не сообщать в анамнезе о проглатывании инородных тел [ 2 ]. Типичная клиническая картина - острое начало дисфагии или неспособности глотать слюну. К другим связанным клиническим признакам относятся одинофагия, болезненность шеи, загрудинная боль, боль в горле, ощущение инородного тела, рвота, рвота и слюнотечение. У пациентов с обструкцией дыхательных путей или аспирацией могут наблюдаться удушье, стридор и одышка. Физические данные экзаменационные включают наличие лихорадки, цервикальный подкожной эмфиземы или эритема и болезненность в случае осложнений [ 6 - 8 ].
Какие биохимические исследования и методы визуализации являются подходящими?
Первоначальная оценка должна основываться на истории болезни пациента и физическом обследовании. Рекомендуемые биохимические исследования - это общий анализ крови (CBC), C-реактивный белок (CRP), анализ газов крови на избыток оснований и лактата (степень 2C).
Рентгенограммы шеи, грудной клетки и брюшной полости полезны для оценки наличия, расположения, формы и размера рентгеноконтрастных предметов или предметов неизвестной формы (степень 1C). Простая рентгенограмма шеи, грудной клетки и брюшной полости полезна для оценки наличия, местоположения, размера, формы и количества проглоченных предметов и возможных признаков перфорации. Обычная рентгенография обычно используется для начального скрининга, но частота ложноотрицательных результатов достигает 47%. Бипланарная рентгенография полезна для уменьшения количества ложноотрицательных результатов, а боковая проекция важна для дифференциации трахеобронхиальных и пищеводных FB. В случае попадания пищевого комка, тонких металлических предметов, предметов из дерева и пластика, осколков стекла, рыбных или куриных костей частота ложноотрицательных результатов при рентгенологической оценке достигает 85% [ 9 , 10 ].
Компьютерная томография (КТ) должна выполняться пациентам с подозрением на перфорацию или другие осложнения, которые могут потребовать интервенционной эндоскопии или хирургического вмешательства (степень 1B). В проспективном одноцентровом исследовании с участием 358 взрослых пациентов с симптомами поражения костей рыб чувствительность обычного рентгеновского снимка составила 32%, тогда как чувствительность компьютерной томографии составила 90–100%, а специфичность - 93,7–100%. По этой причине компьютерную томографию следует рассматривать как важный инструмент для взрослых пациентов, сообщающих о случайном проглатывании или подозрении на проглатывание костных фрагментов и отрицательных рентгеновских снимках. Кроме того, компьютерная томография необходима при подозрении на осложнение, связанное с ФБ (перфорация, абсцесс, медиастинит, свищи аорты / трахеи) [ 11 - 13 ].
Глотание контрастного вещества не рекомендуется и не должно откладывать другие исследования / вмешательства (степень 1B). Следует избегать пероральных контрастных исследований (исследования бария или гастрографина) у пациентов с полной непроходимостью пищевода и неспособностью глотать слюну из-за повышенного риска аспирации. Кроме того, проглатывание бария может покрывать инородное тело и слизистую пищевода, что ухудшает эндоскопическую визуализацию. В любом случае исследования орального контрастирования не должны откладывать другие исследования / вмешательства [ 14 , 15 ].
Какие показания к эндоскопии?
Терапевтическая гибкая эндоскопия рекомендуется в качестве первой линии лечения стойких инородных тел пищевода (степень 1B), хотя 80–90% проглоченных инородных тел спонтанно проходят через желудочно-кишечный тракт. У пациентов со стойкими пищеводными симптомами следует проводить эндоскопическое обследование, даже если рентгенологическое исследование отрицательное. Кроме того, у пациентов с пищей болюсного сдавлением и без признаков осложнений, эндоскопия может быть выполнена первым [ 16 - 18 ]. Это будет зависеть от местных практик, но в большинстве случаев потребуется ввод анестетика, и часто для защиты дыхательных путей будет использоваться общий наркоз с интубацией трахеи.
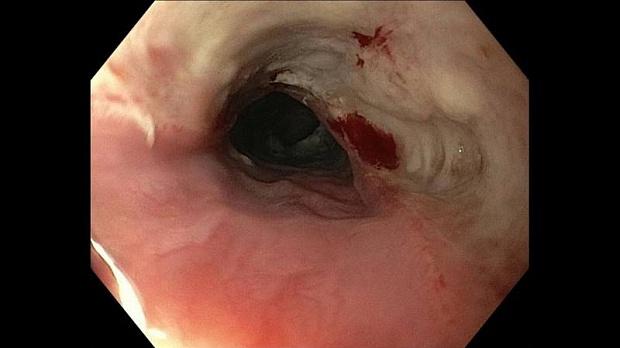
Эмерджентная гибкая эндоскопия (желательно в течение 2 часов, но не позднее 6 часов) рекомендуется для острых предметов, батарей, магнитов и инородных тел, вызывающих полную непроходимость пищевода (степень 1B). Экстренная гибкая эндоскопия должна выполняться (а) при наличии острых предметов из-за высокого риска перфорации на всю толщину (до 35%); (b) в случае проглатывания дисковой батареи из-за риска некроза под давлением, электрических ожогов и химических травм (рис. 1); (c) в случае проглатывания магнита из-за некроза под давлением; и (d) в случае пищевого комка приема с полной обструкцией пищевода из-за риском аспирации, а также перфорация [ 19 - 22 ].
Срочная (<24 ч) гибкая эндоскопия рекомендуется для других инородных тел пищевода без полной непроходимости (степень 1B) [ 19 - 22 ].
Мягкое введение болюса в желудок рекомендуется для лечения закупорки пищевода пищевым болюсом. Если эта процедура не увенчалась успехом, следует рассмотреть возможность извлечения (уровень 1С). Было показано, что в случае введения пищевого болюса инсуффляция воздуха и легкое инструментальное нажатие (техника толчка) связаны с низким уровнем осложнений и вероятностью успеха до 90%. Если большой FB застрял в нижнем отделе пищевода, техника толчка может повлиять на него еще больше; можно использовать осторожное прохождение баллонного катетера (катетер для извлечения камня ERCP) мимо FB и надувание баллона с извлечением, чтобы попытаться ослабить FB, который затем может быть извлечен в сетку. Методы извлечения с использованием корзин, ловушек и захватных щипцов следует рассматривать в случае наличия устойчивых или острых предметов [ 18 ,23 ]. В сложных случаях может потребоваться комбинация техник.
В дополнение к терапевтической эндоскопии рекомендуется диагностическое обследование потенциального основного заболевания, включая гистологическое исследование (степень 1B). Основное заболевание пищевода может быть обнаружено у 25% пациентов. Наиболее часто ассоциированными заболеваниями являются стриктура пищевода, грыжа пищеводного отверстия диафрагмы, перепонка пищевода или кольцо Шацки, эозинофильный эзофагит, ахалазия и опухоли. Скрытый эозинофильный эзофагит может быть диагностирован у 9% пациентов [ 6 , 8 , 24 - 26 ].
Гибкая и жесткая эндоскопия - это дополнительные / перекрестные методы. Гибкая эндоскопия остается подходом «первой линии» к ФБ; ригидная эндоскопия считается терапией «второй линии» (уровень 2B). Жесткая эндоскопия с использованием жестких эндоскопов должна рассматриваться в случае локализации ФБ в верхнем отделе пищевода (ахиллесова пята гибкой эндоскопии) и в случае приема ФБ с сопутствующими респираторными симптомами или подозрением на ФБ в верхних дыхательных путях [ 26 - 28 ]. Другой вариант - использовать двустворчатый дивертикулоскоп Weerda, поскольку он позволяет расширить и открыть верхний сфинктер пищевода. Также возможен комбинированный подход с использованием гибкого эндоскопа, вводимого через дивертикулоскоп Weerda [ 29 , 30]. Кроме того, с помощью дивертикулоскопа можно использовать лапароскопические захватные щипцы для извлечения. Недавний метаанализ, сравнивающий гибкую и жесткую эндоскопию для извлечения верхней части пищевода FB, показал, что оба метода были эффективными и безопасными, с одинаковым успехом и общей частотой осложнений [ 31 ].
Кому следует пройти хирургическое лечение и каковы подходящие сроки для операции?
Возможные показания к хирургическому лечению включают безвозвратное инородное тело, перфорацию, FB вблизи жизненно важных структур (дуга аорты) и другие осложнения (степень 1B). В случае перфорации пищевода с обширным плевральным / медиастинальным загрязнением (степень 1B) следует немедленно приступить к хирургическому вмешательству. До 1–3% пациентов нуждаются в хирургическом вмешательстве из-за осложнений (перфорация, безвозвратные инородные тела, медиастинит, эмпиема плевры, свищ, сильное кровотечение) [ 5 , 6 , 15 , 18 , 32 ].
Какие хирургические процедуры наиболее подходят?
Хирургический подход зависит от места поражения ФБ, сопутствующих заболеваний и состояния пациента (степень 1B). Минимально инвазивные методы лечения следует рассматривать в качестве лечения первой линии в специализированных центрах (уровень 1С). Эзофаготомию с экстракцией FB и первичным закрытием следует рассмотреть в случае ограниченного контаминации плевры / средостения и витальных краев (степень 1C). В зависимости от расположения ФБ и сопутствующих заболеваний у пациента могут использоваться различные хирургические подходы (левая цервикотомия, правосторонняя / левая торакотомия, минимально инвазивная правосторонняя / левая торакоскопия, торакоскопия на животе, лапароскопия и лапаротомия) [ 5 , 6 , 15]. Открытая или малоинвазивная эзофаготомия с первичной пластикой может использоваться в случаях ограниченного контаминации средостения и жизненных краев перфорации. В случае обширного контаминации следует рассмотреть возможность экстренной эзофагэктомии с первичной или отсроченной реконструкцией [ 33 - 37 ].
Коррозионное проглатывание
Коррозионное проглатывание - редкое, но потенциально разрушительное событие, которое может привести к смерти пациента. У выживших он несет ответственность за проблемы с глотанием, снижение качества жизни и значительное бремя для систем здравоохранения. Реальная заболеваемость в настоящее время неизвестна, поскольку о проглатывании коррозионных агентов во всем мире, вероятно, в значительной степени занижается информация [ 38 , 39]. У детей проглатывание происходит случайно, и тяжелые травмы редки. Массовое суицидальное заглатывание сильнодействующих коррозионных агентов обычно происходит у взрослых, страдающих психическими заболеваниями, и требует агрессивного экстренного лечения. Принято считать, что клинические симптомы не коррелируют достоверно со степенью поражения желудочно-кишечного тракта; отсутствие боли и повреждений ротовой полости не исключает опасных для жизни повреждений желудочно-кишечного тракта [ 38 - 44 ]. Надлежащее лечение коррозионных травм в условиях неотложной помощи влияет на исходы пациентов [ 45 ].
Каковы возможные этиологии и как они влияют на клиническую картину и варианты лечения?
Сильные кислоты и щелочи вызывают самые тяжелые едкие повреждения желудочно-кишечного тракта. Идентификация природы, физической формы и количества проглоченного агента, а также случайного добровольного проглатывания являются краеугольными камнями для оказания неотложной помощи при коррозионных повреждениях (степень 2A). Рекомендуется обратиться в токсикологические центры для оценки системной токсичности проглоченных агентов (степень 2B). В случае массивного проглатывания и кислоты, и щелочи могут вызвать обширный некроз желудочно-кишечного тракта [ 45 ]. Окислители (отбеливатель) обычно вызывают легкие травмы, но иногда сообщалось о серьезных повреждениях, требующих экстренной резекции [ 45]. Прием аммиака приводит к поверхностному геморрагическому гастриту, который может прогрессировать в течение первых 24–48 часов и требует особого наблюдения [ 38 ]. Количество проглоченного коррозионного агента связано со случайным / добровольным проглатыванием; это наиболее важный прогностический фактор, хотя надежная информация обычно отсутствует [ 46]. Физическая форма проглоченного вещества - еще один важный фактор, определяющий характер повреждения желудочно-кишечного тракта. Твердые вещества наносят максимальный ущерб ротовой полости и глотке, а жидкости быстро проходят и вызывают ожоги пищевода и желудка; сопутствующее вдыхание паров (аммиак, формальдегид) может вызвать ожоги дыхательных путей. Лица, осуществляющие уход, должны знать, что определенные едкие вещества могут также вызывать серьезные системные эффекты, такие как гипокальциемия (фосфорная, плавиковая кислоты), гипонатриемия (сильные кислоты / щелочи), гипокалиемия и ацидоз [ 38 ].
Каковы соответствующие биохимические исследования и методы визуализации?
Первоначальная лабораторная оценка повреждений едким веществом должна включать общий анализ крови, сывороточные концентрации натрия, калия, хлора, магния, кальция, креатинина мочевины, тесты печени (билирубин, аланинаминотрансфераза, аспартатаминотрансфераза), pH и лактат сыворотки, уровень алкоголя в крови и измерение β-ХГЧ у молодых женщин (степень 2А). Результаты лабораторных исследований и визуализации играют важную роль в выявлении пациентов с трансмуральным некрозом, которым может помочь экстренное хирургическое лечение. Поскольку исходные нормальные лабораторные показатели не исключают трансмуральный некроз, кинетика лабораторных данных полезна для наблюдения за пациентом и ведения пациента [ 47 , 48 ]. Аномальные значения, такие как тяжелый ацидоз (низкий pH, высокий уровень лактата в крови) [ 49 ], нарушение функциональных тестов печени [49 ], лейкоцитоз, повышенный уровень CRP [ 39 ], почечная недостаточность [ 47 ] и тромбоцитопения [ 50 ] являются прогностическими факторами трансмурального некроза и неблагоприятных исходов.
Рентгенограммы шеи, грудной клетки и брюшной полости могут показать наличие свободного воздуха у пациентов с перфорацией желудочно-кишечного тракта (степень 3A). Экстренное управление при проглатывании каустика можно безопасно выполнять, полагаясь на компьютерную томографическую оценку (степень 2A). Недавние исследования показали, что экстренная компьютерная томография (КТ) с контрастным усилением превосходит эндоскопию в обнаружении трансмуральных повреждений желудочно-кишечного тракта после проглатывания каустика и в прогнозировании образования стриктуры пищевода [ 48 , 51 , 52]. КТ шеи, грудной клетки и брюшной полости следует выполнять через 3–6 ч после приема внутрь, до и после внутривенной инъекции (2–3 мл / с) неионного контрастного вещества (Иомерон 350; 2 мл / кг) с Время сбора данных от 18 до 25 с и задержка сканирования 90 с. Основным признаком трансмурального пищеварительного некроза является отсутствие постконтрастного усиления стенки, а его наличие на любом уровне (пищевод, желудок, двенадцатиперстная кишка, кишечник, толстая кишка) является показанием к экстренной операции [ 38 ]. Четырехэтапная КТ-классификация каустических повреждений пищевода (рис. 2) может использоваться, когда: травмы степени I демонстрируют однородное усиление стенки пищевода при отсутствии отека стенки и жировых отложений средостения; Травмы степени IIa демонстрируют внутреннее усиление слизистой оболочки пищевода и гиподенситный аспект стенки пищевода, который кажется утолщенным, в то время как сопутствующее усиление внешней стенки пищевода может иногда давать «целевой» аспект; Травмы степени IIb проявляются в виде тонкого ободка усиления внешней стенки; некротизированная слизистая оболочка не усиливается и заполняет просвет пищевода, имеющий жидкую плотность. Медиастинальная жировая прослойка всегда присутствует при повреждениях пищевода II степени. Травмы III степени показывают отсутствие постконтрастного усиления стенки.
Какова роль эндоскопии и эндоскопического лечения?
Экстренная эндоскопия должна быть выполнена, если (1) КТ недоступна, (2) КТ с введением контрастного вещества противопоказано (почечная недостаточность, аллергия на йод и т. Д.), (3) КТ предполагает трансмуральный некроз пищевода, но интерпретация затруднена / неясна, или ( 4) в педиатрической популяции (степень 2А). Раньше эндоскопия была основой алгоритмов лечения после приема каустика [ 45 , 53 ]. Основным недостатком эндоскопии является ее неспособность точно предсказать трансмуральный некроз, из-за чего пациенты могут подвергнуться либо бесполезной хирургической операции, либо ненадлежащему ведению пациентов «наблюдай и ждать» и риску смерти. Использование алгоритма на основе компьютерной томографии для отбора пациентов для экстренной хирургии значительно улучшило исходы пациентов по сравнению с тактикой на основе эндоскопии [ 48 ,51 , 54 ]. Роль экстренной эндоскопической оценки едких повреждений в настоящее время сводится к ситуациям, в которых КТ не может применяться. Эндоскопия остается предварительным оценочным обследованием у детей, так как тяжелые травмы редки, а долгосрочные последствия радиационного облучения являются важной проблемой [ 38 ]. Чаще всего используется эндоскопическая классификация Заргара [ 54 ] едких повреждений; ее способность предсказывать стриктуры образования остается спорной [ 55 ] и уступает КТ [ 52 ].
Эндоскопия является основным методом диагностики стриктур пищевода / желудка у пациентов с симптомами (степень 2А). Формирование стриктуры - наиболее частое и приводящее к инвалидности осложнение при проглатывании коррозионных веществ. Стриктуры чаще поражают пищевод, чем желудок, и обычно возникают в течение 4 месяцев после приема внутрь [ 52 , 53 ]. Дисфагия и регургитация являются основными симптомами коррозионных стриктур и требуют немедленного обследования верхних отделов желудочно-кишечного тракта [ 56 ].
Эндоскопическая дилатация - это предварительное лечение стриктур пищевода. Эндоскопическую дилатацию следует предпринять через 3–6 недель после приема препарата пациентам с небольшим количеством (<3) коротких (<5 см) стриктур пищевода (степень 2A). Реконструктивная хирургия пищевода должна рассматриваться после повторной неудачи эндоскопической дилатации (степень 2А). Разъедающие стриктуры могут поражать все сегменты пищевода; часто бывают множественными, длинными, неправильными; и имеют длительные задержки стабилизации [ 57 ]. Эндоскопическая дилатация - это метод лечения первой линии [ 39 ]. Дилатацию можно безопасно начать после заживления острых травм, обычно между 3 и 6 неделями, а интервал между дилатациями колеблется от 1 до 3 недель. Ожидается, что от трех до пяти сеансов дадут удовлетворительные результаты [ 39], а реконструкцию пищевода следует рассматривать после 5–7 неудачных попыток [ 58 ]. Появление интервенционной эндоскопии возродило интерес к внутрипросветному стентированию, но надежных данных, подтверждающих этот подход, все еще не хватает.
Каковы показания к консервативному лечению?
Пациентам, у которых нет полнослойного некроза органов пищеварения, следует проводить консервативное лечение (степень 1С). Пациенты, которым назначено безоперационное лечение, требуют тщательного клинического и биологического наблюдения. Любое ухудшение состояния пациента должно побуждать к повторному КТ и рассмотрению возможности хирургического вмешательства (степень 2А). Следует возобновить пероральное кормление, как только пациенты начнут нормально глотать. Пациентам, которые не могут принимать пищу, рекомендуется энтеральное питание через назогастральный зонд или конструкция еюностомии. Психиатрическое обследование обязательно для всех пациентов перед выпиской из больницы (степень 2С). Пациенты, у которых на экстренной компьютерной томографии не обнаружены признаки трансмурального некроза желудочно-кишечного тракта, подходят для безоперационного лечения [ 48 , 51]. Последующее ухудшение клинических симптомов и признаков (болезненность отскока, усиливающаяся боль в животе, шок, потребность в поддержке аппарата искусственной вентиляции легких и т. Д.) Или лабораторных тестов (почечная недостаточность, ацидоз, лейкоцитоз и т. Д.) Предполагают эволюцию травм в трансмуральный некроз (5%). пациентов) и должны потребовать повторной компьютерной томографии [ 38 ]. Пациентов с травмами I степени CT можно немедленно накормить и быстро (24–48 ч) выписать из больницы. Этим пациентам не требуется длительного наблюдения, поскольку риск образования стриктуры равен нулю. Пациенты с КТ-травмой пищевода степени IIa имеют низкий риск (<20%) образования стриктуры [ 52]. Пероральное питание обычно хорошо переносится, и его следует вводить, как только боль уменьшится и пациенты смогут глотать. Пациенты с КТ-поражением пищевода степени IIb относятся к группе высокого риска (> 80%) образования стриктуры [ 52 ]. Боль во время глотания, повышенное слюноотделение и ранняя дисфагия могут препятствовать раннему приему внутрь; если симптомы не исчезнут, требуется длительное парентеральное питание или питательная еюностомия. Посещение через 4–6 месяцев после приема внутрь рекомендуется для пациентов с КТ-травмами степени II, так как большинство стриктур развивается в течение этой задержки. Психиатрическое обследование обязательно для всех пациентов перед выпиской из больницы; во избежание рецидива важен длительный контроль психического заболевания [ 38 ].
Какие показания к хирургическому лечению?
Во избежание смерти пациентам с едким некрозом следует как можно скорее выполнить хирургическое вмешательство (степень 1С). Все очевидные трансмуральные некротические повреждения следует удалить во время начальной операции (степень 2А). В конце операции показана питающая еюностомия (степень 2А). Неотложная операция показана, если первоначальная оценка предполагает трансмуральный некроз желудочно-кишечного тракта (КТ-травмы III степени) [ 38 ]. При отсутствии надлежащего лечения некроз внутрибрюшных органов в конечном итоге приводит к перфорации, перитониту / медиастиниту и смерти [ 59 , 60]. Решение о проведении экстренной операции после проглатывания едкого вещества - событие, изменяющее жизнь пациента; в недавнем отчете стандартный коэффициент смертности пациентов, прооперированных по поводу едкого некроза, составил 21,5 по сравнению с общей популяцией [ 45 ]. Лапаротомия остается стандартным подходом в условиях неотложной помощи, хотя сообщалось об успешном лапароскопическом лечении [ 61 , 62 ]. Все очевидные трансмуральные некротические повреждения следует удалить во время начальной процедуры; При подозрении на продолжающийся некроз следует незамедлительно провести повторную операцию [ 63]. Стриппинг-эзофагэктомия и гастрэктомия, выполняемые с использованием комбинированного абдоминального и шейного доступа, показаны пациентам с трансмуральным некрозом пищевода и желудка [ 45 , 59 , 60 ]. Реконструкция пищевода должна быть запрещена во время экстренной операции, поскольку последующее образование стриктуры может поставить под угрозу функциональные результаты. Если некроз ограничен желудком, следует рассмотреть возможность тотальной гастрэктомии с сохранением нативного пищевода или отведения пищевода [ 38 ]. Немедленная реконструкция эзофагоеюностомии может быть выполнена безопасно при низкой скорости утечки (5-8%) [ 64]. Частичная резекция желудка не рекомендуется, поскольку продолжающийся некроз может поставить под угрозу выживаемость пациента. Изолированный некроз пищевода, оправдывающий эзофагэктомию с сохранением желудка, недавно подвергся сомнению [ 47 , 50 ]; У этих пациентов может быть предпринято безоперационное лечение при отсутствии трансмурального некроза желудка. Сопутствующий некроз соседних органов (селезенки, толстой кишки, кишечника, двенадцатиперстной кишки и поджелудочной железы) требует расширенных резекций во время эзофагогастрэктомии у 20% пациентов [ 45 , 63 ]. Если панкреатодуоденэктомия проводится по поводу коррозионных повреждений, рекомендуется немедленная панкреатобилиарная реконструкция [ 65]. Предоперационная трахеобронхиальная эндоскопия является обязательной для выявления трахеобронхиального некроза, возникшего в результате медиастинального распространения некроза пищевода; в этой ситуации восстановление легочной пластыри с помощью правой торакотомии может спасти жизнь [ 66 ]. От резекции следует отказаться, если при лапаротомии обнаружен обширный некроз кишечника из-за плохой выживаемости и нарушения питания [ 63 ].
Перфорации пищевода
Перфорация пищевода (ПП) охватывает широкий спектр состояний, характеризующихся трансмуральным нарушением пищевода [ 67 ]. Самопроизвольная перфорация пищевода (синдром Бурхаве) чаще всего возникает из-за резкого повышения давления в пищеводе после рвоты при отсутствии расслабления верхнего сфинктера пищевода. На его долю приходится 15% перфораций пищевода; разрыв обычно располагается на левой границе нижней трети грудного отдела пищевода, а дефект стенки большой (3–8 см) [ 68 - 70 ]. Подавляющее большинство (60%) перфораций пищевода являются ятрогенными и возникают во время диагностических и терапевтических (расширение пищевода, перевязка варикозного расширения вен, склеротерапия и т. Д.) Эндоскопических процедур [ 71]. Другие редкие причины включают оперативную и внешнюю травму, злокачественные новообразования, инородные тела и попадание едких веществ в организм. Сильная рвота или рвота, вызывающая перфорацию, ошибочно получила название спонтанной перфорации пищевода; так как это не спонтанно, может быть лучше использовать другие термины, такие как барогенный разрыв или синдром Бурхааве [ 72 ].
Общим знаменателем всех этих разнородных состояний является загрязнение окружающих пространств пищеварительным содержимым и развитие тяжелого сепсиса и смерти при отсутствии своевременной диагностики и соответствующего лечения. Смертность от перфорации пищевода колеблется от 10% до 20%, а отсрочка лечения является наиболее важным показателем выживаемости [ 73 , 74 ].
Каковы подходящие лабораторные и визуализирующие исследования?
Рутинные анализы крови (общий анализ крови, сывороточные концентрации натрия, калия, хлора, магния, кальция, креатинин мочевины, тесты печени (билирубин, аланинаминотрансфераза, аспартатаминотрансфераза), pH и лактат сыворотки) должны проводиться у пациентов с подозрением на EP (степень 1C). ). Первоначальные клинические и биологические проявления ВП не имеют специфических закономерностей; поздние стадии характеризуются признаками воспаления и сепсиса. Чтобы избежать задержки в постановке диагноза (> 50% случаев) и позволить своевременное лечение, требуется высокая степень подозрительности при обращении [ 68 , 75 , 76 ].
Компьютерная томография (КТ) с контрастным усилением и КТ-эзофагография - это визуализирующие исследования выбора у пациентов с подозрением на ВП (степень 1С). КТ очень чувствительна (92–100%) при обнаружении ВП и помогает оценить распространение на соседние структуры (скопление воздуха или жидкости в средостении, плевральные и внутрибрюшинные выпоты) и определить начальную терапию. КТ также может устранить другие состояния, которые могут имитировать ВП (расслоение аорты, интрамуральная гематома пищевода и т. Д.) [ 13 , 67 , 77 , 78 ]. В отдельных случаях эзофагограмма с контрастным усилением (гастрографин / барий) может предоставить полезную информацию о локализации и локализованном характере ВП [ 78]. Косвенные признаки повреждения пищевода также можно увидеть на простой рентгенограмме грудной клетки (плевральный выпот, пневмомедиастинум, подкожная эмфизема, гидроторакс, пневмоторакс и коллапс легкого) [ 79 ].
Какова роль эндоскопии и эндоскопического лечения?
Диагностическая эндоскопия полезна у пациентов с подозрением на ВП и сомнительными результатами КТ. (Оценка 1С). Диагностическая эндоскопия для ВП надежна и безопасна в опытных руках; тем не менее, потенциальные риски увеличения размера перфорации и усугубления загрязнения окружающих пространств требуют осторожности и ограничивают его использование в качестве осмотра первой линии [ 71 ].
Эндоскопическое лечение является золотым стандартом для закрытия EP, которые возникают и распознаются во время эндоскопической процедуры (уровень 2A). Новые интервенционные эндоскопические методы, включая эндоскопические зажимы, покрытые металлические стенты и внутрипросветную вакуумную терапию, были разработаны за последние несколько лет для лечения перфорации пищевода в попытке снизить связанные с этим заболеваемость и смертность [ 80 ]. Размещение эндоскопических зажимов (через зажимы эндоскопа, поверх зажимов) в настоящее время является стандартным методом закрытия небольших (<2 см) люминальных перфораций [ 81 - 83 ]. Эндоскопические стенты (частично или полностью покрытые саморасширяющиеся металлические стенты, саморасширяющиеся пластиковые стенты) могут использоваться для закрытия больших дефектов или полного неудовлетворительного закрытия зажима [ 84]. В недавнем обзоре использование саморасширяющихся стентов для лечения утечек из пищевода (спонтанных, ятрогенных и послеоперационных) привело к успеху в 88% и летальности 7,5%. Эти результаты выгодно отличались от результатов хирургического вмешательства (83% успеха и 17% госпитальной летальности), что привело авторов к выводу, что стентирование пищевода может быть успешно применено в качестве альтернативной терапевтической стратегии при EP [ 85 ]. Рекомендуется минимальная продолжительность установки стента 2–4 недели, чтобы обеспечить герметизацию перфорации. Установка стента в пищевод, вероятно, так же эффективна, как и хирургическое вмешательство для лечения ятрогенного ВП [ 86]. Эндоскопия может использоваться в качестве окончательного лечения либо отдельно, либо в сочетании с интервенционной радиологией или хирургическими процедурами (дренирование плеврального абсцесса, компрессионный пневмоторакс и т. Д.) [ 71 ]. Недавно сообщалось об успешном закрытии дефектов пищевода первичной или экстренной эндолюминальной вакуумной терапией, что может представлять собой многообещающее альтернативное лечение ЭП [ 87 , 88 ].
У пациентов с поздним обращением и у пациентов с неэндоскопическим ВП можно рассмотреть возможность использования эндоскопии в качестве терапии первой линии (степень 2С). Хотя сообщалось об успешном эндоскопическом лечении у некоторых пациентов Бурхааве [ 89 - 91 ] с минимальными симптомами и признаками сепсиса, опасения по поводу безопасности пациентов требуют осторожности при использовании эндоскопического лечения первой линии в таких обстоятельствах [ 71 , 89 ]. Эндоскопическое стентирование является полезным вспомогательным средством лечения пациентов с постоянной утечкой после хирургического лечения ВП [ 92 ].
Каковы показания к безоперационному лечению?
Неоперативное ведение (NOM) ВП может быть рассмотрено у стабильных пациентов с ранним обращением, сдержанным нарушением пищевода и минимальным загрязнением окружающих пространств, если доступно высокоспециализированное наблюдение (степень 1C). Критерии, разработанные Altorjay et al. [ 93 ] более двух десятилетий назад по-прежнему являются основой безоперационного ведения (таблица 1). Совсем недавно была разработана Питтсбургская классификация, которая включает оценку перфорации пищевода на основе десяти клинических и радиологических факторов, чтобы помочь пациентам с ВП принимать решения [ 94 ]. Оценка была подтверждена в многонациональном исследовании, и было высказано предположение, что пациенты с низкой оценкой (≤ 2) могут иметь право на неоперативное лечение [ 95 ].
Таблица 1
Критерии безоперационного лечения перфораций пищевода
|
Задержка в управлении |
Рано: менее 24 часов |
|
Клиническая картина |
Отсутствие симптомов и признаков сепсиса |
|
Радиологические критерии |
Перфорация пищевода в шейном или грудном отделах Ограниченная перфорация окружающими тканями - Внутренний - Минимальная периэзофагальная экстравазация контрастного вещества с внутрипищеводным дренажом - Отсутствие массивного плеврального заражения |
|
Характеристики пищевода |
Отсутствие ранее существовавшего заболевания пищевода |
|
разное |
Возможность тщательного наблюдения командой экспертов по пищеводу Наличие круглосуточных хирургических и рентгенологических навыков |
Пациенты , имеющие право на NOM должны храниться на ниль орально, вводят антибиотики широкого спектра действия (аэробные и анаэробные бактерии) и ингибитор протонного насоса терапию (степень 1С). Раннее введение нутритивной поддержки путем энтерального питания или полного парентерального питания необходимо для заживления пищевода (степень 1C). Рекомендуется эндоскопическая установка назогастрального зонда (степень 2А). Хотя противоинфекционное лечение считается краеугольным камнем в лечении ВП, единого мнения относительно оптимальной схемы приема антибиотиков и продолжительности лечения нет. Недавний обзор литературы выявил необходимость в высококачественных доказательствах, связанных с противоинфекционным лечением пациентов с диагнозом ВП [ 96]. Дополнительные меры должны быть нацелены на борьбу с сепсисом с использованием методов чрескожной радиологии для дренирования периэзофагеальных и плевральных скоплений [ 97 ]. Дренирование плевральных скоплений и декортикация плевры с помощью видеоторакоскопии и использование эндоскопических методов (зажимы, стенты и внутренний вакуумный дренаж) являются частью агрессивного минимально инвазивного лечения ВП. Используя такую комбинированную стратегию, Vogel et al. смогли успешно выполнить NOM у 68% из 47 пациентов с ВП с низким уровнем смертности (6%) [ 98 ].
Какие показания к операции?
Хирургическое вмешательство следует проводить всем пациентам, не отвечающим критериям NOM (степень 1С).
Если операция показана для EP, пациентов следует как можно скорее доставить в операционную (степень 1C). Даже незначительное промедление с хирургическим лечением может повысить заболеваемость и смертность. Смертность пациентов, которым удалось лечить в течение 24 часов после ЭП, составляет менее 10% по сравнению с 30% после этого срока [ 68 , 76 , 78 , 94 ].
Может быть рассмотрен вариант восстановления ВП с помощью малоинвазивного хирургического подхода (лапароскопия, торакоскопия) (степень 1С). Отчеты немногочисленны, и такой подход, вероятно, следует использовать в центрах, в которых доступны высокоспециализированные специалисты [ 99 , 100 ].
Какие хирургические процедуры наиболее подходят?
Общие принципы лечения перфорации пищевода включают (1) отличное обнажение, (2) удаление нежизнеспособной ткани, (3) закрытие дефекта, (4) использование контрфорса для укрепления пищеводных швов и (5) адекватный дренаж трубки. Хирургический доступ должен быть адаптирован в соответствии с местоположением EP.
Шейный EP
Для EP, локализованного на шее, следует попытаться восстановить дефект пищевода, когда это возможно (степень 1C). Доступ к пищеводу осуществляется через разрез на шее слева по переднему краю грудино-ключично-сосцевидной мышцы или через воротниковый разрез, если требуется двустороннее исследование шейки матки [ 74 , 78 ]. Хирургическое лечение включает периферическую мобилизацию пищевода для облегчения заживления, санацию участка перфорации, однослойное или двухслойное закрытие перфорации без натяжения, укрепление заживления с помощью васкуляризированной ткани (грудино-ключично-сосцевидной мышцы, двубрюшной мышцы) и адекватный дренаж [ 74 ]. Установка зонда для кормления (назогастральный, еюностомия) во время восстановления позволяет обеспечить раннее питание и способствует заживлению [68 ].
Если прямое восстановление невозможно (разрыв превышает 50% окружности пищевода, отсроченное хирургическое обследование), рекомендуется внешний дренаж (степень 2А). Следует рассмотреть возможность создания боковой или концевой стомы пищевода, чтобы уменьшить загрязнение окружающих пространств.
Торакальный EP
Первичная пластика - это метод выбора при ВП со свободной перфорацией грудного пищевода (степень 1С). Лечение перфорации грудного пищевода основано на немедленном прекращении контаминации средостения и плевры, санации перфорации до здоровой ткани, первичной пластики без натяжения и адекватного внешнего дренажа [ 101 ].
В этих случаях требуется индивидуальный подход, и трудно четко описывать фактические оперативные действия. Обычно требуется торакотомия, и степень плеврального выпота или видимого дефекта стенки на компьютерной томографии может определять сторону разреза (рис. 3). Лапаротомия или лапароскопия обычно необходимы в дополнение к созданию питающей еюностомии и, возможно, декомпрессивной зондовой гастростомии. Альтернативой является назогастральный зонд или комбинация зондов для декомпрессии и кормления. В общем, диверсионная цервикальная эзофагостомия (для слюны) не рекомендуется. У некоторых пациентов с подходящим телосложением может использоваться трансхиатальный доступ с лапаротомией по средней линии (рис. 4). Иссечение мечевидного отростка в сочетании с использованием ретрактора с крючком для грудины позволяет восстановить перфорацию грудного отдела пищевода без торакотомии. Необходимо мобилизовать глазное дно и обвести пищевод лентой, чтобы обеспечить полную мобилизацию и рассечение высоко в средостение.
Дефект слизистой оболочки часто длиннее мышечной разрыва; продольная миотомия на обоих концах ВП полезна для обнажения краев слизистой оболочки для соответствующего восстановления [ 68 ]. Традиционно рекомендуется двухслойная пластика с раздельным ушиванием слизистой оболочки и мышц. Риск разрыва шва обычно составляет от 25 до 50%. Для снижения риска протекания рекомендуется подкрепление восстановления пищевода окружающей жизнеспособной тканью (межреберный мышечный лоскут, плевральная или перикардиальная пластыря). В случаях трансхиатального доступа фундопликация по Ниссену может быть эффективным средством восстановления. Требуется дренирование средостения и плевральной полости, а энтеральное питание остается важным компонентом плана лечения.
Если прямое восстановление грудного ВП невозможно (гемодинамическая нестабильность, отсроченное хирургическое обследование, обширное повреждение пищевода), следует выполнить исключение, диверсию или резекцию пищевода (степень 1C). Ремонт через Т-образную трубку большого размера может использоваться для создания контролируемого пищеводно-кожного свища и минимизации загрязнения средостения и плевры [ 102 ]. При большом разрыве пищевода требуется полное отведение пищевода или резекция грудного отдела пищевода; Эзофагостомия шейки матки и еюностомия кормления у этих пациентов являются обязательными [ 101 ]. Резекция - лучший вариант при наличии уже существующей патологии пищевода [ 68 , 103]. Если пациент выживает, через 6–12 месяцев после полного отклонения или резекции грудного отдела пищевода требуется интерпозиция толстой кишки или подтягивание желудка.
Брюшной EP
Оперативное восстановление является методом выбора для пациентов со свободной перфорацией брюшной полости пищевода (степень 1С). При доступе к перфорации пищевода в брюшной полости выполняется лапаротомия по средней линии. После обработки некротизированных тканей следует выполнить одно- или двухслойное закрытие перфорации без натяжения. Рекомендуется укрепить пищеводный шов с помощью гастропластики с использованием дна желудка (т. Е. Полная или частичная фундопликация), установить назогастральный зонд, построить питающую еюностомию и выполнить внешний дренаж поддиафрагмального пространства [ 78 ].
Травма пищевода
Повреждение пищевода внешней травмой - редкое состояние. Травматические повреждения пищевода (ТИЭ) составляют менее 15% всех повреждений пищевода [ 104 , 105 ]. TIE были зарегистрированы менее чем у 1% пациентов, находящихся в 20 травматологических центрах уровня I в течение 6 лет [ 106 ]. Они классифицируются по анатомическому расположению, то есть шейному, грудному или абдоминальному, и по механизму повреждения, то есть проникающая или тупая травма. Необычной причиной TIE является баротравма от внешних повреждений, вызванных воздушным ударом [ 107]. Из-за анатомического положения пищевода изолированные TIE встречаются редко; сопутствующие повреждения спинного мозга, дыхательных путей, основных сосудистых структур, легких, сердца и внутренних органов брюшной полости (селезенка, поджелудочная железа, печень) являются обычными и ухудшают прогноз [ 108 , 109 ]. TIE встречается в основном у молодых мужчин, и наиболее частым проявлением является проникающее повреждение шейного отдела пищевода. Смертность от TIE высока, большинство смертей происходит в течение 24 часов из-за тяжелых сопутствующих травм [ 105 ]. Травма грудного отдела пищевода особенно связана с высоким уровнем смертности [ 110 ]. Ранняя диагностика TIE является обязательной для улучшения результатов и требует высокого уровня подозрительности.
Что такое подходящее диагностическое обследование?
Физикальное обследование не является надежным для ранней диагностики TIE (степень 2A). Специфических симптомов или патогномоничных признаков TIE нет. Признаки TIE включают боль в грудной клетке (70%), лихорадку (50%), одышку (25%), подкожную эмфизему (19%) и дисфагию (7%). Механизм травмы превосходит клинические признаки в установлении ранней диагностики TIE [ 109 , 111 ].
Лабораторные исследования бесполезны для ранней диагностики TIE (степень 2A). Биологические модификации, такие как лейкоцитоз, повышенный уровень СРБ и повышенный уровень прокальцитонина, неспецифичны и связаны с воспалительной реакцией. Точно так же наличие лактоацидоза, анемии и коагулопатии связано с шоком, а не с TIE [ 104 ].
КТ с контрастированием и КТ-эзофагография должны выполняться гемодинамически стабильным пациентам с подозрением на TIE (степень 1С). КТ-эзофагограмма имеет высокую чувствительность (95%) и специфичность (91%) при обнаружении перфорации верхних отделов пищеварительного тракта. КТ с контрастным усилением полезна для выявления сопутствующих повреждений и может предоставить важную информацию о траектории проникающего агента (пуля, колотая рана). КТ также может показать косвенные признаки перфорации пищевода (параэзофагеальные скопления, свободный воздух, плевральный выпот). За последние годы КТ в значительной степени заменила эзофагограмму с контрастированием (гастрографин / барий), которая использовалась в течение многих лет, но дает меньше информации, требует стабильного и отзывчивого пациента и может пропустить до 30% мелких перфораций пищевода [ 112 ,113 ]. Одним из основных недостатков методов помутнения пищевода является тот факт, что глотание возможно только у здоровых пациентов; Контрастное вещество, вводимое через назогастральный зонд, может пропустить перфорацию пищевода.
Какова роль диагностической эндоскопии?
Гибкая эндоскопия должна выполняться как дополнение к КТ пациентам с подозрением на TIE (степень 2A). Эндоскопия обеспечивает прямую визуализацию места повреждения и оказалась полезной у пациентов с сомнительными результатами КТ. Другие преимущества включают легкую доступность в большинстве травматологических центров и возможность использования у интубированных и нестабильных пациентов [ 114 , 115]. В сочетании с КТ с контрастным усилением гибкая эндоскопия позволяет точно диагностировать TIE более чем в 90% случаев. Было показано, что использование эндоскопии изменяет хирургическое лечение у 69% пациентов. У нестабильных пациентов, доставленных в операционную, можно использовать интраоперационную эндоскопию, чтобы исключить перфорацию пищевода. При таких обстоятельствах показана тройная эндоскопия (эзофагоскопия, ларингоскопия и бронхоскопия), так как повреждение одной из этих структур должно вызывать подозрение на повреждение соседних органов. Инсуффляция во время процедуры может способствовать загрязнению средостения за счет увеличения размера перфорации; по этой причине рекомендуется инсуффляция с низким потоком и использование CO 2 вместо воздуха [ 104 , 113 ].
Каковы показания к консервативному лечению?
Пациентам с TIE может быть предложена NOM, если у них нет перфорации пищевода. Пациентам с перфорацией пищевода может быть предложено безоперационное лечение, если они соответствуют ранее описанным критериям NOM (таблицаВзаимодействие с другими людьми(Таблица 1)1) (Оценка 2А). У этих пациентов в обязательном порядке необходимо определить место и степень поражения пищевода; любая задержка в лечении пропущенных перфораций пищевода может ухудшить результаты лечения. Также важно выявлять сопутствующие травмы, которые могут повлиять на ведение и выживаемость [ 104 ].
NOM для TIE следует предлагать только в том случае, если интенсивный мониторинг в условиях отделения интенсивной терапии, хирургический опыт и навыки интервенционной радиологии доступны круглосуточно (уровень 1C). NOM требует поддержания пациентом нулевого статуса per os, использования антибиотиков широкого спектра действия, эндоскопического размещения назогастрального зонда и раннего введения нутритивной поддержки посредством использования либо энтерального питания, либо полного парентерального питания. Дополнительные меры могут быть нацелены на борьбу с сепсисом путем использования чрескожного радиологического дренирования периэзофагеальных скоплений, чрескожного введения плевральной дренажной трубки и дренирования плевральных скоплений и декортикации плевры с помощью видеоторакоскопии [ 78 , 104 - 106 , 111 ].
Каковы показания к немедленному хирургическому лечению?
Пациенты с TIE должны подвергнуться немедленному хирургическому лечению, если у них есть гемодинамическая нестабильность, очевидная неконтролируемая экстравазация контрастного вещества и системные признаки тяжелого сепсиса (степень 1C). У таких пациентов операция должна быть предпринята как можно скорее; Большой объем литературы показывает, что отсроченное (> 24 ч) хирургическое лечение перфорации пищевода приводит к увеличению показателей заболеваемости и смертности. Недавние исследования показали, что, хотя отсроченное хирургическое лечение не влияет на уровень смертности, оно тем не менее снижает шансы на успешное первичное восстановление пищевода. Если экстренная операция была вызвана сопутствующими травмами, перфорацию пищевода следует искать во время операции путем прямого осмотра, внутрипросветной инстилляции красителя (метиленового синего) или эндоскопической инсуффляции [ 78, 109 , 111 ].
Отсроченное хирургическое лечение показано пациентам с перфорацией пищевода, связанной с TIE, у которых первичное восстановление пищевода невозможно или не удалось (степень 2A). Пациентам с TIE с перфорацией пищевода, которые не подходят для первичного восстановления, проводят либо резекцию пищевода, либо процедуры исключения-отклонения. Если они выживают, пациентам требуется вторая процедура для восстановления непрерывности желудочно-кишечного тракта. Реконструкция пищевода путем интерпозиции толстой кишки или желудка обычно назначается через 6–12 месяцев после ТИЭ [ 104 ].
Какие хирургические процедуры наиболее подходят?
TIE редки, но очень болезненны. Тактика лечения зависит от расположения перфорации и наличия сопутствующих травм. В большинстве случаев поддается первичному лечению с повторным наложением лоскута. Другие принципы включают адекватный дренаж вокруг восстановления, декомпрессию пищевода и желудка (через назогастральный зонд или гастростомический зонд) и дистальное энтеральное питание (питательная еюностомия) [ 116 ].
При TIE, локализованном на шее, по возможности следует попытаться восстановить перфорацию пищевода (степень 1C). Если прямое восстановление невозможно, рекомендуется эзофагостомия и дренирование шейки матки (степень 2А). В этих обстоятельствах необходимо надлежащее лечение сопутствующих повреждений (трахеи, сонной артерии), поскольку они могут создавать определенные проблемы (трахео-пищеводный свищ, послеоперационное разрушение сонной артерии). Для предотвращения таких осложнений рекомендуется избегать образования трахеотомии, укреплять пластику жизнеспособной тканью и дренировать через противоположную шейку [ 78 , 104 ].
Оперативное лечение является методом выбора при TIE со свободной перфорацией грудного отдела пищевода (степень 1C). Если первичное восстановление невозможно, следует выполнить отклонение, исключение или резекцию грудного отдела пищевода (степень 2А). Тяжелое повреждение позвоночника, магистральных сосудов, сердца и легких может быть связано и определит выживаемость в краткосрочной перспективе; их лечение имеет приоритет над повреждениями пищевода и может потребовать подхода к контролю повреждений [ 78 , 104 ].
Оперативное лечение является методом выбора при TIE со свободной перфорацией брюшной полости пищевода (степень 1C). У пациентов с абдоминальным TIE очень важен контроль возможного кровотечения из-за связанных с травмой печени, селезенки или магистральных сосудов кровотечения, связанного с лечением жизни [ 78 , 104 ].
Какова роль хирургического лечения повреждений?
К гемодинамически нестабильным пациентам с TIE (степень 1C) следует применять принципы хирургической коррекции повреждений и реанимации. В одном исследовании смертность от TIE составила 44%, при этом 92% смертей произошли в течение 24 часов с момента обращения; смертность была связана с оценкой тяжести травмы (ISS), а не с повреждениями пищевода [ 105]. Таким образом, у гемодинамически нестабильных пациентов с ТИЭ первостепенное значение имеет сокращенная хирургическая операция по контролю источника питания с последующим переводом в отделение интенсивной терапии для физиологической реанимации; Затем требуется процедура повторного осмотра в операционной для окончательного хирургического лечения пищеводных и других связанных травм. Внешний дренаж, исключение пищевода или быстрая резекция должны выполняться параллельно с мерами по остановке кровотечения; специфическое лечение поражений пищевода должно проводиться у выживших, как описано ранее [ 111 ].
Заключение
Текущие рекомендации основаны на обширном обзоре литературы и мнениях экспертов. Из-за низкой частоты травм пищевода качественные доказательства отсутствуют, и большинство публикаций в литературе представляют собой отчеты о случаях, серии случаев или обзоры литературы. Несмотря на эти ограничения, ценность консенсусной конференции в Бертиноро заключалась в том, чтобы собрать группу признанных экспертов, которые по пунктам обсудили все основные вопросы, связанные с травмами пищевода (таблица 2). Мы рекомендуем высокую степень подозрительности в клинических ситуациях, которые могут быть связаны с перфорацией пищевода или вторично привести к ней; В этих обстоятельствах начало соответствующего лечения в течение 24 часов может спасти жизнь. И КТ, и эндоскопия являются надежными диагностическими инструментами, и их использование должно быть адаптировано к состоянию пациента. Окончательное ведение неотложных состояний пищевода должно осуществляться в специализированных центрах, в которых круглосуточно доступен многопрофильный специалист (хирурги пищевода, интервенционные радиологи, эндоскописты, специалисты отделения интенсивной терапии).
Таблица2: Основные принципы лечения травм пищевода
Проглатывание инородного тела (FB)
• Компьютерная томография (КТ) - ключевое исследование у пациентов с подозрением на перфорацию или другие осложнения, связанные с ФБ.
• Экстренная эндоскопия (<6 часов) рекомендуется для острых предметов, батареек, магнитов и при полной непроходимости пищевода.
• Показания к операции включают перфорацию и FB, которые необратимы или близки к жизненно важным структурам.
• Эзофаготомия с экстракцией FB и первичным закрытием является предпочтительным подходом.
Проглатывание каустика
• Количество проглоченного агента и результаты состояния модели случайного добровольного проглатывания.
• Экстренное управление можно безопасно выполнять, полагаясь только на компьютерную томографию.
• Эндоскопия остается основным диагностическим и терапевтическим инструментом при стриктурах каустика.
• Пациентам, у которых нет полнослойного некроза органов пищеварения, может быть предложено безоперационное ведение (NOM) под тщательным клиническим и биологическим мониторингом. Экстренная резекция каустического некроза может спасти жизнь.
Перфорация пищевода (ВП)
• КТ и КТ-эзофагография с контрастным усилением - предпочтительный метод визуализации.
• NOM может быть предложен стабильным пациентам с ранним обращением, с нарушением пищевода и минимальным загрязнением окружающих пространств. Эндоскопическое лечение (зажимы, стенты) и методы интервенционной радиологии являются полезными дополнениями во время NOM.
• Неотложная операция должна выполняться пациентам, которые не соответствуют критериям NOM. Лучший способ лечения - прямой ремонт и адекватный дренаж; если восстановление невозможно (обширное разрушение, отсроченное хирургическое вмешательство, предшествующее заболевание пищевода), возможными вариантами являются внешний дренаж, исключение пищевода или резекция.
Травма пищевода
• Физикальное обследование и лабораторные исследования бесполезны для ранней диагностики TIE.
• КТ с контрастным усилением и КТ-эзофагография должны выполняться гемодинамически стабильным пациентам с подозрением на TIE. Предоперационная гибкая эндоскопия полезна для диагностики TIE у нестабильных пациентов.
• Пациентам с TIE может быть предложено NOM, если у них нет EP или если они соответствуют критериям NOM для EP
• Пациенты с TIE должны подвергнуться немедленному хирургическому лечению, если у них есть гемодинамическая нестабильность, очевидная неконтролируемая экстравазация контрастного вещества и системные признаки тяжелого сепсиса.
• Оперативный ремонт - это лечение по выбору TIE. Надлежащее лечение ассоциированных травм обусловливает выживаемость пациентов
.
Статьи по теме:
- Статьи: Химические ожоги пищевода: степени, симптомы
- Статьи: ЭНДОДИАГНОСТИКА ПРИ ОЖОГАХ ПИЩЕВОДА ЩЕЛОЧЬЮ
- Статьи: ФЕДЕРАЛЬНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ «Токсическое действие разъедающих веществ», «Токсическое действие мыл и детергентов» 2014
- Статьи: Классификация Заргар (Zargar classification) - оценка повреждения пищевода при проглатывании едких (каустических) веществ
Список литературы:
evidence. https://www.cebm.net/index.aspx?o=5653.
2. Wyllie R. Foreign bodies in the gastrointestinal tract. Curr Opin Pediatr. 2006;
18(5):563–4.
3. Chiu YH, Hou SK, Chen SC, et al. Diagnosis and endoscopic management of
upper gastrointestinal foreign bodies. Am J Med Sci. 2012;343(3):192–5.
4. Evans DC, Wojda TR, Jones CD, et al. Intentional ingestions of foreign objects
among prisoners: a review. World J Gastrointest Endosc. 2015;7(3):162–8.
5. Athanassiadi K, Gerazounis M, Metaxas E, et al. Management of esophageal
foreign bodies: a retrospective review of 400 cases. Eur J Cardiothorac Surg.
2002;21(4):653–6.
6. Aiolfi A, Ferrari D, Riva CG, et al. Esophageal foreign bodies in adults: systematic
review of the literature. Scand J Gastroenterol. 2018;53(10–11):1171–8.
7. Erbil B, Karaca MA, Aslaner MA, et al. Emergency admissions due to swallowed
foreign bodies in adults. World J Gastroenterol. 2013;19(38):6447–52.
8. Gretarsdottir HM, Jonasson JG, Bjornsson ES. Etiology and management of
esophageal food impaction: a population based study. Scand J
Gastroenterol. 2015;50(5):513–8.
9. Lee JH, Kim HC, Yang DM, et al. What is the role of plain radiography in
patients with foreign bodies in the gastrointestinal tract? Clin Imaging.
2012;36(5):447–54.
10. Liew CJ, Poh AC, Tan TY. Finding nemo: imaging findings, pitfalls, and
complications of ingested fish bones in the alimentary canal. Emerg Radiol.
2013;20(4):311–22.
11. Ngan JH, Fok PJ, Lai EC, et al. A prospective study on fish bone ingestion.
Experience of 358 patients. Ann Surg. 1990;211(4):459–62.
12. Goh BK, Tan YM, Lin SE, et al. CT in the preoperative diagnosis of fish bone
perforation of the gastrointestinal tract. AJR Am J Roentgenol. 2006;187(3):710–4.
13. Young CA, Menias CO, Bhalla S, et al. CT features of esophageal
emergencies. Radiographics. 2008;28(6):1541–53.
14. Marco De Lucas E, Sadaba P, Lastra Garcia-Baron P, et al. Value of helical
computed tomography in the management of upper esophageal foreign
bodies. Acta Radiol. 2004;45(4):369–74.
15. Committee ASoP, Ikenberry SO, Jue TL, et al. Management of ingested foreign
bodies and food impactions. Gastrointest Endosc. 2011;73(6):1085–91.
16. Ricote GC, Torre LR, De Ayala VP, et al. Fiberendoscopic removal of foreign
bodies of the upper part of the gastrointestinal tract. Surg Gynecol Obstet.
1985;160(6):499–504.
17. Webb WA. Management of foreign bodies of the upper gastrointestinal
tract: update. Gastrointest Endosc. 1995;41(1):39–51.
18. Birk M, Bauerfeind P, Deprez PH, et al. Removal of foreign bodies in the
upper gastrointestinal tract in adults: European Society of Gastrointestinal
Endoscopy (ESGE) clinical guideline. Endoscopy. 2016;48(5):489–96.
19. Wu WT, Chiu CT, Kuo CJ, et al. Endoscopic management of suspected
esophageal foreign body in adults. Dis Esophagus. 2011;24(3):131–7.
20. Sugawa C, Ono H, Taleb M, et al. Endoscopic management of foreign
bodies in the upper gastrointestinal tract: a review. World J Gastrointest
Endosc. 2014;6(10):475–81.
21. Chaves DM, Ishioka S, Felix VN, et al. Removal of a foreign body from the
upper gastrointestinal tract with a flexible endoscope: a prospective study.
Endoscopy. 2004;36(10):887–92.
22. Geng C, Li X, Luo R, et al. Endoscopic management of foreign bodies in the
upper gastrointestinal tract: a retrospective study of 1294 cases. Scand J
Gastroenterol. 2017;52(11):1286–91.
23. Vicari JJ, Johanson JF, Frakes JT. Outcomes of acute esophageal food impaction:
success of the push technique. Gastrointest Endosc. 2001;53(2):178–81.
24. Kerlin P, Jones D, Remedios M, et al. Prevalence of eosinophilic esophagitis
in adults with food bolus obstruction of the esophagus. J Clin
Gastroenterol. 2007;41(4):356–61.
25. Nadir A, Sahin E, Nadir I, et al. Esophageal foreign bodies: 177 cases. Dis
Esophagus. 2011;24(1):6–9.
26. Gmeiner D, von Rahden BH, Meco C, et al. Flexible versus rigid endoscopy
for treatment of foreign body impaction in the esophagus. Surg Endosc.
2007;21(11):2026–9.
27. Yan XE, Zhou LY, Lin SR, et al. Therapeutic effect of esophageal foreign
body extraction management: flexible versus rigid endoscopy in 216 adults
of Beijing. Med Sci Monit. 2014;20:2054–60.
28. Tseng CC, Hsiao TY, Hsu WC. Comparison of rigid and flexible endoscopy
for removing esophageal foreign bodies in an emergency. J Formos Med
Assoc. 2016;115(8):639–44.
29. Riva CG, Toti FAT, Siboni S, et al. Unusual foreign body impacted in the
upper oesophagus: original technique for transoral extraction. BMJ Case
Rep. 2018;2018:225241. https://doi.org/10.1136/bcr-2018-225241.
30. Kucharczuk JC, Kaiser LR, Marshall MB. Weerda diverticuloscope: novel
use to remove embedded esophageal foreign bodies. Ann Thorac Surg.
2003;76(4):1276–8.
31. Ferrari D, Aiolfi A, Bonitta G, et al. Flexible versus rigid endoscopy in the
management of esophageal foreign body impaction: systematic review and
meta-analysis. World J Emerg Surg. 2018;13:42.
32. Dalal PP, Otey AJ, McGonagle EA, et al. Intentional foreign object ingestions:
need for endoscopy and surgery. J Surg Res. 2013;184(1):145–9.
33. Shreshtha D, Sikka K, Singh CA, et al. Foreign body esophagus: when endoscopic
removal fails. Indian J Otolaryngol Head Neck Surg. 2013;65(4):380–2.
34. Biancari F, Gudbjartsson T, Mennander A, et al. Treatment of esophageal perforation
in octogenarians: a multicenter study. Dis Esophagus. 2014;27(8):715–8.
35. Orji FT, Akpeh JO, Okolugbo NE. Management of esophageal foreign bodies:
experience in a developing country. World J Surg. 2012;36(5):1083–8.
36. Jiang J, Yu T, Zhang YF, et al. Treatment of cervical esophageal perforation
caused by foreign bodies. Dis Esophagus. 2012;25(7):590–4.
37. Bonavina L, Aiolfi A, Siboni S, et al. Thoracoscopic removal of dental
prosthesis impacted in the upper thoracic esophagus. World J Emerg
Surg. 2014;9(1):5.
38. Chirica M, Bonavina L, Kelly MD, et al. Caustic ingestion. Lancet. 2017;
389(10083):2041–52.
39. Contini S, Scarpignato C. Caustic injury of the upper gastrointestinal tract: a
comprehensive review. World J Gastroenterol. 2013;19(25):3918–30.
40. Hugh TB, Kelly MD. Corrosive ingestion and the surgeon. J Am Coll Surg.
1999;189(5):508–22.
41. Keh SM, Onyekwelu N, McManus K, et al. Corrosive injury to upper
gastrointestinal tract: still a major surgical dilemma. World J Gastroenterol.
2006;12(32):5223–8.
42. Betalli P, Falchetti D, Giuliani S, et al. Caustic ingestion in children: is
endoscopy always indicated? The results of an Italian multicenter
observational study. Gastrointest Endosc. 2008;68(3):434–9.
43. Temiz A, Oguzkurt P, Ezer SS, et al. Predictability of outcome of caustic
ingestion by esophagogastroduodenoscopy in children. World J
Gastroenterol. 2012;18(10):1098–103.
44. Arici MA, Ozdemir D, Oray NC, et al. Evaluation of caustics and
household detergents exposures in an emergency service. Hum Exp
Toxicol. 2012;31(6):533–8.
45. Chirica M, Resche-Rigon M, Bongrand NM, et al. Surgery for caustic injuries
of the upper gastrointestinal tract. Ann Surg. 2012;256(6):994–1001.
46. Bonavina L, Chirica M, Skrobic O, et al. Foregut caustic injuries: results of the
world society of emergency surgery consensus conference. World J Emerg
Surg. 2015;10:44.
47. Zerbib P, Voisin B, Truant S, et al. The conservative management of severe
caustic gastric injuries. Ann Surg. 2011;253(4):684–8.
48. Chirica M, Resche-Rigon M, Pariente B, et al. Computed tomography
evaluation of high-grade esophageal necrosis after corrosive ingestion to
avoid unnecessary esophagectomy. Surg Endosc. 2015;29(6):1452–61.
49. Chou SH, Chang YT, Li HP, et al. Factors predicting the hospital mortality of
patients with corrosive gastrointestinal injuries receiving
esophagogastrectomy in the acute stage. World J Surg. 2010;34(10):2383–8.
50. Chirica M, Resche-Rigon M, Zagdanski AM, Bruzzi M, Bouda D, Roland E,
Sabatier F, Bouhidel F, Bonnet F, Munoz-Bongrand N, Marc Gornet J, Sarfati
E, Cattan P. Computed Tomography Evaluation of Esophagogastric Necrosis
After Caustic Ingestion. Ann Surg. 2016;264(1):107–13.
51. Chirica M, Resche-Rigon M, Zagdanski AM, et al. Computed tomography
evaluation of esophagogastric necrosis after caustic ingestion. Ann Surg.
2016;264(1):107–13.
52. Bruzzi M, Chirica M, Resche-Rigon M, et al. Emergency computed tomography
predicts caustic esophageal stricture formation. Ann Surg. 2018. https://doi.
org/10.1097/SLA.0000000000002732. [Epub ahead of print].
53. Cheng HT, Cheng CL, Lin CH, et al. Caustic ingestion in adults: the role of
endoscopic classification in predicting outcome. BMC Gastroenterol. 2008;8:31.
54. Zargar SA, Kochhar R, Mehta S, et al. The role of fiberoptic endoscopy in the
management of corrosive ingestion and modified endoscopic classification
of burns. Gastrointest Endosc. 1991;37(2):165–9.
Chirica et al. World Journal of Emergency Surgery (2019) 14:26 Page 13 of 15
55. Le Naoures P, Hamy A, Lerolle N, et al. Risk factors for symptomatic
esophageal stricture after caustic ingestion-a retrospective cohort study. Dis
Esophagus. 2017;30(6):1–6.
56. Cowan T, Foster R, Isbister GK. Acute esophageal injury and strictures following
corrosive ingestions in a 27year cohort. Am J Emerg Med. 2017;35(3):488–92.
57. Lahoti D, Broor SL, Basu PP, et al. Corrosive esophageal strictures: predictors
of response to endoscopic dilation. Gastrointest Endosc. 1995;41(3):196–200.
58. Chirica M, Veyrie N, Munoz-Bongrand N, et al. Late morbidity after colon
interposition for corrosive esophageal injury: risk factors, management, and
outcome. A 20-years experience. Ann Surg. 2010;252(2):271–80.
59. Andreoni B, Farina ML, Biffi R, et al. Esophageal perforation and caustic injury:
emergency management of caustic ingestion. Dis Esophagus. 1997;10(2):95–100.
60. Estrera A, Taylor W, Mills LJ, et al. Corrosive burns of the esophagus and
stomach: a recommendation for an aggressive surgical approach. Ann
Thorac Surg. 1986;41(3):276–83.
61. Di Saverio S, Biscardi A, Piccinini A, et al. Different possible surgical
managements of caustic ingestion: diagnostic laparoscopy for Zargar’s
grade 3a lesions and a new technique of “duodenal damage control” with
“4-tubes ostomy" and duodenal wash-out as an option for extensive 3b
lesions in unstable patients. Updat Surg 2015; 67(3):313–320.
62. Dapri G, Himpens J, Mouchart A, et al. Laparoscopic transhiatal esophago-
gastrectomy after corrosive injury. Surg Endosc. 2007;21(12):2322–5.
63. Cattan P, Munoz-Bongrand N, Berney T, et al. Extensive abdominal surgery
after caustic ingestion. Ann Surg. 2000;231(4):519–23.
64. Chirica M, Kraemer A, Petrascu E, Vuarnesson H, Pariente B, Halimi B, Munoz-
Bongrand N, Sarfati E, Cattan P. Esophagojejunostomy after total
gastrectomy for caustic injuries. Dis Esophagus. 2014;27(2):122–7.
65. Lefrancois M, Gaujoux S, Resche-Rigon M, et al. Oesophagogastrectomy and
pancreatoduodenectomy for caustic injury. Br J Surg. 2011;98(7):983–90.
66. Benjamin B, Agueb R, Vuarnesson H, Tranchart H, Bongrand NM, Sarfati E,
Cattan P, Chirica M. Tracheobronchial Necrosis After Caustic Ingestion. Ann
Surg. 2016;263(4):808–13.
67. Sdralis EIK, Petousis S, Rashid F, et al. Epidemiology, diagnosis, and management
of esophageal perforations: systematic review. Dis Esophagus. 2017;30(8):1–6.
68. Chirica M, Champault A, Dray X, et al. Esophageal perforations. J Visc Surg.
2010;147(3):e117–28.
69. Aloreidi K, Patel B, Ridgway T, et al. Non-surgical management of
Boerhaave’s syndrome: a case series study and review of the literature.
Endosc Int Open. 2018;6(1):E92–7.
70. Korn O, Onate JC, Lopez R. Anatomy of the Boerhaave syndrome. Surgery.
2007;141(2):222–8.
71. Baron TH, Wong Kee Song LM, Zielinski MD, et al. A comprehensive
approach to the management of acute endoscopic perforations (with
videos). Gastrointest Endosc. 2012;76(4):838–59.
72. Aidem HP, Baker LD. The Boerhaave syndrome. JAMA. 1964;187:57.
73. Biancari F, D'Andrea V, Paone R, et al. Current treatment and outcome of
esophageal perforations in adults: systematic review and meta-analysis of
75 studies. World J Surg. 2013;37(5):1051–9.
74. Brinster CJ, Singhal S, Lee L, et al. Evolving options in the management of
esophageal perforation. Ann Thorac Surg. 2004;77(4):1475–83.
75. Ali JT, Rice RD, David EA, et al. Perforated esophageal intervention focus
(PERF) study: a multi-center examination of contemporary treatment. Dis
Esophagus. 2017;30(11):1–8.
76. Biancari F, Saarnio J, Mennander A, et al. Outcome of patients with esophageal
perforations: a multicenter study. World J Surg. 2014;38(4):902–9.
77. Backer CL, LoCicero J 3rd, Hartz RS, et al. Computed tomography in patients
with esophageal perforation. Chest. 1990;98(5):1078–80.
78. Ivatury RR, Moore FA, Biffl W, et al. Oesophageal injuries: position paper,
WSES, 2013. World J Emerg Surg. 2014;9(1):9.
79. Soreide JA, Viste A. Esophageal perforation: diagnostic work-up and
clinical decision-making in the first 24 hours. Scand J Trauma Resusc
Emerg Med. 2011;19:66.
80. Watkins JR, Farivar AS. Endoluminal therapies for esophageal perforations
and leaks. Thorac Surg Clin. 2018;28(4):541–54.
81. Mangiavillano B, Viaggi P, Masci E. Endoscopic closure of acute
iatrogenic perforations during diagnostic and therapeutic endoscopy in
the gastrointestinal tract using metallic clips: a literature review. J Dig
Dis. 2010;11(1):12–8.
82. Voermans RP, Le Moine O, von Renteln D, et al. Efficacy of endoscopic
closure of acute perforations of the gastrointestinal tract. Clin Gastroenterol
Hepatol. 2012;10(6):603–8.
83. Baron TH, Song LM, Ross A, et al. Use of an over-the-scope clipping device:
multicenter retrospective results of the first U.S. experience (with videos).
Gastrointest Endosc. 2012;76(1):202–8.
84. Swinnen J, Eisendrath P, Rigaux J, et al. Self-expandable metal stents for the
treatment of benign upper GI leaks and perforations. Gastrointest Endosc.
2011;73(5):890–9.
85. Persson S, Rouvelas I, Irino T, et al. Outcomes following the main treatment
options in patients with a leaking esophagus: a systematic literature review.
Dis Esophagus. 2017;30(12):1–10.
86. Freeman RK, Herrera A, Ascioti AJ, et al. A propensity-matched
comparison of cost and outcomes after esophageal stent placement or
primary surgical repair for iatrogenic esophageal perforation. J Thorac
Cardiovasc Surg. 2015;149(6):1550–5.
87. Laukoetter MG, Mennigen R, Neumann PA, et al. Successful closure of
defects in the upper gastrointestinal tract by endoscopic vacuum therapy
(EVT): a prospective cohort study. Surg Endosc. 2017;31(6):2687–96.
88. Still S, Mencio M, Ontiveros E, et al. Primary and rescue Endoluminal
vacuum therapy in the management of esophageal perforations and leaks.
Ann Thorac Cardiovasc Surg. 2018;24(4):173–9.
89. Tellechea JI, Gonzalez JM, Miranda-Garcia P, et al. Role of endoscopy in the
management of Boerhaave syndrome. Clin Endosc. 2018;51(2):186–91.
90. Wu G, Zhao YS, Fang Y, et al. Treatment of spontaneous esophageal
rupture with transnasal thoracic drainage and temporary esophageal
stent and jejunal feeding tube placement. J Trauma Acute Care Surg.
2017;82(1):141–9.
91. Glatz T, Marjanovic G, Kulemann B, et al. Management and outcome of
esophageal stenting for spontaneous esophageal perforations. Dis
Esophagus. 2017;30(3):1–6.
92. Freeman RK, Ascioti AJ, Wozniak TC. Postoperative esophageal leak
management with the Polyflex esophageal stent. J Thorac Cardiovasc Surg.
2007;133(2):333–8.
93. Altorjay A, Kiss J, Voros A, et al. Nonoperative management of esophageal
perforations. Is it justified? Ann Surg. 1997;225(4):415–21.
94. Abbas G, Schuchert MJ, Pettiford BL, et al. Contemporaneous management
of esophageal perforation. Surgery. 2009;146(4):749–55 discussion 755-6.
95. Schweigert M, Sousa HS, Solymosi N, et al. Spotlight on esophageal
perforation: a multinational study using the Pittsburgh esophageal perforation
severity scoring system. J Thorac Cardiovasc Surg. 2016;151(4):1002–9.
96. Gregory J, Hecht J. Esophageal perforation: a research review of the anti-
infective treatment. Int J Clin Pharm. 2018;40(5):953–62.
97. Wahed S, Dent B, Jones R, et al. Spectrum of oesophageal perforations and
their influence on management. Br J Surg. 2014;101(1):e156–62.
98. Vogel SB, Rout WR, Martin TD, et al. Esophageal perforation in adults:
aggressive, conservative treatment lowers morbidity and mortality. Ann
Surg. 2005;241(6):1016–21 discussion 1021-3.
99. Nakano T, Onodera K, Ichikawa H, et al. Thoracoscopic primary repair with
mediastinal drainage is a viable option for patients with Boerhaave's
syndrome. J Thorac Dis. 2018;10(2):784–9.
100. Cho JS, Kim YD, Kim JW, et al. Thoracoscopic primary esophageal repair in
patients with Boerhaave's syndrome. Ann Thorac Surg. 2011;91(5):1552–5.
101. Vallbohmer D, Holscher AH, Holscher M, et al. Options in the management
of esophageal perforation: analysis over a 12-year period. Dis Esophagus.
2010;23(3):185–90.
102. Linden PA, Bueno R, Mentzer SJ, et al. Modified T-tube repair of delayed
esophageal perforation results in a low mortality rate similar to that seen
with acute perforations. Ann Thorac Surg. 2007;83(3):1129–33.
103. Okonta KE, Kesieme EB. Is oesophagectomy or conservative treatment for
delayed benign oesophageal perforation the better option? Interact
Cardiovasc Thorac Surg. 2012;15(3):509–11.
104. Petrone P, Kassimi K, Jimenez-Gomez M, et al. Management of esophageal
injuries secondary to trauma. Injury. 2017;48(8):1735–42.
105. Patel MS, Malinoski DJ, Zhou L, et al. Penetrating oesophageal injury: a
contemporary analysis of the National Trauma Data Bank. Injury. 2013;44(1):48–55.
106. Makhani M, Midani D, Goldberg A, et al. Pathogenesis and outcomes of
traumatic injuries of the esophagus. Dis Esophagus. 2014;27(7):630–6.
107. Roan JN, Wu MH. Esophageal perforation caused by external air-blast injury.
J Cardiothorac Surg. 2010;5:130.
108. Bryant AS, Cerfolio RJ. Esophageal trauma. Thorac Surg Clin. 2007;17(1):63–72.
109. Asensio JA, Chahwan S, Forno W, et al. Penetrating esophageal injuries:
multicenter study of the American Association for the Surgery of Trauma. J
Trauma. 2001;50(2):289–96.
Chirica et al. World Journal of Emergency Surgery (2019) 14:26 Page 14 of 15
110. Aiolfi A, Inaba K, Recinos G, et al. Non-iatrogenic esophageal injury: a
retrospective analysis from the National Trauma Data Bank. World J Emerg
Surg. 2017;12:19.
111. Biffl WL, Moore EE, Feliciano DV, et al. Western Trauma Association critical
decisions in trauma: diagnosis and management of esophageal injuries. J
Trauma Acute Care Surg. 2015;79(6):1089–95.
112. Fadoo F, Ruiz DE, Dawn SK, et al. Helical CT esophagography for the
evaluation of suspected esophageal perforation or rupture. AJR Am J
Roentgenol. 2004;182(5):1177–9.
113. Srinivasan R, Haywood T, Horwitz B, et al. Role of flexible endoscopy in the
evaluation of possible esophageal trauma after penetrating injuries. Am J
Gastroenterol. 2000;95(7):1725–9.
114. Arantes V, Campolina C, Valerio SH, et al. Flexible esophagoscopy as a
diagnostic tool for traumatic esophageal injuries. J Trauma. 2009;66(6):1677–82.
115. Ahmed N, Massier C, Tassie J, et al. Diagnosis of penetrating injuries of
the pharynx and esophagus in the severely injured patient. J Trauma.
2009;67(1):152–4.
116. Sudarshan M, Cassivi SD. Management of traumatic esophageal injuries. J
Thorac Dis. 2019;11(Suppl 2):S172–6.
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.




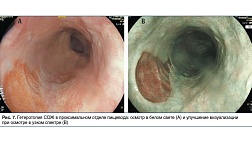


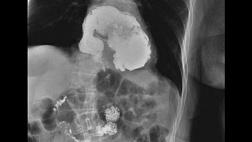



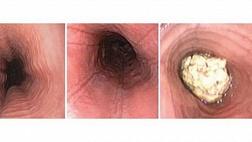
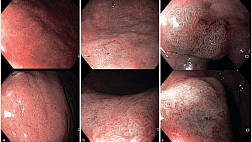


.jpg)





.png)



.jpg)
















Комментарии