- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: НОВЫЕ ТЕХНОЛОГИИ В КРИОХИРУРГИИ ПРИ ЭНДОСКОПИЧЕСКОМ ЛЕЧЕНИИ ОПУХОЛЕЙ ДЫХАТЕЛЬНЫХ ПУТЕЙ
| Авторы: | В.В. СОКОЛОВ, Д.В. СОКОЛОВ, Л.В. ТЕЛЕГИНА, к.м.н., А.Л. НИКОЛАЕВ, к.м.н., А.П. КИРЮХИН, Ю.Л. КУДРЯВЦЕВА, А.Д. КАПРИН 1 2017г. |
| Об авторах: |
1. Московский научно-исследовательский онкологический институт им. П.А. Герцена - филиал Национального медицинского исследовательского радиологического центра |

Полный текст статьи:
10.21518/2079701X20175186190
В.В. СОКОЛОВ, профессор, д.м.н., Д.В. СОКОЛОВ, д.м.н., Л.В. ТЕЛЕГИНА, к.м.н., А.Л. НИКОЛАЕВ, к.м.н., А.П. КИРЮХИН, Ю.Л. КУДРЯВЦЕВА, А.Д. КАПРИН, академик РАН, д.м.н., профессор
Московский научноисследовательский онкологический институт им. П.А. Герцена филиал Национального медицинского исследовательского радиологического центра
НОВЫЕ ТЕХНОЛОГИИ В КРИОХИРУРГИИ ПРИ ЭНДОСКОПИЧЕСКОМ ЛЕЧЕНИИ ОПУХОЛЕЙ ДЫХАТЕЛЬНЫХ ПУТЕЙ
В статье представлена история развития метода криотерапии от античности до настоящего времени, материалы клинического использования криохирургии при эндоскопической диагностике и лечении опухолей дыхательных путей на современном этапе, особенности современного оборудования для криохирургии. Также в статье представлен первый клинический опыт использования криореканализации при стенозирующих опухолях трахеобронхиального дерева в России при помощи медицинского аппарата для криохирургии последнего поколения. Приведены три клинических примера криореканализации. Предварительные результаты клинических исследований свидетельствуют, что в сравнении с криохирургией на аппаратах более ранних версий криореканализация при помощи медицинского оборудования последнего поколения и новой модели криозонда является эффективным методом реканализации с целью восстановления проходимости дыхательных путей, который может быть использован в комбинации с электродеструкцией, аргоноплазменной и лазерной коагуляцией.
Ключевые слова: криохирургия, криореканализация, криобиопсия, стенозирующие опухоли дыхательных путей.
V.V. SOKOLOV, MD, Prof., D.V. SOKOLOV, MD, L.V. TELEGINA, PhD in Medicine, A.L. NIKOLAEV, PhD in Medicine, А.Р. KIRYUKHIN, Yu.L. KUDRYAVTSEVA, A.D. KAPRIN, Acad. RAS, Prof.
Р. Hertsen Moscow Oncology Research Institute branch of the National Medical Research Radiological Centre NEW TECHNOLOGIES FOR CRYOSURGERY IN ENDOSCOPIC TREATMENT OF LUNG AND BRONCHIAL TUMORS The article presents the history of the development of the cryotherapy method from antiquity to the present day, materials of clinical use of cryosurgery for endoscopic diagnosis and treatment of lung and bronchial tumors at the present stage, features of the advanced equipment for cryosurgery. The article also describes the first clinical experience in using cryorecanalization in obstructing tumors of the tracheobronchial tree in Russia using an advanced cryosurgical device. Three clinical examples of cryorecanalization are provided. The preliminary results of the clinical studies show that cryorecanalization using the advanced medical equipment and a new cryoprobe model is an effective method for recanalization to restore airway patency, which can be used in combination with electrodestruction, argonplasma and laser coagulation, as compared with older cryosurgery devices. Keywords: cryosurgery, cryorecanalization, cryobiopsia, obstructing lung and bronchial tumors
ИСТОРИЯ КРИОХИРУРГИИ
Первое применение холода в медицине для лечения инфицированных ран зарегистрировано в Древней Греции еще за 3 500 лет до новой эры. Врачи Древнего Египта, а позже Гиппократ, Гален, Цельс, Авиценна описали болеутоляющие и противовоспалительные свойства холода, который использовали для лечения при различных заболеваниях. В последующем Н.И. Пирогов с успехом использовал охлаждение для лечения ран. На Руси, как известно, давнымдавно принято после горячей бани окунаться в ледяную купель или растираться снегом. В Европе к этой традиции долгое время относились как к чудачеству, и лишь вышедшее в 1886 г. сочинение баварского священника Себастьяна Кнейпа «Мое водолечение» в корне изменило прежнее отношение к лечебному эффекту холода: хождение босиком по мокрой траве, влажным камням, холодной воде, а также по свежему снегу названо самым естественным и простым средством как для закаливания, так и для лечения. Методики Кнейпа стали первым сводом правил холодовой терапии, не потерявших своей актуальности и сегодня. Достаточно напомнить, что после операций, родов, при лихорадочных состояниях или при травмах всегда назначается компресс со льдом [1].
В Англии в 1845 г. M. Faraday впервые описал применения смеси льда и соленой воды для лечения злокачественной опухоли кожи [2]. В 1851 г. успешное применение криотерапии описано James Arnott для лечения злокачественных опухолей наружных покровов [3], что приводило к уменьшению размера опухоли, снижению интенсивности болей и уменьшению кровоизлияний [4]. В 1899 г. Campbell White сообщил об успешном использовании сжиженного газа как хладагента в медицинской практике при лечении красной волчанки, опоясывающего лишая, мягкого шанкра, родимых пятен, бородавок, варикозных язв нижних конечностей, карбункулов, рака кожи [5]. В начале прошлого столетия William Pusey из Чикаго популяризировал использование сухого льда (или твердой углекислоты) вместо смеси соли и льда и с успехом применил криотерапию при «большом черном, покрытый волосами невусе» на коже лица у молодой девушки. Это была одна из первых демонстраций высокой чувствительности меланоцитов к холоду [6].
После разработки в 1961 г. Irvin S. Cooper современного криохирургического аппарата началось активное применение криохирургии при онкологических заболеваниях внутренних органов [7]. Значительный вклад в понимание физиологии криовоздействия внес японский исследователь Sajio Sumida и его ученики. К 1970 г. практика криохирургии в США (Dr. NeeL и Dr. Anderson из клиники Mayo) составила более 8 тыс. наблюдений. Большой вклад в криохирургию последних десятилетий внес доктор Nikolai N. Korpan из Австрии, который разработал и усовершенствовал криохирургические методики для лечения больных первичным и метастатическим раком печени, раком поджелудочной железы, молочной железы, кожи [8].
В России первые попытки экспериментального исследования влияния низкой температуры на функциональное состояние клеток центральной нервной системы отражены в работах А.Д. Сперанского в 1935 г.: были изучены эффекты замораживания ткани коры головного мозга для лечения эпилепсии [9]. Родоначальниками криохирургии в клинике были профессор Э.И. Кандель и физик, академик А.И. Шальников. В начале 60х гг. была создана целая серия криохирургических устройств и аппаратов для практического применения в нейрохирургии, гинекологии, проктологии и панкреатологии. Исторически значимой была публикация Э.И. Канделя, Д.Р. Чирешкина и А.И. Шальникова об итогах развития и перспективах криохирургии [10]. Авторы разработок криохирургической техники и методик их клинического применения были удостоены Государственной премии СССР. Исследования по криобиологии и криомедицине проводились в Российском онкологическом научном центре им. Н.Н. Блохина, где сформировалась наиболее значимая научная онкологическая школа криохирургии. Большая заслуга в этом принадлежит профессору А.И. Пачесу, его коллегам и ученикам.
Активное внедрение криохирургических методов при лечении опухолевой патологии легких началось еще в 70х гг. прошлого века, когда были проведены первые экспериментальные исследования на животных и пролечены первые больные. Одной из первых методик была использована криодеструкция опухолей легких с использованием жидкого азота. В 1975 г. Sanderson DR с соавт. опубликовали одно из первых клинических наблюдений применения криотерапии при эндоскопическом лечении центрального рака легкого [11]. Технически эндоскопическую криотерапию до середины 90х годов осуществляли только посредством ригидной бронхоскопии [12, 13]. В последующем с совершенствованием оборудования стало возможно применять криохирургию и при гибкой фибробронхоскопии [14, 15]. Несмотря на то что метод криотерапии известен очень давно, долгое время он не имел широкого распространения при эндоскопическом лечении опухолей дыхательных путей [16]. Это было связано с тем, что эффект криотерапии был отсрочен (510 дней), что ограничивало его использование при опухолевом стенозе дыхательных путей, вызывающих дыхательную недостаточность [17], и более популярным методом была лазерная хирургия с использованием ND: АИГлазера.
В настоящее время имеется ряд публикаций, демонстрирующие успех криохирургии при опухолевых стенозах дыхательных путей, вызывающих дыхательную недостаточность. В статье Schumann C. представлен клинический опыт лечения 225 пациентов, которым по экстренным показаниям была выполнена реканализация при помощи гибкого криозонда нового поколения при опухолевом стенозе дыхательных путей. У 205 пациентов криореканализация была успешна [18]. По данным Hetzet et al. [19], общая эффективность криохирургии при стенозирующих опухолях дыхательных путей составила 83%: полная регрессия опухоли была получена в 61% (37/60), частичная в 22% (13/60). Рестенозирование при опухолевом стенозе, по данным Hetzet et al. [19], составило 24,6% (14/57) через 1024 нед. после криореканализации. Jung et al. продемонстрировал успешный результат криореканализации у 75% больных раком легкого III и IV стадии [20]. Noppen et al. [21] продемонстрировали методику криодевитализации опухоли при использовании 3 циклов замораживания по 20 с до 80 °C у 5 пациентов с местнораспространенным центральным раком легкого, у 4 с карциномой in situ бронха, у 2 с регионарными метастазами и у одного больного с гемангиомой. Повторный курс лечения был проведен через 12 нед. Общая эффективность составила 80%.
Согласно исследованию Berotoletti et al. [22], после 3 циклов криодевитализации при температуре 70 °C по поводу 18 типичных карциноидов бронхов была достигнута полная регрессия опухоли со сроком наблюдения без рецидива в течении 44,4 мес. Лишь через 7 лет у 2 больных был зафиксирован рецидив опухоли (11,1%).
Maiwand and Asimakopoulos [23] проводили по 2 цикла криодевитализации у 521 пациента с неоперабельным центральным раком легкого. Средняя продолжительность наблюдения составила 18 мес. (от 4 до 84), средняя продолжительность жизни 8,2 мес. и зависела от стадии заболевания.
В России первые попытки экспериментального исследования влияния низкой температуры на функциональное состояние клеток центральной нервной системы отражены в работах А.Д. Сперанского в 1935 г.: были изучены эффекты замораживания ткани коры головного мозга для лечения эпилепсии
В 2011 г. SeonHeui Lee проанализировал данные 15 клинических исследований, в которых описывался успешный опыт применения криохирургии при стенозирующих опухолевых стенозах дыхательных путей. Во всех исследованиях были представлены данные, подтверждающие безопасность данного метода лечения. В 10 из 15 клинических исследований были описаны возможные осложнения, такие как кровотечения, фибрилляция предсердий и одышка, которые возникали в 11,1% случаев, и все были купированы применением консервативной терапией. По данным 5 исследований, смерть в течение 30 дней после процедуры наступила в 7,1% случаев и была связана с кровотечением и острой дыхательной недостаточностью [24].
Отдельным направлением эндобронхиальной криохиругии, применяемой с диагностической целью, является криобиопсия (эндобронхиальная или трансбронхиальная). Основными показаниями для криобиопсии являются центральный рак легкого с эндобронхиальным ростом и интерстициальные заболевания легочной ткани [25, 26]. Криобиопсия позволяет осуществлять забор биологической ткани в 34 раза большего объема, сохраняя ее структуру для последующего гистологического и иммуногистохимического исследования. Криобиопсия позволяет избежать повреждения ткани, свойственного традиционной биопсии, раздавливание ткани в процессе забора материала и последующая химическая фиксация [2729].
СОВРЕМЕННОЕ ОБОРУДОВАНИЕ ДЛЯ КРИОХИРУРГИИ
Несмотря на перспективность метода криохирургии в лечении опухолей легкого, его использование в клинической практике было ограничено до начала XXI в. в связи с отсутствием адекватного технического обеспечения. Имеющиеся криозонды были ограничены в использовании в связи с низкой температурой замораживания, которая не позволяла удалять крупные фрагменты опухолевой ткани. Данные недостатки были учтены при разработке новой модели криозонда для криореканализации, а также методики криобиопсии как экзофитных опухолей дыхательных путей, так и периферических новообразований. Современное оборудование для криохирургии позволяет проводить через гибкий бронхоскоп криобиопсию, криодеструкцию опухоли и криореканализацию суженного просвета трахеи и крупных бронхов при опухолевом стенозе [30]. За последние десятилетия в клиническую практику были внедрены новые усовершенствованные медицинские установки для криохирургии. При работе на данных установках вся необходимая во время процедуры информация четко отображается на дисплее, на таймере демонстрируется продолжительность замораживания. Функция настройки обеспечивает мониторинг и управление процессом заморозки. В приборе используются криозонды новой модели, устойчивые к скручиванию, обладающие значительной прочностью на разрыв. При корректном их применении один криозонд можно использовать и обрабатывать повторно до 100 раз. Гибкий криозонд обеспечивает доступ фактически к любой зоне трахеобронхиального дерева и ткани легкого. Его можно применять для криобиопсии во фронтальной или горизонтальной плоскости, что затруднительно при использовании стандартных биопсийных щипцов. Криозонд может быть использован через регидный и гибкий эндоскоп. При помощи нового криозонда и нового режима заморозки удается удалять ткань опухоли сразу же после заморозки на конце зонда вместе с бронхоскопом.
МАТЕРИАЛЫ И МЕТОДЫ, РЕЗУЛЬТАТЫ
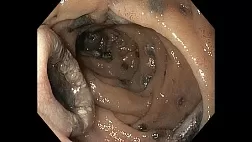
В эндоскопическом отделении МНИОИ им. П.А. Герцена за период с мая 2016 г. по декабрь 2016 г. эндоскопическая криохирургия была проведена у 7 пациентов в возрасте от 43 до 84 лет с различной опухолевой патологией дыхательных путей: рак трахеи (3), рак бифуркации трахеи (1), рецидив нейроэндокринной опухоли левого главного бронха (1), ангиосаркома легкого (1), инвертированная папиллома носа (1). Было проведено 25 сеансов криореканализации. За один сеанс криореканализации проводилось от 23 до 1517 циклов криоэкстракции фрагментов опухоли. Размер удаленных фрагментов опухоли составлял от 56 до 915 мм в максимальном диаметре. В последующем фрагменты опухоли после удаления были направлены на морфологическое, иммуногистохимическое и молекулярногенетическое исследования. Был использован криохирургический медицинский аппарат ERBECRYO 2 с криозондом длинной 78 см и диаметром 2,3 мм. Работа данной медицинской установки основана на использовании эффекта Джоуля Томсона, т. е. резкого охлаждения находящегося под высоким давлением газа при протекании через узкий канал криозонда. В отличие от зондов старого поколения для криодеструкции в новой модели имеется более прочный узкий канал для поступления газа с возможностью расширения поверхности зонда с целью усиления мощности замораживания, что позволяет выполнять фиксированную тракцию больших фрагментов ткани опухоли с исключением возможности его отрыва и дислокации. Гидрофильное пластиковое покрытие зонда позволяет легко проводить его в рабочий канал гибкого бронхоскопа.
Основными показаниями для криобиопсии являются центральный рак легкого с эндобронхиальным ростом и интерстициальные заболевания легочной ткани
Продолжительность процедуры составила от 2030 до 6070 мин (3540 ± 15 мин). Количество сеансов реканализации зависело от локализации и протяженности опухолевого стеноза. В основе криореканализации лежит идея преобразования богато васкуляризированной и содержащей большое количество жидкости опухолевой ткани в замороженный шарик на конце зонда с последующим извлечением ткани. Пограничная зона между замороженной опухолевой тканью и здоровой стенкой, представляет маловаскуляризированную хрящевую ткань. В этой области происходит «обламывание» данного участка, предохраняя от повреждения здоровую ткань. Холод вызывает вазоконстрикцию и микротромбоз капилляров на границе криовоздействия. Именно эти свойства, вероятнее всего, препятствуют кровотечению [19].
При выполнении биопсии криозонд, проведенный через рабочий канал бронхоскопа, устанавливался на поверхности опухоли и затем внедрялся в опухоль на глубину 0,51,0 см. Далее в течение 520 сек производилось замораживание опухолевой ткани вокруг концевого отдела зонда. В большинстве случаев удавалось визуально контролировать границы замороженной опухолевой ткани по глубине и визуализировать момент достижения эффекта заморозки до здоровой ткани. Сразу после достижения необходимого уровня замораживания опухолевой ткани проводилось извлечение бронхоскопа с криозондом вместе с частью опухоли. Описанный выше цикл повторялся до восстановления просвета трахеи и крупных бронхов в зоне опухолевого сужения. Скорость заморозки уменьшается в процессе повторных манипуляций, что обеспечивает дополнительную защиту окружающих здоровых тканей. При случайном замораживании хрящевых полуколец зонд невозможно извлечь, несмотря на прилагаемые усилия. Зонд легко извлекается сразу после окончания воздействия низких температур [19]. В отличие от лазерной реканализации с ее высокой энергией криореканализацию можно выполнять у пациентов со стентами, не боясь их повреждения, и при высокой концентрации кислорода в дыхательных путях [31]. У всех 7 пациентов после криореканализации отмечалось небольшое кровотечение (до 50100 мл) из опухоли, которое было остановлено с помощью консервативных методов, включая аргоноплазменную или лазерную коагуляцию. Ниже приведены 3 клинических примера криореканализации при опухолевом стенозе трахеи и главных бронхов.
Клинический пример 1: пациент С., 43 года.
Анамнез заболевания: в феврале марте 2016 г. пациент находился на обследовании в МНИОИ им. П.А. Герцена по поводу возникшего сухого кашля, эпизодов слабости, повышения температуры тела. По данным видеобронхоскопии была выявлена опухоль нижнедолевого бронха правого легкого. При дообследовании заподозрено метастатическое поражение левого надпочечника. С целью восстановления просвета нижнедолевого бронха было проведено несколько сеансов электродеструкции опухоли. По данным гистологического исследования в нижнедолевом бронхе справа была диагностирована муцинозная аденокарцинома 63. В последующем было рекомендовано проведение паллиативной ПХТ. Первый курс полихимиотерапии по схеме РТ (паклитаксел 300 мг + карбоплатин 450 мг) проведен 23.07.16. Через 3 мес после проведения полихимиотерапии в связи с нарастающей одышкой, слабостью пациент самостоятельно обратился в МНИОИ им. П.А. Герцена, госпитализирован в отделение торакальной онкохирургии МНИОИ им. П.А. Герцена. При дообследовании была выявлена опухоль, обтурирующая просвет правого главного бронха. Была рекомендована эндоскопическая операция с целью восстановления правого главного бронха. Под внутривенным наркозом (Пропофол 600 мг) 03.11.16 была выполнена реканализация правого главного бронха при помощи криоэкстракции: под визуальным контролем произведена интубация трахеи жестким бронхоскопом Фриделя №12. Затем под контролем видеоэндоскопа выполнена криоэкстракция экзофитной части опухоли правого главного бронха. Количество циклов 12, время заморозки 20 сек, средний размер удаляемых кусочков 915 мм. Удалено 2/3 экзофитной части опухоли, выступающей в просвет правого главного бронха. При проведение аппарата через зону опухолевого сужения правого главного бронха визуализирован просвет верхнедолевого бронха без признаков опухолевой инфильтрации. Просвет промежуточного бронха осмотреть не удалось изза циркулярной опухолевой инфильтрации. Основание опухоли обработано при помощи АПК. Признаков активного кровотечения на момент окончания эндоскопической операции не отмечено. При гистологическом исследовании фрагментов удаленной опухоли из правого главного бронха диагностирована высокодифференцированная веретеноклеточная саркома.
В отличие от лазерной реканализации с ее высокой энергией криореканализацию можно выполнять у пациентов со стентами, не боясь их повреждения, и при высокой концентрации кислорода в дыхательных путях
Клинический пример 2: пациент Г., 62 года.
Анамнез заболевания: в августе сентябре 2010 г. по поводу карциноида левого главного бронха в Ставропольском ООД был проведен курс дистанционной лучевой терапии (СОД 70 Гр). В ноябре 2016 г. при комплексном обследовании по месту жительства диагностирован рецидив опухоли со стенозом трахеи и обоих главных бронхов и развитием дыхательной недостаточности. Пациентка была госпитализирована в отделение торакальной онкохирургии МНИОИ им. П.А. Герцена для оказания экстренной медицинской помощи. Учитывая наличие кардиостимулятора, на первом этапе лечения было проведено 3 сеанса эндоскопической лазерной деструкции в сочетании с криоэкстракцией экзофитной части опухоли с восстановлением просвета нижней трети трахеи и правого главного бронха. В последующем было проведено 7 сеансов реканализация левого главного бронха при помощи криоэкстракции экзофитной части опухоли под контролем видеоэндоскопа. Количество циклов за один сеанс криореканализации составило от 8 до 15, время заморозки 2025 сек, размер фрагментов от 3 мм до 10 мм в диаметре. Было удалено 2/3 экзофитной части опухоли, выступающей в просвет левого главного бронха. При проведение аппарата через зону опухолевого сужения левого главного бронха был визуализирован просвет верхнедолевого бронха без признаков опухолевой инфильтрации. Основание опухоли было обработано при помощи аргоноплазменной и лазерной коагуляции. Признаков активного кровотечения во время криореканализации не отмечено. При гистологическом исследовании биоптата из левого главного бронха диагностирован типичный карциноид.
Клинический пример 3: пациент М., 65 лет.
Диагноз: рак бифуркации трахеи с поражением нижней трети трахеи и устьев обоих главных бронхов. Стеноз трахеи II ст. Морфологически верифицирован плоскоклеточный рак. Пациент поступил в МНИОИ им. П.А. Герцена с клиникой дыхательной недостаточности, с жалобами на одышку при минимальной физической нагрузке, периодический кашель с отхождением вязкой мокроты, кровохарканье. При проведении бронхоскопии в нижней трети трахеи определялся проксимальный край экзофитного компонента крупнобугристой опухоли на широком основании, расположенной преимущественно по задней стенке трахеи, протяженностью 2,53 см. Просвет трахеи сужен на 2/3. Опухоль переходила на гребень карины, задний треугольник карины и устья обоих главных бронхов по заднемедиальным скатам. Просветы главных бронхов сужены до 0,5 см, протяженность опухоли 0,60,7 см. Дистальнее опухоли бронхи осмотрены до 5 порядка без выраженной опухолевой и воспалительной патологии. С целью реканализации просвета трахеи и главных бронхов выполнена эндоскопическая операция: проведено 6 циклов криодеструкции экзофитной части опухоли нижней 1/3 трахеи и обоих главных бронхов диаметром 0,6 х 0,5 см с последующей коагуляцией поверхности опухоли при помощи полупроводникового лазера Dornier и АПК. Просвет трахеи расширен до анатомической нормы, просвет главных бронхов расширен на 1 диаметра. Осложнений нет. При повторной бронхоскопии проведен дополнительный сеанс криореканализации: по 2 цикла криореканализации в области устьев главных бронхов с последующей обработкой поверхности опухоли при помощи АПК. Просветы расширены до анатомической нормы. В последующем тактика лечения пациента обсуждена на межотделенческом консилиуме. Пациент был направлен для проведения лучевой терапии.
ЗАКЛЮЧЕНИЕ
В сравнении с криохирургией на аппаратах более ранних версий криореканализация при помощи медицинского аппарата последнего поколения ERBECRYO 2 и новой модели разработанного криозонда является эффективным методом реканализации с целью восстановления проходимости дыхательных путей, который может быть использован в комбинации с электродеструкцией, аргоноплазменной и лазерной коагуляцией. Новая технология не требует большой продолжительности криодеструкции и последующего удаления некротизированной ткани. Замороженная ткань удаляется сразу же в процессе криовоздействия на конце зонда после термообработки.
Этот метод может быть использован у пациентов с опухолевыми стенозами трахеи и крупных бронхов для устранения дыхательной недостаточности. По данным литературы, криореканализация успешна в 83% наблюдений вне зависимости от локализации опухоли (трахея, главные, долевые или сегментарные бронхи). В отличие от других способов реканализации при опухолевых стенозах дыхательных путей криореканализация относится к наиболее дешевым методам лечения и в настоящее время может быть выполнена с помощью гибких бронхоскопов.
Список литературы:
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.














.jpg)





.png)

.jpg)














Комментарии