- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Обновленные данные об эозинофильных заболеваниях желудочно-кишечного тракта Гузий А.В.2017
Полный текст статьи:
Обновленные данные об эозинофильных заболеваниях желудочно-кишечного тракта
Гузий А.В.
Резюме. Раскрыт вопрос современного диагностического подхода, этиологии и лечения
Эозинофильные заболевания желудочно-кишечного тракта, включая эозинофильный эзофагит и эозинофильный гастроэнтерит, являются редкими хроническими видами патологии пищеварительного тракта с иммуноопосредованным патогенезом. Результаты недавних научных исследований свидетельствуют о том, что в развитии эозинофильных нарушений, наряду с общеизвестным иммуноглобулин (Ig)E-ответом на аллергены, также может быть задействована реакция гиперчувствительности замедленного типа.
Интерес к проблеме эозинофильных заболеваний желудочно-кишечного тракта заметно возрос в последние десятилетия, но ввиду их редкой выявляемости данные об эпидемиологии, патогенезе и результатах лечения на сегодняшний день весьма фрагментарны. Для понимания этиологии и выбора оптимального терапевтического подхода ощущается нехватка в детальной характеристике эозинофильных заболеваний желудочно-кишечного тракта. Фактически современные методы лечения все еще противоречивы, и нет общего мнения относительно длительности дието- и/или кортикостероидной терапии.
В декабре 2016 г. в журнале «Clinical and Molecular Allergy» опубликован научный обзор обновленных данных по проблематике эозинофильных заболеваний желудочно-кишечного тракта, выполненный учеными Пармского университета (University of Parma), Италия. В работе приведены наиболее ценные сведения клинических исследований последнего десятилетия.
Эозинофильный эзофагит
Эозинофильный эзофагит — это хроническое воспалительное заболевание пищевода с иммуноаллергическим патогенезом, характеризующееся эозинофильной инфильтрацией (≥15 в поле зрения) и вторичным фиброзом. Эпидемиологические исследования в США и Европе определили частоту выявляемости эозинофильного эзофагита в количестве 50 случаев на 100 тыс. жителей любого возраста (от младенческого до преклонного), но диагноз впервые устанавливают чаще всего на третьем-четвертом десятилетии жизни. Болезнь чаще поражает мужчин, чем женщин (3:1), превалирует среди кавказских субэтносов (до 90% в общемировой популяции), но также может затрагивать африканскую, азиатскую, индейскую и латиноамериканскую популяции. Клинические формы эозинофильного эзофагита включают три подтипа: слизистый, мышечный и серозный.
Развитие эозинофильного эзофагита обусловлено сложным патогенезом, включающим генетические и экологические кофакторы, но точный механизм до сих пор неизвестен. При уровне наследуемости около 70% проявление патологии у монозиготных близнецов составляет всего 30%, что указывает на сильную роль в развитии болезни различных внешних факторов. Наиболее распространенные варианты геномных нарушений у пациентов с эозинофильным эзофагитом проявляются повышением экспрессии (до 53 раз по сравнению с нормальной функцией слизистой оболочки пищевода) эотаксина-3, хемокина эозинофильной активности. Другое важное нарушение касается гена, кодирующего синтез тимусного стромального лимфопоэтина и его аллелей, таких как rs3806932, присутствующих на хромосоме 5q22. Тимусный стромальный лимфопоэтин представляет собой цитокин, индуцирующий иммунный ответ в дендритных клетках, опосредованный Т-хелперами 2-го типа. Ген, кодирующий синтез рецептора тимусного стромального лимфопоэтина, находится в Y-хромосоме, что объясняет возможную причину высокой распространенности эозинофильного эзофагита в мужской популяции.
Формирование адаптивного иммунитета в патогенезе эозинофильного эзофагита координируется мощными провоспалительными медиаторами эозинофилов (гранулоцитарно-макрофагальный колониестимулирующий фактор, трансформирующий фактор роста-β, фактор некроза опухоли-α) и клеток Т-хелперов 2-го типа (интерлейкин-4, -5, -13). Трансформирующий фактор роста-β опосредует пролиферацию эпителиальных клеток и внеклеточное ремоделирование посредством регуляции генов, участвующих в патогенезе фиброза. Интерлейкин-4 вместе с интерлейкином-13 повышают продуцирование эотаксина-3. Интерлейкин-13, кроме того, ответственен за индуцирование производства хемокинов CCL11, CCL24 и CCL26 из эотаксинов, повышение экспрессии генов BANCR и NTRK1. Секвенирование РНК, полученного при биопсии пищевода пациентов с эозинофильным эзофагитом, выявило избыточную экспрессию lcnRNA BANCR, которая отвечает за местную гиперэозинофилию. BANCR также связан с повышением производства периостина — секретируемого белка ремодулирования тканей. Повышенная концентрация NTRK1 провоцирует усиленный ответ на его лиганд — нейротропную тирозин-киназу, которая играет основную роль в развитии гиперплазии при эозинофильном эзофагите.
Роль тучных клеток в патогенезе эозинофильного эзофагита объясняется высвобождением простагландина D2, который способен повышать эозинофильную инфильтрацию в пищеводе. В модулируемом на животных эозинофильном эзофагите увеличение количества тучных клеток наблюдалось после антигенной стимуляции пропорционально времени и количеству аллергена.
Определяемые в образцах биопсии пищевода пациентов с эозинофильным эзофагитом іNKT-лейкоциты являются субпопуляцией Т-клеток. В одном из недавних исследований выявлено, что сфинголипиды молока могут стимулировать продуцирование воспалительных цитокинов клетками iNKT.
Патогенетическая роль аллергии в развитии эозинофильного эзофагита была подтверждена различными экспериментальными и эпидемиологическими исследованиями у 75% участников. Сенсибилизация к ингаляционным и/или пищевым аллергенам среди взрослых пациентов фиксируется на уровне 86–93% и 50–82% соответственно. В педиатрической когорте пациентов семейная история аллергии присутствует примерно в 73,5% случаев. Наиболее частыми клиническими проявлениями являются аллергический ринит (60% случаев) и аллергическая (атопическая) бронхиальная астма (39% случаев). Примечательно, что случаи анафилаксии у пациентов с эозинофильным эзофагитом и пищевой IgE-сенсибилизацией проявляются крайне редко.
В исследовании, проведенном среди пациентов с сезонной респираторной аллергией, была установлена корреляция между ее проявлениями и эозинофильной инфильтрацией пищевода. Фактически было продемонстрировано сезонное распределение обострений и вновь выявленных случаев эозинофильного эзофагита. Более того, среди пациентов с этим заболеванием широко распространена сенсибилизация к паналлергенам, ответственным за перекрестную реактивность к ингаляционным и пищевым антигенам. Различия в моделях сенсибилизации среди детей и взрослых пациентов с эозинофильным эзофагитом характеризуются постепенным повышением эффекта ингаляционных аллергенов и параллельным снижением роли пищевых аллергенов.
Как указывалось выше, эозинофильный эзофагит возможен в любой возрастной группе, но его клинические проявления различны. У взрослых наиболее распространенными симптомами являются дисфагия, ощущение комка в горле, боль в торакальной и эпигастральной области, без явления гастроэзофагеального рефлюкса в начальной стадии заболевания. Среди пациентов педиатрического профиля признаки болезни чаще проявляются отказом от пищи и замедлением роста у младенцев; рвотой, тошнотой и болью в животе — у детей старшего возраста.
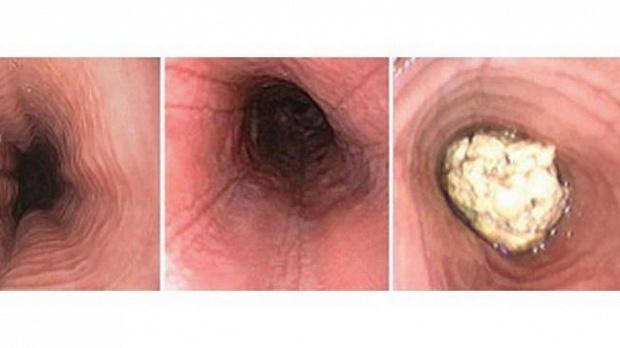
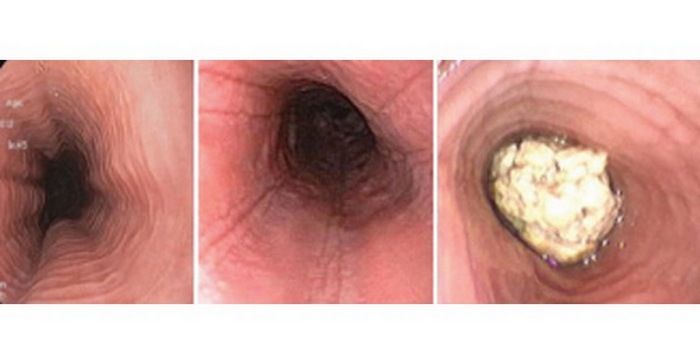
Диагностика этого заболевания преимущественно ориентирована на данные эндоскопии, но подтверждение на 100% обеспечивает только результат гистологического исследования пяти образцов биопсии. Характерная макроскопическая картина при эндоскопии: отек слизистой оболочки, наличие белых экссудатов, продольных борозд или концентрических колец («трахеализация» пищевода) и стеноз (рис. 1). Однако приблизительно в 20% случаев макроскопически состояние слизистой оболочки пищевода может казаться вполне нормальным.
Рис. 1. Макроскопическая картина при эндоскопии пищевода
Пищевод — единственный отдел желудочно-кишечного тракта, который в нормальном состоянии не содержит эозинофилов. Их количество в слизистой оболочке постепенно увеличивается по ходу от желудка до слепой кишки. Но даже если выявление эозинофилов в пищеводе считать патологическим признаком, оно все же не является патогномоничным для эозинофильного эзофагита, а вполне может быть клиническим результатом таких нарушений, как гастроэзофагеальная рефлюксная болезнь, эозинофильный гастроэнтерит, паразитоз, целиакия, болезнь Крона, лекарственная гиперчувствительность, васкулит, идиопатический гиперэозинофильный синдром, реакция «трансплантат против хозяина» и склеродермия.
Результат биопсии, позволяющий сделать выводы в пользу диагноза «эозинофильный эзофагит», должен содержать ≥15 выявленных эозинофилов в поле зрения по меньшей мере в одном образце. Характерными находками при гистологическом исследовании являются микроабсцессы, удлинение сосочков слизистой оболочки, гиперплазия базального слоя, отслоение поверхностных слоев, дегрануляция эозинофилов, увеличение числа тучных клеток и лимфоцитов
Рекомендуемые участки для набора образцов при биопсии — проксимальный, средний и дистальный отделы пищевода, а также желудок и двенадцатиперстная кишка (с целью исключения эозинофильного гастроэнтерита).
Лечение эозинофильного эзофагита включает диетическую, эндоскопическую и фармакологическую терапию, назначаемую в соответствии с симптоматикой по схеме step up или step down. Хронический характер заболевания предусматривает длительное лечение, продолжительность которого зависит от индивидуального ответа организма пациента. Начальный 8-недельный курс применения ингибиторов протонной помпы необходим для исключения гастроэзофагеальной рефлюксной болезни или чувствительного к ингибиторам протонной помпы эозинофильного эзофагита, после чего следует диагностика.
Препаратами первой линии терапии эозинофильного эзофагита являются топические кортикостероиды. В большинстве случаев их применение улучшает клиническое и гистологическое состояние пациентов. Наиболее часто назначаемыми препаратами этой группы являются будесонид и флутиказон. Фармацевтической промышленностью не предусмотрена конкретная форма выпуска для эозинофильного эзофагита, поэтому клиницисты должны обучать пациентов глотать, а не вдыхать кортикостероиды для целенаправленного воздействия на пищевод.
Дозы флутиказона обычно варьируют от 88 и 440 мкг/сут для детей и от 880 и 1760 мкг/сут — для взрослых. Суточная доза будесонида составляет 1 мг для детей и 2 мг — для взрослых. Только 1% принимаемых таким образом кортикостероидов всасывается в кровь, и, следовательно, системные побочные эффекты крайне редки. Самым распространенным осложнением является оральный и пищеводный кандидоз, с целью предотвращения которого необходимо выполнять полоскание рта после терапии.
Иногда определяют несоответствие между гистологическим результатом и клиническим состоянием пациентов. Фактически некоторые симптомы продолжают проявляться даже при отрицательном эндоскопическом тесте, что с большой вероятностью, может быть отнесено к остаточным проявлениям фиброза и гипертрофии мышц пищевода. В педиатрической группе пациентов эффективность лечения топическими кортикостероидами значительно выше, чем у взрослых ввиду меньшей степени морфологических изменений стенки пищевода.
Системные кортикостероиды обычно применяют только для устранения симптомов при таких тяжелых состояниях, как значимая потеря массы тела в результате дисфагии или стеноза пищевода. Рекомендуемая суточная доза составляет 1–2 мг/кг массы тела (максимум — 60 мг/24 ч) в течение 7–15 дней. После отмены системных кортикостероидов часто происходит рецидив эозинофильного эзофагита.
Среди прочих лекарственных средств, применяемых при эозинофильном эзофагите, следует отметить иммуномодуляторы и ингибиторы лейкотриена, моноклональные антитела к интерлейкинам-5, -13 и молекуле CRTH2. Поскольку однозначный позитивный эффект (снижение внутриэпителиальной оэзинофилии и продукции эотаксина-3) с устойчивым клиническим улучшением показали только моноклональные антитела к интерлейкинам-5 и -13 (препарат QAX576), решение о применении остальных перечисленных средств выносится с большой осторожностью.
Диетическая терапия при эозинофильном эзофагите обычно начинается одновременно с фармакологическим лечением, хотя иногда рекомендуется после прекращения приема препаратов. В течение последних десятилетий разработаны три различных принципа:
1) элементарная диета, подразумевающая питание в рамках элементарной аминокислотной формулы;
2) IgE-ориентированная диета, исключающая продукты, к которым есть сенсибилизация;
3) SFED (Six Food Elimination Diet) — диета, исключающая шесть наиболее вероятных пищевых аллергенов: молоко и молокопродукты, яйца, соя, орехи/арахис, морская пища (рыба/моллюски).
Первый тип диеты наиболее эффективен и способствует клинической/гистологической ремиссии при условии соблюдения в течение не менее 6 нед. Недавний метаанализ подтвердил эффективность элементарной диеты при достижения гистологической ремиссии у детей и взрослых в примерно 90% случаев. Важнейшим ограничением этой диеты является ее сильное влияние на качество жизни. Фактически пациенты должны принимать большое количество жидких, не всегда приятных на вкус и очень дорогих смесей.
Значительная вариабельность показателей ремиссии, полученных в итоге применения второго типа диеты у пациентов с эозинофильным эзофагитом, может быть связана с механизмом реакции замедленной гиперчувствительности, вместо предполагаемого ранее IgE-опосредованного эффекта. Наиболее частой причиной пищевой сенсибилизации признаны молоко, яйца, арахис, морепродукты, горох, рожь, томаты и пшеница. Для взрослых эффективность этого типа рациона еще не обоснована. Эмпирическая диета SFED, предложенная в 2006 г. по результатам метаанализов, показала эффективность у 70% пациентов.
Эндоскопическая дилатация показана при наличии тяжелого стеноза (диаметр пищеводного канала <10 мм) у пациентов, не реагирующих на фармакологическую и/или диетическую терапию. В некоторых случаях ремиссия в результате однократного эндоскопического лечения может сохраняться несколько месяцев, но для достижения стойкой дилатации (диаметр пищеводного канала не уже 15–18 мм) необходимо проведение нескольких сеансов. Риск перфорации в результате дилатации составляет около 0,1%.
Долгосрочный прогноз эозинофильного эзофагита ограничен. Имеющиеся данные свидетельствуют о прогрессирующей тенденции фиброза/стеноза пищевода. В течение каждых последующих 10 лет при отсутствии лечения риск развития фибростеноза удваивается.
Эозинофильный гастроэнтерит
Эозинофильный гастроэнтерит относится к идиопатической группе заболеваний, характеризующихся эозинофилией в одном или нескольких участках желудочно-кишечного тракта. При эозинофильном гастрите эозинофилия ограничена желудком, при эозинофильном колите — толстой кишкой. Клинические проявления различны и не специфичны для этого спектра заболеваний.
Повышение частоты заболеваемости эозинофильным гастроэнтеритом в последние годы, вероятно, связано с улучшением распознаваемости этой патологии и растущего интереса среди клиницистов. По неполным оценкам, он составляет 1–30 на 100 тыс. населения. Наиболее подвержены заболеванию мужчины (3:2 по сравнению с женщинами, за исключением серозного подтипа) среднего и пожилого возраста. Также, как и в ситуации с эозинофильным эзофагитом, эозинофильный гастроэнтерит чаще отмечают у представителей кавказских народов. Около 70% пациентов с эозинофильным эзофагитом сенсибилизированы к распространенным аллергенам.
Этиология и патогенез эозинофильного гастроэнтерита, в соответствии с текущими данными, базируются на механизме гиперчувствительности замедленного типа. Обычно у пациентов с эозинофильным гастроэнтеритом определяют гиперэозинофилию в периферической крови и тканях желудочно-кишечного тракта, повышенный уровень IgE в сыворотке крови, повышенный уровень медиаторов воспаления в биопсийных образцах кишечника и положительный ответ на терапию кортикостероидами.
Классификация и клинические проявления эозинофильного гастроэнтерита зависят от анатомической локализации. Наиболее распространенным подтипом является слизистый, который проявляется неспецифическими симптомами (тошнота, рвота, диарея, анемия из-за хронического воспаления или дефицита железа, признаки наличия мальабсорбции). Для детей с этим подтипом эозинофильного гастроэнтерита наиболее характерны уменьшение массы тела и энтеропатическая потеря белка.
Вторая по выявляемости — мышечная форма эозинофильного гастроэнтерита. Довольно часто она приводит к непроходимости кишечника и утолщению его стенок (обструкция тощей кишки как наиболее частый вариант).
Серозный подтип эозинофильного гастроэнтерита наиболее часто отмечают у женщин. Клинические проявления обычно начинаются с асцита, иногда сопровождаемого симптомами кишечной непроходимости. Асцитический выпот содержит большое количество эозинофилов. Серозный подтип в своей реакции на кортикостероидную терапию отличается от двух других типов эозинофильного гастроэнтерита. В отличие от слизистого подтипа, клиническое течение серозного подтипа эозинофильного гастроэнтерита не имеет хронического характера и большую часть времени находится в стадии ремиссии.
Эндоскопическая и гистологическая картина довольно часто (как в желудке, так и в толстой кишке) может быть нормальной или иметь неспецифические признаки хронического воспаления. Могут быть выявлены эритема слизистой оболочки, ее ранимость, эрозии или изъязвления, слизистые конкреции или беловатые пятна
Диагноз должен основываться на выявлении эозинофильной инфильтрации слизистой оболочки. В ситуации с эозинофильным гастроэнтеритом не существует общепринятого порога определения эозинофилов в поле зрения, поскольку их наличие в этих отделах желудочно-кишечного канала является нормой. Наиболее приемлемым является значение, превышающее 20 в поле зрения по меньшей мере в одном из образцов биопсии. Помимо самих эозинофилов, может быть выявлена повышенная концентрация их медиаторов, в частности металлопротеиназ, эозинофильной катионной протеазы, интерлейкинов-3, -5 и гранулоцитарномакрофагального колониестимулирующего фактора.В данное время единичные лабораторные тесты или процедуры, позволяющие идентифицировать эозинофильный гастроэнтерит отсутствуют. С учетом вышеперечисленных признаков следует исключить другие возможные причины желудочно-кишечной эозинофилии и эозинофильной инфильтрации в других органах (гиперэозинофильный синдром, эозинофильный гранулематоз с полиангиитом, целиакия, воспалительные заболевания кишечника, узелковый периартериит и другие системные коллагенозы, инфекции и лекарственные аллергии. У 80% пациентов с эозинофильным гастроэнтеритом определяют эозинофилию в периферической крови, особенно при серозном подтипе.
После определения диагноза эозинофильного гастроэнтерита необходимо провести оценку аллергии. Пищевая сенсибилизация может быть триггером клинических проявлений и/или патогенеза эозинофильного гастроэнтерита.
Лечение пациента с эозинофильным гастроэнтеритом предполагает диетический и фармакологический подход. Хирургические вмешательства, такие как лапароцентез, могут потребоваться в случае осложнений.
Учитывая преимущества диеты, полученные у пациентов с эозинофильным эзофагитом, подобный подход был разработан для пациентов с эозинофильным гастроэнтеритом. В настоящее время эффективность таких диет основана на клинических отчетах и серии небольших исследований.
Фармакотерапия при эозинофильном гастроэнтерите основана на системных курсах применения преднизолона (эффективен у примерно 80% пациентов) в объеме 20–40 мг/сут в течение 2–6 нед. В отдельных случаях лечение может быть продлено с применением будесонида.
Эффективность применения других препаратов (стабилизаторы тучных клеток, омализумаб, меполизумаб, реслизумаб, инфликсимаб, ингибиторы лейкотриена, антигистаминные средства, ингибиторы Th-2, такие как суплатаст и CRTH2) из-за ограниченности имеющихся исследований еще не определена.
- Ridolo E., Melli V., Angelis G., Martignago I. (2016) Eosinophilic disorders of the gastro-intestinal tract: an update. Clin. Mol. Allergy, 14:17.
Александр Гузий
Источник:
Статьи по теме
Рекомендуемые статьи
Синдром Аддисона - Бирмера
(злокачественное малокровие, пернициозная анемия, в12-дефицитная анемия) B12 анемия, обусловленная аутоимунными механизмами, сопровождается ахилией, отсутствие пепсина и продукцией антител к париетальным клеткам.Гастроскопия выявляет гнездную, реже тотальную атрофию слизистой желудкаХарактерным симптомом является наличие так называемых перламутровых бляшек — блестящих зеркальных участков атрофии слизистой, локализующихся главным образом на складках слизистой желудка.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.












.jpg)





.png)




















Комментарии