- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению ахалазии кардии и кардиоспазма
| Авторы: | В. Т. Ивашкин, А. С. Трухманов, Э. А. Годжелло, И. В. Маев, Ю. В. Евсютина, Т. Л. Лапина, О. А. Сторонова 2016г. |
Аннотация:
Цель обзора. Познакомить практических врачей с клиническими рекомендациями Российской гастроэнтерологической ассоциации по ведению больных с ахалазией кардии и кардиоспазмом. Основные положения.
Полный текст статьи:
Рекомендации Российской гастроэнтерологической ассоциации
по диагностике и лечению ахалазии кардии и кардиоспазма
В.Т. Ивашкин1, А.С. Трухманов1, Э.А. Годжелло2, И.В. Маев3, Ю.В. Евсютина1, Т.Л. Лапина1, О.А. Сторонова1
1 ФГБОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Российская Федерация
2 ФГБНУ «Российский научный центр хирургии имени академика Б.В. Петровского», Москва, Российская Федерация
3 ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А. И. Евдокимова» Минздрава России, Москва, Российская Федерация
Diagnostics and treatment of cardiac achalasia and cardiospasm: guidelines of the Russian gastroenterological association
V.T. Ivashkin1, A.S. Trukhmanov1, E.A. Godzhello2, I.V. Mayev3, Yu.V. Evsyutina1,
T.L. Lapina1, O.A. Storonova1
1 State educational government-financed institution of higher professional education
«Sechenov First Moscow state medical university», Ministry of Healthcare of the Russian Federation, Moscow, the Russian Federation
2 Petrovsky National Research Center of Surgery of Russian Academy of Medical Science, Moscow, the Russian Federation
3 State educational government-financed institution of higher professional education «Yevdokimov Moscow State University of Medicine and Dentistry», Ministry of Healthcare of the Russian Federation,
Moscow, Russian Federation
Годжелло Элина Алексеевна – доктор медицинских наук, главный научный сотрудник, ФГБНУ «Российский науч- ный центр хирургии им. академика Б.В. Петровского». Контактная информация: godjello@inbox.ru; 119991, Москва, Абрикосовский пер., д. 2
Godzhello Elina A. — MD, PhD, chief research associate, Petrovsky National Research Center of Sur-gery of Russian Academy of Medical Science. Contact information: godjello@inbox.ru; 119991, Moscow, Abrikosovsky per., 2 Трухманов Александр Сергеевич – доктор медицинских наук, профессор кафедры пропедевтики внутренних болез- ней ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова», Контактная информация: troukh@mail.ru ; 119991, Москва, ул. Погодинская, д. 1, стр. 1.
Trukhmanov Aleksander S. — MD, PhD, professor, Chair of internal diseases propedeutics, medical faculty, Sechenov First Moscow state medical university. Contact information: troukh@mail.ru; 119991, Moscow, Pogodinskaya street, 1, bld 1.
Получено 15.10.15
Received 15.10.15
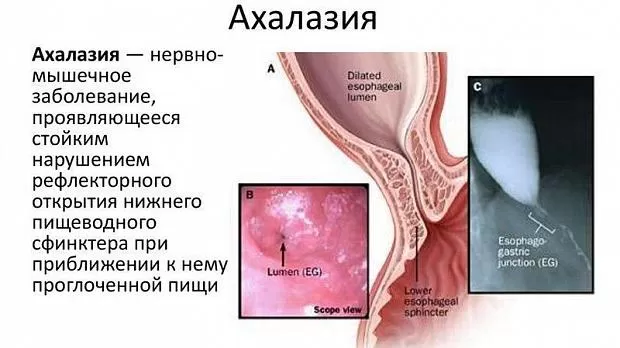
Рассматриватся три основные гипотезы развития болезни: генетическая, инфекционная и аутоиммунная.
Клинические проявления болезни — затруднение прохождения твёрдой и жидкой пищи по пищеводу, срыгивание, в некоторых случаях боль в грудной клетке, при тяжёлом течении — кашель и уменьше- ние массы тела. Дифференциальный диагноз про- водят с: кардиоэзофагеальным раком, пептической стриктурой, мембранами и кольцами пищевода, неврогенной анорексией и ишемической болезнью сердца при наличии боли в грудной клетке.
При рентгеноконтрастном исследовании обнаружи- вают расширение и деформацию пищевода, кону- совидное сужение в области нижнего пищеводного сфинктера, задержку контрастной массы в пищево- де, отсутствие газового пузыря желудка.
При эндоскопии выявляют дилатацию и девиацию просвета пищевода, наличие в нем остатков пищи, жидкости и слизи, равномерность раскрытия кардии при инсуффляции воздуха и возможность проведе- ния эндоскопа в желудок. «Золотым стандартом» обследования пациентов с подозрением на ахала- зию является манометрия.
В клинических рекомендациях впервые в отече- ственной литературе представлены новейшие под- ходы к диагностике ахалазии кардии с помощью метода манометрии пищевода высокого разре- шения с использованием современной Чикагской классификации. Эта классификация выделяет три типа ахалазии кардии, и её использование позволя- ет существенно повысить точность прогноза резуль- татов лечения.
Клинические рекомендации содержат детальное описание всех существующих на сего-дняшний день методов лечения ахалазии кардии и кардиоспазма (консервативные, эндоскопические, оперативные), которые направлены на расширение кардии и сни- жение ее тонуса для улучшения прохождения пищи через область пищеводно-желудочного перехода. Прогноз заболевания благоприятный при своевре- менной диагностике и лечении; уровень ремиссии в течении 10 лет после проведённой пневмокарди- одилатации составляет 75–90%. Однако больные требуют постоянного амбулаторного наблюдения в связи с риском развития рака пищевода (3–8% наблюдений).
Заключение. Клинические рекомендации содержат полную современную необходимую для практиче- ского врача информацию по диагностике и лечению больных с ахалазией кардии и кардиоспазмом.
Ключевые слова: ахалазия кардии, кардиоспазм, нижний пищеводный сфинктер, мано-метрия высо- кого разрешения, мегаэзофагус, дискинезия груд- ного отдела пищевода, боль в грудной клетке, эзо- фагит, рак пищевода, кардиодилатация, кардиоми- отомия, диагностика, лечение.
Для цитирования: Ивашкин В.Т., Трухманов А.С., Год- желло Э.А., Маев И.В., Евсютина Ю.В., Лапина Т.Л., Сторонова О.А. Рекомендации Российской гастроэнтеро- логической ассоциации по диагностике и лечению ахалазии кардии и кардиоспазма. Рос журн гастроэнтерол гепатол колопроктол 2016;26(4):36-54
Clinical symptoms of disease: difficulty of passage of solid and liquid food through the esophagus, vomit- ing, in certain cases — chest pain; severe disease is accompanied by cough and weight loss. Differential diagnosis is carried out with cardioesophageal cancer, peptic stricture, esophageal webs and rings, neuro- genic anorexia and coronary heart disease in the cases with chest pain.Bariu meal study reveals dilation and deformity of the esophagus, coneshaped narrowing in the lower esopha- geal sphincter area, retention of barium contrast in the esophagus, absence of stomach gas bubble.
Endoscopy discloses dilation and deviation of esopha- geal lumen, presence of food remnants, liquids and mucus, uniform opening of cardia at air insufflation and capability of passage of endoscope into the stomach.
«The gold standard» of investigation of patients with suspected achalasia is manometry.
Clinical guidelines for the first time in Russian literature presents the latest approaches to cardiac achalasia diagnosis by high resolution esophageal manometry with application of modern Chicago classification. This classification defines three types of cardiac achalasia, and its usage provides significant increase of treatment prognosis accuracy.
Clinical guidelines contain the detailed description of all up-to-date treatment methods for cardiac achalasia and cardiospasm (conservative, endoscopic, surgical) aimed to dilation of cardia and decrease of its pressure to improve of passage of food through area of gastro- esophageal junction. Disease prognosis at timely diag- nosis and treatment is favorable; remission rate for 10 years post-pneumocardiodilation ranges 75 to 90%. However patients require constant outpatient monitor- ing due to esophageal cancer risk (3 to 8% of cases). Conclusion. Clinical guidelines contain complete mod- ern information, essential for the practical doctor on diagnosis and treatment of cardiac achalasia and car- diospasm.
Key words: cardiac achalasia, cardiospasm, lower esophageal sphincter, high resolution manometry, megaesophagus, thoracic esophagus dyskinesia, chest pain, esophagitis, esophageal cancer, cardiodilation, cardiomyotomy, diagnosis, treatment.
For citation: Ivashkin V.T., Trukhmanov A.S., Godzhello E.A., Mayev I.V., Evsyutina Yu.V., Lapina T.L., Storonova O.A. Diagnostics and treatment of cardiac achalasia and cardio- spasm: guidelines of the Russian gastroenterological associa- tion. Ross z gastroenterol gepatol koloproktol 2016;26(4):36-54
Методология
Методы, использованные для сбора/селек- ции доказательств:
– поиск в электронных базах данных.
Описание методов, использованных для сбора/селекции доказательств:
– доказательной базой для рекомен- даций являются публикации, вошедшие в Кохрановскую библиотеку, базы данных EMBASE и MEDLINE. Глубина поиска составляла 15 лет.
Методы, использованные для оценки качества и силы доказательств:
– консенсус экспертов;
– оценка значимости в соответствии с рейтин- говой схемой (схема прилагается).
Методы, использованные для анализа доказательств:
– обзоры опубликованных мета-анализов;
– систематические обзоры с таблицами дока- зательств.
Методы, использованные для формулиро- вания рекомендаций:
– консенсус экспертов.
Экономический анализ:
– анализ стоимости не проводили и публи- кации по фармакоэкономике не анализировали.
Метод валидизации рекомендаций:
– внешняя экспертная оценка;
– внутренняя экспертная оценка.
Описание метода валидизации рекомендаций
Настоящие рекомендации в предваритель- ной версии были рецензированы независимыми экспертами, которых попросили прокомменти- ровать прежде всего то, насколько интерпрета- ция доказательств, лежащих в основе рекомен- даций, доступна для понимания.
Уровни доказательности
(классификация Оксфордского центра доказательной медицины)
|
Уровень |
Тип данных |
|
1a |
Доказательства, полученные в мета-анализах рандомизированных исследований |
|
1b |
Доказательства, полученные как минимум в одном рандомизированном исследовании |
|
2a |
Доказательства, полученные как минимум в одном хорошо спланированном контролируемом исследовании без рандомизации |
|
2b |
Доказательства, полученные как минимум в одном хорошо спланированном полуэксперимен- тальном исследовании другого типа |
|
3 |
Доказательства, полученные в хорошо спланированных неэкспериментальных исследованиях, таких как сравнительные, корреляционные исследования и описания клинических случаев (случай–контроль) |
|
4 |
Доказательства, полученные из отчетов экспертных комиссий, на основе мнений или клиниче- ского опыта авторитетных специалистов |
Рейтинговая схема для оценки силы рекомендаций
|
Сила |
Описание |
|
A |
По меньшей мере один мета-анализ, систематический обзор или РКИ, оценённые как 1++, напрямую применимые к целевой популяции и демонстрирующие устойчивость результатов, или группа доказательств, включающая результаты исследований, оценённые как 1+, напрямую применимые к целевой популяции и демонстрирующие общую устойчивость результатов |
|
B |
Группа доказательств, включающая результаты исследований, оценённые как 2++, напрямую применимые к целевой популяции и демонстрирующие общую устойчивость результатов, или экстраполированные доказательства из исследований, оценённых как 1++ или 1+ |
|
C |
Группа доказательств, включающая результаты исследований, оценённые как 2+, напрямую применимые к целевой популяции и демонстрирующие общую устойчивость результатов, или экстраполированные доказательства из исследований, оценённых как 2++ |
|
D |
Доказательства уровня 3 или 4 или экстраполированные доказательства из исследований, оцененных как 2+ |
Получены комментарии врачей первичного звена и участковых терапевтов в отношении доходчивости изложения рекомендаций и оцен- ки их важности как рабочего инструмента в повседневной практике.
Комментарии, полученные от экспертов, тщательно систематизированы и обсужде- ны председателем и членами рабочей груп- пы. Каждый пункт обсужден, и внесенные в результате этого изменения в рекомендации зарегистрированы. Если же изменения не вно- сили, то регистрировали причины отказа от внесения изменений.
Консультация и экспертная оценка
Последние изменения в настоящих реко- мендациях были представлены для дискус- сии в предварительной версии на Российской гастроэнтерологической неделе в 2015 г.
Определение
Ахалазия кардии (синонимы: мегаэзофагус или долихоэзофагус, идиопатическое расширение пищевода, кардиоспазм и др.) — идиопатическое нервно-мышечное заболевание, проявляющееся функциональным нарушением проходимости кар- дии вследствие дискоординации между глотком, рефлекторным раскрытием нижнего пищеводного сфинктера (НПС) и двигательной и тонической активностью гладкой мускулатуры пищевода.
Код по МКБ-10
К.22.0. Ахалазия кардиальной части.
Эпидемиология
Ахалазию кардии считают редким заболева- нием: ее распространенность составляет 10 слу- чаев на 100 000 населения, а заболеваемость —
1 на 100 000 населения. По сводным данным Б.В. Петровского (1962) и В.В. Уткина (1966), в качестве причины дисфагии она занимает третье место после рака и ожоговых стриктур пищевода, частота заболевания варьирует от 5 до 8%. По дан- ным Т.А. Суворовой (1966) и А.З. Моргенштерна (1968), ахалазия кардии составляет 3,1–20% всех заболеваний пищевода. Идиопатическая ахалазия встречается на всех континентах, причем с оди- наковой частотой у мужчин и женщин. У взрос- лых ахалазию кардии чаще всего диагностируют в возрастной группе от 25 до 60 лет [7, 30, 39].
История заболевания
Впервые ахалазия кардии описана в 1674 г. английским врачом Thomas Williams, который вылечил пациента с постоянной прогрессировав- шей рвотой, расширив пищевод с помощью губки,
насаженной на китовый ус. В 1882 г. J. Mikulich ввел в медицинскую литературу термин «кар- диоспазм», объясняя сущность патологического процесса в кардии с помощью теории нарушения нервно-мышечной передачи вследствие выпаде- ния функции блуждающих нервов, в результате чего возникает длительное сокращение гладко- мышечных волокон в области НПС. В 1914 г. в литературе появился термин «ахалазия кар- дии», который был предложен вначале C. Perry, а затем A. Hurst (1927), определившими ее как отсутствие релаксации (от греч. a — отсутствие, chalasis — расслабление). A. Hurst, наблюдав- ший около 20 пациентов с дисфагией и рвотой, предположил, что их причиной может быть отсут- ствие нормального рефлекторного расслабления НПС в ответ на глоток вследствие органического поражения ауэрбаховского сплетения. В последу- ющие годы было установлено, что в патогенезе заболевания важную роль играет также наруше- ние тонуса и перистальтики пищевода.
В настоящее время в англоязычной литературе чаще всего используют именно термин «ахалазия кардии», тогда как в отечественных источниках встречаются оба названия заболевания — «аха- лазия кардии» и «кардиоспазм». Это объясняется тем, что существуют две патогенетически разные формы функциональной непроходимости кардии, выделенные Plammer и Vinson еще в 1921 г., которые существенно различаются по клиниче- ской симптоматике, рентгенологической карти- не и результатам эзофагоманометрии, особенно в начальных стадиях [3, 38]. Эти различия обу- словлены разными уровнями поражения парасим- патической нервной системы. Так, при морфоло- гических исследованиях у больных с кардиоспаз- мом были выявлены значительные дегенеративно- дистрофические изменения в преганглионарных нейронах дорсальных ядер блуждающих нервов в стволе головного мозга, которые обусловлива- ют нарушения центральной иннервации НПС, и менее выраженные — в постганглионарных нейронах ауэрбаховского сплетения. Считается, что в связи с нарушением центральной иннерва- ции гладкая мускулатура НПС становится более чувствительной к ее физиологическому регулято- ру — эндогенному гастрину. Таким образом, при данном варианте течения заболевания наблюда- ется истинный спазм кардии [25]. При ахалазии кардии поражается преимущественно перифериче- ское звено — постганглионарные нейроны интра- мурального ауэрбаховского сплетения [16, 41], блуждающие нервы [14], симаптические нервные стволы и ганглии [6], в результате чего выпада- ет рефлекс открытия кардии в ответ на глоток. Поскольку центральная иннервация сохраняется, отсутствуют условия для возникновения повы- шенной чувствительности гладкой мускулатуры НПС к гастрину.
Следует отметить, что «ахалазическая» теория патогенеза этого заболевания получила распро- странение лишь в 50–60-х годах XX в., когда нача- ли применять эзофаготонокимографию. В нашей стране эту методику разработал и внедрил в кли- ническую практику Андрей Леонидович Гребенев. Именно под его руководством были досконально изучены тонус и перистальтика пищевода у паци- ентов с ахалазией кардии.
Самым эффективным методом консервативно- го лечения ахалазии кардии всегда считали кар- диодилатацию под рентгенологическим контро- лем, а хирургического — эзофагокардиомиото- мию по Геллеру, которую необходимо дополнить неполной фундопликацией для предупреждения рефлюкса. В запущенных стадиях болезни выпол- няют экстирпацию пищевода с одномоментной пластикой желудочной трубкой [3, 7, 40]. Для расширения кардии вначале применяли метал- лический кардиодилататор, изобретенный Starck в 1924 г. (отечественную модификацию предло- жила Т.А. Тимофеева в 1968 г.), а в 50-х годах XX в. был создан пневматический кардиодила- татор, который в нашей стране широко исполь- зовали в модификации, разработанной в 1964 г. О.Д. Федоровой и Г.М. Мельник.
А.Л. Гребенев и его ученики, имея большой опыт лечения таких пациентов, разработали пока- зания и противопоказания к пневмокардиодила- тации и тактику ведения больных после ее про- ведения. Однако у части больных, особенно при выраженном расширении пищевода (S-образный пищевод), проведение пневмодилататора под рентгенологическим контролем невозможно. При использовании рентгенологической методи- ки, кроме того, отсутствует возможность оценки состояния слизистой оболочки в зоне пищевод- но-желудочного перехода непосредственно после окончания вмешательства. Использование эндо- скопической техники позволяет выполнить вме- шательство под контролем зрения практически при любой степени ахалазии кардии и немедлен- но диагностировать возникшие осложнения [10, 19, 23, 26, 27, 37, 46 и др.].
Еще один способ эндоскопического лечения — интрамуральное введение ботулинового токси- на. Этот метод применяют в основном за рубежом [42, 43, 55, 79 и др.], хотя и в России накоплен
определенный опыт [19, 24].
В 2008 г. H. Inoue (Япония) впервые вместо кардиодилатации и хирургической эзофагокар- диомиотомии выполнил у человека пероральную эндоскопическую миотомию (POEM) и в 2010 г. опубликовал результаты лечения первых 17 паци- ентов [62]. Эта операция, получившая к настоя- щему времени достаточно широкое распростра- нение за рубежом, которую начали применять и в России, претендует на право стать «золотым стандартом» в лечении ахалазии кардии.
В настоящее время продолжается актив- ное изучение идиопатической ахалазии кардии, и в первую очередь исследования ученых направ- лены на установление этиологии заболевания.
Этиология и патогенез
Перистальтика пищевода и расслабление НПС контролирует энтеральная нервная система (ЭНС), представляющая собой сложную сеть нервов и сплетений, работу которых координиру- ют центральная нервная система и ядра блуждаю- щего нерва, расположенные в дне IV желудочка. Нейроны, входящие в состав ЭНС, располагаются в ауэрбаховском межмышечном сплетении и кон- тролируют двигательную активность желудочно- кишечного тракта. Существует два основных типа нейронов: тормозящие, нейротрансмиттерами которых являются оксид азота (NO) и вазоак- тивный интестинальный пептид (ВИП), и воз- буждающие, медиатором которых служит ацетил- холин.
Результаты гистологического исследования материала, полученного во время вскрытия и мио- томии, свидетельствуют, что в межмышечных сплетениях развивается воспаление, в котором принимают участие CD3/CD8 — позитивные цито- токсические Т-лимфоциты, эозинофилы, тучные клетки, происходит потеря ганглионарных кле- ток и развивается фиброз. В начальных стадиях заболевания преобладает воспалительный компо- нент с поражением главным образом тормозящих нейронов, в которых осуществляется синтез NO и ВИП. При прогрессировании заболевания про- исходят полная потеря этих клеток и замещение их соединительной тканью. Потеря тормозящих NO-ергических нейронов приводит к неполному расслаблению НПС и характерному для ахалазии отсутствию перистальтики грудного отдела пище- вода.
Несмотря на многовековую историю изучения ахалазии кардии, ее этиология до сих пор неиз- вестна. В настоящее время рассматриваются три основные гипотезы: генетическая, аутоиммунная и инфекционная.
Генетическая гипотеза. Наибольшее под- тверждение эта гипотеза находит в педиатриче- ской практике. Так, у детей самой частой причи- ной развития ахалазии кардии является мутация гена AAAS12q13, которая приводит к развитию аутосомно-рецессивного заболевания — так назы- ваемого синдрома Allgrove, или синдрома ААА, характеризующегося развитием ахалазии, алакри- мии и болезни Аддисона. Идиопатическая ахала- зия кардии встречается также у детей с синдро- мами Дауна (примерно у 2%), Розицки и Робена.
У взрослых определенную роль в развитии заболевания играет полиморфизм некоторых генов. Так, в испанской популяции у мужчин
моложе 40 лет с ахалазией кардии достоверно чаще выявляют полиморфизм гена IL23R Arg381 Gln. В той же испанской популяции гаплотип GCC промотора IL10 ассоциирован с развитием идиопатической ахалазии кардии.
Установлена также ассоциация данного забо- левания со специфическим HLA-генотипом, кото- рая выражается в том, что у пациентов с идио- патической ахалазией кардии с аллелями HLA DQA1 и DQB1 достоверно чаще выявляют ауто- антитела к межмышечным сплетениям.
Заслуживает внимания и теория о полимор- физме NO-синтазы (NOS), которая представляет собой фермент, катализирующий образование NO из аргинина, кислорода и NADPH. Существует три типа NOS: нейрональная (nNOS), инду- цибельная (iNOS) и эндотелиальная (eNOS). Ответственные за них гены локализуются в хро- мосомах 12q24.2, 17q11.2-q12 и 7q36. В ряде работ показан полиморфизм всех трех генов у пациентов с ахалазией кардии, при этом чаще всего выявля- ли полиморфизм iNOS22*A/Ab и eNOS*4a4a.
Кроме NO, нейротрансмиттером тормозящих нейронов является ВИП. Один из его рецепто- ров — рецептор 1, который принадлежит к семей- ству секретиновых и экспрессируется различными иммунными клетками, такими как Т-лимфоциты, макрофаги и дендритные клетки. Полиморфизм этого гена (VIPR1) также может играть роль
в развитии идиопатической ахалазии. VIPR1 локализуется в хромосоме 3p22. В некоторых исследованиях были установлены пять его про- стых нуклеотидных полиморфизмов: (rs421558)
Intron-1, (rs437876) Intron-4, (rs417387) Intron-6, rs896 и rs9677 (3’UTR).
Аутоиммунная гипотеза. Подтверждением этой гипотезы служит тот факт, что у пациен- тов с ахалазией кардии риск развития аутоим- мунных заболеваний примерно в 3,6 раза выше, чем в общей популяции. По данным исследова- ний, проведенных в Канаде, в которых приняли участие больные с ахалазией кардии, риск раз- вития сахарного диабета 1-го типа у них выше в 5,4 раза, гипотиреоза — в 8,5 раза, синдрома Шегрена — в 37 раз, системной красной волчан- ки — в 43 раза, увеита — в 259 раз.
Результаты исследований в этой области сви- детельствуют о наиболее частом сочетании аха- лазии кардии и патологии щитовидной железы, которая в 20–25% случаев представлена гипоти- реозом.
Рассматривая аутоиммунную природу заболе- вания, необходимо напомнить о циркулирующих аутоантителах. У пациентов с ахалазией кардии чаще всего обнаруживают следующие нейро- нальные аутоантитела: антитела к никотиновым рецепторам ацетилхолина — ганглионарного и мышечного типа, к кальциевым каналам — P/Q- и N-типа, к декарбоксилазе глутаминовой кислоты, к скелетным мышцам и антинейрональ- ные нуклеарные антитела, известные также под названием anti-Hu. Так, в одном из последних крупных исследований, проведенном в клинике Mayo, установлено, что у 26% больных с идио- патической ахалазией кардии выявляют антитела к скелетным мышцам, а у 21% — к декарбокси- лазе глутаминовой кислоты.
Инфекционная гипотеза. В течение многих лет болезнь Чагаса рассматривают как один из этио- логических факторов в развитии ахалазии кардии. Это заболевание, называемое также «американ- ский трипаносомоз», вызывается микроорганиз- мом Trypanosoma cruzi и встречается в странах Латинской Америки. Заболевание протекает в две фазы, первая из которых — острая и связана с циркуляцией паразитов в крови, а вторая про- является в проникновении трипаносом в сердце и мышечный слой пищевода, где и происходит их кумуляция. Как следствие поражаются главным образом межмышечные сплетения пищевода, что в последующем приводит к дегенеративным изме- нениям в них и нарушению двигательной функции пищевода. Именно в эту фазу заболевания про- исходит нарушение функции расслабления НПС и развивается атония пищевода, которые проявля- ются дисфагией, пищеводной рвотой и болями по ходу пищевода при проглатывании пищи.
Высказано также предположение о вирусной природе идиопатической ахалазии кардии. Так, существует некая корреляция между ахалази- ей кардии и предшествующими инфекционными заболеваниями, в частности корью и опоясываю- щим герпесом (herpes zoster).
Клиническая картина
Основные симптомы заболевания — прогрес- сирующая дисфагия, регургитация и загрудин- ные боли, связанные с неполным опорожнением пищевода и хроническим эзофагитом [21, 22, 30,
34, 35, 45, 71 и др.].
Дисфагия возникает у 99% пациентов при упо- треблении твердой пищи и у 90–95% — жидкой. Характер возникновения дисфагии различен для двух форм заболевания. Так, при одной из них дисфагия развивается остро, обычно среди полно- го здоровья, после психотравмирующей ситуации. Чаще болеют молодые люди. Пациенты могут точно указать, когда они отметили появление симптомов и с чем это было связано. Часто дис- фагия имеет парадоксальный характер: хорошо проходит твердая пища, а жидкость задержива- ется. Необходимо отметить, что нервное перевоз- буждение, непривычная обстановка, разговоры во время еды и быстрый прием пищи, особенно плохо пережеванной и холодной, способствуют увеличению выраженности дисфагии. Дисфагия может сопровождаться чувством задержки пищи в пищеводе на какое-то время с последующим «провалом» ее в желудок.
Другая форма характеризуется постепенным развитием заболевания, часто в течение многих лет, без парадоксальной дисфагии. Чаще боле- ют лица среднего и пожилого возраста, которые не могут вспомнить, когда именно они заболели и что послужило причиной возникновения болез- ни: им кажется, что они болеют всю жизнь.
Пациент может самостоятельно уменьшить выраженность дисфагии, используя различные приемы: запивание пищи большим количеством жидкости, заглатывание воздуха, повторные гло- тательные движения, ходьба. Немаловажное зна- чение имеет и температура принимаемой пищи: большинство больных отмечают, что лучше про- ходит теплая и горячая пища.
Ярким симптомом заболевания является актив- ная и пассивная регургитация, которая отмечает- ся у 84 и 68% больных соответственно. Активная регургитация представляет собой срыгивание только что съеденной пищи или слизи и более характерна для начальных стадий болезни. Она возникает при незначительной дилатации пищево- да, тогда как значительное расширение пищево- да может привести к отсроченной регургитации, объем которой значительно больше. Пассивная регургитация возникает вне приема пищи, обычно в горизонтальном положении пациента или при наклоне туловища вперед, чаще наблюдается при ахалазии кардии. Регургитация, особенно пас- сивная, может сопровождаться аспирацией пищи в дыхательные пути, которая может привести к нарушению функции органов дыхания, сопро- вождающемуся одышкой и кашлем, и маскиро- вать основное заболевание. Необходимо отметить, что ночной кашель наряду с симптомом «мокрой подушки» свидетельствуют о декомпенсации забо- левания и служат абсолютным показанием к про- ведению пневмокардиодилатации.
Еще одна характерная жалоба больных — боли в груди, которые наблюдаются примерно у 59% из них, чаще в молодом возрасте. При повышении давления в НПС и грудном отделе пищевода возникает интенсивная спастическая загрудин- ная боль, тогда как при атонии грудного отдела пищевода отмечаются умеренно выраженные боли за грудиной распирающего характера. Боли могут возникать во время приема пищи вследствие пере- растяжения стенок пищевода и проходить после срыгивания или «проваливания» пищи в желу- док. Они также могут быть вызваны спазмом гладкой мускулатуры пищевода и возникать как во время приема пищи, так и без четкой связи с ним. Для 1/3 больных с ахалазией кардии харак- терна жгучая боль по ходу пищевода, возникаю- щая вследствие прямого раздражающего действия на пищевод остатков задержавшихся в нем пищи и лактата, продукция которого повышена при
избыточной бактериальной ферментации сохраня- ющихся в пищеводе углеводов.
Один из симптомов ахалазии — уменьшение массы тела, которое наблюдается у 61% больных и коррелирует с тяжестью течения заболевания. Средняя потеря массы тела составляет 5–10 кг.
Примерно у 8% пациентов возникает икота, основной причиной которой является длительная обструкция дистального отдела пищевода, приво- дящая к раздражению диафрагмального нерва.
Дифференциальный диагноз
Дифференциальный диагноз ахалазии кардии проводят со следующими заболеваниями:
– кардиоэзофагеальным раком, для кото- рого характерна прогрессирующая дисфагия, как и для истинной ахалазии. Однако быстрое уменьшение массы тела, короткий анамнез, часто пожилой возраст пациентов к моменту появле- ния дисфагии свидетельствуют о злокачественном поражении. При физикальном осмотре можно выявить пальпируемое образование в брюшной полости и лимфаденопатию. При рентгенологи- ческом исследовании с бариевой взвесью просвет пищевода может быть умеренно дилатирован, но степень расширения не коррелирует с выражен- ностью дисфагии. В дистальном отделе имеется сужение, но в отличие от такового при ахалазии оно не имеет характерного вида птичьего клюва или мышиного хвостика с постепенным симме- тричным сужением просвета и гладкими стен- ками, а чаще эксцентрично, с обрывом по типу ступеньки и неровными бугристыми контурами. Для установления точного диагноза необходи- мо проведение эзофагогастродуоденоскопии (ЭГДС). При малейшем подозрении на наличие злокачественного процесса в области кардии обя- зательным является получение материала для гистологического и цитологического исследова- ний, поскольку рак развивается у 3–8% больных с ахалазией [30]. Необходимо помнить о возмож- ности развития рака не только в области пище- водно-желудочного перехода, но и в стенке вос- паленного расширенного пищевода;
– пептической стриктурой, являющейся осложнением длительно текущей гастроэзофа- геальной рефлюксной болезни (ГЭРБ). Для нее также характерна дисфагия: в начальных стадиях отмечается затрудненное прохождение по пищеводу только твердой пищи, тогда как в более поздних стадиях присоединяется наруше- ние пассажа кашицеобразной пищи и жидкостей. Дисфагии, как правило, предшествует длитель- но существующая изжога, часто возникающая в ночное время, однако к моменту формирования стриктуры изжога прекращается. Для дифферен- циальной диагностики важно проведение мано- метрии и рентгенографии пищевода с контрастированием, результаты которого свидетельствуют об отсутствии значимого расширения просвета пищевода, а в вертикальном положении больно- го контрастное вещество (взвесь сульфата бария) в отличие от ахалазии кардии длительно в пище- воде не задерживается. При ЭГДС могут быть выявлены эрозии;
– ишемической болезни сердца (ИБС), основ- ное клиническое проявление которой — боли в груди. Этот симптом практически невозможно отличить от такового при ахалазии кардии, осо- бенно если ИБС провоцируется приемом пищи. Не помогает в плане дифференциальной диагно- стики и эффект от приема нитроглицерина, так как боли при ахалазии, как и при ИБС, купи- руются после его приема. ЭКГ также не всег- да позволяет уточнить диагноз, так как ишемия миокарда очень часто имеет скрытый характер и выявляется лишь при физической нагрузке. В связи с этим в спорных ситуациях необходи- мо проводить комплексное кардиологическое обследование, включающее велоэргометрию или тредмил-тест, эхокардиографию и комбинирован- ное исследование — суточное холтеровское мони- торирование и 24-часовую pH-метрию;
– врожденными мембранами и кольцами пищевода, которые при их небольшом размере часто остаются бессимптомными и манифести- руют после введения в рацион ребенка твердой пищи такими симптомами, как дисфагия и сры- гивание во время или после кормления. У детей более старшего возраста возникает характерная для идиопатической ахалазии рвота содержимым пищевода, что усложняет установление правиль- ного диагноза;
– неврогенной анорексией, которая обычно возникает у молодых женщин в отличие от аха- лазии, одинаково часто развивающейся у мужчин и женщин, и характеризуется дисфагией и рво- той содержимым желудка, часто провоцируемы- ми психотравмирующими ситуациями. Для дан- ного заболевания также характерно значительное уменьшение массы тела.
Диагностика
Лабораторные исследования
Всем пациентам с ахалазией кардии необхо- димо выполнить общий анализ крови (определе- ние уровня эритроцитов, гемоглобина, лейкоци- тов, тромбоцитов), оценить коагулограмму (для определения риска развития кровотечения перед выполнением пневмокардиодилатации или опе- ративным вмешательством), установить уровень сывороточного креатинина и альбумина, провести общий анализ мочи (определение кетоновых тел, которые обнаруживают в моче при длительном голодании).
Рис. 1. Рентгенограммы пищевода. Умеренное рас- ширение пищевода, длительная задержка в нем бариевой взвеси. Раскрытия кардии при проглаты- вании контрастного вещества не происходит, оно начинает поступать в желудок тонкой струей лишь при значительном наполнении пищевода, заметны слабые неперистальтические сокращения, не смыка- ющие стенки пищевода (данные Клиники пропедев- тики внутренних болезней, гастроэнтерологии, гепа- тологии УКБ № 2 ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова»)
Fig. 1. Esophageal X-ray. Moderate esophageal dilation, prolonged retention of the barium meal. Opening of the cardia does not occur at swallowing of the contrast substance, it starts to enter the stomach by a thin stream only at significant filling of the esophagus, weak peristaltic contractions not bringing esophageal walls together may be seen (data of Vasilenko Clinic of internal diseases propedeutics, gastroenterology and hepatology, Sechenov First Moscow State medical University)
Инструментальные исследования
Для подтверждения диагноза идиопатической ахалазии необходимо использовать инструмен- тальные методы обследования, такие как рентге- нография пищевода с контрастированием, ЭГДС и манометрия, которая признана «золотым стан- дартом» диагностики.
Некоторые авторы рекомендуют перед про- ведением рентгеноконтрастного исследования выполнить обзорную рентгенографию грудной клетки, по результатам которой можно опре- делить наличие уровня жидкости в средосте-
нии, обусловленного застоем пищевых масс в пищеводе, а также выявить расширение сре- достения и отсутствие газового пузыря желуд- ка. Рентгеноконтрастное исследование выпол- няют с бариевой взвесью, при этом оценивают степень расширения пищевода, его деформацию (S-образный пищевод), длительность задержки контрастной массы в пищеводе, рельеф абдоми- нального отдела пищевода и области пищевод- но-желудочного перехода в момент открытия кардиоэзофагеального сфинктера, наличие или отсутствие газового пузыря желудка и некоторые другие параметры (рис. 1).
У больных с кардиоспазмом при рентгеноло- гическом исследовании выявляют усиление мото- рики пищевода с выраженными сегментарными сокращениями, при ахалазии кардии — сниже- ние моторной активности пищевода (отсутствие первичной перистальтики в дистальных 2/3 пище- вода). При обеих формах заболевания просвет пищевода расширен, иногда может иметь С- или S-образную форму, типичной находкой является конусовидное сужение в области НПС, похожее на мышиный хвостик или птичий клюв, отмеча- ется замедление эвакуации контрастного вещества из пищевода в желудок.
Для определения стадии заболевания пред- ложены многочисленные классификации, напри- мер четырехстадийная классификация кардио- спазма Б.В. Петровского (1962), классификация Т.А. Суворовой (1966), впоследствии дополнен- ная А.Л. Гребеневым (1987), в которой выде- лены два типа ахалазии пищевода; трехстадий- ная классификация кардиоспазма, предложен- ная Г.Д. Вилявиным (1978). Однако наиболь- шее распространение получила классификация Б.В. Петровского:
I стадия — функциональный непостоянный спазм кардии без расширения пищевода;
II стадия — стабильный спазм кардии с нерез- ко выраженным расширением пищевода и уси- ленной моторикой стенок;
III стадия — рубцовые изменения (стеноз) мышечных слоев НПС с выраженным расшире- нием пищевода и нарушениями тонуса и пери- стальтики;
IV стадия — резко выраженный стеноз кар- дии со значительной дилатацией, удлинением, S-образной деформацией пищевода, эзофагитом и периэзофагитом.
Для ахалазии кардии характерна положитель- ная проба Хурста, когда начало опорожнения пищевода происходит вне акта глотания и зави- сит от высоты столба бариевой взвеси, при повы- шении гидростатического давления НПС раскры- вается и контрастное вещество «проваливается» в желудок.
При проведении контрастного исследова- ния важное значение имеют фармакологические
Рис. 2. Эндофото. Наличие пенистой слизи
и остатков пищи в расширенном пищеводе (дан- ные Клиники пропедевтики внутренних болезней, гастроэнтерологии, гепатологии УКБ № 2 ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова»)
Fig. 2. Endoscopic photograph. Foamy mucus and food remnants are visible in non-dilated esophagus (data of Vasilenko Clinic of internal diseases propedeutics, gastroenterology and hepatology, Sechenov First Moscow State medical University)
пробы. Широкое распространение получила проба с нитроглицерином: через некоторое время после введения бариевой взвеси пациент помеща- ет под язык 1–2 таблетки нитроглицерина, что при ахалазии приводит к снижению тонуса НПС и быстрому продвижению контрастного вещества из пищевода в желудок. Проводят также пробы с карбахолином и ацетилхолином, при введе- нии которых возникают непропульсивные бес- порядочные сокращения мускулатуры в грудном отделе пищевода и повышается тонус НПС, что приводит к длительной задержке бариевой взвеси в пищеводе. Похожий эффект дает введение син- тетического аналога холецистокинина синкалида, который в норме расслабляет НПС, однако из-за утраты тормозящих нейронов развивается пара-
Рис. 3. Кардиоспазм II стадии.
а — рентгенограмма; б — эндофото (данные ФГБНУ «РНЦХ им. акад. Б.В. Петровского»). Fig. 3. Second-degree cardiac spasm. a – X-ray film; b — endoscopic photograph (data of Petrovsky National Research Center of Surgery)
доксальный эффект в виде его стойкого сокраще- ния, что вызывает задержку контрастного веще- ства в пищеводе.
При возникновении подозрения на наличие ахалазии кардии необходимо провести ЭГДС с целью исключения псевдоахалазии, которую выявляют у 2–4% пациентов с диагнозом аха- лазии. При эндоскопическом исследовании в первую очередь обращают внимание на сте- пень дилатации и девиации просвета пищевода, наличие в нем остатков пищи, принятой накану- не, жидкости и слизи. Одновременно оценива- ют состояние слизистой оболочки пищевода, ее толщину, цвет, блеск, определяют наличие пери- стальтики.
После визуализации кардии, которую не всег- да легко осуществить при значительно дефор- мированном пищеводе, оценивают ее положение относительно оси пищевода, наличие воспали- тельных и рубцовых изменений слизистой обо- лочки в этой зоне, эластичность стенок, равно- мерность раскрытия кардии при инсуффляции воздуха и возможность проведения эндоскопа в желудок. Необходимым условием обеспечения безопасности исследования является выполнение его только под визуальным контролем, исключая проведение аппарата «вслепую» через остатки пищи и слизь, так как в этом случае высока опас- ность перфорации стенки пищевода, измененной в результате хронического воспалительного про- цесса.
Заключительный этап эндоскопического иссле- дования включает тщательный осмотр желудка и двенадцатиперстной кишки и обязательный ретроградный осмотр кардии для исключения кардиоэзофагеального рака.
Рис. 4. Кардиоспазм III стадии.
а — рентгенограмма; б — эндофото (данные ФГБНУ «РНЦХ им. акад. Б.В. Петровского»)
Fig. 4. Third-degree cardiac spasm. a – X-ray film; b
– endoscopic photograph (data of Petrovsky National Research Center of Surgery)
Рис. 5. Кардиоспазм IV стадии.
а — рентгенограмма; б — эндофото (данные ФГБНУ «РНЦХ им. акад. Б.В. Петровского»). Fig. 5. Fourth-degree cardiac spasm. a – X-ray film; b – endoscopic photograph (data of Petrovsky National Research Center of Surgery).
Стадию заболевания целесообразно опреде- лять, основываясь на следующих критериях [8].
При I стадии заболевания эндоскопических изменений просвета пищевода, перистальтики, состояния слизистой оболочки, положения кар- дии и ее открытия выявить не удается.
При II стадии определяется умеренное (до 3–4 см) расширение просвета пищевода; остат- ков пищи в пищеводе, как правило, нет, может быть небольшое количество прозрачной жидкости или слизи; слизистая оболочка гладкая, ровная, блестящая, ее складки расположены продольно;
Чикагская классификация нарушений моторики пищевода
|
Ахалазия |
Тип I Тип II Тип III Нарушение проходимости кардии |
|
Заболевания, связанные с нарушением моторики |
Диффузный эзофагоспазм Чрезмерная интенсивность сокращений (DCI >8000 — «отбойный молоток») Гипокинезия/отсутствие сокращений |
|
Изменения перистальтики |
Нарушение перистальтики с большими разрывами Нарушение перистальтики с малыми разрывами Незавершенная перистальтика Ускоренные сокращения Гиперкинезия грудного отдела пищевода («пищевод щелкунчика») |
Рис. 6. Подтягивание НПС и укорочение грудного отдела пищевода у пациента с ахалазией кардии. Сплошная стрелка — истинное расположение НПС, пунктирная — подтягивание НПС (данные Клиники пропедевтики внутренних болезней, гастроэнтероло- гии, гепатологии УКБ № 2 ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова»)
Fig. 6. Shifting of LES and shortening of thoracic esophagus in cardiac achalasia. Solid arrow - true location of LES, dotted arrow — shifting of LES (data of Vasilenko Clinic of internal diseases propedeutics, gastroenterology and hepatology, Sechenov First Moscow State medical University)
перистальтика усилена; кардия расположена по центру, обычно плотно сомкнута, но достаточно легко раскрывается при избыточной (по сравне- нию с обычным эндоскопическим исследованием) инсуффляции воздуха (рис. 2). При ретроград- ном осмотре складки в области пищеводно-желу- дочного перехода плотно обхватывают эндоскоп, слизистая оболочка мягкая, эластичная.
В III стадии кардиоспазма и ахалазии кар- дии пищевод расширен до 4–8 см, в его просве- те остатки жидкой и твердой пищи, много слизи. Перистальтика очень вялая или «рваная» из-за снижения мышечного тонуса пищевода, вслед- ствие чего формируются четкообразные участ- ки — неравномерное расширение просвета на разных уровнях. В дистальном отделе пищевода отмечается начинающаяся S-образная деформа- ция, из-за чего кардия расположена эксцентрич- но, отклоняясь вначале вправо от продольной оси пищевода, а затем немного влево. Вторая часть изгиба становится более выраженной при про- грессировании болезни. Выраженный изгиб сви- детельствует о начинающемся удлинении пище- вода, что проявляется в увеличении расстояния от резцов до кардии: вместо 38–40 см в норме 41–45 см или более. Кардия, как правило, плотно сомкнута, раскрывается при избыточной инсуф- фляции воздуха. Слизистая оболочка пищевода несколько утолщена, может быть гиперемирована в дистальном отделе.
При IV стадии заболевания просвет пищево- да значительно расширен (часто более 8–10 см), пищевод удлинен и извит, имеет вид неперисталь- тирующего мешка вследствие отсутствия мышеч- ного тонуса. В просвете содержится большое количество жидкости и остатков пищи. Слизистая оболочка утолщена, рыхлая, местами имеет круп- ноячеистый вид, иногда с эрозиями, обусловлен- ными длительным стазом пищи или развитием кандидозного эзофагита, отмечается поперечная складчатость слизистой оболочки из-за удлинения и растяжения пищевода. Очень часто пищевод заканчивается «слепым мешком», заполненным остатками пищи, а кардия резко смещена в сто- рону и, как правило, находится выше дна этог «мешка». Расстояние от резцов до кардии в ряде случаев значительно увеличено — от 45 до 70 см. Часто она сомкнута неплотно, возможны рубцо- вые изменения слизистой оболочки.
Визуализация кардии при III и особенно IV стадиях кардиоспазма может быть затруднена из-за большого количества содержимого в пище- воде и резкой деформации просвета, так как могут наблюдаться несколько изгибов пищево- да. Однако необходимо отметить, что при любой стадии ахалазии кардии, в отличие от органиче- ского стеноза на уровне пищеводно-желудочного перехода (злокачественная опухоль или рубцовая стриктура), удается провести эндоскоп в желу- док без сопротивления. Затруднения связаны не с преодолением спазма как такового, а с удли- нением пищевода и формированием одного или нескольких «колен», в том числе в верхней трети, и эксцентричным положением кардии. Если же для проведения эндоскопа через кардию требует- ся заметное усилие или осуществить его не удается, отмечается выраженное «побеление» стенок пищевода и пищеводно-желудочного перехода из-за ригидности, необходимо заподозрить опухо- левый характер стеноза.
Рис. 7. Три типа ахалазии кардии.
а — I тип; б — II тип; в — III тип (данные Клиники пропедевтики внутренних болезней, гастроэнтероло- гии, гепатологии УКБ № 2 ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова»)
Fig. 7. Three types of cardiac achalasia. а – type I; б – type II; в - type 3 (data of Vasilenko Clinic of internal diseases propedeutics, gastroenterology and hepatology, Sechenov First Moscow State medical University)
Как правило, каждой клинико-рентгенологи- ческой стадии кардиоспазма и ахалазии кардии соответствует определенная эндоскопическая картина, на основании которой стадия болезни может быть установлена и без предшествующего рентгенологического исследования, если оно не может быть выполнено по каким-либо причинам (рис. 3–5).
«Золотым стандартом» обследования паци- ентов при подозрении на ахалазию кардии является манометрия. В настоящее время для исследования двигательной функции пищевода можно использовать как метод открытых кате- теров (водно-перфузионная манометрия), так и современные высокотехнологичные методы — манометрию высокой разрешающей способности (high resolution manometry — HRM) и объемную 3D-манометрию, которые имеют явные преиму- щества по сравнению с манометрией, выполняе- мой с помощью 4- или 8-канального водно-перфу- зионного катетера. При расположении датчиков давления на расстоянии 5 см друг от друга боль- шие участки перистальтической волны грудного отдела пищевода «выпадают» из анализа. Так, подтягивание НПС и укорочение грудного отде- ла пищевода у больных с ахалазией кардии часто принимают за истинное, хотя и недостаточное, расслабление сфинктера («псевдорелаксация»). Использование многоканальных катетеров при манометрии высокой разрешающей способности позволяет избежать подобных ошибок (рис. 6).
При анализе результатов обследования паци- ентов с ахалазией кардии, проведенного с исполь- зованием манометрии высокого разрешения, следует учитывать Чикагскую классификацию нару- шений моторики пищевода, созданную в 2008 г. Применение этого метода исследования позволи- ло выделить три типа ахалазии кардии в зави- симости от выявленных изменений двигательной активности грудного отдела пищевода, что дает возможность более точно прогнозировать эффек- тивность лечения с помощью пневмокардиодила- тации (рис. 7).
Для всех типов заболевания характерны повы- шение суммарного давления расслабления (выше 15 мм рт. ст.) и отсутствие перистальтической волны сокращения грудного отдела пищевода, при этом давление покоя (Resting Pressure) может быть повышено или в пределах нормальных зна- чений (норма 10–35 мм рт. ст.). При I типе (клас- сическая ахалазия кардии) при 100% влажных глотков отсутствует любая перистальтика грудно- го отдела пищевода. При ахалазии кардии II типа отсутствует нормальная перистальтическая волна сокращения, однако наблюдается равномерное спастическое сокращение умеренной интенсивно- сти по всей длине пищевода от верхнего до ниж- него пищеводного сфинктера более чем при 20% влажных глотков. Ахалазия кардии III типа характеризуется отсутствием нормальной пери- стальтической волны, наличием отдельных эпи- зодов перистальтики в грудном отделе пищевода или преждевременными спастическими сокраще- ниями (дистальный эзофагоспазм), зарегистриро- ванными более чем при 20% влажных глотков.
Истинную ахалазию кардии следует отличать от феномена нарушения проходимости кардии, при котором повышается суммарное давление расслабления НПС, однако сохраняется нормаль- ная перистальтика грудного отдела пищевода или отмечается снижение интенсивности сокращения в этом отделе с малыми разрывами.
Наилучших результатов лечения достигают у пациентов с ахалазией II типа. В то же время отсутствие перистальтики (I тип) и выраженную гипермоторную дискинезию грудного отдела пище- вода (III тип) можно рассматривать в качестве прогностических критериев высокого риска реци- дива ахалазии кардии после кардиодилатации.
Лечение
Существующие методы лечения кардиоспазма и ахалазии кардии (консервативные, эндоскопи- ческие, хирургические) направлены на расшире- ние кардии тем или иным способом либо сниже- ние ее тонуса, для того чтобы улучшить прохож- дение пищи через область пищеводно-желудочно- го перехода.
Диета и модификация образа жизни
Пациентам с ахалазией кардии необходи- мо назначить диету по типу пищеводного стола с исключением острых и кислых продуктов; пища должна быть теплой, принимать ее нужно мед- ленно, тщательно пережевывая. Оптимальным считается 4- или 5-разовое питание небольшими по объему порциями. Следует также отметить, что существует индивидуальный набор про- дуктов, усиливающих дисфагию у конкретных пациентов, которые целесообразно исключить из рациона.
После приема пищи не следует принимать горизонтальное положение во избежание ее регургитации. Во время сна пациент не должен находиться в строго горизонтальном положении, так как пища может задерживаться в пищево- де до нескольких часов, а верхний пищеводный сфинктер расслабляется во время сна, что приво- дит к пассивной регургитации и возможной аспи- рации дыхательных путей.
Лекарственная терапия
Для консервативного лечения пациентов с ахалазией кардии используют две группы препаратов: блокаторы кальциевых каналов и нитраты. Чаще всего применяют нифедипин и изосорбида мононитрат в дозе 5–10 мг, кото- рые следует принимать за 20—30 мин до при- ема пищи. Эти лекарственные средства снижа- ют давление НПС в среднем на 47–63%, однако полностью купировать симптомы ахалазии уда- ется редко. Необходимо также помнить о воз- можных побочных эффектах этих препаратов, из которых наиболее часто возникают головная боль, артериальная гипотензия, головокруже- ние. В связи с этим лекарственную терапию при- меняют в случае невозможности использовать альтернативные методы при лечении пациентов, ожидающих выполнения пневмокардиодилата- ции или хирургического лечения, и как сопутствующую терапию у больных с ахалазией кар- дии, сопровождающейся рефрактерной болью в груди.
Пневмокардиодилатация
При лечении всех больных с ахалазией кардии первично целесообразно использовать неоператив- ные методы, основным из которых остается сту- пенчатая баллонная пневматическая дилатация (ПД) под флюороскопическим контролем. Эта методика практически вытеснила применявшуюся ранее дилатацию кардии с помощью металличе- ского дилататора Штарка благодаря существен- но меньшей травматичности. Эффективность ПД варьирует от 60 до 85% [3, 4, 7, 9, 39, 92, 101, 104 и др.], снижаясь пропорционально количеству проводимых курсов лечения. У 30–40% больных возникает рецидив клинической симптоматики, в связи с чем требуется повторное лечение.
Процедура основана на расширении сужен- ного участка пищеводно-желудочного перехода с помощью кардиодилататора, в результате чего снижается давление НПС и улучшается пассаж пищи по пищеводу. Для этого используют пнев- модилататоры, смонтированные на желудочном зонде, которые имеют форму гантели для лучшей фиксации в зоне пищеводно-желудочного перехо- да (ЗАО «МедСил», Россия). Дилатацию выпол- няют под рентгенологическим контролем, однако в случаях выраженного расширения, удлинения и деформации пищевода, проявляющейся в зна- чительном отклонении его от продольной оси (С- или S-образный пищевод), проведение пнев- модилататора под рентгенологическим контро- лем затруднено или невозможно. Использование эндоскопической техники позволяет выполнить дилатацию под контролем зрения при заболева- нии в любой стадии, а также оценить состояние слизистой оболочки в зоне пищеводно-желудоч- ного перехода непосредственно после окончания вмешательства и немедленно диагностировать возникшие осложнения. Эндоскопические вмеша- тельства являются методом выбора при поздних стадиях кардиоспазма и ахалазии кардии у паци- ентов, у которых высок операционно-анестезио- логический риск.
Лечебную процедуру выполняют с помощью кардиодилататора, который надевают на дис- тальную часть эндоскопа. Диаметр баллона для дилатации кардии в широкой части составляет 30 и 40 мм, в области «талии» — 25 и 30 мм, длина — 12–15 см. Баллон укреплен на полой трубке, внутренний диаметр которой соответству- ет наружному диаметру эндоскопа и составляет 9–10 мм, длина — 17–20 см. К проксимальному концу баллона присоединена трубка диаметром около 3 мм для инсуффляции воздуха или вве- дения воды в баллон. «Талия» в средней части баллона облегчает его фиксацию в кардии.
Шкала Eckardt
|
Симптомы |
|
|
Баллы* |
|
|
| |
|
|
|
|
| ||||
|
Дисфагия |
Никогда |
Периодически |
1 раз в день |
Каждый |
прием |
пищи | |
|
Регургитация |
Никогда |
Периодически |
1 раз в день |
Каждый |
прием |
пищи | |
|
Боли в груди |
Никогда |
Периодически |
1 раз в день |
Каждый |
прием |
пищи | |
|
Уменьшение массы тела, кг |
Нет |
<5 |
5–10 |
|
>10 |
| |
* 0–3 балла — ремиссия, более 4 баллов — неэффективность ПД.
Давление при кардиодилатации повыша- ют постепенно — от 120–160 мм рт. ст. в нача- ле лечения до 300–320 мм рт. ст. в конце курса. Экспозиция составляет 1–2 мин, для достижения эффекта требуется в среднем 4–5 сеансов. Уровень давления контролируют с помощью манометра.
Для проведения дилатации кардии применяют также дилататоры «Rigiflex» («Boston Scientific», MA, США), представляющие собой полиэтилено- вые баллоны трех диаметров — 30, 35 и 40 мм. Аналогичные баллоны диаметром 30 и 35 мм про- изводит фирма «Cook Medical» (США).
ПД можно проводить как под рентгеноло- гическим контролем, так и с помощью эндо- скопической техники по введенной в желудок через канал эндоскопа направляющей струне. Процедура заключается в установке баллона точно в месте перехода пищевода в желудок. При извитом пищеводе для правильного позициониро- вания баллона в кардии необходим визуальный контроль, для чего параллельно баллону вводят эндоскоп. Для предупреждения осложнений (пер- форация, кровотечение) очень важно избегать форсированной дилатации и повышать давление в баллоне постепенно в течение нескольких сеан- сов от 160 до 300 мм рт. ст. в течение 40–60 с. Баллон может быть заполнен не только воздухом, но и жидкостью — водой или водорастворимым контрастным веществом для лучшей визуализа- ции. Такая процедура называется гидродилатаци- ей кардии, ее выпоняют, как правило, при давле- нии 0,5–2 атм в течение 2 мин. Уровень давления контролируют с помощью манометра.
Эффективность терапии достаточно высокая, зависит от диаметра кардиодилататора и через 3 года составляет в среднем 74, 86 и 90% при использовании баллонов диаметром 30, 35 и 40 мм соответственно.
После дилатации и для мониторирования состояния после лечения, которое необходимо проводить 1 раз в год, жалобы пациентов могут быть оценены по шкале Eckardt.
Кроме улучшения клинического течения забо- левания, предиктором длительной ремиссии после ПД является давление НПС <10 мм рт. ст., изме- ренное по окончании процедуры. После ПД необ- ходимо провести контрольное рентгенологическое исследование пищевода с контрастированием.
На эффективность ПД оказывают положи- тельное влияние ряд факторов, такие как возраст пациентов более 40 лет, II тип ахалазии кардии по данным HRM, начальная стадия заболевания, давление НПС <10 мм рт. ст. после проведен- ной ранее ПД, эвакуация из пищевода более 50% бариевой взвеси через 1 мин от начала проведе- ния рентгеноскопии с контрастированием. К фак- торам, оказывающим негативное влияние на эффективность ПД, относят: мужской пол, I и III типы ахалазии по данным HRM, давление НПС >15 мм рт. ст. после ранее выполненной ПД, эва- куация из пищевода менее 50% бариевой взвеси через 1 мин от начала рентгеноскопии пищевода, однократно проведенная ПД с использованием баллона диаметром 30 мм.
Необходимо помнить, что самым тяжелым осложнением ПД, которое наблюдается в 1,5–3% случаев, является перфорация стенки пищево- да. Однако использование современных дилата- торов и опыт специалистов, выполняющих ПД, позволяют значительно снизить риск ее возник- новения. После ПД могут отмечаться также боли в груди, повреждение слизистой оболочки пище- вода и гематома, повышение температуры тела и аспирационная пневмония, однако риск их раз- вития очень мал. Достаточно редко после проце- дуры развивается ГЭРБ.
Введение ботулинотоксина
Еще в 1994 г. в зарубежной литературе поя- вились сообщения об использовании ботулино- вого токсина А для эндоскопического лечения кардиоспазма и ахалазии кардии [42, 43, 49, 60, 79 и др.]. Ботулиновый токсин оказывает рассла- бляющее действие на гладкую мускулатуру путем блокирования выброса медиатора парасимпатиче- ской нервной системы ацетилхолина холинергиче- скими нейронами и нарушения нервно-мышечной передачи. При этом процесс синтеза и депонирова- ния ацетилхолина в пресинаптической терминали синапса не нарушается [20, 55]. Введение ботули- нового токсина А в зону кардии приводит к сни- жению базального и остаточного давления НПС.
Процедура основана на интрамуральном эндо- скопическом введении ботулинового токсина А в НПС в дозе 80–100 ЕД, при этом 1 мл препара- та (20–25 ЕД) вводят с помощью иглы диаметром 5 мм для склеротерапии в каждый из четырех квадрантов НПС под визуальным контролем.
Эффективность терапии составляет около 80% в течение 1-го месяца наблюдения, 70% после 3 мес, 50% через 6 мес и около 40% через 1 год, в связи с чем иногда требуется повторная инъек- ция ботулинового токсина.
Несмотря на безопасность и простоту выпол- нения, этот метод можно рассматривать в каче- стве альтернативного варианта только при лечении пациентов, имеющих абсолютные про- тивопоказания к пневмокардиодилатации, эндо- скопическому и оперативному вмешательству, особенно если речь идет о лицах старшей воз- растной группы, наличии тяжелой сопутствую- щей патологии сердечно-сосудистой и бронхоле- гочной систем, а также при наличии S-образного пищевода [9].
К факторам, оказывающим негативное влияние на эффективность этого метода, относят: молодой возраст пациентов, мужской пол, высокое давле- ние покоя НПС, отсутствие эффекта от предыду- щих инъекций ботулинового токсина, а наиболее выраженный эффект от лечения можно ожидать у людей пожилого возраста и пациентов с ахалази- ей и выраженной гипермоторной дискинезией груд- ного отдела пищевода. Следует также отметить, что до настоящего времени в Российской Федерации препарат «Диспорт» не зарегистрирован в качестве средства для применения в гастроэнтерологии, его разрешено использовать лишь в неврологии и кос- метологии. Для лечения ахалазии кардии препарат применяют в Республике Татарстан по специаль- ному разрешению Министерства здравоохранения этого субъекта РФ.
Хирургическое лечение
При неэффективности нехирургических методов лечения решают вопрос о необходимо- сти выполнения оперативного вмешательства. Следует отметить, что выполняемая в ряде лечеб- ных учреждений эзофагокардиомиотомия по Геллеру, заключающаяся в рассечении мышечной оболочки нижнего конца расширенного сегмента пищевода и кардиальной части желудка по перед- ней и задней стенкам, у 15% больных осложня- ется развитием ГЭРБ. В связи с этим основным оперативным вмешательством является эзофаго- кардиомиотомия с неполной фундопликацией для предупреждения рефлюкса. Согласно отдален- ным результатам, по эффективности она превос- ходит ПД, однако из-за травматичности любого оперативного вмешательства, необходимости ане- стезиологического пособия и вероятности разви- тия послеоперационных осложнений этот метод лечения применяют при неэффективности повтор- ных ПД.
В настоящее время для лечения кардиоспаз- ма широко применяют лапаро- и торакоскопические операции, из которых предпочтение отдают лапароскопической миотомии с частичной фундо- пликацией в различных модификациях, обеспе- чивающей беспрепятственное прохождение пищи у пациентов с ослабленной моторикой пищевода, с одной стороны, и предупреждающей рефлюкс — с другой [1, 71, 92, 101 и др.]. Эффективность минимально инвазивных вмешательств не уступа- ет таковой открытых хирургических операций — 94 и 84% соответственно, а частота послеопера- ционных осложнений ниже. К сожалению, после хирургического лечения также в ряде случаев возникает рецидив дисфагии, в связи с чем тре- буется повторное проведение консервативного, в том числе с использованием эндоскопических методов, или хирургического лечения.
В терминальной стадии заболевания выпол- няют экстирпацию или субтотальную резекцию пищевода с одномоментной пластикой желудоч- ной трубкой, в том числе с применением лапаро- и торакоскопической техники. Показания к выбо- ру метода оперативного вмешательства определя- ют индивидуально [1, 36 и др.].
В 2007 г. был предложен и апробирован на живых свиньях новый метод лечения ахалазии, заключающийся в обеспечении прямого доступа к мышечному слою пищевода через туннель, соз- данный в подслизистом слое (один из вариантов NOTES — внутрипросветной эндоскопической хирургии через естественные отверстия) [80]. У человека эта операция, получившая назва- ние «пероральная эндоскопическая миотомия» (POEM), впервые выполнена в 2008 г. [62]. С этого времени операцию стали быстро внедрять в клиническую практику, и к настоящему време- ни она выполнена уже нескольким сотням паци- ентов [52, 63, 86, 87, 96, 109, 111 и др.].
Авторы рассматривают эту методику в каче- стве альтернативы баллонной кардиодилатации и эзофагокардиомиотомии по Геллеру. Суть ее состоит в следующем: с помощью специальных инструментов, введенных по инструментальному каналу гибкого эндоскопа, делают продольный надрез слизистой оболочки пищевода на про- тяжении 1,5–3 см примерно на 10–12 см выше пищеводно-желудочного перехода, через который в подслизистый слой вводят эндоскоп. Вместо воздуха инсуффлируют углекислый газ для предупреждения развития пневмомедиастинума и пневмоперитонеума. Под визуальным контро- лем на всем протяжении вплоть до малой кривиз- ны желудка как минимум на 3 см ниже пищевод- но-желудочного перехода создают туннель между слизистой оболочкой и мышечным слоем путем последовательного пересечения соединительно- тканных волокон и сосудов после порционного введения изотонического раствора натрия хлори- да с добавлением, как правило, раствора высо- кой вязкости, чаще всего на основе глицерола и гиалуроновой кислоты, подкрашенного инди- гокармином или метиленовым синим для лучшей визуализации. Рассечение волокон выполняют специальными ножами различной формы разных производителей («Olympus», «Fujifilm», «ERBE» и др.). Затем постепенно рассекают циркулярные мышечные волокна в направлении сверху вниз. Дефект в слизистой оболочке клипируют.
POEM — эффективная и достаточно без- опасная процедура. Исследователи сообщают об уменьшении выраженности симптомов дисфагии с 10 баллов до 1,3 балла, снижении давления НПС с 52,4 (14,2–80,5) до 19,8 (9,3–42,7) мм рт. ст. в течение в среднем 5 мес. При оценке жалоб пациентов по шкале Eckardt отмечается значи- тельное улучшение состояния: если до операции средняя оценка составляла 7–8 баллов, то после нее у всех пациентов она была ниже 3 баллов, в основном 0–1 балл. Частота развития ГЭРБ варьирует, согласно данным разных авторов, от 0 до 37% [109].
Однако технически эта процедура достаточ- но сложная и длительная даже в руках опытных специалистов, выполняют ее под наркозом. Необходимо проведение дальнейших проспектив- ных рандомизированных исследований для оцен- ки ближайших и отдаленных результатов POEM и определения ее места в алгоритме современных методов лечения кардиоспазма и ахалазии кар- дии.
Прогноз
Ахалазия кардии может быть отнесена к пред- раковым заболеваниям, поскольку известно, что рак развивается у 3–8% больных с кардиоспаз- мом и ахалазией кардии и вероятность его воз- никновения возрастает с увеличением продол- жительности заболевания [30, 46], причем не только в кардии, но и в измененном пищеводе. В связи с этим необходимо своевременное выяв- ление и лечение больных с данной патологией. Если оценивать длительность ремиссии после ПД как наиболее эффективного метода лечения, то в течение 5–10 лет она составляет в среднем около 75–90%.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. The authors declare no conflict of interest.
Список литературы:
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.
















.jpg)




.png)















Комментарии