- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Современные представления о факторах риска развития рака желудка
| Авторы: | В.М. Хомяков 1 А.Д. Ермошина 2 С.С. Пирогов 3 А.Б. Рябов 4 2017г. |
| Об авторах: |
1. кандидат медицинских наук, руководитель торакоабдоминального хирургического отделения отдела торакоабдоминальной онкохирургии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИРЦ» Минздрава России. 2. аспирант торакоабдоминального хирургического отделения отдела торакоабдоминальной онкохирургии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИРЦ» Минздрава России. 3. кандидат медицинских наук, ведущий научный сотрудник эндоскопического отделения МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИРЦ» Минздрава России. 4. доктор медицинских наук, руководитель отдела торакоабдоминальной онкохирургии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИРЦ» Минздрава России. |
Из данной публикации Вы узнаете:
Анонс:
Рак желудка — полиэтиологичное заболевание, которое развивается под воздействием и при взаимодействии внешних и внутренних факторов. РЖ кишечного типа и РЖ диффузного типа имеют различный патогенез и факторы риска. Оценка факторов риска позволяет осуществлять профилактику заболевания, а также выявлять группы риска, в которых необходимо проводить мероприятия по профилактике и ранней диагностике РЖ.




Полный текст статьи:
Актуальность
Несмотря на неуклонное снижение заболеваемости раком желудка (РЖ) во второй половине XX века, он остается одной из наиболее распространенных форм злокачественных новообразований человека, занимая пятое месте среди всех злокачественных новообразований и третье — в структуре смертности при злокачественных новообразованиях [1, 2].
В нашей стране ежегодно диагноз РЖ впервые устанавливают примерно около 36 тыс. пациентам. Мужчины болеют в 1,3 раз чаще женщин, пик заболеваемости приходится на возраст 64–68 лет [4].
Понимание основных причин и механизмов развития РЖ, знание ключевых факторов риска позволяют активно выявлять предраковые заболевания и начальные формы РЖ среди лиц, относящихся к группе риска развития данного заболевания.
Типы рака желудка по Lauren и их особенности
При рассмотрении факторов риска следует учитывать, что РЖ является гетерогенным заболеванием, включающим различные по этиологии и патогенезу гистологические и генетические формы опухолей. Предикторы развития РЖ для каждой формы следует рассматривать отдельно.
Первое деление РЖ в зависимости от молекулярно-генетических и патоморфологических особенностей было отражено в классификации, предложенной P. Lauren еще в 1965 г.
Согласно данной классификации, были выделены кишечный и диффузный типы РЖ [6].
Рак желудка кишечного типа (РЖКТ)
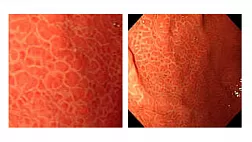
Рак желудка кишечного типа (РЖКТ) по строению сходен с опухолями кишечника (откуда и берет свое название) и представлен отчетливо выраженными железистыми структурами, состоящими из высокодифференцированного цилиндрического эпителия с развитой щёточной каёмкой (рис. 1).
Эта форма опухоли, локализующаяся преимущественно в дистальных отделах желудка, исторически преобладала в регионах с высокой заболеваемостью [7].
- В патогенезе РЖКТ превалируют экзогенные факторы, включающие особенности питания и образа жизни (см. «Пищевые факторы риска»), а также хроническая инфекция Helicobacter pylori (H. рylori).
- При развитии этой формы опухоли отчетливо прослеживается каскад последовательных предраковых изменений слизистой оболочки: хронический активный гастрит без атрофии -> хронический атрофический гастрит -> кишечная метаплазия и дисплазия с последующим переходом тяжелой дисплазии в инвазивный РЖ [8].
- В то же время молекулярно-генетические механизмы возникновения РЖКТ по-прежнему неясны. РЖКТ чаще метастазирует гематогенно, экспрессирует Her2/neu в 5–10% случаев и характеризуется относительно более благоприятным течением и прогнозом.
- Именно заболеваемость РЖ этой формы снизилась в наибольшей степени под воздействием изменений характера питания и широкого применения антигеликобактерной терапии [9].
Следует отметить, что аденокарцинома кардии и нижней трети пищевода, хотя и формально представлена опухолью кишечного типа, существенно отличается от дистального РЖКТ по патогенезу, генетическому профилю (CIN-тип), течению и прогнозу [10].
Рак желудка диффузного типа (РЖДТ)
Рак желудка диффузного типа (РЖДТ) представлен слабоорганизованными группами клеток или одиночными клетками с большим содержанием муцина в цитоплазме, оттесняющего ядро к периферии (перстневидные клетки) (рис. 2).
- Морфологические особенности РЖДТ обусловлены потерей факторов клеточной адгезии, что способствует более активной инвазии и раннему началу метастазирования [11]. Одним из ключевых механизмов патогенеза (но, по-видимому, не единственным) данной формы РЖ является утрата экспрессии белка межклеточных контактов Е-кадгерина в результате изменения активности гена CDH1. Этот белок находится на поверхности клеточных мембран и отвечает за создание межклеточных соединений, тем самым поддерживая структуру эпителиальной ткани [12].
- Изменение активности гена CDH1 чаще всего (в 40–83% случаев) является следствием спорадических соматических мутаций [13].
- Для РЖДТ нехарактерно наличие фоновых заболеваний, однако существуют наследственные формы (наследственный РЖДТ — НРЖДТ), обусловленные передачей дефектного гена CDH1, расположенного в хромосоме 16q22.1.
- Эта форма рака наследуется по аутосомно-доминантному типу и характеризуется ранней манифестацией (см. далее).
- Принимая во внимание сложности ранней диагностики РЖДТ, а также учитывая его крайне агрессивное течение и неблагоприятный прогноз, пациенты с подтвержденной мутацией СDH1 и семейным анамнезом могут являться кандидатами для выполнения профилактической гастрэктомии [14].
- На фоне общего снижения заболеваемости РЖ удельный вес РЖДТ продолжает увеличиваться [15].
- В отличие от РЖКТ при РЖДТ не выявлено стадийности поражения слизистой оболочки, предшествующего развитию злокачественного процесса, даже если имеется колонизация слизистой оболочки H. pylori.
- Еще одной особенностью РЖДТ является мультифокальный характер поражения [16]. Для РЖДТ характерны диффузный инфильтративный рост и высокая частота развития карциноматоза брюшины.
- Опухоль этого типа чаще развивается у лиц молодого возраста и отличается агрессивным течением, низкой чувствительностью к химиотерапии и неблагоприятным прогнозом [17].
Предраковые заболевания и изменения
В контексте рассматриваемой проблемы следует разделять собственно факторы риска и предраковые заболевания или изменения, возникшие под воздействием факторов риска и являющиеся промежуточным звеном в процессе злокачественной трансформации нормальной слизистой оболочки желудка.
Предраковые заболевания и изменения
К основным предраковым заболеваниям желудка в настоящее время относят
- аденоматозные полипы (риск малигнизации 8–59%) и
- хронический атрофический гастрит (повышает риск развития заболевания в 3–18 раз), как типа А, так и типа Б [18, 19].
Атрофический гастрит характеризуется прогрессирующей атрофией железистого эпителия с потерей обкладочных клеток, а также компенсаторным увеличением производства сывороточного гастрина, являющегося мощным индуктором пролиферации клеток эпителия желудка.
- Уменьшение количества нормальных экзокринных желез слизистой оболочки желудка вызывает гипохлоргидрию (снижение выработки соляной кислоты), что приводит к повышению уровня рН в желудке.
- Аномально высокий уровень рН благоприятствует колонизации слизистой оболочки микробными агентами, часть которых содержит нитратредуктазу, обеспечивающую процессы нитрозирования, вызывающие генетические изменения в клетке.
- На фоне атрофического гастрита также уменьшается количество эндокринных клеток, способствующих регенерации слизистой оболочки [20].
Именно на фоне атрофического гастрита, как правило, реализуется каскад патологических изменений, приводящих к РЖКТ.
Аденоматозные полипы (АП) составляют 6–10% всех полипов желудка.
- АП обычно возникают на фоне хронического атрофического гастрита.
- Они, как правило, одиночные, расположены в антральном отделе, изредка — в теле желудка и кардии, характеризуются небольшой частотой малигнизации.
- Риск малигнизации возрастает с увеличением размера полипа и неровности его контура, а также с нарастанием выраженности диспластических изменений [21].
Помимо атрофического гастрита и АП, вклад в развитие РЖ вносят
- язвенная болезнь желудка вследствие общности их этиологических факторов (заболеваемость выше в 1,8 раза),
- гипертрофическая гастропатии — болезнь Менетрие (риск малигнизации 2–15%) и
- иммунодефицитные состояния (гипогаммаглобулинемия) [22].
Непосредственно предраковыми изменениями слизистой оболочки являются кишечная метаплазия и дисплазия желудочного эпителия.
Кишечная метаплазия — потенциально обратимое состояние, которое развивается в ответ на хроническую инфекцию H. pylori, рефлюкс желчи, воздействие ионизирующего излучения и другие повреждающие факторы.
К предраку также относят дисплазию эпителия желудка различной степени тяжести, при этом тяжелая дисплазия является облигатным предраком и в некоторых странах (например, в Японии) ее рассматривают как ранний рак желудка и подвергают обязательному эндоскопическому лечению [23].
Вероятность малигнизации при легкой, умеренной и значительной степени выраженности дисплазии составляет 21, 33 и 57% соответственно.
Факторы риска
Все факторы риска можно условно разделить на экзогенные и эндогенные (см. таблицу).
Экзогенные факторы риска
Пищевые факторы
К пищевым факторам, которые достоверно повышают риск развития РЖ, относят
- потребление чрезмерного количества поваренной соли,
- диету с высоким (более 30 г/сут) содержанием мясных продуктов, приготовленных с использованием соли, копчения, консервантов (processed meat), а также
- пищевые нитраты и нитрозосодержащие компоненты.
Патогенез
Соль
- Известно, что потребление поваренной соли в больших количествах приводит к повреждению слизистой оболочки желудка, при этом повышается ее восприимчивость к воздействию других канцерогенных факторов.
- Избыточное потребление соленой пищи также ассоциировано с увеличением инфицированности H. pylori, а их синергическое взаимодействие вызывает ускорение процессов, приводящих к злокачественной трансформации слизистой оболочки желудка [26, 27].
Пищевые нитраты и нитрозосодержащие соединения
Канцерогенными факторами принято считать также пищевые нитраты и нитрозосодержащие соединения, попадающие в организм человека из потребляемой пищи, алкоголя, табачного дыма и других источников окружающей среды.
- N-нитрозосоединения образуются после потребления нитратов, которые являются естественными компонентами пищевых продуктов, таких как овощи и картофель, а также используются в качестве пищевых добавок при изготовлении некоторых сыров и колбасных изделий.
- Процесс всасывания нитратов происходит в желудке, в дальнейшем нитраты секретируются слюнными железами в составе слюны (в концентрированной форме), где происходит их восстановление до нитритов с помощью бактерий, обитающих в ротовой полости, которые содержат фермент нитратредуктазу.
- Нитриты могут также взаимодействовать с такими соединениями, как амины, амиды и аминокислоты, с образованием N-нитрозосоединений (нитрозаминов и нитрозамидов), которые обладают широким спектром биологических эффектов, основные из которых — канцерогенный, тератогенный и мутагенный.
Согласно результатам большого числа исследований, преобладание в рационе жареной пищи, обработанного мяса и рыбы (с низким содержанием овощей, фруктов, молока и витамина А), а также алкоголя было связано с повышением риска развития РЖ [29, 30]. Мета-анализ показал, что относительный риск развития РЖ, связанный с потреблением 30 г обработанного мяса в день (примерно половина средней порции), составил 1,15 (95% CI 1.04–1.27) [31].
Однако существуют пищевые факторы, способные снизить риск развития РЖ, — свежие овощи и фрукты [32]. Кроме того, показано, что риск развития РЖКТ, в том числе ассоциированного с инфекцией H. pylori, может быть снижен на фоне регулярного применения нестероидных противовоспалительных препаратов [34].
Патогенез протективных факторов
Считается, что протективный эффект свежих овощей и фруктов связан с высоким содержанием витамина С, который уменьшает образование N-нитрозосоединений.
Инфекционные факторы
К инфекционным факторам относят
- инфекцию H. pylori и
- вирус Epstein–Barr (EВV).
Инфекция H. pylori
- По данным ВОЗ, инфекция H. pylori относится к канцерогенам 1-й группы [35].
- H. pylori тропен к слизистой оболочке желудка и двенадцатиперстной кишки.
- Особенность этого микроорганизма состоит в способности повреждать слизистую оболочку желудка путем высвобождения ферментов и токсинов и тем самым повышать уязвимость слизистой оболочки желудка к кислотно-пептическому повреждению.
- Кроме того, иммунный ответ организма на H. pylori вызывает воспалительную реакцию, которая в свою очередь усугубляет повреждение ткани.
- Хроническое воспаление, индуцированное H. pylori, приводит к нарушению секреторной функции желудка разной степени выраженности и развитию хронического гастрита.
Считается, что именно H. pylori является причиной перехода от хронического воспаления к атрофии и последующей метаплазии. Запуск процесса канцерогенеза связан, предположительно, с окислительным стрессом, обусловленным индукцией синтеза оксида азота в ответ на воспаление, обусловленное наличием инфекции H. pylori.
Оксид азота может вызвать повреждение ДНК эпителиальных клеток, что ведет к активации каскада последовательных предраковых изменений слизистой оболочки желудка:
- хронический активный гастрит без атрофии →
- хронический атрофический гастрит →
- кишечная метаплазия (полная, неполная) →
- дисплазия →
- инвазивный рак [36].
Существует четыре серотипа H. pylori в зависимости от выработки микроорганизмами вакуолизирующего цитотоксина VacA и цитотоксинассоциированного белка CagA:
- серотип I (CagA+, VacA+),
- серотип Iа (CagA+, VacA–),
- серотип Ib (CagA–, VacA+),
- серотип II (CagA-, VacA–) [37].
- После транслокации CagA способен активировать или инактивировать некоторые специфические внутриклеточные сигнальные пути клетки хозяина.
- CagA нарушает механизмы, поддерживающие нормальную эпителиальную дифференцировку, включая адгезию клеток, полярность клеток и ингибирование миграции.
- Следствием этого может быть злокачественная трансформация клеток желудочного эпителия.
- Наиболее онкогенны серотипы I и Iа.
- Определение серотипа штаммов H. pylori у инфицированных лиц имеет важное прогностическое значение, так как у пациентов, у которых выявлены CagА(+)-штаммы H. pylori, риск развития язвенной болезни и РЖ значительно выше, чем у инфицированных CagА(–)-штаммами [38].
Цитотоксин VacA ведет себя как пассивный переносчик мочевины, который потенциально способен увеличить проницаемость желудочного эпителия для мочевины, тем самым создавая благоприятную среду для инфицирования H. pylori.
Хроническая инфекция H. pylori и вызываемый ею атрофический гастрит достоверно повышают риск развития РЖ обоих типов, а эрадикационная терапия снижает этот риск.
Однако возникновение опухоли в желудке нельзя объяснить воздействием только инфекционного фактора. Известно, что РЖ развивается у очень небольшого процента лиц, инфицированных H. pylori. Заболеваемость по регионам также не совпадает с инфицированностью (самая высокая инфицированность в Африке, где низкая заболеваемость РЖ) [39].
Наконец, парадоксальным является тот факт, что среди больных с дуоденальными язвами, вызванными H. pylori, заболеваемость РЖ не повышается или даже снижается.
Степень вирулентности различных штаммов H. pylori, а также полиморфизм генов цитокинов хозяина непосредственно влияют на исходы H. pylori-инфекции, включая малигнизацию.
Все это свидетельствует о том, что РЖ –полиэтиологичное заболевание, возникающее при одновременном воздействии и взаимодействии множества факторов, одним из которых может быть данный инфекционный агент.
Вирус Epstein–Barr (EВV)
Вторым инфекционным фактором, который может быть ответствен за развитие РЖ, является EBV: ДНК этого вируса обнаруживают у 5–10% больных РЖ [40].
EBV-ассоциированный РЖ имеет клинические особенности:
- чаще развивается у мужчин,
- локализуется преимущественно в кардии или теле желудка,
- реже метастазирует в лимфатические узлы [41].
- У больных EBVассоциированным раком РЖ чаще выявляют его диффузный тип.
- Однако прогноз при EBVассоциированном РЖ все же лучше, чем при других формах.
Факторы внешней среды и образа жизни
К факторам внешней среды и образа жизни относят
- курение табака (в 1,5 раза повышает риск развития РЖ), ожирение (OR1,22 при BMI>25),
- низкий социальный статус и
- ряд профессиональных вредностей, в частности связанные с добычей угля, производством резины и металла [42].
Риск развития РЖ может повышаться в результате медицинских воздействий.
- Одним из основных ятрогенных факторов является резекция желудка в анамнезе, при этом злокачественная трансформация после резекции желудка по Бильрот II наблюдается чаще, чем после резекции по Бильрот I [43]. Это может быть связано с рефлюксом желчи и панкреатического сока, изменяющих pH в желудке и способствующих поддержанию хронического воспаления слизистой оболочки. Риск развития РЖ возрастает с увеличением времени, прошедшего после оперативного вмешательства.
- Длительный (в течение нескольких лет) прием ингибиторов протонной помпы и Н2-блокаторов, а также
- лучевое воздействие на брюшную полость по поводу лимфомы Ходжкина, особенно в сочетании с прокарбазином (OR=77,5), также являются ятрогенными факторами развития РЖ [44].
Эндогенные факторы риска
Строго наследственными формами РЖ в настоящее время считают три генетических синдрома:
- Наследственный рак желудка диффузного типа (НРЖДТ), вызываемый мутациями гена CDH1, который отвечает за экспрессию белка межклеточных контактов E-кадгерина (данная форма РЖ рассмотрена выше);
- синдром GAPPS (от англ. — gastric adenocarcinoma & proximal polyposis of the stomach);
- синдром фамильного РЖ кишечного типа (FIGC).
Наследственный рак желудка диффузного типа
- Наиболее тяжелым из этих синдромов является НРЖДТ, при котором вероятность развития РЖ в течение жизни превышает 80%.
- Средний возраст больных, в котором возникает опухоль при НРЖДТ, составляет 38 лет.
- Одной из наиболее вероятных генетических основ данного синдрома является мутация гена CDH1, которая наследуется по аутосомно-доминантному типу [45].
Согласно международным рекомендациям 2015 г., НРЖДТ можно заподозрить при наличии одного из следующих критериев:
- если имеется как минимум два случая развития РЖ в семье, из которых хотя бы в одном возник РЖДТ;
- если РЖДТ развился у пациента в возрасте до 40 лет;
- если имеется сочетание РЖДТ и долькового рака молочной железы у одной больной или у близких родственников при возникновении любой из этих опухолей в возрасте до 50 лет.
- Данная форма наследственного РЖ характеризуется ранней манифестацией, агрессивным течением и крайне неблагоприятным прогнозом.
- Сочетание клинических критериев НРЖДТ и подтвержденной мутации CDH1 может явиться показанием к выполнению профилактической гастрэктомии в молодом возрасте [46].
Синдром GAPPS (от англ. — gastric adenocarcinoma & proximal polyposis of the stomach)
- Синдром GAPPS обусловлен развитием полипоза фундальных желез в проксимальной части желудка без поражения двенадцатиперстной и толстой кишки.
- Тип наследования данной патологии аутосомно-доминантный, однако характерна неполная пенетрантность.
- Рак при этой наследственной патологии локализуется исключительно в проксимальной части желудка [47].
Синдром фамильного РЖ кишечного типа (FIGC).
- Наличие синдрома FIGC у пациента с отягощенным семейным анамнезом по РЖ следует заподозрить при выявлении опухоли кишечного типа и отсутствии полипов в желудке [48].
- Тип наследования данной патологии также аутосомно-доминантный.
Генетические нарушения, ответственные за развитие двух последних синдромов (GAPPS, FIGC), не установлены.
Риск развития РЖ повышен при наследственных синдромах, сопровождающихся полипозом кишечника:
- семейном аденоматозном полипозе,
- наследственном неполипозном колоректальном раке (до 10%),
- синдроме Li Fraumeni, синдроме Peutz–Jeghers и других [49–50].
При наблюдении за этими больными необходимы не только исследование толстой кишки, но и выполнение гастроскопии.
Заключение
Таким образом, РЖ — полиэтиологичное заболевание, развивающееся под воздействием и при взаимодействии различных факторов риска, как внешних, так и внутренних. Это одна из немногих форм рака, в развитии которой была доказана роль инфекционных агентов. Две основные формы РЖ (кишечного типа и диффузного типа) имеют различный патогенез и факторы риска. Оценка факторов риска позволяет осуществлять профилактику данного заболевания и формировать группы риска для регулярного эндоскопического исследования.
Список литературы:
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.














.jpg)





.png)


.jpg)
















Комментарии