- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Стандарты качественной колоноскопии (пособие для врачей)
| Авторы: | С. В. Кашин, Е. Л. Никонов, Н. В. Нехайкова, Д. В. Лилеев 1 2019г. |
| Об авторах: |
1. ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия |
Аннотация:
Пособие для врачей посвящено одному из наиболее востребованных на настоящий момент эндоскопических исследований — колоноскопии. В работе изложены: актуальность эндоскопического исследования толстой кишки, вопросы качественной подготовки толстой кишки к исследованию, технического обеспечения метода, методики выполнения исследования, современные стандарты оформления протокола колоноскопии, а также сроки динамического контроля последующих исследований. В пособии подробно представлены современные критерии оценки качества колоноскопии.
Пособие предназначено для практических врачей-эндоскопистов, врачей-гастроэнтерологов, хирургов, колопроктологов и научных работников в области клинической гастроэнтерологии, хирургии, онкологии и эндоскопии.
Организация-разработчик: кафедра гастроэнтерологии ФДПО Российского научно-исследовательского медицинского университета им. Н.И. Пирогова.
Данное пособие утверждено экспертным советом по науке Департамента здравоохранения города Москвы 08.02.2019 года (протокол № 3 от 03.03.2019)
EndoExpert.ru.jpg)
Полный текст статьи:
Раздел 1. Введение
Колоректальный рак (КРР) занимает одно из ведущих мест в мире в структуре заболеваемости и смертности от онкологических заболеваний. В США и Европе КРР в структуре смертности от онкозаболеваний занимает второе место. Ежегодно по всей Европе и в США регистрируется почти 427 000 новых случаев заболевания КРР и 195 000 случаев смерти от КРР [1, 2]. На территории США и Европы были проведены исследования, доказывающие, что колоноскопия является чувствительным методом для обнаружения предраковой патологии толстой кишки. Проведенные исследования показали, что при использовании колоноскопии как метода скрининга КРР происходит снижение уровня заболеваемости КРР на 60—90%. Ежегодно в Италии проводят более 1,5 млн колоноскопий, около 40% из них проводятся с целью скрининга колоректальных полипов и рака [3].
КРР, оставаясь одной из наиболее распространенных форм опухолей органов системы пищеварения, относится к числу заболеваний, в отношении которых наиболее эффективны профилактические меры. Выявление рака на ранних стадиях и его профилактика на популяционном уровне решаются посредством скрининга на наличие опухоли и предраковых заболеваний как в группах риска, так и в определенных возрастных группах, с учетом кумулятивного риска возникновения рака (в зависимости от возраста) [4]. Диагностика опухоли на начальных стадиях до развития клинических симптомов позволяет провести малоинвазивное и органосохраняющее лечение, приводящее к излечению большинства пациентов без потери качества жизни. Кроме этого, эндоскопическое удаление выявленных при скрининге полипов толстой кишки снижает риск их перерождения в злокачественную опухоль и таким образом снижает заболеваемость КРР. К наиболее эффективным и популярным методикам скрининга КРР в популяции среднего риска в возрасте 50—75 лет относят эндоскопическое исследование толстой кишки (сигмоскопию, колоноскопию) и лабораторное исследование содержимого кишечника на скрытую кровь [5, 6]. Проводятся исследования эффективности новых технологий скрининга, таких как рентгенологическое исследование толстой кишки (колонография), выполненное с применением современного компьютерного томографа — виртуальная колоноскопия [7], а также эндоскопическое исследование с помощью видеокапсулы [8]. Сигмоскопия и колоноскопия обладают рядом преимуществ перед другими методами скрининга, так как позволяют не только выполнить детальный осмотр всей поверхности слизистой оболочки кишки, но и биопсию обнаруженных патологических изменений, а также провести удаление выявленных образований непосредственно во время проведения скринингового исследования [9].
В течение последних десятилетий показатели заболеваемости и смертности от КРР снижаются, особенно в странах Европы, в США и Японии, где широко внедряются программы скрининга КРР. В нашей стране эти показатели имеют тенденцию к росту, что может быть обусловлено недостаточным внедрением в клиническую практику методов скрининга и эффективной диагностики и лечения предопухолевой патологии. Из всех методов скрининга эндоскопическое исследование толстой кишки — колоноскопия — является наиболее эффективным в диагностике предопухолевой патологии и рака на ранних стадиях развития опухолевого процесса. В связи с этим вопросы совершенствования эндоскопических методик диагностики КРР, повышения качества эндоскопического исследования остаются по-прежнему в центре внимания широкого круга эндоскопистов, гастроэнтерологов, хирургов и онкологов.
Современная колоноскопия, проводимая с целью диагностики предраковых изменений и ранних форм рака, предполагает использование всех современных технологий, позволяющих выявлять патологические образования даже самых небольших размеров: хромоскопии, узкоспектральной эндоскопии, увеличительной эндоскопии, аутофлюоресцентной эндоскопии. Клиническое применение современного диагностического алгоритма, включающего эффективную подготовку кишечника пациента, адекватную седацию во время колоноскопии, рутинное использование хромоскопии и новых оптических технологий эндоскопического оборудования, позволят улучшить результаты диагностики и повысить популярность эндоскопического исследования у пациентов, подлежащих скринингу. Для этого современному специалисту необходимы четкие методические рекомендации, учитывающие все этапы организации колоноскопии в лечебном учреждении, а также включающие критерии качества эндоскопического исследования толстой кишки, проводимого с целью скрининга полипов и рака.
Раздел 2. Критерии качественной колоноскопии
В странах, где организованы национальные программы скрининга КРР, создаются специальные рекомендации, направленные на снижение риска осложнений во время исследований, определяются стандарты и показатели (индикаторы) качества колоноскопии. Владения техникой проведения колоноскопии недостаточно для выполнения высококачественной колоноскопии, важно соблюдение целевых показателей индикаторов качества колоноскопии. Главная ценность колоноскопии, как скринингового метода, зависит от качества проведенного осмотра слизистой оболочки толстой кишки, а результаты являются решающим фактором для определения интервала последующих колоноскопий.
Европейское Общество Гастроинтестинальной Эндоскопии (European Society of Gastrointestinal Endoscopy — ESGE) и Европейское Общество Гастроэнтерологов (United European Gastroenterology) определили качество эндоскопического исследования как самый главный приоритет. Из-за большой разницы между врачами-эндоскопистами в отношении качества, выполняемой ими колоноскопии и ввиду внедрения национальных программ скрининга КРР, качество в колоноскопии признано приоритетной задачей для рабочей группы ESGE. Цель рабочей группы ESGE — определение ключевых показателей эффективности выполнения колоноскопии. Основные показатели эффективности выполнения колоноскопии должны были отвечать следующим требованиям: доказанное влияние на клинические результаты или качество жизни, простота методов и способов измерения, восприимчивость к совершенствованию, возможность применения на всех уровнях эндоскопической службы.
В 2012 и 2017 г. ESGE представило список ключевых показателей эффективности выполнения колоноскопии [10, 11]:
1) уровень адекватной подготовки толстой кишки;
2) показатель интубации слепой кишки;
3) показатель выявления аденом (Adenoma detection rate — ADR);
4) применение соответствующей техники полипэктомии;
5) уровень развития осложнений;
6) показатель переносимости пациентом колоноскопии;
7) соблюдение соответствующих интервалов по наблюдению после полипэктомии.
Согласно рекомендациям Американского Общества Гастроинтестинальной Эндоскопии (American Society Gastrointestinal Endoscopy — ASGE), все индикаторы качества колоноскопии разделены на три этапа относительно исследования [12]: первый этап — до момента проведения колоноскопии, второй этап — во время проведения колоноскопии, третий этап — после колоноскопии.
Индикаторы качества колоноскопии на этапе, предшествующем проведению обследования:
1. Соблюдение рекомендаций по назначению колоноскопии. Колоноскопия должна быть оправданно назначена по соответствующим показаниям. Целевой показатель: ≥80%.
2. Информированное добровольное согласие. Пациенты или их представители должны подписать форму информированного добровольного согласия. Все риски, связанные с колоноскопией, возможные осложнения, преимущества и альтернативные методы должны быть понятно разъяснены до начала проведения колоноскопии. Целевой показатель: ≥90%.
3. Соблюдение рекомендованных временных интервалов при проведении последующих колоноскопий. Интервалы для последующих колоноскопий должны быть соблюдены, основываясь на результатах осмотра (без выявленной патологии, полипы или рак). Целевой показатель: ≥90%.
4. Соблюдение интервалов между последующими колоноскопиями, проводимыми с целью наблюдения при воспалительных заболеваниях кишечника: болезни Крона и неспецифическом язвенном колите. ASGE рекомендует проведение колоноскопии 1—2 раза в год первые 8—10 лет с момента установления диагноза в связи с повышенным риском развития КРР. Целевой показатель: ≥90%.
Индикаторы качества колоноскопии на этапе выполнения эндоскопического исследования толстой кишки должны учитывать следующие показатели:
1. Качество подготовки толстой кишки. Врач-эндоскопист должен зарегистрировать качество подготовки толстой кишки в отчете по проведенной колоноскопии. Для оценки уровня очистки толстой кишки используют различные оценочные шкалы. Но можно также использовать термины «адекватная» и «неадекватная», характеризующие подготовку к колоноскопии. Качество подготовки толстой кишки напрямую влияет на интервал перед последующей колоноскопией. Повторная колоноскопия при «неадекватной» подготовке толстой кишки должна быть проведена повторно в течение 1 года. Целевой показатель: ≥98%. Число пациентов, которым рекомендуется повторить колоноскопию в течение 1 года, не должно превышать 15%. Целевой показатель для адекватной подготовки толстой кишки: 85%.
2. Интубация слепой кишки с фотодокументацией. При колоноскопии обязательно проведение колоноскопа до купола слепой кишки (Cecal Intubation Rate — CIR) с четкой идентификацией и фотографиями основных анатомических ориентиров слепой кишки. Целевой показатель при скрининговых колоноскопиях: >95%.
3. Показатель выявленных аденом у пациентов при скрининговой колоноскопии должен превышать 20%.
4. Время выведения колоноскопа (Colonoscopy Withdrawal Time — CWT) должно быть измерено. Целевой показатель: >98%. При скрининговой колоноскопии без выявления патологии время выведения колоноскопа должно превышать 6 мин.
5. Соблюдение рекомендаций по полипэктомии. Полипы на ножках и на широком основании размером до 2 см должны быть удалены методикой эндоскопической резекции слизистой оболочки толстой кишки с полипом. Только в случае невозможности выполнения эндоскопической резекции эти пациенты должны быть направлены на хирургическое лечение.
К индикаторам качества колоноскопии, которые учитываются на этапе после проведения колоноскопии, относятся следующие:
1. Осложнения. Частота перфораций после проведения колоноскопии не должна превышать 1 на 500 осмотров, в случае скрининговых колоноскопий — 1 на 1000 осмотров. Частота кровотечения после полипэктомии должна быть <1%, при этом учитывается как остро возникшее кровотечение, так и отсроченное.
2. Соблюдение рекомендаций по назначению последующих колоноскопий. Интервалы для последующих колоноскопий определяются после результатов гистологического исследования и должны быть обязательно зарегистрированы в медицинской документации.
Европейское и Американское общества гастроинтестинальной эндоскопии (ESGE и ASGE) из всех вышеперечисленных индикаторов качества колоноскопии выделяют приоритетные, наиболее важные при оценке организации проведения скрининговой колоноскопии, оценки профессиональной подготовки врача-эндоскописта. К ним относятся качество подготовки кишки к исследованию, показатель выявления аденом, показатель интубации слепой кишки, время осмотра кишки при выведении эндоскопа от слепой до прямой кишки.
1. Качество подготовки толстой кишки к исследованию: минимум в 90% скрининговых исследований качество очистки кишечника должно быть оценено как адекватное или лучше, предпочтительно — 95%.
2. Частота достижения купола слепой кишки: минимальный показатель интубации слепой кишки 90%, предпочтительно — 95%, фотоизображение купола слепой кишки.
3. Показатель выявления аденом: минимальный показатель выявления аденом при скрининговых или диагностических колоноскопиях у лиц старше 50 лет — ≥25%.
4. Время извлечения/выведения колоноскопа (время осмотра на выходе): минимальное время 6 мин для диагностических исследований, предпочтительно 10 мин.
5. Описание морфологии неполиповидных образований: по Парижской классификации.
1. Качество подготовки толстой кишки к исследованию: минимум в 90% скрининговых исследований качество очистки кишечника должно быть оценено как адекватное или лучше, предпочтительно — 95%. Согласно рекомендациям ESGE [10], уровень очистки толстой кишки перед колоноскопией должен быть оценен и должен быть адекватным (хорошая и отличная подготовка кишечника по данным оценочной шкалы) не менее чем в 90% проведенных скрининговых колоноскопий (рис. 1).
Шкала Оттава. Оценка возможности осмотра слизистой оболочки от 0 до 4 в каждом сегменте:
— Отличная (0) — cлизистая оболочка толстой кишки хорошо визуализируется. Минимальное количество остаточной жидкости.
— Хорошая (1) — хорошая визуализация слизистой оболочки. Минимальное количество мутной жидкости.
— Достаточная (2) — необходимо убрать с помощью отсоса остаточную жидкость с пузырьками и жидкие каловые массы. Приемлемая визуализация слизистой оболочки.
— Плохая (3) — в просвете кишки полутвердые каловые массы. Необходимо отмыть и извлечь с помощью отсоса содержимое толстой кишки, чтобы получить приемлемую визуализацию слизистой оболочки.
— Неадекватная (4) — в просвете кишки полутвердые и твердые каловые массы, препятствующие осмотру. Омыть содержимое кишки и извлечь с помощью отсоса не представляется возможным.
Количество жидкости во всей кишке, от 0 до 2:
— Низкое — 0
— Среднее — 1
— Большое — 2
Шкала Бостон. Количественная 4-балльная система оценки подготовки проводится по трем сегментам: правые отделы толстой кишки (слепая и восходящая ободочная кишка), средние отделы (поперечно-ободочная кишка, включая печеночный и селезеночный изгибы) и левые отделы (нисходящая и сигмовидная ободочная кишка, прямая кишка).
Каждому из трех отделов выставляется оценка от 0 до 3 баллов:
— Отличная (3) — отличная визуализация слизистой оболочки без наличия остаточной жидкости в кишке.
— Хорошая (2) — небольшое количество мутной жидкости с примесью жидкого кала. Хорошая визуализация слизистой оболочки.
— Плохая (1) — в кишке жидкие и твердые каловые массы.
— Неадекватная (0) — в кишке твердый стул, слизистая оболочка не визуализируется.
Общее количество баллов суммируется, и максимальное их количество, соответствующее идеальному качеству подготовки, в сумме составляет 9. Адекватной считается подготовка с общей суммой баллов 6 и/или при условии, что общая сумма баллов по каждому сегменту >2.
Для применения данной шкалы в своей практике рекомендуется предварительно пройти самостоятельный тренинг по обучающей программе: www: cori.org/bbps/.
Пример описания в протоколе исследования отличное, 9 баллов (3, 3 и 3 по Качество подготовки: каждому сегменту) по Бостоновской шкале.
Оценка возможности осмотра слизистой оболочки от 0 до 3 баллов в каждом сегменте:
— отличная (3 балла) — отличная визуализация слизистой оболочки без наличия остаточной жидкости в кишке;
— хорошая (2 балла) — небольшое количество мутной окрашенной жидкости с примесью жидкого кишечного содержимого, но при этом визуализация слизистой оболочки хорошая;
— плохая (1 балл) — в кишке жидкие и твердые каловые массы, видна только часть слизистой оболочки;
— неадекватная (0 баллов) — в кишке твердое (плотное) кишечное содержимое, слизистая оболочка не визуализируется из-за невозможности отмыть ее от плотного кишечного содержимого, данный отдел не подготовлен к исследованию.
Независимо от использованной шкалы для оценки уровня очистки толстой кишки врач-эндоскопист должен задокументировать качество подготовки толстой кишки, основываясь на возможности определять полипы после того, как остаточная жидкость и кишечное содержимое по возможности будут удалены [12]. Этот индикатор качества является одним из наиболее важных для врача, выполняющего колоноскопию, и пациента, которому необходимо провести обследование таким образом, чтобы не пропустить ранние формы рака и другие мельчайшие структурные изменения слизистой оболочки кишечника. Эффективная очистка толстой кишки — основополагающий фактор для выполнения высококачественной колоноскопии.
Некоторые практикующие эндоскописты для характеристики уровня подготовки толстой кишки перед колоноскопией используют такие термины, как адекватная и неадекватная подготовка. При адекватной подготовке толстой кишки возможно определение полипов размером >5 мм [33]. В случае неадекватной подготовки толстой кишки рекомендовано выполнить повторную колоноскопию в течение 1 года [12]. Адекватная подготовка толстой кишки оптимизирует показатель интубации слепой кишки, тогда как плохая подготовка ассоциирована с удлинением времени колоноскопии и снижением показателя выявления аденом [34, 35].
При выборе препарата и режима приема слабительного препарата необходимо внимательно оценить такие моменты, как наличие у пациента печеночной, почечной, сердечной недостаточности и возможное использование диуретиков в настоящий момент. Препараты на основе фосфата соды могут лучше переноситься пациентом за счет меньшего объема раствора, но они не безопасны, особенно, когда применяется у пожилых пациентов с почечной недостаточностью [36]. Переносимость большого объема (4 л) раствора полиэтиленгликоля, особенно у пожилых пациентов, может быть плохой. Улучшает переносимость большого объема слабительного препарата деление дозы (split-dose) на два этапа, т. е. половина дозы слабительного препарата принимается вечером накануне исследования, а вторая половина — утром в день исследования, что также повышает качество подготовки толстой кишки.
Алессандро Репичи (Милан, Италия) и соавт. провели исследование, в котором оценили эффективность и общую приемлемость для разных слабительных препаратов, используемых для подготовки толстой кишки перед колоноскопией. В исследовании 57,3% пациентов применяли 4 л ПЭГ (полиэтиленгликоль), 29,5% пациентов использовали 2 л ПЭГ и 13,2% пациентов использовали 2 стакана слабительного раствора, содержащего натрия фосфат/магния цитрат/натрия пикосульфат. Общая приемлемость была выше в группах, применяющих 2 л ПЭГ и 2 стакана слабительного раствора. Хорошая очистка толстой кишки была в группах, принимающих 2 и 4 л ПЭГ, уровень очистки в этих группах был значительно лучше, чем в группе пациентов, использующих 2 стакана слабительного раствора (натрия фосфат/магния цитрат/натрия пикосульфат). Таким образом, исследование показало, что 2 и 4 л ПЭГ предоставляли более эффективную очистку толстой кишки перед колоноскопией. Но из-за в 2 раза меньшего объема слабительного раствора в группе пациентов, использующих 2 л ПЭГ, приемлемость подготовки была значительно выше [37].
Также к важным факторам, улучшающим качество подготовки толстой кишки, является временной промежуток между окончанием приема слабительного препарата и началом проведения колоноскопии. Проведенные исследования показали, что качество подготовки ухудшается, если этот интервал увеличивается, особенно это касается правых флангов толстой кишки [38]. Эндоскописты, у которых >15% осмотров с неадекватной подготовкой, должны пересмотреть свои протоколы по подготовке толстой кишки, включая более детальное обучение пациента всем правилам безопасной и эффективной подготовки кишечника к колоноскопии, выбор наиболее эффективного и безопасного слабительного препарата, выбор режима приема слабительного препарата.
2. Частота достижения купола слепой кишки: минимальный показатель интубации слепой кишки 90%, предпочтительно — 95%, фотоизображение купола слепой кишки. Показатель интубации слепой кишки (Cecal Intubation Rate — CIR) определяется как число колоноскопий, при которых эндоскоп был заведен в купол слепой кишки с обязательным предоставлением фотодокументации основных ориентиров слепой кишки. Согласно рекомендациям ESGE [10], показатель интубации слепой кишки должен составлять не менее 90% и подтверждаться наличием фотографий устья червеобразного отростка и илеоцекального клапана. Из этого числа исключаются случаи обструктивного рака, требующие хирургического лечения. Полный осмотр толстой кишки — это основа скрининговой колоноскопии. Медиальная стенка слепой кишки между устьем червеобразного отростка и илеоцекальной заслонкой не визуализируется на расстоянии. Интубация слепой кишки подразумевает заведение эндоскопа в слепую кишку и касание кончиком эндоскопа устья червеобразного отростка. ESGE рекомендует обязательно подсчитывать показатель интубации слепой кишки. Низкое значение этого показателя ассоциировано с высоким уровнем интервального проксимального рака толстой кишки [20]. Быстрое и точное заведение эндоскопа в слепую кишку является косвенным признаком мастерства эндоскописта. Однако существует ряд факторов, влияющих на успешное заведение колоноскопа в слепую кишку. По мере увеличения возраста пациента и увеличения индекса массы тела снижаются шансы на успешное заведение эндоскопа в слепую кишку [21, 22]. Использование эндоскопа с изменяющейся жесткостью повышает шансы на успешное заведение колоноскопа в слепую кишку [23]. Интубация слепой кишки всегда должна быть подтверждена фотодокументацией основных ориентиров слепой кишки. Первая фотография — устье червеобразного отростка — должна быть сделана на расстоянии от 2 до 4 см и включать слепокишечную складку. Вторая фотография — вход в слепую кишку — должна охватывать всю слепую кишку и илеоцекальный клапан. Если исследование прекращено по ряду причин, то должны быть предоставлены фотографии тех состояний, по причине которых исследование было прекращено [12]. На случаи с плохой подготовкой толстой кишки поправок не делается, т. е. они входят в подсчет показателя интубации слепой кишки. Этот факт позволяет выявлять эндоскопические отделения, где уровень очистки толстой кишки оценивается как субоптимальный, и проводить анализ подготовки толстой кишки с целью улучшения уровня очистки перед колоноскопией [10].
3. Показатель выявления аденом: минимальный показатель выявления аденом при скрининговых или диагностических колоноскопиях у лиц старше 50 лет — ≥25%. Показатель выявленных аденом и показатель выявленных полипов толстой кишки (Polyp Detection Rate — PDR). Показатель выявленных аденом — это отношение числа колоноскопий, при которых выявлена одна или несколько гистологически подтвержденных аденом к общему числу выполненных колоноскопий [10]. Показатель выявленных полипов — это отношение числа колоноскопий, при которых выявлен один или несколько полипов, к общему числу выполненных колоноскопий. Значение показателя выявленных аденом при правильной организации скрининговой колоноскопии должно быть при обследовании женщин не менее 15%, а мужчин — не менее 25% и в среднем превышать 20% [13]. Обнаружение аденом и раннего рака является основой колоноскопии, проводимой с целью скрининга колоректальных полипов и рака. Данные британского и американского исследований по скринингу КРР показывают, что удаление аденом толстой кишки снижает риск последующего развития рака толстой кишки [14].
Показатель выявленных аденом коррелирует с показателем пропущенного КРР. Исследование M. Kaminski и соавт. [15] выявило тесную связь между показателем выявленных аденом и риском развития интервального рака (p=0,008). Интервальный рак был определен как колоректальная аденокарцинома, обнаруженная в момент между скрининговой колоноскопией и последующей пост-скрининговой колоноскопией. В исследовании анализировали полученные данные по показателю выявления аденом при колоноскопиях, проводимых с целью скрининга, и данные по интервальным ракам из регистра по заболеваемости КРР. Проведенное исследование показало, что уровень показателя выявленных аденом ниже 20% был значимо связан с возрастанием риска интервального КРР по сравнению с уровнем показателя выявления аденом 20% и выше [15].
В 2014 г. исследование D. Corley и соавт. [16] показало, что увеличение показателя выявления аденом на 1% снижает заболеваемость КРР на 3% и сокращает смертность от КРР на 5%. Высокий уровень выявления аденом был ассоциирован со снижением риска развития как проксимального, так и дистального КРР в одинаковой степени для мужчин и для женщин.
Ряд исследований [17] демонстрируют хорошую корреляцию между показателем выявленных аденом и показателем выявленных полипов толстой кишки. Однако показатель выявленных аденом более соответствует для оценки качества колоноскопии, потому что показатель выявленных полипов включает в себя число всех полипов, выявленных на колоноскопии, — и число аденом, и число гиперпластических полипов.
В последнее время все чаще звучит вопрос: является ли показатель выявленных аденом оптимальным показателем качества осмотра слизистой оболочки толстой кишки? В литературе представлен ряд проблем, связанных с показателем выявленных аденом. Во-первых, этот показатель требует ручного ввода и дополнительной работы от эндоскопистов. Во-вторых, необходима устойчивость врача к игровому поведению (gaming), когда действия эндоскописта направлены на достижение цели, но не ведут к оптимизации обнаружения предраковых изменений. Это явление названо «one and done», когда врач при проведении колоноскопии находит одно образование с эндоскопическими признаками аденомы и перестает внимательно осматривать оставшиеся участки слизистой оболочки толстой кишки [12]. Возможно, более оптимальным показателем качества осмотра слизистой оболочки толстой кишки может стать индекс выявления аденом (Adenoma Detection Index — ADI). Индекс выявления аденом определен как общее количество выявленных аденом, деленное на общее число выполненных колоноскопий [10]. Он отражает показатель качества осмотра слизистой оболочки по всей длине толстой кишки и более точно, чем показатель выявления аденом, фиксирует разницу между работой эндоскопистов в отношении качества осмотра слизистой оболочки [18]. Использование индекса выявления аденом помогает преодолеть проблему «one and done». В настоящее время этот показатель используется в основном в клинических исследованиях [19]. Во многих странах, где существуют национальные программы скрининга КРР, показатель выявления аденом является самым важным индикатором качества скрининговой колоноскопии.
4. Время извлечения/выведения колоноскопа (время осмотра на выходе): минимальное время 6 мин для диагностических исследований, предпочтительно 10 мин. Время выведения эндоскопа из купола слепой кишки до анального канала (Colonoscopy Withdrawal Time — CWT) должно быть достаточным для детального осмотра всех отделов толстой кишки с целью визуализации полипов и КРР. Согласно рекомендациям ESGE [10], время выведения колоноскопа (CWT) должно быть измерено и составлять ≥6 мин не менее чем в 90% случаев.
Показатель CWT напрямую связан с показателями выявления полипов и аденом. Показатель выявления аденом снижается, когда время выведения колоноскопа из купола слепой кишки менее 6 мин. В 2006 г. R. Barclay и соавт. [24] одними из первых сообщили, что эндоскописты, у которых время выведения колоноскопа (CWT) из слепой кишки до анального канала было 6 мин и больше, выявляли большее количество колоректальных неоплазий, чем те, у кого время выведения колоноскопа было <6 мин (28,3 и 11,8% соответственно; p<0,001).
В исследовании T. Lee и соавт. [25] в 2011 г. был выполнен анализ показателей выявления аденом в зависимости от CWT. Были рассмотрены четыре группы показателей выявления аденом в зависимости от CWT. Результаты исследования представлены в табл. 1.
Исследование показало, что при возрастании CWT до 10 мин растет и показатель выявления аденом. Его возрастание происходит за счет обнаружения большего количества неоплазий размером менее 1 см, а также за счет выявления неоплазий в правых отделах толстой кишки. При дальнейшем увеличении CWT (≥11 мин) повышения показателя выявления аденом не наблюдается. Таким образом, данное исследование показывает, что оптимальное время выведения колоноскопа при скрининговой колоноскопии — 10 мин. Минимум в 6 мин рекомендован для случаев без проведения биопсии и полипэктомии. Скорость выведения колоноскопа — не единственный фактор, влияющий на показатель выявления полипов и аденом. Повышают показатель выявления полипов и аденом такие факторы, как аспирация внутрипросветной жидкости, внимательный осмотр за гаустрами [26], изменение позиции пациента, использование бускопана, использование дистального мягкого колпачка [27], применение хромоскопии [28], применение всех доступных технологий осмотра «слепых» зон в ободочной кишке за гаустрами [29].
5. Описание морфологии неполиповидных образований: по Парижской классификации. Информация представлена в разделе «Раздел 7. Стандарты оформления протокола колоноскопии».
Раздел 3. Плановая диагностическая колоноскопия
Показания к плановой диагностической колоноскопии
1. Выявленные по результатам рентгенологического исследования толстой кишки (ирригоскопии) изменения: рак толстой кишки, неясный или сомнительный диагноз рака толстой кишки при ирригоскопии, стриктуры, несоответствие между данными ирригоскопии и клинической картиной заболевания.
2. Проведение колоноскопии для установления сопутствующей или вторичной патологии толстой кишки: полипы верхних отделов пищеварительного тракта, полипы дистального отдела толстой кишки, выявленные при ректороманоскопии, патология смежных органов (эндометриоз, опухоли органов малого таза, забрюшинного пространства и органов брюшной полости), системные заболевания (коллагенозы, амилоидоз, васкулиты, лимфопролиферативные заболевания).
3. Жалобы и клинические признаки, характерные для поражения толстой кишки (нарушение акта дефекации — запоры, поносы, неустойчивый стул); выделение крови при акте дефекации, патологические примеси в кале (слизь, гной), положительный анализ кала на скрытую кровь, анемия неясного генеза.
4. Исследование пациентов, относящихся к группам риска (с неспецифическими воспалительными заболеваниями толстой кишки, семейным аденоматозом, с ранее диагностированными мелкими полипами, перенесшие удаление эпителиальных и неэпителиальных образований толстой кишки), перенесшие хирургические вмешательства на толстой кишке по поводу злокачественных новообразований, неспецифических колитов и т. д.
5. Наличие колостомы перед операцией по ее закрытию.
Противопоказания к плановой диагностической колоноскопии
К абсолютным противопоказаниям к эндоскопическому исследованию толстой кишки относятся все патологические состояния, при которых риск проведения осмотра превышает его диагностическую ценность, а результаты исследования не имеют принципиального значения для выбора тактики лечения пациента.
Абсолютные противопоказания:
1. Отказ пациента от выполнения исследования.
2. Острая фаза нарушения мозгового кровообращения.
3. Острая фаза инфаркта миокарда.
4. Тяжелые степени сердечно-сосудистой, легочной и смешанной недостаточности при ишемической болезни сердца и пороках сердца в стадии декомпенсации, при массивных эмболиях легочной артерии.
5. Нарушения ритма сердечной деятельности (пароксизмальная брадиаритмия, мерцательная аритмия с мерцанием предсердий или пароксизмы мерцательной аритмии, групповые желудочковые экстрасистолы в виде бигемении или тригемении, тяжелые степени поперечной блокады сердца).
6. Тяжелые клинические формы (молниеносные, фульминантные) воспалительных заболеваний толстой кишки (язвенный колит, болезнь Крона, ишемический колит, радиационный колит, дивертикулит).
7. Аневризма аорты или сердца.
8. Острые воспалительные инфильтраты брюшной полости, включая дивертикулит.
9. Подозрение на абсцесс брюшной полости.
10. Инфекционные заболевания (вирусные гепатиты, инфекционные колиты, ВИЧ-инфекция, СПИД) — в таких случаях плановая эндоскопия выполняется в условиях специализированного эндоскопического отделения.
Относительные противопоказания — заболевания, при которых, несмотря на тяжесть состояния пациента, исследование выполняется по жизненным показаниям, так как его результаты играют важную роль в установлении правильного диагноза и выборе оптимальной тактики лечения:
1. Острые воспалительные заболевания аноректальной зоны (анальная трещина, геморрой в стадии обострения, тромбоз геморроидальных узлов, парапроктит).
2. Перитонит.
3. Ранний послеоперационный период по поводу хирургического вмешательства на органах брюшной полости и малого таза.
4. Беременность (II и III триместры).
5. Гепатоспленомегалия.
6. Напряженный асцит.
7. Гидроторакс, гидроперикард.
8. Тяжелые нарушения свертывающей системы крови.
9. Геморрагические васкулиты.
Ограничения проведения плановой диагностической колоноскопии могут быть связаны с техническими моментами (например, плохая подготовка к исследованию) или с особенностями имеющейся патологии. К возможным ограничениям колоноскопии можно отнести спаечную болезнь (спаечный процесс) с фиксацией петель и формированием резких, несмещаемых перегибов кишки; выявленные макроскопические признаки дивертикулита при стертой клинической картине (клиническая картина дивертикулита явялется абсолютным противопоказанием к проведению колоноскопии); крупные вентральные грыжи, если при инсуффляции при колоноскопии происходит увеличение грыжевого выпячивания или в процессе введения эндоскоп оказывается в грыжевом мешке; болезнь Гиршпрунга в стадии субкомпенсации и декомпенсации.
Раздел 4. Качественная подготовка к исследованию
Одним из условий полноценной подготовки пациента к выполнению колоноскопии является предварительная консультация с врачом-эндоскопистом. Основные задачи предварительной беседы — анализ жалоб и анамнестических данных, уточнение показаний к исследованию, предоставление пациенту всей необходимой информации о предстоящем исследовании, его эмоциональная подготовка, налаживание контакта и доверия к врачу. Благоприятный настрой пациента и понимание важности данного исследования улучшают качество подготовки, облегчают проведение и повышают эффективность колоноскопии.
Предварительная консультация, предшествующая эндоскопическому исследованию, должна включать:
1) обсуждение показаний к исследованию с учетом конкретной клинической ситуации;
2) обсуждение подготовки к исследованию;
3) подробное описание самого хода исследования: как проводится эндоскоп, как и какие отделы кишечника осматриваются, роль нагнетаемого воздуха в просвет кишки, возможность смены положения пациента в зависимости от осматриваемого отдела кишки, а также возможность ручного пособия ассистента со стороны передней брюшной стенки пациента;
4) особое внимание следует уделить неприятным моментам колоноскопии (возникновение неприятных ощущений при нагнетании воздуха в просвет кишки, при прохождении эндоскопом изгибов кишки и т. д.), возможным неудачам, побочным эффектам, осложнениям и способам их разрешения;
5) ознакомление с формой информированного добровольного согласия пациента на исследование и подписание данного документа;
6) ответы на возникшие у пациента вопросы.
Также во время предварительной беседы рекомендуется получить сведения об общем состоянии здоровья пациента:
1) наличие заболеваний органов пищеварительной системы в анамнезе;
2) ранее проведенные рентгенологические исследования толстой кишки, эндоскопические исследования и/или операции (результаты, переносимость, осложнения);
3) ранее перенесенные операции, травмы, наличие водителя ритма сердца, других металлических имплантатов и др.;
4) наличие опухолевых и/или воспалительных заболеваний, в том числе органов пищеварительного тракта, у родственников;
5) наличие сопутствующей патологии: хронических заболеваний сердца, легких, сахарного диабета, глаукомы, эпилепсии, заболеваний щитовидной железы, заболеваний или состояний, связанных с повышенной кровоточивостью (частые носовые кровотечения, склонность к возникновению кровоподтеков), инфекционные заболевания (гепатит, СПИД и др.);
6) наличие аллергических реакций;
7) постоянный прием лекарственных средств, в том числе препаратов, разжижающих кровь (противовоспалительных и обезболивающих, включая аспирин, тромбоасс, гепарин и др.).
Для облегчения восприятия непростой для пациента медицинской информации можно использовать подготовленные специально для пациентов различные иллюстративные материалы — информационные буклеты, образовательные видеофильмы об актуальности и необходимости выполнения колоноскопии, о подготовке к данному исследованию и т. д. При этом информация должна быть доступна и понятна человеку без медицинского образования, следует избегать специфических медицинских терминов либо объяснять их значение.
На общем эмоциональном состоянии пациента и последующем проведении исследования отрицательно сказывается изобилие медицинской информации (содержание информированного согласия, объяснение этапов проведения исследования и т. д.), полученной непосредственно перед исследованием. В такой стрессовой обстановке пациент может забыть важные анамнестические данные, у него может усугубиться страх перед предстоящим исследованием, возникнуть вегетативные и гемодинамические расстройства. Мы считаем, что осмотр и беседу с пациентом, подписание информированного добровольного согласия лучше назначить заранее, а не в день исследования.
4.1. Информирование пациента
Согласно ст. 20 «Информированное добровольное согласие на медицинское вмешательство и на отказ от медицинского вмешательства» Федерального закона № 323-ФЗ от 21.11.11 (ред. от 29.07.17) «Об основах охраны здоровья граждан в Российской Федерации» необходимым предварительным условием медицинского вмешательства является информированное добровольное согласие гражданина или его законного представителя на медицинское вмешательство, на основании предоставленной лечащим врачом в доступной для него форме полной информации о целях и методах оказания медицинской помощи, связанном с ними риске, возможных вариантах медицинского вмешательства, о его последствиях, возможных осложнениях, а также о предполагаемых результатах исследования. Оформленный и подписанный пациентом и лечащим врачом бланк информированного добровольного согласия подшивается в медицинскую документацию пациента. При отказе пациента от колоноскопии пациенту должны быть разъяснены возможные последствия такого отказа, в том числе вероятность развития осложнений основного заболевания.
Информированное добровольное согласие — это медико-юридический документ, подтверждающий информированность пациента о сути предстоящего вмешательства, его назначении, особенностях проведения, возможных осложнениях и последствиях, а также добровольное согласие на это вмешательство либо отказ от него.
Форма информированного добровольного согласия пациента на выполнение эндоскопического исследования — колоноскопии — должно содержать следующие разделы:
1. Контактная информация о лечебном учреждении.
2. Информация о планируемом исследовании — краткое описание методики, длительность выполнения, диагностические и лечебные возможности.
3. Схема подготовки к колоноскопии.
4. Возможные осложнения колоноскопии и частота их возникновения.
5. Возможные альтернативные методы обследования.
6. Рекомендации после выполнения исследования.
7. Согласие или отказ на исследование: юридически состоятельная формулировка согласия или отказа пациента от эндоскопического вмешательства, завизированная личной подписью лечащего врача, врача-оператора, пациента или его законного представителя.
Согласно той же ст. 20, порядок оформления информированного добровольного согласия (или отказа) на медицинское вмешательство, форма информированного добровольного согласия утверждаются уполномоченным федеральным органом исполнительной власти.
Представляем пример информированного добровольного согласия на выполнение колоноскопии.
Уважаемый пациент! Рекомендованное Вам эндоскопическое исследование позволяет врачу осмотреть внутреннюю поверхность толстой кишки (колоноскопия) и дистальных отделов тонкой кишки (колоноилеоскопия) и выявить их заболевания. Это наиболее информативный метод исследования нижних отделов желудочно-кишечного тракта. Колоноскопия позволяет выявить воспалительные заболевания кишечника, дивертикулез, полипы (эпителиальные образования, доброкачественные опухоли) и рак толстой кишки на самых ранних его стадиях. Колоноскопия выполняется при помощи гибкой трубки небольшого диаметра — эндоскопа, на конце которого находится миниатюрная видеокамера. Во время исследования эндоскоп через задний проход проводят в кишечник. Проведение эндоскопа, как правило, не вызывает боли, однако возможен дискомфорт и ощущение вздутия живота. С целью уточнения диагноза во время колоноскопии могут применяться дополнительные методы: биопсия (взятие образцов ткани на анализ), хромоскопия (окраска слизистой оболочки специальными красителями) и др. Колоноскопия, как правило, выполняется после премедикации (внутримышечное введение спазмолитиков и/или обезболивающих медикаментов), а в необходимых случаях, при наличии медицинских показаний — под внутривенной седацией, т. е. во время медикаментозного сна. Средняя продолжительность исследования составляет 30—60 мин. Фото-, видеоматериалы и другие данные, полученные во время исследования, принадлежат клинике и могут быть использованы для научных и образовательных целей.
Подготовка к исследованию. От качества подготовки толстой кишки зависит успех проведенного исследования. После назначения данного исследования врач объяснит Вам порядок подготовки и выдаст на руки подробную инструкцию. Необходимо соблюдать все этапы рекомендованной подготовки: 1) за 2—3 дня до исследования рекомендуется соблюдение диеты с низким содержанием растительной клетчатки; 2) прием очищающего препарата — двухэтапная схема (раздельный прием препарата вечером и утром) или одноэтапная (утренняя) схема в зависимости от времени назначенного исследования. В день исследования принимать пищу не следует. Если Вы постоянно принимаете лекарственные средства, согласуйте режим и условия их приема с врачом. Просим Вас прибыть в отделение эндоскопии в назначенное время с медицинской документацией.
Возможные осложнения. Предстоящее Вам эндоскопическое исследование является инвазивным инструментальным вмешательством и, несмотря на низкий уровень побочных эффектов (не более 0,1%) и максимально бережное выполнение, все же несет в себе риск следующих осложнений: 1) перфорация органа; 2) пневмоперитонеум; 3) кровотечение; 4) сердечно-сосудистое расстройство; 5) местные и аллергические реакции; 6) обострение хронического заболевания. При возникновении вышеперечисленных осложнений может потребоваться госпитализация, неотложное интенсивное, эндоскопическое и оперативное лечение, общая анестезия.
После окончания исследования может сохраняться ощущение вздутия живота, которое пройдет после отхождения газов; если выполнялась биопсия, следует исключить физические нагрузки в течение суток. Не рекомендуется водить машину, управлять какими-либо механизмами или принимать важные решения в течение 1 ч, а при выполнении внутривенной седации — в течение суток. Проинформируйте врача при появлении необычных симптомов и любых тревожащих Вас обстоятельств в первые часы и дни после исследования.
Альтернатива колоноскопии. Эндоскопическое исследование является одним из самых достоверных методов диагностики. Однако в силу объективных причин его выполнение в полном объеме и постановка точного диагноза возможны не во всех случаях. Возможной альтернативой колоноскопии являются лучевые методы исследования (в первую очередь — рентгенологические).
Для полноценного выполнения колоноскопии необходимы: 1) адекватная подготовка кишечника к исследованию; 2) квалифицированная техника введения эндоскопа; 3) тщательный эндоскопический осмотр толстой кишки с применением дополнительных методик уточняющей диагностики.
Качественная подготовки толстой кишки к эндоскопическому исследованию включает три основных компонента:
1. Соблюдение диеты с низким содержанием клетчатки.
2. Современный малообъемный (2 л) препарат для очищения кишечника — макрогол 3350 (полиэтиленгликоль 3350/ПЭГ 3350) с аскорбатным комплексом.
3. Пеногаситель — симетикон.
4.2. Рекомендации по питанию перед подготовкой к колоноскопии
В зависимости от регулярности стула у пациента, за 2—3 дня до подготовки к колоноскопии рекомендуется соблюдать рацион питания с низким содержанием клетчатки.
Разрешенные продукты:
1) яйца, сыр, сметана, сливочное масло, йогурт
и кисломолочные продукты без добавок
и наполнителей
2) мясо, птица и рыба нежирных сортов (в отвар-
ном, паровом или тушёном виде)
3) сахар, мёд (не в сотах)
Разрешенные жидкости: бульоны (прозрачные, процеженные), сок без мякоти, чай, вода, безалкогольные неокрашенные напитки.
Разрешенные продукты и жидкости не должны содержать мелкие косточки, зерна, семена, отруби.
Запрещенные продукты:
1) все хлебобулочные, мучные и макаронные изделия;
2) овощи, включая картофель, зелень, грибы, морскую капусту;
3) крупы, каши, бобовые, злаковые, орехи, семечки, кунжут, мак, зерна, отруби и другие семена, специи;
4) жесткое мясо с хрящами, сосиски, колбасы, консервы, морепродукты;
5) фрукты, ягоды, включая сухофрукты, варенье, джем, мармелад, желе;
6) чипсы, гамбургеры, шоколад.
Также из рациона рекомендуется исключить следующие жидкости: алкоголь, газированные напитки, кофе, компот, кисель, молоко.
Любые другие продукты и жидкости, не входящие в список разрешенных, настоятельно рекомендуется также исключить из рациона.
При хронических запорах рацион питания нужно соблюдать в течение 5 дней. За 3–5 дней до процедуры начать или продолжить прием слабительных препаратов по рекомендации врача-гастроэнтеролога [43].
Режим приема пищи в день накануне колоноскопии
При двухэтапной схеме подготовки:
— утром легкий завтрак (согласно списку разрешенных продуктов и жидкостей);
— до 13:00 легкий обед (также согласно списку разрешенных продуктов и жидкостей);
— ужин только разрешенные жидкости (прозрачные бульоны, чай, сок без мякоти, вода, безалкогольные неокрашенные напитки).
При утренней одноэтапной схеме подготовки:
В день накануне колоноскопии: завтрак, обед и легкий ужин до 18:00: согласно списку разрешенных продуктов и жидкостей.
Утром в день исследования: только разрешенные прозрачные жидкости. после окончания подготовки можно выпить сладкий чай, прозрачные жидкости. Прекратить прием всех жидкостей следует не позже, чем за 2 ч до исследования [43].
4.3. Схемы и режимы современной малообъемной подготовки толстой кишки
Наиболее оптимальным способом очищения толстой кишки перед эндоскопическим исследованием является лаваж с помощью слабительных препаратов на основе полиэтиленгликоля (ПЭГ/макрогола), которые практически полностью заменили использовавшиеся для этой цели постановки сифонных клизм. С момента внедрения данной группы препаратов стандартным считался объем, равный 4 л.
Отмечено, что в настоящее время все препараты для очищения кишечника перед исследованиями и операциями можно условно разделить на две группы: препараты на основе макрогола:
1) МОВИПРЕП,
2) Фортранс,
3) Лавакол,
4) Эндофальк
и препараты на основе солевых слабительных:
1) Фосфо-сода на основе фосфата натрия,
2) Колокит на основе фосфата натрия,
3) Пикопреп на основе пикосульфата натрия с цитратом магния,
4) Эзиклен на основе трех сульфатов.
Особенностью действия макрогола является, то, что данная молекула, являясь крупной, не способна к всасыванию и поступлению в системный кровоток, а оказывает слабительное действие только в кишечнике [42, 48]. Таким образом, группа препаратов на основе макрогола является наиболее безопасной и входит во все ведущие клинические рекомендации по подготовке кишечника к колоноскопии.
Напротив, солевые слабительные, являясь небольшими молекулами, способны проникать в системный кровоток, оказывая влияние, например, на почки и сердце, а уже оставшееся часть солевого слабительного оказывает осмотическое действие в кишечнике [46, 47, 49, 50]. Следует отметить, что данная группа слабительных препаратов имеет определенные предупреждения, связанные с безопасностью. Так, фосфаты не рекомендованы ESGE для использования в рутинной практике из-за риска развития острой фосфатной нефропатии, а ASGE предупреждает об осторожности при использовании данной группы препаратов у пожилых людей и у пациентов с патологией почек. Препарат на основе трех сульфатов не включен в рекомендации ESGE. При воспалительных заболеваниях кишечника (ВЗК) или риске их возникновения ESGE рекомендует использование макрогола (ПЭГ), тк остальные препараты могут вызывать поражения слизистой кишечника, похожие на таковые при ВЗК. Было доказано, что при использовании пикосульфата натрия с цитратом магния и фосфата натрия возникновение поврежений слизистой оболочки кишечника, вызванное приемом препарата, в 10 раз более частое, чем при использовании ПЭГ [44, 45].
В выборе того или иного препарата для подготовки пациента к колоноскопии определенное значение также имеет сопутствующая патология, которая может ограничивать применение тех или иных слабительных. Например, в инструкции по медицинскому применению препарата на основе трех сульфатов указано, что препарат принимается с осторожностью у пациентов, которые получают лекарственные препараты, удлиняющие интервал QT [50]. Стоит отметить, что таких препаратов в настоящее время более 50, которые используются по разным показаниям в различных медицинских областях (кардиология, неврология и т. д.) [51]. Препарат МОВИПРЕП®, являясь, с одной стороны, препаратом на основе макрогола, а с другой стороны, малообъемным препаратом, занимает своего рода золотую середину между группой препаратов на основе макрогола, которые отличаются благоприятным профилем безопасности, и группой солевых слабительных, которые имеют небольшие объемы. [42].
Преимуществами современной малообъемной подготовки на МОВИПРЕП являются качественное очищение меньшим объемом препарата (2 л препарата Мовипреп® вместо 4 л растворов ПЭГ предыдущего поколения), более легкая переносимость пациентами, достоверно меньше частота развития тошноты и рвоты по сравнению с высокообъемным ПЭГ 4 л, а также более благоприятный профиль безопасности по сравнению с солевыми слабительными (фосфатами, сульфатами), что позволяет применять препарат у более широкого круга пациентов [42].
В упаковке препарата Мовипреп® имеются два саше «А» и два саше «Б» для приготовления 2 л раствора. Для приготовления 1 л раствора препарата необходимо содержимое одного саше, А и одного саше Б растворить в небольшом количестве воды, затем довести объем раствора водой до 1 л. и перемешать
Раствор следует пить дробно, небольшими глотками (залпом не пить!) по 250 мл (1 стакан) каждые 15 мин. Приготовленный раствор препарата можно пить охлажденным, через коктейльную трубочку (соломинку), в промежутках пить или запивать раствор небольшим количеством воды, чая и другой разрешенной жидкости, а также рассасывать леденцовую карамель (леденцы типа «барбарисок»), мед, лимон и т. п. Во время приема препарата рекомендуется соблюдать двигательную активность: ходить по квартире, выполнять круговые движения корпусом, наклоны в стороны, вперед-назад, приседания, можно выполнять самомассаж живота, особенно в случаях замедленного действия препарата.
Препарат начинает действовать индивидуально: в среднем в течение 1—2 ч от начала приема появляется первый стул. Активное действие препарата продолжается индивидуально: в среднем в течение 2 ч (в это время будет интенсивный жидкий стул). К моменту окончания подготовки стул должен измениться на прозрачную бесцветную или слегка окрашенную жидкость, что свидетельствует о готовности к обследованию. Закончить прием препарата необходимо за 2—4 ч до назначенного времени исследования, т. е. исследование желательно провести в промежутке от 2 до 4 ч после окончания приема препарата [42].
В клинической практике применяются различные схемы приема данного препарата — одноэтапная вечерняя, двухэтапная (раздельный прием дозы препарата вечером накануне и утром в день исследования), одноэтапная утренняя [42]. Одноэтапную вечернюю схему настойчиво не рекомендуется использовать перед эндоскопическими исследованиями из-за физиологических особенностей работы кишечника. При данной схеме из-за большого временного промежутка между окончанием приема препарата и началом эндоскопического исследования правые отделы толстой кишки вновь заполняются кишечным содержимым, что затрудняет детальный осмотр слизистой оболочки и приводит к неполноценному объему исследования [44]. Одноэтапная вечерняя схема больше подходит для хирургических вмешательств.
Для колоноскопии рекомендуется двухэтапная (раздельная) схема (рекомендации европейского и американского гастроэнтерологических обществ), а также одноэтапная утренняя схема в зависимости от времени назначенного исследования и организационных условий конкретной клиники [44].
Двухэтапная схема подготовки препаратом Мовипреп применяется, если колоноскопия назначена в первой половине дня — ориентировочно с 8:00 до 14:00.
Вечером накануне исследования необходимо выпить 1 л препарата Мовипреп® и 500 мл разрешенной жидкости (вода, прозрачный бульон, фруктовый сок без мякоти, безалкогольные неокрашенные напитки, чай). Утром в день исследования выпить еще 1 л препарата Мовипреп® и 500 мл разрешенной жидкости. В утреннюю порцию разрешенной жидкости необходимо добавить ¼ флакона пеногасителя симетикона в жидкой форме, т. е. в виде эмульсии или сиропа. Доступные в нашей стране препараты на основе симетикона — боботик, саб симплекс, симетикон, эспумизан, антифлат, симикол, инфакол, дисфлатил и др.
Время утреннего приема препарата выбрать так, чтобы от момента окончания приема препарата до исследования прошло минимум 2 ч и максимум 4 ч (табл. 2)
Утренняя одноэтапная подготовка рекомендуется при выполнении колоноскопии с 14:00 до 20:00. Конкретное время приема раствора обсуждается с врачом и зависит от того, на какое время назначено исследование. Подготовка проводится непосредственно в день выполнения колоноскопии.
Утром в день исследования выпить 2 л препарата Мовипреп, после каждого 1 л дополнительно принять по 500 мл разрешенной жидкости (вода, прозрачный бульон, фруктовый сок без мякоти, безалкогольные неокрашенные напитки, чай), во в последнюю порцию разрешенной жидкости необходимо добавить ¼ флакона пеногасителя симетикона в жидкой форме (табл. 3).
При необходимости время приема препарата МОВИПРЕП® может корректироваться лечащим врачом в зависимости от повседневной активности пациента и времени на дорогу до клиники с соблюдением указанных временных интервалов [42].
4.4. Временной интервал (продолжительность) исследования
Временной интервал эндоскопического исследования включает следующие компоненты:
1. Предварительная беседа с пациентом: анализ жалоб, анамнеза, результатов ранее выполненных исследований.
2. Изучение документации.
3. Выполнение подготовки к исследованию и премедикация.
4. При выполнении исследования с внутривенной анестезией — осмотр и консультация врачом-анестезиологом.
5. Проведение эндоскопического исследования с фотофиксацией результатов исследования (при выполнении исследования на видеосистемах с помощью видеоэндоскопов).
6. Обработка и ДВУ эндоскопа и инструментария.
7. Оформление медицинской документации, в том числе составление протокола исследования — его текстовой части и фотоизображений, оформление биопсийного материала.
8. При необходимости — консультация с заведующим отделением, лечащим врачом.
9. Беседа с пациентом — объяснение результатов исследования и последующих рекомендаций.
Данные временного интервала по европейским рекомендациями:
Согласно рекомендациям Европейского общества гастроинтестинальной эндоскопии (ESGE), время выведения колоноскопа (CWT) должно быть измерено и составлять ≥6 мин в не менее чем 90% случаев.
Раздел 5. Техника выполнения колоноскопии
5.1. Материально-техническое обеспечение метода колоноскопии
Технологический прогресс позволил значительно расширить диагностические возможности современной эндоскопии. Поэтому в настоящее время качественная колоноскопия, безусловно, должна выполняться с использованием эндоскопических видеосистем с видеоэндоскопами и медицинскими мониторами высокой четкости. Современные видеосистемы позволяют во время исследования получать и сохранять статические изображения высокой четкости, а также видеосигнал, в том числе с использованием электронной хромоскопии и функции увеличения изображения. Кроме того, современные колоноскопы оснащены функцией изменяющейся жесткости, что значительно облегчает прохождение участков с изгибами.
Для расправления просвета кишки имеется возможность использования углекислого газа (СО2), а не воздуха, как это было ранее, что обеспечивает более комфортное и безопасное проведение исследования. Для этого необходимо оборудовать эндоскопическую стойку инсуффлятором СО2. Углекислый газ абсорбируется в тканях в 150 раз быстрее, чем воздух. Это обеспечивает значительное уменьшение дискомфорта и болевых ощущений у пациента как во время, так и после исследования.
Просвет кишки и остаточное содержимое необходимо отмывать с помощью водоструйной помпы и полностью аспирировать эндоскопическим отсосом. Для дополнительного отмывания кишки от остаточного содержимого на современных эндоскопах имеется дополнительный канал, что значительно облегчает процесс отмывания стенок кишки и детального осмотра слизистой оболочки.
Для обработки эндоскопа (дезинфекция высокого уровня) и многоразового инструментария отделение эндоскопии должно быть оснащено специализированным оборудованием — автоматизированной моюще-дезинфицирующей машиной, шкафом для хранения эндоскопов в асептических условиях.
Организация рабочего места
Кабинет колоноскопии должен быть оснащен системой принудительной вытяжки и вентиляции. Окна в кабинете должны быть затонированы или закрываться с помощью непроницаемых для света жалюзи. В кабинете колоноскопии или в непосредственной близости с ним должна располагаться туалетная комната.
Стол для выполнения колоноскопии следует выбирать с возможностью изменения его конфигурации. Врач-эндоскопист выполняет исследование в положении стоя слева от стола. Преимущества данной позиции: 1) удобство для пациента благодаря возможности максимального выпрямления ног в процессе исследования; 2) рабочая часть эндоскопа не свисает со стола, а располагается на его горизонтальной плоскости, что позволяет избежать нежелательного сгибания эндоскопа и сохранить его ось; при этом сохраняется главный принцип введения колоноскопа в толстую кишку — соосное введение; при изменении положения пациента из левой боковой позиции в положение на спине, левая нога при этом легко фиксируется на дополнительно установленной подставке для фиксации.
Особенности техники выполнения колоноскопии
Для выполнения данного исследования, включающего осмотр всех отделов толстой кишки, требуются понимание анатомического строения кишечника, техническая подготовка врача и владение специальными навыками методики. Существуют два основных метода выполнения колоноскопии: 1) выполнение одним врачом (варианты ротационной методики, подтягивания); 2) выполнение врачом и ассистентом (методика проталкивания). Мы считаем оптимальным способом — комбинацию обоих вариантов. Главная задача на этапе введения колоноскопа до купола слепой кишки — обеспечение безболезненности. Задача при выведении — тщательный осмотр всей поверхности слизистой оболочки.
Анатомическое строение кишечника. Фиксированные отделы толстой кишки — восходящая и нисходящая ободочная кишка, прямая кишка, а также область печеночного и селезеночного изгибов. Подвижные участки кишки — сигмовидная и поперечная ободочная кишки.
Положение пациента на операционном столе. Пациента укладывают на операционный стол в положении лежа на левом боку (левое латеральное положение лежа) с приведенными к животу коленями. В дальнейшем при необходимости пациента поворачивают на спину, колени остаются также в согнутом положении, ступни ног опираются на поверхность стола, при этом согнутую в колене правую ногу желательно положить на левую (нога на ногу), что позволяет уменьшить напряжение передней брюшной стенки пациента, а также увеличить пространство на операционном столе для расположения эндоскопа в соответствии с его осью.
Перед введением эндоскопа необходимо провести пальцевое ректальное исследование прямой кишки. Для облегчения введения эндоскопа его дистальный конец и область заднего прохода смазывают специальными анестезирующими гелями.
Основные принципы введения колоноскопа:
1) манипуляции правой рукой включают движения вперед, назад и вращение вокруг оси колоноскопа; при этом правой рукой необходимо удерживать колоноскоп на расстоянии 20 см от ануса — этим достигается максимальная чувствительность движений дистальной части эндоскопа в просвете кишки, с этой же целью колоноскоп следует держать прямо, без изгибов;
2) манипуляции левой рукой обеспечивают сгибание вверх и вниз.
Наиболее важный фактор — удержание собственной оси колоноскопа. После того как колоноскоп будет проведен за изгибы, его ось следует тут же вернуть в первоначальное положение, так как загибание эндоскопа (манипуляции с углообразованием) и формирование петли влекут за собой временное отклонение от оси. Строгое соблюдение этих принципов обеспечивает безболезненное введение колоноскопа за короткое время (техника удержания оси эндоскопа с присбориванием (укорачиванием) кишки).
Основные моменты введения колоноскопа состоят в зацеплении за складку и присборивании (подтягивании) кишки. Ключевым моментом является то, что следует пройти толстую кишку между ее фиксированными участками прямо, без растяжения. Данная методика похожа на технику горнолыжного спуска слалома. Имеется 4 фиксированных участка: нижние отделы прямой кишки, переход сигмовидной в нисходящую кишку, области селезеночного и печеночного изгибов. Колоноскоп не должен приближаться (достигать) к фиксированному участку при наличии острого угла. Эта методика укорачивает (подтягивает) кишку безболезненно, обеспечивая полный контроль эндоскопа.
В сигмовидной ободочной кишке метод подтягивания (укорочения) с вращением вправо используется для прохождения изгибов без формирования альфа-петли. Колоноскоп вращают вправо (т.е. по часовой стрелке) и продвигают вперед, используя аспирацию и подтягивание. Сигмовидная кишка должна быть укорочена (подтянута, в подтянутом состоянии) и фактически выпрямлена до того, как колоноскоп достигнет перехода сигмовидной ободочной кишки в нисходящую ободочную. При этом колоноскоп следует продвигать таким образом, чтобы просвет сигмовидной кишки визуализировался с правой стороны.
Длина колоноскопа при достижении селезеночного изгиба составляет 35—40 см. Если этой длины недостаточно, это указывает на наличие у пациента удлиненной сигмовидной кишки. В таких случаях необходимо повторить выпрямление сигмовидной кишки. При положении пациента лежа на левом боку, селезеночный изгиб является самой нижней точкой толстой кишки, где, возможно, остается очищающий раствор. Оставшийся раствор необходимо полностью удалить. При повороте колоноскопа влево и сгибании вверх определяется поперечная ободочная кишка. Признаком адекватно подтянутой кишки является то, что голубоватое пятно от селезенки невозможно увидеть. Когда кончик колоноскопа находится в селезеночном изгибе, сигмовидная кишка должна быть адекватно подтянута.
Введя колоноскоп в поперечно-ободочную кишку, его сгибают вниз и выпрямляют с помощью медленного поворота влево. Удерживая просвет поперечно-ободочной кишки слева, эндоскоп продвигают к области печеночного изгиба; тем временем аспирируют воздух из просвета поперечно-ободочной кишки и подтягивают ее с помощью поворота влево (т.е. против часовой стрелки). После прохождения самой нижней части поперечно-ободочной кишки колоноскоп достигает печеночного изгиба самопроизвольно, при подтягивании эндоскопа на себя на фоне аспирации. Во время этой манипуляции очень важно сохранить собственную ось колоноскопа. Если кончик колоноскопа не продвигается вперед при подтягивании (извлечении эндоскопа), ассистент может помочь предотвратить растяжение кишки с помощью сдавливания передней брюшной стенки — от пупочной области кверху, в направлении эпигастрия.
Визуализация второго синеватого пятна указывает на то, что колоноскоп находится в печеночном изгибе. Это синеватое пятно можно наблюдать почти во всех случаях. После того как поперечно-ободочная кишка будет выпрямлена, колоноскоп поворачивают направо в печеночный изгиб, сгибают вверх и вводят в восходящую ободочную кишку. Длины колоноскопа примерно 60 см достаточно для достижения печеночного изгиба.
Введя колоноскоп в восходящую кишку, его продвигают в слепую кишку при аспирации. Баугиниеву заслонку обычно видно с левой стороны видимой области. Если заслонка просматривается нечетко, то объем воздуха в кишечнике следует сократить (аспирировать), после чего можно отчетливо определить область заслонки.
Устье червеобразного отростка в форме полумесяца визуализируется в области схождения кишечных теней.
Для того чтобы достичь слепой кишки, не причиняя боли пациенту, колоноскоп необходимо вводить с наименьшим количеством воздуха, насколько это возможно. Поэтому подробный осмотр во время введения аппарата не рекомендуется. Увеличение объема воздуха создает настолько острые углы в каждом фиксированном участке, что их прохождение может быть затруднительным. Следовательно, объем воздуха не стоит увеличивать; лучше воздух в пройденных участках кишки аспирировать как можно больше. Слабая сторона метода подтягивания кишки с участием одного специалиста заключается в большом количестве слепых зон; следовательно, при введении эндоскопа необходимо проводить тщательный осмотр, чтобы не пропустить патологических образований. В ситуациях, когда образование локализуется в проксимальных отделах толстой кишки и выполняется стрип-биопсия или полипэктомия, внимание направлено на извлечение резецированного участка во время извлечения эндоскопа. При этом осмотр дистальных отделов кишки будет неадекватным. Чтобы избежать таких ситуаций, тщательный осмотр необходимо выполнять и при введении эндоскопа. В противном случае исследование необходимо повторить после полипэктомии или петлевой биопсии.
При выявлении патологического новообразования колоноскопист должен сразу же определить: следует ли удалить образование или продолжить введение эндоскопа, запомнив локализацию опухоли. Если опухоль слишком маленькая, ее месторасположение следует пометить китайской тушью или клипированием.
Время выполнения исследования. Непосредственно эндоскопическая диагностика патологии толстой кишки выполняется на этапе извлечения эндоскопа. При этом все внимание уделяется технически правильному выполнению исследования, а не скорости. Основное правило: не торопиться! Чем спокойнее врач проводит колоноскоп, подчиняясь техническим правилам выполнения исследования, тем быстрее появится купол слепой кишки.
При продвижении эндоскопа необходимо:
— исключить любые чрезмерные усилия: продвижение должно быть физиологичным (повторять ход кишки) и безболезненным;
— изгибы кишки преодолевать по кратчайшему пути, но не по стенкам;
— избегать образования лишних петель колоноскопа.
Исследователь должен следить за длиной введенной рабочей части эндоскопа, чтобы при необходимости извлекать колоноскоп с целью подтягивания, укорачивания и распрямления кишки. В идеале при проведении колоноскопа до купола слепой кишки при условии полного распрямления всех изгибов кишки эндоскоп приобретает форму вопросительного знака или семерки. При этом можно предположительно определить, на каком расстоянии будут находиться различные отделы толстой кишки: слепая кишка — 80 см, поперечно-ободочная кишка — 60 см, селезеночный угол — 50 см, нисходящая ободочная кишка — 40 см, сигмовидная ободочная кишка — 30 см. Параллельно определению локализации по расстоянию можно ориентироваться по расположению жидкости в кишке, данным пальпации передней брюшной стенки, просвечиванию передней стенки живота источником света.
Обследование во время извлечения колоноскопа должно восполнить недостаточный осмотр при введении эндоскопа. Другими словами, неосмотренные при введении углы и межскладочные пространства должны быть тщательно обследованы, включая брыжеечный край печеночного изгиба, самую нижнюю часть поперечно-ободочной кишки, селезеночный изгиб, переход сигмовидной в нисходящую ободочную кишку, сигмовидную кишку, окружность нижних отделов прямой кишки и анальный канал.
После того как эндоскоп достигнет слепой кишки при подтягивании кишечника, аппаратом можно свободно и эффективно управлять, что позволяет более тщательно осмотреть кишку при извлечении аппарата, чем во время введения.
Кроме того, во время выведения колоноскопа необходимо правильно регулировать объем воздуха для обеспечения оптимального динамичного обследования. Частое регулирование объема воздуха уменьшает число dead-углов за гаустрами, что помогает не просмотреть опухоль. В особенности глубокие гаустры восходящей кишки требуют частого регулирования объема воздуха. Сигмовидную кишку с ее большим количеством dead-углов, возникающих при введении эндоскопа с подтягиванием вправо, следует медленно и внимательно обследовать при извлечении аппарата. Нижние отделы прямой кишки и анальный канал, которые также имеют большое количество неосмотренных при введении участков, рекомендуется осматривать при регулировании объема воздуха и/или при ретроградном осмотре с помощью U-образного изгиба колоноскопа.
Для выявления патологических образований толстой кишки при эндоскопическом осмотре следует уделять особое внимание следующим моментам: возвышения, деформация стенок и изменения цвета при динамическом режиме. Для того чтобы обнаружить мельчайшие опухоли или в особенности углубленную форму раннего рака, необходимо обращать внимание на изменение цвета, т. е. легкое покраснение или бледность. Это позволяет обнаружить и распознать ранний рак.
Появление неприятных или болевых ощущений у пациента указывает на наличие лишних изгибов эндоскопа или избыточное раздувание кишки воздухом.
Мануальное пособие ассистента
Количество подаваемого в просвет кишки воздуха. При проведении эндоскопа до купола слепой кишки следует уделять постоянное внимание подаче воздуха — стараться использовать как можно меньший объем воздуха и аспирировать лишний воздух. При этом объем подаваемого воздуха должен быть достаточным только для точного определения хода просвета кишки. Непосредственно осмотр кишки проводится на выходе, поэтому при проведении колоноскопа до слепой кишки полное расправление просвета кишки воздухом нецелесообразно. Если на каком-то этапе требуется дополнительная подача воздуха, то излишки его необходимо аспирировать тотчас после прохождения очередного изгиба или складки. Каждый раз, когда эндоскоп проведен в проксимальные отделы, а они при этом достаточно раздуты воздухом, следует частично его аспирировать. Таким образом, во время всего исследования идет постоянная смена подачи воздуха и аспирации его избытка. Надо помнить, что аспирировать воздух следует как можно чаще.
Инсуффляцию воздуха проводить только для расправления просвета кишки непосредственно перед оптикой, для визуализации направления хода просвета кишки.
Аспирация воздуха активизирует перистальтику кишки, следовательно, способствует «насаживанию» кишки на эндоскоп. При аспирации следует избегать присасывания эндоскопа к стенке кишки.
Содержимое в просвете кишки. Непосредственно эндоскопический осмотр слизистой оболочки толстой кишки следует выполнять на фоне полной аспирации содержимого из просвета кишки, в том числе жидкой полупрозрачной части содержимого. При этом надо стараться не допускать присасывания стенки кишки к эндоскопу, чтобы избежать в этой области возникновения геморрагических изменений, которые затрудняют эндоскопическую оценку слизистой оболочки.
В сигмовидной кишке просвет надо удерживать в правом углу на 3—4 часах и присборивать; в сигмовидной кишке — подтягивать эндоскоп при его повороте вправо на фоне аспирации воздуха из просвета кишки; в поперечной ободочной кишке — подтягивать эндоскоп при его повороте влево на фоне аспирации воздуха из просвета кишки.
В конце исследования колоноскоп в просвете максимально подтянутой кишки приобретает форму семерки.
Основной смысл техники «слалома» заключается в том, что эндоскоп следует проводить по наименьшему радиусу движения. Анатомически это соответствует брыжеечному краю кишки. Как в слаломе: наименьшее время спуска достигается при движении ближе к флажку, если же держаться далеко от флажка, то удлиняется расстояние, а соответственно и время спуска.
Раздел 6. Анестезиологическое обеспечение исследования
В течение многих лет в отечественной эндоскопической школе доминировало положение об отсутствии нужды и даже определенной вредности обезболивания колоноскопии, так как сохранение контакта с пациентом позволяло контролировать его дыхательную функцию, а боль свидетельствовала о неверном выполнении колоноскопии и предупреждала о возможном повреждении кишки. В последние годы колоноскопия все чаще выполняется с премедикацией, анестезиологическим обеспечением, мониторированием пульса, артериального давления, сатурации крови и выполнением электрокардиограммы (ЭКГ). Подобные изменения, с одной стороны, связаны с коммерциализацией медицины, с другой — обусловлены осознанием простого факта: обезболивание вмешательства дает возможность выполнить его более качественно и не увеличивает риск перфорации кишки.
Основы законодательства РФ в области здравоохранения (раздел VI, ст. 30. Права граждан при оказании медико-социальной помощи) предоставляют пациенту право требовать облегчения боли при выполнении любой манипуляции или исследования, поэтому если пациент требует, врач обязан провести гастроскопию или колоноскопию с анестезией. Пациентов, настаивающих на обезболивании, становится все больше, и зачастую решающим фактором выбора того или иного учреждения для проведения исследования является возможность выполнения гастроскопии или колоноскопии с анестезиологическим пособием.
Организация рабочего места анестезиолога-реаниматолога
Согласно Порядку оказания медицинской помощи взрослому населению по профилю «анестезиология и реаниматология» (приказ Минздрава России № 919н от 15.07.12), медицинские организации или их структурные подразделения (группы, отделения, центры), оказывающие первичную специализированную медико-санитарную помощь и специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «анестезиология и реаниматология», должны иметь специально оборудованные пациенто-места для профилактики и лечения боли и болезненных ощущений при медицинских вмешательствах, искусственного замещения или искусственного поддержания обратимо нарушенных функций жизненно важных органов и систем, которые могут располагаться в операционной, манипуляционной, диагностических кабинетах, противошоковых палатах, преднаркозной палате, палате пробуждения и других подразделениях.
Рекомендуемое распределение рабочего времени врача анестезиолога-реаниматолога для анестезиологических пособий: 70% времени отводится на проведение анестезии и 30% — на осмотры и консультирование больных в амбулаторных и стационарных условиях.
Специально оборудованные места для оказания медицинской помощи по профилю «анестезиология и реаниматология» в плановом порядке при диагностических, лечебных и иных медицинских вмешательствах организуются, если потребность в них для проведения анестезии составляет не менее 70% рабочего времени в течение года.
Специально оборудованные места для оказания круглосуточной медицинской помощи по профилю «анестезиология и реаниматология» в экстренной форме организуются, если потребность в них для проведения анестезии составляет не менее 50% рабочего времени в течение года.
Оснащение рабочего места анестезиолога-реаниматолога в эндоскопическом отделении
В приложении № 3 Порядок оказания медицинской помощи взрослому населению по профилю «анестезиология и реаниматология» (приказ Минздрава России № 919н от 15.07.12) определен стандарт оснащения рабочего места анестезиолога-реаниматолога.
Для безопасного проведения седации и общей анестезии в крупном эндоскопическом отделении необходимо также организовать палату пробуждения на 3 пациенто-места, стандарт оснащения которой также представлен в приложении № 3 приказа Минздрава России № 919н от 15.07.12.
Подготовка к общей анестезии и седации. Основные положения
Минимальный интервал приема прозрачных жидкостей для подготовки кишечника — за 2 часа до начала общей анестезии.
— Для пациентов без сопутствующей патологии достаточно иметь перед осмотром анестезиолога в день исследования общий анализ крови и ЭКГ с описанием.
— Пациенты с сопутствующей патологией должны быть осмотрены анестезиологом заблаговременно для коррекции приема препаратов накануне исследования и назначения дополнительных анализов и консультаций.
— Амбулаторные пациенты, которым планируется общая анестезия, должны прибыть на исследование с сопровождающим и быть заранее предупреждены о невозможности управления транспортным средством в день исследования. Этот пункт необходимо отразить в информированном добровольном согласии на проведение общей анестезии.
Общая анестезия и седация при эндоскопических исследованиях
В настоящее время для проведения анестезиологического пособия при диагностических эндоскопических исследованиях используются следующие методики.
1. Контролируемая седация пропофолом или мидазоламом. Пропофол: быстрая индукция в дозе 1,5—2 мг/кг, поддержание седации — болюсы пропофола по 20—50 мг. Мидазолам: медленно, со скоростью 1 мг в 30 с, начальная доза составляет 2,5 мг за 5—10 мин до начала процедуры, при необходимости вводят последующие дозы по 1 мг. Средние суммарные дозы мидазолама колеблются от 3,5 до 7,5 мг.
2. Тотальная внутривенная анестезия. Вводная анестезия — болюсное введение пропофола 1,0—1,5 мг/кг в комбинации с фентанилом 0,8—1,1 мкг/кг, поддержание анестезии инфузией пропофола в дозе 4,5±2,1 мг/кг×с болюсным введением фентанила по 50—100 мкг, при подозрении на неэффективность аналгезии.
3. Ингаляционная анестезия: индукция и поддержание анестезии севофлураном. Индукции без предварительного заполнения дыхательного контура и максимальной концентрацией севофлурана (8 об.%) с первым вдохом пациента. Поток свежих газов (кислородно-воздушная смесь с FiO2 100%) 8 л/мин. Поддержание анестезии севофлураном 1,3±0,3 МАК при спонтанном дыхании пациента через лицевую маску наркозного аппарата.
4. Комбинированная анестезия. Индукцию анестезии проводят пропофолом 0,5—0,75 мг/кг и фентанилом 1 мкг/кг с последующей ингаляционной анестезией севофлураном 1,0±0,3 МАК через лицевую маску наркозного аппарата.
Во время анестезии пациент дышит кислородно-воздушной смесью с помощью носовых катетеров или через маску наркозного аппарата.
Выбор метода анестезиологического пособия зависит от состояния пациента, уровня подготовки анестезиологической бригады и оснащения рабочего места анестезиолога. Наиболее часто используется контролируемая седация пропофолом.
Мониторинг анестезии
Для проведения качественного и безопасного анестезиологического пособия во время эдоскопических исследований необходимо мониторировать следующие показатели пациента во время и после исследования: ЭКГ, пульсоксиметрию (SpO2), артериальное давление (неинвазивным методом), термометрию, концентрацию кислорода во вдыхаемой смеси, концентрацию ингаляционного анестетика и углекислого газа в конце выдоха, глубину анестезии (при наличии ВIS-монитора).
Пробуждение пациента
Все амбулаторные пациенты после проведения седации и общей анестезии должны находиться под наблюдением анестезиологической бригады не менее 2 ч.
Раздел 7. Стандарты оформления протокола колоноскопии
Оформление медицинской документации после проведения колоноскопии включает: 1) формирование и сохранение протокола исследования в архиве; 2) оформление направлений на различные виды морфологического исследования.
Стандартизированный протокол по колоноскопии должен содержать следующие разделы:
1. Клинические данные: анамнез, особенности сопутствующей патологии, которые могут потребовать определенных мер предосторожности (прием антикоагулянтов, наличие искусственных водителей ритма и т. д.), результаты и переносимость ранее проводимых эндоскопических исследований, информированное добровольное согласие.
2. Показания для исследования: а) скрининговое исследование (по графику диспансеризации); б) наблюдение по поводу колоректальных неоплазий (семейный анамнез, особенно учитывается наличие колоректальных неоплазий у родственников первой линии), что может потребовать проведения скрининговой колоноскопии в более ранние сроки; наблюдение после ранее выполненных эндоскопических и хирургических удалений колоректальных образований; в) наблюдение по поводу воспалительных заболеваний кишечника; г) наличие симптоматики, например кишечное кровотечение; д) выявленные изменения по результатам других методов исследования (тест кала на скрытую кровь, ирригоскопия, методы компьютерной диагностики и т. д.).
3. Особенности исследования: а) схема и качество подготовки к исследованию (например, по Бостонской шкале); премедикация или метод анестезиологического пособия; б) используемое оборудование (эндоскопическая система, эндоскоп с указанием серийного номера, монитор, инсуффлятор СО2, водоструйная помпа и т. д.); в) полнота исследования: документация анатомических ориентиров (устье червеобразного отростка, илеоцекальный клапан (Баугиниева заслонка), предпочтительна фотодокументация; фотофиксация результатов исследования (фото Баугиниевой заслонки, устья червеобразного отростка, терминального отдела подвздошной кишки, восходящей ободочной кишки, поперечной ободочной кишки, нисходящей ободочной кишки, сигмовидной ободочной кишки, прямой кишки, фото выявленных патологических изменений; г) время осмотра при диагностическом исследовании (время от начала осмотра от слепой кишки до времени извлечения из прямой кишки без полипэктомии и биопсии); д) при сложностях проведения исследования, плохой переносимости исследования (в случае выполнения его под местной анестезией), особенно при неполноценном исследовании, необходимо указывать причины этого в протоколе для более эффективного проведения повторных исследований.
4. Результаты исследования: стандартизованное описание выявленных образований толстой кишки (морфология, размер в миллиметрах, метод удаления, полнота (завершенность) удаления, извлечение для гистологического исследования, развитие осложнений во время или после исследования, результаты патоморфологического исследования.
Рекомендации по дальнейшему ведению (наблюдению): при удалении образований или выполнения биопсии рекомендации оформляются после получения результатов патоморфологического исследования по принятым гайдлайнам европейского общества гастроинтестинальной эндоскопии (ESGE).
7.1. Современная макроскопическая классификация эпителиальных образований толстой кишки — парижская классификация
Макроскопической классификацией поверхностных эпителиальных образований (тип роста образования) служит Парижская классификация (40) (1)
Эпителиальные новообразования желудочно-кишечного тракта квалифицируются как поверхностные, когда глубина их распространения ограничена слизистой оболочкой или подслизистым слоем, т. е. двумя внутренними, поверхностными по отношению к просвету желудочно-кишечного тракта, слоями.
Латерально распространяющиеся опухоли (LST — laterally spreading tumors)
Некоторые уплощенные приподнятые новообразования могут достигать большого (более 10 мм; более 20 мм в публикации 2005 г.) диаметра в основании без увеличения их высоты (протрузии) над слизистой оболочкой. Их называют латерально распространяющимися (растущими) или стелющимися опухолями (Lateraly Spreading Tumor — LST). Они в свою очередь подразделяются на опухоли, состоящие из множества мелких узелков, цвета окружающей слизистой оболочки (гранулярные) — тип LST-G (Granular) и плоские гомогенные опухоли — LST-NG (NonGranular) (41)
LST — латерально растущие (распространяющиеся) опухоли
— Гранулярного типа:
— гомогенный тип;
— смешанной зернистости (нодулярный смешанный тип).
— Негранулярного типа:
— плоско-приподнятый тип;
— с псевдодепрессией.
Классификация поверхностных эпителиальных новообразований толстой кишки (новообразований нулевого типа) употребляется: для характеристики рака, с инвазией в собственную пластинку слизистой оболочки и глубиной пенетрации ограниченной подслизистым слоем; для новообразований без инвазии собственной пластинки слизистой оболочки — доброкачественных интраэпителиальных неоплазий как низкой, так и высокой степени, а также для не неопластических образований, могущих обладать скрытым неопластическим компонентом (таких например, как гиперпластические полипы) (рис. 7).
При эндоскопическом исследовании новообразования желудочно-кишечного тракта, в частности толстой кишки, называются поверхностными, когда по эндоскопической картине предполагается наличие неинвазивной неоплазии (дисплазии/аденомы), либо рака небольших размеров, глубина инвазии (прорастания) которого в кишечную стенку не выходит за пределы подслизистого слоя, т. е. отсутствует опухолевая инфильтрация мышечного слоя. Если поражение является инвазивным, поверхностная опухоль относится к стадии Т1 по классификации TNM, при которой инвазия ограничена слизистым или подслизистым слоем. Классификация раннего рака желудка разработана японским обществом гастроинтестинальной эндоскопии и впервые была представлена на специальной лекции президента 4-го Конгресса этого общества в 1962 г.
В Японии новообразования желудка, которые при эндоскопии имеют поверхностный вид, классифицируются как подтипы «типа 0». По мере роста заболеваемости КРР в Японии классификация поверхностных новообразований желудка, начиная с 1977 г., стала применяться и для характеристики опухолей толстой кишки (Kanehara, 1999). Термин «тип 0» был избран для того, чтобы отличать классификацию поверхностных поражений от классификации Боррманна, предложенной в 1926 г. для характеристики распространенных форм опухолей желудка, которая включает типы 1—4. Тип 5 был добавлен в эту классификацию Японской ассоциацией по изучению рака желудка. В настоящее время аналогичная классификация используется и для характеристики распространенных форм рака толстой кишки (табл. 4).
В Японии новообразования толстой кишки, так же как и неопластические образования желудка, которые при эндоскопии имеют «поверхностный» вид, классифицируются как подтипы типа 0. Внутри (в рамках) нулевого типа выделяют полиповидные и неполиповидные подтипы. Неполиповидные подтипы включают группу поражений с незначительными вариациями поверхностной структуры (слегка приподнятые, плоские, слегка углубленные) и изъязвленные (подрытые) поражения.
— Классификация образований типа 0 основана на разграничении между полиповидными (синоним: выступающими) (подтип 0-I); неполиповидными (синоним: невыступающими), неизъязвленными (синоним: неподрытыми) (подтип 0-II); неполиповидными, изъязвленными (синоним: подрытыми) (подтип 0-III). Дополнительно образования подтипа 0-II разделяются по признаку отсутствия или наличия углубления на незначительно приподнятые (подтип 0-IIa), плоские (подтип 0-IIb) и углубленные (подтип 0-IIc). Поверхностные выступающие образования (подтип 0-I) также называются «полипы»; подрытые образования (подтип 0-III) называются «язвы». Менее заметные образования (невыступающие и неподрытые) часто называют «плоские», хотя большинство из них незначительно приподнятые или углубленные. Данная минимальная стандартная терминология покрывает бóльшую часть клинически значимой морфологии и применима к пищеводу, желудку и толстой кишке. Для каждого органа существуют свои тонкости применения этой классификации, которые подчеркивают прогностическое значение каждого подтипа.
Полиповидные и неполиповидные новообразования
Характерные черты полиповидных и неполиповидных поражений представлены в табл. 4 и на схеме (рис. 8).
Полиповидные новообразования (в соответствии с Парижской классификацией — тип 0–I) при эндоскопическом исследовании возвышаются над окружающей слизистой оболочкой. В удаленном образце высота образования превышает толщину прилегающей нормальной слизистой оболочки более чем в 2 раза. Однако толщина нормальной слизистой оболочки варьируется от 0,25 до 1,5 мм, к тому же ее невозможно оценить без гистологического исследования. Вот почему более практично относить новообразование к выступающему, если его высота превышает треть или половину его диаметра или, еще проще, если оно выглядит куполообразным, полиповидным. Полиповидные (выступающие) поражения разделяются на: полипы на ножке, полипы на широком основании и полипы на узком основании. Полипы на ножке (стебельчатые, pedunculated) имеют узкое основание; у фиксированных, сидячих (sessile) полипов основание и верхушка образования имеют одинаковый диаметр, в русской литературе их чаще называют полипы «на широком основании». Промежуточные и пограничные формы дословно называют полустебельчатыми (semipedunculated, Isp), а в русской литературе чаще всего используется термин «на узком основании»; к ним следует относиться так же, как и к полипам на широком основании.
Невыступающие или неполиповидные новообразования включают язвы (0-III) и так называемые плоские поражения (0-II). Эти последние могут быть слегка (незначительно) приподнятыми (0-IIa), полностью плоскими (0-IIb) или углубленными (0-IIc) (безусловно, углубленными) — по сравнению с прилегающей слизистой оболочкой.
При эндоскопическом исследовании незначительно приподнятые поражения легко спутать с полиповидными новообразованиями на широком основании. Различие между этими подтипами эндоскопически оценивается по сравнению с закрытыми чашечками стандартных биопсийных щипцов (равными приблизительно 2,5 мм), которые размещаются рядом с образованием в качестве измеряющего устройства. Более надежно это различие можно установить при патоморфологическом исследовании удаленного фрагмента, в котором возможно сравнить высоту новообразования с полной толщиной нормальной слизистой оболочки.
В толстой кишке изъязвленные новообразования (подтип 0-III) практически никогда не встречаются.
Различия между углубленными (0-IIc) и изъязвленными (0-III) новообразованиями лучше всего видны на операционном материале. В изъязвленном новообразовании наблюдаются резкий обрыв эпителиального слоя и прерывание (отчетливое нарушение целостности) мышечной пластинки слизистой оболочки (т.е. слизистый слой отсутствует).
В смешанных типах одновременно существуют два различных макроскопических подтипа поражения, состоящие из приподнятого участка (IIa) и углубления (IIc), легко диагностируются при эндоскопии. Однако для точного расположения этих смешанных типов в Японской классификации требуется детальная оценка их структуры, и в этом разделе по-прежнему сохраняются разногласия между исследователями, так как соответствующая поверхность каждого типа не является единственным фактором, влияющим на прогноз. Углубленное образование с приподнятыми краями или центральным возвышением классифицируется как углубленно-приподнятый подтип 0IIc+IIa — углублена большая часть его поверхности; приподнятый участок прослеживается в сегменте образования на периферии. Приподнятое образование с центральным углублением на его верхушке относят к приподнято-углубленному подтипу 0-IIa+IIc. Этот смешанный тип также может быть относительно или абсолютно углубленным образованием. Как правило, образования типа IIa+IIc имеют более плохой прогноз и более высокий риск массивной инвазии в подслизистый слой, чем все другие типы образований, включая IIa. Также описаны и другие смешанные подтипы образований и разновидности (варианты) их классификации, в зависимости от места расположения (в частности, если на верхушке образования I типа или поблизости с ней имеется небольшое углубление, оно классифицируется как подтип I+IIc).
— Полиповидные образования 0-I типа можно разделить на тип 0-Ip и тип 0-Is (на ножке и на широком основании). С позиций клинической значимости нет необходимости в выделении промежуточного типа 0-Isp (на суженном основании); к образованиям этого типа следует относиться так же, как к образованиям типа Is.
— При небольших и приподнятых новообразованиях их отнесение к типу 0-Is (полиповидное, на широком основании) или к типу 0-IIa (неполиповидное, приподнятое) облегчается путем сравнения высоты образования (но не его диаметра!) с закрытыми чашечками стандартных биопсийных щипцов (равными приблизительно 2,5 мм), которые размещаются рядом с образованием в качестве измеряющего устройства. Образования, выступающие выше уровня закрытых бранш биопсийных щипцов, т. е. более 2,5 мм высотой, относят к типу 0-Is; приподнятые образования, не достигающие этого уровня, т. е. менее 2,5 мм, относят к типу 0-IIa.
— Особое значение придается углубленным образованиям типа 0-IIc. При эндоскопии различие между углубленным (0—IIc) и изъязвленным поражением (0—III) основывается на глубине депрессии и анализе поверхности эпителия в области углубления. Поверхностные эрозии в углубленном образовании затрагивают только самые поверхностные слои. При изъязвленном новообразовании наблюдается разрушение слизистого, а часто и подслизистого слоя. В толстой кишке образования подтипа 0-IIc, даже небольшого диаметра, часто находятся на более развитой стадии неоплазии с большей глубиной инвазии по сравнению с другими типами новообразований такого же размера. Поверхностные новообразования подтипа 0-III практически не встречаются в толстой кишке.
— При наличии углубления в центре новообразования его уровень сравнивают с уровнем прилежащей слизистой оболочки. Образование считают абсолютно углубленным, когда уровень углубления (депрессии) ниже поверхности прилегающей слизистой оболочки, и относительно углубленным, когда уровень депрессии (углубления) все еще выше уровня прилегающей слизистой оболочки. Это положение особенно применимо для толстой кишки.
Основные варианты морфологии новообразований нулевого типа показаны на рис. 9.
Тем не менее эксперты, принимавшие участие в Парижском семинаре, сделали заключение о том, что эндоскопическая описательная морфология может помочь в выборе метода лечения, включающего эндоскопическую резекцию или хирургическое вмешательство. Главная задача «эндоскопического стадирования» — прогнозирование риска инвазии в подслизистый слой и связанного с ней риска метастазирования в лимфоузлы.
Диаметр образования 0-I типа является надежным прогностическим критерием. Риск развития инвазии в подслизистый слой возрастает по мере увеличения диаметра образования. С другой стороны, для образований 0-II типа большее значение имеют морфологические подтипы. Инвазия в подслизистый слой наиболее часто встречается при углубленных образованиях (0-IIc).
Надежность эндоскопического стадирования, еще не достигшая совершенства, может быть улучшена с помощью ЭУС, особенно с использованием высокочастотных датчиков (20 МГц). Впрочем и эндоскопический, и эндосонографический методы имеют свои ограничения. Эндоскопия склонна недооценивать стадию поверхностных образований, а ЭУС, напротив, — переоценивать. Предсказательное значение исследования возрастает, когда оба метода дают единое, общее заключение.
Эндоскопическая морфология подтипов внутри типа 0. В японских исследованиях имеется несколько крупных серий, показывающих распределение и разновидности строения поверхностных неопластических образований типа 0. Некоторые серии включают эндоскопическое описание образований вместе с их патогистологической картиной. В сериях из эндоскопических отделений слабым местом является патоморфологическая часть, в то время как эндоскопическое описание остается слабым местом в работах из хирургических отделений или патоморфологических лабораторий. Соотношение каждого типа и подтипа варьируется в зависимости от органа, характера эпителия и порядка набора материала (массовый скрининг или отдельные случаи).
7.2. Рекомендации после выполнения колоноскопии (European Society of Gastrointestinal Endoscopy — ESGE) по эндоскопическому наблюдению пациентов после полипэктомии
Эффект эндоскопического скрининга КРР обусловлен двумя механизмами. Во-первых, удаление аденоматозных полипов, из которых развивается КРР, и обнаружение рака на ранних стадиях — все это снижает заболеваемость и смертность от КРР [1—3]. Во-вторых, осуществляется стратификация, т. е. определение риска развития КРР, основанное на эндоскопических находках и гистологических заключениях, обеспечивающее пациентам с высоким риском развития КРР положительный эффект от проведения эндоскопических наблюдений с рекомендованными интервалами.
Предполагается, что пациенты, у которых были выявлены аденоматозные полипы, должны быть включены в программу эндоскопического наблюдения, которая способствует выявлению метахронных или рецидивирующих образований, а также способствует выявлению рака толстой кишки на ранней стадии. Несколько проведенных исследований показывают, что больные, которые не были включены в программу эндоскопического наблюдения после полипэктомии, имеют в 4 раза выше риск развития КРР [4, 5].
Данные рекомендации не относятся к наблюдению пациентов после эндоскопической резекции малигнизированных полипов и пациентов с синдромом семейного наследственного полипоза.
Основные определения (дефиниции), используемые в данных рекомендациях:
1. Высококачественная колоноскопия — это тотальная колоноскопия (когда колоноскопия проводится в полном объеме с заведением эндоскопа в купол слепой кишки) с тщательным осмотром слизистой оболочки толстой кишки и радикальным удалением всех выявленных неопластических образований, с обязательным последующим гистологическим исследованием удаленных образований.
2. Первичная колоноскопия — это первая (инициирующая) высококачественная скрининговая, колоноскопия, по результатам которой вырабатывается стратегия эндоскопического наблюдения за больным.
Если есть национальная, скрининговая программа, то следующая колоноскопия в рамках эндоскопического наблюдения после полипэктомии будет называться «первая колоноскопия» в рамках наблюдения, следующая за первой — вторая колоноскопия в рамках эндоскопического наблюдения и т. д.
Если нет национальной скрининговой программы, то колоноскопия в рамках эндоскопического наблюдения будет называться повторной.
3. Метахронные образования — образования, которые обнаружены при проведении колоноскопий в рамках эндоскопического наблюдения за пациентом после полипэктомии.
4. Группа с низким риском развития КРР:
— 1—2 тубулярные аденомы <10 мм с низкой степенью дисплазии;
— зубчатые полипы <10 мм в размере, без дисплазии.
5. Группа с высоким риском развития КРР:
— аденома любого размера с виллезным компонентом;
— аденома любого размера с дисплазией высокой степени;
— размер аденомы >10 мм;
— ≥3 аденом;
— зубчатые полипы ≥10 мм;
— зубчатые полипы любого размера с дисплазией.
6. Advanced adenoma — аденомы с высоким риском малигнизации:
— аденома любого размера с виллезным компонентом;
— аденома любого размера с дисплазией высокой степени;
— размер аденомы >10 мм.
7. Advanced neoplasia:
— аденома любого размера с виллезным компонентом;
— аденома любого размера с дисплазией высокой степени;
— размер аденомы >10 мм;
— КРР.
8. Зубчатые полипы:
— гиперпластические полипы;
— сидячий зубчатый полип/аденома;
— традиционная зубчатая аденома;
— смешанный полип.
Рекомендации по эндоскопическому наблюдению пациентов после полипэктомии могут быть применены только в случае проведения качественной колоноскопии с радикальным удалением всех обнаруженных неопластических образований.
Качественная колоноскопия ассоциирована со значительным снижением показателей заболеваемости и смертности от КРР в последующем и с низким риском метахронных образований.
Колоноскопии низкого качества ассоциированы с высоким риском интервального КРР [6—8]. Нерадикальное удаление образований также связано с возрастанием риска интервального рака [5, 9]. По этим причинам внедрение программ, гарантирующих и контролирующих качество колоноскопии, является необходимым для эффективности скрининговых программ и программ по эндоскопическому наблюдению пациентов после полипэктомии.
Планирование эндоскопического наблюдения больного основывается не только на гистологической характеристике и числе полностью (радикально) удаленных полипов, обязательно учитываются также качество проведенной колоноскопии, возраст больного, его анамнез.
ESGE рекомендует врачам-эндоскопистам финализировать отчет по колоноскопии после получения результатов гистологического исследования. Врач-эндоскопист должен дать письменную рекомендацию по срокам эндоскопического наблюдения, учитывая все эндоскопические данные, гистологическое заключение и факторы, связанные с пациентом. Соблюдение рекомендаций по срокам эндоскопического наблюдения пациентов после эндоскопического удаления полипов должно контролироваться как часть программы гарантии качества колоноскопии [10—12].
Основные положения рекомендаций ESGE
1. Группа с низким риском развития КРР:
— 1—2 тубулярные аденомы <10 мм с низкой степенью дисплазии;
— зубчатые полипы <10 мм в размере, без дисплазии.
ESGE рекомендует включать таких пациентов в национальные скрининговые программы и проводить повторную колоноскопию через 10 лет после первичной колоноскопии; если нет скрининговой программы, то в любом случае обязательно повторное проведение колоноскопии через 10 лет.
2. Группа с высоким риском развития КРР:
— аденома любого размера с виллезным компонентом;
— аденома любого размера с дисплазией высокой степени;
— размер аденомы >10 мм;
— ≥3 аденом;
— зубчатые полипы размером ≥10 мм;
— зубчатые полипы любого размера с дисплазией.
ESGE рекомендует провести повторную колоноскопию в рамках наблюдения через 3 года после первичной, скрининговой колоноскопии.
Пациенты с 10 аденомами и более должны быть направлены на генетическое обследование для исключения синдрома семейного наследственного полипоза.
3. В группе с высоким риском развития КРР, если при первой колоноскопии в рамках эндоскопического наблюдения после проведения полипэктомии не выявлены аденомы с высоким риском развития КРР, то ESGE рекомендует провести вторую колоноскопию в рамках эндоскопического наблюдения после полипэктомии через 5 лет.
Если при первой колоноскопии (и при последующих) в рамках эндоскопического наблюдения после полипэктомии выявлены аденомы с высоким риском развития КРР, то ESGE рекомендует провести следующую колоноскопию через 3 года.
4. Зубчатые полипы — гиперпластический полип, традиционная зубчатая аденома, сидячий зубчатый полип/аденома, смешанный полип:
— группа высокого риска развития КРР: зубчатые полипы размером <10 мм без дисплазии;
— группа низкого риска развития КРР: зубчатые полипы размером ≥10 мм; зубчатые полипы любого размера с дисплазией любой степени.
ESGE рекомендует, чтобы первая колоноскопия в рамках эндоскопического наблюдения после первичной высококачественной колоноскопии (полипэктомии) была проведена в соответствии с рекомендациями для пациентов с аденомами, стратифицированным по группам риска развития КРР.
Ряд исследований [13—16] показали, что у пациентов с гиперпластическими полипами в отсутствие каких-либо неопластических образований нет риска развития аденом с высоким потенциалом малигнизации (advanced adenoma), хотя отмечается незначительное увеличение риска развития аденом. Сосуществование гиперпластических полипов с аденомами при первичной, скрининговой колоноскопии не увеличивает риска развития аденом и аденом с высоким потенциалом малигнизации (advanced adenoma) при последующих колоноскопиях в рамках эндоскопического наблюдения по сравнению с пациентами, у которых были выявлены только аденомы при первичной, скрининговой колоноскопии.
До настоящего времени существуют сложности у патоморфологов по классификации зубчатых образований. Поэтому в рамках данных рекомендаций ESGE все зубчатые образования отнесены в группу зубчатых полипов.
5. ESGE рекомендует: врач-эндоскопист ответственен за предоставление письменной рекомендации по планированию эндоскопических осмотров в рамках эндоскопического наблюдения пациентов после полипэктомии.
ESGE отдельно рассматривает несколько особых ситуаций.
1. В случае фрагментарной резекции аденомы размером >10 мм необходимо сначала провести эндоскопический контроль через 6 мес, а затем включить пациента в программу эндоскопического наблюдения после полипэктомии.
2. ESGE не находит достаточных доказательств для предоставления рекомендаций пациентам в рамках эндоскопического наблюдения после полипэктомии, основываясь на других потенциальных факторах риска развития КРР, таких как возраст, семейный анамнез КРР. Однако представляется разумным остановить эндоскопическое наблюдение в возрасте 80 лет или раньше в зависимости от коморбидных заболеваний.
3. ESGE рекомендует повторную колоноскопию или укорочение интервалов эндоскопического наблюдения у пациентов с неадекватной подготовкой толстой кишки, особенно если неопластические образования были обнаружены при первичной колоноскопии..
- EndoEnglish: Показатели качества колоноскопии: ADR, PDR
- Статьи: Индикаторы качества колоноскопии, проводимой с целью скрининга колоректальных полипов и рака
- Статьи: Азбука QuaCol - брошюра образовательного проекта посвященному качеству колоноскопии
- Брошюра образовательного проекта QuaCol (материалы, классификации)
Список литературы:
Рекомендуемые статьи
Эластография при эндосонографии (ЭУС или эндоУЗИ)
Эластография (эластосонография) – метод виртуальной пальпации (технология улучшенной визуализации при ЭУС диагностике), позволяющий дифференцировать злокачественные и доброкачественные поражения лимфоузлов. Основана на принципе, что более мягкие ткани при сжатии легче деформируются, это позволяет объективно оценить консистенцию ткани, показать различия в плотности между нормальными и патологически измененными тканями.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.












.jpg)





.png)




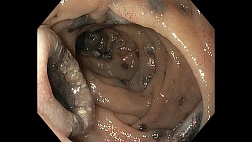













Комментарии