- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Документы и приказы: Функциональные расстройства органов пищеварения у детей
| Авторы: | Хавкин Анатолий Ильич 2020г. |

Полный текст статьи:
ФУНКЦИОНАЛЬНЫЕ РАССТРОЙСТВА ОРГАНОВ ПИЩЕВАРЕНИЯ У ДЕТЕЙ
(РОССИЙСКИЕ КЛИНИНИЧЕСКИЕ РЕКОМЕНДАЦИИ)
Оглавление
ВВЕДЕНИЕ
Младенческие срыгивания
Младенческие колики
Младенческая дисхезия
Синдром циклической рвоты
Функциональная тошнота и рвота
Функциональная диспепсия
Синдром раздраженного кишечника
Функциональная абдоминальная боль
Билиарная дисфункция
Функциональные запоры
ВВЕДЕНИЕ
Российские Клинические Рекомендации «Функциональные расстройства органов пищеварения» (ФРОП) разработаны на основе разработанных экспертами Всемирной гастроэнтерологической организации (WGO) Римских критериев IV, 2016 г. Однако они существенно переработаны с учетом особенностей отечественного здравоохранения, лекарственного обеспечения, национальных традиций медицинской науки и практики.
В частности, действующая в России возрастная периодизация предполагает выделение младенческого (до 1 года) и раннего (1-3 лет) возраста, для первого характерны такие ФР как младенческие срыгивания, колика, дисхезия, которые не встречаются у детей старше года. В Римских критериях предлагается выделять возрастной диапазон 0-4 года, который объединяет три периода отечественной возрастной периодизации.
Такая форма ФРОП как билиарные дисфункции вообще не включены в педиатрические разделы Римских Критериев, 2016, хотя в многолетних традициях отечественной педиатрии принято выделять функциональные расстройства билиарного тракта, протекающие с абдоминальной болью. В возрастную группу 1-3 года нами включена такая форма ФРОП как функциональная абдоминальная боль (ФАБ), так как нельзя отрицать наличие болей функциональной природы в этой возрастной группе, хотя в Римских критериях эта форма ФР у детей до 4 лет не предусмотрена.
Еще одной веской причиной, создания Российской версии рекомендаций являются национальные особенности регистрации, показаний и противопоказаний к лекарственным средствам. Ряд рекомендуемых Римскими Критериями препаратов не зарегистрированы для применения в России, ряд лекарственных средств имеют возрастные ограничения к применению. Имеются различия и в возможностях инструментальной и лабораторной диагностики.
Определение:
Функциональные расстройства органов пищеварения – это комплекс постоянных или повторяющихся симптомов, свойственных определенному возрасту, не объяснимых структурными или биохимическими нарушениями. Функциональные расстройства обычно не влияют на нормальное развитие ребенка и могут развиваться вследствие недостаточной адаптации в ответ на внешние или внутренние стимулы.
Примерно 20-30% детей первого года жизни и 12-20% детей более старшего возраста страдают ФРОП.
Таблица 1
Классификации функциональных расстройств по Римским Критериям и Российским клиническим рекомендациям.
|
Римские критерии IV |
Российские рекомендации |
|
| |
|
G. ФРОП у детей раннего возраста (от 0 до 3 лет): |
А. ФРОП у младенцев (до 1 года): |
|
Младенческие срыгивания |
Младенческие срыгивания |
|
Синдром руминации |
Младенческие колики |
|
Синдром циклических рвот |
Младенческая дисхезия |
|
|
Функциональные запоры |
|
Младенческие колики |
Б. ФРОП у детей раннего возраста (1 - 3 г): |
|
Функциональная диарея |
Синдром циклических рвот |
|
Младенческая дисхезия |
Функциональные абдоминальные боли |
|
Функциональные запоры |
Функциональные запоры |
|
H. ФРОП у детей и подростков (от 3 до 17 лет) |
В. ФРОП у детей и подростков (от 3 до 17 лет) |
|
Функциональные расстройства с тошнотой и рвотой
- Функциональная тошнота - Функциональная рвота |
Функциональные расстройства с тошнотой и рвотой
- Функциональная тошнота - Функциональная рвота |
|
Функциональные расстройства с абдоминальной болью
|
Функциональные расстройства с абдоминальной болью
|
|
Функциональные расстройства дефекации
|
Функциональные расстройства дефекации
|
Общие механизмы развития ФРОП:
Современные представления о природе ФРОП в целом можно представить в виде т.н. «биопсихосоциальной модели» (рис.1), которая объединяет патофизиологические механизмы и психосоциальные факторы:
1. Патофизиологические механизмы:
· Нарушения моторики ЖКТ: они свойственны большинству ФР, но не отличаются постоянством и в значительной степени вариабельны, несмотря на сходство симптомов у разных пациентов. Эта изменчивость может объясняться не столько нарушением моторики как таковой (вследствие недоразвития нервных ганглиев или нарушений гладкой мускулатуры ЖКТ), сколько нарушением нейроэндокринной регуляции, зависящей от многих внешних и внутренних факторов: диеты, микробных метаболитов, сигналов ЦНС.
· Нарушения висцеральной чувствительности: характерны для некоторых видов ФР (функциональная диспепсия, синдром раздраженного кишечника (СРК), младенческие кишечные колики). Висцеральная гиперчувствительность может быть следствием хронического воспаления и нарушенной нейро-эндокринной регуляции ЖКТ.
· Пищевая интолерантность: для многих больных с разными видами ФРОП характерна индивидуальная повышенная чувствительность к определенной пище. Это может быть непереносимость некоторых углеводов (фруктанов, моносахаридов, полиолов, глютена, лактозы), пищевых волокон, жирной и жареной, а также обильной пищи.
· Нарушение кишечной микробиоты: обнаружены при большинстве ФР как в раннем, так и в старшем возрасте. Как известно, микробиота кишечника выполняет ряд важнейших функций: метаболическую, защитную, иммуногенную. При изменении ее состава может меняться и спектр микробных метаболитов. В ряде работ было показано уменьшение уровня короткоцепочечных жирных кислот, в частности, бутирата, который оказывает противовоспалительное, регенераторное воздействие на слизистую оболочку кишечника и, напротив, увеличение количества потенциально токсичных метаболитов, которые могут оказывать раздражающее действие на рецепторы толстой кишки и усиливать боли. При нарушении микробного метаболизма могут в избытке образовываться газы: водород, метан, углекислый газ, сероводород. Как следствие, возникают типичные для ФР симптомы. Нарушением микробного метаболома можно объяснить тот факт, что больные ФР не переносят различные продукты - ведь спектр конечных метаболитов зависит, с одной стороны, от исходного продукта, а с другой – от состава кишечной микробиоты.
· Хроническое воспаление: несмотря на отсутствие явных эндоскопических изменений слизистой оболочки желудка или толстой кишки, у большинства больных ФР (функциональной диспепсией или СРК) на микроскопическом уровне выявляют признаки хронического воспаления слизистой оболочки, в том числе, увеличение числа тучных клеток и Т-лимфоцитов, а также повышение уровня провоспалительных цитокинов: IL-1β, IL-6, IL-8, TNF-a и снижение соотношения IL-10/IL-12. Этому сопутствует повышенная проницаемость кишечного барьера, которая также может быть обусловленна воспалением. Рецептор к нейропептиду S-1, расположенный на кишечном эпителии, экспрессируется при воспалении. Два специфических аллеля гена этого рецептора регулируют проницаемость эпителия. Это может объяснять связь слабого воспаления, повышенной проницаемости и нарушенной моторики при ФР.
Связь воспаления и моторики осуществляется также на уровне взаимодействия иммунной и нервной систем кишечника, причем эта связь двунаправленная. Лимфоциты собственной пластинки обладают рядом нейропептидных рецепторов (SP, CGRP, VIP, SOM и др.). Когда иммунные клетки в процессе воспаления высвобождают активные молекулы и медиаторы (простаноиды, цитокины), то энтеральные нейроны экспрессируют рецепторы для этих иммунных медиаторов (цитокинов, гистамина, PARS и др.). Возможно, этим объясняется и повышенная висцеральная чувствительность, свойственная ряду ФРОП.
2. Психосоциальные факторы:
Симптомы ФРОП могут появляться или закрепляться вследствие нарушений ЦНС. Перенесенные стрессовые ситуации, длительные периоды негативного психологического воздействия могут приводить к формированию висцеральной гиперчувствительности и нарушенной моторики.
Нарушение оси «мозг-кишка»: Благодаря общности строения и функционирования центральной и энтеральной нервной системы, ЖКТ реагирует на центральные импульсы, прежде всего, через серотонинэргическую систему. Гиперпродукция серотонина является ответной и компенсаторной реакцией на активацию катехоламинами 5HT3-рецепторов энтерохромафинных клеток, при этом отмечается усиление продукции серотонина и повышение уровня внутриклеточного кальция, что может вызвать усиление болевого синдрома со стимуляцией перистальтики и развитием висцеральной гиперчувствительности. Длительное сохранение феномена висцеральной гиперчувствительности в сочетании с повышенной активностью серотонинэргической системы может приводить к модификации эмоционального поведения, психологического статуса пациентов, развитию у них депрессивных состояний.
Таким образом, связь «мозг-кишка» двунаправлена. С одной стороны, поток болевых и других импульсов, поступающих из ЖКТ в мозг, закрепляется в виде очагов возбуждения, что было подтверждено данными позитронно-эмиссионной томографии. С другой стороны, встречный поток сигналов – от ЦНС в ЖКТ, вызывает и закрепляет нарушения моторики и гиперчувствительности в некий «порочный круг».
Формирование пищеварительной и моторной функции ЖКТ, становление кишечного биоценоза, иммунной системы кишечника, а также созревание центральной и энтеральной нервной системы происходит в первые месяцы жизни ребенка. Поэтому любые нарушения в этот период, связанные с диетическими, инфекционными, стрессовыми воздействиями, приводят к нарушению адаптации и диссинхронизации этого сложного взаимодействия. Взаимодействие основных механизмов рассматривается как ось «микробиом-кишка-мозг». Нарушения становления кишечной микробиоты лежит в основе изменения спектра микробных метаболитов, иммунных нарушений, развития воспаления в кишечнике, повышения проницаемости кишечного барьера, моторных нарушений ЖКТ, а также повышенной возбудимости и беспокойства ребенка, формируя симптомокомплекс ФРОП, свойственный детям раннего возраста. Главной особенностью большинства ФРОП в раннем возрасте (младенческие срыгивания, колики, диарея) является их благоприятное течение, уменьшение и исчезновение с возрастом по мере созревания и адаптации ребенка.
|
ФРОП: · Симптомы · Тяжесть · Течение
|
|
Психосоциальные факторы: · Стресс · Психологическое состояние |
|
Последствия: · Медицинская помощь · Нарушение качества жизни · Финансовые затраты |
|
Патофизиология: · Нарушения моторики · Висцеральная гиперчувствительность · Воспаление/иммунные нарушения · Дисбиоз · Диета |
|
Ранний возраст: · Генетика · Перинатальные факторы · Вскармливание
|
Рис.1. Схема «биопсихосоциальной модели» функциональных расстройств ЖКТ
(по D.Drossman)
Младенческие срыгивания
1. Определение
1.1. Младенческие срыгивания (регургитация) (МКБ-X Р 92.1) – представляют собой ретроградный пассаж (заброс) содержимого желудка за пределы органа – глотку, ротовую полость или из ротовой полости [1].
2. Эпидемиология
2.1. Ежедневные срыгивания отмечаются у детей в возрасте до 3 месяцев с частотой 86,9%, угасают к году, сохраняясь только у 7,6% [1,2].
3. Классификация не разработана.
4. Этиология и патогенез
4.1. Высокая частота срыгиваний у детей первого года жизни обусловлена особенностями строения верхних отделов пищеварительного тракта (пищевод широкий, переходит в желудок под прямым углом, желудок шарообразной формы, ножки диафрагмы неплотно охватывают пищевод, пилорический отдел желудка развит хорошо, кардиальный отдел выражен слабо) и незрелостью нервно-гуморального звена регуляции сфинктерного аппарата и моторики желудочно-кишечного тракта. Срыгивание носит физиологический характер и связано с механизмом сосания - облегчает отхождение избытка заглоченного воздуха из желудка.
4.2. Причинами срыгиваний у здоровых детей являются: высокое давление в брюшной полости вследствие тугого пеленания, запоров, повышенного газообразования, длительного крика, нарушение техники кормления; перекорма.
Появление срыгивания связано с объемом принимаемой пищи: его увеличение приводит к удлинению времени опорожнения желудка, к повышению внутрижелудочного давления и к учащению эпизодов спонтанных транзиторных расслаблений нижнего пищеводного сфинктера, что создает предпосылки для развития у ребенка гастроэзофагального рефлюкса (ГЭР) [2].
4.3. Другими причинами срыгиваний без структурных изменений со стороны желудочно-кишечного тракта может быть синдром вегето-висцеральных нарушений при церебральной ишемии (пилороспазм), дискинезия ЖКТ, наследственные заболевания, связанные с нарушением обмена веществ.
5. Диагностика
5.1. Срыгивания – диагноз клинико-анамнестический.
Диагноз синдрома срыгивания у здоровых детей в возрасте от 3 недель до 12 месяцев может быть установлен при наличии эпизодов срыгивания, по меньшей мере, 2 раза в день на протяжении не менее 3 недель, на фоне отсутствия тошноты, примеси крови в рвотных массах, аспирации желудочного содержимого, апноэ, отставания в темпах физического развития, затруднений во время кормления или в процессе проглатывания пищи, а также неправильного положения тела [2].
5.2. У детей с упорными срыгиваниями необходимо провести тщательный сбор анамнеза и полное физикальное обследование с целью исключения «симптомов тревоги», свидетельствующих о наличии органического заболевания: снижение массы тела, рвота фонтаном, рвота с примесью крови или желчи, а также респираторные нарушения вплоть до развития апноэ и синдрома внезапной смерти. Одним из важных этапов обследования является анализ антропометрических показателей, что позволяет оценить темпы физического развития [3].
6. Лабораторно-инструментальные методы обследования
6.1. При наличии «симптомов тревоги», для исключения анатомических аномалий верхних отделов желудочно-кишечного тракта, рекомендуется проведение рентгеноскопии верхних отделов желудочно-кишечного тракта с барием.
6.2. Проведение ультразвукового исследования (УЗИ) целесообразно для исключения анатомических нарушений (пилоростеноз, гидронефроз, камни ЖП, перекрут яичка, гастропарез, нарушение моторики желудка).
6.3. Проведение зофагогастродуоденоскопия (ЭГДС) необходимо детям, имеющим такие «симптомы тревоги», как отказ от еды, недостаточную прибавку массы тела, рецидивирующие заболевания ЛОР органов (например, отиты), беспокойство при глотании и т.д. Это обследование позволяет оценить состояние слизистой оболочки пищевода, желудка, состоятельность кардиального сфинктера и др. При необходимости проводится прицельная биопсия слизистой оболочки пищевода и желудка. Гистологическое исследование помогает в максимально ранние сроки определить природу и степень выраженности воспалительного процесса.
Рутинное применение УЗИ желудка с водно-сифонной пробой и ЭГДС для диагностики гастроэзофагальной рефлюксной болезни не рекомендуется [мнение экспертов].
6.4. Дополнительное обследование, в случае наличия симптомов тревоги, может включать консультацию специалистов – детского хирурга, аллерголога, невролога.
7. Дифференциальный диагноз
К основным заболеваниям, с которыми необходимо проводить дифференциальную диагностику младенческих срыгиваний относятся: анатомические аномалии верхних отделов желудочно-кишечного тракта (грыжа пищеводного отверстия диафрагмы, пилоростеноз, стеноз 12-перстной кишки, ахалазия, стриктуры, кольца Шацкого, трахеоэзофагеальная фистула, орофарингеальная дисфагия), гастроэзофагеальная рефлюксная болезнь, аллергия к белкам коровьего молока, лактазная недостаточность, натальная травма шейного отдела позвоночника, нарушение вегетативной регуляции, муковисцидоз.
8. Лечение
8.1. Мероприятия по лечению срыгиваний включают обучение родителей простейшим приемам постуральной терапии и правильной технике вскармливания с целью предотвращения аэрофагии. Необходимо информирование о том, что перекармливание способствует срыгиванию.
8.2. Постуральная терапия (терапия положением) у грудных детей заключается в кормлении ребенка под углом 45-60 градусов, что препятствует срыгиванию и аэрофагии. Удерживать ребенка в вертикальном положении после кормления следует не менее 20-30 минут (с приподнятой головой) [4].
8.3. Придание ребенку вынужденного положения во время сна (приподнятый головной конец кровати, горизонтальное положение на животе) не рекомендуется вследствие риска синдрома внезапной детской смерти [5].
8.4. Диетическая коррекция
При естественном вскармливании необходимо создать спокойную обстановку для кормящей матери, направленную на сохранение лактации, нормализовать режим кормления ребенка, исключающий перекорм и контролировать правильное прикладывание к груди для профилактики аэрофагии.
При искусственном вскармливании в случае отсутствия данных за гастроинтестинальные проявления пищевой аллергии, ребенка можно перевести на один из специализированных продуктов питания – антирефлюксную молочную смесь (табл. 3), вязкость которой повышается за счет введения в состав загустителей [3]. В качестве таких загустителей используются два вида полисахаридов - неперевариваемые (клейковина бобов рожкового дерева - камедь) и перевариваемые (модифицированные крахмалы). Антирефлюксные смеси обладают хорошей переносимостью и удовлетворяют потребность детей во всех основных пищевых веществах и энергии.
Камедь, входящая в состав антирефлюксных смесей, набухает в желудке ребенка и связывает жидкость, тем самым, делая смесь гуще, что препятствует срыгиваниям. Антирефлюксные продукты, содержащие камедь, вводятся в рацион ребенка постепенно, в каждое кормление. Объем лечебной смеси подбирается индивидуально до прекращения срыгиваний. Возможно ее добавление в бутылочку со стандартной молочной смесью, которую получает ребенок, но более эффективным является самостоятельное применение этой смеси в начале кормления.
Специальные лечебные смеси, в состав которых в качестве загустителя введен крахмал (рисовый, кукурузный или картофельный) оказывают антирефлюксное действие за счет его набухания в желудке ребенка, что препятствует возникновению срыгиваний. Эффект от их применения наступает в более отдаленный период, по сравнению со смесями, содержащими камедь. Эти смеси показаны детям как при нормальном стуле, так и при склонности к неустойчивому стулу. Крахмалосодержащие смеси целесообразно рекомендовать для полной замены ранее получаемой молочной смеси.
Несмотря на высокую клиническую эффективность антирефлюксных смесей, они не должны использоваться бесконтрольно, как альтернатива обычным адаптированным молочным формулам. Эти смеси применяются на определенном этапе лечения синдрома срыгиваний, при конкретных показаниях. Продолжительность применения антирефлюксных смесей – индивидуальна, иногда достаточно длительная (до 2 – 3 мес.), и только после достижения стойкого терапевтического эффекта ребенок переводится на адаптированную молочную смесь [3,6].
8.5. Назначение антисекреторных препаратов и прокинетиков при физиологической регургитации неэффективно [7-9].
9. Показания для госпитализации
9.1. Упорные срыгивания, неподдающиеся коррекции;
9.2 Наличие симптомов обезвоживания, значительная потеря массы тела;
9.3 Респираторные симптомы, ассоциирующиеся со срыгиваниями (ларингоспазм, бронхоспазм, афония, кашель);
9.4 Срыгивания, чередующиеся рвотой, примесь крови и желчи в рефлюктате
9.5 Наличие срыгивания у ребенка старше года;
Список литературы
1. Sherman P.M., Hassall E., Fagundes-Neto U., Gold B.D., Kato S., Koletzko S. A global, evidence-based consensus on the definition of gastroesophageal reflux disease in the paediatric population. Am J Gastroenterol 2009; 104:1278–95.
2. Vandenplas Y., Gutierrez-Castrellon P, Velasco-Benitez C, Palacios J., Jaen D, Ribeiro H, Lynette Shek Pei-Chi, Lee Bee-Wah, Alarcon P. Practical algorithms for managing common gastrointestinal symptoms in infants. Nutrition 29 (2013) 184–194.
3. Rosen R, Vandenplas Y, Singendonk M, Cabana M, DiLorenzo C, Gottrand F, Gupta S, Langendam M, Staiano A, Thapar N, Tipnis N, Tabbers M. Pediatric Gastroesophageal Reflux Clinical Practice Guidelines: Joint Recommendations of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. // J Pediatr Gastroenterol Nutr. 2018 Mar; 66(3):516-554.
4. van Wijk MP, Benninga MA, Davidson GP, et al. Small volumes of feed can trigger transient lower esophageal sphincter relaxation and gastroesophageal reflux in the right lateral position in infants. J Pediatr 2010; 156: 744–748, 748 e1.
5. Moon RY. SIDS and other sleep-related infant deaths: expansion of recommendations for a safe infant sleeping environment. Pediatrics 2011; 128:1030–1039
6. Horvath A, Dziechciarz P, Szajewska H. The effect of thickened-feed interventions on gastroesophageal reflux in infants: systematic review and meta-analysis of randomized, controlled trials. Pediatrics 2008; 122:e1268–e1277.
7. Vandenplas Y, Gutierrez-Castrellon P, Velasco-Benitez C. Palacios et al. Practical algorithms for managing common gastrointestinal symptoms in infants. Nutrition. 2013;29(1):184–94.
8. Lightdale JR, Gremse DA. Gastroesophageal reflux: management guidance for the pediatrician. Section on Gastroenterology, Hepatology, and Nutrition. Pediatrics. 2013;131(5):e1684–95.
9. Moore DJ, Tao BS, Lines DR, et al. Double-blind placebo-controlled trial of omeprazole in irritable infants with gastroesophageal reflux. J Pediatr. 2003;143(2):219–23.
Младенческие колики
1. Определение
1.1. Младенческие колики (МКБ-X R 10.4 и Р 92.0) - регулярные эпизоды повышенной раздражительности, беспокойства и/или плача, возникающие и завершающиеся без очевидных причин [1].
1.2. Младенческие колики характерны для детей младше 5 месяцев.
1.3. Младенческие колики типичны для детей, у которых нет нарушения роста и развития, лихорадки или проявлений других заболеваний [1].
2. Эпидемиология
2.1. Частота возникновения младенческих колик в среднем 20 %. Данное расстройство с одинаковой частотой поражает детей обоих полов, находящихся на естественном и искусственном вскармливании [2].
3. Классификация не разработана.
4. Этиология и патогенез
4.1. Младенческая колика может быть обусловлена разными причинами, как со стороны ребенка, так и со стороны матери (таблица 2).
Таблица 2.
Факторы риска колик со стороны матери и ребенка
|
Со стороны матери |
Со стороны ребенка |
|
Психосоциальные факторы: - первый ребенок в семье - отсутствие социальной поддержки беременной женщины - конфликты в семье - матери «одиночки» - возраст старше 35 лет - курение во время беременности - психоэмоциональное состояние окружения Болезни матери: - метаболический синдром - мигрень у матери |
Роды путем «кесарева сечения» |
|
Нарушение формирования адекватного микробиома кишечника | |
|
Увеличение содержания Escherichia coli: метеоризм, нарушение двигательной активности | |
|
Недостаток мелатонина и избыток серотонина | |
|
Ферментативная незрелость (транзиторная, относительная лактазная недостаточность) | |
|
Повышенный уровень мотилина и грелина в крови | |
|
Ошибки ухода: - нарушение диеты кормящей матерью; - нарушение техники вскармливания: быстрое сосание, неправильный захват соска, заглатывание воздуха, перекорм, перегрев. |
Сенсибилизация к белку коровьего молока |
5. Диагностика
Диагноз младенческих колик - клинико-анамнестический.
5.1. Обычно младенческие колики проявляются в первые недели жизни младенца, достигают кульминации в возрасте 2-3 месяцев и постепенно уменьшаются, исчезая к 5 месяцам. Вечерние часы – наиболее типичное время для развития колик. Основополагающим клиническим симптомом колики является чрезмерный и упорный громкий плач. Во время каждого эпизода ребенок становится возбужденным, раздраженным и беспокойным, сучит ножками. Также наблюдают покраснение лица и, нередко, урчание в животе. Эта симптоматика вызывает серьезное беспокойство родителей, даже если ребенок выглядит вполне здоровым, нормально растет, развивается, и имеет хороший аппетит. Проводимое обследование ребенка, как правило, не позволяет выявить наличие патологических нарушений [1].
Рекомендуемым первым шагом в диагностике колики является выявление «симптомов тревоги» (таблица 3).
Таблица 3
Симптомы тревоги при младенческой колике
|
Упорный крик с изменением тональности |
|
Повторные рвоты |
|
Рвота с кровью |
|
Кровь в стуле |
|
Отсутствие набора массы тела и/или потеря массы тела |
|
Замедление линейного роста |
|
Необъяснимая лихорадка |
6. Лабораторно-инструментальные методы обследования
6.1. По показаниям, при наличии «симптомов тревоги» могут быть назначены: клинический анализ крови и мочи, анализ кала на скрытую кровь, анализ кала на кальпротектин, биохимические анализы крови (уровень печеночных трансаминаз, щелочной фосфатазы, ɣ- глутамилтранспептидазы, амилазы, СРБ), ультразвуковое исследование, эндоскопические исследования (эзофагогастродуоденоскопия, колоноскопия), дыхательные водородные тесты с лактозой.
6.2. Для уточнения инфантильных спазмов рекомендуется консультация невролога.
7. Дифференциальный диагноз
Необходимо исключить у младенца заболевания, сопровождающиеся развитием младенческих колик, таких как гастроинтестинальная форма пищевой аллергии, лактазная недостаточность, патология центральной нервной системы (синдром внутричерепной гипертензии). При наличии «симптомов тревоги» рекомендуется исключение острой хирургической патологии (инвагинации кишечника, ущемленной грыжи, кишечной непроходимости, аномалий развития).
8. Лечение
Младенческие колики представляют собой состояние с множеством различных этиологических и предрасполагающих факторов. Многофакторный характер расстройства предопределяет низкую вероятность значимого клинического улучшения в общей популяции пациентов на фоне применения одного вида вмешательства. Предлагается комплексный подход в лечении.
8.1. Первым шагом в лечении младенческой колики является психологическая поддержка и разъяснительная работа с родителями, которым объясняют основные причины развития младенческих колик, их тенденцию уменьшаться с возрастом.
При младенческих коликах на фоне нормального физического и нервно-психического развития основное внимание следует уделить предотвращению плача и предоставлению родителям необходимой информации и поддержки.
Важнейшие принципы, соблюдение которых рекомендовано:
1) помимо патологии, плач свидетельствует о наличии у младенцев повышенной возбудимости или гиперактивности;
2) первые три месяца жизни ребенка можно рассматривать в качестве переходного этапа нервно-психического развития, который большинство детей проходят более или менее благополучно;
3) информирование родителей в том, что раздражение, вызываемое детским плачем, является нормальной реакций, а также информирование об опасностях «синдрома детского сотрясения»;
4) выработка путей предупреждения и минимизации детского плача, акцентируя родителей на положительных особенностях развития ребенка;
5) поиск возможностей для получения поддержки в уходе за ребёнком, которые позволяют каждому из родителей найти свободное время для восстановления сил;
6) психологическая поддержка родителей и помощь в осознании того, что первые 3 месяца жизни ребенка представляют собой трудный период, который они в состоянии преодолеть с положительными последствиями для себя и для их взаимоотношений с ребенком [3,4].
8.2. Диетотерапия колик должна быть дифференцированной, в зависимости от вида вскармливания.
Естественное вскармливание
Из питания матери исключают продукты, повышающие газообразование в кишечнике (сахар и кондитерские изделия, сладкий чай с молоком, виноград, сладкие творожные пасты и сырки, безалкогольные сладкие напитки), и продукты, богатые экстрактивными веществами (мясные и рыбные бульоны, лук, чеснок, консервы, маринады, соленья, колбасные изделия). Цельное молоко рекомендуется заменить на кисломолочные продукты (кефир, йогурт, творог, сыр, сливочное масло). Необходимо исключить перекорм ребенка, особенно при свободном вскармливании.
Искусственное и смешанное вскармливание
Необходимо рекомендовать ребенку адекватную современную детскую молочную смесь, соответствующую особенностям его пищеварительной системы, не допускать перекорма. Возможно введение в рацион адаптированной кисломолочной смеси. При отсутствии эффекта целесообразно использование продуктов, предназначенных для детей с ФРОП - смесей, которые имеют в своём составе частично гидролизованный белок, пониженное содержание лактозы и обогащены пре- и пробиотиками (смеси серии Комфорт). Возможно применение смесей на основе высокого гидролиза белка сроком на 2-4 недели. При наличии эффекта необходимо продолжить кормление указанными смесями.
8.3. Физические методы воздействия – сухое тепло на живот ребенка (например, теплая пеленка); поглаживание живота; применение газоотводной трубочки в ряде случаев помогают при колике.
8.4. Медикаментозная терапия.
В литературе нет однозначных данных, указывающих на эффективность применения медикаментозной терапии при младенческих коликах. Медикаментозное лечение младенческих колик носит индивидуальный характер. Можно использовать препараты, содержащие симетикон, Lactobacillus reuteri [5,6]. Однако в связи с полученными противоречивыми результатами исследований не рекомендуется их рутинное применение.
9. Показания для госпитализации
9.1 Продолжительность болевого приступа более 3 часов;
9.2 Отсутствие стула, выделение слизи с примесью крови;
9.3 Повышение температуры тела, симптомы интоксикации;
9.4 Повторная рвота, рвота кишечным содержимым.
Список литературы
1. Benninga S, Nurko MA, Faure C, Hyman PE, James Roberts I.St., Schechter NL. Childhood Functional Gastrointestinal Disorders: Neonate/Toddler. Gastroenterology. 2016; 150(6): 1443- 1455.
2. Shergill-Bonner R.. Infantile colic: practicalities of management, including dietary aspects. J.Fam Health Care 2010;20:206–9.
3.James-Roberts IS, Alvarez M, Hovish K. Emergence of a developmental explanation for prolonged crying in 1- to 4-month-old infants: review of the evidence. J Pediatr Gastroenterol Nutr 2013; 57(Suppl 1):S30–S36.
4. Vik T., Grote V., Escribano J., Socha J., Verduci E., Fritsch M., Carlier C., von Kries R., Koletzko B.; European Childhood Obesity Trial Study Group. Infantile colic, prolonged crying
and maternal postnatal depression. Acta Paediatr. 2009 Aug;98(8):1344-8.
5. Szajewska H, Gyrczuk E, Horvath A. Lactobacillus reuteri DSM 17938 for the management of infantile colic in breastfed infants: a randomized, double-blind, placebocontrolled trial. J Pediatr 2013;162:257–262.
6. Savino F, Cordisco L, Tarasco V, et al. Lactobacillus reuteri DSM 17938 in infantile colic: a randomized,double-blind, placebo-controlled trial. Pediatrics 2010;126: e526–e533.
Младенческая дисхезия
1. Определение
1.1. Младенческая дисхезия представляет собой нарушенную дефекацию, обусловленную неспособностью координировать повышенное внутрибрюшное давление с расслаблением мышц тазового дна [1,2].
2. Эпидемиология
2.1. Популяционное исследование, проведенное в Нидерландах, показало, что в возрасте 1 и 3 месяцев, дисхезия наблюдалась соответственно у 3,9% и 0,9% новорожденных [3]. По данным анкетирирования 1447 матерей распространенность дисхезии составила 2,4% в первый год жизни [4].
3. Классификация не разработана.
4. Этиология и патогенез.
Причиной дисхезии является неспособность ребенка координировать повышенное внутрибрюшное давление во время дефекации с расслаблением мышц тазового дна [1].
5. Диагностика
Дисхезия – диагноз клинико-анамнестический.
5.1. Диагностические критерии дисхезии для детей в возрасте <9 месяцев включают [3]:
1. По крайней мере, напряжение и плач в течение 10 минут перед неудачной или успешной дефекацией мягким стулом.
2. Отсутствие другой патологии.
5.2. Клиническая картина: проявляется дисхезия криком и плачем ребенка перед дефекацией. При этом наблюдается резкое покраснение лица ребенка (так называемый «синдром пурпурного лица»). Симптомы обычно сохраняются в течение 10-20 минут, дефекация может отмечаться несколько раз в день, кал мягкий и без примесей. Характерно для дисхезии то, что ребенок успокаивается сразу после дефекации. У большинства младенцев симптомы дисхезии начинаются в первые 2–3 месяца жизни и разрешаются самопроизвольно к 9 месяцам.
5.3. Врач оценивает диету ребенка, проводит физикальное обследование, в том числе ректальное, для исключения аноректальных аномалий; анализирует параметры физического развития ребенка [2].
6. Лабораторно-инструментальные методы обследования – не требуются.
6.1. Дополнительное обследование проводится при наличии симптомов тревоги (появление крови в стуле, необъяснимой лихорадки, отсутствие набора массы тела и/или потеря массы тела, замедление линейного роста).
6.2. Дополнительное обследование может включать консультацию специалистов – детского проктолога, невролога.
7. Дифференциальный диагноз
7.1. Дифференциальный диагноз проводится с аноректальными пороками развития.
8. Лечение
8.1. Родителям ребенка необходимо сообщить об отсутствии патологического процесса, который требует необходимости вмешательства.
8.2. Не рекомендуется прибегать к стимуляции прямой кишки, поскольку в дальнейшем ребенок может ждать стимуляции, прежде чем совершит акт дефекации [2]. Возможна периодическая стимуляция перианальной зоны.
8.3. Слабительные средства при дисхезии не назначаются [2].
9.Показания для госпитализации
Не определены.
Список литературы
1. Hyman PE, Milla PJ, Benninga MA, et al. Childhood functional gastrointestinal disorders: neonate/toddler. Gastroenterology 2006;130:1519–1526.
2. Benninga MA., Nurko S, Faure C, Hyman PE, Roberts I St. J, Schechter NL. Childhood Functional Gastrointestinal Disorders: Neonate/ToddlerGastroenterology 2016;150:1443–1455
3. Kramer EA, den Hertog-Kuijl JH, van den Broek LM, et al. Defecation patterns in infants: a prospective cohort study. Arch Dis Child 2015;100:533–536.
4. Van Tilburg MA, Hyman PE, Rouster A, et al. Prevalence of functional gastrointestinal disorders in infants and toddlers. J Pediatr 2015;166:684–689.
Синдром циклической рвоты
1. Определение
1.1. Синдром циклической рвоты (СЦР) (МКБ-X R 11) – постоянные, стереотипные эпизоды интенсивной тошноты и рвоты длительностью от часов до нескольких дней, которые разделены интервалами от недели до месяца (Rom IY) [6].
2. Эпидемиология
2.1. Распространённость СЦР – 0,2-1,0%. Средний возраст начала СЦР – 3.5-7 лет, но может наблюдаться у детей любого возраста и взрослых. В 46% начало в 3 года или раньше [4,6].
3. Клиническая картина характеризуется фазностью течения.
3.1. В фазу приступа отмечаются стереотипные (примерно одинаковые у каждого отдельного пациента по продолжительности, клиническим проявлениям и длительности бессимптомного периода) эпизоды интенсивной рвоты, которые начинаются, как правило, утром, продолжаются от нескольких часов до дней, могут сопровождаться тошнотой, болями в животе, сонливостью, мигренеподобными симптомами (головной болью, фото- и фонофобией, головокружением) и может закончиться внезапно или постепенно (восстановительная фаза) в течение нескольких часов.
3.2. Фаза продрома предшествует рвоте, могут наблюдаться тошнота, бледность, смена настроения, утомляемость, беспокойство, головная боль и головокружение.
3.3. В межприступную фазу симптоматика отсутствует.
4. Патофизиология [5,9,10]
4.1. СЦР является полиэтиологичным заболеванием, в основе которого лежат неврологические, метаболические, эндокринные, а также двигательные нарушения желудочно-кишечного тракта, часто связанные с другими эпизодическими состояниями, такими как мигрень, абдоминальная мигрень.
4.2. Провоцирующими факторами являются инфекционные заболевания (в т.ч. синуситы, отиты), нарушения сна, травмы, эмоциональное возбуждение, психологические стрессы, связанные со школой, семейными и другими конфликтами, менструации, тревожность, употребление некоторых продуктов (сыр, шоколад, продуктов, содержащих глютамат натрия, аспартам), пищевая аллергия;
4.3. Генетическая предрасположенность к развитию мигрени, что подтверждается семейными случаями мигрени. Значение генетического фактора в механизме развития СЦР было подтверждено и наследованием по материнской линии митохондриальной ДНК.
4.4. Нейро-эндокринная дисфункция, связанная с повышенным выделением кортикотропин-рилизинг-фактора, с последующей гиперсекрецией АКТГ и активацией гипоталамо-гипофизарно-адреналовой системы.
4.5. Нарушение автономной вегетативной регуляции, на что указывает наличие в фазу приступа, кроме рвоты, таких симптомов как повышение температуры, слюнотечение, диарея, бледность, вялость, а также выявленные в межприступную фазу исходно высокий тонус симпатической и низкий тонус парасимпатической ВНС.
4.6. Хроническое употребление каннабиноидов (курение гашиша, марихуаны) может быть причиной сильной рвоты, тошноты, болей в животе (каннабиоидный гиперметрический синдром), что должно рассматриваться у больных подростков.
5. Диагностика
5.1. Диагностические критерии СЦР включают всё из следующих (Rome IV):
1. Два периода или более интенсивной упорной тошноты и пароксизмов рвоты, длящихся от часов до дней в течение 6-месячного периода;
2. Эпизоды стереотипны у каждого пациента;
3. Эпизоды разделяются периодами от недель до месяцев с возвращением базового состояния здоровья между эпизодами рвоты;
4. После надлежащей медицинской оценки симптомы не могут быть отнесены к другому состоянию.
5.2. У детей с ранним началом симптомов следует исключить нейрометаболические заболевания путём соответствующего исследования, которое должно осуществляться во время эпизодов рвоты до назначения инфузий (Rome IV)
5.3. Показаниями для углубленного обследования являются – неукротимая рвота на фоне сильной боли в животе; прогрессивное ухудшение эпизодов рвоты, их хроническое течение; приступы, провоцируемые интеркуррентным заболеванием, ограничением употребления пищи и / или употребления пищи с высоким содержанием белка; рвота на фоне неврологических нарушений; наличие лабораторных нарушений (гипогликемии, метаболического ацидоза, респираторного алкалоза или гипераммониемии) [7].
6. Лабораторно-инструментальные методы обследования [1,3,5]
6.1. К методам обследования на первом уровне детей с СЦР относятся общеклинические анализы крови, мочи, биохимический анализ крови (липаза, амилаза, АлАТ, АсАТ, ГГТП, билирубин, глюкоза, электролиты).
6.2. На первом этапе обследования - УЗИ органов брюшной полости, почек.
6.3. ЭГДС может быть проведена при наличии симптомов желудочно-кишечного кровотечения, которое возможно при выраженной рвоте из пищевода, при желудочно-пищеводном разрывно-геморрагическом синдроме Маллори-Вейса, для исключения гастродуоденальной патологии.
6.4. На втором уровне по показаниям МРТ головного мозга, ЭЭГ
6.5. Может потребоваться определение лактата, пирувата, органических кислот, аминокислот, карнитина, ацилкарнитина, кортизола для диагностики митохондриальной дисфункции, которая в числе полисистемных проявлений может иметь рецидивирующую рвоту. Необходимость её диагностики подтверждается, во-первых, преобладанием лиц женского пола среди больных СЦР, а известно, что митохондриальная дисфункция характеризуется наличием у пациентов мутаций митохондриальной ДНК (mtDNA), которая наследуется только по материнской линии. Во-вторых, выявленного во время эпизодов СЦР повышения мочевой кислоты, лактата и нарушения обмена органических кислот, подобных изменениям у больных с известными митохондриальными заболеваниями, а также эффективностью применения при СЦР декстрозы, L-карнитина и предупреждения голодания, что указывает на наличие очевидной митохондриальной дисфункции даже у больных без выявленных мутаций mtDNA.
6.6. Анализ спектра аминокислот и ацилкарнитинов методом тандемной масс-спектрометрии для исключения заболеваний, связанных с нарушением обмена аминокислот, органических кислот, дефектов b-окисления жирных кислот.
Для выявления мутаций исследование митохондриальной ДНК путём сиквенса.
6.7. Также при дифдиагностики может потребоваться определение порфиринов в моче.
7. Дифференциальный диагноз
7.1. При наличии показаний (п.5.2., 5.3.) следует проводить дифференциальную диагностику с широким спектром заболеваний:
· патологией ЖКТ, в т.ч. хирургической: мальротация с заворотом кишок, послеоперационные стриктуры и спайки, заболевания желчного пузыря, киста общего желчного протока, панкреатит, гепатит;
· патологией почек (пельвиоуретральняа обструкция);
· патологией нервной системы: опухоли головного мозга, мигрень, мальформации Киари, гидроцефалии, сложные парциальные эпилепсии;
· метаболические/эндокринные нарушения: сахарный диабет, болезнь Аддисона, феохромоцитома, аминоацидопатии, органические ацидемии, нарушение окисления жирных кислот, митохондриальные нарушения, дефекты цикла мочевины, острая перемежающаяся порфирия.
8. Лечение
8.1. В фазу продрома и приступа [5,7,10]:
8.1.1. Ребёнок должен находится в спокойной обстановке, исключить раздражающее действие света, звука, исключить употребление пищи (до 2-3 дней). Необходимо раннее начало лечения (в первые 2-4 часа)
8.1.2. Противорвотные препараты. Обычные противорвотные препараты (метоклопрамид, домперидон) могут быть мало- или неэффективными. Используется антагонист 5HT3-рецепторов ондансетрон 0,3–0,4 мг/кг в/в каждые 4-6 часов (до 20 мг).
8.1.3. Введение жидкостей, электролитов: декстроза D10 + KCl, при невозможности орального приёма пищи 3 и более дня парентеральное питание
8.1.4. Седативные средства: дифенгидрамин (димедрол) 1,0–1,25 мг/кг в/в каждые 6 часов; лоразепам 0,05–0,1 мг/кг в/в каждые 6 часов; хлорпромазин (аминазин) 0,5–1,0 мг/кг каждые 6 часов.
8.1.5. Симптоматические средства: аналгетики (НПВП / наркотические), эпигастральная боль (ИПП), диарея (имодиум), артериальная гипертензия (ингибиторы АПФ), антимигренозные средства (триптаны).
8.1.6. При синдроме каннабиоидной рвоты временное облегчение симптомов часто обеспечивает настойчивая длительная горячая ванна или душ [6,4].
8.2. В межприступную фазу:
8.2.1. Выявлять провоцирующие факторы и избегать их действия: стрессы, перенапряжение, эмоциональное возбуждение, употребление продуктов (сыр, шоколад, аллергены, аспартам, глутамат натрия, кофеин), нарушения сна, голодание.
8.2.2. Профилактическое лечение [7,8]. У детей до 5 лет - ципрогептадин 0,25-0,50 мг/кг/день разделен на 2-3 приема (в настоящее время в РФ отсутствует); пропранолол 0,25–1,00 мг/кг/день, чаще всего 10 мг 2-3 раза в день. У детей старше 5 лет после консультации невролога амитриптилин: начальная доза 0,25–0,50 мг/кг, увеличивая ежедневно на 5-10 мг до 1,0–1,5 мг/кг, мониторирование ЭКГ (интервал QT) перед началом и в течение 10 суток на пиковой дозе; пропранолол (дозу см. выше)
8.2.3.Дополнительная терапия: коэнзим Q10, L-карнитин [2,6,7].
8.2.4. Акупунктура или психотерапевтическая (поведенческая) терапия [6]
9. Показания для госпитализации
9.1. Затяжная, повторяющаяся рвота.
9.2. Наличие признаков эксикоза, метаболических нарушений.
9.3. Неэффективность лечения в амбулаторно-поликлинических условиях.
9.3. Невозможность обследования в амбулаторно-поликлинических условиях.
Список литературы
1. Белоусова Е.Д. Циклическая рвота. Российский вестник перинатологии и педиатрии. – 2011. - №6. - с.63-65.
2. Боулс Р. Эффективность комбинированной терапии с применением коэнзима Q10,
L-карнитина и амитриптилина в лечении синдрома циклической рвоты
и сопутствующих функциональных расстройств. Российский вестник перинатологии и педиатрии. 2012. – Т.4, №2. - 105-111.
3. Камалова А.А., Шакирова А.Р. Синдром циклической рвоты. Вопросы детской диетологии. – 2013. – Т.11, №6. – с.69-71.
4. Пиманов С.И., Силивончик Н.Н. Римские IY рекомендации по диагностике и лечению функциональных гастроэнтерологических расстройств: Пособие для врачей. М.,2016, с. 136-137.
5. Пипа Л.В., Свістільнік Р.В., Леньга В.Р. и др. Синдром циклічної блювоти у дітей. Сучасні погляди і останні рекомендації з ведення хворих Частина 2 Здоровье ребенка. 2011; 4 (31): http://www.mif-ua.com/archive/article_print/23053
6. Hyams J.S., Di Lorenzo S., Saps M. et al. Functional gastrointestinal disorders: child / adolescent. Gastroenterology. 2016; 150:1456-68. DOI: https://doi.org/10.1053/j.gastro.2016.02.015
7. Li B.U., Lefevre F., Chelimsky G. G. et al. North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition Consensus Statement on the Diagnosis
and Management of Cyclic Vomiting Syndrome. J Pediatr Gastroenterol Nutr, 2008; 47 (3): 379–393.
8. Madani S, Cortes O, Thomas R. Cyproheptadine Use in Children With Functional Gastrointestinal Disorders. J Pediatr Gastroenterol Nutr. 2016; 62(3): 409-13. doi: 10.1097/MPG.0000000000000964.
9. Kaul A, Kaul K. Cyclic vomiting syndrome: a functional disorder. Pediatr Gastroenterol Hepatol Nutr. 2015; 18(4): 224–9. doi: 10.5223/pghn.2015.18.4.224
10. Romano C., Dipasquale V., Rybak A., Comito D., Borrelli O. An overview of the clinical management of cyclic vomiting syndrome in childhood. Curr Treat Options Gastroenterol. 2018 https://doi.org/10.1080/03007995.2018.1445983
Функциональная тошнота и рвота
1. Определение
1.1. Тошнота - это субъективный симптом неприятного ощущения надвигающейся потребности во рвоте, обычно испытываемое в эпигастрии или горле. Рвота - это мощное, активное поступление желудочного и кишечного содержимого в ротовую полость и наружу, при этом сокращаются мышцы живота и грудной клетки (МКБ-X R 11; Rome IV H1b). Рвоту следует различать от регургитации (срыгивания) и руминации. (Rom IY) [1,2].
Данная форма функциональных расстройств у детей в Римских критериях выделена впервые [2,3].
2. Эпидемиология
2.1. В литературе отсутствуют данные по распространённости изолированной тошноты и изолированной рвоты, а также сочетания этих симптомов у детей [1,2].
2.2. Имеются отдельные сообщения, в которых функциональная тошнота (ФТ) и функциональная рвота (ФР) встречались у 0,7% детей 8-18 лет [5], функциональная тошнота у 3,4% [7]
3. Классификация
Не разработана
4. Патофизиология
4.1. Тошнота и рвота возникают в результате сложных взаимодействий между желудочно-кишечным трактом, центральной нервной системой и вегетативной нервной системой. Афферентные пути из желудочно-кишечного тракта через блуждающий нерв, вестибулярную систему и триггерную зону хеморецептора проецируются на ядро солитариуса, которое, в свою очередь, передаёт сигналы на центральный генератор паттернов, чтобы инициировать множественные нисходящие пути, что приводит к симптомам тошноты и рвоты [6].
Полученные в последнее время данные показывают, что несмотря на тесную связь, центральные пути тошноты и рвоты частично отличаются и тошнота больше не считается только предпоследней стадией рвоты, а также центральный путь хронической тошноты отличается от такового при острой тошноте и очень похож на путь нейропатической боли.[6 ]
4.2. Расстройство ВНС, т.к. некоторые пациенты с функциональной тошнотой и рвотой испытывают такие симптомы как потливость, головокружение, бледность, тахикардия. Некоторые дети испытывают тошноту только рано утром, а когда они «спят подольше», тошнота не возникает (Romе IY).
5. Диагностика
5.1. Диагностические критерии ФТ включают соответствие всем следующим критериям в течение не менее 2 последних месяцев перед диагностикой (Rome IV) [1,2].:
- Беспокоящая тошнота как преобладающий симптом, возникающий по крайней мере дважды в неделю и, как правило, не связанный с приёмом пищи;
- Не постоянно ассоциируется с рвотой;
- После надлежащей оценки тошнота не может быть полностью объяснена другими медицинскими состояниями.
5.2. Диагностические критерии ФР включают соответствие всем следующим критериям в течение не менее 2 последних месяцев перед диагностикой (Rome IV) [1,2].:
1. В среднем 1 эпизод рвоты или более в неделю;
2. Отсутствие самоиндуцированной рвоты или критериев расстройства пищевого поведения или руминации;
3. После надлежащей оценки рвота не может быть полностью объяснена другими медицинскими состояниями.
5.3. В Римских критериях IY ФТ и ФР рассматриваются как отдельные события, но пациенты с хронической тошнотой обычно жалуются на умеренную рвоту с различной частотой. Наличие сильной рвоты в дополнение к тошноте представляет собой иную ситуацию, при которой исключаются заболевания ЦНС и ЖКТ (Rome IV) (см. раздел дифдиагностики).
6. Лабораторно-инструментальные методы обследования [1,2]
6.1. К методам обследования на первом уровне детей с ФТ и ФР относятся общеклинические анализы крови, мочи, биохимический анализ сыворотки крови (электролиты, кальций, кортизол, гормоны щитовидно железы, липаза, амилаза, АлАТ, АсАТ, ГГТП, билирубин, глюкоза) [Рим 4, мнение экспертов].
6.2. УЗИ органов брюшной полости
6.3. При наличии рецидивирующей рвоты на втором уровне рентгеноскопия верхнего отдела ЖКТ, рентгенография брюшной полости для исключения кишечной непроходимости и нарушения моторики.
6.4. ЭГДС может быть проведена,
6.5. По показаниям МРТ головного мозга.
7. Дифференциальный диагноз
7.1. С заболеваниями ЖКТ (мальротация, гастропарез, псевдобструкция, заболевания желчного пузыря, поджелудочной железы, печени, пищевода, желудка и ДПК);
7.2. С заболеваниями нервной системы: опухоли головного мозга, другие
7.3. Нарушения психологического состояния (тревожность, депрессия, астения, др.).
8. Лечение
8.1. Применение противорвотных препаратов различных классов (прокинетиков) [мнение экспертов]:
· блокатора дофаминовых рецепторов домперидона в виде суспензии, таблеток для рассасывания, таблеток внутрь
· блокатора допаминовых D2-рецепторов метоклопрамида в\м, в\в, внутрь, длительностью до 5 дней, может вызывать серьёзные побочные эффекты со стороны ЦНС (сонливость, экстрапирамидные расстройства, беспокойство);
· стимулятора периферических β-, μ- и k-опиоидных рецепторов ЖКТ тримебутина у детей с 3 лет в виде таблеток 0,1, с 12 лет - табл. 0,2;.
8.2. При неэффективности прокинетиков может использоваться противорвотный препарат антагонист 5HT3-рецепторов ондансетрон 0,3–0,4 мг/кг в/в каждые 4-6 часов (до 20 мг). [мнение экспертов]
8.3. Коррекция психологических нарушений у детей с явными психологическими коморбидными проблемами [2].
8.4. Психотерапия. .
9. Показания для госпитализации
9.1. Рецидивирующая рвота;
9.2 Наличие крови в рвотных массах;
9.3. Невозможность обследования в амбулаторно-поликлинических условиях.
9.4. Неэффективность лечения в амбулаторно-поликлинических условиях.
Список литературы
1. Пиманов С.И., Силивончик Н.Н. Римские IY рекомендации по диагностике и лечению функциональных гастроэнтерологических расстройств: Пособие для врачей. М.,2016, с. 136-137.
2. Hyams J.S., Di Lorenzo S., Saps M. et al. Functional gastrointestinal disorders: child / adolescent. Gastroenterology. 2016; 150:1456-68. doi.org/10.1053/j.gastro.2016.02.015
3. Koppen IJ, Nurko S, Saps M, Di Lorenzo C, Benninga MA. The pediatric Rome IV criteria: what's new? Expert Rev Gastroenterol Hepatol. 2017 Mar;11(3):193-201. doi: 10.1080/17474124.2017.1282820.
4. Kovacic K, Miranda A, Chelimsky G, Williams S, Simpson P, Li BU Chronic idiopathic nausea of childhood. J Pediatr. 2014 May;164(5):1104-9. doi: 10.1016/j.jpeds.2014.01.046.
5. Saps M, Velasco-Benitez CA, Langshaw AH, Ramírez-Hernández CR. Prevalence of Functional Gastrointestinal Disorders in Children and Adolescents: Comparison Between Rome III and Rome IV Criteria. J Pediatr. 2018; 199:212-216.
6. doi: 10.1016/j.jpeds.2018.03.037
7. Singh P1, Kuo B2. Central Aspects of Nausea and Vomiting in GI Disorders. Curr Treat Options Gastroenterol. 2016 ; 14(4):444-451.
8. Trivić I, Hojsak I. Initial Diagnosis of Functional Gastrointestinal Disorders in Children Increases a Chance for Resolution of Symptoms. Pediatr Gastroenterol Hepatol Nutr. 2018; 21(4):264-270. doi: 10.5223/pghn.2018.21.4.264.
Функциональная диспепсия
1. Определение
1.1.Функциональная диспепсия (МКБ-XК30)- симптомокомплекс, боль в эпигастральной и/или околопупочной области, в сочетании с 1 и более симптомами:
- чувство переполнения в животе после приема пищи,
- раннее насыщение,
- тошнота;
при отсутствии каких-либо органических, системных или метаболических заболеваний, которые могли бы объяснить эти проявления [15].
1.2.Только частота, периодичность и продолжительность симптомов позволяют диагностировать ФРОП, в частности ФД (1 раз в неделю, не менее 2-х месяцев подряд) [15,22].
2. Эпидемиология
2.1. Распространенность ФД в разных странах сильно варьирует, что связано с различными диагностическими критериями, разной интерпретацией выраженности симптомов. Среди европейцев ФД встречается у 20% лиц, в США – 29%, а в Корее – 11% [22, 23].
2.2.По данным эпидемиологических исследований в РФ различными формами ФРОП страдают до 30–40% детей, у 11,8-46% из них отмечается ФД [1,7].
3. Классификация
С целью большей объективизации диагноза целесообразно определение варианта ФД по преобладающей симптоматике. Выделяют 2 основных варианта ФД [15]:
1. Постпрандиальный дистресс-синдром (cиндром постпрандиального дискомфорта), который включает в себя чувство переполнения после еды или раннее насыщение, которое опережает обычное время окончания приёма пищи. В качестве дополнительных рассматриваются такие симптомы как вздутие в верхних отделах живота, послеобеденная тошнота или чрезмерная отрыжка.
2. Синдром эпигастральной боли, который включает в себя боль (достаточно сильную, чтобы препятствовать занятию повседневными делами). Боль локализуется в эпигастрии или околопупочной области, не распространяясь в другие отделы (за грудину, в боковые или нижние отделы живота), не уменьшаются после дефекации или отхождения газов.
3. Смешанный вариант ФД
4 Этиология и патогенез
4.1.В развитии ФД, как и при других формах ФРОП, проявляющихся абдоминальной болью, играют роль факторы, нарушающие моторику и регуляцию в системе оси «головной мозг–ЖКТ», вызывающие висцеральную гиперчувствительность, нарушение мукозального гомеостаза, а также генетическая предрасположенность [6, 10, 11,12, 13, 15].
4.2. Этиологическими факторами ФД являются социальная дезадаптация, психологическое напряжение, стресс, утомление, нарушение режима сна, учебы и отдыха[11, 13].
4.3. К факторам, нарушающим мукозальный гомеостаз, относятся прием медикаментов (противовоспалительные, антибиотики), пищевая аллергия, инфекция H.pylori [13, 22,23].
4.4.Около 20% случаев ФД развиваются в исходе острых кишечных инфекции и пищевых токсикоинфекций[7, 13].
4.5.В генезе симптомов ФД могут принимают участие нарушения моторики гастродуоденальной зоны: гастроэзофагеальный и дуоденогастральный рефлюксы, нарушение желудочной аккомодации, замедление эвакуации из желудка и двенадцатиперстной кишки.
Воспаление минимальной степени активности слизистой оболочки желудка и(или) двенадцатиперстной кишки возможно при ФД и не противоречит этому диагнозу. Вследствие комплекса механизмов формируется висцеральная гиперчувствительность стенок желудка и двенадцатиперстной кишки, которая приводит к возникновению и персистированию симптомов под влиянием любых стимулов [11, 12].
4.6.ФД может выступать как гастроэнтерологическая «маска» синдрома вегетативных дисфункций отдельно или в сочетании с проявлениями со стороны других отделов пищеварительной системы или других систем организма [мнение экспертов].
4.7.Один из возможных механизмов развития ФД - нарушение секреции гуморального регулятора органов пищеварения грелина - пептида, синтезируемого энтероэндокринными клетками, который активирует моторную активность желудка и двенадцатиперстной кишки, желудочную секрецию, а также вызывает чувство голода, стимулируя аппетит через прямое воздействие на центральную нервную систему [8]. Кроме этого, в развитии моторных нарушений при ФД может иметь значение изменение уровня гастрина и холецистокинина.
4.8. Инфекция H.pylori может играть определенную роль в развитии симптомов диспепсии, способствуя изменению желудочной секреции и усилению висцеральной гиперчувствительности. Однако, нет доказательств, что НР-ассоциированный гастрит вызывает симптомы диспепсии[2, 15].
5. Диагностика
5.1.ФД – диагноз клинико-анамнестический. Данные клинические признаки должны проявляться с достаточной интенсивностью, чтобы повлиять на повседневную деятельность пациента, то есть, «причинять беспокойство» [15, 22].
5.2.После полного обследования должно быть уточнено, что симптомы не могут объясняться другими патологическими состояниями[15].
5.3.Наличие хотя бы одного из следующих симптомов тревоги у детей, требует более углубленного диагностического поиска:
1. Семейный анамнез по ВЗК, целиакии или язвенной болезни;
2. Дисфагия, одинофагия;
3. Рецидивирующая рвота
4. Признаки гастроинтестинального кровотечения;
5. Артрит;
6. Необъяснимая потеря веса;
7. Замедление линейного роста;
8. Задержка пубертатного периода;
9. Необъяснимая лихорадка [15]
10.Наличие в крови признаков воспаления (лейкоцитоз, увеличение СОЭ) [11].
11. К симптомам тревоги так же следует отнести неэффективность стандартной терапии «функционального расстройства» в течение 2 недель.
6. Лабораторно-инструментальные методы обследования
6.1.К обязательным методам обследования детей с ФД относятся общий анализ крови, анализ мочи, УЗИ брюшной полости позволяет уточнить состояние печени, желчного пузыря, поджелудочной железы, исключить хирургическую патологию.
6.2. Обследование второй линии включает: биохимический анализ крови (СРБ, сывороточное железо) анализ кала на скрытую кровь (fecal immunochemical test), анализ кала на цисты лямблий/ ПЦР кала на АГ лямблий, УЗИ органов малого таза (девочки-подростки), лактулозный дыхательный тест.
6.3. К проведению ЭГДС следует подходить дифференцировано, это исследование не позволяет достоверно судить о наличии хронического гастрита и его форме. Хронический гастрит диагноз морфологический, а биопсия слизистой желудка крайне редко проводится детям в широкой клинической практике. Гипердиагностика гастрита способствует полипрагмазии, затрудняет выявление истинной причины диспепсии [15, 22].
Отечественными авторами предлагается следующий алгоритм определения показаний для ЭГДС.
• эпидемиологические (мужской пол, подростковый возраст, отягощенный семейный анамнез по ЯБ);
• клинические (ночные боли, голодные боли, редкая сильная боль);
• неэффективность к стандартной терапии в течении 2-х недель.
6.4.Кроме этого, очевидно, что ЭГДС необходимо проводить при наличии у ребенка симптомов «тревоги»[15].
6.5.Обследование на НР детей с ФД показано в тех случаях, если при его выявлении обоснована эрадикационная терапия (наследственная отягощенность по язвенной болезни, раку желудка, рефрактерная железодефицитная анемия, идиопатическая тромбоцитопеническая пурпура, желание пациента и его родителей после обсуждения с врачом потенциального риска и пользы от лечения) [16].
7. Дифференциальный диагноз
К основным заболеваниям, с которыми необходимо проводить дифференциальную диагностику ФД относят гастроэзофагеальную рефлюксную болезнь, эозинофильный эзофагит, язвенную болезнь желудка и двенадцатиперстной кишки, болезнь Крона, инфекции мочевой системы, иные формы ФРОП, протекающие с абдоминальными болями.
8. Лечение
8.1.Лечение больных ФД включает в себя общие мероприятия по нормализации образа жизни и характера питания, применение лекарственных препаратов, а в ряде случаев и психотерапевтических методов лечения. Питание должно быть полноценным, но нужно исключать кофеин-содержащие, острые, жирные продукты, рекомендуется избегать обильных приемов пищи, ужин - не менее чем за 3 часа до сна. Следует помнить, что прием НПВС способствует сохранению и усилению симптомов диспепсии. Необходимо устранение психологических факторов, которые могут способствовать усилению симптомов диспепсии[5, 9, 13, 15].
8.2.Важная роль нарушений двигательной функции желудка и двенадцатиперстной кишки в патогенезе ФД послужила основанием для применения прокинетиков и спазмолитиков. Прокинетик домперидон вызывает блокаду периферических дофаминовых рецепторов, что предотвращает расслабление гладкой мускулатуры желудка и верхних отделов кишечника, в норме вызываемое дофамином. Тем самым повышается тонус сфинктеров пищевода желудка и верхних отделов кишечника, ускоряется их опорожнение за счет усиления холинергических влияний [20].
8.3.Применение блокатора центральных дофаминовых рецепторов метоклопрамида при ФД нецелесообразно в связи с серьезными побочными эффектами [инструкция к препарату].
8.4.Тримебутин является агонистом периферических опиатных рецепторов различных типов (µ, δ, κ), действуя на всем протяжении желудочно-кишечного тракта. Результатом этого агонизма ко всем трем типам рецепторов является регулирующий эффект тримебутина на моторику пищеварительного тракта. Кроме того, он снижает висцеральную чувствительность отделов ЖКТ, оказывая умеренное анальгетическое действие [24].
8.5.Положительный эффект от применения ингибиторов протонной помпы (ИПП) в лечении ФД, в основном, при синдроме эпигастральной боли, имеет высокий уровень доказательности. ИПП применяют обычно в стандартных дозировках, однако, в резистентных случаях они могут быть назначены и в более высоких дозах [15, 16, 17]. Следует отметить, что ни у одного из ИПП, зарегистрированных в России, нет в перечне показаний ФД, поэтому допустимо назначение данных препаратов только при сочетании ФД с симптомами ГЭРБ.
8.6. Рекомендуется применение антацидов, как средств, снижающих периферическую гиперчувствительность за счет кислотонейтрализующих и мукоцитопротективных свойств. Однако, эффективность монотерапии антацидами не доказана, в ряде исследований она не отличается от эффекта плацебо [15, 19, 23].
8.7.В случаях торпидности к терапии перечисленными средствами, рекомендуются низкие дозы трициклических антидепрессанов (амитриптилин и имипрамин) [15]. В качестве седативных более безопасны средства растительного происхождения (на основе валерианы, пустырника).
8.8.Обоснованность антихеликобактерной терапии для купирования симптомов диспепсии сомнительна в то же время участи больных она способствует стойкому устранению симптомов [2, 20].
8.9.В дополнение медикаментозной терапии, активно используются физические методы лечения: питье гидрокарбонатно-хлоридных натрий-кальциевыхвод малой и средней минерализации; интерференц-терапия, электросон, гальванизацияворотниковой области по Щербаку, амплипульс-терапия. [4].
8.10. Продолжительность основного курса лечения должна составлять, в среднем, около 4 недель. В последующем в зависимости от самочувствия пациентов, наличия или отсутствия рецидивов ФД выбирается индивидуальная схема поддерживающей терапии (в режиме «по требованию», поддерживающая терапия в половинных дозах) [мнение экспертов].
8.11.При сохранении диспепсических симптомов на фоне гастроэнтерологического лечения необходима повторная тщательная оценка имеющихся данных и более углубленное обследование. При подтверждении первоначального диагноза ФД может ставиться вопрос о дополнительной консультации психотерапевта/психиатра и назначении соответствующей терапии [мнение экспертов].
9.Показания для госпитализации
9.1. Наличие «симптомов тревоги»
Список литературы
1. Данные Департамента развития медицинской помощи и курортного дела ФГУ «Центральный научно-исследовательский институт организации и информатизации здравоохранения» Минздрава, 2011. Электронный ресурс: режим доступа:http://mednet.ru/index.php
2. Лазебник Л.Б., Ткаченко Е.И., Абдулганиева Д.И., и др. VI Национальные рекомендации по диагностике и лечению кислотозависимых и ассоцированных с HELICOBACTER PYLORI заболеваний (VI Московские соглашения). - Экспериментальная и клиническая гастроэнтерология. 2017. № 2 (138). С. 3-21.
3. Маев И. В., Буеверов А. О., Самсонов А. А. и др. Место прокинетиков в последних алгоритмах диагностики и лечения функциональной диспепсии. - Рус.мед. журн. -2010. -№ 9. -С. 549.
4. Мельцева Е.М., Кулик Е.И., Олексенко Л.Л., и др. Физические методы лечения функциональной диспепсии у детей. - Вестник физиотерапии и курортологии. 2016. Т. 22. № 4. С. 49-57.
5. Нижевич А.А., Валеева Д.С., Сатаев В.У., и до. Современные подходы к лечению функциональной диспепсии в детском возрасте. - Вопросы детской диетологии. 2017. Т. 15. № 3. С. 5-11.
6. Печкуров Д.В., Алленова Ю.Е., Тяжева А.А. Содержание интерлейкина-1 в желудочной слизи у детей с функциональной диспепсией - Вопросы детской диетологии. - 2016. - Т. 14. - № 2. - С. 29-31.
7. Печкуров Д.В., Щербаков П.Л., Каганова Т.И. Синдром диспепсии у детей. — М., 2007. — 143 с.
8. Akamizu T., Iwakura H., Ariyasu H., Kangawa K. Ghrelin and functional dyspepsia //Int. J. Peptides. — 2010. — Vol. 1. — P. 1–6.
9. Browne PD, Nagelkerke SCJ, van Etten-Jamaludin FS, et all.Pharmacological treatments for functional nausea and functional dyspepsia in children: a systematic review. Expert Rev ClinPharmacol. 2018 Dec;11(12):1195-1208.
10. Drossman DA, Hasler WL. Rome IV -Functional GI Disorders: Disorders of Gut-Brain Interaction. Gastroenterology. 2016;150(6):1257-61.
11. Drossman D.A. The functional gastrointestinal disorders and the Rome III process // Gastroenterology. — 2006. — Vol. 130. — P. 1377–90.
12. Chitkara DK, Camilleri M, Zinsmeister AR, et al. Gastricsensory and motor dysfunction in adolescents with functional dyspepsia. J Pediatr 2005;146:500–505.
13. Feinle-Bisset C., Vozzo R., Horowitz M., Talley N. Diet, food intake, and disturbed physiology in the pathogenesis of symptoms in functional dyspepsia // Am. J. Gastroenterol. — 2004. — Vol. 99. — P. 170–181
14. Ford A., Marwaha A., Lim A., Moayyedi P. Systematic review and meta-analysis of the prevalence of irritable bowel syndrome in individuals with dyspepsia // Clin. Gastroenterol. Hepatol. — 2010. — Vol. 8. — P. 401–409.
15. Jeffrey S. Hyams,Carlo Di Lorenzo,Miguel Saps et all. Childhood Functional Gastrointestinal Disorders: Child/Adolescent. - Gastroenterology 2016;150:1456–1468
16. Jones NL, Koletzko S, Goodman K, et all. Joint ESPGHAN/NASPGHAN Guidelines for the Management of Helicobacter pylori in Children and Adolescents (Update 2016). Rowland M; ESPGHAN, NASPGHAN. J PediatrGastroenterolNutr. 2017 Jun;64(6):991-1003.
17. Kim BJ, Kuo B Gastroparesis and Functional Dyspepsia: A Blurring Distinction of Pathophysiology and Treatment. -J NeurogastroenterolMotil. 2018 Dec 3
18. Koppen IJ, Nurko S, Saps M, Di Lorenzo C, Benninga MA. The pediatric Rome IV criteria: what's new?Expert Rev GastroenterolHepatol. 2017 Mar;11(3):193-201
19. Keita ÅV, Söderholm JD. Mucosal permeability and mast cells as targets for functional gastrointestinal disorders. - CurrOpinPharmacol. 2018 Dec;43:66-71.
20. PRAC recommends restricting use of domperidone Benefits still considered to outweigh risks when given short-term and in low doses to treat nausea or vomiting 07 March 2014 EMA/129231/2014 The way of access: www.ema.europa.eu
21. Suzuki H., Matsuzaki J., Hibi T. What Is the Diff erence Between Helicobacter pylori — Associated Dyspepsia and Functional Dyspepsia? // J. Neurogastroenterol. Motil. — 2011. — Vol. 17, N 2. — P. 124–130
22. Tack J, Drossman DA. What's new in Rome IV?NeurogastroenterolMotil. 2017 Sep;29(9)
23. Shcherbak V.A. The prevalence of Helicobacter pylori infection in children with the syndrome of dyspepsia in the Trans-Baikal Territory// Journal of pediatric gastroenterology and nutrition. 2017. – Vol.64. Suppl.1. –P. 570
24. Van Tilburg MAL, Walker L, Palsson O, et al. Prevalence of child/adolescent functional gastrointestinal disorders in a national U.S. community sample. Gastroenterology 2014;144(Suppl 1):S143–S144.
25. Yang YJ, Bang CS, Baik GH, et all. Prokinetics for the treatment of functional dyspepsia: Bayesian network meta-analysis.BMC Gastroenterol. 2017
Синдром раздраженного кишечника
1. Определение
1.1. Синдром раздраженного кишечника (МКБ-10 К58) – симптомокомплекс, характеризующийся ненормальной частота стула (4 или более раз в день либо 2 и менее в неделю), нарушением формы и консистенции стула (сегментированный/ жесткий или разжиженный/водянистый), акта дефекации (дополнительное усилие, императивность позывов), наличием в стуле слизи и вздутия живота [7].
1.2. Обязательными условиями диагноза СРК является связь указанных симптомов, прежде всего АБ, с актом дефекации: улучшение состояния после дефекации, связь болей с изменениями в частоте или консистенции стула.
2. Эпидемиология
2.1 Распространенность СРК в зависимости от региона мира варьируется от 10 до 25% [2].
2.2 В России эта цифра находится на уровне примерно 15% [1].
2.3 СРК можно назвать заболеванием молодого и среднего возраста, так как среди пациентов преобладают люди, не достигшие 50 лет [9].
2.4 В детском возрасте СРК встречается у четверти детей до 6 лет с ФР, протекающими с абдоминальными болями, как правило, в этой возрастной группе СРК развивается в исходе острых кишечных инфекций. Подъём заболеваемости СРК так же приходится на подростковый возраст [3].
3 Классификация
В зависимости от доли времени, в течение которого наблюдаются изменения стула того или иного характера (запор или диарея) СРК подразделяются на:
1. СРК с запором (IBS-C, СРК-З),
2. СРК с диареей (IBS-D, СРК-Д),
3. смешанный СРК (IBS-M, СРК-См).
Врачу не всегда удается четко определить клинический вариант, так как симптомы диареи и запора часто неправильно интерпретируются самим больным, поэтому целесообразно выделять подтипы только при проведении исследований.
Также в последние годы получила распространение классификация СРК, основанная на этиологических факторах: постинфекционный СРК (ПИ-СРК), вариант, связанный с непереносимостью пищевых продуктов СРК и классический СРК, индуцированный стрессом.
Выделяют СРК легкой, умеренно-тяжелой и тяжелой степени, тяжесть расстройства определяет тактику ведения пациента и в, конечном итоге, объем медицинских мероприятий.
4 Этиология и патогенез
4.1 СРК считается расстройством регуляции оси головной мозг – кишечник: нарушения нейрогуморальной регуляции моторики органов пищеварения, связанные с психоэмоциональной сферой, вегетативными расстройствами и повышенной висцеральной чувствительностью [6]
4.2 В последние годы к этим ключевым позициям прибавились воспаление. С одной стороны, воспаление может быть вторичным, т.е. последствием нарушений моторики, приводящих к изменению состава внутренней среды в просвете кишки и повреждению слизистой оболочки. С другой стороны, оно все-таки может входить в структуру самого заболевания, обнаруживая при этом черты, отличающие его от других воспалительных заболеваний кишечника. Данный феномен получил в англоязычной научной литературе обозначение, которое можно перевести как «воспаление в слизистой оболочке низкой степени активности» (Low-grade mucosal inflammation) [4].
4.3 Рассматриваемый воспалительный процесс может быть последствием инфекционного процесса (острой кишечной инфекции при т.н. постинфекционном СРК), но также быть обусловленным изменениями в составе микрофлоры кишечника, нейрогуморальными механизмами (в т.ч. стрессом) или пищевой аллергией [10].
5 Диагностика
Согласно Римским критериям IV для постановки диагноза СРК необходимо выполнение следующих условий:
5.1. Абдоминальная боль, отмечается по меньшей мере 1 раз в неделю, на протяжении не менее 2-х месяцев и связана с одним из следующих пунктов,:
а) с актом дефекации;
б) с изменением частоты дефекации;
в) с изменением формы и консистенции стула.
5.2. У детей с запорами, боль не проходит после излечения запоров (дети, у которых боль проходит, имеют функциональные запоры, это не СРК)
5.3. После полного обследования уточнено, что симптомы не могут быть объяснены другими патологическими состояниями.
6. Лабораторно-инструментальная диагностика
6.1. Исключение симптомов тревоги – общий анализ крови, общий анализ мочи, копрограмма с целью исключения воспалительных поражений кишечника, ферментативной недостаточности, косвенных признаков СИБР, УЗИ органов брюшной полости – уточнить состояние печени, желчного пузыря, поджелудочной железы, исключение хирургической патологии.
6.2. Обследование второй линии включает:
- биохимия крови (СРБ, белок и фракции, диастаза),
- определение уровня фекального кальпротектина,
- эластаза-1 в кале,
- водородный дыхательный тест;
- анализ крови на АТ к гельминтному комплексу, ПЦР кала на АГ лямблий,
- ФКС при наличии «симптомов тревоги», торпидности к терапии.
7. Дифференциальный диагноз.
К основным заболеваниям, с которыми необходимо проводить дифференциальную диагностику СРК относят воспалительные заболевания кишечника (болезнь Крона, Язвенный колит), гастроинтестинальную форму пищевой аллергии, глистную инвазию, заболевания поджелудочной железы, целиакию.
8. Лечение
8.1. Коррекция психо-неврологического статуса, режима дня. В целом пациентам следует рекомендовать умеренные физические упражнения, снижение психоэмоционального напряжения, сон не менее 7–8 ч в сутки. Такие рекомендации рассматриваются некоторыми специалистами в качестве факторов, способных уменьшить симптомы СРК. При коррекции образа жизни пациента с СРК следует рекомендовать постепенное умеренное повышение физической активности, т. к. избыточная или непривычная для данного пациента нагрузка может, напротив, стать причиной возникновения болевого абдоминального синдрома [8].
8.2 Диетотерапия является важным элементов лечения пациентов с СРК. Необходимо ограничить короткоцепочечные углеводы (FODMAP), ферментируемые олигосахариды (фруктаны и галактаны), дисахариды (лактоза), моносахариды (фруктоза) и полиолы (сахарные спирты – изомальтит, мальтит, маннит, ксилит, сорбит), глютен-содержащие продукты [2].
8.2. Тримебутин, обладающий прокинетическим, спазмолитическим и местным анестезирующим действием
8.3. При спастических состояния – миотропные (папаверин) или вегетотропные (гиосцина бутил бромид) спазмолитики
8.4. Этапная коррекция нарушений микробиоценоза: rишечная деконтаминация при СРК с диареей – нитрофураны (нифуроксазид, нифуратель), сахаромицеты буларди, затем курс мультиштаммовых пробиотиков.
8.5 При СРК с диарей – энтеросорбенты (смектиты, полисорб)
8.6. При СРК с запорами – препараты полиэтиленгликоля, лактулозы, лактитола.
9.Показания для госпитализации
9.1 Наличие «симптомов тревоги»
Список литературы
1. Маев И.В., Дичева Д.Т., Андреев Д.Н., Сенина Ю.С. Синдром раздраженного кишечника в практике гастроэнтеролога. В сб.: Актуальные вопросы ведомственной медицины. М., 2012: 83–8
2. Казюлин А.Н., Дичева Д.Т., Русс И.С., Андреев Д.Н., Парцваниа-Виноградова Е.В. Дието терапия со сниженным содержанием ферментируемых олигосахаридов, дисахаридов, моносахаридов и полиолов (fodmap) при синдроме раздраженного кишечника. Consilium Medicum, 2016, 18(8): 75-78
3. Печкуров Д.В., Алленова Ю.Е., Тяжева А.А. Возрастные особенности функциональных расстройств желудочно-кишечного тракта, проявляющихся абдоминальными болями, с позиций биопсихосоциальной модели. Вопросы детской диетологии, 2015; 13( 2): 11-15
4. Barbara G, Stanghellini V, De Giorgio R, Cremon C, Cottrell GS, Santini D, Pasquinelli G, Morselli-Labate AM, Grady EF, Bunnett NW, Collins SM, Corinaldesi R. Activated mast cells in proximity to colonic nerves correlate with abdominal pain in irritable bowel syndrome.// Gastroenterology.- 2004.- Vol.126.- P.693-702.
5. Canavan C, West J, Card T. The epidemiology of irritable bowel syndrome. Clin Epidemiol, 2014, 6: 71-80.
6. Drossman D.A., Hasler W.L. Rome IV - Functional GI disorders: disorders of gut-brain interaction. Gastroenterology 2016; 150(6): 1257-61.
7. Jeffrey S. Hyams, Carlo Di Lorenzo, Miguel Saps et all. Childhood Functional Gastrointestinal Disorders: Child/Adolescent. - Gastroenterology 2016;150:1456–1468
8. Johannesson E, Simrén M, Strid H et al. Physical activity improves symptoms in irritable bowel syndrome: a randomized controlled trial. Am J Gastroenterol, 2011, 106: 915–922.
9. Lovell R. M., Ford A. C. Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis//Clin Gastroenterol Hepatol. 2012.№ 10. Р. 712-721.
10. Ohman L, Simrén M. Pathogenesis of IBS: role of inf lammation, immunity and neuroimmune interactions.// Nat Rev Gastroenterol Hepatol.- 2010.- Vol.7.- P.163-173.
Функциональная абдоминальная боль
1. Определение
1.1 Функциональная абдоминальная боль без других специфических проявления (ФАБ, FAP-NOS) (МКБ-X R10) – продолжительная или часто рецидивирующая боль, локализованная в околопупочной области, или в других областях живота, наблюдающаяся на протяжении более 2 мес., при частичном или полном отсутствии связи между болью и физиологическими событиями (т.е. приемом пищи, дефекацией и др.), сопровождающаяся незначительной потерей повседневной активности, отсутствием органических причин боли и диагностических признаков других функциональных гастроэнтерологических нарушений [7].
1.2 Интенсивность, характер боли, частота приступов разнообразны.
2 Эпидемиология
2.1 Распространенность данного симптомокомплекса среди взрослого населения составляет по разным источникам 0,5–2%, чаще страдают женщины [10].
2.3 FAP-NOS отмечается у детей школьного возраста 2,7% в Колумбии, 4,4% в Шри-ланке, в США 1,2% в США и в 2% в Германии [5].
2.4 В России среди детей в структуре болевого синдрома ФАБ составляет 40%, преимущественно это дети дошкольного и младшего школьного возраста [2].
3 Классификация
Не разработана
4 Этиология и патогенез
4.1 Феномен боли при FAP-NOS обусловлен усилением ее восприятия в коре головного мозга за счет избыточной восходящей афферентной импульсации (в меньшей степени) и ее недостаточного нисходящего подавления (в большей степени) [10].
4.2 Процессу амплификации болевых ощущений при FAP-NOS способствует ряд факторов, к которым относят, прежде всего, психические стрессы [4] Существуют доказательства связи между психологическим стрессом и хронической абдоминальной болью в детском и подростковом возрасте. Хроническая абдоминальная боль ассоциируется со стрессовыми жизненными ситуациями, такими как развод родителей, госпитализация, страхи, жестокое обращение проблемы в школе [11].
4.4 У больных FAP-NOS часто выявляются депрессия и повышенный уровень тревоги [7].
4.5 В патогенезе FAP-NOS отсутствует висцеральная гиперчувствительность и взаимосвязь с характером питания, перенесенной пищевой токсикоинфекцией [4,6,10].
5 Диагностика
Для постановки диагноза ФАБ необходимо наличие следующих критериев:
- эпизодическая или продолжительная абдоминальная боль, преимущественно в оклопупочной зоне, которая не связана с физиологическими причинами (прием пищи, дефекация, менструация);
- недостаточно критериев для СРК, ФД или абдоминальной мигрени;
- после полного обследования уточнено, что симптомы не могут быть объяснены анатомическими, структурными, воспалительными или метаболическими причинами;
- перед постановкой диагноза критерии должны беспокоить как минимум 2 месяца не реже одного раза в неделю.
6. Лабораторно-инструментальное обследование
6.1. Обследования первой линии
- общий анализ крови, мочи;
- копрограмма, включая обследование на гельминтозы и простейшие;
- УЗИ печени, желчного пузыря, поджелудочной железы, почек, органов малого таза;
Наличие симптомов тревоги, требует углубленного диагностического поиска (cм. раздел ФД) [7]
6.2. Обследования второй линии (проводятся при неэффективности проводимой в течение 2 недель терапии болевого синдрома)
- анализ крови на ИФА к гельминтам и лямблиям/ ПЦР кала на АГ лямблий;
- анализ крови на СРБ, АлАТ, АсАТ, билирубин, холестерин, ГГТП, амилазу, липазу;
- анализ уровня кальпротектина в кале;
- КТ, МРТ;
- электроэнцефалография;
- ЭГДС, колоноскопия;
- допплерография сосудов брюшной полости (для исключения стеноза чревного ствола);
- диагностическая лапароскопия;
- рентгеноскопия ЖКТ с барием;
- консультация невролога, психиатра, психолога, хирурга;
- консультация гинеколога с обследованием по профилю.
7. Дифференциальный диагноз.
Так как при ФАБ отсутствует видимая связь с какими-либо физиологическими процессами (прием пищи, дефекация, менструация) и они не сопровождаются иными гастроэнтерологическими симптомами, указывающими на поражение ЖКТ, диагностический поиск достаточно широкий и охватывает, помимо заболеваний пищеварительной, мочеполовую, нервную, костно-мышечную и иммунную системы.
• Патология мочевой системы
• Запоры и их осложнения
• ГЭРБ
• Воспалительные заболевания кишечника
• Побочное действие лекарственных средств
• Альгодисменорея, другая гинекологическая патология
• Болезни сердца и сосудов
• Грыжи, в том числе межпозвоночные
• Хронический гепатит
• Психогенные причины болей
• Опухоли брюшной полости, головного и спинного мозга
• Вегето-висцеральный синдром при неврологических заболеваниях
Нарушения обмена веществ (порфирия, периодическая болезнь)
8. Лечение
8.1 Важное место занимает установление правильных взаимоотношений между врачом и ребёнком, а так же его родителями, включающее образование больных детей, их переубеждение, преодоление негативизма и повышение ответственности больных за результаты лечения [3].
8.2 Обучение детей и их родителей предполагает объяснение им (на доступном уровне) механизмов возникновения у них болевых ощущений, а также анализ факторов, которые способствовали их возникновению или усилению.
8.3 Терапия первой линии включает назначение спазмолитиков (тримебутин, дротаверин, мебеверин, гиосцина бутилбромид).
8.4. При неэффективности терапии спазмолитиками можно дополнить лечение нестероидными противовоспалительными препаратами (ибупрофен, кетопрофен) [9].
8.5. При устойчивых к лечению болях в животе назначаются психотропные средства (амитриптилин, сертралин тералиджен), оказывающие положительный эффект за счет влияния на центральные механизмы регуляции восприятия боли с обязательной консультацией психотерапевта [9].
8.6. Медикаментозное лечение целесообразно дополнить когнитивной, поведенческой, гипнотерапией и другими видами психотерапии [8].
8.7. Продолжительность лечения ФАБ может достигать 6-12 месяцев.
9.Показания для госпитализации
9.1 Наличие «симптомов тревоги»
Список литературы
1. Ивашкин В.Т., Маев И.В., Кучерявый Ю.А., Лапина Т.Л., Баранская Е.К., Осипенко М.Ф., Ливзан М.А., Гриневич В.Б., Сас Е.И., Драпкина О.М., Шептулин А.А., Абдулганиева Д.И., Алексеева О.П., Корочанская Н.В., Мордасова В.И., Полуэктова Е.А., Прохорова Л.В., Трухманов А.С., Фаизова Л.П., Черемушкин С.В. и др. Клинические рекомендации Российской гастроэнтерологической ассоциации по ведению пациентов с абдоминальной болью
// Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2015. Т. 25. № 4. С. 71-80.
2. Печкуров Д.В., Алленова Ю.Е., Тяжева А.А. Возрастные особенности функциональных расстройств желудочно-кишечного тракта, проявляющихся абдоминальными болями, с позиций биопсихосоциальной модели. Вопросы детской диетологии, 2015; 13( 2): 11-15
3. Щербак В.А., Щербак Н.М. Функциональные нарушения желудочно-кишечного тракта у детей. 2014. № 1. С. 123-131.
4. Clouse R.E., Mayer E.A., Aziz Q., Drossman D.A., Dumitrascu D.L., Monnikes H., Naliboff B.D. Functional abdominal pain syndrome. Gastroenterology 2006; 130:1492-7
5. Devanarayana NM, Mettananda S, Liyanarachchi C, et al. Abdominal pain-predominant functional gastrointestinal diseases in children and adolescents: prevalence, symptomatology, and association with emotional stress. J Pediatr Gastroenterol Nutr 2011;53:659–665.
6. Drossman D.A. The physican-patient relationship // Approach to the patient with chronic gastrointestinal disorders (Ed.E.Corazziari). – Milano, 2000. – P.133-139
7. Jeffrey S. Hyams, Carlo Di Lorenzo, Miguel Saps et all. Childhood Functional Gastrointestinal Disorders: Child/Adolescent. - Gastroenterology 2016;150:1456–1468
8. Levy RL, Langer SL, Walker LS, et al. Cognitivebehavioral therapy for children with functional abdominal pain and their parents decreases pain and other symptoms. Am J Gastroenterol 2010;105:946–956.
9. Saps M, Youssef N, Miranda A, et al. Multicenter, randomized, placebo-controlled trial of amitriptyline in children with functional gastrointestinal disorders. Gastroenterology 2009;137:1261–1269.
10. Sperber A.D., Drossman D.A. Review article: the functional abdominal pain syndrome // Aliment. Pharmacol. Ther. – 2011. – Vоl.33. – P.514-524
11. Yacob D, Di Lorenzo C, Bridge JA, et al. Prevalence of pain-predominant functional gastrointestinal disorders and somatic symptoms in patients with anxiety or depressive disorders. J Pediatr 2013;163:767–770.
Билиарная дисфункция
1. Определение
1.1. Билиарная дисфункция (МКБ-10 K82.8) –функциональные расстройства желчного пузыря и желчевыводящих путей - клинический симптомокомплекс, развивающийся в результате моторно-тонической дисфункции желчного пузыря, желчных протоков и сфинктеров без признаков органического поражения [1].
1.2. БД ранее обозначились множеством диагнозов, включая акалькулёзную билиарную боль, дискинезию ЖП, дискинезию желчевыводящих путей, стеноз сфинктера Одди, ампулярный стеноз [16].
1.3. На сегодняшний день отсутсвуют международные рекомендации по диагностике и введению БД у детей [27].
2. Эпидемиология
2.1. Билиарная дисфункция - это распространённая клиническая проблема, встречается у 15–20% взрослого населения, частота растет по мере увеличения возраста пациентов, прогрессируя в органические заболевания [2].
2.2. Частота БД в детской популяции в России составляет 5,5% [3]. В структуре ФР ЖКТ у детей БД занимают 5-7%, частота выше у подростков [5].
2.3.. Количество и пропорция сделанных операций из-за дисфункции ЖП повышается, в США дисфункция ЖП значится как причина холецистэктомии в 10-20% случаев [9,10].
2.4. Данные об эпидемиологии БД, базирующиеся на инструментальных данных (УЗИ, сцинтиграфия) не являются достоверными, в связи с тем, что основа диагностики БД – клинико-анамнестические данные. Отсроченное опорожнение ЖП наблюдается во многих случаях, в том числе, у практически здоровых лиц и у пациентов с другими ФРОП. [Peter B. Cotton,2016].
3. Классификация.
• Дисфункция желчного пузыря
• Дисфункция сфинктера Одди:
дисфункция сфинктера Одди по билиарному типу (ДБСО)
дисфункция сфинктера Одди по панкреатическому типу (ДПСО)
дисфункция сфинктера Одди по смешанному типу [16]
4. Этиология и патогенез БД
4.1. Симптомокомплекс БД развивается в результате нарушения моторно-тонической функции ЖП, желчных протоков или сфинктеров без признаков их органического поражения, изменения свойств желчи, способных индуцировать воспаление в желчном пузыре и протоках, а так же повышенной чувствительности рецепторов билиарного тракта к давлению [3].
4.2. Не установлена четкая взаимосвязь между фракцией выброса ЖП и клиническими проявлениями, однако, дисфункция ЖП в форме нарушений спонтанной и стимулированной сократительной активности часто определяется у пациентов с БД, [7]
4.3. При сниженной фракции выброса на сцинтиграфии, чаще определяется билиарный сладж и микролитиаз [Sharma BC., 1998].
4.4. Одно из объяснений боли при ДБСО исходит из концепции ноцептивной сенситизации - тканевое воспаление активирует ноцицептивные нейроны что приводит к сенсибилизации и усилению чувства боли [23]. У части пациентов с БД, даже незначительное увеличение давления в желчных протоках (в пределах физиологического диапазона) может вызвать ноцицептиную болевую активацию и ощущение боли (аллодиния) [16].
4.5. Многие внутренние органы имеют общую сенсорную иннервацию, почти половина сенсорных нейронов в поджелудочной железе также иннервируют двенадцатиперстную кишку, данный феномен обозначается как кросс-сенситизация. [Li C, 2013].
4.6. Существует порочный круг стаза и воспаления в ЖП. Некоторые пациенты могут иметь первичные нарушения сокращения ЖП, но также могут играть роль и изменения в составе желчи [24].
4.7. Причинами дискинезий желчевыводящих путей являются соматовегетативные расстройства, неврозы, депрессии, стрессовые ситуации., что приводит к нарушениям нервных процессов в коре головного мозга, ослаблению высших вегетативных центров, расстройству нейрогуморальных механизмов, а затем – к ФРОП, включая БД [16].
4.8. У пациентов с дискинезией ЖП имеет место повышенная сократимость сфинктера Одди, дисфункция ЖП может ассоциироваться и с более генерализованным типом дискинезии, например ФД, СРК, хроническим запором, возможно гастропарезом [26, 30].
4.9. Экспериментальные исследования обнаружили несколько молекул, которые могут связывать воспаление с моторикой, одним из важных возможно является простогландин Е2 [6, 25].
5. Диагностика.
5.1. Диагностические критерии билиарной боли:
Боль локализуется в эпигастрии и/или в правом верхнем квадранте, при этом присутствуют все последующие признаки:
- постепенно нарастает до устойчивого уровня;
- случается с разными промежутками времени (не ежедневно);
- достаточно сильная, чтобы нарушать повседневные занятия или вызвать скорую помощь
* Боли в правом подреберье могут возникать как в связи с приемом пищи, так и на фоне стрессов и эмоциональных состояний. Боли провоцируются приемом жирной, жареной, обильной пищей, могут сопровождаться тошнотой, могут быть связаны с движениями (<20%) и облегчаться изменением положения тела или понижением кислотности (<20%)
Поддерживающие критерии:
Боль может сопровождаться:
- тошнотой и рвотой;
- иррадиацией в спину и/или правую подлопаточную область
- пробуждением ото сна
5.2. Дисфункция желчного пузыря.
Данный термин применяется в отношении пациентов с билиарной болью и интактным ЖП без камней или взвеси.
Диагностические критерии для дисфункции ЖП:
- билиарная боль
- может быть тошнота, горечь во рту, вздутие живота
- отсутствие желчных камней и другой структурной патологии
Поддерживающие критерии:
- низкая фракция выброса при сцинтиграфии ЖП
* В РФ доступно в клинической практике определение функции ЖП путем УЗИ
- нормальный уровень печеночных ферментов, связанного билирубина и амилазы/липазы.
*Могут быть и другие причины для повышения печеночных ферментов, такие как стеатоз печени, что не исключает дисфункцию ЖП.
5.3. Дисфункция сфинктера Одди по билиарному типу (ДБСО).
1. Билиарная боль.
2. Кратковременное преходящее повышение маркеров холестаза не более чем на 25% выше нормальных показателей на высоте болевого синдрома.
3. Отсутствие камней желчных протоков или структурных аномалий.
Подтверждающие критерии
1. Нормальные уровни амилазы / липазы.
2. Если возможно: аномальные данные манометрии сфинктера Одди.
5.4. Дисфункция сфинктера Одди по панкреатическому типу (ДПСО)
1. Боли в левом верхнем квадранте живота, глубоко в эпигастрии или от подреберья к подреберью, глубокие, тупые, возникающие или усиливающиеся после еды, особенно жирной, жареной и обильной пищей, могут сопровождаться тошнотой, иногда рвотой. При глубокой пальпации живота болезненность в зоне Шоффара, точке Мейо-Робсона.
2. Кратковременное преходящее повышение амилазы в крови, не более чем на 25% на высоте болевого синдрома.
3. Отсутствие увеличения размеров поджелудочной железы, изменений ее структуры или расширения главного панкреатического протока на УЗИ, включая эндо УЗИ.
4. Аномальные данные сфинктерной манометрии.
То есть, для ДПСО характерна панкреатогенная боль, но недостаточно критериев для постановки диагноза «панкреатит».
* Дифферециальная диагностика между ДЖП и ДСО затруднительна и единственным достоверным критерием может быть только кратковременное повышение маркеров холестаза при ББСО или амилазы при ДПСО.
6. Лабораторно-инструментальные методы обследования
6.1. Общий анализ крови, копрограмма, включая исследование на простейшие и гельминты.
6.2. Биохимический анализ крови (АЛТ, АСТ, амилаза, диастаза, ГГТП, билирубин, глюкоза, холестерин, ЩФ).
6.3. УЗИ брюшной полости: камни ЖП, билиарная взвесь, изменения, характерные для хронического панкреатита и образования брюшной полости должны быть исключены с помощью УЗИ, по возможности дополненным эндоскопическим УЗИ [24].
6.4 ИФА на АТ к гельминтному комплексу, лямблиям
6.5. ЭГДС (для исключения патологии гастродуоденальной зоны)
6.6. В диагностически сложных случаях показано проведение КТ, МРТ.
6.7. Опорожнение ЖП в РФ оценивается методом УЗИ. Для оценки моторики желчного пузыря проводят функциональные тесты, назначая желчегонный стимулятор и оценивая изменения размеров желчного пузыря до и после стимуляции. В качестве стимулятора используются ксилит, сорбит, лекарственные препараты. В норме поперечник желчного пузыря и его объем в течение 45 минут должны сократиться примерно на 50%. Более интенсивное сокращение говорит о его гипермоторике (гиперкинезии), а слабое – гипомоторике (гипокинезии). Метод не дает прямого ответа на вопрос о тонусе сфинктеров [6].
6.8. Международно признанным стандартом диагностики ДЖП является определение фракции выброса при холецистокинин-стимулированной холесцинтиграфии, однако в России этот метод не является широко доступным [12].
6.9. Проведение ЭРХПГ связано с высоким риском развития панкреатита (частота 10-15%) [8, 22].
6.10. Дуоденальное зондирование в настоящее время практически не проводится, в связи с тем, что это длительное и плохо переносимое ребенком исследование, эффект раскрытия сфинктера Одди удается добиться примерно в 70% случаев.
7. Дифференциальный диагноз.
7.1. К основным заболеваниям, с которыми необходимо проводить дифференциальную диагностику БД относят пороки билиарного и панкреатического трактов, хронический холецистит, гепатит, панкреатит, желчнокаменную болезнь, жировой гепатоз, язвенная болезнь ДПК [Мнение эксперта].
7.2. Первичный диагностический минимум должен состоять из тщательного сбора анамнеза и физикального обследования, за которыми следуют стандартные анализы крови на печеночные и поджелудочные маркеры, ЭГДС и абдоминальная визуализация. Несмотря на то, что УЗИ или КТ могут использоваться изначально, магнитно-резонансная холангиопанкреатография или эндоскопическое ультразвуковое исследование дадут более полную картину. Эндоскопическое УЗИ является лучшим вариантом выявления камней в желчном протоке и патологии сосочка [Мнение эксперта].
8. Лечение дисфункции ЖП.
8.1. Пациенты могут реагировать и на психологический покой, диету, на медицинское лечение такое как спазмолитики, нейромодуляторы или урсодезоксихолевая кислота, хотя их ценность недостаточно хорошо обоснована [24].
*При гипертонической и гиперкинетической формах рекомендуется ограничение продуктов, вызывающих сокращение пузыря: жирные мясо, рыба и птица, растительное масло, изделия из жирного теста, пряности, грибы, бульоны, лук, чеснок, щавель, редьку, маринады, копчености, газированные напитки. При гипотонической гипокинетической формах в диету должны быть включены фрукты, овощи, растительное и сливочное масло, сливки, сметана, яйца.
*Минеральные воды с высокой минерализацией, значительным содержанием газа, сульфатов, хлоридов (Ессентуки 17, Арзни и др.) комнатной температуры или слегка подогретые за 30-60 минут до еды стимулируют моторику желчевыводящих путей, в то время как слабо минерализированные воды (Славяновская, Смирновская, Ессентуки 4, 20, Нарзан и др.) в подогретом виде обладают спазмолитическим и тормозящим моторику эффектом.
8.2. Холеретики увеличивают концентрацию желчных кислот в желчи. К этой группе относятся препараты, содержащие компоненты бычьей желчи и/или растительные стеролы, входящие в состав желчегонных трав, увеличивающие концентрацию органических анионов. Эти препараты в связи с их раздражающим действием на слизистую оболочку ЖКТ у детей с гастроэнтерологической патологией следует применять ограниченно.
Холекинетики стимулируют сократительную функцию желчного пузыря и снижают давление в билиарной системе (сернокислая магнезия, многоатомные спирты, растительные препараты). Эффективным холекинетическим средством остаются тюбажи (слепое зондирование) с различными стимуляторами, в частности с минеральной водой.
Препарат на основе листьев артишока обладает смешанным холеретическим и холекинетическим эффектом и разрешен к применению в любом возрасте.
8.3. Важным компонентом лечения являются холеспазмолитики (мебеверин, дротаверин, гимекромон и др.). Эффективным регулятором моторики желчевыводящих путей является тримебутин, обладающий спазмолитическим эффектом, в связи с чем назначаемый самостоятельно, без необходимости комбинирования с холекинетиками и другими препаратами.
*Физиотерапия при гиперкинетических нарушениях может включать электрофорез с новокаином, парафиновые аппликации, общие радоновые или хвойные ванны, а при гипокинетических – электрофорез с или сульфатом магнезии, гальванизацию, диадинамические токи Бернара.
8.4. В мировой литературе обсуждается вопрос о целесообразности и эффективности холецистэктомиии при торидных к медикаментозной терапии случаях БД, частота купироания болевого синдрома в отдельных исследованиях колеблется от 34% до 100% [11, 19, 33].
9. Лечение дисфункции сфинктера Одди
9.1. Современные рекомендации по ведению пациентов с подозрением на ДСО основаны на экспертном соглашении с недастаточными доказательствами.
9.2. Коррекция психоэмоциональных и вегетативных нарушений. Дробное питание в течение дня (5-6 раз), а также исключение жареных блюд, шоколада, какао, кофе, крепких бульонов, копченостей, газированных напитков.
9.3. Доказан эффект снижения базального давления сфинктеров у пациентов с ДБСО тримебутина, гиосцина бутилбромида, октреотида. По имеющимся данным в 77% случаев ДБСО эффективно лечение тримебутином [34].
9.4. В качестве дополнительных средств при внепеченочном холестазе могут быть назначены гепатопротекторы (эссенциальные фосфолипиды), обеспечивающие защиту клеток печени и протоков от повреждающего действия желчи в условиях гипертензии в желчевыводящих путях [6,9].
9.5. Снижению панкреатической секреции и внутрипротокового давления при ДПСО способствует применение антисекреторных средств, препаратов панкреатических ферментов [Мнение эксперта].
9.6. При торпидности к терапии болевого синдрома рассматривается вопрос о назначении психотропных средств (амитриптилин, алимемазина тартрат)
9.Показания для госпитализации
9.1 Наличие «симптомов тревоги»
Список литературы
1. Бельмер С.В., Хавкин А.И., Печкуров Д,В, Функциональные нарушения органов пищеварения у детей. Принципы диагностики и лечения (в свете Римских критериев IV) / М. : ГЭОТАР-Медиа, 2017. — 160 с.
2. Баранская Е. К, Юрьева Е. Ю., Лемина Т. Л., Ивашкин В. Т. Диагностика и возможности коррекции функциональной патологии билиарного тракта // Клинические перспективы гастроэнтерол., гепатол. 2007; 2: 5–8.
3. Волынец Г.В., Хавкин А.И. Дисфункции билиарного тракта у детей.
Медицинский оппонент. 2018. № 3. С. 59-64.
4. Науменко Г.В., Шашель В.А., Бурлуцкая А.В. Распространенность дисфункциональных расстройств билиарного тракта у детей и подростков Краснодарного края. // Кубанский научный медицинский вестник. – 2017. – 24 (4). – с.102-104
5. Печкуров Д.В., Щербаков П.Л., Каганова Т.И. Синдром диспепсии у детей. – М. ГЭОТАР – 2007 . с.
6. Alcon S, Morales S, Camello PJ, et al. Contribution of different phospholipases and arachidonic acid metabolites in the response of gallbladder smooth muscle to cholecystokinin. Biochem Pharmacol 2002;64:1157–1167.
7. Amaral J, Xiao ZL, Chen Q, et al. Gallbladder muscle dysfunction in patients with chronic acalculous disease. Gastroenterology 2001;120:506–511.
8. Akshintala VS, Hutfless SM, Colantuoni E, et al. Systematic review with network meta-analysis: pharmacologica prophylaxis against post-ERCP pancreatitis.Aliment Pharmacol Ther 2013;38:1325–1337.
9. Bielefeldt K. The rising tide of cholecystectomy for biliary dyskinesia. Aliment Pharmacol Ther 2013;37: 98–106.
10. Bielefeldt K, Saligram S, Zickmund SL, et al. Cholecystectomy for biliary dyskinesia: how did we get there? Dig Dis Sci 2014;59:2850–2863.
11. Carney DE, Kokoska ER, Grosfeld JL, et al Predictors of successful outcome after cholecystectomy for biliary dyskinesia. J Pediatr Surg 2004; 39:813–816.
12. Carr JA, Walls J, Bryan LJ, et al. The treatment of gallbladder dyskinesia based upon symptoms: results of a 2- year, prospective, nonrandomized, concurrent cohort study. Surg Laparosc Endosc Percutan Tech 2009; 19:222–226.
13. Corwin MT, Lamba R, McGahan JP. Functional MR cholangiography of the cystic duct and sphincter of Oddi using gadoxetate disodium: is a 30-minute delay long enough? J Magn Reson Imaging 2013;37: 993–998.
14. Cotton PB, Durkalski V, Romagnuolo J, et al. Effect of endoscopic sphincterotomy for suspected sphincter of Oddi dysfunction on pain-related disability following cholecystectomy: the EPISOD randomized clinical trial. JAMA 2014;311:2101–2109.
15. DiBaise JK, Oleynikov D. Does gallbladder ejection fraction predict outcome after cholecystectomy for suspected chronic acalculous gallbladder dysfunction? A systematic review. Am J Gastroenterol 2003; 98:2605–2611.
16. Drossman D.A., Hasler W.L. Rome IV - Functional GI disorders: disorders of gut-brain interaction. Gastroenterology 2016; 150(6): 1257-61.
17. Fidler JL, Knudsen JM, Collins DA, et al. Prospective assessment of dynamic CT and MR cholangiography in functional biliary pain. AJR Am J Roentgenol 2013; 201:W271–W282.
18. Guelrud M, Rossiter A, Souney PF, et al. The effect of transcutaneous nerve stimulation on sphincter of Oddi pressure in patients with biliary dyskinesia. Am J Gastroenterol 1991;86:581–585.
19. Johnson JJ, Garwe T, Katseres N, et al Preoperative symptom duration predicts success in relieving abdominal pain caused by biliary dyskinesia in a pediatric population. J Pediatr Surg 2013; 48:796–800.
20. Li C, Zhu Y, Shenoy M, et al. Anatomical and functional characterization of a duodeno-pancreatic neural reflex that can induce acute pancreatitis. Am J Physiol Gastrointest Liver Physiol 2013;304:G490–G500.
21. Lee SK, Kim MH, Kim HJ, et al. Electroacupuncture may relax the sphincter of Oddi in humans. Gastrointest Endosc 2001;53:211–216.
22. Mazaki T, Mado K, Masuda H, et al. Prophylactic pancreatic stent placement and post-ERCP pancreatitis: an updated meta-analysis. J Gastroenterol 2014; 49:343–355.
23. Pasricha PJ. Unraveling the mystery of pain in chronic pancreatitis. Nat Rev Gastroenterol Hepatol 2012; 9:140–151.
24. Peter B. Cotton, Grace H. Elta, C. Ross Carter, Pankaj Jay Pasricha, Enrico S. Corazziari Gallbladder and Sphincter of Oddi Disorders. J Gastroenterol. 2016; 150(6):1420-1429
25. Pozo MJ, Camello PJ, Mawe GM. Chemical mediators of gallbladder dysmotility. Curr Med Chem 2004; 11:1801–1812.
26. Ruffolo TA, Sherman S, Lehman GA, et al. Gallbladder ejection fraction and its relationship to sphincter of Oddi dysfunction. Dig Dis Sci 1994;39:289–292.
27. Santucci, Neha R.*; Hyman, Paul E.*; Harmon, Carroll M. Biliary Dyskinesia in Children: A Systematic Review JPGN Volume 64, Number 2, February 2017
28. Sharma BC, Agarwal DK, Dhiman RK, et al. Bile lithogenicity and gallbladder emptying in patients withmicrolithiasis: effect of bile acid therapy. Gastroenterology 1998;115:124–128.
29. Sherman S, Lehman G, Jamidar P, et al. Efficacy of endoscopic sphincterotomy and surgical sphincteroplasty for patients with sphincter of Oddi dysfunction (SOD); randomized, controlled study. Gastrointest Endosc 1994;40:A125.
30. Sood GK, Baijal SS, Lahoti D, et al. Abnormal gallbladder function in patients with irritable bowel syndrome. Am J Gastroenterol 1993;88:1387–1390.
31. Toouli J, Roberts-Thomson IC, Kellow J, et al. Manometry based randomised trial of endoscopic sphincterotomy for sphincter of Oddi dysfunction. Gut 2000;46:98–102.
32. Veenstra BR, Deal RA, Redondo RE, et al. Long-term efficacy of laparoscopic cholecystectomy for the treatment of biliary dyskinesia. Am J Surg 2014;207:366–370.
33. Vegunta RK, Raso M, Pollock J, et al Biliary dyskinesia: the most common indication for cholecystectomy in children. Surgery 2005; 138:726–733.
34. Vitton V, Delpy R, Gasmi M, et al. Is endoscopic sphincterotomy avoidable in patients with sphincter of Oddi dysfunction? Eur J Gastroenterol Hepatol 2008; 20:15–21.
35. Dumont RC, Caniano DA. Hypokinetic gallbladder disease: a cause of chronic abdominal pain in children and adolescents. J Pediatr Surg 1999; 34:858–
36. Wu Q, Cotton PB, Durkalski V, et al. Sa1499 duloxetine for the treatment of patients with suspected sphincter of Oddi dysfunction: an open-label pilot study. Gastrointest Endosc 2011;73(Suppl):AB189.
37. Yap L, Wycherley AG, Morphett AD, et al. Acalculous biliary pain: cholecystectomy alleviates symptoms in patients with abnormal cholescintigraphy. Gastroenterology 1991;101:786–793.
Функциональные запоры
Функциональный запор (МКБ Х К 59.0) - увеличение интервалов между актами дефекации и/или систематически неполное опорожнение кишечника Увеличение интервала между дефекациями, изменение плотности стула и приложение определенных усилений для опорожнения.
2. Эпидемиология
2.1. Запоры могут быть диагностированы у ребенка любого возраста, распространенность запоров среди детей в мире, включая младенцев и подростков, от 10% до 23%, в Европе - от 0,7% до 12%. По данным Mugie SM, Benninga MA, Di Lorenzo C. (2011) распространенность запоров у детей составляет от 0,7 до 29,6% в зависимости от используемых критериев [21].
2.2. У детей первого года жизни распространенность ФЗ - 20-35% [19], от года от 17 до 40% [20, 22]. Huang R. et al. (2014), Robin S.G. et al. (2018) отмечают, что распространенность функциональных запоров у детей младшего возраста несколько выше (18,5%), чем у детей и подростков (14,1%-15%) [24].
2.3. Пик заболеваемости запорами у детей отмечается в возрасте от 2 до 4 лет, когда начинается обучение к горшку [2].
2.4. У младенцев запоры редко проявляются как изолированное состояние. Около половины детей до 1 года одновременно имеют сочетание нескольких функциональных расстройств (например, младенческой колики, срыгивания и запоры) [25].
3. Рабочая классификация запоров функционального происхождения
(Хавкин А.И., 2000 г. [3])
3.1. По течению – острые и хронические.
3.2. По механизму развития – кологенные и проктогенные.
По стадии течения: декомпенсированные, субкомпенсированные и компенсированные.
1. Компенсированная стадия:
- отсутствие самостоятельного стула 2–3 дня;
- сохранены позывы на дефекацию;
- отсутствуют боли в животе и вздутие живота;
- запоры корригируются диетой.
2. Субкомпенсированная стадия:
- отсутствие самостоятельного стула 3–7 дней;
- дефекация после слабительных;
- могут быть боли в животе и вздутие живота.
3. Декомпенсированная стадия:
- отсутствие самостоятельного стула свыше 7 дней;
- отсутствуют позывы на дефекацию;
- боли в животе и вздутие живота;
- каловая интоксикация;
- запоры устраняются только после сифонной клизмы
3.3. В зависимости от этиологических и патогенетических признаков: алиментарные, неврогенные, инфекционные, воспалительные, психогенные, гиподинамические, механические, токсические, эндокринные, медикаментозные, вследствие аномалии развития толстой кишки, вследствие нарушений водно-электролитного обмена.
4.1. ФЗ не связаны с органическими нарушениями. В его основе лежит нарушение регуляции моторной деятельности толстой кишки, которая проявляется урежением акта дефекации, его затруднением, систематически недостаточным опорожнением кишечника и/или изменением формы и характера стула. При этом замедление транзита каловых масс по всей толстой кишке способствует развитию кологенных запоров, а затруднение опорожнения ректосигмоидного отдела толстой кишки ведет к проктогенным запорам. У детей чаще всего наблюдаются смешанные расстройства (кологенные и проктогенные).
4.2. Формированию ФЗ у детей первого года жизни могут способствовать изменения в питании ребенка - недостаточный объем питания, который получает ребенок (например, при грудном вскармливании в случае наличия гипогалактии у матери); смена питания (переход на искусственное вскармливание или замена детской смеси, введение прикорма); инфекции (вирусные, острые кишечные инфекции), анальные трещины.
4.3. У детей старше года к развитию ФЗ наиболее часто могут также приводить алиментарные причины (нарушение режима и характера питания с недостаточным содержанием в рационе питания продуктов, богатых пищевыми волокнами, растительными маслами или избыточным потреблением напитков, содержащих большое количество вяжущих веществ, например, чая); психическая травма или стресс (психогенные запоры); систематическое подавление физиологических позывов на дефекацию, связанное, например, с началом посещения детского сада и т.п. [7, 23]. Трещины ануса, анусит, сфинктерный проктит первичный и вторичный на фоне других воспалительных заболеваний анального канала, прямой кишки и параректальной клетчатки, болевая реакция в виде нарушения расслабления сфинктера, а также раннее принудительное (конфликтное) приучение к горшку являются причиной острого запора.
4.3. Немаловажное значение в поддержании хронического течения ФЗ запоров имеют стесняющие, некомфортные условия для опорожнения кишечника в детском саду, часто антисанитарное состояние туалетов, непривычные для ребенка открытые кабинки и наличие других детей в этом же месте.
5.1. Диагноз функционального запора устанавливается на основании тщательно собранного анамнеза и данных объективного обследования.
Основные критерии функционального запора у детей (согласно Римским критериям IV):
Наличие 2-х или более симптомов в течение 1 месяца:
- 2 или менее дефекаций в неделю
- 1 или более эпизодов недержания кала в неделю
- Чрезмерная задержка стула в анамнезе
- Дефекации, сопровождающиеся болью и натуживанием в анамнезе
- Большой диаметр каловых масс в анамнезе, вызывающих засор в унитазе (данное уточнение было удалено в Римских критериях IV пересмотра)
- Наличие большого количества каловых масс в прямой кишке
Дополнительные критерии:
- Раздражительность
- Снижение аппетита и/или раннее насыщение
Симптомы купируются сразу после дефекации.
Дополнительные критерии функционального запора у детей, имеющих туалетные навыки на момент постановки диагноза:
- По крайней мере, 1 эпизод недержания кала после приобретения туалетных навыков.
- Большой диаметр каловых масс, вызывающих засор в унитазе по данным анамнеза.
Объективное обследование: оценка веса и роста ребенка, осмотр области живота и пальпация живота, осмотр перианальной и пояснично-крестцовой областей.
6. Лабораторно-инструментальны методы исследования
6.1. Диагноз ФЗ – клинико-анамнестический.
6.2. Наличие симптомов тревоги и рефрактерного запора требует дополнительных методов обследования для уточнения причины запора [7]:
6.2.1. У младенцев и детей раннего возраста:
- Раннее начало запора (в возрасте <1 мес. жизни)
- Выделение мекония более чем через 48 ч после рождения у доношенного новорожденного
- Семейный анамнез в отношении болезни Гиршпрунга
- Лентовидный стул
- Кровь в стуле при отсутствии анальных трещин
- Задержка развития
- Лихорадка
- Рвота желчью
- Аномалия щитовидной железы
- Выраженное вздутие живота
- Перианальная фистула
- Аномальное положение ануса
- Анальный рефлекс или кремастерный рефлекс отсутствуют
- Снижение мышечной силы нижних конечностей / тонуса / рефлексов
- Пучок волос над остистым отростком позвонка (косвенный признак spina bifida)
- Впадина в области крестца (косвенный признак spina bifida)
- Отклонение межъягодичной борозды
- Сильный страх во время осмотра ануса
- Рубцы в области анального отверстия
6.2.2. Для детей сарше3-х лет к симптомам тревоги относятся [3,5]:
· подъемы температуры до субфебрильных или фебрильных цифр,
· гепатомегалия,
· спленомегалия,
· изменения в клиническом анализе крови (анемия, лейкоцитоз, увеличение СОЭ),
· изменения в биохимическом анализе крови [3].
6.2.3. Наличие симптомов тревоги и рефрактерного запора (запор, не отвечающий на адекватную консервативную терапию в течение не менее 3-х месяцев) в ряде случаев требует консультации хирурга.
6.3. Обычное рентгенологическое исследование брюшной полости может быть использовано в случаях колостаза, когда объективное обследование невозможно или его результаты малоинформативны;
6.4. Исследование транзита по ЖКТ (пассаж бария по ЖКТ) может использоваться в дифференциальной диагностике функциональных запоров и функционального недержания кала, а также в неясных случаях;
6.5. Биопсия слизистой прямой кишки является «золотым стандартом» диагностики болезни Гиршпрунга;
6.6. Толстокишечная манометрия показана детям с рефрактерным запором до решения вопроса о необходимости хирургического вмешательства;
6.7. МРТ спинного мозга не рекомендуется использовать в рутинной практике в случае рефрактерного запора без других неврологических симптомов;
6.8. Биопсия толстой кишки для диагностики нейромышечных заболеваний толстой кишки не рекомендуется у детей с рефрактерным запором;
7. Дифференциальная диагностика
В дифференциальной диагностике при наличии симптомов тревоги у детей раннего возраста должны исключаться: болезнь Гиршпрунга, анатомические аномалии (ахалазия ануса, атрезия ануса, стеноз ануса), аномалии спинного мозга, аномалии мышц брюшной стенки (гастрошизис, синдром Дауна, синдром сливообразного живота), муковисцидоз, целиакия, гипотиреоз, гиперкальциемия, гипокалиемия, аллергия к белкам пищи, передозировка витамина D, аллергия к белкам коровьего молока (АБКМ).
8. Лечение
8.1. Важными составляющими лечения запора является проведение образовательной и разъяснительной работы с родителями [2]. Необходимо акцентировать внимание родителей на том, что хронический запор – это длительно существующая проблема, требующая длительного лечения.
8.2. Лечение должно быть этапным, комплексным, последовательным и индивидуальным и строится в определенной последовательности:
- обучение ребенка и родителей;
- проведение коррекции питания и питьевого режима;
- до начала основной терапии может быть рекомендовано освобождение кишечника от избытка каловых масс (очистительные клизма, свечи с глицерином);
- основная терапия с помощью медикаментозных средств, прежде всего, слабительных;
- поддерживающая терапия.
8.3. Лечение функциональных запоров у детей, не имеющих туалетных навыков, включает диетотерапию и при необходимости медикаментозное лечение.
8.3.1. У детей, находящихся на грудном вскармливании, необходимо нормализовать режим питания ребенка для исключения недокорма или перекорма. Учитывая, что состав грудного молока в определенной мере зависит от рациона питания матери, необходимо провести коррекцию пищевого рациона кормящей женщины (продукты, стимулирующие моторику кишечника - продукты с высоким содержанием пищевых волокон (овощи, фрукты, сухофрукты, крупы, хлеб из муки грубого помола и др.), при этом необходимо соблюдать оптимальный питьевой режим, кисломолочные продукты в рацион кормящей женщины вводятся при условии отсутствия риска развития пищевой аллергии у младенца).
Функциональные запоры у детей, получающих естественное вскармливание, не являются показанием для перевода ребенка на смешанное или искусственное вскармливание [2].
В случае, если есть подозрение, что запор у младенца связан с АБКМ (слизь, кровь в стуле, наличие атопического дерматита, стул по типу «запорного поноса») из диеты матери следует исключить продукты, содержащие молочный белок.
8.3.2. При искусственном вскармливании необходимо провести коррекцию режима питания ребенка, уточнить объем получаемого продукта для исключения перекорма. Могут быть использованы смеси серии «Комфорт», оказывающие комплексное воздействие на пищеварительную систему ребенка: частично гидролизованный белок, олигосахариды, сниженное содержание лактозы, а также измененный жировой компонент, способствующие появлению регулярного стула. Также могут быть рекомендованы адаптированные кисломолочные смеси.
У детей с АБКМ, являющейся причиной запоров, необходимо использовать смеси на основе высоко гидролизованного белка или аминокислот.
Детям с рефрактерным запором при подозрении на АБКМ назначается диагностическая элиминационная диета смесями на основе высоко гидролизованного белка или аминокислот сроком от 2-х до 4-х недель [2].
8.3.3. В периоде введения прикорма для детей с запором, рекомендуется начинать с овощных прикормов (большее количество клетчатки). Введение продуктов и блюд прикорма в рацион детей с запорами должно осуществляться в соответствии с рекомендуемой схемой вскармливания с 4 – 5 месяцев жизни. Первыми в питание детей с функциональными запорами вводятся продукты, богатые пищевыми волокнами – фруктовое (яблоко, слива, чернослив) или овощное пюре (из кабачка, цветной капусты и др.), а в качестве зернового прикорма используются – гречневая, кукурузная, овсяная каши.
8.4. У детей, приобретающих туалетные навыки на момент постановки диагноза важно проведение образовательной и разъяснительной работы с родителями [2]. Необходимо акцентировать внимание родителей на том, что хронический запор – это длительно существующая проблема, требующая длительного лечения.
Существуют два основных критических периода, в течение которых риск развития запоров функционального характера наиболее высок. Это периоды обучения ребенка гигиеническим навыкам («приучение к горшку») и начала посещения организованных коллективов (детский сад, школа) [2].
Важной составляющей в профилактике запоров в детском возрасте является туалетный тренинг, предусматривающий высаживание ребенка с 1,5 лет на горшок 2-3 раза в день в течение 5 минут после приема пищи. Наиболее физиологичной считается утренняя дефекация, после завтрака. Тренинг обеспечивает развитие гастроколитического рефлекса, который усиливает перистальтику кишки за счет растяжения желудка.
Если ребенок активно отказывается от пользования горшком, рекомендуется прервать туалетный тренинг на период от 1 до 3-х месяцев. При отсутствии болезненной дефекации и запоров после перерыва большинство детей готовы продолжать «обучение». Но, если повторные попытки безуспешны, или ребенку более 4-х лет, то необходимо еще раз обследовать ребенка и/или обратиться к детскому неврологу [7].
8.5. Лечение функциональных запоров у детей, имеющих туалетные навыки.
8.5.1. Поведенческая терапия. Дефекация должна быть каждый раз в одно и то же время [2]. Ребенку с ФЗ необходимо проводить в туалете 3–10 мин (в зависимости от возраста). Высаживать ребенка на горшок или предлагать посетить туалет надо после каждого приема пищи.
Обязательное условие эффективной дефекации – обеспечить хороший упор для ног. Это может быть обеспечено наличием в туалете низкой скамейки для ребенка, на которую он может поставить ноги (повышение внутрибрюшного давления в «позе Вальсальвы»). Ежедневную частоту дефекаций можно отмечать в дневнике, который может быть проанализирован при плановом посещении педиатра. Для облегчения описания формы стула можно пользоваться «Бристольской шкалой» [2]. Рекомендуются массаж и регулярные занятия физкультурой, хотя их роль в лечении запоров с позиций доказательной медицины не имеет полноценной доказательной базы [2].
8.5.2. Коррекция питания. В комплексной терапии ФЗ показана диета, включающая зерновые, фрукты и овощи [2]. Углеводы, присутствующие в сливовом, персиковом и яблочном соках и пюре (особенно сорбит), влияют на частоту дефекаций и консистенцию каловых масс за счет увеличения водной составляющей. Недостаточное употребление пищевых волокон в ежедневном рационе является фактором риска возникновения запора [5]. Отмечена эффективность в лечении запора диеты, обогащенной фруктами, растительными волокнами или ржаным хлебом [22, 23].
Из питания рекомендуется исключить продукты, задерживающие опорожнение кишечника. Не рекомендуется «пища-размазня», пюреобразная, «еда на ходу», «перекусы».
Наоборот, показана рассыпчатая пища, мясо/птица/рыба «куском». Обязателен «объемный» завтрак – для стимуляции «гастроцекального рефлекса».
При употреблении в пищу грубой клетчатки необходимо обеспечить достаточное потребление воды.
Считается, что оптимальный водный режим для здоровых детей для детей в возрасте до 1 года составляет не менее 100-200 мл воды в сутки в зависимости от возраста и характера вскармливания.
С целью «оживления» двигательной функции кишечника детям с запорами показан прием прохладной жидкости натощак (питьевой и минеральной воды, сока, компотов, кваса) для усиления послабляющего эффекта возможно добавление меда, ксилита или сорбита.
При выборе минеральной воды при запорах у детей рекомендуется учитывать характер моторики толстой кишки. При гипомоторной дискинезии толстой кишки вода должна быть холодной (20–25°С), средней и высокой минерализации (Ессентуки N17, Баталинская, Арзни, Donat Mg и др.).
Молоко в чистом виде и в блюдах должно использоваться детьми с запорами ограниченно, так как нередко на фоне употребления этого продукта возникает метеоризм с возникновением или усилением болей в животе. Предпочтение отдается кисломолочным продуктам – кефир, ацидофилин, наринэ, мацони, простокваша, йогурт и т.п.
Есть данные, свидетельствующие о влиянии пробиотиков на моторику пищеварительного тракта. Однако полученных данных недостаточно для оценки эффективности пробиотиков при лечении ФЗ [25].
8.6. Медикаментозная терапия запоров. При отсутствии эффекта от проводимой диетотерапии и коррекции поведения их необходимо сочетать с медикаментозной терапией. Лечение ФЗ следует проводить дифференцированно с учетом возраста ребенка и стадии ФЗ: компенсированной, субкомпенсированной и декомпенсированной.
8.6.1. Лечение при «каловом завале»
Копростаз встречается у половины детей с функциональным запором. Необходимо устранить копростаз до начала поддерживающей терапии для усиления эффекта лечения. Для эвакуации из кишки плотных каловых масс могут быть использованы пероральные и ректальные препараты: очистительные клизмы, минеральные масла или микроклизмы с лаурилсульфатом. Рекомендуется применение в течение 3-6 дней (максимум 6 дней) препаратов полиэтиленгликоля (ПЭГ) в более высоких дозах (1-1.5 г/кг) или клизм. Несмотря на то, что применение ПЭГ чаще ассоциируется с недержанием кала по сравнению с клизмами, ввиду меньшей инвазивности, ПЭГ является препаратом первого выбора [21]. Ряд пациентов с субкомпенсированным и декомпенсированным течением ФЗ могут нуждаться в госпитализации [24].
8.6.2. Поддерживающая медикаментозная терапия
Цель терапии – регулярный безболезненный стул мягкой консистенции и профилактика повторного формирования «калового завала». Это достигается с помощью слабительных средств.
Терапия первой линии включает назначение препаратов ПЭГ (с электролитами или без) в стартовой дозе 0,4 г/кг/сутки с последующим подбором дозы в зависимости от ответа на терапию [21]. Препараты лактулозы используются также как терапия первой линии при невозможности приема ПЭГ детям с рождения. Поддерживающая терапия осмотическими слабительными должна продолжаться не менее 2 месяцев [21].
При недостаточной эффективности и/или в случае наличия выраженного проктогенного компонента запоров в качестве дополнительной терапевтической опции также могут быть назначены ректальные формы (свечи с глицерином) коротким курсом.
Применение минеральных масел, стимулирующих слабительных рекомендуется как дополнительная терапия или терапия второй линии при неэффективности или недостаточной эффективности предшествующей терапии осмотическими слабительными [21].
Наряду со слабительными средствами, эффективно назначение нормокинетиков (тримебутин), пре- и пробиотиков, а также у части больных спазмолитиков и желчегонных средств.
Применение пробиотиков при запорах у детей является предметом дискуссии. На сегодняшний день исследовано влияние на моторную функцию кишечника у младенцев Bifidobacterium longum, Lactobacillus reuteri (DSM 17938), Bifidobacterium animalis subsp.lactis (BB-12) [21, 22]. На данный момент экспертами не рекомендуется рутинное использование про- и пребиотиков, значимого изменения питания и массивной лекарственной терапии при запорах у младенцев [19].
Рекомендуется постепенное снижение дозы применяемых препаратов до полной отмены, но не ранее чем через месяц после купирования симптомов запора. В этом случае доза осмотических слабительных, таких как лактулоза, сорбитол, ПЭГ подбирается индивидуально и чаще составляет 1/3-1/2 от терапевтической. Такая схема терапии используется с целью профилактики и оценки рецидивов.
Клинические исследования, указывающие на оптимальную длительность поддерживающей терапии при функциональных запорах у детей, отсутствуют. Согласно международным рекомендациям, терапия должна быть прекращена только при достижении удовлетворительных результатов туалетного тренинга [21].
9. Показания для госпитализации:
9.1 Развитие осложнений (кишечное кровотечение, копростаз, энкопрез, хроническая трещина прямой кишки);
9.2 Торпидность к проводимой терапии, ранние рецидивы при отмене терапии;
9.3 Подозрение на органический или симптоматический запор.
Список литературы
1. Захарова И. Н., Андрюхина Е. Н. Запоры у детей раннего возраста: современные подходы к терапии //Медицинский совет. – 2011. – №. 9-10. – С. 122-129
2. Хавкин А.И., Бельмер С.В., Горелов А.В., и др. Прокт конснсуса общества детских гастроэнтрологов «Диагностика и лечение функцонального запора у детей» Вопросы детской диетологии. 2013. Т. 11. № 6. С. 51-59.
3. Хавкин АИ. Коррекция функциональных запоров у детей. Российский вестник перинатологии и педиатрии. 2012;4(1):127-30.
4. Утц ИА, Городкова ЕИ. Синдром раздраженного кишечника у детей. Экспериментальная и клиническая гастроэнтерология. 2006;5:92-8.
5. Andrews CN, Storr M. The pathophysiology of chronic constipation. Can J Gastroenterol. 2011 Oct;25 Suppl B:16B-21B.
6. Boilesen S. N. et al. Water and fluid intake in the prevention and treatment of functional constipation in children and adolescents: is there evidence? //Jornal de Pediatria (Versão em Português). – 2017. – Т. 93. – №. 4. – С. 320-327; 36
7. Hyman PE, Milla PJ, Benninga MA, Davidson GP, Fleisher DF, Taminiau J. Childhood functional gastrointestinal disorders: neonate/toddler. Gastroenterology. 2006 Apr;130(5):1519-26.
19. Loening-Baucke V. Encopresis and soiling. Pediatr Clin North Am. 1996 Feb;43(1):279-98.
20. Longstreth GF, Thompson WG, Chey WD, Houghton LA, Mearin F, Spiller RC. Functional bowel disorders. Gastroenterology. 2006 Apr;130(5):1480-91.
21. Mugie S., Benninga M. A., Di Lorenzo C. Epidemiology of constipation in children and adults: a systematic review //Best practice & research Clinical gastroenterology. – 2011. – Т. 25. – №. 1. – С. 3-18
22. Rao SS, Ozturk R, Laine L. Clinical utility of diagnostic tests for constipation in adults: a systematic review. Am J Gastroenterol. 2005 Jul;100(7):1605-15.
23. Rasquin A, Di Lorenzo C, Forbes D, Guiraldes E, Hyams JS, Staiano A, et al. Childhood functional gastrointestinal disorders: child/adolescent. Gastroenterology. 2006 Apr;130(5):1527-37.
24. Robin S. G. et al. Prevalence of pediatric functional gastrointestinal disorders utilizing the Rome IV criteria //The Journal of pediatrics. – 2018. – Т. 195. – С. 134-139; Huang R., Ho S.Y., Lo W.S., Lam T.H. Physical activity and constipation in Hong Kong adolescents //Plos one. – 2014. – Т. 9. – №. 2. – С. e90193
25. Vandenplas Y. et al. Functional gastro‐intestinal disorder algorithms focus on early recognition, parental reassurance and nutritional strategies //Acta Paediatrica. – 2016. – Т. 105. – №. 3. – С. 244-252
Рекомендуемые статьи
Синдром Крона
неспецифические гранулёмы в пищеводе.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.











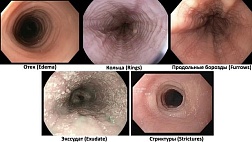


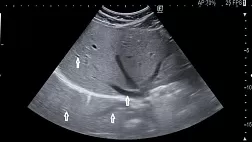


.jpg)




.png)













Комментарии