- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Дайджест
- QuaCol
- Разделы
- Пациентy
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Случайный выбор
данная функция, случайным образом выбирает информацию для Вашего изучения,
запустите выбор нажав кнопку ниже

Обратная связь
Напишите нам
Новости: The Lancet: эффективность "Спутника V" в третьей фазе испытаний превысила 91%
Полный текст статьи:
Также исследователи пришли к выводу, что вакцина полностью защищает при тяжелых случаях заболевания.
Помимо этого, результаты показали, что уровень антител у привитых добровольцев в 1,3—1,5 раза превышал уровень антител у переболевших.
1 Logunov DY, Dolzhikova IV, Shcheblyakov DV, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet 2021; published online Feb 2. https://doi.org/10.1016/S0140-6736(21)00234-8.
2 Barouch DH, Kik SV, Weverling GJ, et al. International seroepidemiology of adenovirus serotypes 5, 26, 35, and 48 in pediatric and adult populations. Vaccine 2011; 29: 5203–09.
3 Dolzhikova IV, Zubkova OV, Tukhvatulin AI, et al. Safety and immunogenicity of GamEvac-Combi, a heterologous VSV- and Ad5-vectored Ebola vaccine: an open phase I/II trial in healthy adults in Russia. Hum Vaccin Immunother 2017; 13: 613–20.
4 Lu S. Heterologous prime-boost vaccination. Curr Opin Immunol 2009; 21: 346–51.
5 Voysey M, Clemens SAC, Madhi SA, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet 2021; 397: 99–111.
6 Sadoff J, Le Gars M, Shukarev G, et al. Safety and immunogenicity of the Ad26.COV2.S COVID-19 vaccine candidate: interim results of a phase 1/2a, double-blind, randomized, placebo-controlled trial. medRxiv 2020; published online Sept 25. https://doi.org/10.1101/2020.09.23.20199604 (preprint).
7 Zhu F-C, Guan X-H, Li Y-H, et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet 2020; 396: 479–88.
8 Almuqrin A, Davidson AD, Williamson MK, et al. SARS-CoV-2 candidate vaccine ChAdOx1 nCoV-19 infection of human cell lines reveals a normal low range of viral backbone gene expression alongside very high levels of SARS-CoV-2 S glycoprotein expression. Res Square 2020; published online Oct 20. https://doi.org/10.21203/rs.3.rs-94837/v1 (preprint).
9 Liu J, Ewald BA, Lynch DM, et al. Magnitude and phenotype of cellular immune responses elicited by recombinant adenovirus vectors and heterologous prime-boost regimens in rhesus monkeys. J Virol 2008; 82: 4844–52.
10 Logunov DY, Dolzhikova IV, Zubkova OV, et al. Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia. Lancet 2020; 396: 887–97.
11 Cohen J. Russia’s claim of a successful COVID-19 vaccine doesn’t pass the ‘smell test,’ critics say. Science 2020; published online Nov 11. https://doi.org/10.1126/science.abf6791.
Рекомендуемые статьи
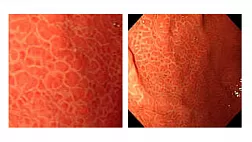
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Работаем и учимся при поддержке
Партнеры

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.














.jpg)





.png)


.jpg)














Комментарии