- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Актуальные вопросы эндоскопии. Сборник статей 12ой Всероссийской научной практической конференции, 2021
Введение:

Полный текст статьи:
13-14 МАЯ 2021 САНКТ-ПЕТЕРБУРГ СБОРНИК МАТЕРИА ЛОВ КОНФЕРЕНЦИИ УДК 616-072.1(082) ББК 53.433.5я43 А43 А43 Актуальные вопросы эндоскопии. Сборник статей 12ой Всероссийской научной практической конференции, 2021. УДК 616-072.1(082) ББК 53.433.5я43 ДОРОГИЕ ДРУЗЬЯ! УВАЖАЕМЫЕ КОЛЛЕГИ! Перед вами сборник тезисов нашей с вами 12-й конференции «Актуальные вопросы эндоскопии». Мы не виделись с вами больше года и этот год был для всех нас очень непростым, приходилось работать в условиях новой коронавирусной инфекции, однако мы с оптимизмом смотрим в будущее… Благодарю всех вас, кто подготовил свои материалы для публикации, мы еще раз убеждаемся в том, что уровень мастерства российских врачей-эндоскопи стов нисколько не уступает достижениям иностранных специалистов в области диагностической и лечебной эндоскопии. Успехи многих областей медицины, в частности гастроэнтерологии, напрямую связаны с внедрением новых эндоскопических методов обследования и лечения в широкую клиническую практику. Быстрое развитие эндоскопической техники значительно расширило возможности врачей-эндоскопистов, позволило снизить риск осложнений и внедрить новые методики эндоскопической диагностики и лечения. И все это благодаря развитию новых технологий в эндоскопии и в медицине в целом. Именно поэтому тема нашей конференции 2021: «Эндоскопия – будущее медицины». Считаю основным достижением нашей конференции общение друг с другом. Мы уже давно стали одной дружной семьей, а наши личные встречи и многочисленные онлайн мероприятия в разных регионах России в последний год позволили нам выявить и осветить в программе многие проблемные вопросы. Ждем вас на сессиях: новые технологии в эндоскопии, экстренная эндоскопия, скрининг рака ЖКТ, бронхоскопия, детская эндоскопия. Мы подготовили специализированную сессию: «Эндоскопия в условиях эпидемии новой коронавирусной инфекции», где обобщен опыт работы эндоскопии в условиях пандемии, а также предложены новые рекомендации по обеспечению эпидемиологической безопасности в условиях инфекции. На секции для эндоскопических сестер осветим новые требования санитарного законодательства к обеспечению эпидемиологической безопасности в эндоскопии, а также большое внимание будет уделено вопросам дезинфекции эндоскопического оборудования на hands-оn тренингах. Мне хочется поблагодарить всех участников нашей конференции за активное участие в проведении и организации нашего эндоскопического праздника, праздника, который дает нам заряд профессионального удовлетворения и дружеского общения на целый год. Благодарю вас за активное участие в Первенстве России по эндоскопии, которое в этом году будет уже 10-м и желаю удачи участникам и болельщикам. В этом году конференция проходит в мае это прекрасное время, когда наш город в преддверии Белых ночей очень красив и приветлив к своим гостям. Мы постарались сделать пребывание на конференции и в нашем городе приятным и полезным для Вас. От имени организаторов выражаю благодарность нашим постоянным партнерам фирмам производителям эндоскопического оборудования и инструментария, медицинских препаратов. Желаю всем вам интересной и плодотворной работы на нашей конференции, интересных профессиональных и дружеских встреч. А самое главное удачи в нашем благородном деле – лечении наших пациентов. Председатель Российского эндоскопического общества д.м.н., профессор Королев М. П. ОПЫТ ПРИМЕНЕНИЯ УЛЬТРАЗВУКОВЫХ ЗОНДОВ ДЛЯ ДИАГНОСТИКИ ПЕРИФЕРИЧЕСКИХ НОВООБРАЗОВАНИЙ ЛЕГКИХ, В КУРГАНСКОМ ОБЛАСТНОМ ОНКОЛОГИЧЕСКОМ ДИСПАНСЕРЕ, Верходлиб Ю. В., заведующая отделением внутрипросветной эндоскопической диагностики, ГБУ « Курганский областной онкологический диспансер» г. Курган Рак легкого занимает одно из 1-х мест по заболеваемости, как правило, диагностируется на 3-4 стадии, что ведет к неизлеченности и рецидивам заболевания, часто это связано с поздней обращаемостью и неполной диагностикой, поэтому требования к методам диагностики постоянно увеличиваются. Злокачественные новообразования легких имеют полиморфную картину и дальнейшая тактика лечения, как правило, зависит от морфологического заключения. Диагностика центральных новообразований как правило не вызывает трудностей, в первую очередь для получения морфологического материала, диагностика периферических новообразований, вызывают затруднения, связанные с получением материала на гистологическое исследование. Своевременная и правильная диагностика с получением морфологического заключения важна для тактики лечения и ультразвуковая эндосонография, во многих слу- ■ Верходлиб Ю. В. чаях может стать оптимальным методом для диагностики злокачественных новообразований легких. В отделении эндоскопии Курганского онкологического диспансера, используем ультразвуковые высокочастотные минизонды, проводим их в инструментальный канал видеобронхоскопа, что дает возможность получить изо- бражения периферических новообразований бронхов. Дополнительно используется тубус – проводник с ультразвуковым зондом, после визуализации опухоли выполняется биопсия, с использованием щетки цитологической и биопсийных щипцов. Осмотр проводился, с использованием видеобронхоскопов, и ультразвуковых зондов (УЗ) 20МГц, у пациентов с периферическими новообразованиями легких, диагностированных на рентгене и КТ ОГК. Все исследования проведены амбулаторно под местной анестезией раствором лидокаина, с использованием видеобронхоскопов BF 1Т 190 и 180 Olympus, ультратонкий ультразвуковой зонд UM-S20-20R и ультразвуковой центр EU-ME2. Видеобронхоскоп введен трансназально, или трансорально в просвет трахеи, с последующим ультразвуковым сканированием бронхов высокочастотным минизондом, при топировании образования через тубус проводник – проведены цитологическая щетка и щипцы с поэтапным проведением забора материала. Результаты За 2020 г. с января по декабрь 2020 г. в ГБУ «Курганском областном онкологическом диспансере», осмотрено 70 пациентов, которым было проведено диагностическая бронхоскопия с использованием УЗ зондов, у пациентов с периферическими новообразованиями легких. Цитологическое подтверждение диагноза получено в 72% случаев, гистологическое в 54% случаев, во всех случаях подтверждено злокачественное новообразование. Эффективность диагностики при использовании бронхоскопии с минидатчиками, зависит от расположения зонда во время исследования относительно очага. Исследования, при которых, по данным изображений, зонд был в центре очага поражения, имели более высокие показатели эффективности диагностики. При расположении зонда рядом с очагом информативность значительно снижалась, верификацию в таких случаях получено не было, это позволяет нам предположить, что поражения, которые визуализируются рядом с УЗ зондом, находиться в тесном контакте с поверхностью бронха, и поэтому диагностическая биопсия здесь, как правило, не эффективная, у пациентов использовались другие методы диагностики (торакоскопия в том числе). Эффективность диагностики очагов в зависимости от размера не зависела, при расположении зонда в центре очага. У всех пациентов отмечалась незначительная кровоточивость после забора материала, что свидетельствует о правильном расположении зонда, и адекватном заборе материала. Методика биопсии периферических новообразований легкого с предварительным исследованием УЗ зондом позволяет верифицировать периферический рак легкого различных локализаций и является методом выбора. Современный диагностический метод востребован в практической медициной, эффективен, может быть широко использован. ЭНДОСКОПИЧЕСКАЯ КЛАПАННАЯ БРОНХОБЛОКАЦИЯ У ПАЦИЕНТКИ С ОСЛОЖНЕНИЯМИ COVID-19 КЛИНИЧЕСКИЙ СЛУЧАЙ Дробязгин Е. А.1,2, Чикинев Ю. В.1,2, Архипов Д. А.1 1ГБУЗ НСО «Государственная Новосибирская областная клиническая больница» 2ФГБОУ ВО «Новосибирский Государственный медицинский университет» Минздрава России г. Новосибирск В период 2020 года в стационары города резко увеличилась госпитализация пациентов с вирусно-бактериальными пневмониями, вызванными SARSCov-2, осложненными деструкциями легочной ткани. Эндоскопическая клапанная бронхоблокация является одним из методов лечения пациентов с деструктивными процессами в легочной ткани, осложненными возникновением бронхоплевральных свищей. Представляем опыт применения эндоскопической клапанной бронхоблокации при лечении пациентки с правосторонней деструктивной вирусно-бактериальной пневмонией, осложненной бронхо-плевральным свищем и эмпиемой плевры. Пациентка К. Возраст 34 лет. Поступила в стационар 25.04.2020 с диагнозом: Вирусно-бактериальная пневмония. Беременность IV, 23 недели. Со слов пациентки: заболела с 16.04.2020, когда отметила повышение температуры тела до 38 градусов, сухой кашель, першение в горле. Лечилась самостоятельно, принимала амоксиклав, парацетамол без эффекта. Через 7 суток (23.04.2020) кашель усилился, сохранялось повышение температуры тела до 37,8, слабость, появилась одышка. Госпитализирована с диагнозом: ОРВИ. Вирусно-бактериальная пневмония. Беременность IV, 23 недели. При рентгенографии органов грудной клетки – правосторонняя нижнедолевая пневмония. 26.04.2020 выполнен мазок на COVID-19 – результат положительный, переведена в ОРИТ, на момент перевода SpO285% на фоне инсуфляции увлажненного кислорода 8л/ мин, ЧДД 28 в минуту, ЧСС 103 в 1 минуту, признаки РДС, переведена на ИВЛ. 27.04.2020 в связи с прогрессированием дыхательной недостаточности выполнено досрочное родоразрешение: Кесарево сечение (живой недоношенный мальчик 600 г весом). Осложнений в послеоперационного периода нет. 27.04.2020 для обеспечения адекватной санации трахеобронхиального дерева выполнена нижняя трахеотомия. При МСКТ органов грудной клетки (27.04.2020) (Рис. 1) объем нижней доли левого легкого несколько уменьшен, с наличием в структуре доли (практически все сегменты кроме S8) отмечается появление обширного участка консолидации на фоне которого отмечаются суженные просветы бронхов. Также отмечается появление подобных изменений в дорзальных отделах нижней доли (S6, S9, S10) и в прикорневых и дорзальных отделах верхней доли правого и в дорзальных отделах S1-2 левого легкого, бронх В6 правого легкого практически не прослеживаются. Также в динамике отмечается нарастание выраженности двухсторонних участков уплотнений по типу матового стекла в структуре участков утолщения внутрии междольковых перегородок с утолщением внутридольковых перегородок (с-м «булыжной мостовой»), расположенные во всех сегментах обоих легких. 14.05.2020 по данным МСКТ органов грудной клет ки признаки двухсторонней пневмонии, деструктивной справа, большого правостороннего гидроторакса (Рис. 2). Торакальным хирургом выполнена пункция плевральной полости справа – получено 1200 мл выпота в виде «мясных помоев». Тогда же пациентка начала дышать самостоятельно и была переведена для лечения в профильное отделение 15.05.2020. При ларинготрахеобронхоскопии признаки диффузного катарально-гнойного I ст. эндобронхита. Трахеостомическая трубка удалена. По данным МСКТ органов грудной клетки (03.06.2020) признаки правостороннего гидропневмоторакса с компрессией легочной ткани (Рис. 3), выполнено дренирование правой плевральной полости. В течение двух суток сохранялась утечка воздуха по плевральному дренажу. 05.06.2020 выполнена ларинготрахеобронхоскопия под местной анестезией с установкой клапанного бронхоблокатора в промежуточный бронх (блокатор Medlung № 12) (Рис. 4) с хорошим клиническим эффектом– сброс воздуха по плевральному Рис. 1. Рентгеновская мультиспиральная компьютерная томография органов грудной клетки. Во всех отделах легких определяются двухсторонние участки уплотнений по типу матового стекла В структуре участков утолщения внутрии междольковых перегородок с утолщением внутридольковых перегородок Рис. 2. Рентгеновская мультиспиральная компьютерная томография органов грудной клетки. Явления деструкции в нижней доле правого легкого с наличием массивного гидроторакса Рис. 3. Рентгеновская мультиспиральная компьютерная томография органов грудной клетки. Гидропневмоторакс справа с компрессией правого легкого дренажу прекратился через 6 часов после вмешательства. Но, 07.06.2020 дня пациентка откашляла бронхоблокатор, что потребовало повторной клапанной бронхоблокации промежуточного бронха (блокатор Medlung № 13) с хорошим клиническим эффектом (сброс воздуха по плевральному дренажу прекратился через 8 часов после вмешательства). При МСКТ органов грудной клетки 10.06.2020 – положительная динамика по течению пневмонии, минимальный правосторонний пневмоторакс, формирование фиброателектаза правого легкого вследствие клапанной бронхоблокации промежуточного бронха (Рис. 5). 16.06.2020 ухудшение состояния с появлением утечки воздуха по плевральному дренажу, дополнительно выполнена установка клапанного бронхоблокатора в верхнедолевой бронх справа, с уменьшением интенсивности утечки воздуха из плевральной полости справа. При МСКТ органов грудной клетки от 18.06.2020 отмечена отрицательная динамика, выражающаяся в увеличении остаточной плевральной полости до 9,9x3,8x12,6см в следствие миграции бронхоблокатора из промежуточного в нижнедолевой бронх (Рис. 6), выполнено удаление блокатора из промежуточного бронха с установкой блокатора большего размера. После этого отмечена положительная динамика с прекращением утечки воздуха по плевральному дренажу. По данным МСКТ органов грудной клетки (24.06.2020) ателектаз правого легкого, пневмоторакса нет, остаточная плевральная полость не определяется (Рис. 7). Клапанный бронхоблокатор из верхнедолевого бронха справа удален 29.06.2020, утечка воздуха не рецидивировала. По МСКТ органов грудной клетки (02.07.2020) признаки уплотнения легочной ткани правого легкого (по типу гиповентиляции и интерстициальных изменений) (Рис. 8). Дренаж из плевральной полости удален 03.07.2020 и 07.07.2020 пациентка выписана из стационара. Поступила 10.08.2020 для дообследования и удаления бронхоблокатора. При поступлении: состояние удовлетворительное, жалоб активно не предъявляет. По данным МСКТ органов грудной клетки (25.07.2020) (Рис. 9) легочные поля умеренно ассиметричны. Определяется диффузное снижение пневматизации паренхимы легких в виде уплотнения по типу матового стекла и ретикулярных изменений. В S4,5,6,7,8,9,10 правого легкого пневматизация паренхимы повышена с выраженными уплотнениями, где просветы бронхов расширены, стенки их утолщены. В правой плевральной полости определяется скопление жидкости по дорзальной и латеральной поверхностям с толщиной слоя до 7 мм. Заключение Признаки остаточных изменений полисегментарной двухсторонней пневмонии с интерстициальным компонентом. Признаки малого правостороннего гидроторакса. Признаки гипервентиляции нижней и средней долей правого легкого на фоне бронхиального блокатора в просвете нижнедолевого бронха. При эндоскопическом исследовании 11.08.2020 (Рис. 10) – определяются рубцовые изменения слизистой верхнедолевого бронха правого легкого, просвет промежуточного бронха перекрыт клапанным бронхоблокатором). Удалить блокатор с применением видеобронхоскопии не удается, что потребовало экстракции блокатора при ригидной бронхоскопии с применением щипцов для ригидной бронхоскопии. 13.08.2020 пациентка выписана из стационара. Рис. 4. Эндофото. Клапанный блокатор, перекрывающий промежуточный бронх Рис. 5. Рентгеновская мультиспиральная компьютерная томография органов грудной клетки через 5 суток после клапанной бронхоблокации промежуточного бронха. Положительная динамика по течению пневмонии, минимальный правосторонний пневмоторакс, формирование ателектаза правого легкого Рис. 6. Рентгеновская мультиспиральная компьютерная томография органов грудной клетки через 18 суток после клапанной бронхоблокации промежуточного бронха. Отрицательная динамика: увеличение остаточной плевральной полости до 9,9x3,8x12,6 см Рис. 7. Рентгеновская мультиспиральная компьютерная томография органов грудной клетки после замены блокатора в промежуточном бронхе. Ателектаз правого легкого, пневмоторакса нет, остаточная плевральная полость не определяется Рис. 8. Рентгеновская мультиспиральная компьютерная томография органов грудной клетки после удаления блокатора из верхнедолевого бронха справа. Определяются уплотнения легочной ткани правого легкого (по типу гиповентиляции и интерстициальные изменений) Рис. 9. Рентгеновская мультиспиральная компьютерная томография органов грудной клетки перед удалением бронхоблокатора из промежуточного бронха. Малый правосторонний гидроторакс. Гиповентиляция нижней и средней долей правого легкого Рис. 10. Эндофото а – клапанный блокатор, перекрывающий просвет промежуточного бронха; b – рубцовые изменения слизистой верхнедолевого бронха справа; c – через сутки после удаления блокатора из промежуточного бронха (отек, гиперемия слизистой промежуточного бронха) ЭНДОСКОПИЧЕСКАЯ КЛАПАННАЯ БРОНХОБЛОКАЦИЯ ПОСЛЕ РЕЗЕКЦИОННЫХ ОПЕРАЦИЙ НА ЛЕГКИХ Дробязгин Е. А.1,2, Чикинев Ю. В.1,2, Архипов Д. А.1 1ГБУЗ НСО «Государственная Новосибирская областная клиническая больница» 2ФГБОУ ВО «Новосибирский Государственный медицинский университет» Минздрава России г. Новосибирск За период с 2015 по 2021 годы в отделении торакальной хирургии ГБУЗ НСО ГНОКБ у 19 пациентов (мужчины-15, женщины-4) после резекционных операций на легких (апитичные резекции, лобэктомии) при периферических новообразованиях легких (15), альвеококкозе (2), врастании опухоли средостения или плевры в легочную ткань (2), травматическом разрыве легочной ткани (1) в раннем послеоперационном периоде отмечена утечка воздуха по плевральным дренажам. Возраст пациентов находился в диапазоне от 15 до 78 лет и составил в среднем значении 58,17 лет. Для купирования утечки воздуха всем пациентам в течение 2-3 суток после операции выполнена эндоскопическая клапанная бронхоблокация силиконовым клапаном Medlung (Россия) под местной анестезией. Определение «адресного» бронха осуществлялось на основании данных протокола выполненной операции, а также путем временной окклюзии бронха баллонным катетером Фогарти, установленным в бронх через биопсийный канал гибкого эндоскопа. Установка блокатора осуществлялась под местной анестезией с использованием гибкого эндоскопа. У трех па- циентов блокаторы были установлен в верхнедолевой бронх справа, у 3 в верхнедолевой бронх слева, у 5 в промежуточный бронх, у 3 в правый главный бронх, у 2 в левый главный бронх, у 1 в нижнедолевой бронх слева. По 2 блокатора (в верхнедолевой бронх справа и промежуточный бронх) были установлены у 2 пациентов. Осложнений при установке блокатора не отмечено. Дополнительная блокация потребовалась у двух пациентов (после установки блокатора в нижнедолевой бронх слева блокатор установлен в левый главный бронх, после установки блокатора в верхнедолевой бронх справа блокатор был установлен в промежуточный бронх) через сутки после первого вмешательства из-за сохраняющейся утечке воздуха. В большинстве случаев (18) отмечена положительная динамика с прекращением утечки воздуха и расправлением легкого. Прекращение утечки воздуха происходило в течение первых суток после установки у большинства (16) пациентов. В двух случаях утечка прекратилась в течение вторых суток после вмешательства. Один пациент был оперирован через трое суток после вмешательства из-за сохраняющегося сброса воздуха. Положительный эффект подтвержден при рентгенографии органов грудной клетки, при которой отмечен регресс пневмоторакса (рисунки 1 a,b). Дренажи из плевральной полости извлекались на 2-3 сутки после прекращения сброса воздуха. Выписка из стационара осуществлялась на 3-4 сутки после блокации. В среднем значении длительность нахождения блокатора в бронхе составляла 16 дней (от 7 до 30 суток). В 1 случае блокатор был установлен на 6 месяцев. Осложнений при удалении блокатора не отмечено. Во всех случаях отмечались различной степени выраженности явления эндобронхита, в 4 случаях с возникновением грануляционной ткани в месте контакта блокатора со слизистой бронхиального дерева. В отдаленном периоде у 1 пациентки с длительностью блокации 6 месяцев через 2 месяца после удаления блокатора возник рубцовый стеноз верхнедолевого бронха справа, потребовавший проведения бужирования бронха. Выводы. Эндоскопическая клапанная бронхоблокация является высокоэффективным вмешательством, позволяющим добиться прекращения утечки воздуха по плевральным дренажам у 95% оперированных пациентов. Оптимальным сроком установки блокатора считаем 1-2 сутки после операции. Длительность блокации не должна превышать 1 месяц из-за риска осложнений. БРОНХОСКОПИЯ 21-ГО ВЕКА – ДОСТИЖЕНИЯ И ПЕРСПЕКТИВЫ Паламарчук Г. Ф., Деревянко А. В., Сайденова М. С., Герасин А. В. СЗГМУ им И. И. Мечникова ПСПбГМУ им. акад. И. П. Павлова г. Санкт-Петербург Эволюция бронхоскопии в течении более 120 лет (1897-2021) – наглядный пример смены приоритетов в диагностике и лечении заболеваний лёгких. Изобретение каждой новой модели бронхоскопа сопровождается разработкой и внедрением в практику новых, а также усовершенствованием прежних бронхологических методов в бронхопульмонологии. Так, гибкая фиброоптическая и видеобронхоскопия, стали доминирующими по отношению к жёсткой, и стимулировали разработку методики трансбронхиальной биопсии легких (ТББ), а также методики диагностического сегментарного бронхоальвеолярного лаважа (БАЛ) под местной анестезией, ранее применявшейся при жёсткой бронхоскопии и под общим обезболиванием. В то же время, для жёсткой бронхоскопии остались такие безальтернативные показания, как эндоскопический гемостаз при массивном легочном кровотечении и удаление крупного инородного тела или пищевых масс при их аспирации в дыхательные пути (ДП). Положительные тенденции наблюдаются в эндобронхиальной терапии заболеваний лёгких. Так, отмена протеолитических ферментов и нитрофурановых препаратов, применявшихся ранее при лечебной бронхоскопии, избавила пациентов от таких ятрогенных осложнений, как бронхоспазм, кровохарканье и отёк слизистой оболочки ДП. Выбор лекарственных средств для эндобронхиальной терапии стал патогенетически обоснованным и применяется в комплексе с системной терапией, что значительно повышает качество лечения. Существенно возросла роль гибкой, вспомогательной бронхоскопии, это и: интрооперационный мониторинг при торакальных операциях, эндоскопическая установка клапанного бронхоблокатора «Medlung», установка различных стентов при рубцовых и опухолевых стенозах трахеи и бронхов, эндоскопический контроль при чрезкожной дилятационной трахеотомии, проведение фотодинамической и брахитерапии. К основным видам современной гибкой диагностической бронхоскопии относятся: бронхоскопия с высоким разрешением (HDR), осмотр в узком спектре света (NBI), аутофлюоресцентная бронхоскопия (АФ), ультразвуковая бронхоскопия с тонкоигольной биопсией (EBUS TBNA), бронхоскопия с новыми видами ТББ под ультразвуковым наведением и криобиопсия. Применение для эндоскопии технологий HDR, NBI и АФ открывают неограниченные, но пока ещё не совсем изученные возможности визуального восприятия изменений струк- туры и сосудов слизистой оболочки ДП на качественно новом уровне – промежуточным между макро – и микроскопическим, прежде всего при ранних формах центрального рака лёгкого. Методика EBUS TBNA является более безопасной альтернативой медиастиноскопии при внутригрудных лимфоаденопатииях туберкулезного, саркойдного или метастатического происхождения, обнаруженных на МСКТ. Для диагностики периферических образований и интерстициальных изменений в лёгких в настоящее время применяются три вида ТББ: классическая ТТБ при гибкой бронхоскопии под местной анестезией и рентгенотелевизионным контролем, уменьшающем лучевую нагрузку на больного и врача; ТББ под ультразвуковым наведением и криобиопсия. Для выполнения криобиопсии используется жёсткая бронхоскопия в комбинации с гибкой под общим обезболиванием. Тем не менее, приоритетной остается классическая ТББ при гибкой эндоскопии под местной анестезией и полипозиционным рентгенологическим контролем, тогда как для других методов ТББ по прежнему требуются клинические доказательства их эффективности и безопасности. Таким образом, для современной бронхоскопии характерно стремление к усовершенствованию визуализации патологических изменений ДП, а также поиск информативных видов биопсии из лимфатических узлов средостения (EBUS TBNI) и лёгких (ТББ). Для внедрения в клиническую практику новых бронхологических методик исследований необходима соответствующая аппаратура, адекватные условия для безопасного её использования, дополнительная подготовка врача эндоскописта-бронхолога, владеющего классической (базовой, стандартной) гибкой и жёсткой бронхоскопией. У каждой бронхологической методики есть преимущества и недостатки, а также пределы диагностических возможностей. Поэтому, всегда необходимо учитывать целесообразность их применения по принципу «польза – риск». По мнению H. Baucher, главного редактора JAMA: «маловероятно, что многие из новых изобретений станут более важными чем те, чья эффективность уже доказана», высказанного по поводу поспешных публикаций, основанных на небольшом объеме данных. В материалах одиннадцатой конференции «Актуальные вопросы эндоскопии» отсутствуют тезисы докладов авторов по респираторный эндоскопии, что противоречит общепринятым правилам и исключает возможность цитирования данных, представленных в устном виде. ДИАГНОСТИКА ПЕРИФЕРИЧЕСКИХ ОБРАЗОВАНИЙЛЕГКИХПРИИСПОЛЬЗОВАНИИ УЛЬТРАЗВУКОВОЙ БРОНХОСКОПИИ Попова И. А., Важенин А. В., Кулаев К. И., Зуйков К. С., Юсупов И.М, Пушкарев Е. А., Казанцев А. С. ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины» г. Челябинск Цель невозможности проведения биопсийных щипцов или браш-щетки в сканируемый бронх.) Злокачественное новообразование было верифицировано у 186 пациентов (55,2%). Подозрение на злокачественное новообразование было у 21 пациента (6,3%). У 14 больных (4,2%) был верифицирован доброкачественный процесс. Характер опухолевого процесса не был установлен у 116 пациентов (34,4%), данным пациентам в последующем были выполнены более инвазивные процедуры. Из 186 пациентов у 76 (40,9%) была диагностирована немелкоклеточная карцинома. Также из группы немелкоклеточного рака практически с одинаковой частотой были выявлены аденокарцинома Повысить эффективность диагностики периферических новообразований легких при использовании ультразвуковой бронхоскопии. Материалы и методы На базе эндоскопического отделения ЧОКЦО и ЯМ в 2020 году было проведено 541 ультразвуковых бронхоскопий (rEBUS) пациентам с подозрением на периферический рак легкого в возрасте от 40 до 90 лет (мужского пола – 383 человека, женского – 158 человек). После ультразвуковой визуализации новообразования в легком выполнялся забор материала биопсийными щипцами и/или браш-щеткой, введенными поочередно через тубус-проводник к месту ЭУС-локации образования. Полученный материал направлялся на цитологическое и гистологическое исследование. Всем пациентам перед ультразвуковой бронхоскопией проводились рентгенография и компьютерная томография органов грудной клетки. По рентгенологическим данным органов грудной клетки все образования были 20 мм и более. Результаты Из 541 обследованного больного при ультразвуковой бронхоскопии визуализация новообразований достигнута у 409 пациентов (75,6%). У 132 пациентов (24,4%) новообразование не было выявлено при rEBUS. Из 409 пациентов с выявленными опухолями биопсия выполнена у 337 (82,4%) пациентов. (У 72 (13,3%) пациентов биопсия технически была не выполнима из-за парабронхиального расположения опухоли либо из-за инвазии новообразования в стенку сосуда, либо из-за легкого и плоскоклеточный рак, 36 (19,4%) и 38 (20,4%) случаев соответственно. У 12 (6,5%) пациентов был диагностирован мелкоклеточный рак. Метастазы диагностированы у 9 (4,8%) пациентов. Другие формы злокачественных новообразований легкого были верифицированы у 15 (8,1%) пациентов. Среди новообразований размерами от 2,0 см до 4,0 см был верифицировано 83 (44,6%) случая злокачественных новообразований. При размерах опухолей более 4,1 см число верификаций возрастает до 103 (55,4%). Из 337 пациентов, которым выполнялась биопсия, в 44 случаях была проведена браш-биопсия. Цитологическое подтверждение злокачественного новообразования при этом выявлено в 25 (56,9%), из них у 6 (13,6%) пациентов диагноз рака легкого выставлен только по цитологии. Тяжелых осложнений при выполнении ультразвуковой бронхоскопии не возникло. Капилярное кровотечение возникло у 3 (0,6%) пациентов из 541, которое было остановлено эндоскопическим методом. Летальных исходов не было. Выводы Из-за небольшого количества осложнений и малоинвазивности исследования проведение ультразвуковой бронхоскопии возможно на амбулаторном этапе. Перед исследованием необходимо выполнить рентгенографию и компьютерную томографию органов грудной клетки. Процент визуализации образований легкого при ультразвуковой бронхоскопии за 2020 год составляет 75,6%, а процент верификации злокачественных образований легкого – 55,2%. РОЛЬ БРОНХОСКОПИИ В ДИАГНОСТИКЕ И ЛЕЧЕНИИ ЛЕГОЧНЫХ ОСЛОЖНЕНИЙ У ПАЦИЕНТОВ С CОVID-19 Терещенко С. Г., Богданов А. П., Мечёва Л. В. ГБУЗ МЗ МО МОНИКИ им. М. Ф. Владимирского г. Москва Введение Фибробронхоскопия и лечебный лаваж бронхов являются эффективными методиками при нарушении бронхиальной проходимости, что особенно актуально у пациентов, нуждающихся в длительной искусственной вентиляции лёгких (ИВЛ). Без поддержания достаточной проходимости дыхательных путей невозможно говорить об обеспечении приемлемой инвазивной вентиляции легких, оксигенации и эффективности ИВЛ у пациентов с коронавирусной инфекцией COVID-19 [1, 2]. При выполнении эндоскопических вмешательств у пациентов с COVID-19 следует учитывать высокий риск передачи инфекции, тщательно оценивать показания и противопоказания к данной манипуляции [3]. Цель Анализ результатов лечебной фибробронхоскопии у пациентов с тяжелым течением COVID-19. Материал и методы Лечебная бронхоскопия была проведена у 60 больных (40 мужчин и 20 женщин), находившихся в палатах реанимации и интенсивной терапии инфекционного отделения. У всех пациентов была идентифицирована инфекция COVID-19, осложненная внебольничной пневмонией. Возраст больных был от 27 до 84 лет. Сопутствующая патология у пациентов была представлена хроническими болезнями почек, хронической ишемической болезнью сердца, артериальной гипертензией, сахарным диабетом, онкологическими заболеваниями и др. Для определения тяжести поражения легочной ткани применяли классификацию по степени характерных изменений, выявленных при компьютерной томографии (КТ) органов грудной клетки (КТ 0-КТ 4) [4]. Степень поражения легочной ткани КТ-2 была у 7 пациентов, КТ-3 – у 23, КТ4 – у 10. Основными показаниями для санации ТБД были: обтурация бронхов гнойными, фибринозными, геморрагическими сгустками, требующая удаления содержимого из бронхиального дерева; кровохаркание и легочное кровотечение; аускультативное ослабление дыхания; снижение показателя оксигенации по данным пульсоксиметрии. Манипуляции проводили со строгим соблюдением правил асептики, антисептики и эпидемиологической безопасности. Процедуру выполняли под местной анестезией (2% раствор лидокаина на бифуркацию трахеи и в просвет главных бронхов) или под внутривенным наркозом. Эндо- скопические манипуляции проводили через интубационную или трахеостомическую трубку. Согласно рекомендациям по соблюдению эпидемиологической безопасности [3], в ОРИТ бронхоскопия проводится через интубационную/трахеостомическую трубку в условиях ИВЛ после преоксигенации под контролем реаниматолога. Введение бронхоскопа должно осуществляться через адаптер-переходник без размыкания дыхательного контура, для уменьшения риска образования аэрозоля во время манипуляции. При выполнении санации трахеобронхиального дерева аспирация отделяемого проводится порционно, с длительностью непрерывной аспирации не более 3-5 секунд, в условиях апноэ, также для минимизации риска формирования аэрозоля. Результаты Количество лечебных бронхоскопий составило от 1 до 9 на пациента. После эвакуации из ТБД патологического содержимого улучшалась аускультативная картина, повышались объективные показатели оксигенации и легочной механики. Анализ результатов показал, что изменения ТБД соответствуют тяжести течения заболевания. Эндобронхит 1 ст. составлял 79% при первой бронхоскопии, при второй, третьей и четвертой – имел тенденцию к уменьшению. Эндобронхит 2 ст. при первой санации был у 21% больных, в дальнейшем была тенденция к нарастанию этих изменений, особенно при пятой бронхоскопии. Эндобронхит 3 ст был диагностирован у 7% больных со второго исследования и, в дальнейшем, количество таких изменений увеличивалось. Эрозивно-язвенные поражения ТБД были выявле ны при первой бронхоскопии у 15% больных и имели тенденцию к нарастанию. Динамика эндоскопической картины эрозивно-язвенных изменений ТБД показала нивелирование картины эрозивного воспаления и заживление дефектов слизистой. Рецидивы кровотечений в просвет бронхов из эрозий и язв были отмечены у 5% больных. Из 60 пациентов, находившихся под наблюдением, выздоровление имело место у 11 (18%), летальный исход был у 49 заболевших. Летальных исходов в ходе применения лечебной бронхоскопии и от осложнений бронхоскопии не зарегистрировано, пациенты погибли в результате прогрессирования основного заболевания. Заключение Своевременная санация ТБД у пациентов с тяжелым течением COVID-19, осложненным внебольничной пневмонией, необходима для обеспечения эффективной ИВЛ. Бронхоско- пия у таких пациентов позволяет прогнозировать развитие легочных осложнений. Санация ТБД не влияет на патогенетические изменения при тяжелом течении COVID-19. Лмтература 1. Wahidi MM, Shojaee S, Lamb CR, Ost D, Maldonado F, Eapen G, Caroff DA, Stevens MP, Ouellette DR, Lilly C, Gardner DD, Glisinski K, Pennington K, Alalawi R. The Use of Bronchoscopy during the COVID-19 Pandemic: CHEST/AABIP Guideline and Expert Panel Report. Chest 2020; S0012-3692(20)30850-3. 2. Luo F, Darwiche K, Singh S, Torrego A, Steinfort DP, Gasparini S, Liu D, Zhang W, Fernandez-Bussy S, Herth FJF, Shah PL. Performing Bronchoscopy in Times of the COVID-19 Pandemic: Practice Statement from an International Expert Panel. Respiration 2020; 99(5): 417-422. 3. Дуванский В. А., Карпенкова В. И., Князев М. В., Королев М. П., Короткевич А. Г., Кузин М. Н., Сазонов Д. В., Сивокозов И. В., Субботин А. М., Старков Ю. Г., Федоров Е. Д., Федоровский А. Ф., Филин А.А; Гренкова Т. А., Селькова Е. П. Временные рекомендации (версия 4 от 27 апреля 2020 года). Организация работы эндоскопических подразделений и обеспечение эпидемиологической безопасности эндоскопических вмешательств в условиях эпидемии новой коронавирусной инфекции.// Клиническая эндоскопия 2020, № 1 (56), С 51-52. 4. Синицын В. Е., Тюрин И. Е., Митьков В. В. Временные согласительные методические рекомендации Российского общества рентгенологов и радиологов (РОРР) и Российской ассоциации специалистов ультразвуковой диагностики в медицине (РАСУДМ)«Методы лучевой диагностики пневмонии при новой коронавирусной инфекции COVID-19» (версия 2). // Вестник рентгенологии и радиологии. 2020. Том 101 № 2 С 83. ОПЫТ ПРИМЕНЕНИЯ ПУНКЦИОННО-ДИЛЯТАЦИОННОЙ ТРАХЕОСТОМИИ У КОМОРБИДНЫХ ПАЦИЕНТОВ С ТЯЖЕЛЫМ ТЕЧЕНИЕМ COVID-19 Терещенко С. Г., Богданов А. П., Мечёва Л. В. ГБУЗ МЗ МО МОНИКИ им. М. Ф. Владимирского г. Москва Введение Пациентам с тяжелым течением COVID-19 при остром развитии инфекционно-воспалительных изменений со стороны дыхательной системы, в связи с необходимостью длительной искусственной вентиляции легких (ИВЛ) показано наложение трахеостомы. При наличии трахеостомы снижается потребность в седации, уменьшается дискомфорт пациента, облегчается уход за полостью рта и верхними дыхательными путями, ускоряется процесс перевода пациента на самостоятельное дыхание и укорачивается время пребывания в отделении реанимации [1]. Трахеостомия сопряжена с риском развития различных осложнений, в том числе летальных. В последние годы предпочтение отдают пункционно-дилатационному методу трахеостомии (ПДТ), который менее травматичен, прост в исполнении, позволяет уменьшить инфицирование операционной раны [2, 3, 4]. Основными методиками пункционной трахеостомии являются методы Сигли (с помощью серии дилататоров увеличивающегося диаметра) и Григза (с помощью дилатационного зажима) [3, 5]. В данной работе представлен опыт применения ПДТ у пациентов с коронавирусной инфекцией тяжелого течения, осложненной внебольничной пневмонией, находившихся на лечении в отделении реанимации. Материал и методы Показаниями к выполнению ПДТ были: прогнозируемая длительность ИВЛ более пяти суток; угнетение сознания до комы или необходимость проведения продлённой седации. Сотрудники эндоскопического отделения участвовали в выполнении 56 пункционных чрескожных трахеостомий (у 36 женщин и 20 мужчин) в палатах интенсивной терапии инфекционного отделения. Возраст больных был от 29 до 84 лет. Сопутствующая патология у пациентов была представлена хроническими болезнями почек, осложненными почечной недостаточностью, хронической ишемической болезнью сердца, артериальной гипертензией, аритмией, сахарным диабетом, онкологическими заболеваниями и др. Трахеостомия выполнялась на 1-16 сутки пребывания в отделении, среднее значение составило 7,1+1,3 дня. Во всех случаях применена методика дилатационной трахеостомии по Сигли при помощи одноразовых трахе- остомических наборов. Манипуляция проводилась в положении пациента лежа на спине, с разогнутой шеей, для чего под плечи подкладывался валик. Объем кислорода в дыхательной смеси увеличивали до 100%. Под эндоскопическим контролем после декомпрессии манжеты интубационную трубку подтягивали до уровня голосовой щели. Для адекватной вентиляции легких использовался специальный Г-образный переходник, позволяющий одновременно проводить вентиляцию и осуществлять эндоскопический контроль при манипуляции. После антисептической обработки проводился вертикальный разрез кожи по срединной линии шеи в проекции 1-2-го трахеальных колец. Выполнялась тупая диссекция мягких тканей претрахеального пространства и под визуальным контролем через бронхоскоп между 1-м и 2-м трахеальными кольцами проводниковой канюлей с иглой пунктировалась трахея. После извлечения иглы через канюлю вводился проводник-катетер с гибкой струной-проводником. По струне отверстие в трахее расширялось бужом диаметром 14 Fr, затем по струне и катетеру проводнику осуществлялось введение основного конусовидного бужа с переменным диаметром 14-42 Fr до уровня, обозначенного как Skin Level Positioning Mark (маркировка позиции уровня кожи). Бужи вводились в просвет трахеи строго вертикально, вкручиванием в ткани, что позволяло минимально травмировать последние. После извлечения бужа в трахею на обтураторе помещалась трахеостомическая трубка и налаживалась искусственная вентиляция легких. Трубка фиксировалась к шее пациента. Тактика профилактики осложнений, связанных с трахеостомией, (пневмоторакса, гидроторакса, трахеопищеводной и трахеососудистой фистулы) строилась в строгом соответствии с национальными и международными рекомендациями [4, 6, 7]. Результаты и обсуждение ПДТ заменяет хирургическую трахеостомию (ХТ) в реанимационной практике в связи с быстротой наложения ПДТ и меньшей частотой развития различных осложнений по сравнению с ХТ [3, 5]. Длительность трахеостомии в нашей серии наблюдений составила 10,5 ± 2,9 мин. По данным литературы, такое время можно считать обычным для методики ПДТ. Выполнение пункционно-дилятационной трехеостомии было успешно завершено у всех 56 пациентов. В ряде случаев наблюдались осложнения. У 3 пациентов (5%) отмечалось выраженное капиллярное кровотечение из зоны кожного разреза, которое было устранено дополнительным прошиванием подкожной клетчатки. Рецидивов кровотечения отмечено не было. По литературным данным, периоперационные кровотечения являются наиболее частыми осложнениями ПДТ и могут стать причиной ухудшения состояния пациента [3]. У 12 пациентов (21%) в ходе выполнения ПДТ было отмечено быстрое выраженное критическое снижение параметров оксигенации. Ни у одного из 56 пациентов, которым мы выполнили ПДТ, не отмечалось развития таких тяжёлых периоперационных осложнений, как остановка сердца, ранение задней стенки трахеи, пневмо-, гемоторакс, разрыв трахеи, ранение бронхов, трахеопищеводный свищ. Летальных исходов в ходе выполнения пункционной трахеостомии не зарегистрировано. Проследить отдален- ные осложнения в этой группе больных на данный момент не представляется возможным. В первую очередь таким наблюдениям препятствует высокая летальность среди пациентов: 35 (56%) из них погибли в результате прогрессирования основного заболевания. Заключение Выполнение пункционно-дилятационной трахеостомии у пациентов с тяжелым течением коронавирусной инфекции можно считать мерой профилактики развития целого ряда осложнений, которые способны ухудшить результаты лечения. Видеоэндоскопический контроль при пункционной трахеостомии позволяет свести к минимуму частоту осложнений. Дилятационный метод наложения пункционной трахеостомы является предпочтительным из-за более щадящего воздействия на ткани претрахеального пространства и трахеи. Относительная простота и скорость выполнения такой операции дают возможность рекомендовать ее к использованию в условиях реанимационного отделения стационара по лечению больных с тяжелым течением COVID-19. Литература 1. Alansari M., Alotair Н., Aseri Z. A., Elhoseny M. A. Use of ultrasound guidance to improve the safety of percutaneous dilatational tracheostomy: a literature review. Crit. Care. 2015; 19(1): 229. 2. Эпштейн С. Л., Романовcкий Ю. Я., Назаров В. В. Чрескожная трахеотомия – оптимальная альтернатива стандартной методике // Вестник интенсивной терапии.1997. № 4. С. 33. 3. Freeman B., Isabella K., Perren C. et al. A prospective, randomised study comparing percutaneous with surgical tracheostomy in critically ill patients // Crit. Care Med. 2001. Vol. 29. P. 926-930. 4. Briche T., Le Manach Y., Pats B. Complications of percutaneous tracheostomy // Chest. 2001. Vol. 119, No. 4. P. 1282-1283. 5. Friedman Y., Fildes J., Mizock В. et al. Comparison of percutaneous and surgical tracheostomies // Chest.1996. Vol. 110. Р. 480-485. 6. Brunetti I., Pelosi P. Frova’s Rotational Technique and Fantoni’s Translaryngeal Tracheostomy. In: Servillo G., Pelosi P., eds. Percutaneous Tracheostomy in Critically Ill Patients. Springer, Cham; 2016. 7. Bodenham A., Bell D., Bonner S., Branch F., Dawson D., Morgan P., et al. Standards for the care of adult patients with a temporary tracheostomy; standards and guidelines. Intensive Care Society. 2014; 2014: 29-32. ОСОБЕННОСТИ ЭНДОСКОПИЧЕСКОЙ ПУНКЦИОННО-ДИЛЯТАЦИОННОЙ ТРАХЕОСТОМИИ У ПАЦИЕНТОВ С COVID-19 Филин А. А., Пиханов Р. В., Черных Д. А. ГБУЗ «Ленинградская областная клиническая больница» г. Санкт-Петербург Эндоскопическая пункционно-дилятационная трахеостомия (ЭПДТ) у пациентов с вирусной пневмонией COVID-19 сопряжена с высоким риском заражения медицинского персонала и высоким риском осложнений у пациента (в основном, усугубление ОРДС, гипоксия). В нашей клинике ЭПДТ традиционно выполняется двумя врачами эндоскопистами при помощи эндоскопической медсестры и поддержке врача реаниматолога. При этом оператор непосредственно формирует трахеостому, а ассистент обеспечивает адекватную визуализацию процесса. Реаниматолог контролирует витальные функции пациента, обеспечивает наркоз. Пункционно-дилятационная трахеостомия без эндоскопического контроля имеет значительно более высокий риск неудачи, в том числе с критическими (вплоть до летальных) последствиями. При наличии анатомических особенностей (короткая шея, тучный пациент, уплощённая форма трахеи, девиация трахеи и т. п.) значительно возрастает риск травмы задней стенки трахеи, повреждения пищевода, установки канюли в претрахеальное пространство или в просвет пищевода. Помимо этого, высока вероятность пропустить кровотечение в трахеобронхиальное дерево. В условиях высокого риска осложнений, для ЭПДТ имеет смысл привлекать максимально опытных специалистов. Существует ряд особенностей, позволяющих выполнять ЭПДТ максимально эффективно и безопасно. Очень важна визуализация просвета трахеи при выполнении инвазивных этапов. Это позволит избежать травмы задней стенки трахеи, точнее выбрать траекторию пункции, стабилизировать инструменты, проконтролировать положение канюли. Для этого мы рекомендуем использовать эндоскопические системы с видеомонитором. Это могут быть как мобильные эндоскопические стойки, так и под- ключаемые внешние камеры, лекциоскопы. При высоком уровне угрозы заражения персонала преимущество следует отдавать видеосистемам, либо внешним камерам для фибробронхоскопов. Для формирования эндоскопической трахеостомы пациент должен быть интубирован в обязательном порядке. Интубация сама по себе имеет инфекционные риски для врача анестезиолога-реаниматолога, поэтому использование видеосистем для интубации является приоритетным. Размер дыхательной трубки должен соответствовать диаметру бронхоскопа. Чаще всего, оптимальной является трубка № 8,0 и больше. В противном случае есть значи- тельно повышается риск повреждения бронхоскопа и его выхода из строя. При этом следует учитывать, что интубация через носовые ходы обеспечит более стабильную позицию дыхательной трубки за счёт дополнительной точки фиксации. Это существенно облегчит и обезопасит дальнейшие этапы операции. У пациентов, интубированных через рот, более высокий риск критической миграции дыхательной трубки. При стандартной эндоскопической трахеостомии желательно использовать внутривенный наркоз без миорелаксации, так как это позволяет избежать дыхательных осложнений (асфиксии) при неудаче. Иначе обстоит дело при вирусной пневмонии (COVID-19). В этом случае выдох пациента в открытое пространство может сопровождаться массированных выбросом вирусных агентов с высоким инвазивным началом. При кашле эта ситуация значительно усугубляется. В связи с этим, у данной группы пациентов имеет смысл использование миорелаксантов на всех этапах эндоскопической трахеостомии. Сама процедура бронхоскопии, при высоком риске заражения персонала и прогрессирования ОРДС у пациента, должна осуществляться без значимого нарушения герметичности дыхательного контура (через отверстие в клапане переходника). Отсоединение дыхательного контура от дыхательной трубки на период бронхоскопии крайне нежелательно (недопустимо). Пока оператор готовит операционное поле, ассистент при сдутой манжетке трахеальной трубки под визуальным контролем подтягивает дыхательную трубку таким образом, чтобы нижний её край находился на уровне истинных голосовых складок, определяя при этом скат гортани. Анестезиолог раздувает манжету максимально. Это связано с тем, что преддверье гор- тани значительно шире трахеи, а нам необходимо минимизировать сброс воздуха по системе. Для снижения риска инфицирования персонала необходимо предотвратить выдохи пациента в атмосферу на этом этапе. Имеет смысл временно прекратить подачу газовой смеси в лёгкие на выдохе. При этом дополнительную опасность представляют этапы дилятации трахеи и установки трахеостомической канюли, так как при этом возможен резких выдох через стому с выбросом контаминированного воздуха, мокроты, слизи и даже крови с широким углом поражения. На этих этапах целесообразно обеспечить отрицательное давление в дыхательных путях (путём временного отключения ИВЛ на выдохе). По этой причине рекомендуется наличие минимум одного опытного оператора в команде для минимизации периода вынужденного апноэ и снижения риска интраоперационных осложнений. Табл. 1 За один год работы нашей эндоскопической службы в специализированном инфекционном стационаре (100 коек, 35 коек реанимации) выполнено более 200 ЭПДТ. Эффективность методики составила 99%. В двух случаях операция не была завершена. Это стойкая интраоперационная гипоксия и техническая недоступность трахеи (короткая шея, тучный пациент, девиация трахеи). Частота кровотечений из кожного разреза, требующих дополнительного гемостаза (прошивание) составила 5%, что в 2-2,5 раза выше, чем у пациентов без COVID-19. В ряде случаев зарегистрированы нарастающие пневмомедиастинум и пневмоторакс на фоне жестких параметров вентиляции после ЭПДТ в течение 12-24 часов после ЭПДТ (причина -наличие канала трахеостомы) – 2%. При этом летальность от прогрессирующих кардиореспираторных нарушений составила 50%. Стремительная гипоксия с крайне медленным восстановлением зарегистрирована в 25% случаев. При анализе данных важным фактором является то, что затруднена достоверная оценка отдалённых результатов ЭПДТ из-за высокой смертности пациентов с COVID-19 на ИВЛ. ЭПДТ у пациентов реанимации с COVID-19 – это своего рода вызов для эндоскопистов и реаниматологов. Она несёт в себе больше рисков тяжелых осложнений, чем стандартная ЭПТД. Операция требует чёткого понимания процесса, тщательной подготовки команды, мастерства исполнителей и соблюдения методики. В таком случае ЭПДТ остается максимально эффективной и безопасной, увеличивая шансы пациентов с тяжелыми формами COVID-19 на восстановление. Таблица № 1. Критические моменты ЭПТД Критический момент ЭПДТ Опасность Тактический аспект Интубация пациента Массивный вирусный выброс, асфиксия Видеосистемы для интубации Бронхоскопия Массивный вирусный выброс, усугубление ОРДС Доступ через клапан с сохранением герметичности контура Позиционирование дыхательной трубки Массивный вирусный выброс, спонтанная экстубация Миорелаксанты, блок ИВЛ на выдохе, контроль и фиксация трахеальной трубки Формирование трахеостомы Массивный вирусный выброс, кровотечение Миорелаксанты, блок ИВЛ на выдохе, опытный оператор, эндоскопический контроль Установка канюли Асфиксия Опытный оператор, эндоскопический контроль ПРОМЕЖУТОЧНЫЕ РЕЗУЛЬТАТЫ РАНДОМИЗИРОВАННОГО ИССЛЕДОВАНИЯ ПО ОЦЕНКЕ СРАВНИТЕЛЬНОЙ ЭФФЕКТИВНОСТИ ВИРТУАЛЬНОЙ БРОНХОСКОПИИ И РАДИАЛЬНОЙ ЭНДОСОНОГРАФИИ В ДИАГНОСТИКЕ ПЕРИФЕРИЧЕСКИХ ОБРАЗОВАНИЙ ЛЕГКИХ Чесалина Я. О. ФГБНУ «Центральный научно-исследовательский институт туберкулеза» г. Москва Цель На сегодняшний день нет единого мнения о роли виртуальной бронхоскопии (ВБ) в качестве навигационной методики в малоинвазивной диагностике периферических образований легких (ПОЛ), в том числе в сочетании с радиальной эндобронхиальной ультрасонографией (рЭБУС). Целью данной работы явилась первая в России сравнительная оценка эффективности виртуальной бронхоскопии и радиальной эндобронхиальной ультрасонографии в дифференциальной диагностике периферических образований легких. Материалы и методы В скрининг вошло 70 пациентов, удовлетворяющих критериям включения в исследование. Рандомизировано 62 пациента, проанализированы данные 54 из них (25 мужчин, средний возраст 52,5 года). Пациенты с периферическими образованиями (средний размер составил 34 мм), выявленными по данным КТВР ОГК, рандомизировались в две группы в зависимости от применяемой методики навигации: в первой (33 чел) выполнялась ВБ (программные пакеты Osirix/Horos) в комбинации с рЭБУС с помощью мини-зонда (Olympus UM-S20-17S), во второй (21 чел) – только ВБ. Всем пациентам в рамках дифференциальной диагностики проводилась бронхоскопия с различными видами биопсий как в комбинациях, так и в моновариантах (с учетом данных навигации) с последующим цитологическим, гистологическим и микробиологическим исследованием полученного материала. Оценивалась диагностическая эффективность, а также факторы эффективности биопсий в каждой из анализируемых групп. Результаты Перипроцедурных осложнений не было отмечено ни в одной из групп. Диагностическая эффективность биопсий суммарно составила 58% (19/33) и 76% (16/21) для группы I (ВБ + рЭБУС) и группы II (ВБ), соответственно (p=0.16). Необходимо отметить, что четыре пациента в группе I с неинформативными результатами биопсий выбыли из наблюдения. Диагностическая эффективность достигла 100% (11/11) и 83% (10/12) при злокачественных образованиях, 67% (4/6) и 67% (4/6) – при туберкулезе органов дыхания, 33% (4/12) и 66% (2/3) – при доброкачественной этиологии образований в группах I и II соответственно. Факторами, повышающими эффективность биопсий при навигационной бронхоскопии в каждой из групп, являлись: наличие симптома дренирующего бронха по данным КТ ОГК, размер образования более 20мм, верхнедолевая локализация периферического образования, а также этиология процесса. Помимо этого, в первой группе эффективность биопсий была выше при достижении визуализации образования при рЭБУС, а во второй группе – измененная внутрипросветная анатомия бронхов по результатам ВБ как возможный признак централизации злокачественного процесса в легком. Заключение Виртуальная бронхоскопия и радиальная эндобронхиальная ультрасонография – эффективные методы навигации, позволяющие повысить информативность малоинвазивной диагностики при периферических образованиях легких. Виртуальная бронхоскопия может являться альтернативой в случае отсутствия других методов навигации, в том числе рЭБУС. ЧУВСТВИТЕЛЬНОСТЬ ЭНДОСКОПИЧЕСКОГО УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ ЛЁГКОГО В ЗАВИСИМОСТИ ОТ ПОЛОЖЕНИЯ УЛЬТРАЗВУКОВОГО ЗОНДА В ПАТОЛОГИЧЕСКОМ ОЧАГЕ Юсупов И. М., Кулаев К. И., Важенин А. В., Зуйков К. С., ГБУЗ «Челябинский Областной Клинический Центр Онкологии и Ядерной Медицины» г. Москва Введение Эндоскопическая ультразвуковая диагностика периферических новообразований легкого, прочно вошла в повседневную клиническую практику врачей эндоскопистов. Гистологическая верификация периферических новообразований лёгкого колеблется от 30% до 85%. Процент верификации напрямую зависит от положения ультразвукового очага в патологическом очаге. Материалы и методы В исследования включены пациенты с подозрением на периферический рак лёгкого, проходившие обследования и лечение в ГБУЗ «ЧОКЦО и ЯМ» с 2009 по 2016 г. Проведен анализ материалов амбулаторных карт и историй болезни 129 больных с подозрением на периферический рак лёгкого. Из них 100(77,5%) мужчин и 29(22,5%) женщин. Средний возраст в группах составил 66±8,2 года. Возрастной интервал находился в пределах от 40 до 86 лет. В соответствии с целью работы, для решения поставленных задач пациенты были разделены на три группы в зависимости от расположения зонда в патологическом очаге. В первую, контрольную группу вошли пациенты (n=56) с самой благоприятной ситуацией с позиции диагностики новообразования – ультразвуковой зонд располагался в центре патологического очага и был окружён опухолевой тканью. Данная группа формировалась ретроспективно. Во вторую, основную группу, проспективную, вошли пациенты (n=40), у которых ультразвуковой зонд располагался в патологическом очаге, но близко, либо на границе, с окружающей здоровой тканью органа. В этих случаях применялась другая методика забора материала – использовался модифицированный тубус-проводник для улучшения качества получаемого материала. Третью группу сравнения составили пациенты (n=33) у которых, как и в основной группе, ультразвуковой зонд расположен в патологическом очаге, но близко, либо на границе, с окружающей неизменённой тканью органа, но в отличие от второй группы для выполнения биопсии опухолевой ткани использовали стандартный тубус-проводник. Результаты исследования Стандартная методика с использованием стандартного тубус проводника биопсии применялась нами в двух группах, контрольная группа и группа сравнения. В этих группах использовался стандартный тубус-проводник. В сравниваемых группах опухоли были подразделены по размеру до 20 мм, с 21 до 40 мм и более 41 мм. Самое большое количество новообразований (размером 41мм и более) отмечалось у 75 (58,2%) пациентов. Новообразования 21-40 мм определялись у 47 (36,4%) пациента, новообразования до 20 мм – у 7 (5,4%) пациентов. Группы по размерам были сопоставимы. Диагноз злокачественного новообразования в основной группе верифицирован у 21 пациентов (52,5%) в группе сравнения у 13 пациентов (39,4%), в контрольной группе у 32 пациентов (60,7%). Итого из 129 пациентов диагноз злокачественного новообразования был установлен у 68 (52,5%) пациентов. Разница между II и III группой составляет 13,1%. (патент № 2591634 от 22.06.2016 года) Выводы 1. Нами была разработана и предложена новая методика получения материала из патологического очага при расположении ультразвукового зонда в новообразовании, но на границе с неизменённой паренхимой лёгкого, что позволила повысить процент верификации на 13%. 2. Разработанная и апробированная методика обладает рядом преимуществ и позволяет повысить эффективность по сравнению с II группой. 3. Еще одним плюсом является то что исследования проводиться на амбулаторном этапе и не требует госпитализации. Капсульная эндоскопия Высокое качество изображения по самой доступной ЦЕНЕ в России ЭНДОУЛЬТРАСОНОГРАФИЧЕСКАЯ ДИАГНОСТИКА СУБЭПИТЕЛИАЛЬНЫХ ОБРАЗОВАНИЙ ПИЩЕВОДА Борсук А. Д., ГУ «Республиканский научно-практический центр радиационной медицины и экологии человека» г. Гомель, Республика Беларусь Введение Стандартная эндоскопия в белом свете является основным методом диагностики субэпителиальных образований (СЭО) желудочно-кишечного тракта. Она дает возможность описать интралюминальный вид СЭО, его локализацию, приблизительный размер, однако не позволяет провести дифференциальную диагностику между разными типами поражений. Эндоскопическая ультрасонография (ЭУС) считается методом выбора в оценке размера, границ, структуры образования, слоя, из которого оно исходит, дает возможность провести дифференциальную диагностику между внутристеночными (интрамуральными) образованиями и экстраорганной компрессией. Цель Изучить возможности ЭУС в диагностике СЭО пищевода. Метод Исследование проводилось с использованием эхоэндоскопа PENTAX с линейным датчиком и ультразвукового сканера HITACHI NOBLUS с частотой сканирования 7,5-10 МГц. ЭУС-характеристика СЭО основывалась на определении слоя, из которого оно исходит, размера, контура (четкий/нечеткий), эхогенности (анэхогенное, гипоэхогенное, гиперэхогенное, смешанной эхогенности), структуры (однородная, неоднородная), наличия включений (кальцификаты, трубчатые структуры) и положения по отношению к соседним анатомическим образованиям. Всем пациентам перед ЭУС выполнялось стандартное эндоскопическое исследование в белом свете. Результаты и обсуждение Всего с подозрением на СЭО пищевода было обследовано 64 пациента. 36 (56,2%) из них были женщины, 28 (43,8%) – мужчины. Возраст пациентов варьировал от 19 до 52 лет. Средний возраст составил 35,7 года. Из всех обследованных пациентов с подозрением на СЭО пищевода диагноз был подтвержден у 57 (89,1%). В 51 (89,5%) случае были выявлены доброкачественные образования. Чаще всего диагностировались лейомиомы – 29 (56,9%) случаев, реже – кисты – 15 (29,4%), липомы – 3 (5,8%), зернистоклеточные опухоли – 2 (3,9%), карцино- ид – 1 (2,0%), нейрофиброма – 1 (2,0%). В 6 (10,5%) случаях были выявлены гастроинтестинальные стромальные опухоли (ГИСО). Диагноз во всех случаях был подтвержден иммуногистохимическим исследованием материала, полученного ЭУС-ассистированной ■ Борсук А. Д. тонкоигольной пункцией (ЭУС-ТИП). Размеры ГИСО варьировали от 1,2 см до 3,5 см. В 1 (16,7%) случае поражение имело размер 2,6 см, нечеткий контур, неоднородную структуру, гипери анэхогенные включения, что дало основание предположить его злокачественную трансформацию. У двух пациентов было выявлено несколько СЭО: в одном случае – сочетание лейомиомы и кисты, во втором – ГИСО и зернистоклеточной опухоли. У 7 (10,9%) пациентов эндосонографических данных за наличие СЭО выявлено не было. На эхограммах определялись неизмененные слои стенки пищевода, деформация просвета была обусловлена компрессией прилежащими органами и структурами, в двух случаях– кистами средостения. Наиболее распространенной локализацией СЭО явился грудной отдел пищевода – 82%. Заключение В случаях выявления СЭО пищевода или при подозрении на их наличие при выполнении эндоскопических исследований дополнительно используется ряд уточняющих неинвазивных диагностических методов: рентгенологический, компьютерная томография. Однако эти методы оказываются малоили неинформативными для постановки правильного диагноза. Преимущества ЭУС перед другими методами визуализации в настоящее время очевидны. ЭУС позволяет не только дифференцировать СЭО от экстраорганной компрессии, но и точно определить слой, из которого данное образование исходит, его точную локализацию, ряд характерных ЭУС-признаков, а ЭУС-ТИП дает возможность получить материал для морфологического и иммуногистохимического исследования. Безопасность метода сопоставима с таковой при обычном эндоскопическом исследовании в белом свете (риск осложнений <0,05% при диагностической ЭУС). По совокупности клинико-эндоскопических и ЭУС-признаков возможно предположить вероятность злокачественности обнаруженного образования, определить дальнейшую тактику ведения пациента. ИНОРОДНОЕ ТЕЛО ПИЩЕВОДА, ОСЛОЖНЕННОЕ ДВУМЯ ПЕРФОРАЦИЯМИ КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ Вербовский А. Н., Якимчук Р. И., Балалыкин А. С., Шашкова Ю.С. ГБУЗ МО «Красногорская городская больница № 1» г. Москва Введение Инородные тела пищевода являются частой патологией в экстренной эндоскопии. Подавляющее большинство инородных тел (80-90%) проходят через желудочно-кишечный тракт (ЖКТ) самостоятельно, без осложнений. Эндоскопическое вмешательство является передовым методом извлечения инородных тел и лишь менее 1% больных подвергаются хирургическому лечению [1]. Однако ежегодно от данной патологии погибает до 1500 человек. При этом перфорация пищевода инородным телом – грозное осложнение, приводящее к развитию медиастинита, эмпиемы плевры, пищеводных фистул и кровотечений [2]. Клиническое наблюдение Больной Х., 20 лет, 19.04.2020 г. поступил в хирургическое отделение с диагнозом инородное тело пищевода. Из анамнеза известно, что за 2 часа до госпитализации пациент проглотил фрагмент мяса с костью (баранина). 19.04.2020 г. выполнена эзофагогастродуоденоскопия (ЭГДС) дежурной службой. При ЭГДС в просвете средней трети пищевода определяется инородное тело плоской формы, светло-желтой окраски, размером около 20х35х3 мм. Многократные попытки извлечь инородное тело безуспешны. Манипуляция была прекращена. 20.04.2020 г. под эндотрахеальным наркозом выполнена повторная попытка экстракции инородного тела. При пальпа- Рис. 1. Плоское инородное тело в просвете пищевода Рис. 2. По эндоскопу в просвет пищевода низведен Overtube Рис. 3. Попытки завести кость в просвет Overtube при помощи захвата для извлечения инородных тел безуспешны Рис. 4. Кость захвачена эндоскопической корзиной и разрушена при помощи механического литотриптора Рис. 5. Кость захвачена эндоскопической корзиной и разрушена при помощи механического литотриптора Рис. 6. В области прилегания краев кости определяются две перфорации стенок пищевода Рис. 7. В области прилегания краев кости определяются две перфорации стенок пищевода Рис. 8. Закрытие дефектов при помощи эндоскопических клипс Рис. 9. Закрытие дефектов при помощи эндоскопических клипс Рис. 10. Закрытие дефектов при помощи эндоскопических клипс Рис. 11. Закрытие дефектов при помощи эндоскопических клипс Рис. 12. При рентгеноскопии с водорастворимым контрастом данных за экстравазацию не получено торном исследовании в области шеи определялась крепитация, что свидетельствовало о вероятной перфорации стенки пищевода. При эндоскопии на расстоянии 25 см от края резцов визуализировано инородное тело (кость) плоской формы, размером 20х35х3. Края инородного тела плотно прилегали к стенкам пищевода (рис. 1). Эндоскоп был извлечен. В связи с отсутствием CO2 инсуффлятора, на эндоскоп монтирован и заведен в пищевод Overtube (рис. 2). Наличие Overtube позволило выполнять дальнейшие манипуляции в условиях минимальной инсуффляции атмосферного воздуха в просвет ЖКТ и безопасно извлекать через него острые инородные тела (осколки кости). Вместе с тем попытки завести инородное тело в Overtube оказались безуспешны из-за несоответствия диаметра Overtube и кости. Попытки фрагментировать кость эндоскопическими ножницами неудачны. В результате на кость наброшена эндоскопическая корзина Дормиа. Выполнено механическое разрушение кости. Острые фрагменты разрушенного инородного тела извлечены через Overtube (рис. 3, 4, 5). В области стояния инородного тела визуализированы два перфоративных отверстия на противоположных стенках, размером 10 мм и 7 мм (рис. 6, 7). При помощи эндоскопических клипс отверстия полностью закрыты. Всего потребовалось 11 клипс (рис. 8, 9,10, 11). Под контролем рентеноскопии в пищевод введена водорастворимая контрастная жидкость. Данных за экстравазацию контраста нет. Контраст свободно проходит в желудок (рис. 12). Больной получал антибактериальную, инфузионную и антисекреторную терапию. Выписан из стационара на 7 сутки в удовлетворительном состоянии. Заключение Перфорация пищевода инородным телом – жизнеугрожающее состояние, требующее принятия экстренных лечебных мер. Современные эндоскопические технологии позволяют извлекать инородные тела из ЖКТ и лечить развившиеся осложнения. Такой малоинвазивный подход является достойной альтернативой традиционной хирургии. Литература 1. Guidelines for the management of ingested foreign bodies. GastrointestEndosc 1995;42:236-8 2. Chirica, M., Kelly, M. D., Siboni, S., Aiolfi, A., Riva, C. G., Asti, E., Bonavina, L. (2019). Esophageal emergencies: WSES guidelines. World Journal of Emergency Surgery, 14(1). doi:10.1186/s13017-019-0245-2 ЭНДОСКОПИЧЕСКОЕ ОБСЛЕДОВАНИЕ У ПАЦИЕНТОВ С ЗАБОЛЕВАНИЯМИ ПИЩЕВОДНО-ЖЕЛУДОЧНОГО ПЕРЕХОДА Галимов О. В., Ханов В. О., Бакиров М. Р., Галимов Д. О., Сайфуллин Р. Р. ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России г. Уфа Нами проведено эндоскопическое обследование и хирургическое лечение 280 пациентов с доброкачественной патологией кардии (грыжи пищеводного отверстия, ахалазия кардии), находившихся на лечении на клинических базах кафедры хирургических болезней и новых технологий Башкирского государственного медицинского университета и отделения хирургии и желудка РКОД МЗ РТ (г. Казань). Методика исследования и критерии его оценки были традиционные. Исследовали состояние слизистых оболочек глотки, пищевода, желудка и дуоденум, определяли наличие в них очаговых и диффузных поражений, поверхностных эрозий и геморрагий, физиологичность расположения складок, их эластичность. Эндоскопическое описание включало визуальную оценку диаметра просвета пишевода, его проходимости и содержимого, перистальтики, тонуса кардиального сфинктера, воспалительных изменений слизистой наличие рефлекторного ответа в момент глотания. При выявлении язвенных поражений пищевода, последние тщательно исследовали и описывали их локализацию, диаметр и глубину дефекта. Для идентификации участков поражения при эндоскопическом исследовании пищеводав 35 наблюдениях мы использовали МВ1-эндоскопию. Гистологическое исследование было выполнено в 188 случаях (67,1%), из них у всех 74 пациентов (100%) основной группы до операции и в 39 случаях (52,7%) у пациентов основной группы после операции. Полученные нами результаты свидетельствуют о том, что фиброэндоскопия является одним из наиболее достоверных методов диагностики АК, позволяет изучить состояние слизистой оболочки пищевода и желудка на основании визуального осмотра, а также результатов гистологического и цитологгического исследования полученного биопсийного материала. ЭНДОСКОПИЧЕСКОЕ ЛЕЧЕНИЕ ПИЩЕВОДНО-БРОНХИАЛЬНОГО СВИЩА Гасанов А. М., Даниелян Ш. Н., Тарабрин Е. А., Николаева Е. Б., Ахмедов М. Г. ГБУЗ НИИ СП им. Н.В. Склифосовского г. Москвы Пищеводно-бронхиальный свищ (ПБС) – редкая патология, относящаяся к сложным разделам торакальной хирургии. Развитие ПБС чаще всего свидетельствует о прогрессировании рака пищевода или легкого, в то время как доброкачественная этиология заболевания регистрируется значительно реже (4-6%). Цель исследования Поделиться собственным опытом лечения пищеводно-бронхиального свища с использованием эндоскопических тоннельных методик. Пациентка К., 58 лет поступила в НИИ СП им. Н.В Склифосовского с жалобами на частое поперхивание при приеме пищи. В анамнезе у пациентки диагностировано генетическое заболевание синдром Лейдена с частыми рецидивирующими тромбоэмболиями легочной артерии. При обследовании у пациентки выявлен пищеводно-бронхиальный свищ овальной формы размерами 8х3 мм (Рис. 1). При бронхоскопии свищ локализовался в левом главном бронхе, из просвета свища отмечалось поступление гнойного секрета. Под эндотрахеальным наркозом выполнена эндоскопическая чрезкожная гастростомия. Далее гибким эндоскопом из просвета пищевода выполнен продольный разрез слизистой оболочки на 5 см проксимальнее свищевого хода, сформирован подслизистый тоннель протяженностью 6 см. Свищевой ход мобилизован по окружности, иссечен у основания и клипирован (Рис. 2, 3). Питание в послеоперационном периоде осуществлялось через гастростому. При контрольном рентгенологическом и эндоскопическом исследованиях спустя 30 дней свищевого хода не выявлено (Рис. 4, 5). Гастростомическая трубка удалена. Пациентка выписана из стационара. Заключение Эндоскопические тоннельные методики могут быть рекомендованы при лечении пациентов с пищеводно-респираторными свищами. ВНУТРИПРОСВЕТНЫЕ ВМЕШАТЕЛЬСТВА ПРИ СУБЭПИТЕЛИАЛЬНЫХ ОПУХОЛЯХ ПИЩЕВОДА Дробязгин Е. А.1,2, Чикинев Ю. В.1,2, Архипов Д. А.1 1 ГБУЗ НСО «Государственная Новосибирская областная клиническая больница» 2 ФГБОУ ВО «Новосибирский Государственный медицинский университет» Минздрава России г. Новосибирск В Государственной Новосибирской областной клинической больнице в период с 2018 по 2021 год удаление подслизистых опухолей пищевода проведено 29 пациентам в возрасте от 30 до 72 лет (средний возраст пациентов 49 лет). Среди пациентов 12 мужчин и 17 женщин. У 20 (69%) пациентов диагноз субэпителиального новообразования был установлен ранее. Срок от момента установления диагноза до обращения к нам клинику был различен и находился в диапазоне от 2 недель до 8 лет. При этом у 19 отмечено увеличение новообразования в динамике в ходе проводимого наблюдения. У 17 пациентов жалоб не было. У 12 пациентов были жалобы на дисфагию при приеме твёрдой пищи (7) и изжогу (1). Решающее значение для выбора метода удаления новообразования придавалось данным эндоскопического ультразвукового исследования, при котором определялась локализация опухоли в стенке пищевода по отношению к его слоям (Рис. 1). Во всех случаях новообразования исходили из 2 (мышечная пластика слизистой оболочки) и 4 (собственный мышечный слой) слоев стенки органа. Во всех случаях новообразования определялись как гипоэхогенные, преимущественно гомогенные, новообразования, расположенные в пределах слизистой оболочки, подслизистого слоя, мышечного слоя пищевода с достаточно четко отграниченными контурами. У 1 пациента опухоль локализовалась в верхней трети пищевода, у 16 в средней трети пищевода (в одном наблюдении диагностированы две субэпителиальные опухоли небольших размеров), у 10 в нижней трети пищевода, у 2 в зоне пищеводно-желудочного перехода. Опухоль размером 5-10 мм были у 4 пациентов, 11-15 мм у 9, 16-20 мм у 5, 21-25мм у 3, 26-30 мм у 3, 31-35мм у 2, 36-40 мм у 1, более 40 мм у 2. Размер опухолей в наибольшем измерении в среднем значении составлял 20 мм. Все вмешательства выполнялись в условиях операционной под общей анестезией с интубацией трахеи с использованием гибким эндоскопов Olympus (Япония) (180 серия) с использованием CO2 инсуффлятора Olympus (Япония). Для рассечения слизистой, формирования тоннеля и выделения опухоли применялись tringle-knife Olympus, ножи Qили О-типа (Finemedics – Ю. Корея). Гемостаз осуществлялся с применением коаграспера Olympus (Япония) или щипцов для горячей биопсии (Finemedics – Ю. Корея). При выполнении тоннельного типа вмешательства основной этап проводил- ся с использованием коагуляции в спрей-режиме. При вариантах резекции слизистой оболочки применялись ножи О-типа (Finemedics – Ю. Корея) и петли для полипэктомии. Тактика вмешательства зависела от размеров и глубины расположения опухоли. В 2 случаях выполнена резекция слизистой оболочки пищевода с новообразованием. У большинства (27) пациентов вмешательство выполнялось путем туннелирования (Рис. 2 а-г). В 25 случаях опухоль извлекалась целиком. Лишь у двух пациентов из-за размеров опухоли более 4 см, последняя извлекалась после разделения ее на фрагменты (Рис. 3). Длительность вмешательства составляла от 15 до 210 минут (в среднем значении 61,23 минуты). Особые сложности представляли плексиморфные опухоли, которые встретились у 3 пациентов (из-за особенностей их формы были трудности с визуализацией, увеличение длительности операции) и опухоли размером более 4 см (у 2 пациентов). Интраи послеоперационных осложнений не было. Во всех наблюдениях опухоль была полностью удалена. Рис. 2. Эндофото. Удаление субэпителиального новообразования с использованием туннельной методики (а – этап рассечения слизистой оболочки; б – этап выделения новообразования; в-новообразование выделено и смещено в туннель; г – вид после удаления новообразования). Рис. 3. Фото. Фрагменты извлеченной опухоли Расхождений между локализацией опухоли по данным УЗИ и интраоперационными данными не обнаружено. Во всех случаях туннелирования дефект слизистой оболочки в зоне досупа клипировался. При резекции слизистой оболочки необходимости в клипировании не было. Патоморфологической верификации подвергались все удаленные новообразования. Проводилось определение новообразования при светооптической микроскопии. При необходимости выполнялось иммуногистохимическое исследование. У 27 пациентов диагностирована лейомиома (Рис. 4), в 1 случае – зернисто-клеточная опухоль (из мышечной пластики слизистой оболочки). Выводы Эндоскопические вмешательства при подслизистых новообразованиях пищевода являются малотравматичными, высокоэффективными и безопасными, позволяя сократить длительность пребывания пациентов в стационаре. Рис. 4. Иммуногистохимическое исследования удаленной опухоли. Ki-67 менее 1% ПЕРОРАЛЬНАЯ ЭНДОСКОПИЧЕСКАЯ МИОТОМИЯ ПРИ ЛЕЧЕНИИ АХАЛАЗИИ КАРДИИ У ПАЦИЕНТОВ СТАРШЕ 65 ЛЕТ Канищев И. С., Шишин К. В., Недолужко И. Ю., Курушкина Н. А., Шумкина Л. В. ГБУЗ Московский Клинический Научный Центр им. А. С. Логинова ДЗМ г. Москва Актуальность Пероральная эндоскопическая миотомия (ПОЭМ) в настоящее время является приоритетным методом лечения ахалазии кардии в специализированных центрах. Эффективность ПОЭМ сопоставима с операцией Геллера, однако имеет меньшую продолжительность оперативного вмешательства, а также меньшую частоту послеоперационных осложнений. Ввиду более длительного течения заболевания, а также физиологических особенностей пациентов данной возрастной группы, выбор метода лечения должен основываться на таких факторах как безопасность, эффективность, а также возможность выполнения одноэтапного лечения, без повторных манипуляций. Материалы и методы В отделение оперативной эндоскопии МКНЦ им. А. С. Логинова 280 пациентам с диагнозом ахалазии кардии была выполнена ПОЭМ в период с 07.2014 по 10.2020 гг. Среди них, число пациентов старше 65 лет составило 49 человек. При этом средний возраст составил – 70,6 года (65-84 года). Во всех клинических наблюдениях диагноз ахалазии кардии был установлен на основании данных ЭГДС, рентгенологических методов исследования, а также на результатах манометрии высокого разрешения. Результаты 4 стадия ахалазии кардии была установлена у 6 пациентов (12%). Средняя продолжительность оперативного вмешательства составила 88,8 минуты. Ни в одном из клинических наблюдений в периоперационном периоде не отмечалось развитие таких осложнений как кровотечение или перфорация. Интраоперационное развитие карбоксиперитонеума, на фоне инсуффляции CO2, потребовавшее декомпрессии брюшной полости с помощью иглы Вереша было отмечено у 2 пациентов. Во всех клинических наблюдениях, на следующие сутки после оперативного вмешательства, выполнялось контрольное рентгенологическое исследование с целью исключения осложнений. Среди сопутствующих хронических заболеваний у пациентов преобладали артериальная гипертензия и сахарный диабет, по поводу которых пациенты получали терапию, назначенную профильными специалистами. Ни в одном из клинических наблюдений не было отмечено развитие осложнений, связанных с общесоматическим статусом или хроническими заболеваниями пациентов. При этом, среднее число койко-дней в стационаре составило 2,91. Послеоперационный контроль проводился через 3, 6 и 12 месяцев после операции. Во всех клинических наблюдениях в послеоперационном периоде было отмечено снижение или полное отсутствие характерных для ахалазии кардии симптомов, что подтверждалось снижением количества баллов по шкале Эккардта ≤3. У одного пациента через 11 месяцев после проведенного оперативного лечения отмечался возврат ранее присутствующих симптомов. ПОЭМ была выполнена повторно. На протяжении 6 месяцев не отмечается рецидива заболевания у данного пациента. Продолжается динамическое наблюдение. У одного пациента в послеоперационном периоде отмечались проявления гастроэзофагеального рефлюкса, которые были устранены после назначения препарата группы ИПП. Выводы При лечении ахалазии кардии у пациентов пожилого и старческого возраста ПОЭМ может рассматриваться в качестве предпочтительной методики. Особенностью пациентов данной возрастной группы является более длительное персистирование заболевания, а также физиологические особенности, которые могут иметь весомое значение при осложненном течении послеоперационного периода. Наравне с этим, при лечении пациентов старше 65 лет, целью является выполнение одноэтапного лечения, не требующее повторных манипуляций. Среди различных методик лечения ахалазии кардии, именно ПОЭМ, соответствует всем этим факторам. ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ ПАЦИЕНТОВ С ПИЩЕВОДОМ БАРРЕТА С ДИСПЛАЗИЕЙ С ИСПОЛЬЗОВАНИЕМ МЕТОДИКИ ГИБРИДНОЙ АРГОНОПЛАЗМЕННОЙ КОАГУЛЯЦИИ HYBRID-APC Кашин С. В., Видяева Н. С., Куваев Р. О., Крайнова Е. А. ФГБОУ ВО РНИМУ им. Н. И. Пирогова, Москва ГБУЗ «Ярославская областная клиническая онкологическая больница», ФГБОУ ВО ЯГМУ Минздрава России, Ярославль г. Москва, Ярославль Цель исследования Целью настоящего исследования было оценить безопасность, эффективность и отдаленные результаты лечения пациентов с пищеводом Баррета (ПБ) с дисплазией с использованием методики гибридной аргоноплазменной коагуляции (Hybrid-APC). Методы Диагностические и лечебные процедуры выполнялись в эндоскопическом отделении Ярославской областной клинической онкологической больницы. Всем пациентам, с подозрением на ПБ выполнялся осмотр с использованием эндоскопов высокого разрешения, применением хромоскопии и оптического увеличения. Протяженность сегмента метаплазии оценивалась в соответствии с Пражскими критериями. Биопсия выполнялась по Сиэтлскому протоколу, наличие и степень дисплазии оценивались двумя морфологами, один из которых является экспертом в диагностике ПБ. При наличии видимого патологического участка в сегменте ПБ с дисплазией выполнялась его резекция. При отсутствии видимого патологического участка в сегменте ПБ с дисплазией, а также после эндоскопической резекции, выполнялась эрадикация всего сегмента цилиндроклеточной метаплазии методикой Hybrid-APC. Hybrid-APC – технология, которая комбинирует подслизистую инъекцию физиологического раствора для формирования защитной гидроподушки в подслизистом слое с помощью водоструйной системы со стандартной арго- ноплазменной коагуляцией в одном инструменте. Процедура абляции выполнялась в 5 этапов: 1) маркировка зоны планируемой абляции, 2) инъекция в подслизистый слой физиологического р-ра с индигокармином с помощью подачи водной струи под высоким давлением (ERBEJET 2, Erbe Elektromedizin, Tuebingen, Germany), 3) 1ая абляция слизистой (режим PULSED APC, эффект 2, 60 Вт), 4) удаление коагуляционного струпа с помощью фиксированного на дистальном конце эндоскопа прозрачного пластикового колпачка; 5) 2ая абляция слизистой с использованием меньшей мощности (режим PULSED APC, эффект 2, 40Вт). В послеоперационном периоде все пациенты получали ИПП в высоких дозах для подавления кислотности и обеспечения оптимальных условий для заживления зоны абляции плоским эпителием. После полной эрадикации ПБ через 3, 6, 12 месяцев и затем ежегодно выполнялась контрольная ЭГДС с тщательным осмотром дистального отдела пищевода и области пищеводно-желудочного соединения в белом свете и узкоспектральном режиме с увеличением для выявления очагов рецидива кишечной метаплазии и дисплазии, а также четырехквадрантная биопсия области нового плоского эпителия, сформированного в зоне абляции. Биопсийный материал оценивал патоморфолог, специализирующимся в диагностике ПБ. Результаты Эндоскопическая абляция ПБ с использованием технологии Hybrid-APC была выполнена 11 пациентам с ПБ и дисплазией низкой и высокой степени (5 мужчин и 6 женщин) с июля 2014 г. по сентябрь 2017 г.. На момент лечения средний возраст пациентов составил 46 лет (от 25 до 63 лет). Среди пациентов 5 имели короткий сегмент ПБ, 7 пациентов – длинный сегмент ПБ, средняя протяженность сегмента метаплазии составила C1 M2. Всего этим пациентам было выполнено 5 эндоскопических резекций патологических участков и 18 сеансов абляций. Средняя продолжительность сеанса абляции составила 15мин (6-26мин). Полная эрадикация ПБ была достигнута в среднем за 1,6 сессий (от 1 до 3 сессий). Во время операций осложнений не возникло. В раннем послеоперационном периоде 5 пациентов (45,5%) отмечали незначительные нежелательные явления в виде тошноты, умеренного болевого синдрома. В позднем послеоперационном периоде возникло 1 осложнение (9,1%) – стеноз пищевода в зоне резекции, выявленный через 3 месяца после выполнения резекции и абляции в рамках одной сессии. Этой пациентке был выполнен 1 сеанс баллонной дилятации с положительным эффектом, полным регрессом симптомов дисфагии. Наблюдение пациентов осуществлялось в течение 4,9 лет (от 41 до 77 месяцев) после полной эрадикации сегмента ПБ. Ни у кого из пациентов не было выявлено признаков рецидива кишечной метаплазии и дисплазии при эндоскопическом осмотре. Было выполнено 274 биопсий из нового плоского эпителия в зоне абляции, 36 биоптатов (13,1%) содержали собственную пластинку слизистой. При морфологической оценке ни в одном из биоптатов не было выявлено признаков «захороненной» кишечной метаплазии и дисплазии. Выводы В соответствии с данными этого исследования, HybridAPC является эффективным и безопасным методом лечения ПБ с дисплазией. Во время операций и в послеоперационном периоде не было зафиксировано серьезных нежелательных явлений. В течение 5-летнего наблюдения пациентов после лечения не было выявлено эндоскопических признаков рецидива ПБ, а также морфологических признаков «захороненной» кишечной метаплазии и дисплазии. Технология Hybrid-APC является оператор-зависимой, поэтому для получения хороших отдаленных результатов ее применения, необходимо предварительное обучение специалистов и соблюдение основных этапов выполнения этой манипуляции. СТРИКТУРА ПИЩЕВОДА КАК ОСЛОЖНЕНИЕ ТЕЧЕНИЯ КРАСНОГО ПЛОСКОГО ЛИШАЯ Лучинина Д. В.1, Оглоблин А. Л.2, Королёв М. П.2, Федотов Л. Е.2, Киладзе К. П.1 1 СПБ ГБУЗ «Городская Мариинская больница»; 2 Федеральное государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России. г. Санкт-Петербург Введение Красный плоский лишай (КПЛ) – хроническое воспалительное заболевание кожи и слизистых оболочек, реже поражающее ногти и волосы, типичными элементами которого являются папулы [1]. Заболевание является мультифакторным, иммуноопосредованным и характеризуется хроническим рецидивирующим течением, полиморфизмом клинических проявлений, а так же возможностью опухолевой трансформации и торпидностью к проводимой традиционной медикаментозной терапии [2]. Распространенность болезни – 0,5-4% от общей численности населения, а у 60-75% характеризуется изолированным поражением слизистой оболочки полости рта [3]. Для КПЛ характерно поражение слизистых оболочек и других органов: половых, заднего прохода, конъюнктивы, желудка, уретры, пищевода, а их частота варьирует от 20 до 25% [4]. Чаще страдают женщины в возрасте 40-60 лет [5]. Этиология заболевания остаётся неизвестной. Цель исследования Поделиться опытом лечения больных с редко встречающейся стриктурой пищевода, вызванной красным плоским лишаем. Материалы и методы С 2011 по 2021 год в СПб ГБУЗ «Городская Мариинская больница», на базе кафедры общей хирургии с курсом эндоскопии ФГБОУ ВО СПБ ГПМУ находилось на лечении 17 больных в возрасте от 50 до 72 лет в ходе сбора анамнеза и обследования которых была диагностирована стриктура пищевода, этиологическим фактором которой являлся красный плоский лишай. В нашем исследование отмечено, что наиболее часто данной патологией болели женщины пожилой возрастной группы (по классификация ВОЗ) – 84% (χ2 = 8,62, p < 0,05), средний возраст составил 61,7 ± 6,3 года. Пациенты имели длительный анамнез заболевания – 15,4 ± 4,5 лет, находились на амбулаторном лечении у дерматолога / оториноларинголога поликлиники по месту жительства. Поражение слизистой оболочки полости рта встречалось у 76% больных, что расценивалось как активная стадия течения болезни Рис. 1). В 3 (18%) случаев имелась типичная форма поражения кожи, сопровождающаяся зудом. Для всех больных, включенных в исследование, основной жалобой была дисфагия, степень выраженности которой составляла от 1 до 3 баллов по шкале S. Bown (1987 г.). 12 (76%) больных испытывали боль при глотании, вероятной причиной которой, являлось эрозивно-язвенное поражение слизистой оболочки ротоглотки; одинофагия отмечалась у 5 (29%); регургитация у 3 (18%); снижение массы тела – у 4 (23%) больных; следует отметить, что жалобы на регургитацию и снижение массы тела имели больные с длительно существующей стриктурой пищевода, которая сопровождалась дисфагией 3 балла. Результаты исследования Рентгеноскопия пищевода с двойным контрастированием достоверно позволила установить, что стриктура пищевода у исследуемой группы больных образовывалась в проксимальном его отделе: у 10 (58%) – локализовалась в шейном отделе (Рис. 2), а у 7 (42%) – в верхнем грудном; протяжённость стриктуры составляла 1,8 ± 0,6 см. ЭГДС с режимами ZOOM и NBI позволяли детально осмотреть изменённые участки стенки пищевода, исключить патологию желудка и двенадцатиперстной кишки. Поверхностные эрозии, изъязвления и псевдомембранозные налеты на стенке пищевода диагностированы у 12 (76%) больных, так же имевших поражение слизистой полости рта, а у 69% из них нами отмечено наличие множественных папул на слизистой оболочке белесоватого цвета (Рис. 3). У 5 (24%) слизистая оболочка пищевода была не изменена. Саму стриктуры осматривали гастроскопом Olympus GIF-XP160, который позволял визуализировать и осмотреть её на всем протяжении, оценить стенку, исключить малигнизацию в стриктуре, произвести биопсию. Особенностью являлось легкое отслоение слизистой оболочки, после чего оставалась рыхлая, легко кровоточащая при контакте воспаленная поверхность стенки пищевода. Обязательным условием являлось взятие биопсии из проксимального отдела пищевода. При наличии воспалительных изменений слизистой оболочки биопсию брали из данных участков, у 24% больных с неизменённой слизистой оболочкой взятие биоптатов производили из 7-10 участков на разной протяжённости шейного и грудного отделов пищевода. Первичная биопсия позволяла диагностировать специфические для заболевания признаки у 70% больных. Для патоморфологической картины которых был характерен: плоский эпителий, множественные лимфоцитарные инфильтраты и рассеянные апоптотические кератиноциты, тельца Сиватта (Рис. 4). 30% больным для верификации диагноза требовалась повторная биопсия, которую на наш взгляд следует производить через 10-14 дней после бужирования стриктуры. Основным методом хирургического лечения считаем эндоскопическое бужирование стриктуры, от 1 до 3 сеансов которого выполнено 17 (100%) больным. Для патогенетического системного воздействия на активность течения КПЛ использовали следующие медикаментозные препараты: «Преднизон» от 5 до 30 мг/сутки в зависимости от степени тяжести заболевания, «Азатиоприн» 50 мг/ сутки. Так же применяли алюминий содержащие антациды, действие которых связано с цитопротективным эффектом, заключающемся в их способности создавать защитную пленку на поверхности повреждённой слизистой оболочки пищевода, стимуляции синтеза простагландинов, которые, в свою очередь, улучшают микроциркуляцию сосудистого русла и повышают регенераторную функцию слизистой оболочки пищевода. Оценка эффективности и результатов лечения производилась на 14 день после последнего сеанса дилатации, спустя 1 год и через 3 года. Через две недели у 17 (100%) больных дисфагия полностью регрессировала, восстановление просвета органа отмечалось и при рентгенологическом исследовании пищевода с «водорастворимым» контрастом. Отличительной особенностью заболевания являлось возникновение свежих эрозий и язв в пищеводе после бужирования в местах механической травматизации стенки за счёт воздействия бужа на суженный участок органа даже у тех больных, которые при первичной ЭГДС не имели воспалительных изменений слизистой оболочки пищевода. Данное наблюдение схоже с симптомом Кебнера, который отмечается при кожном проявлении заболевания. Данный факт может свидетельствовать, что бужирование вызывает обострение КПЛ. Спустя 1 год контрольный осмотр проведён 15 (88%) больным. Дискомфорт при приёме твердой пищи ис- пытывали 11 (73%) пациентов, диаметр стриктуры пищевода был равен 0,9 ± 0,1 см, показаний к бужированию у данной группы больных не выявлено. У 4 (27%) имелась клиника дисфагии 2-3 балла, сопровождающаяся одинофагией, диаметр стриктуры составлял 0,4 ± 0,2 см, что говорило о рецидиве стриктуры. Данной группе была произведена повторная дилатация сужения и скорректирована дозировка медикаментозных препаратов. Рецидив стриктуры отмечался у категории больных, самостоятельно отказавшихся без указания врача от приёма препаратов в разные сроки после выписки, что может свидетельствовать о тяжелом и сложно контролируемом течении болезни. Через три года результат лечения удалось оценить у 13 (76%) больных. Рецидив стриктуры, сопровождающейся клиникой дисфагии более одного балла и, потребовавший повторного бужирования, диагностирован у 5 (38%) больных. Выводы Лечение стриктуры пищевода, вызванной поражением органа красным плоским лишаем, должно включать в себя поэтапное бужирование стриктуры и медикаментозную терапию, которая назначается в максимальных дозировках в период проведения сеансов дилатации и обострения, а в дальнейшем постепенно снижается и остается в минимальной поддерживающей дозе в течение длительного времени. Правильная диагностика этиологии редко встречающихся стриктур позволяет выбрать наиболее оптимальный метод лечения, добиться наилучших результатов лечения и снизить частоту рецидивов стриктур, тем самым улучшить качество жизни больных. Литература 1. Олисова О. Ю., Чикин В. В., Минеева А. А. Федеральные клинические рекомендации по ведению больных красным плоским лишаем // Российское общество дерматовенерологов и косметологов. 2015. С. 6-16. 2. Белева Н. С. Совершенствование диагностики и комплексного лечения в системе диспансеризации больных красным плоским лишаем слизистой оболочки полости рта: Автореф. дис. канд. мед. наук: 14.01.14 / Белева Наталья Сергеевна. ‒ Пермь, 2010. ‒ 25 с. 3. Miller C. S., Epstein J. B., Hall E. H., Sirois D. Changing oral care needs in the United States: the continuing need for oral medicine. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2001. vol. 91. P. 34-44. 4. Eisen D. The evaluation of cutaneous, genital, scalp, nail, esophageal, and ocular involvement in patients with oral lichen planus. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1999. vol. 88. P. 431-6. doi:10.1016/s1079-2104(99)70057-0. 5. Rao B., Gulati1 A., Jobe B., Thakkar S. Esophageal Lichen Planus: Understanding a Potentially Severe Stricturing Disease. Case Reports in Gastrointestinal Medicine. 2017. vol. 2017. article ID: 5480562. P. 4. ЭНДОСКОПИЧЕСКАЯ ПЕРОРАЛЬНАЯ МИОТОМИЯ ПЕРВЫЙ ОПЫТ Мерзляков М. В., Попова М. А., Джабашев Р. А., Ооржак О. В., Хапаева Т. Н. ГАУЗ Кемеровская областная клиническая больница им. С. В. Беляева г. Кемерово Актуальность У пациента с аномалиями развития: расщелиной мягкого и твёрдого нёба, транспозицией внутренних органов не удалось выполнить миотомию до конца. Причиной неудачи стал выраженный фиброз подслизистого слоя, при формировании тоннеля подслизистый слой четко не визуализировался, плотно сращен с мышечным слоем, что привело к ошибочному формированию тоннеля сквозь мышцу в области кардии. Также выраженная васкуляризация в области фиброза привела к развитию частых кровотечений, значимо усложняющих визуализацию. Тоннель завершен в сальниковой сумке. При попытке иссечь мышцу от слизистой и вер- Ахалазия пищевода (АП) – редкое заболевание, с распространенностью 10 случаев на 100000 населения, характеризуется отсутствием адекватного расслабления нижнего пищеводного сфинктера и двигательной тонической активностью гладкой мускулатуры пищевода. Различные авторы выделяют два пика заболеваемости: 30-40 лет, второй пик – старше 60 лет, причем сообщается, что у лиц старше 75 лет ахалазия встречается в 4 раза чаще, чем в первой возрастной группе. Основные клинические проявления заболевания – прогрессирующая дисфагия, дискомфорт за грудиной, регургитация. Пероральная эндоскопическая миотомия (ПОЭМ) на сегодняшний день признана наиболее эффективным и безопасным методом лечения АП. Материалы и методы В 2020 году в клинике хирургии ГАУЗ КОКБ пероральная эндоскопическая миотомия выполнена 12 пациентам, 11 взрослых и 1 мальчик 12 лет. Из них: 8 мужчин, 4 женщины, возраст пациентов от 41 до 69 лет, средний возраст 55,1 год. Диагноз АП выставлялся на основании эндоскопического исследования и рентген контрастного исследования пищевода. ПОЭМ выполнялась в стандартной технике: по задней стенке пищевода, уровень инициального разреза и миотомии определялся исходя из наличия колец гиперперистальтики. Для создания тоннеля применялся раствор гелофузина подкрашенный индигокармином, вводимый в подслизистой слой посредством гибридного ножа. В области кардии выполнялась полнослойная миотомия, проксимальнее– пересекался только циркулярный слой мышц. Результаты ПОЭМ эффективна у 10 пациентов, одному пациенту потребовалось хирургическое вмешательство. Летальных исходов не было. нуться в верную траекторию тоннеля, возникло кровотечение, в исходе коагуляции которого был поврежден слизистый слой. Операция прекращена. В отсроченном периоде наложена лапароскопическая гастростома. В плане лапароскопическая эзофагокардиомиотомия по Геллеру. У одного из пациентов после проведения миотомии до уровня 48,0 см от резцов (истончения мышечного слоя желудка до 0.2 см) сохранилась клиническая картина ахалазии, при контрольной рентгеноскопии контраст задерживается в просвете пищевода, мелкими порциям поступает в желудок, (рентгенологически абдоминальная часть пищевода более 7 см), (рис 1). Больному выполнена лапароскопическая эзофагокардиомиотомия по Геллеру с фундопликацией по Тoupet – рассечены 4 см сохраненного мышечного слоя. У пациента 12 лет с бронхиальной астмой, килевидной деформацией грудной клетки, ахалазией пищевода, выполнен инициальный разрез от 33.0 см, миотомия до уровня 46.0 см и визуального истончения мышечного слоя желудка до 0.2 см. В отсроченном периоде сохранялась клиника дисфагии. В условиях Университета Павлова г. Санкт Петербург выполнена манометрия пищевода, выявлены оставшиеся циркулярные мышечные волокна пищевода, по противоположной стенке выполнена миотомия. Клинически – выздоровление. Кровотечения, затрудняющие работу развились у трех пациентов, у двоих кровотечение при формирования тоннеля и миотомии, у одного пациента – при инициальном разрезе. Гемодинамически значимых кровотечений не было. Повреждения слизистого слоя было у 2х пациентов, в одном случае потребовалось клипирование дефекта, на отсроченных рентгенологических исследованиях затеков контрастного вещества не было. Подкожная эмфизема в области шеи у 1 пациента разрешилась без дополнительных вмешательств через 4 часа. 1 случай не напряженного карбоксиперитонеума у 1 пациента, была выполнена пункция брюшной полости иглой Вериша. У одного пациента развился ГЭРБ. В послеоперационном периоде больные находились на парентеральном питании. На 3 сутки проводилось рентгенологическое исследование пищевода, затеков контрастного вещества обнаружено не было (рис 2), после пациентам разрешалось пить, на 5-6 сутки разрешен щадящий стол. Средняя продолжительность госпитализации 11 дней. Выводы • ПОЭМ – эффективный метод лечения пациентов с ахалазией пищевода. • Операции не сопровождалась серьёзными осложнениями. • Наибольшую сложность при выполнении ПОЭМ стал выраженный фиброз подслизистого слоя и кровоточивость тканей в области фиброза. • При проведении манометрии пищевода вероятность неполноценной миотомии и неудачной миотомии сводятся к минимуму • Быстрая реабилитация пациентов. • Для более детального анализа необходимо наблюдения большого количества случаев. Литература 1. Inoue H, Shiwaku H, Iwakiri K, Onimaru M, Kobayashi Y, Minami H, Sato H, Kitano S, Iwakiri R, Omura N, Murakami K, Fukami N, Fujimoto K, Tajiri H. Clinical practice guidelines for peroral endoscopic myotomy. Dig Endosc. 2018 Sep;30(5):563-579. doi: 10.1111/den.13239. PMID: 30022514. 2. Shiwaku H, Inoue H, Sato H, Onimaru M, Minami H, Tanaka S, Sato C, Ogawa R, Okushima N, Yokomichi H. Peroral endoscopic myotomy for achalasia: a prospective multicenter study in Japan. Gastrointest Endosc. 2020 May;91(5):1037-1044.e2. doi: 10.1016/j.gie.2019.11.020. Epub 2019 Nov 21. PMID: 31759035. 3. Ивашкин В. Т., Трухманов А. С., Годжелло Э. А., Маев И. В., Евсютина Ю. В., Лапина Т. Л., Сторонова О. А. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению ахалазии кардии и кардиоспазма. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2016;26(4):36-54. doi:10.22416/1382-4376-2016-26-4-36-54 4. Смирнов А. А., Любченко М. Е., Кирильцева М. М., Дворецкий С. Ю., Романихина Д. И., Семенихин А. И., Бураков А. Н., Кайбышева В. О., Багненко С. Ф. Осложнения пероральной эндоскопической миотомии. Трехлетний опыт одного центра ЭиКГ. 2018. № 10 (158). DOI:10.31146/1682-8658-ecg-158-10-57-61 5. Шишин К. В., Недолужко И. Ю., Янова О. Б., Эмбутинекс Ю. В., Васнев О. С., Казакова С. С., Павлова И. А., Шумакина Л. В., Курушкина Н. А. Современные подходы к диагностике и лечению ахалахии кардии. Пероральная эндоскопическая миотомия. Методические рекомендации. Москва 2019. 39с. РЕЗУЛЬТАТЫ ЭНДОСКОПИЧЕСКОГО ЛЕЧЕНИЯ ПАЦИЕНТОВ С ДИВЕРТИКУЛОМ ЦЕНКЕРА В ОДНОМ ЦЕНТРЕ Павлов И. А., Шишин К. В., Недолужко И. Ю., Шумкина Л. В. ГБУЗ Московский клинический научный центр им. А. С. Логинова ДЗМ г. Москва Актуальность Эндоскопические методики в настоящее время имеют приоритет в лечении пациентов с дивертикулом Ценкера (ДЦ). Тем не менее стандартное эндоскопическое лечение сопровождается большим числом рецидивов заболевания и достигает 20%. Тоннельная методика позволяет выполнить необходимый объем миотомии вне зависимости от размера дивертикула, однако, недостатком тоннельной операции является сохранение остаточной полости дивертикула, которая определяет потенциальный риск развития рецидива при дивертикуле большого размера. В связи с этим нами была разработана комбинированная методика, которая сочетает все преимущества стандартной и тоннельной операции. Цель Оценить эффективность эндоскопических методик лечения пациентов с ДЦ. Материал и методы В период с июля 2014 года по апрель 2021 года эндоскопические операции по поводу ДЦ были выполнены у 187 пациентов. Средний размер дивертикула составил 2,8 см (от 0,5 до 7 см). По стандартной методике оперировано 34 пациента. По тоннельной методике оперировано 39 пациентов. Среднее время оперативного вмешательство в двух группах составило 40 минут. По комбинированной методике оперировано 114 пациентов. Среднее время оперативного вмешательства составило 35 минут. При выполнении тоннельных методик крикофарингомиото- мия дополнялась верхнепищеводной миотомией на протяжении 3-7 см в зависимости от размеров дивертикула. Pезультаты Всем пациентам выполнялось ЭГДС через 3 и 12 месяцев после операции с последующим ежегодным эндоскопическим контролем. При наличии жалоб дополнительно выполнялось рентгенологическое исследование. За весь период наблюдения у 4 (11,8%) пациентов, оперированных по стандартной методике в послеоперационном периоде, был выявлен рецидив клинических проявлений заболевания, что потребовало в общей сложности проведения 7 (17,1%) повторных операций. После тоннельных операций ни в одном наблюдении не было выявлено рецидива клинических проявлений заболевания. Всем пациентам на следующие сутки проводилось контрольное рентгенологическое исследование. У двух пациентов, оперированных по комбинированной методике, был выявлен параэзофагеальный затек. Одному пациенту было выполнено вскрытие и дренирование параэзофагеального затека. Проводилась антибактериальная терапия, зондовое питание. На 17 сутки после операции пациент был выписан в удовлетворительном состоянии. Второму пациенту проводилась консервативная терапия. Выписан был на 5 сутки после оперативного вмешательства. Выводы Исследование показало высокую эффективность тоннельных вмешательств в лечении ДЦ и могут быть применены при любом размере дивертикула. ЭПИДЕРМОИДНАЯ МЕТАПЛАЗИЯ СЛИЗИСТОЙ ПИЩЕВОДА КЛИНИЧЕСКИЙ СЛУЧАЙ Хихлова А. О., Олевская Е. Р., Шафеев Е. В. ГБУЗ Челябинская областная клиническая больница г. Челябинск Эпидермоидная метаплазия пищевода является достаточно редкой эндоскопической находкой у пациентов среднего и пожилого возраста, преимущественно женского пола. Впервые случай эпидермоидной метаплазии был описан Y. Nakanishi и соавт. в 1997 году [1]. Эндоскопическая картина эпидермоидной метаплазии представлена белесыми плоскоприподнятыми очагами различных размеров, поверхность которых имеет вид «булыжной мостовой», чаще локализованных в средней и нижней трети пищевода. В 2011 г. Y. Ezoe описал четыре характерных эндоскопических критерия: белесые плоскоприподнятые очаги в пищеводе, с четкими границами, с шероховатой неровной поверхностью, неокрашиваемые раствором Люголя [2]. С учетом макроскопических характеристик эпидермоидную метаплазию дифференцируют с кандидозом пищевода, гликогенным акантозом, отслаивающимся эзофагитом, плоскоклеточной папилломой [3]. Этиология остается неизвестной, но большинство авторов среди вероятных предикторов отмечают длительное употребление алкоголя, курение и хронический рефлюкс. Описаны случаи эпидермоидной метаплазии у пациентов с ахалазией кардии, склеродермией и плоским лишаем слизистой оболочки полости рта и пищевода. Частыми клиническими проявлениями являются дисфагия, одинофагия и симптомы гастроэзофагеального рефлюкса. Наряду с термином «эпидермоидная метаплазия» для описания данного состояния в пищеводе используют взаимозаменяемые «лейкоплакия», «гиперкератоз» [3]. Однако для эпидермоидной метаплазии характерна специфическая гистологическая картина наличия выраженного зернистого слоя и расположенного над ним компактного гиперортокератозного слоя эпителия, в то время как при лейкоплакии наблюдается выраженный акантоз плоского эпителия с гиперкератозом и паракератозом. Важность диагностики и наблюдения эпидермоидной метаплазии пищевода связана с ее высоким предраковым потенциалом. Выявление мутации ТР53 в биоптатах эпидермоидной метаплазии было статистически связано с метахронной и синхронной плоскоклеточной карциномой пищевода и служит биомаркером раннего выявления неоплазии у пациентов [4]. Фотодинамическая терапия, радиочастотная аблация могут использоваться как профилактические методы лечения. У пациентов с выявленной карциномой на фоне эпидермоидной метаплазии описан случай эндоскопической резекции слизистой пищевода [2]. Клинический случай Пациент 53 лет в августе 2020 года обратился на прием к гастрохирургу с жалобами на дисфагию, направлен на проведение эзофагогастродуоденоскопии (ЭГДС). Из анамнеза известно, 20 лет назад перенес химический ожог ротоглотки и пищевода кислотой. С тех пор периодически беспокоят симптомы дисфагии, купируемые сеансами эндоскопического бужирования. Последний курс эндоскопического бужирования проводился 6 лет назад. В 2000 г. выполнена лапаротомия, ушивание раны печени по поводу проникающего колото-резаного ранения брюшной полости. В 2019 г. перенес инфаркт миокарда. Пациент отмечает злоупотребеление алкоголем в течение многих лет, курение (индекс курения 19 пачка/лет). Сопутствующие заболевания, прием лекарственных препаратов отрицает. На ЭГДС в ротоглотке выявлены рубцовые изменения слизистой, в средней трети пищевода по всем стенкам визуализированы плоскоприподнятые белесые очаги гиперкератоза слизистой, с четкими границами, с шероховатой поверхностью вида «булыжной мостовой» протяженностью до 10 см, окружающая слизистая не изменена (Рис. 1-3). В нижней трети пищевода на расстоянии 38 см от резцов выявлено циркулярное рубцовое сужение с диаметром просвета до 0,8см (Рис. 4, 5). По результатам гистологического исследования обнаружена эпидермоидная метаплазия пищевода с гиперкератозом поверхностного слоя эпителия и выраженным слоем зернистых клеток, без явлений дисплазии. По данным рентгеноскопии пищевода и желудка с барием выявлен субкомпенсированный стеноз средней трети пищевода. Пациенту выполнен курс эндоскопического бужирования с положительным эффектом в сентябре 2020 г., сеанс поддерживающего бужирования в октябре 2020г, назначена терапия ингибиторами протонной помпы(Рис. 6). Симптомы дисфагии полностью купированы. Эндоскопическая картина эпидермоидной метаплазии на фоне проведенного лечения с положительной динамикой в виде уменьшения толщины и выраженности очагов (Рис. 7). От радиочастотной аблации очагов эпидермоидной метаплазии пищевода пациент воздержался. Рекомендовано эндоскопическое наблюдение. Заключение Эпидермоидная метаплазия пищевода является редкой эндоскопической находкой и ассоциирована с высоким риском плоскоклеточной карциномы пищевода. Знание клинических проявлений, эпидемиологических данных, эндоскопической и гистологической картины является ключевым в постановке правильного диагноза и выборе тактики наблюдения данных пациентов. На сегодняшний день требует пристального внимания клиницистов и дальнейшего изучения для разработки рекомендаций по ведению пациентов. Литература 1. A. D. Singhi, C. A. Arnold, C. D. Crowder, D. M. Lam-Himlin, L. Voltaggio, E. A. Montgomery. Esophageal leukoplakia or epidermoid metaplasia: a clinicopathological study of 18 patients. Mod Pathol. 2014;27(1):38-43. doi: 10.1038/modpathol.2013.100. 2. S. Yamanouchi, Y. Sako, S. Suemitsu, K. Tsukano, S. Kotani. Early esophageal cancer with epidermization diagnosed and treated with endoscopic resection. Clin J Gastroenterol. 2018;11(1):29-33. doi: 10.1007/s12328-017-0792-6. 3. M. E. Johncilla, A. Srivastava. Esophagitis unrelated to reflux disease: current status and emerging diagnostic challenges. Virchows Arch. 2018;472(1):29-41. doi: 10.1007/s00428-017-2238-4. 4. A. D. Singhi, C. A. Arnold, D. M. Lam-Himlin, M. N. Nikiforova, L. Voltaggio, M. I. Canto, K.M. McGrath, E. A. Montgomery. Targeted next-generation sequencing supports epidermoid metaplasia of the esophagus as a precursor to esophageal squamous neoplasia. Mod Pathol. 2017;30(11):1613-1621. doi: 10.1038/modpathol.2017.73. ОСЛОЖНЕНИЯ ПИЩЕВОДА У ТУБЕРКУЛЕЗНЫХ БОЛЬНЫХ, АССОЦИИРОВАННЫХ С ВИЧ ИНФЕКЦИЕЙ Цыганков В. К., Якушенко Н. С., Григорьева В. С. Городская туберкулезная больница № 2 г. Санкт-Петербург Наличие первичного иммунодефицита (ВИЧ инфекция) в социуме фтизиатрических больных представляет большой клинический интерес современной медицины. Изучение этой категории больных является актуальной проблемой фтизиатрии и спидологии. Прогрессивно увеличивающееся количество инфицированных больных ВИЧ инфекцией увеличивает число осложнений со стороны других органов и систем, в частности верхних отделов отделов желудочно-кишечного тракта (ЖКТ). Несмотря на некоторую относительную стабилизацию инфекционной заболеваемости туберкулезом в России, количество больных ВИЧ инфекцией неуклонно растет и не имеет тенденции к ее снижению. 6000 человек в мире ежедневно заражаются ВИЧ-инфекцией. За 10 лет количество ВИЧ инфицированных в России увеличилось в 3 раза. Число смертельных случаев возросло в 13 раз. Актуальность заключается в определении частоты возникновения осложнений СО пищевода у туберкулезных больных, ассоциированных ВИЧ инфекцией и определении тактики лечения. Материалы и методы исследования Проведен про – и ретроспективный анализ 1280 пациентов, находившихся в больнице на лечении с различными формами легочного туберкулеза, включая генерализованный, ассоциированных ВИЧ инфекцией с в период 2014-2018 гг. Возраст пациентов составил 47 ± 8,5 лет. Исследование верхних отделов ЖКТ видеоэзофагогастродуоденоскопия (ВЭГДС) проводили видеогастроскопом фирмы «Pentax» (Япония), микропроцессор I-7000 в трех режимах I – scan. Остановка кровотечения проводилась клипированием источника с помощью клипс фирмы «Olympus» и EndoStar. Электрокоагуляцию выполняли на электрохирургическом комплексе ERBA (Германия). Хирургическое вмешательство при кровотечении проводили при безуспешности эндоскопического и системного гемостаза. Состояние слизистой оболочки верифицировали гистологическими методами исследования. Результаты исследования и обсуждение Эндоскопическое исследование пищевода является обьективным критерием состояния слизистой оболочки, оценки возникших образований и характера процесса. При этом все визуальные данные при эндоскопическом исследовании подтверждены результатами гистологического исследования. Частота и нозологические формы изменений изменений СО пищевода отражена в Табл. 1. Из данных таблицы следует, что большая часть пациентов изменений СО пищевода приходится на кандидозное поражение СО (63%), проявляющееся диффузными или ограниченными плоскими бляшками с признаками воспаления или изьязвления, а также эрозивно-язвенные поражения (17%) и синдром Mallory-Weiss (10%). В 10% случаев встречалось варикозное расширение вен пищевода, обусловленное начальными проявлениями цирроза печени, в силу наличия существующего хронического гепатита С и в 3% случаев пищеводно-трахеальные свищи. Они обусловлены генерализацией туберкулезного процесса вследствие развития грудной лимфаденопатии. В 3 случаях они осложнились развитием тяжелого медиастинита с летальным исходом. На фоне существующего нарушения коагуляционных свойств крови у этой категории пациентов возникают кровотечения из эрозивно-язвенных дефектов СО пищевода и при синдроме Mallory-Weisss, характеризующихся упорным течением, плохо поддающейся коррекции эндоскопического и системного гемостаза. Летальность в этих случаях не превышала 30%. Необходимо отметить. что осложнения СО пищевода у туберкулезных больных, ассоциированных с ВИЧ инфекцией, протекают значительно благоприятнее по сравнении с другими локализациями процесса в ЖКТ. Вывод Осложнения СО пищевода у туберкулезных больных, ассоциированных ВИЧ инфекцией, значительно отличаются по исходу и смертности по сравнении с другими локализациями ЖКТ. Исключение составляют пациенты с трахео-бронхиальнми свищами в следствие развития тяжелого необратимого медиастинита. При эрозивно-язвенных кровотечениях и варикозно расширенных вен летальность составляет 30% в терминальной стадии заболевания. Требуется дальнейшее более глубокое изучение этой проблемы. Табл. 1 Нозологическая форма Количество больных, n Частота,% Кандидозный эзофагит 687 63 Пищеводно-трахеальные свищи 12 3 Эрозивно-язвенные поражения 112 17 Варикозное расширение вен 34 7 Синдром Mallory-Weiss 86 10 РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ВНУТРИПРОСВЕТНЫХ ЭНДОСКОПИЧЕСКИХ МЕТОДОВ В ЛЕЧЕНИИ СУБЭПИТЕЛИАЛЬНЫХ ОБРАЗОВАНИЯХ ВЕРХНИХ ОТДЕЛОВ ПИЩЕВАРИТЕЛЬНОГО ТРАКТА ОПЫТ КЛИНИКИ Шаповальянц С.Г, Фёдоров Е. Д., Плахов Р. В., Будзинский С. А., Горбачев Е. В., Селезнев Д. Е. Российский Национальный Исследовательский Медицинский Университет им. Н. И. Пирогова Городская клиническая больница № 31 Медицинский реабилитационный центр Клиника+31 г. Москва г. Москва Введение Появление в современной клинической практике новых эффективных методик эндоскопического лечения пациентов с субэпителиальными образованиями (СубЭО) – эндоскопическая диссекция (ЭДПС) и тоннельные резецирующие операции (ТЭРО) – на первых этапах их применения порождало вопросы о возможности их использования и радикальности. В наибольшей степени это относится к гастроинтестинальным стромальным опухолям. Однако, с начала внедрения данных методик в практику привело к тому, что внутрипросветные методы, особенно тоннелирующие операции, находят все большее количество сторонников. Немаловажно и то, что ни ЭДПС, ни ТЭРО не препятствуют проведению в случае необходимости более радикального хирургического лечения и адъювантной лекарственной терапии. Показания и выбор метода удаления СубЭО, наряду с природой образования, определяются клиническим течением заболевания, расположением и характером роста. ЭДПС и ТЭРО все чаще применяют при «сложной» локализации, в частности при опухолях пищевода и кардии, исходящих из мышечного слоя, в точности с экстраорганным характером роста. Кроме того, применение эндоскопических операции диктуется стремлением к ранней реабилитации и обеспечению качества жизни пациентов. Цель исследования – оценка роли применения внутрипросветных эндоскопических методов лечения при субэпителиальных образованиях верхних отделов желудочно-кишечного тракта. Материал и методы исследования В период с 01.01.2003 по 01.01.2020 г. в клинике было прооперировано 186 пациентов с субэпителиальными образованиями верхних отделов желудочно-кишечного тракта (СубЭО ВО ЖКТ). У 95 (51,1%) пациентов удаление локализованных СубЭО было выполнено через гибкий эндоскоп. Остальные 91 (48,9%) пациент были оперированы трансабдоминально (лапароскопическим доступом – 42 (22,6%) из 186, в частности 12 с применением робототех- ники; путем лапаротомии – 49 (26,3%)). Группа из 95 пациентов, оперированных внутрипросветными эндоскопическими методами, состояла из 20 (21,1%) мужчин и 75 (78,9%) женщин в возрасте от 25 до 80 лет. Средний возраст (M±m) составил 58,3 ±11,3 лет. Всего у 95 пациентов было обнаружено и предпринято удаление 103 СубЭО: у 91 пациента было по одному СубЭО; у 3-х – по 2, средний размер составил 28,1 ± 2,4 мм. СубЭО располагались в пищеводе у 27 (28,4%) пациентов; в желудке – у 51 (53,7%); в ДПК – у 17 (17,9%). В относительно «сложных» для хирургического удаления зонах образования располагались у 51/95 (53,7%) пациента (устье и шейный отдел пищевода – 4; абдоминальный отдел пищевода – 16; кардиальный отдел – 3, задняя стенка тела желудка – 21, препилорический отдел желудка И ДПК – 17). В 96/103 (93,2%) случаев СубЭО росли преимущественно в просвет органа; в 3/103 (2,9%) – экстраорганно; в 5/103 (4,9%) наблюдался смешанный характер роста. Все пациенты были обследованы в предоперационном периоде проходили комплексное обследование с применением лучевых и стандартных эндоскопических методов исследования/ Одним из важнейших методов предоперационного обследования являлась эндосонография, выполненная у 76/95 (80,0%) больных: радиальное – у 53/76 (69,7%), зондовое – у 23/76 (30,3%) У 19 (20,0%) пациентов эндоУЗИ не выполняли, так как 4 из них были оперированы, как мы считали, по поводу эпителиальных образований, а у остальных 15 пациентов СубЭО имели небольшие размеры, полиповидную форму или сформированную псевдоножку, и при начальном внедрении методики в клинике мы не считали такой вариант роста показанием к эндоУЗИ. Ведущими показаниями к хирургическому лечению послужили: согласно шкале злокачественности подозрительные на злокачественные и пограничные образования у 7 больных; гипоэхогенные СубЭО размером от 20 до 50 мм у 43; увеличение СубЭО в размерах в процессе наблюдения у 15; клиническая симптоматика и осложненное течение заболевания – у 30. Удаление СубЭО ВОПТ через эндоскоп было предпринято тремя основными способами: внутрипросветная петлевая электроэксцизия (ВПЭ), эндоскопическая диссекция подслизистого слоя (ЭДПС), тоннельная эндоскопическая резекция опухоли (ТЭРО). Внутрипросветная петлевая электроэксцизия и ее модификации была выполнена у 52 больных, по поводу СубЭО пищевода (6 больных), желудка (30 больных) и ДПК (16 больных). Используя ВПЭ, удаляли СубЭО, исходящие из 2 и 3 эхослоев (мышечной пластинки слизистой оболочки и подслизистой основы) с ростом в просвет органа. Размер СубЭО составил от 5 до 160 мм, средний размер – 25,2 ± 2,4мм. Эндоскопическая диссекция подслизистого слоя (ЭДПС), как основной оперативный прием удаления образований, была выполнена у 7 больных по поводу СубЭО пищевода (2 больных), желудка (14 больных) и ДПК (1 больной). С применением ЭДПС удаляли СубЭО более 2 см в диаметре на широком основании, исходящие из 2 и 3 эхослоев. Размер СубЭО составил от 10 до 65 мм, средний размер составил 32,8±2,5мм. Тоннельная эндоскопическая резекция (ТЭРО) была предпринята у 26 больных по поводу СубЭО пищевода у 17 (65,4%) больных (грудной отдел – 12, абдоминальный отдел – 5); желудка (кардии и верхней трети тела желуд- ка) у 9 (34,6%) больных. С применением ТЭРО выполняли попытку удалить 29 СубЭО от 15 до 50 мм в диаметре, средний размер составил 28,4±3,3мм, исходящих из мышечной пластинки (11 СубЭО), подслизистого слоя (4 СубЭО) и мышечного слоя (15 СубЭО). Преимущественно экстраорганный характер роста имели 6 СубЭО, из них 4 образования пищевода располагались в заднем средостении; интрамуральный рост – 2; внутрипросветно росли остальные 14. Тотальная внутривенная анестезия (ТВВА) с миоплегией и ИВЛ была применена у 32 больных; ТВВА с сохранением спонтанного дыхания – у 28; только местная анестезия путем орошения ротоглотки 10% лидокаином – у 35 больных. В запланированном объеме оперативные вмешательства были выполнены у 93 (97,8%) из 95 больных. У 2 пациентов в процессе выполнения ТЭРО обнаружить предполагаемое СубЭО после создания тоннеля не удалось, в связи с экстраорганным ростом образований нераспознанным при предоперационном обследовании. Таким образом, у 95 пациентов было удалено 101 СубЭО, в том числе 15 ГИСО. Табл. 1. Патоморфологическая характеристика удаленных СубЭО ВОПТ Категория СубЭО Патоморфология СубЭО Локализация СубЭО Всего Пищевод Желудок ДПК n (%) Опухолеподобные СубЭО (N=21) Абберантная поджелудочная железа – 5 – 5 (5,0) Бруннерома – – 12 12 (11,9) Киста 3 – 1 4 (4,0) Доброкачественные СубЭО (N=60) Лейомиома 18 9 1 28 (27,3) Воспалительный фиброзный полип – 12 – 12 (11,9) Фиброма (ангио, нейро) 2 5 1 8 (7,9) Липома – 2 5 7 (6,9) Гемангиома 2 – – 2 (2,0) Плексиформная фибромиксома – 1 1 2 (2,0) ПЕКома – 2 – 2(2,0) Лимфангиома – – 1 1 (1,0) Промежуточные СубЭО (N=3) Воспалительная микрофибробластическая опухоль – 3 – 3 (3,0) Злокачественные СубЭО (N=15) ГИСО: очень низкий и низкий риск промежуточный риск высокий риск 4 9 1 1 – 15 (14,9) Всего 29 50 22 101 (100) Единым блоком были удалены 93/101 (92,1%) СубЭО, в точности 15/93 (16,1%) ГИСО; без повреждения капсулы – 91/101 (90,1%) СубЭО, в точности 15/91 (16,5%) ГИСО. При ВПЭ удаление по частям использовано у 4 больных с крупными доброкачественными СубЭО. При ТЭРО резекцией по частям были удалены 2 лейомиомы, которые уходили в заднее средостение. Средняя продолжительность эндоскопических операций составила 58,3 ± 5,6 мин. (диапазон от 10 до 240 мин.). Патологоанатомическое исследование удаленных СубЭО (101) было выполнено у 93 прооперированных больных, в том числе ИГХ – у 51/93 (54,8%) из них. Результаты патологоанатомического исследования представлены в табл. 1. ГИСО, верифицированные у 15/93 (14,9%) больных, в 14/15 (93,3%) случаях представляли собой веретеноклеточную опухоль, в 1/15 (6,7%) – смешанный подтип ГИСО. Все удаленные ГИСО были без нарушения целостности капсулы и имели край резекции R0. Согласно МКБ-О 2017 г., доброкачественная ГИСО верифицирована в 13/15 (87,5%) случаях и чаще всего располагалась в желудке (11), реже в абдоминальном отделе пищевода (4). Для оценки риска прогрессирования заболевания и решения вопроса о применении адъювантной терапии совместно с онкологами при ГИСО было выполнено определение стадии и оценка риска прогрессирования заболевания. По классификации TNM AJCC/UICC8-го пересмотра (2017 г.) удаленные ГИСО были квалифицированы как Т 1 у 14 больных, как Т 2 у 1 больного. Стадии II соответствовало 1 удаленная ГИСО, стадии I и Ia – 14 ГИСО. Оценка риска злокачественности проводилась по критериям H. Joensuu (2008 г.) и M. Miettinen (2006 г.). Отсутствие риска или очень низкий риск прогрессии был верифицирован у 6/15 (37,5%) больных; низкий риск – у 7/15 (50%); промежуточный риск – у 1/15(6,25%); высокий риск – еще у 1/15 (6,25%) больного. Следует отметить, что в двух последних случаях пациентам врачом-онкологом по месту жительства была назначена адъювантная терапия (иматиниб), от которой они сами отказались. Ближайшие результаты лечения в сроки от 6 месяцев до 1 года изучены у 62/93 (66,7%) больных, у остальных 33,3% (31/93) больных получить достоверные сведения о состоянии здоровья после выписки из стационара не удалось из-за отсутствия контакта или их отказа от предлагаемого обследования. Отдаленные результаты лечения в сроки от 1 года до 14 лет изучены у 27 больных, включая всех 15 больных после удаления ГИСО (с особым вниманием к больным с промежуточным и высоким риском злокачественности), которые параллельно находились под наблюдением онколога и обследовались ежегодно в соответствии с КР (ЭГДС, УЗИ и КТ брюшной полости и грудной клетки). За все время наблюдения признаков резидуального либо рецидивного СубЭО, а также прогрессирования заболевания не было обнаружено ни у одного из 62 наблюдаемых пациентов Заключение Таким образом, эндоскопические методы резекции позволяют успешно удалять локализованные субэпителиальные образования ВОЖКТ, в том числе мезенхимальные опухоли с низким риском прогрессирования с минимальным риском осложнений и отсутствием рецидива в сроки набдлюдения от 1 до 14 лет. КОМПЛЕКСНОЕ РЕШЕНИЕ ДЛЯ ОБРАБОТКИ ГИБКИХ ЭНДОСКОПОВ • Автоматизация ручно й очистки • Автоматическая мойка и дезинфекция высокого уровня • Сушка и хранение • Система документирования • Транспортировка Изображения создаются путем выделения сигналов высших гармоник, генерируемых введенным контрастным веществом, что помогает обнаруживать и классифицировать опухоли и аномальные образования. Относительная плотность тканей визуализируется цветовой шкалой от синего до красного, позволяя получить больше информации о структуре объекта. СОСТОЯНИЕ МИКРОЦИРКУЛЯЦИИ ПРИ ЭРОЗИВНО-ЯЗВЕННЫХ ПОРАЖЕНИЯХ СЛИЗИСТОЙ ЖЕЛУДКА ПО ДАННЫМ БУЛЬБАРНОЙ МИКРОСКОПИИ Апресов Э. Г., Алипа В. Н., Татевосов С. Э. ФГБУ «Объединенный санаторий «Сочи» Управления делами Президента РФ г. Сочи В современной клинической практике актуален вопрос о ранней доклинической диагностике заболеваний с помощью исследования нарушений в микроциркуляторном русле (Гогин Е. Е., Седов В. П., 1999; Федорович А. А., 2010). Расстройства микроциркуляции весьма разнообразны по своему патогенезу и клиническим проявлениям. Микроциркуляция определяет конечную цель функционирования сердечно-сосудистой системы и играет ключевую роль в трофическом обеспечении тканей и поддержании тканевого метаболизма (Сиротин Б. З., Жмеренецкий К. В., 2010) . К системе микроциркуляции относят совокупность кровеносных сосудов диаметром 150-200 мкм и менее. Микроциркуляторное русло вместе с тканевым окружением составляет гистофизиологическую микросистему органа, функциональный элемент органа или модуль. В указанную единицу функционально-анатомического строения органов входят кровеносные и лимфатические сосуды, специализированные паренхиматозные клетки, нервные волокна и соединительнотканная строма (Чернух A. M., 1984). Каждый модуль отражает микроциркуляцию определенной части органа. Система микроциркуляции включает также структурно-функциональные, реологические особенности крови, движение жидкости в перикапиллярных, межклеточных, периневральных пространствах и в лимфатических капиллярах, т. е. микроциркуляция отражает выраженность сосудистых, внутрии вне-сосудистых изменений. Микроциркуляторное русло в физиологическом отношении обеспечивает кровоснабжение, иннервацию, метаболизм, что поддерживает функцию органов. Микроциркуляторное русло, являясь терминальным отделом сердечно-сосудистой системы, в то же время органоспецифично и адаптировано к тканевой организации и функции органов. В системе микроциркуляции реализуется транспортная функция сердечно-сосудистой системы и обеспечивается транскапиллярный обмен, создающий необходимый для жизни тканевый гомеостаз (Чернух A. M., 1984). В связи с тем, что функциональные структуры микроциркуляторного русла реагируют как единая целостная система, обладающая большой пластичностью и приспособляемостью к условиям тканевого обмена, функционально-структурное изучение какой-либо области, доступной для исследования, может дать представление o состоянии микроциркуляции в целом (Маколкин В. И., 2006; Федорович А. А., 2010). Изменения в системе микроциркуляции тесно коррелируют со сдвигами в центральной гемодинамике, что позволяет использовать параметры микроциркуляции в качестве прогностического и диагностического критерия в оценке общего физического состояния организма. Микроциркуляторное русло быстро реагирует на воздействие различных патологических факторов, поэтому нарушения микроциркуляции являются наиболее ранними, стойкими и часто единственными признаками заболевания. Ранними признаками нарушений капиллярного кровотока являются сужение артериол, застойные явления в венулах, приводящие к их расширению и извитости, а также снижение интенсивности кровотока в капиллярах. На более поздних стадиях выявляется распространенная внутрисосудистая агрегация эритроцитов, что неизбежно влечет за собой остановку кровотока в капиллярах. Финал микроциркуляторных расстройств – стаз, т. е. полная блокада кровотока и резкое нарушение барьерной функции микрососудов, что нередко сопровождается кровоизлияниями через стенку капилляров, которые являются наиболее ранимыми. Артериоло-венулярные анастомозы более устойчивы к расстройствам микроциркуляции и сохраняют кровоток даже в условиях распространения стаза на значительную часть микроциркуляторного русла (Сиротин Б. З., Жмеренецкий К. В., 2009) . Наиболее доступным к применению в клинической практике методом исследования микроциркуляции является визуализация микроциркуляторного русла бульбарной конъюнктивы. Бульбарная конъюнктива является единственным участком сердечно-сосудистой системы человека, где представлены и максимально просматриваются все структуры микроциркуляторного русла – от артериол и прекапилляров до функционирующих капилляров, посткапилляров и венул. Поверхностное расположение микрососудов конъюнктивы и их плоскостная ориентация, отчетливая визуализация внутрисосудистого кровотока in vivo предоставляют возможность прямого наблюдения за морфологией микроциркуляторного русла и процессами микрогемоциркуляции (Алябьева Ж. Ю.,2000; Крылова Н. В., 1986;). Микроциркуляторное русло конъюнктивы не связано со специфическими органными функциями, так как модульная организация этой анатомической структуры не выражена вследствие терминального типа ветвления микрососудов. Проникающие в конъюнктиву и располагающиеся радиально по отношению к зрачку мелкие артерии ветвятся дихотомически, давая несколько порядков артериол разного диаметра. Их сопровождает одна или две венулы. Между прекапиллярными артериолами и посткапиллярными венулами находится слаборазветвленная капиллярная сеть (Волосок Н. И.,1980). Такие анатомические особенности сосудов конъюнктивы позволяют отражать состояние микроциркуляции на уровне всего организма человека (Михеева И. Г.,2007). Преимуществами метода биомикроскопии бульбарной конъюнктивы являются неинвазивность, безопасность, быстрота получения результатов и их информативность. В патогенезе заболеваний желудка определенное значение придается поражению мелких сосудов и капилляров всего организма, т. е. изменению в системе микроциркуляции (М. С. Вовси, 1960; Никитин Г. А., 2002). Методика биомикроскопии бульбарной конъюктивы дает возможность проследить особенности микроциркуляции глазного яблока и, при наличии патологии, выявить пациентов группы риска с заболеваниями желудка (А. И. Струков, А. М. Чернух, 1965; Козлов В. И., 2006). Основными методами лечения на курорте Сочи являются активные физические факторы, в том числе натуральные сероводородные ванны Мацесты, абсолютно противопоказанные при эрозивно-язвенных поражениях слизистой желудка. В условиях санатория выполнено 50 видеогастроскопий (ВГС). Распределение пациентов по нозоологиям, прошедших ВГС, выглядит следующим образом: 38 человек – с заболеваниями костно-мышеч- ной системы, 12 – с заболеваниями системы кровообращения. Большинство пациентов (80,6%), выполнивших ВГС, имеют заболевания, требующие приема нестероидных противовоспалительных средств (НПВС), препаратов ацетилсалициловой кислоты (АСК), антиагрегантов. При ВГС выявлено 138 патологических изменения верхних отделов ЖКТ, из которых 27% составили эрозивно – язвенные поражения, из которых 14 – язвы желудка,23 – эрозии желудка. Пациентам, имеющим эрозивно-язвенные поражения желудка, для оценки состояния микроциркуляции выполнена биомикроскопия сосудов конъюктивы глазного яблока. Среди проявлений патологического характера прежде всего следует отметить изменения в венозной системе бульбарной конъюнктивы. При поверхностных эрозиях слизистой желудка вены умеренно расширены и извиты у 50% больных, определяется также статистически достоверное сужение артериол и, соответственно, уменьшение по сравнению с нормой артериоло-венулярного коэффициента. При хронических эрозиях желудка венозная патология усугубляется, что выражается в появлении резкой извитости венул, ампулои мешкообразных расширений. У 60% больных дилатация вен сочетается с резким сужением артериол, можно обнаружить артериоло-венулярные анастомозы, значительно меняются реологические свойства крови (замедление кровотока и единичные периваскулярные геморрагии). При язвенных поражениях желудка почти у 100% больных наблюдаются наиболее тяжелые изменения микроциркуляторного русла бульбарной конъюнктивы: артериальное звено пребывает в состоянии спазма, вены резко расширены, полнокровны, извиты, наблюдаются сладж-феномен, замедленный, толчкообразный и маятникообразный ток крови, иногда полный ее стаз. В значительной степени выражены периваскулярный отек и геморрагии, а также глубокие внутрисосудистые изменения (замедление кровотока, феномен Книзелли III – IV степени). Определение парциальных конъюнктивальных индексов с помощью условных баллов позволяет предположить наличие патологии слизистой желудка, определить показанность к проведению ВГС и подборать оптимальный лечебный комплекс с учетом имеющихся заболеваний, принимая во внимание показания и противопоказания для назначения отдельных бальнеофизиотерапевтических факторов. ГАСТРОДУОДЕНА ЛЬНЫЕ ЯЗВЕННЫЕ КРОВОТЕЧЕНИЯ АНАЛИЗ РЕЗУЛЬТАТОВ ЛЕЧЕНИЯ В УСЛОВИЯХ РАЙОННОЙ БОЛЬНИЦЫ Валеев М. В.1 ,Тимербулатов Ш.В.2 ГБУЗ РБ Белорецкая центральная районная клиническая больница 2Башкирский государственный медицинский университет г. Белорецк, Уфа Введение Кровотечения из верхних отделов пищеварительного тракта остаются актуальной проблемой неотложной хирургии. Ежегодная заболеваемость во всем мире составляет 100 случаев на 100000 населения[1,2]. В структуре кровотечений, наиболее частой причиной являются пептические язвы желудка и двенадцатиперстной кишки(ДПК) – 28-59% [1,2]. Заболеваемость язвенными кровотечениями в мире составляет 19-57 случаев на 100000 населения[3]. По наблюдениям авторов, летальность при язвенных кровотечениях в мире составляет 5-10%[4]. Основными причинами летальных исходов считаются возраст пациента, рецидив кровотечения(РК) и декомпенсированное сопутствующее заболевание[5]. Успешный первичный гемостаз может быть достигнуть у 90% пациентов[4]. Не смотря на это, повторное язвенное кровотечение возникает в 12,4-17,3% случаев[6,7]. В клиниках, активно применяющих терапевтическую эндоскопии в лечении язвенных кровотечений, удалось снизить оперативную активность до 6,8-7,9%. В тоже время, в связи со слабой материально-технической базой и дефицитом квалифицированных кадров, в нашей стране остается много клиник, не применяющих в своей практике эндоскопический гемостаз. Результаты исследования За период с 2008 по 2018 гг. в условиях 1 хирургического отделения Белорецкой центральной районной клинической больницы было пролечено 240 пациентов с язвенными кровотечениями. По нашим наблюдениям, язвенные кровотечения занимают первое место в структуре неварикозных кровотечений – 50,8%. Заболеваемость язвенными кровотечениями по Белорецкому району за анализируемый период остается стабильной, имея некоторую тенденцию к увеличению (Рис. 1). По нашим данным язвенные кровотечения встречаются у людей разных возрастных групп, но основная доля наблюдений приходилась на возрастной интервал от 41 до 60 лет(50% больных). Мужчины болеют чаще чем женщины, соотношение составляет 3:1 соответственно. Средний возраст пациентов составил 54±1 год. 22,9% пациентов имели алкогольный анамнез на момент поступления. У 40 пациентов(16,7%) причиной развития язвенного кровотечения явилось применение нестероидных противовоспалительных препаратов или антикоагулянтов. Язвенная болезнь в анамнезе была у 81 пациента(33,8%). Медиана длительности стационарного лечения составила 13 койко-дней с интерквартильным размахом от 10 до 18. Диагноз устанавливался на основании клинических и эндоскопических данных. Диагностическая гастроскопия выполнялась всем пациентам в первые 1,5 часа от момента поступления. При первичном осмотре локализовать источник кровотечения удалось у 213 пациентов(88,8%). Чаще всего кровоточащая язва локализовалась в желудке – 139 случаев(57,9%) и ДПК – 86 случаев(35,8%). Более редкие наблюдения – сочетание кровоточащей язвы желудка и ДПК – 7 наблюдений(2,9%) и язва оперированного желудка – 8 наблюдений(3,3%). Хронический характер язвы встречался чаще – 76,7% наблюдений. Наиболее частыми локализациями для язвы желудка являются малая кривизна(20,4%) и тело(19,6%). Язва ДПК чаще всего локализовалась по передней стенке(14,6%). Основными клиническими проявлениями язвенных кровотечений являются рвота свежей или изменен ной кровью, мелена, коллапс. По нашим наблюдениям наиболее частым симптомом является дегтеобразный, который удалось выявить у 78% пациентов. Рвота свежей кровью или кофейной гущей встречалась несколько реже – в 51% случаев. Стоит отметить, что у 12 пациентов(5%) на момент осмотра в приемном покое отсутствовали рвота и мелена, а заболевание проявлялось слабостью и головокружением. Заболевание порой имеет скудную симптоматику, что объясняет позднюю обращаемость за медицинской помощью – по нашим наблюдением 48% пациентов об- ратились в приемное отделение более чем через 24 часа от момента начала заболевания. В первые 6 часов после появления признаков заболевания обратилось лишь 22% пациентов. Шок различной степени наблюдался у 45 пациентов(18,8%). В процессе лечения, 114 пациентам(47,5%) понадобилась интенсивная терапия в условиях отделения реанимации. Переливание эритроцитарной массы потребовалось 77 пациентам(32,1%) Степень гемостаза в язве описывалась с помощью классификации J. A. Forrest. Частота различных типов гемостаза по классификации Forrest была следующей – 1A – 0,8%, 1B – 15,4%, 2A – 16,7%, 2B-26,7%, 2C-25,8%, 3-12,1%. Рецидив кровотечения(РК) произошел у 52 пациентов(21,7%). Стоит обратить внимание на то, каким образом влияет РК на наступление летального исхода. Летальность в группе пациентов с РК составила 26,9%(14 пациентов из 52). В группе пациентов где РК не произошло, летальность составила 0,53%(1 пациент из 188). После наступления РК риск развития летального исхода возрастал в 68,9 раз(p<0,001, OR=68,9; 95% CI 8,8-539,7). По поводу язвенных кровотечений было прооперировано 55 пациентов(22,9%). Показаниями для оперативного лечения являлись продолжающееся кровотечение, рецидив кровотечения и высокий риск его наступления. Виды применявшихся оперативных пособий – прошивание язвы(41), резекция желудка(9), иссечение язвы(3), реконструктивная резекция желудка(2). Высокую оперативную активность мы связываем с отсутствием эндоскопического гемостаза в клинике. Послеоперационная летальность составила 20%(11 пациентов). На высоте РК, по экстренным показаниям, был прооперирован 41 пациент(74,5% от общего количества прооперированных). 14 пациентов были прооперированы по срочным показаниям в связи с высоким риском наступления РК. Хирургическое лечение, проводимое на фоне РК сопровождалось высокой послеоперацион- ной летальностью – 26,8%(11 пациентов). После оперативных вмешательств, выполненных по срочным показаниям, летальных исходов не наблюдалось. Общая летальность при язвенных кровотечениях составила 6,3%(15 пациентов). Летальность выше при локализации язвы в желудке, чем в ДПК – 8,4% и 4,4% соответственно. Заключение 1. Язвенные кровотечения остаются актуальной проблемой неотложной эндоскопии. Заболеваемость язвенными кровотечениями не имеет тенденции к снижению, демонстрирую небольшой рост. Летальность остается на достаточно высоком уровне. 2. Рецидив язвенного кровотечения является одной из главных причин неудовлетворительных результатов лечения. Риск летального исхода после наступления РК возрастает в десятки раз(OR=68,9; 95% CI 8,8-539,7). Оперативное лечение, проводимое на фоне РК, имеет высокую послеоперационную летальность – 26,8%. Срочные операции, выполняемые у пациентов с высоким риском наступления РК, демонстрирует лучшие результаты. 3. Прогнозирование риска РК является важным этапом в диагностике и лечении пациентов с язвенными кровотечениями. Ранее выявление пациентов с высоким риском рецидива позволит своевременно предпринять профилактические меры и избежать развития тяжелого осложнения, что в конечном итоге позволит снизить летальность. 4. Все эндоскопические отделения, оказывающие помощь пациентам с ОГДК, должны иметь техническую возможность осуществления эндоскопического гемостаза. Эффективная терапевтическая эндоскопия не представляется возможной без специального оснащения. Материально-техническая база районных больниц оставляет желать лучшего и чаще всего не позволяет использовать весь арсенал современных методов лечения. Литература 1. Hearnshaw SA, Logan RF, Lowe D et al. Acute upper gastrointestinal bleeding in UK: patients characteristics, diagnoses and outcomes in the 2007 UK audit // Gut. 2011. Vol. 60, No 10. P. 1327-1335. 2. Leerdam ME. Epidemiology of acute upper gastrointestinal bleeding // Best Pract. Res. Clin. Gastroenterol. 2008. Vol. 22, No 2. P. 209-224. 3. Lau JY, Sung J, Hill C, et al. Systematic review of the epidemiology of complicated peptic ulcer disease: incidence, recurrence, risk factors and mortality // Digestion. 2011. Vol. 84. P. 102-113. 4. Laine L, Jensen DM. Management of patients with ulcer bleeding // Am. J. Gastroenterol. 2012. Vol. 107. P. 345-360. 5. Ljubicic N., Puljiz Z., Budimir I., et al. The influence of etiologic factors on clinical outcome in patients with peptic ulcer bleeding // Dig. Dis. Sci. 2012. Vol. 57, No 12. P. 3195-3204. 6. Хунафин С. Н., Федоров С. В., Петров Ю. В. и др. Гастродуоденальные язвенные кровотечения // Пермский медицинский журнал. 2014. Т. 31, № 5. С. 17-21. 7. Jimenez Rosales R., Martinez-Cara J.G., Vadillo-Calles F. et al. Analysis of rebleeding in cases of an upper gastrointestinal bleed in a single center series // Rev. Esp. Enferm. Dig. 2018. Vol. 111, No 3. P. 189-192. МОДИФИЦИРОВАННАЯ МЕТОДИКА ТРАКЦИИ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ КЛИПС И ЗУБНОЙ НИТИ ПРИ СЛОЖНЫХ ESD КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ Вербовский А.Н.1, Пирогов С.С.2, Балалыкин А.С.1 1 ГБУЗ МО «Красногорская городская больница № 1» 2 Московский научно-исследовательский онкологический институт имени П. А. Герцена, филиал ФГБУ «НМИЦ Радиологии» МЗ РФ г. Красногорск, Москва Введение В 1998 году японскими специалистами K. Hosokawa и S. Yoshida был представлен метод ESD, позволяющий выполнить удаление эпителиальных новообразований размером более 2 см единым блоком в пищеводе, желудке, двенадцатиперстной и толстой кишке. В настоящий момент наибольший опыт накоплен в Японии, где ESD является золотым стандартом лечения больных с неинвазивными эпителиальными новообразованиями пищеварительного тракта. Резекция опухоли единым блоком позволяет провести точное гистологическое стадирование, увеличить радикальность и значительно снизить риск местного рецидива. Несмотря на все вышеперечисленные преимущества, метод подслизистой диссекции в европейских странах широко не распространён, ввиду сложности выполнения, длительности операции и риска развития осложнений (кровотечения, перфорации). Так, частота развития интраоперационных перфораций при ESD достигает 10%, а главными причинами их развития являются недостаточная визуализация структур подслизистого слоя, особенно в условиях фиброза; ограниченная возможность маневрирования эндоскопа и недостаточный опыт врача. Кроме того, вследствие отсутствия хорошей видимости подслизистого слоя при ESD, можно столкнуться с повреждением крупных сосудов и развитием клинически значимых кровотечений. В литературе описано большое количество различных методик тракции опухоли при выполнении ESD, применение которых снижает риск развития осложнений и значительно уменьшает время операции. Основой любой тракционной методики при ESD является натяжение края рассеченной слизистой оболочки, что позволяет улучшить визуализацию структур подслизистого слоя, ускорить процесс диссекции подслизистого слоя и снизить риск развития интраоперационных и послеоперационных осложнений. Однако в настоящее время нет методики тракции, которая бы отвечала всем необходимым требованиям. Отсутствие контроля направления тракции, синхронность движений эндоскопа и тракционной системы, отрыв клипсы от края опухоли и т. д. диктуют необходимость усовершенствования операции. Наиболее часто применяется методика тракции с использованием нити и клипс (Oyama в 2002 г.). Такая распространенность связана в первую очередь с простотой применения и небольшой стоимостью. Суть технологии заключается в том, что после рассечения слизистой оболочки по периметру опухоли на край рассеченной слизистой с опухолью фиксируется клипса с нитью. При тракции в направлении «на себя» приподнимается край слизистой оболочки, за счет чего достигается визуализация подслизистого слоя. Однако при опухолях, локализованных в сложных анатомических зонах, и при фиброзе подслизистого слоя зачастую недостаточно тракции с одной стороны. Возможным решением данной проблемы, с нашей точки зрения, является фиксация нити на опухоли в дополнительных точках по периметру, что обеспечивает подъем образования сразу с нескольких сторон. Этим может достигаться снижение времени операции и уменьшение количества интраоперационных и послеоперационных осложнений (кровотечения, перфорации), особенно – в технически сложных случаях. Клиническое наблюдение Пациентка Х, 65 лет, поступила в ГБУЗ МО «Красногорская городская больница № 1» с диагнозом: латерально стел.щаяся опухоль восходящей ободочной кишки гранулярного типа (LST-G). 08.10.2020 г. под эндотрахеальным наркозом выполнено удаление опухоли методом эндоскопической резекции слизистой оболочки с диссекцией в подслизистом слое с применением разработанной нами методики тракции. После определения границ опухоли (Рис. 1) и введения в подслизистый слой раствора геловузина с добавлением индигокармина (Рис. 2) выполнен циркулярный разрез слизистой оболочки по периметру опухоли при помощи ножа I-тип Finemedix (Korea) в режиме PulseCutSlow 30W. Первая клипса с нитью фиксирована к проксимальному краю рассеченной слизистой оболочки. Далее выполнена фиксация нити клипсами еще в трех точках (Рис. 3). При подтягивании нити «на себя» края рассеченной слизистой оболочки приподнимаются с хорошей визуализацией подслизистого слоя по периметру (Рис. 4). Поэтапно выполнена диссекция подслизистого слоя при помощи эндоскопического ножа I-тип Finemedix (Korea) в режиме PulsCutSlow 30W (Рис. 5). После профилактической коагуляции видимых сосудов в дне дефекта (Рис. 6) щипцами Coagrasper в режиме SoftCoag 80Wобразование извлечено наружу и фиксировано иглами к полотну из пробкового дерева (Рис. 7). Общее время операции составило 1 час 50 мин. Время диссекции подслизистого слоя – 45 мин. Осложнений не отмечено. При морфологическом исследовании выявлена тубуло-ворсинчатая аденома толстой кишки, достигнута радикальная (R0) резекция. Пациентка выписана из стационара на четвертые сутки после операции в удовлетворительном состоянии. Заключение Разработанная нами методика многоточечной тракции опухоли при выполнении эндоскопической диссекции подслизистого слоя может позволить удалять эндоскопически опухоли, ранее считавшиеся нерезектабельными вследствие размеров, локализации или фиброза подслизистого слоя. Такой подход позволяет лучше визуализировать подслизистый слой и крупные сосуды в нем, может обеспечить более высокую радикальность вмешательства, сократить длительность операции и уменьшить риск развития интраоперационных и послеоперационных осложнений. СТАТИСТИКА ЯЗВЕННОЙ БОЛЕЗНИ ЖЕЛУДКА И 12 ПЕРСТНОЙ КИШКИ ПО РЕЗУЛЬТАТАМ 5 – ЛЕТНЕЙ РАБОТЫ ЭНДОСКОПИЧЕСКОГО ОТДЕЛЕНИЯ ИРКУТСКОЙ ГОРОДСКОЙ БОЛЬНИЦЫ № 8 Дубовский А. В. ОГБУЗ «Иркутская городская больница № 3» г. Иркутск Введение В работе представлена статистическая картина распространённости язвенной болезни желудка и двенадцатиперстной кишки (ЯБЖ и ДПК) среди пациентов, обследованных в эндоскопическом отделении ОГАУЗ Иркутской городской больницы № 8. Определена частота ЯБЖ и ДПК, распределение впервые выявленной и рецидивной ЯБЖ ДПК по полу, возрасту, клиническим формам. Цель исследования Проведённое исследование было направлено на изучение распределения ЯБ ДПК по различным группам населения для выявления групп наибольшего риска по полу и возрасту и организации дальнейших лечебно-профилактических мероприятий. Влияние других факторов риска (генетическая предрасположенность, обсеменённость Helycоbacter pylori, социальные факторы – психоэмоцильнальный статус пациентов, характер питания, особенности профессиональной деятельности, вредные привычки) в данной работе не анализировалось. Актуальность Опубликованные к настоящему времени статистические данные разных авторов показывают, что ЯБ до сих пор остаётся одним из широко распространённых заболеваний, особенно среди мужского населения. ЯБ страдает от 10 до 15% всего населения земного шара [2]. Ежегодно в мире фиксируется около 500 000 новых случаев ЯБ [1]. До 35-40 процентов больных ЯБЖ страдают серьёзными осложнениями [1]. ЯБ является междисциплинарной (терапия и хирургия) проблемой [2]. Хотя благодаря лечебно-профилактическим мероприятиям (в том числе широкое внедрение в повседневную практику методики эндоскопического обследования верхних отделов пищеварительного тракта, применение лекарственных препаратов для эрадикадии Helycоbacter pylori, которая считается одной из основных причин развития ЯБ, уровень заболеваемости ЯБ за последние годы снизился, однако ущерб, наносимый этим заболеванием здоровью населения, продолжает оставаться значительным, снижая качество жизни пациентов. Также ЯБ является серьёзной социально-экономической проблемой, наносящей существенный экономический вред государству [3]. В связи с вышеизложенным для дальнейшего планирования и проведения системных диагностических и лечебно-профилактических мероприятий в условиях поликлиник и стационаров необходим анализ современных результатов исследований о распространённости ЯБ, распределении её в различных по полу и возрасту группам пациентов. Кроме этого следует учитывать частоту выяв- Табл. 1. Распределение выявленной ЯБ по локализации, клиническим формам и полу пациентов Патология Мужчины Женщины Всего Примечание хр. впервые выявленная язва желудка 97(1,07%) 116 (0,71%) 214 (0,84%) Хр. рецидивирующая язва желудка 69 (0,76%) 70 (0,43%) 139 (0,55%) Острая впервые выявленная язва желудка 53(058%) 89 (0,51%) 142 (0,56%) Острая рецидивирующая язва желудка 16 (0,18%) 20 (0,12%) 36 (0,14%) Хроническая впервые выявленная язва желудка с переходом на ДПК 3 (0,03%) 2 (0,012%) 5 (0,02%) Не включена в итоговые цифры Патология Мужчины Женщины Всего Примечание Хроническая рецидивирующая язва желудка с переходом на ДПК 3 (0,03%) - 3 (0,012%) Не включена в итоговые цифры Хроническая впервые выявленная язва ДПК 174(1,91%) 209 (1,28%) 383 (1,5%) Хроническая рецидивирующая язва ДПК 214(2,35%) 166 (1,02%) 380 (1,492%) Острая впервые выявленная язва ДПК 24 (0,26%) 17 (0,1%) 41 (0,16%) Острая рецидивирующая язва ДПК 7 (0,08%) 3 (0,02%) 10 (0,04%) Острая+хроническая впервые выявленные язвы ДПК 2 (0,021%) - 2 (0,08%) Острая+хроническая рецидивирующие язвы ДПК - 1 (0,006%) 1 (0,004%) Язва ДПК после резекции желудка - 1 (0,006%) 1 (0,004%) Острая+хроническая впервые выявленные язвы желудка - 5 5 (0,031%) Острая+хроническая рецидивирующие язвы желудка 1 (0,011%) - 1 (0,004%) Сочетанные впервые выявленные хронические желудка ДПК 7 (0,08%) 6 (0,037%) 13 (0,05%) Сочетанные рецидивирующие хронические язвы желудка и ДПК 3(0,03%) 9 (0,055%) 12 (0,047%) Сочетанные впервые выявленные острые желудка ДПК 3 (0,03%) 1 (0,006%) 4 (0,016%) Сочетанные рецидивирующие острые язвы желудка и ДПК 1 (0,011%) - 1 (0,004%) Сочетанные рецидивирующие хроническая язва желудка и острая язва ДПК - 1 (0,006%) 1 (0,004%) Сочетанные впервые выявленные острая язва желудка хроническая язва ДПК 3(0,03%) 3 6 (0.037%) Сочетанные рецидивирующие острая язва желудка хроническая язва ДПК 1 (0,011%) 1 (0,006%) 2 (0,08%) Сочетанные впервые выявленные язвы желудка и ДПК 13 (0,143%) 15 (0,09%) 28 (0,11%) Сочетанные впервые выявленные язвы желудка и ДПК всего 18 (0,21%) 21 (0,13%) 39 (0,153%) Все острые язвы желудка 69 (0,76%) 109 (0,67%) 178 (0,7%) Все хронические язвы желудка 166 (1,82%) +6 язв Барретта 186 (1,14%) +3 язв Барретта 352 (1,358%) +9 язв Барретта Все впервые выявленные язвы желудка 150 (1,65%) 205 (1,25%) 355 (1,395%) Все рецидивирующие язвы желудка 85 (0,93%) 90 (0,55%) 175 (0,69%) Все язвы желудка 235 2,58) + язв Барретта 295 (1,8%) +3 язв Барретта 530 (2,08%) + 9 язв Барретта Все острые язвы ДПК 31 (0,34%) 20 (0,12%) 51 (0,2%) Все хронические язвы ДПК 388 (4,26%) 375 (2,29%) 765 (3,01%) Все впервые выявленные язвы ДПК 198 (2,18%) 226 (1,38%) 424 (1,67%) Все рецидивирующие язвы ДПК 221 (2,43%) 169 (1,03%) 390 (1,53%) Все язвы ДПК 419 (4,6%) 395 (2,41%) 814 (3,2%) Язва культи желуда 2 (0,021%) 1 (острая) (0,006%) 3 (0,012%) Не включена в итоговые цифры ЯЗВА ГЭА (! Отд) 8 (0,09%) 2 (0,012%) 10 (0,039%) Не включена в итоговые цифры Хроническая язва сегмента Барретта ВПЕРВЫЕ 3 (0,03%) 1 (0,006%) 3 (0,012%) Хроническая рецидивирующая язва сегмента Барретта 3 (0,03%) 2 (0,012%) 5 (0,24%) ления первичной ЯБ и её рецидивов, различных форм ЯБ (острая, хроническая, сочетанные язвы). Материалы и методы Работа основана на материалах эндоскопического обследования верхних отделов пищеварительного тракта (ЭГДС), проведённого в течение 5 лет пациентам в эндоскопическом отделении Иркутской городской клинической больницы № 8. Исследования выполнялись с помощью видеои фиброэндоскопов Pentax и Olympus. Всего обследован 26921 пациент в возрасте от 7 до 91 года (до 18 лет – 700 человек), в том числе в поликлинике – 19388, в стационаре – 7533. Первичных ЭГДС выполнено 25456. Среди первично обследованных мужчин – 9103 (33,8%), женщин – 16363 (66,2%). Результаты Проведённые в течение 5 лет исследования дали следующие результаты: среди 25456 пациентов, которым была первично выполнена ЭГДС ЯБ обнаружена у 1344 человек, что составляет 5,28% от общего количества обследованных. ЯБЖ выявлена у 530 пациентов (2,08%), ЯБ ДПК – у 814 пациентов (3,2%). Среди обследованных мужчин ЯБ обнаружена у 654 человек (7,18%). В том числе ЯБЖ – у 235 пациентов (2,58%), ЯБ ДПК – у 419 (4,6%). Среди женщин ЯБ выявлена у 690 пациенток (4,21%), ЯБЖ – у 295 человек (1,8%). ЯБ ДПК выявлена у 395 человек (2,41%). Таким образом, по данным проведённых исследований соотношение количества мужчин и женщин, страдающих ЯБ составляет 1,67: 1 (по ЯБЖ – 1,43:1, по ЯБ ДПК 1,9: 1). Хронические язвы выявлялись чаще как у мужчин (6,84% обследованных), так и у женщин (3,43%), чем острые язвы (1,1% среди мужчин, 0,79% среди женщин). Хронические ЯЖ выявлялись чаще как у мужчин (2,58%), так и у женщин (1,14%), чем острые язвы (соответственно – у мужчин 0,76% и у женщин – 0,67%. Хронические ЯДПК также выявлялись чаще как у мужчин (4,26%), так и у женщин (2,29%), чем острые язвы (у 0,34% обследованных мужчин и у 0,12% женщин). Среди как хронических, так и острых ЯЖ у мужчин и у женщин преобладали впервые выявленные язвы над рецидивирующими. У 39 пациентов выявлено сочетание язв желудка и ДПК, а также острой и хронической, соответственно 18 наблюдений у мужчин и 21 – у женщин. Среди хронических ЯДПК у мужчин преобладали рецидивирующие (214) язвы над первично выявленными (174). У женщин, напротив, впервые выявленных язв ДПК (209) было больше, чем рецидивирующих (166). В структуре острых ЯДПК преобладали впервые выявленные, как у мужчин (24), так и у женщин (17). Рецидивирующие острые язвы ДПК у мужчин – 7, у женщин – 3. Чаще всего ЯБЖ у мужчин выявлялась в возрасте от 28 до 57 лет. У женщин – от 28 до 67 лет. Наибольшее количество ЯБ ДПК у мужчин выявлено в возрастной группе от 18 до 37 лет, у женщин – в более широких возрастных пределах – от 18 до 57 лет. Согласно нашим наблюдениям, частота ЯБЖ с каждым годом уменьшается, что связано с качественной диагностикой путём массового эндоскопического обследования населения и своевременным проведением адекватной противоязвенной терапии. Количество выявленных сочетанных язв желудка и ДПК, а также сочетание острой и хронической язвы ДПК существенно меньше (всего 39 случаев – 18 у мужчин, 21 – у женщин). Распределение выявленной ЯБ по локализации, клиническим формам и полу пациентов приведены в таблице 1. На рисунках 1-5 язвы желудка и ДПК. Выводы 1. Язвенная болезнь у пациентов Иркутской городской больницы № 8 по данным 5-летней работы эндоскопического отделения составляет 5,28% среди обследованного населения (ЯБЖ – 2,08% наблюдений, ЯБ ДПК – 3,2%) при этом соотношение больных мужчин и женщин составляет 1,67: 1 (ЯБЖ – 1,43:1, ЯБ ДПК 1,9: 1). 2. Язвенная болезнь ДПК встречается на 53,6% чаще, чем язвенная болезнь желудка (у мужчин – на 78,3%, у женщин – на 33,9%) 3. Сочетанные язвы желудка и ДПК выявлены у 0,153% обследованных (7,36% больных ЯБ). 4. Наиболее «рискованной» по развитию ЯБ среди мужчин является возрастная группа от 18 до 57 лет (ЯБЖ чаще встречается от 28 до 57 лет, ЯБДПК от 18 до 37 лет), а у женщин – более «широкая» по возрастным рамкам группа – от 18 до 67 лет. (ЯБЖ 28-67 лет, ЯБ ДПК 18-67 лет). 5. Как у мужчин, так и у женщин впервые выявленные хронические и острые язвы желудка, острые язвы ДПК диагностировались чаще, чем рецидивные. Рецидивные хронические язвы ДПК у мужчин обнаруживались чаще, чем впервые выявленные (в отличие от женщин, у которых ситуация обратная – преобладали впервые выявленные хронические язвы ДПК). Литература 1. Полунина Т. Е. Новый взгляд на болезнь язвы желудка и двенадцатиперстной кишки // Медицинский совет. – 2018 г. – № 9-10. – С. 54-59. 2. Совалкин В. И., Бикбавова Г. Р., Смирнова Л. М., Кокухина Н. С. Язвенная болезнь желудка и двенадцатиперстной кишки: история взглядов на патогенез и лечение // Омский научный вестник. – 2013 г. – № 2 (124). – С. 54-57. 3. Сосновская Е. В. Фармакоэкономические аспекты терапии больных язвенной болезнью желудка на стационарном и амбулаторно-поликлиническом этапах // Саратовский научно-медицинский журнал. – 2011 г. – Том 7. – № 2. – С. 418-420. ОПЫТ ПРИМЕНЕНИЯ ЭНДОСКОПИЧЕСКИХ РЕЗЕКЦИЙ КАК РАДИКАЛЬНОГО МЕТОДА ЛЕЧЕНИЯ РАННЕГО РАКА ЖЕЛУДКА Зуйков К. С., Важенин А. В., Кулаев К. И., Юсупов И. М., Попова И. А., Пушкарев Е. А., Казанцев А. С. ГБУЗ Челябинский областной клинический центр онкологии и ядерной медицины г. Челябинск Актуальность Так как пятилетняя выживаемость больных с ранним раком желудка после хирургических резекций достигла 93-98% в последнее время возникает все больший интерес в деле сохранения целостности желудка и его функции с поддержанием высокого качества жизни пациентов путем внедрения малоинвазивных методов лечения. Ранние формы рака желудка ограниченные пределами слизистого или поверхностных уровней подслизистого слоев стенки органа, имеющие небольшой размер (до 2,0 см. в диаметре) с высокой степенью дифференцировки имеют минимальный риск развития лимфогенных метастазов и открывают широкие возможности для применения малоинвазивных процедур, таких как мукозальная резекция слизистой (EMR) и субмукозальная эндодиссекция (ESD), как радикальных методов их лечения. Цель работы Показать эффективность метода эндоскопических резекций как радикального метода лечения ранних форм рака желудка. Материалы и методы На базе эндоскопического отделения ГБУЗ «Челябинский Областной Клинический Центр Онкологии и Ядерной Медицины» в период с 2009 по 2020 год проведено 508 эндоскопических вмешательств при ранних формах рака органов желудочно-кишечного тракта, из них 268 эндоскопических резекций выполнены по поводу ранних форм рака желудка у 113 женщин и 69 мужчины в возрасте от 29 до 83 лет, средний возраст составил 53+7,2 лет, в объеме 69 EMR (включая резекции подслизистых новообразований) и 199 ESD. Большее, в сравнении с общим количеством пациентов, количество выполненных резекций связано с тем, что некоторым из пациентов выполнялось несколько резекций в связи с мультицентричным характером роста новообразования (НЭН). Для определения глубины инвазии опухоли в стенку органа всем пациентам на амбулаторном этапе дообследования производилось эндосонография стенки желудка. Критериями отбора больных для эндоскопических резекций, в зависимости от их вида, были инвазия в пределах слизистой оболочки (включая рак in situ) или до поверхностных слоев подслизстого слоя стенки органа, гистологически верифицирована аденокарцинома высокой или умеренной степени дифференцировки, макроскопический тип новообразования соответствовал IIа – IIb типам (Парижская классификация, 2002 год), размер опухоли до 2 см. в диаметре, отсутствие клинически определяемых (эндоУЗИ, РКТ) метастазов в регионарные лимфатические узлы. Операции проводились в условиях операционной под общей анестезией. Время проведения операций зависело от её вида, количества, размера и локализации новообразований составляя в среднем при EMR30+10 минут и при ESD85+10 минут. Условиями радикальности проведенных резекция считаются иссечение опухоли в пределах здоровых тканей единым блоком (при ESD), отсутствие роста опухоли по краям и дну резекции слизистой оболочки, в случае выявления, аденокарцинома высокоили умерено дифференцированной, не было вовлечения в опухолевый процесс кровеносных и лимфатических сосудов (отсутствие опухолевых эмболов). Результаты В таблице 1 представлены данные о гистологическом строении резецированных новообразований желудка. При гистологическом описании макропрепаратов при EMR резекция новообразования проведена единым блоком в 89,2% случаев и в 100% случаев с соблюдением всех критериев радикальности операции. При ESD резекция проведена единым блоком в 100% случаев и в 96,4% случаев с соблюдением всех критериев радикальности операции (у 6 пациентов выявлен рост опухоли по одному из краев резекции). Осложнения возникли в 14 (6,7%) случаях: в 6 (42,9% от общего количества осложнений) случаях развилось интраоперационное кровотечение купированное либо путем наложения эндоклипс или методом воздействия аргоноплазменной или диатермокоагуляции. В 7 случаях (50% от общего количества осложнений) произошли перфорации стенки желудка, все при выполнении Табл. 1. Гистологическое строение резецированных новообразований Гистологический тип новообразования Количество Нейроэндокринная неоплазия слизистой 66 Аденокарцинома высокодифференцированная 80 умереннодифференцированная 5 Тубулярная аденома с дисплазией тяжёлой (III) степени (на амбулаторном этапе обследования гистологически верифицирована аденокарцинома) 17 GIST – опухоль 10 эктопия поджелудочной железы 3 липома 2 Периневрома 1 Гамартома 1 ESD, из них в 3 случаях (50%) зона перфорации закрыта методом эндоклипирования, без развития осложнений в послеоперационном периоде, в оставшихся 3 случаях (50%), в связи с безуспешностью попыток эндоскопического закрытия дефектов стенки желудка, выполнены следующие операции – лапароскопия с аппапартным ушиванием зоны дефекта стенки желудка, лапаротомия с клиновидной резекцией желудка и минилапаротомия с ушиванием стенки желудка. В 1 случае (7,1% от общего количества осложнений) при установке овертьюба в просвет пищевода произошла перфорация грушевидного синуса. В послеоперационном периоде осложнений не наблюдалось. Летальных исходов не было. Лечебная тактика среди пациентов у которых при исследовании макропрепарата выявлен рост по краю резекции представлена в таблице 2. Результаты динамического наблюдения за пролеченными пациентами, сроком от 6 до 80 месяцев, представлены в таблице 3. Выводы 1. Эндоскопические резекции являются эффективной лечебной методикой обеспечивающей радикальное удаление опухолевого очага. В 97,6% случаев они стали окончательным методом лечения ранней формы рака желудка, что сопоставимо с хирургическими, составляющие, в среднем, 95%. Это дает право рассматривать эндоскопические резекции альтернативой хирургических операций на ранних стадиях развития опухолевого процесса в желудке. 2. Субмукозальная эндодиссекция может рассматриваться как радикальное лечение рецидивов новообразований желудка после других способов эндоскопического или иного малоинвазивного способа лечения. 3. Мукозальная резекция позволяет проводить удаление полиморфных (относящихся к предраковым) изменений слизистой (аденома/дисплазия) любого размера как в качестве лечебной, так и в качестве диагностической процедуры, как метод расширенной биопсии. Табл. 2. Пациенты с ростом опухоли по краю резекции Данные гистологического исследования макропрепарата Вид резекции Кол-во пациентов Проведенное лечение Примечание Рост опухоли по боковому и нижнему краю резекции ESD 2 Гастрэктомия с лимфодиссекцией до D2 Рост опухоли по боковому краю резекции ESD 2 Резекция желудка Рост опухоли по боковому краю резекции ESD 2 Наблюдение (выраженная сопутствующая патология) При биопсии зоны операции данных за новообразования не выявлено Табл. 3. Результаты динамического наблюдения Данные гистологического исследования макропрепарата Вид проведенной ранее резекции Кол-во пациентов Проведенное лечение Примечание Выявлен новый очаг перстневидноклеточного рака ESD 1 Гастрэктомия с лимфодиссекцией (D2) Гистологическое заключение после ESDвысокодифференцированная аденокарцинома Обнаружение новых очагов неоплазии (мультицентричный рост) ESD 1 Гастрэктомия с лимфодиссекцией (D2) Обнаружение новых очагов (мультицентричный рост) нейроэндокринной неоплазии ESD 2 Повторная ESD Решение вопроса о хирургической резекции не рассматривалось, ввиду выраженной сопутствующей патологии «КЛИНИЧЕСКАЯ ЭНДОСКОПИЯ» — журнал о современных достижениях, возможностях и перспективах развития диагностической, лечебной и оперативной эндоскопии и ее непосредственной роли в отражении многообразия клинических проявлений заболеваний. «КЛИНИЧЕСКАЯ ЭНДОСКОПИЯ» — помощь клиницистам различных специальностей, использующим эндоскопические методы диагностики и лечения, врачам эндоскопических отделений и кабинетов, стремящимся профессионально идти в ногу со временем. «КЛИНИЧЕСКАЯ ЭНДОСКОПИЯ» — реальная возможность публикации своих научных исследований и практических наблюдений. «КЛИНИЧЕСКАЯ ЭНДОСКОПИЯ» публикует оригинальные статьи, обзоры, случаи из практики, сообщения о новых достижениях эндоскопии и малоинвазивной хирургии, информационные материалы, рефераты, сообщения о съездах и конференциях, технических достижениях и разработках эндоскопической аппаратуры. Периодичность: четыре информационных выпуска в год Языки: русский, английский Распространение: РФ и страны СНГ Российское Эндоскопическое Общество Адрес редакции: 194295, Санкт-Петербург, а/я 35 Телефон/телефакс: +7 (812) 559-96-26 Телефон: +7 (812) 635-65-64 E-mail: red@rusendo.ru СРАВНЕНИЕ ЭНДОСКОПИЧЕСКОЙ ПОДСЛИЗИСТОЙ ДИССЕКЦИИ (ЭПД), ЭНДОСКОПИЧЕСКИ АССИСТИРОВАННОЙ ЛАПАРОСКОПИИ (ЭАЛ) И ОТКРЫТОЙ ХИРУРГИИ РАННЕГО РАКА ЖЕЛУДКА (РРЖ) РЕТРОСПЕКТИВНОЕ ИССЛЕДОВАНИЕ Кашин С. В.1, Дыленок А. А.1, Крайнова Е. А.1, Меркулова А. О.1,2, Тарасова Е. Л.1 1ГБУЗ Ярославской области Клиническая онкологическая больница 2ГБУЗ НИИ Неотложной детской хирургии и травматологии Департамента здравоохранения города Москвы г. Ярославль, Москва Введение Гастрэктомия (ГЭ) в западных странах и в России по-прежнему выполняется чаще, чем ЭПД, даже у пациентов на ранней стадии рака желудка. Цель Исследование направлено на сравнение периоперационных исходов и онкологической радикальности ЭПД по сравнению с ЭАЛ и открытой хирургией в лечении РРЖ. Материалы и методы 248 пациентов с установленным диагнозом раннего рака желудка (T1N0M0) получили лечение в Ярославской областной клинической онкологической больнице в период с 2006 по 2010 г. 140 из них была выполнена ЭПД, 94 – ГЭ и 14 – эндоскопическая полностенная резекция с лапароскопической навигацией сторожевых лимфоузлов. Среди пациентов, получивших ЭПД/ ГЭ, не было выявлено значимых различий по возрасту, полу, сопутствующей патологии или по степени анестезиологического риска, однако в группе ЭАЛ преобладали коморбидные пациенты. Сравниваемые клинические данные включали в себя демографические показатели, характеристику патологии, послеоперационные осложнения, длительность операции и пребывания в стационаре, общую выживаемость. Рис. 4. ЭПД Рис. 5. Навигация лимфоузлов Результаты Продолжительность операции была больше в группе ГЭ [205+/-0.01 мин], чем в группе ЭПД [130.65+/-0.99 мин; p < 0.001], и такая же, как в группе ЭАЛ [204+/-0.8 мин; p>0.01]. В группе ГЭ средняя длительность пребывания в стационаре была больше, чем в группе ЭАЛ или ЭПД [18,5; 12,3; 5,0 дней соответственно; р < 0,001]. После ЭАЛ метастатическое поражение лимфатических узлов выявлено не было ни в одном случае. Периоперационная летальность в группах ЭПД и ЭАЛ равнялась 0. Частота осложнений была достоверно выше в группе ГЭ, особенно 3-5 степеней по шкале Клавьен-Диндо (3 степень – 8%, 5 степень – 4%), чем в группе ЭПД (5 перфораций и 7 отсроченных кровотечений, купированных эндоскопически). Частота метахронного рака была выше в группе ЭПД (10 случаев – 7,1%), чем в группе ГЭ (0 случаев). Частота рецидивов составила 3,5% после ЭПД (из них 2 пациента подверглись хирургическому лечению, 3 – эндоскопической резекции) и 0 после хирургического лечения. Общая 5-летняя выживаемость (для пациентов, получивших лечение до 2015 г.) составила 95% в группе ЭПД и 82% в группе ГЭ (Р<0,001). Заключение В терапии РРЖ ЭПД показала сходные онкологические результаты по сравнению с радикальной ГЭ. Пациенты после ЭПД имели лучшие периоперационные исходы с точки зрения длительности операции, частоты осложнений, продолжительности пребывания в стационаре и общей выживаемости. ЭАЛ с навигацией сторожевых лимфоузлов может быть предпочтительной альтернативой тотальной или субтотальной гастрэктомии у отдельных пациентов. ОСОБЕННОСТИ АНТИКОАГУЛЯНТНОЙ ТЕРАПИИ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА И ЕЕ ВЛИЯНИЕ И ОСЛОЖНЕНИЕ НА ЖКТ Кодиров Ш.С Республиканский специализированный научно-практический медицинский центр кардиологии г. Ташкент, Узбекистан Наиболее весомыми установлены гастропатии, формирующиеся при длительном применении нестероидных противовоспалительных средств (НПВС), угрожающие развитием осложнений со стороны желудочно-кишечного тракта. Эти побочные эффекты НПВС заключаются в том, что они способны в кислой желудочной среде непосредственно проникать в клетки слизистой оболочки (СО). Изменение слизисто-бикарбонатного барьера и обратная диффузия ионов водорода приводят к “контактному” повреждению покровного эпителия. Процессы окислительного фосфорилирования, развивающиеся в результате блокирования ферментных систем митохондрий эпителиоцитов, способствуют снижению устойчивости клеток к агрессивному действию соляной кислоты и пепсина, формированию некробиотических процессов, появлению эрозивно-язвенных процессов, нарушению процессов регенерации слизистой оболочки. Цель исследования Изучить особенности применения антикоагулянтной терапии у больных с ишемической болезнью сердца и выявить неблагоприятное воздействие на желудочно-кишечный тракт. Материал и методы Обследовано 146 больных с ИБС, среди них больных с острым инфарктом миокарда (ИМ) было – 12 (8,22%), с прогрессирующей напряженной стенокардией (ПНС) – 68 (46,57%), напряженной стенокардией (НС, функциональный класс III-IV) – 66 (45,20%) человек. Средний возраст больных составил 56,3±2,4 лет. Всем пациентам с клинически установленной ИБС наряду с общепринятыми клинико-лабораторными и инструментальными исследованиями проводили эзофагогастродуоденоскопию – ЭГФДС (FUJINON2500 и PENTAX5000, Япония), кал на скрытую кровь. Пациенты с ИБС получали традиционную терапию, включающую гепарин (болюс, затем инфузия и подкожное введение), аспирин и клопидогрел (нагрузочные дозы с последующим переходом на поддерживающие). Статистическая обработка произведена в программе Excell-2017. Результаты исследования В настоящем исследовании оценивался “язвенный” анамнез и, уточнялось, было ли осложнение (кровотечение, пенетрация или перфорация). Детализация данных анамнеза позволила установить, что «язвенный» анамнез был выявлен лишь в 22,60% случаев. В остальных случаях по мере возрастания длительности течения заболевания и, соответственно, длительности применения антиагрегантов и антикоагулянтов отмечается прямо-пропорциональная зависимость повышения частоты гастропатии. Необходимо заметить, что при поступлении, после установления тяжести состояния, наличия осложнений, возрастных данных, терапия основного заболевания (ИБС) продолжалась (В-блокаторы, статины, гликозиды, мочегонные), но согласно полученным показателям коагулограммы и формирующимся осложнениям применялись комбинированные виды терапии. Проведенные исследования включали в себя план изучения влияния антиагреганой терапии у пациентов с ИБС, в зависимости от ее формы, выявляемые как у мужчин, так и у женщин. Вследствие этого была определена частота вариантов антиагрегантной терапии у пациентов ИБС с стабильной (1-я группа) и нестабильной (2-я группа) формами. Необходимо отметить, что вариант монотерапии в 1 группе больных не применялся, тогда как данный вид лечения был применен у пациентов 2 группы в 39,39% случаях (26), у мужчин в 7,53%, а у женщин в 1,27% случаях, от общего числа пациентов данных групп, несколько низкими критическими значениями. Двойной вид антиагрегантной комбинированной терапии пациенты 1 группы получили в 15% случаях, тогда как пациенты 2 группы в – 59,09%, когда у мужчин в 29,54%, а у женщинв 5,47%, от общего числа больных в группах, с высокой достоверностью результатов (p<0,001), и низкими критическими значениями. Тройной вид антиагрегантной терапии был применен в 85% случаях пациентам 1 группы и только в 1,51% больным 2 группы, тогда как мужчинам применялся в 38,35%, а женщинам в 8,90% случаях, с высокой степенью достоверности результатов (p<0,001), с высокими критическими значениями выборки, от общего числа больных в группах. Формирование такого грозного осложнения как ЖКК, накладывает определенный отпечаток на течение ИБС, в связи с чем пациентам применялись различные варианты антиагрегантной и антикоагулянтной терапии. Исследованием было выявлено, что при проведении варианта монотерапии у пациентов 1 группы (ИБС. Нестабильная стенокардия) и 2 группы (ИБС. Стабильная стенокардия) явлений ЖКК у 17,20% пациентов не было, а в 18,86% случаях были отмечены осложнения в виде ЖКК. Осуществление метода двойной комбинированной терапии проводилось в 15% пациентам 1 группы и в 59,09% – пациентам 2 группы, с высокой степенью достоверности (p<0,001), и низкими значениями критической выборки, причем явлений ЖКК не отмечено у 44,08% пациентов, когда в 18,86% – обнаружены осложнения ЖКК. В свою очередь, метод тройной комбинированной терапии применялся в основном (85%) пациентам 1 группы, и только в 1,51% – больным 2 группы, с высокой степенью достоверности (p<0,001), и высокими значениями критической выборки Без осложнений ЖКК частота пациентов выявлена в 38,70% случаях, а осложнения ЖКК были определены у 62,26% больных. Выделение больных по возрастным группам показало, что у всех больных пожилого возраста (104 пациента) регистрировалась анемия 1-2 степени тяжести. Легкая анемия (Hb 119-90 г/л) выявлена у 33 (31,7%) пациентов, умеренная (Hb 89-96 г/л) – у 3 (2,88%) человек, тяжелая (Hb <60 г/л) – у 1 (0,96%) пациентов. При изучении данного вопроса, анемия была выявлена 43 (29,45%) наблюдаемых больных и была 1-2 степени. При анализе наличия анемии у наблюдаемых больных ИБС легкая степень анемии (Hb 119-90 г/л) была выявлена у 34 (23,28%) пациентов, умеренная (Hb 89-96 г/л) – у 8 (5,5%) человек, тяжелая (Hb <60 г/л) – у 1 (0,68%) пациентов. Нужно заметить, что достоверность выраженности ане- мического синдрома у пациентов 56-65 лет, как у мужчин, так и у женщин, находятся в прямо пропорциональной зависимости, однако без определенной достоверности результатов и низкими критическими значениями выборки. В группе пациентов 66-75 летнего возраста прямо пропорциональная зависимость также недостоверна по результативности, с более низкими критическими значениями выборки. Заключение Таким образом, возникновение и развитие эрозивно-язвенных поражений у больных с ишемической болезнью сердца в большой степени способствует прием антиагрегантных или антикоагулянтных препаратов. ЖКК, как осложнения поражений желудка и ДПК у больных ИБС в большинстве случаев (47,3%) были ассоциированы с приемом комбинированной терапия антиагрегантами (клопидогрел+аспирин). ЖКК, в свою очередь, способствовали развитию анемического синдрома, при этом легкая степень анемии отмечалась у 23,28%, умеренная – у 5,5% человек и тяжелая – у 0,68% пациентов. ХАРАКТЕРНАЯ ЭНДОСКОПИЧЕСКАЯ КАРТИНА ЭРОЗИВНО-ЯЗВЕННЫХ ПОРАЖЕНИЙ В ЗАВИСИМОСТИ ОТ НАЛИЧИЯ И ОТСУТСТВИЯ ИБС Кодиров Ш.С.1, Даминова Л.Т.2 1 Республиканский специализированный научно-практический медицинский центр кардиологии 2 Ташкентский государственный стоматологический институт г. Ташкент, Узбекистан У больных ИБС наблюдается рост частоты возникновения острых эрозивно-язвенных поражений верхних отделов желудочно-кишечного тракта (ВОЖКТ), обусловленных не только трофическими нарушениями тканей, но и значительным приемом разнообразных препаратов для лечения ИБС (ишемическая болезнь сердца), вызывающих повышение кислотно-пептического фактора и уменьшение секреции слизи, защищающей слизистую оболочку от этих воздействий, в частности, современная лечебная тактика применения антиагрегантной терапии (ААТ), основанная на огромном опыте назначения ацетилсалициловой кислоты (АСК), пероральных непрямых антикоагулянтов, тиенопиридинов и их сочетания. При приеме стандартных доз АСК (75-150 мг) или антагонистов витамина К риск кровотечений увеличивается в 1,8 раза, при назначении клопидогрела – в 1,1 раза. Двойная ААТ сопровождается более высокими показателями относительного риска кровотечений: сочетание АСК и дипиридамола сопровождается увеличением риска развития кровотечений в 2,3 раза; АСК и антикоагулянтов непрямого действия – в 5,3 раза; АСК и клопидогрела – в 7,4 раза. Решение этих вопросов – актуальная задача для профилактического лечения поражений ВОЖКТ (верхнего отдела желудочного кишечного тракта) как при изолированной ИБС. Цель исследования Изучить особенности различия эндоскопической картины гастродуоденальной зоны в зависимости от наличия и отсутствия ИБС. Материалы и методы Обследовано 146 больных с ИБС, среди которых больных с острым инфарктом миокарда (ИМ) было – 12 (8,22%), с прогрессирующей напряженной стенокардией (ПНС) – 68 (46,57%), напряженной стенокардией (НС, функциональный класс III-IV) – 66 (45,21%) человек и 71 больных с хронической язвенной болезнью без ИБС. Средний возраст больных составил 56,3±2,4 лет. Одним из основных задач исследований явилось определение особенности язвенных образований в желудке и ДПК с установлением их характеристики у пациентов с ИБС и без ИБС. С этой целью в ходе обследований пациентов применялась методика ЭГДФС на аппарате FUJINON2500 и PENTAX 5000, Япония. Стандартная техника выполнения метода ЭГДФС не отличалась от известных методов, однако изучение внутреннего состояния пищевода, желудка, ДПК визуализировалось на мониторе компьютера и происходящая картина фиксировалась специальной программой [1,2] и записывалась в память устройства. Вследствие этого, в цветном формате, можно было выделить характер язв, размеры и локализации язв. Статистическая обработка произведена в программе Excell-2017. 261. Достоверность межгрупповых сравнений проводилась с использованием критерия Стьюдента для парных и непарных различий. Результаты и их обсуждение В процессе выполнения работы нами был проведен сравнительный анализ эндоскопические картины ГДЗ у больных ИБС и ЭЯПЖ и ДПК без ИБС. Полученные результаты, показывают наибольшую встречаемость единичных язв у пациентов с ЭЯПЖ без ИБС (81,3%), при высокой достоверности (p<0,001), а множественные язвы были характерны для пациентов с ЭЯПЖ с ИБС (66,44%), также с высокой достоверностью (p<0,001). В то же время как сочетанные язвы более присуще больным с ЭЯПЖ с ИБС. Данный феномен подтверждает известный постулат о влиянии факторов риска и своевременности лечения язвенной болезни. Обращает на себя внимание фактор размеров язв у обследованных пациентов, если малые размеры язв выявлялись в большинстве случаев у пациентов с ЭЯПЖ при ИБС (83,57%), то более крупные язвы (1,1-1,5 см, и 1,6-2,0 см) были присущи пациентам с ЭЯПЖ без ИБС (56% и 14,7% соответственно). Локализация язвенного процесса в антральном отделе желудка и ДПК (63,811% и 23,80% соответственно) является характерной картиной для пациентов с ЭЯПЖ без ИБС, в то время как для пациентов с ЭЯПЖ с ИБС более характерно формирование большинства язв в кардиальном (5,93%) и пилорическом (25,84%) отделах. Более чаще встречаются язвы желудка и ДПК у пациентов с ЭЯПЖ без ИБС с дуоденальногастральным рефлюксом желчи (4,54%). В свою очередь и обсеменённость НР более распространена у этих же пациентов (97,33%). При сопоставлении срока давности язвенного процесса, у пациентов с ЭЯПЖ без ИБС анаместически время язвенной болезни более длительно и встречается чаще (94,6%). Выводы Проведенный анализ показал наибольшую встречаемость единичных ЭЯПЖ у пациентов без ИБС (76,66%), при высокой достоверности (p<0,001), а множественные язвы были характерны для пациентов с ИБС (53,29%), также с высокой достоверностью (p<0,001). В то же время как сочетанные язвы более присуще больным с ЭЯПЖ с ИБС. Данный феномен подтверждает известный постулат о влиянии факторов риска и своевременности лечения язвенной болезни. Литература 1. Кодиров Ш. С., Шек А. Б., Даминова Л. Т., Нурмухамедов Х. К., Уразметов Х. Р., Караханов Н. А. Способ измерения размеров язв желудка и двенадцатиперстной кишки. //Агентство по интеллектуальной собственности Республики Узбекистан. Официальное сообщение (Расмий ахборотнома). 2020. 10(234). С. 13-13. 2. Кодиров Ш. С., Шек А. Б., Курбанов Р. Д., Даминова Л. Т., Нурмухамедов Х. К., Уразметов Х. Р. Система оперативного анализа для постановки высокоточных диагнозов «Gaster-Endoskopics Program» //Патент DGU07867. 2020. Свидетельство об официальной регистрации программ для электронно-вычислительных машин. Агентство по интеллектуальной собственности Республики Узбекистан. РЕДКИЕ ФОРМЫ РАННЕГО РАКА ЖЕЛУДКА: НОВЫЕ ВЫЗОВЫ ДЛЯ ЭНДОСКОПИСТА И МОРФОЛОГА Куваев Р. О.1,2, Кашин С. В.1, Крайнова Е. А.1 1 ГБУЗ ЯО Клиническая онкологическая больница, г. Ярославль 2 ФГАОУ ВО Российский национальный исследовательский медицинский университет им. Н. И. Пирогова Минздрава России г. Ярославль, Москва Актуальность Традиционно в соответствии с гистологической классификацией Lauren [1] рак желудка подразделяется на кишечный и диффузный типы. Однако, до 10% случаев рака желудка имеют другие гистологические особенности, которые не позволяют отнести их к кишечному или диффузному типу [2]. Со временем стало очевидным, что карциномы желудка могут развиваться из различных эпителиальных клеточных линий: поверхностного фовеолярного эпителия, пилорических желез, фундальных желез (главных и париетальных клеток) желудка. Однако, в настоящее время подобные случаи аденокарцином «желудочного фенотипа» остаются мало изученными и требуют дальнейшего многостороннего анализа. Материал и методы В эндоскопическом отделении Ярославской областной клинической онкологической больницы было выявлено и успешно пролечено три случая раннего рака желудка [3,4], имеющих гистологическое строение высокодифференцированной аденокарциномы желудочного фенотипа (1 – из фундальных желез желудка, 1 – из пилорических желез желудка, 1 – из фовеолярного эпителия). Диагностический этап был проведен в соответствии с общепринятыми алгоритмами с использованием современных эндоскопических технологий узкоспектральной визуализации и оптического увеличения (Olympus Exera II, GIF Q160Z, Lucera GIF, Q260Z, EXERA III, GIF HQ 190). Все выявленные новообразования были удалены с помощью методики эндоскопической диссекции по подслизистому слою. Результаты У пациентки 65 лет при эндоскопическом исследовании выявлено приподнятое образование по большой кривизне тела желудка размером 6 мм в диаметре белесоватой окра- ски без четкой демаркационной линии с регулярным сосудистым рисунком и регулярным рисунком микрорельефа, наличием расширенных сосудов на поверхности. Гистологическая верификация – высокодифференцированная аденокарцинома фундальных желез (рост преимущественно из главных клеток фундальных желез). У пациентки 64 лет при эндоскопическом исследовании выявлено приподнятое образование по передней стенке тела желудка размером около 30 мм в диаметре белесоватой окраски с четкой демаркационной линией, незначительно нерегулярным сосудистым рисунком и нерегулярным рисунком микрорельефа. Гистологическая верификация – высокодифференцированная аденокарцинома из пилорических желез. У пациентки 60 лет при эндоскопическом исследовании выявлено приподнятое образование в области кардии размером около 20 мм в диаметре белесоватой окраски c ярко красными участками c ячеистой структурой (изменение «по типу малиновой ягоды» – «raspberry-like lesion»), с наличием четкой демаркационной линии и нерегулярным сосудистым рисунком и регулярным рисунком микрорельефа. Гистологическая верификация – высокодифференцированная аденокарцинома из фовеолярного эпителия. Выводы В данной работе продемонстрированы три редких случая раннего рака желудочного фенотипа: аденокарциномы из поверхностного фовеолярного эпителия, пилорических желез и фундальных желез желудка. Данные новообразования имеют нетипичную эндоскопическую картину и необычные гистологические характеристики, что является причиной плохой диагностики таких образований. С учетом отсутствия отечественных публикаций, описывающих такие случаи, данное сообщение является первым описанием трех основных вариантов аденокарцином желудочного фенотипа в Российской Федерации. Литература 1. Lauren P. The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma. an attempt at a histoclinical classification. Acta Pathol Microbiol Scand. 1965;64:31-49 2. Wu H, Rusiecki JA, Zhu K, et al. Stomach carcinoma incidence patterns in the United States by histologic type and anatomic site. Cancer Epidemiol Biomarkers Prev. 2009;18:1945-1952. 3. Kuvaev R, Kraynova E, Vieth M, Kashin S, Yao K, Yao T. eP77V Well differentiated gastric adenocarcinoma on the base of pyloric gland adenoma. Endoscopy 2021; 53: S121-S122. 4. Kuvaev R, Kashin S, Kraynova E, Yao K, Yao T. OP135V Early gastric adenocarcinoma of the fundic gland (chief cell predominant type): a new challenge for an endoscopist and a pathologist, Endoscopy 2019; 51: S48. СОВРЕМЕННЫЕ ТЕХНОЛОГИИ ИСКУССТВЕННОГО ИНТЕЛЛЕКТА В ДИАГНОСТИКЕ РАННЕГО РАКА ЖЕЛУДКА С ИСПОЛЬЗОВАНИЕМ УВЕЛИЧИТЕЛЬНОЙ УЗКОСПЕКТРАЛЬНОЙ ЭНДОСКОПИИ Куваев Р. О.1,2, Кашин С. В.1, Крайнова Е. А.1, Хрящев В. В.3, Степанова О. А.3, Лебедев А. А.3, Русаков А. И.3, Никонов Е. Л. 2 1 ГБУЗ ЯО Клиническая онкологическая больница, г. Ярославль 2 ФГАОУ ВО Российский национальный исследовательский медицинский университет им. Н. И. Пирогова Минздрава России 3 ФГБОУ ВО Ярославский государственный университет имени П. Г. Демидова, г. Ярославль г. Ярославль, Москва Актуальность Своевременная диагностика рака желудка и последующее лечение является наиболее приемлемой стратегией снижения смертности от рака желудка. Современные методики увеличительной и узкоспектральной эндоскопия позволяют улучшить выявление рака желудка на ранних стадиях [1]. Однако эффективное использование таких методик в клинической практике затруднено вследствие сложности структуры слизистой оболочки желудка и многообразия ее изменений, что требует адекватного обучения врачей. Технологии искусственного интеллекта, широко применяемые для решения разнообразных задач по распознаванию объектов, могут использоваться для автоматизированного анализа эндоскопических изображений и помощи специалистам в правильной интерпретации получаемых данных [2]. Целью настоящего исследования была разработка и тестирование автоматизированной системы идентификации раннего рака желудка на эндоскопических изображениях с использованием сверточных нейронных сетей. Материалы и методы Для решения поставленных задач была создана база эндоскопических изображений, состоящая из 1293 изображений различных образований и изменений слизистой оболочки желудка в узкоспектральном режиме визуализации с оптическим увеличением (Olympus Exera II, GIF Q160Z, Lucera GIF, Q260Z, EXERA III, GIF HQ 190): 357 изображений злокачественных новообразований и 936 изображений доброкачественных образований и изменений. Основой разрабатываемого алгоритма детектирования в рамках данного исследования была выбрана сверточная нейронная сеть SSD (Single Shot Multibox Detector). Реализация архитектуры сети осуществлялась с помощью фреймворка Caffe. Для инициализации части весов свёрточной нейронной сети SSD использовалась модель укороченной нейронной сети VGG-16 для классификации объектов, предварительно обученная на базе изображений Imagenet [3]. Обучение И тестирование алгоритма проводилось параллельно на четырех видеокартах суперкомпьютера NVIDIA DGX-1. Для проведения численного эксперимента из созданной базы были случайным образом отобраны 100 изображений, из которых 24 относились к классу «рак» и 76–к классу «не-рак». Для оценки качества работы алгоритма на видеопотоке был проведен анализ эффективности автоматизированного детектирования на 415 кадрах видеофрагмента эндоскопического исследования в сравнении с экспертной разметкой, выполненной врачом-эндоскопистом. Для оценки качества работы алгоритма рассчитывались следующие значения: Average Precision–AP (усреднение значений точности при разных значениях порога), mean Average Precision– mAP (основная мера качества работы детекторов объектов, представляет собой усреднение значений AP по всем классам). В качестве метрики качества детектирования патологий на кадрах из видеоданных с эндоскопа использовалась метрика Intersection Over Union–IoU (отношение площади пересечения экспертной рамки и рамки, полученной с помощью алгоритма к площади объединения этих рамок). Результаты В соответствии с результатами численного эксперимента AP для класса «рак» составила 0,827, для класса «нерак» – 0,923, mAP для алгоритма – 0,875. При анализе видеопотока среднее значение метрики IoU составляет 0,767, что характеризует высокий уровень соответствия автоматизированной оценки и экспертной разметки. Выводы Предложенный алгоритм, использующий возможности сверточных нейронных сетей, позволяет эффективно проводить анализ эндоскопических изображений с целью идентификации раннего рака желудка. Разработанная автоматизированная система может применяться для анализа видеопотока эндоскопического исследования при интеграции ее в медицинскую систему управления данными. Литература 1. Pimentel-Nunes P., Libânio D., Marcos-Pinto R. et al. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopy. 2019 Apr;51(4):365-388. 2. Kuvaev R., Kashin S. V., Kraynova E., Khryashchev V., Stepanova O., Lebedev A., Rusakov A., Nikonov E. Artificial intelligence methods for diagnosis of early gastric cancer with magnifying narrow band imaging endoscopy. United European Gastroenterology Journal. – 2019, Vol. 7(8S). – p. 814 АНАЛИЗ ЧАСТОТЫ ВЫЯВЛЕНИЯ ЭРОЗИВНО-ЯЗВЕННЫХ ПОРАЖЕНИЙ ВЕРХНИХ ОТДЕЛОВ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА Султанаева З. В., Салимова Л. А. ГБУЗ Республиканский кардиологический центр г. Уфа В статье представлена статистическая картина распространённости эрозивно-язвенных поражений верхних отделов желудочно-кишечного тракта (ЖКТ) среди пациентов, обследованных в эндоскопическом кабинете Республиканского кардиологического центра (РКЦ). Цель исследования Целью работы было эндоскопическое обследование пациентов для изучения частоты выявления эрозивно-язвенных поражений верхних отделов ЖКТ у пациентов РКЦ, находящихся на антиагрегантной и антикоагулянтной терапии, выявления наиболее «рискованных» категорий, а также оптимизации дальнейших мероприятий по диагностике, лечению и диспансерному наблюдению за пациентами. Актуальность Опубликованные к настоящему времени статистические данные разных авторов показывают, что эрозивно-язвенные поражения верхних отделов ЖКТ до сих пор остаются одними из широко распространённых заболеваний, особенно среди пациентов, длительно принимающих антиагреганты и антикоагулянты. Острые эрозивно-язвенные поражения (ЭЯП) верхних отделов желудочно-кишечного тракта являются крайне неблагоприятным дополнительным осложнением и фактором, существенно ухудшающим прогноз жизни больных сердечно-сосудистого профиля, в частности, находящихся в отделении интенсивной терапии. По данным разных авторов, частота ЭЯП у таких пациентов достигает 80-90%, а обусловленных ими желудочно-кишечных кровотечений45-55% . Особую роль в лечении пациентов с болезнями системы кровообращения играет прием таких препаратов, как дезагреганты и антикоагулянты в варианте моно-, двойной и тройной терапии, прием нестероидных противовоспалительных средств (НПВС), интервенционные вмешательства малого и большого объема. Прием препаратов, влияющих на свертываемость крови вместе с исходным фоном повышает риск развития эрозивно-язвенных поражений ЖКТ, больших и малых кровотечений как из ЖКТ, так и других локализаций. Для 30-90% больных характерно бессимптомное течение, для 46-58% – отсутствие типичной и выраженной клинической картины, а у 25-42% пациентов преобладают симптомы основного заболевания. В результате ЭЯП часто остаются не диагностированными, пока неожиданно не проявятся кровотечением, нередко опасным для жизни. Критериями вероятного возникновения эрозивно-язвенного процесса желудка и двенадцатиперстной кишки (ДПК) являются: ИВЛ более 48 часов, коагулопатия, острая печеночная недостаточность, выраженная артериальная гипотензия и шок, сепсис, хроническая почечная недостаточность, алкоголизм, лечение глюкокортикоидами, длительная назогастральная интубация. В связи с вышеизложенным, для дальнейшего планирования и проведения системных диагностических и лечебно-профилактических мероприятий необходим анализ современных результатов исследований о распространённости эрозивно-язвенных поражений верхних отделов ЖКТ, распределении её в различных группах пациентов. Материалы и методы Работа основана на материалах эзофагогастродуоноскопического (ЭФГДС) исследования, проведённо го в течение последних 3-х лет (2017-2019 гг.) пациентам в эндоскопическом кабинете РКЦ. Описана частота встречаемости эрозивно-язвенных поражений верхних отделов ЖКТ по клиническим формам и полу. Исследования выполнялись с помощью фиброэндоскопов Pentax и Olympus. Всего обследован 9546 пациент в возрасте от 1 до 95 лет (до 18 лет – 157 человек), в том числе амбулаторные – 3405, стационарные – 6141. ЭФГДС в плановом порядке выполнено 5212, в экстренном порядке4334. Среди обследованных: мужчин – 5283 (55,3%), женщин – 4263 (44,7%). Результаты При эндоскопическом обследовании 9546 пациентов эрозивно-язвенные поражения (ЭЯП) обнаружены у 3968 (42%) человек. У мужчин на 5283 обследованных ЭЯП выявлены у 2243 человек (42,5%), у женщин на 4263 обследованных ЭЯП выявлена у 1725 человек (40,5%)(Рис.1). Кровотечение, как осложнение ЭЯП было констатировано у 83 (0,9%) пациентов от всего обследованного контингента, 33,7% из них – как осложнение эрозивного поражения желудка (Рис.2а-2б). Эрозии ДПК выявлены у обследованных 687 (7,2%), у мужчин – 388 (4%) у жен- щин – 299 (3,1%). Эндоскопический гемостаз и профилактика геморрагии выполнялись путём инфильтрации в подслизистый слой с помощью эндоскопических инъекторов раствора адреналина на 0,9% физиологическом растворе и наложением клипс на кровоточащий сосуд. Рецидивов кровотечения не было. Рак пищевода по данным патогистологического исследования выявлен в 6 случаях, что составило 0,06% от общего числа обследованных пациентов, рак желудка – в 12 случаях, что составило 0,13% от общего числа обследованных пациентов. Выводы 1. По данным массового эндоскопического обследования ЭЯП выявлены у пациентов в 42% наблюдений. Соотношение мужчин и женщин составляет 1,3:1. 2. Частота развития гастродуоденальных кровотечений у данной категории пациентов составляет 0,9% наблюде- ний. У мужчин кровотечение верифицировано в 2,92 раза чаще, чем у женщин. 3. Эрозии ДПК выявлены у 7,2% обследованных, причём у мужчин в 1,3 раза чаще, чем у женщин. Активного кровотечения из эрозий ДПК за описанный период выявлено не было. 4. Эндоскопический гемостаз и профилактика геморрагии инъекционным и механическим (клипирование сосуда) способами позволили в 100% случаев справиться с ургентной ситуацией. 5. Рак пищевода выявлен в 6 случаях, что составило 0,06% от общего числа обследованных пациентов, рак желудка в 12 случаях0,13% от общего числа обследованных пациентов. Заключение Несмотря на рост частоты эрозивно-язвенный поражений, нерешенность вопросов их профилактики, диагностики и лечения, в последние годы наблюдается тенденция к снижению связанных с ЭЯП смертельных желудочно-кишечных кровотечений. Профилактика и лечебная тактика при первичном кровотечении и рецидивах кровотечения у больных с эрозивно-язвенными поражениями основываются на общих принципах гемостаза желудочно-кишечных кровотечений, но важнейшими компонентами общей стратегии лечения являются коррекция ишемии, последствий ишемически-реперфузионного синдрома и достижение пролонгированного гипоацидного состояния с помощью современных антисекреторных препаратов. РАЗРАБОТКА АЛГОРИТМОВ ОБНАРУЖЕНИЯ ПАТОЛОГИИ ЖЕЛУДКА НА ОСНОВЕ СВЕРТОЧНЫХ НЕЙРОННЫХ СЕТЕЙ (СНС) Хрящев В. В.1, Кашин С. В.2, Меркулова А. О.2,3, Степанова О. А.1, Тарасова Е. Л.2, Среднякова А. С.1, Казина Е. М.1 1Ярославский государственный университет им. П. Г. Демидова, Ярославль 2ГБУЗ Ярославской области Клиническая онкологическая больница, Ярославль 3ГБУЗ НИИ Неотложной детской хирургии и травматологии Департамента здравоохранения города Москвы г. Ярославль, Москва Введение Анализ эндоскопических изображений затруднён ввиду значительной их сложности, низкой контрастности, шума и размытости. Разработка алгоритмов автоматического анализа эндоскопических изображений имеет важное значение в развитии систем поддержки принятия решений в эндоскопии. Цель исследования Разработка и исследование алгоритмов обнаружения патологии на эндоскопических изображениях желудка на основе различных архитектур сверточных нейронных сетей (СНС). Материалы и методы В качестве основы для алгоритмов были выбраны две эффективные архитектуры СНС: Single Shot Detector (SSD) и RetinaNet. С целью формирования базы данных для обучения и тестирования алгоритмов было использовано 54 видеозаписи эндоскопических исследований желудка, из которых был отобран каждый пятый кадр. Собранная база данных эндоскопических изображений включала 5942 кадра. Из-за небольшого размера базы данных эндоскопических изображений мы дополнительно использовали предварительное обучение СНС на изображениях базы данных ImageNet и аугментацию данных. Для оценки качества алгоритмов мы использовали метрики AP (Average Precision) и mAP (Mean Average Precision) как одни из ключевых метрик для анализа качества детектирования объектов. Результаты Все собранные изображения были аннотированы и разделены на три подгруппы: ранний рак желудка (902 изображения), не ранний рак (297 изображений) и доброкачественные изменения: кишечная метаплазия, аденома, гиперпластический полип, эрозия, язва, фовеолярная гиперплазия, ксантома (1772 изображения). База данных была разделена на обучающие (5594 кадра) и тестовые (348 кадров) наборы различных эндоскопических изображений желудка. С помощью нашей базы данных были разработаны, обучены и протестированы алгоритмы обнаружения патологии на эндоскопических изображениях на основе СНС SSD и RetinaNet. Значения метрики AP, рассчитанные для разработанных алгоритмов в различных подгруппах, приведены в таблице 1. Значение mAP составило 0,771 для SSD и 0,808 для алгоритма RetinaNet. Заключение Тестирование показало, что алгоритм на основе RetinaNet превосходит алгоритм на основе SSD по метрике AP для всех подгрупп патологий, рассмотренных в данном исследовании. Значение mAp для алгоритма RetinaNet также было выше, чем для SSD (на 0,037). Полученные значения метрик являются высокими для обоих алгоритмов и доказывают возможность использования СНС для обнаружения патологий на эндоскопических изображениях. Табл. 1 Алгоритмы AP («рак») AP («ранний рак») AP («доброкачественные изменения») SSD 0.642 0.937 0.453 RetinaNet 0.873 0.976 0.524 ЖЕЛУДОЧНО-КИШЕЧНЫЕ КРОВОТЕЧЕНИЯ У БОЛЬНЫХ С ОБЛИТЕРИРУЮЩИМИ ЗАБОЛЕВАНИЯМИ СОСУДОВ НИЖНИХ КОНЕЧНОСТЕЙ Цыганков В. К. Городская больница № 14 г. Санкт-Петербург Атеросклеротическое поражение артерий нижних конечностей достаточно широко распространенное заболевание, составляющее 2-3% от общей численности населения и около 10% лиц пожилого возраста (Покровский А. В., 1999, Степаненко А. Б., 2002). В РФ облитерирующим атеросклерозом сосудов нижних конечностей (ОАСНК) страдают около 3 миллионов человек. В структуре облитерирующих заболеваний атеросклероз сосудов составляет 80-85%, диабетическая ангиопатия 6%. ОАСНК составляет 20% от всех видов сердечно-сосудистой патологии. У лиц старше 50 лет заболеваемость ОАСНК составляет 0,75% населения, старше 65 лет отмечается в 17% (Покровский А. В. с соавт, 2003). Каждый второй пациент, страдающий ОАСНК, умирает в течение 10 лет с момента появления первых симптомов. Актуальность проблемы обусловлена увеличением количества и тяжести осложнений со стороны других органов и систем, в частности верхних отделов желудоч- но-кишечного тракта (ЖКТ). Таким грозным осложнением у больных с ОАСНК является желудочно-кишечное кровотечение (ЖКК). Материалы и методы исследования Проведен прои ретроспективный анализ 876 пациентов, находившихся в больнице на лечении и обследовании с ОАСНК, сахарным диабетом с диабетической ангиопатией (синдром диабетической стопы – СДС) в возрасте от 35 до 90 лет. Пациенты старческого возраста (75-90 лет) составили 15%. Их средний возраст составил 80,3 ± 4,4 лет. Исследование верхних отделов ЖКТ проводили видеогастродуоденоскопом (ВГДС) фирмы «Pentax» (Япония), микропроцессор I-7010 в трех режимах I – scan. Остановку кровотечения осуществляли путем клипирования источника кровотечения с помощью клипс фирмы «Olympus» и EndoStar. Электрокоагуляцию выполняли на электрохирургическом комплексе ESG-100 “OLYMPUS”. Хирургическое вмешательство проводи- Табл. 1 Источник кровотечения Количество больных (n) Число случаев (%) Язва желудка 28 17,7 Язва луковицы 12-ти перстной кишки 32 20,2 Синдром Mallory-Weiss 24 15,1 Синдром Deulafua 3 1,9 Варикозное расширение вен пищевода (ВРВП) 6 3,8 Эрозивный кандидозный эзофагит 16 10,1 Эрозивный геморрагический гастрит 52 32,2 ИТОГО 158 100 ли при безуспешности эндоскопического и системного гемостаза. Оценку язвенного кровотечения оценивали по классификации Forrest J. A.N.1987. Состояние слизистой оболочки верифицировали гистологическими методами исследования. Результаты исследования и обсуждение Эндоскопическое исследование верхних отделов ЖКТ является обьективным критерием состояния слизистой оболочки, оценки возникших образований и характера процесса. При этом все визуальные данные при эндоскопическом исследовании подтверждены результатами гистологического исследования. Из 876 обследованных пациентов с подозрением на острое ЖКК было 204 человека, выявлено с эрозивно-язвенным кровотечением 158 человек. Источники кровотечения определялись в разных отделах ЖКТ, которые представлены в табл. 1. Из таблицы видно, что доля ЖКК у обследованной категории больных составляет 18%. На язвенные кровотечения желудка и 12-ти перстной кишки приходилось 37,9%, эрозивно-геморрагические – 43.1%. Таким образом, 80% кровотечений верхних отделов ЖКТ составляли эрозивно-язвенные поражения СО, остальные 20% – другие источники. Устойчивый эндоскопический гемостаз достигнут в 70% случаев, причем к комбинированным способам остановки кровотечения удалось прибегнуть в большинстве случаев. При активном (продолжающемся) капиллярном кровотечении, что наблюдалось при эрозивных изменениях СО, применялись местно охлажденные растворы разных медикаментозных средств путем орошения. Чаще эрозивные кровотечения не бывали массивными и в большинстве случаев останавливались самостоятельно. В 30% случаев пациентам выполнены хирургические вмешательства. К ним относились больные, поступившие в стационар в экстренном порядке, которым ВГДС не проводилась накануне. При ретроспективном изучении историй болезни выяснилось, что эти пациенты страдали язвенной болезнью желудка и 12ти перстной кишки. Чаще у них выявлялись множественные (3-5) и большие язвенные дефекты (более 2,5 см) с выраженным воспалительно-деструктивным процессом в крае язвы с аррозией крупного сосуда, а также пациенты с низкой социальной адаптацией. Сложности эффективности эндоскопического гемостаза возникали у больных, которым проводились сосудистые оперативные вмешательства, где применялись медикаментозные средства резко изменяющих реологические свойства крови и факторы свертывания системного гемостаза. Вывод Таким образом, у больных с ОАСНК эндоскопический гемостаз при ЖКК верхних отделов ЖКТ достигается в 70% случаев. Эффективный устойчивый гемостаз не достигнут у больных ОАСНК после проведенных сосудистых оперативных вмешательств по причине резких изменений реологических свойств крови и факторов свертывания системного гемостаза. Национальный медицинский ис01едовательский центр имени В. А. Алмазова Институт экспериментальной медицины Рнхи им. проф. А.Л. Поленова (филиал Центра) Институт онкологии И гематологии биологии и генетики СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА РАЗЛИЧНЫХ МЕТОДОВ МИНИМАЛЬНО ИНВАЗИВНОЙ ДЕКОМПРЕССИИ ПРОТОКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ ПРИ СТРИКТУРАХ Аванесян Р. Г., Королев М. П., Федотов Л. Е., Турянчик М. М., Лепехин Г. М., Сабри С. Н., Плетнев М.Ю., Нурмагомедов М.Г. ФГБОУ ВО Санкт-Петербургский Государственный Педиатрический медицинский университет МЗ РФ СПб ГБУЗ Городская Мариинская больница г. Санкт-Петербург Цель исследования Определить эффективность различных методов декомпрессии протока поджелудочной железы при стриктурах последних с использованием антеградных чрескожных и ретроградных эндоскопических операций. Материал и методы За период с 2006 по 2019 гг. в клинике Общей хирургии с курсом эндоскопии СПбГПМУ выполнены минимально инвазивные операции при стриктурах протока ПЖ на фоне хронического панкреатита 88 больным, из которых 50 (56,82%) мужчин и 38 (43,18%) женщин. Средний возраст больных – 46,2 лет. При УЗИ у всех больных выявлены признаки внутрипротоковой панкреатической гипертензии (табл. 1). До госпитализации в клинику 16 больным в анамнезе выполнены различные виды операций, которые представлены в табл. 2. Оценивали интенсивность болевого синдрома у пациентов по шкале вербальных оценок по Hawker G. A., согласно которой отсутствие боли соответствует 0 баллов, слабой боли – 1 балл, средней (умеренной) интенсивности – 2 балла, сильной (выраженной) – 3 балла, нестерпимой – 4 балла. Кроме болевого синдрома у больных со стриктурами протока поджелудочной железы встречались следующие осложнения хронического панкреатита, которые представлены в табл. 3. У 12 больных при билиарной гипертензии выполнены дополнительные операции декомпрессии желчных путей (Табл. 4). Парапанкреатические абсцессы встречались у 4 (4,54%) больных стриктурой протока ПЖ. Во всех случаях парапанкреатические абсцессы были дренированы с применением минимально инвазивных операций под ультразвуковым контролем У 2 больных выполнено дренирование абсцесса печени с применением чрескожных дренажей, устанавливаемых под ультразвуковым контролем (Рис. 1). При стриктурах обеих протоков ПЖ (Рис. 2) нами разработан метод наружно-внутреннего дренирования и главного, и добавочного протоков единым чрескожным доступом (Патент РФ № 2654004 от 22.12.2016 г., Рис. 3). Табл. 1. УЗИ протока ПЖ с определением диаметра последнего Осложнения хронического панкреатита Проток более 2 мм (одноуровневый блок) Проток более 2 мм (многоуровневый блок) Всего больных n % n % n % Стриктура протока ПЖ 73 82,95 15 17,05 88 100 Табл. 2. Перенесенные операции больных до госпитализации в клинику Табл. 3. Осложнения при патологии протоков ПЖ Табл. 4. Виды миниинвазивных операций при механической желтухе Результаты и их обсуждение Для сравнения результатов лечения больных стриктурами протока ПЖ мы провели анализ клинических и лабораторных данных, осложнений в ближайшем послеоперационном периоде у больных 2 групп: 1) пациентов после первичного ретрогардного стентирования протока ПЖ пластиковым стентом, 2) после антеградного наружно-внутреннего дренирования протока (Таб. 5). Проведен анализ интенсивности болевого синдрома у больных до операции и спустя сутки, неделю и месяц после операции. При оценке интенсивности боли на следующий день после операции получены следующие результаты: после ретроградного стентирования протока ПЖ средние показатели боли по шкале были 3,5, после наружно-внутреннего дренирования – 2,8, после наружного дренирования протока – 2. Через неделю шкала боли у больных располагалась следующим образом: после ретроградного стентирования протока ПЖ интенсивность болей была на уровне 3, после наружно-внутреннего дренирования – на уровне 2, после наружного дренирования – 1. Данные анализа уровня боли после различных минимально инвазивных операций при стриктурах протока ПЖ отражены на рис. 4. Разница между интенсивностью болей после ретроградного стентирования и наружного или наружно-внутреннего дренирования протока ПЖ связано со следующими факторами: 1) просвет пластикового стента, устанавливаемого эндоскопическим методом, меньше просвета наружного или наружно-внутреннего дренажа; 2) доступностью к просвету протока ПЖ после антеградных методов дренирования через дренаж, и, как результат, возможность промывать просвет и дренажа, и протока ПЖ. При сравнении результатов диаметра протока ПЖ после ретроградного стентирования и антеградного наружного или наружно-внутреннего дренирования. Больным выполняли УЗИ до операции, спустя 2 дня, через 2 недели и через месяц после декомпрессии протока ПЖ. Полученные результаты отражены в табл. 6. Были также изучены показатели α-амилазы после дренирования протока ПЖ ретроградным и антеградными способами (Рис. 5). Табл. 5. Виды декомпрессии протока ПЖ Вид декомпрессии протока ПЖ N Ретроградное стентирование 33 Предварительное Антеградное наружновнутреннее дренирование протока ПЖ наружное дренирование 5 протока ПЖ 55 Без предварительного наружного дренирования 50 протока ПЖ Всего 88 Рис. 1. Абсцесс левой доли печени после наружновнутреннего дренирования ОЖП (белая стрелка) и протока ПЖ (черная стрелка) Рис. 2. Наружно-внутреннее дренирование протока ПЖ через добавочный проток (белая стрелка). Сохраняется стриктура главного протока ПЖ (черная стрелка) Рис. 3. Наружно-внутреннее дренирование главного и добавочного протоков ПЖ (больной С., ист. бол. № 53002, 2016 г.) Табл. 6. Средние показатели диаметра протока ПЖ до и после декомпрессии протока ПЖ при панкреатической гипертензии Вид декомпрессии протока ПЖ Диаметр протока до декомпрессии Диаметр протока ПЖ через 2 дня после декомпрессии Диаметр протока ПЖ через 2 недели после декомпрессии Диаметр протока ПЖ через месяц после декомпрессии Ретроградное стентирование 7,29 мм 6,26 мм 4,03 мм 4,68 мм Наружное И наружно-внутреннее дренирование 7,88 мм 5,1 мм 3,04 мм 2,41 мм Исследоваие показало, что через неделю и через месяц после наружного и наружно-внутреннего дренирования протока ПЖ показатели α-амилазы крови достоверно ниже, чем после ретроградного стентирования протока ПЖ. Из 33 случаев после ретроградного стенитирования протока ПЖ в 24 выполнили смену стента в период от 6 до 9 недель после первичного стентирования. В 9 из 24 случаях в дальнейшем пластиковый стент заменен наружно-внутренним дренажем. Основными критериями в пользу замены стента в протоке ПЖ являются 2 показателя: расширение протока ПЖ при контрольном УЗИ и возобновление болевого синдрома. При анализе отдаленных результатов ретроградного стентирования стриктуры протока ПЖ отметим возникновение рецидива болей в 24 случаев из 33 в течение от 6 до 9 недель после стентирования. В остальных 9 случаях стенты удалены через 6 месяцев, рецидива стриктуры протока ПЖ не было, боли не возобновлялись. Таким образом, в 72,73% из всех больных после ретроградного стентирования стриктуры протока ПЖ необходима была повторная декомпрессия панкреатической гипертензия. Из 24 больных 9 выполнены антеградные наружно-внутреннее дренирования протока ПЖ, что было связано с рецидивом стриктуры протока ПЖ после удаления стента, что составило 27,27% от общего числа пациентов после ретроградного стентирования протока ПЖ. Судьба 8 больных после ретроградного стентирования протока ПЖ нам неизвестна, 4 больным выполнены операции панкреатикодигестивного шунтирования в различных клиниках. Остальным 3 больным выполняли смену пластикового стента каждые 3-4 месяца. Клинический успех после операции ретроградного стентирования протока ПЖ у больных стриктурой в виде уменьшения болевого синдрома достигнут у 27 больных из 33, что составило 81,82%. Через месяц количество больных, которые отмечали положительный эффект в состоянии, уменьшилось еще на 12, т. е. через месяц количество больных, удовлетворенных результатами лечения было 45,45% от общего числа больных после ретроградного стентирования. Из осложнений после операций ретроградного стентирования протока ПЖ необходимо отметить 2 случая острого панкреатита и 1 случай кровотечения из линии разреза после ЭПСТ. Консервативная терапия в случаях с острым панкреатитом и клипирование кровоточащего сосуда в случае с кровотечением были эффективными. Тяжелых осложнения и летальности в группе с эндоскопическим стентированием протока ПЖ мы не наблюдали. Из 55 больных после антеградного наружно-внутреннего дренирования или стентирования стриктуры протока ПЖ рецидив болей при установленных каркасных эндопротезах возникли у 2 больных. При анализе инструментальных методов исследования (УЗИ и интраоперационной панкреографии) выявлены признаки расширения контрлатерального (не дренированного) протока ПЖ, что было причиной выполнения декомпрессии и второго протока из единого чрескожного доступа по разработанному в клинике методу. Таким образом, если у всех 55 больных после наружного и наружно-внутреннего дренирование протока ПЖ при стриктурах непосредственно после операции в 100% случаев больные отмечали положительную динамику, то уже через месяц у 2 больных возобновились боли в животе в результате стриктуры контрлатерального протока, что можно было расценить как рецидив болевого синдрома и отсутствие клинического эффекта. После дренирования 2-го блокированного протока ПЖ боли были купированы. В остальных случаях тактика ведения больных не отличалась от общепринятой в клинике. Все больные находились под наблюдением, в амбулаторном порядке посещали сотрудников отделения в установленные сроки, а именно: после выписки через 2 недели, через месяц, через 3 месяца и через 6 месяцев. Из 55 больных необходимый диаметр протока ПЖ в области стриктуры достигнут у 54 больных в течение 24 месяцев. Рабочий диаметр протока ПЖ в области стриктуры зависел от начальных величин диаметра супрастенотического расширения протока. В 33 случаях диаметр протока ПЖ в области стриктуры в конечном итоге расширен до 12 F (4 мм), у 19 больных до 10,2 F (3,4 мм), у 2-14 F (4,7 мм). В конечном итоге, после 24 месяцев каркасного наружно-внутреннего дренирования протока ПЖ в области стриктуры, больным выполняли смену дренажа на каркасный пластиковый стент, диаметр которого на 2 F меньше диаметра последнего установленного наружно-внутреннего дренажа. Всем больным через 3 месяца пластиковые стенты извлекали с помощью эндоскопической техники. В течение данного периода времени больному выполняли контрольные УЗИ, при необходимости МРХПГ после удаления пластикового стента (рис. 6). Летальный исход отмечен у одного больного, которому выполнено наружно-внутреннее дренирование протока Уровень значимости b(se) – 0,50(0,23), p=0,035* b(se) – 0,11(0,20), p=0,566 b(se) – 0,43(0,21), p=0,048* b(se) – 2,50(0,22), p<0,001*** Рис. 4. Разница болевого синдрома после различных методов декомпрессии при стриктурах протока ПЖ Рис. 5. Разница показателей α-амилазы после различных методов декомпрессии протока ПЖ до и после операции ПЖ по поводу стриктуры. Причиной летального исхода был эпизод аррозионного кровотечения из мягких тканей парапанкреатической клетчатки через 4 месяца после установленного наружно-внутреннего дренажа. Выводы 1. Антеградное эндопротезирование протока поджелудочной железы является эффективным методом декомпрессии внутрипротоковой панкреатической гипертензии. В сравнении с ретроградным стентированием получены следующие результаты: технический успех реканализации стриктуры протока ПЖ при антеградном вмешательстве составляет 90,91%, при ретроградном – 68,75%; непосредственный клинический успех после операции при антеградном стентировании 100%, при ретроградном – 81,82%. 2. Каркасное антеградное наружно-внутреннее дренирование позволяет в долгосрочной перспективе добиться ремиссии болевого синдрома в 96,36% случаев, тогда как при ретгроградном стентировании болевой синдром через 3 месяца купируется лишь у 27,27% больных. 3. Разработанная методика длительного каркасного дренирования стриктуры протока поджелудочной железы с периодической смены каркасных дренажей и постепенным увеличением диаметра наружно-внутреннего дренажа позволяет избежать рецидива. ПЕРВЫЙ ОПЫТ ПРИМЕНЕНИЯ СУПЕРИМПУЛЬСНОГО ВОЛОКОННОГО ТУЛИЕВОГО ЛАЗЕРА ПРИ КОНТАКТНОЙ ЛИТОТРИПСИИ КОНКРЕМЕНТОВ ОБЩЕГО ЖЕЛЧНОГО И ГЛАВНОГО ПАНКРЕАТИЧЕСКОГО ПРОТОКОВ Будзинский С. А.1,2, Федоров Е. Д.1,2, Шаповальянц С. Г. 1,2, Воробьева Е. А.2, Свирин М. Ю.3, Платонова Е.Н1 1Городская клиническая больница № 31 Департамента здравоохранения г. Москвы РФ 2ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н. И. Пирогова» МЗ РФ 3Компания UMETEX, Москва, Российская Федерация г. Москва Актуальность Последние десятилетия эндоскопические транспапиллярные методики являются «золотым стандартом» при лечении холедохои вирсунголитиаза. В случаях выявления крупных конкрементов желчных и панкреатических протоков, не подвластных традиционным методам их ретроградного удаления, все большее количество авторов рекомендуют применение эндоскопической контактной литотрипсии во время пероральной транспапиллярной холангиопанкреатикоскопии[1,2]. При этом примерно одинаковой эффективностью обладают как лазерная, так и электрогидравлическая литотрипсия – 99,0% и 96,7%, соответственно[3]. Основным аппаратом для внутрипротоковой лазерной литотрипсии желчных и панкреатических камней служит гольмиевый лазер. С 2013 года стали появляться публикации, посвященные возможностям нового вида лазера, в основе действия которого находятся ионы редкоземельного металла тулия. «Тулиевые» лазеры имеют более высокую степень поглощения водой по сравнению с гольмиевыми, что обеспечивает большую способность передачи энергии окружающей водосодержащей среде. В то же время появление суперимпульсного режима, позволяющего модулировать выходящие импульсы в более широком диапазоне по сравнению с классическими импульсными лазерами, по количеству энергии в единичном импульсе, по его продолжительности и частоте, обеспечило более дозированное и прецизионное воздействие на водосодержащую среду, и, в частности, на конкременты, находящиеся в ней. Превосходство именно в этих параметрах и определяет высокую эффективность волоконных суперимпульсных лазеров: до 4-х раз более высокое КПД, а также до 20 раз более широкий диапазон настройки основных параметров. Однако сообщения по применению нового тулиевого лазера посвящены исключительно его возможностям в области урологии [4]. Так, в доступной нам мировой литературе мы не встретили публикаций о возможности выполнения эндоскопической контактной лазерной литотрипсии с использованием именно данного типа лазера в лечении ХЛ и ВЛ. Цель Представление первого успешного опыта и особенностей проведения контактной литотрипсии с применением суперимпульсного фиброволоконного тулиевого лазера у четырех пациентов с крупными конкрементами общего желчного и главного панкреатического протока (ГПП). Материалы и методы С 11.2020 по 04.2021 в нашей Клинике было выполнено 4 вмешательства по поводу крупного холедохoи вирсунголитиаза с применением нового тулиевого лазера. В 3 случаях была успешно проведена контактная литотрипсия конкрементов желчевыводящих протоков и в 1 наблюдении – вирсунголита. Во всех наблюдениях мы использовали одноразовый холангиопанкреатикоскоп SpyGlass DS II (Boston Scientific Company, США) и суперимпульсный фиброволоконный тулиевый лазер FiberLase U2 («ИРЭ-Полюс», Россия) Крупный холедохолитиаз у женщины 80 лет и у мужчины 72 лет осложнил течение хронического калькулёзного холецистита; размеры конкрементов по данным предоперационного обследования составляли 26х28 мм (рис. 1А) и 36х18 мм (рис. 1Б), соответственно. Еще у одной пациентки 61 года холедохолитиаз был проявлением постхолецистэктомического синдрома, а размер камня составил 14х18 мм (рис. 1В). Крупный вирсунголитиаз был выявлен у пациента 50 лет с хроническим калькулезным панкреатитом. Размер единичного конкремента, располагающегося в ГПП на 15-20 мм выше его устья, составлял 18х12 мм (рис. 3А). Результаты У всех трёх больных с холедохолитиазом была выполнена эндоскопическая ретроградная холангиография, папиллосфинктеротомия (ЭПСТ), баллонная дилатация области ЭПСТ, с последующими безуспешными попыт- ками удаления конкрементов традиционными способами с помощью корзинок Дормиа, экстракционных баллонов, а также механических литотрипторов различных размеров. В связи с этим всем пациентам была выполнена транспапиллярная холангиоскопия с контактной литотрипсией конкрементов с помощью суперимпульсного тулиевого лазера. Литотрипсия проводилась преимущественно в режимах «Распыление» и «Попкорнинг» с постепенным увеличением параметров частоты с 40 до 60 Гц и средней мощности с 8 до 12 Вт, при энергии в импульсе 0.2 Дж. Все конкременты обладали высокой плотностью и изначально разрушению подвергались поверхностные слои, а затем их центральная часть (рис. 2). Продолжительность вмешательств составляла от 40 до 65 минут, причем время, потребовавшееся непосредственно на литотрипсию составило от 13 до 28 минут. Пациенту с вирсунголитиазом была выполнена эндоскопическая ретроградная панкреатикография, ЭПСТ, вирсунготомия (ВТ) и баллонная дилатация области ВТ. После этого была выполнена транспапиллярная панкреатикоскопия с внутрипротоковой контактной литотрипсией также с помощью суперимпульсного фиброволоконного тулиевого лазера (рис. 3Б-В). При безопасных настройках частоты и средней мощности от 60 до 100 Гц и от 6 до 10 Вт соответственно, и энергии в импульсе 0.1 Дж был разрушен поверхностный слой конкремента в режиме «Распыление». После этого выполнена фрагментация основного «ядра» вирсунголита в режиме «Попкорнинг» с постепенным увеличением параметров частоты и средней мощности с 40 до 60 Гц и с 8 до 12 Вт, соответственно, при энергии в импульсе 0.2 Дж. Продолжительность вмешательства составила 115 минут, причем время, потребовавшееся непосредственно на литотрипсию – 70 минут. Таким образом, во всех 4-х случаях достаточно быстрая и мелкофракционная фрагментация билиарных и панкреатических конкрементов позволила без технических трудностей выполнить последующую санацию желчевыводящих путей и протоков поджелудочной железы с применением традиционных инструментов. Показательно, что наибольшее время потребовалось для разрушения крупного вирсунголита. Все пациенты были выписаны на 3-4 сутки после вмешательства с выраженной положительной динамикой как клинически, так и по данным лабораторных и инструментальных исследований. Заключение: Наш первый опыт использования суперимпульсного фиброволоконного тулиевого лазера через холангио-панкреатикоскоп для контактной литотрипсии крупных конкрементов общего желчного и главного панкреатического протока завершился полным клиническим успехом во всех случаях. Применение данного методического подхода оказалось максимально эффективным, обеспечив полную санацию протоковых систем печени и поджелудочной железы при использовании подобранных установок работы лазера. При этом, разрушение поверхностных слоев камней начинало происходить уже при первых воздействиях на него лазерного волокна даже на минимальных установках мощности и частоты, но в то же время не травмировало стенку протоковых систем, даже при кратковременном попадании на них действующего луча. Оптимальные режимы лазерного воздействия еще предстоит отработать, в зависимости от размеров и состава конкрементов. Литература 1. Buxbaum J. L., Abbas Fehmi S. M., Sultan S., Fishman D. S., Qumseya B. J., Cortessis V. K., et all. ASGE guideline on the role of endoscopy in the evaluation and management of choledocholithiasis. Gastrointest Endosc. 2019 Jun;89(6):1075-1105.e15. doi: 10.1016/j.gie.2018.10.001. Epub 2019 Apr 9. 2. McCarty T.R., Sobani Z., Rustagi T. Per-oral pancreatoscopy with intraductal lithotripsy for difficult pancreatic duct stones: a systematic review and meta-analysis. Endosc Int Open.2020 Oct;8(10): E1460-E1470. doi: 10.1055/a-1236-3187. Epub 2020 Oct 7. 3. Brewer Gutierrez O. I., Bekkali N. LH., Raijman I., Sturgess R., Sejpal D. V., Aridi H. D. Efficacy and Safety of Digital Single-Operator Cholangioscopy for Difficult Biliary Stones. Clin Gastroenterol Hepatol. 2018 Jun;16(6):918-926.e1. doi: 10.1016/j.cgh.2017.10.017. Epub 2017 Oct 24. 4. Gao B., Bobrowski A., Lee J. A scoping review of the clinical efficacy and safety of the novel thulium fiber laser: The rising star of laser lithotripsy. Can Urol Assoc J. 2021 Feb;15(2):56-66. doi: 10.5489/cuaj.6804. НЕПОСРЕДСТВЕННЫЕ И ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ЭНДОСКОПИЧЕСКОГО ЛЕЧЕНИЯ ПОСЛЕОПЕРАЦИОННЫХ РУБЦОВЫХ СТРИКТУР БИЛИАРНОГО ТРАКТА Будзинский С. А.1,2, Шаповальянц С. Г. 1,2, Федоров Е. Д.1,2, Захарова М. А.2 1Городская клиническая больница № 31 Департамента здравоохранения г. Москвы РФ 2ФГБОУ ВО Российский национальный исследовательский медицинский университет им. Н. И. Пирогова РФ, г. Москва Актуальность Малоинвазивное лечение рубцовых послеоперационных стриктур (РПС) билиарного тракта является предпочтительным методом коррекции нарушения желчеоттока у пациентов, перенесших операции на жёлчных протоках. При этом основным методом, позволяющим добиться хороших результатов без ухудшения качества жизни пациентов, являются эндоскопические ретроградные транспапиллярные вмешательства [1, 2]. Цель Оценить непосредственные и отдаленные результаты эндоскопического лечения пациентов с РПС желчного дерева. Материал и методы Проведён ретроспективный анализ эндоскопического лечения пациентов с РПС билиарного тракта в нашей Клинике за период с 01.1991 по 01.2021 г. Эндоскопические транспапиллярные вмешательства по поводу РПС внепеченочных желчных протоков потребовались у 89 пациентов. Из них женщин было 63 (70,8%), мужчин-26 (29,2%), средний возраст составил 53,2 ± 21,3 года (диапазон 21-88). Суммарно данной группе больных было выполнено 414 вмешательств. Причиной формирования билиарных РПС в 67 (75,3%) случаях послужила травма желчных протоков во время холецистэктомии, в 6 (8,7%) – при гемигепатэктомии, в 4 (4,5%) – при эндоскопической литоэкстракциии крупных конкрементов и их фрагментов неправильной формы, а в 12 (13,5%) наблюдениях РПС развились после трансплантации печени. Чаще всего клинические проявления РПС возникали в первые 12 месяцев после вмешательства на жёлчных протоках: в срок до 3 месяцев – в 22 (24,7%) случаях, 3-6 месяцев – в 20 (22,5%) наблюдени- ях, 6-12 месяцев – у 17 (19,1%) больных. Еще у 15 (16,9%) пациентов клиническая манифестация была зарегистрирована через 1-3 года, у 6 (6,7%) – через 3-5 лет, в 5 (5,6%) наблюдениях – через 5-10 лет, и у 4 (4,5%) человек – более чем через 10 лет после первичной операции на желчном дереве. В большинстве случаев основным клиническим проявлением РПС была острая механическая желтуха, наблюдавшаяся у 82 (92,1%) больных. При этом признаки холангита, или формирование холангиогенного абсцесса имели место у 29 (32,6%) пациентов. Холедохолитиаз был выявлен в 39 (43,9%) случаях, в том числе в 20 (22,5%) наблюдениях конкременты располагались над областью стриктуры. При ретроградной холангиографии «высокие» РПС были обнаружены у 68 (76,4%) пациентов. Согласно классификации Гальперина Э. И. (1984) [3], стриктуры типа 0 встречались в 6 (8,8%) случаях, I типа– в 34 (50%), а II – в 28 (41,2%) наблюдениях (Рис. 1А-В). В остальных 21 (23,7%) случае были выявлены «низкие» и «средние» окклюзии (Рис. 1Г). Среди них стриктуры супрадуоденального отдела холедоха выявлены у 18 (85,7%) больных, ретродуоденального отдела холедоха – 2 (9,5%), интрапанкреатической части холедоха – у 1 (4,8%) пациента. Результаты Эндоскопическое лечение РПС желчного дерева подразумевало под собой выполнение этапного билиодуо- денального дренирования с постепенным увеличением количества стентов с целью надежного расправления области окклюзии с поддержанием размещения наибольшего количества эндопротезов в просвете желчных протоков на срок не менее 12 месяцев. Данный технико-тактический подход после предварительного выполнения ЭПСТ и эндоскопического бужирования зоны сужения (Рис. 2) оказался осуществим в 72 (80,9%) наблюдениях. При этом в 68 (76,4%) случаях вмешательство было выполнено традиционным ретроградным способом, а в 4 (4,5%) наблюдениях при технической невозможности преодоления РПС транспапиллярно через эндоскоп было выполнено вмешательство по типу «Рандеву» с предварительным прохождением и бужированием области окклюзии через чрескожно-чреспеченочный доступ. Дополнительная баллонная дилатация области стриктуры потребовалась в 35 (39,3%) случаях (Рис.3). В 7 (7,9%) наблюдениях (2018-2020 гг) проводилась пероральная транспапиллярная холангиоскопия с целью визуальной оценки области сужения и выявления наличия инородных структур в толще стенки желчных протоков, которые могли снизить эффективность эндоскопического лечения. Данная процедура позволила выявить наличие клипсы в 1 случае и шовного материала в 2. У всех больных удалось успешно удалить инородные тела под сочетанным эндоскопическим и рентгенологическим контролем. Билиарное стентирование пластиковыми стентами с постепенным увеличением количества эндопротезов (максимально 6) выполнялось 71 (98,6%) пациенту (рис.4 А-Б), в одном случае (1.4%) был установлен полностью покрытый саморасширяющийся билиарный стент. В остальных 17 наблюдениях выполнить билиарное стентирование не удалось. Объем вмешательств у данной группы больных ограничился проведением изолированной ЭПСТ в 6 (6,7%) случаях, а также ЭПСТ с частичным эндоскопическим бужированием стриктуры в 11 (12,4%) наблюдениях, что, однако, не позволило установить билиодуоденальный эндопротез. Основными причинами неудач стали выраженная ангуляция зоны окклюзии и протяженность сужения, которые в большинстве случаев (13) сочетались друг с другом. Осложнения эндоскопических вмешательств по поводу РПС желчного дерева возникли в 6 (6,7%) наблюдениях (кровотечение – 2, острый постманипуляционный панкреатит – 2, ретродуоденальная перфорация – 2). Пять (83.3%) из них были успешно ликвидированы эндоскопически (комбинированный эндоскопический гемостаз, неотложное панкреатическое стентирование, а также клипирование области перфорации). Один (16.7%) пациент с кровотечением из области ЭПСТ был прооперирован; в данном случае имел место летальный исход. Летальность в анализируемой группе больных составила 1,1%. Таким образом, хорошие непосредственные результаты, заключавшиеся в разрешении острой механической желтухи, холангита и начатом этапном эндоскопическом лечении, были получены у 72 (80,9%) пациентов. В 9 (10,1%) случаях, при технической невозможности эндоскопического билиарного стентирования успешное эндоскопическое бужирование обеспечило частичное дрени- рование жёлчных протоков, что позволило подготовить пациентов к плановому хирургическому вмешательству, что оценивалось нами, как удовлетворительные результаты. В свою очередь, в 8 (9,0%) наблюдениях разрешить явления механической желтухи не удалось, что потребовало проведения срочного хирургического лечения у 7 пациентов, а в 1 случае, учитывая возникшее осложнение, привело к летальному исходу. При проведении этапного лечения плановые вмешательства проводились каждые 2-6 месяцев в зависимости от количества и общего диаметра ранее установленных билиарных стентов. Средняя продолжительность лечения составила 18+6,9 месяцев (от 12 до 29). Отдаленные результаты были оценены у 53 из 72 (73,6%) пациентов, прошедших этапное эндоскопическое лечение РПС желчного дерева. Еще 5 больных продолжают курс эндоскопической коррекции в настоящее время, а 14 человек для контроля оказались недоступны. Медиана наблюдения в контрольной группе составила 8,5 +5,9 лет (диапазон 1-25 лет). Хорошие результаты (отсутствие признаков нарушения оттока жёлчи и рецидива стриктуры) были получены у 47 из 53 (88,7%) пациентов; удовлетворительные (рецидивирующий холедохолитиаз) – у 4 (7,5%) больных; плохие (рецидив РПС через 6 и 19 месяцев после завершения эндоскопического лечения) – в 2 (3,8%) случаях. Заключение Эндоскопическое лечение РПС билиарного тракта, являясь методом первого выбора, позволяет по нашим данным достичь непосредственного технического успеха в 80,9% случаев (72/89). При этом этапное эндоскопическое лечение с применением билиарного рестентирования позволило добиться хороших и удовлетворительных отдаленных результатов у 96,2% из 53 доступных для контроля пациентов, которым эндоскопическая терапия была проведена в полном объеме при среднем сроке наблюдения 8,5 лет. Литература 1. Wong MY, Saxena P, Kaffes AJ. Benign Biliary Strictures: A Systematic Review on Endoscopic Treatment Options. Diagnostics (Basel). 2020 Apr 15;10(4):221. doi: 10.3390/diagnostics10040221. PMID: 32326542; PMCID: PMC7235774. 2. Yang Q, Liu J, Ma W, Wang J, Li F, Bramer WM, Peppelenbosch MP, Pan Q. Efficacy of Different Endoscopic Stents in the Management of Postoperative Biliary Strictures: A Systematic Review and Meta-analysis. J Clin Gastroenterol. 2019 Jul;53(6):418-426. doi: 10.1097/ MCG.0000000000001193 3. Гальперин Э. И., Кузовлев Н. Ф., Карагюлян С. Р./Рубцовые стриктуры желчных протоков / – М.: Медицина, 1982. – 240 с. ОДНОМОМЕНТНОЕ БИЛОБАРНОЕ БИЛИАРНОЕ ПРОТЕЗИРОВАНИЕ САМОРАСШИРЯЮЩИМИСЯ СТЕНТАМИ ПРИ ПРОКСИМАЛЬНОЙ ОПУХОЛЕВОЙ СТРИКТУРЕ КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ Быков М. И., Гобаева С. Л., Таран А. А. ГБУЗ НИИ-ККБ № 1 им. С. В. Очаповского, МЗКК. г. Краснодар Диагностика и лечение проксимальных опухолевых стриктур желчевыводящих протоков (ЖВП) остается одной из актуальных проблем современной гепатобилиарной хирургии. На сегодняшний день не вызывает сомнения превосходство миниинвазивных технологий вмешательств, и как в плане первичной предоперационной билиарной декомпрессии, так и в качестве метода окончательного лечения в группе инкурабельных больных. Анализируя последние европейские клинические рекомендации по эндобилиарному стентированию, следует отметить, что многие исследователи не выделяют различий в тактике выбора способа дренирования в зависимости от уровня блока ЖВП и предопределяют ретроградный эндоскопический метод декомпрессии, как первичный. В то же время данный вопрос остается предметом мультидисциплинарной дискуссии большинства научных конференций, так как единого подхода и взвешенных рекомендаций по данному вопросу не выработано. Цель Определить новые возможности эндоскопических транспапиллярных методов диагностики и лечения у больных с проксимальными билиарными стриктурами опухолевой этиологии. Материалы и методы В данном клиническом наблюдении с целью дифференциальной диагностики этиологии билиарной стриктуры, а также детализации уровня поражения ЖВП применя- лась методика пероральной холангиоскопии с помощью видеоцифровой системы Spyglass. При выполнении холангиоскопии под непосредственно визуальным контролем с помощью адаптированного инструмента Spybite произведена щипцевая биопсия внутрипротокового новообразования, определены точные границы билиарного поражения, а также осуществлена селективная канюляция долевых печеночных протоков струнами-проводниками с целью последующего их протезирования. В качестве окончательного метода билиарной декомпрессии выполнено билобарное протезирование ЖВП саморасширяющимися металлическими стентами (модель – Hanarostent BNHS-06-100-180) с одномоментным параллельным заведением двух доставочных устройств. Клиническое наблюдение Пациентка Ш. 65 лет, поступила в клинику с диагнозом: злокачественное новообразование общего желчного протока сТ 2NxMx, 2 кл. группа, механическая желтуха. В общеклиническом анализе крови отмечалась гипербилирубинемия – 367 мкмоль/л. На трансабдоминальном ультразвуковом исследовании (ТА УЗИ) и компьютерной томографии было выявлено новообразование на уровне общего печеночного протока (ОПП), гидроперитонеум (рис. 1). При выполнении эндоскопической ретроградной холангиографии диагностирована стриктура ОПП, классифицировать которую между I и II типом по BismuthCorlette было затруднительно (Рис. 2). С целью дифференциальной диагностики этиологии выявленной стриктуры ЖВП после предварительно выполненной эндоскопической папиллосфинктеротомии проведена пероральная холангиоскопия с применением системы Spyglass. В области выявленной на холангиографии стриктуры ОПП визуализировалось сужение просвета до 1-2 мм в диаметре, отмечалось наличие папиллярных, в том числе узловатых выступающих изменений слизистой протока без четких границ, нерегулярный микрорельеф эпителия, выраженная контактная кровоточивость, а также признаки фрагментации при биопсии (рис. 3 и 4). Кроме этого применение холангиоскопии позволило определить проксимальную границу опухоли, детализировать Рис. 1. ТА УЗИ. Эхо-признаки новообразования ЖВП (указано стрелкой) Рис. 2. Холангиограммы. Стриктура общего печеночного протока (указана стрелкой) Рис. 3. Холангиоскопия. Макроскопические признаки опухолевой стриктуры ОПП Рис. 4. Холангиоскопия. Щипцевая биопсия под визуальным контролем Рис. 5. Холангиоскопия. Определение проксимальной границы опухоли Рис. 6. Холангиоскопия. Проведение струны под визуальным контролем отсутствие вовлечения долевых печеночных протоков, что дало возможность классифицировать уровень поражения, как I тип по Bismuth-Corlette (Рис. 5). Учитывая локализацию выявленного поражения ЖВП, а также отказ решением онкологического консилиума от проведения радикального хирургического лечения, методом выбора окончательной билиарной декомпрессии являлось выполнение билобарного протезирования непокрытыми саморасширяющимися металлическими стентами (СМС). Под контролем холангиоскопии выполнена селективная канюляция внутрипеченочных протоков правой и левой доли печени (Рис. 6 и 7). Учитывая наличие объективных технических трудностей при установке стентов у больных с проксимальным уровнем опухолевой обструкции ЖВП, в большинстве случаев у пациентов данной группы следует выполнять реканализацию зоны стриктуры общего печеночного и при необходимости долевых протоков с помощью билиарных бужей и\или баллонных дилататоров. В данном клиническом наблюдении выполнена последовательная баллонная дилатация стриктуры с помощью билиарных дилататоров диаметром 6 и 8 мм. Сложность одномоментной имплантации нескольких эндопротезов при билобарном ретроградном дрениро- вании проксимальных билиарных стриктур обычно вынуждает отдавать предпочтение пластиковым стентам небольшого диаметра (7-8,5 Fr), однако относительно небольшие сроки их функционирования предопределяют необходимость повторных госпитализаций с целью рестентирования. Имплантация СМС при билобарном протезировании технически не всегда успешна в связи с частым возникновением затруднений при проведении второго доставочного устройства на этапе раскрытия первого стента. В связи с чем при наличии показаний к билобарному протезированию СМС наиболее эффективной представляется инновационная методика одномоментного заведения двух доставочных устройств с последующим их последовательным раскрытием. Для этого необходимо использовать СМС, находящиеся в доставочных устройствах небольшого диаметра (5,9 Fr), что и было впервые применено в данном наблюдении (Рис. 8). Послеоперационный период протекал без осложнений, при выписке больной общий билирубин крови – 79 мкмоль/л. Результаты патогистологического и иммунногистохимического исследования – аденокарцинома (фрагменты стенки желчного протока с грубым фиброзом с дискретным расположением опухолевых клеток и атипичных желез в стенке, клетки эпителия в исследованном материале экспрессируют Cytokeratin 7, пролиферативная активность выявлена в большинстве клеток). Заключение Таким образом, на основании применения комплекса современных эндоскопических методов диагностики и лечения, включавших в себя эндоскопическую холангиографию, диагностическую пероральную холангиоско- пию с внутрипротоковой биопсией, а также билобарное протезирование ЖВП с помощью СМС был выставлен и верифицирован диагноз злокачественного поражения ОПП, выполнено окончательное малоинвазивное лечение опухолевой проксимальной билиарной компрессии, а также получены перспективы для проведения таких паллиативных вмешательств, как внутрипротоковая радиочастотная абляция и фотодинамическая терапия. ДИАГНОСТИЧЕСКАЯ И ЛЕЧЕБНАЯ ПАНКРЕАТОСКОПИЯ. НОВЫЙ ВЗГЛЯД НА СТАРУЮ ПРОБЛЕМУ Габриэль С. А., Дынько В. Ю., Крушельницкий В. С., Кулагин В. В., Мамишев А. К. ГБУЗ ККБ № 2 г. Краснодар Введение За последние годы отмечается рост количества пациентов с хроническим панкреатитом. После перенесенного острого деструктивного панкреатита у 50-60% больных наблюдается хронизация процесса с развитием различных осложнений, таких как панкреатолитиаз (вирсунголитиаз), стриктуры различных отделов главного протока поджелудочной железы (ГППЖ) и нарушение непрерывности протока поджелудочной железы, ложные кисты и панкреатические свищи. В большинстве случаев эти осложнения способствуют стойкой внутрипротоковой гипертензии поджелудочной железы, являющийся основной причиной упорного болевого синдрома и инвалидизации пациентов. Трудности хирургической коррекции, значительное число неудовлетворительных результатов, снижение качества жизни пациентов после традиционных операций заставляют искать новые пути в лечении данной группы больных. С развитием малоинвазивных технологий лечение многих патологических состояний поджелудочной железы стали выполняться малоинвазивно, с применением эндоскопических технологий, вершину которых заняла панкреатоскопия (ПС). Цель работы Показать возможности и эффективность как диагностической, так и лечебной панкреатоскопии у пациентов с патологией поджелудочной железы Материалы и методы В отделении эндоскопии ГБУЗ «ККБ№ 2» города Краснодара у пациентов с обструктивными поражениями ГППЖ применяется как диагностическая, так и лечебная панкреатоскопия. Диагностическая ПС выполняется для установления или морфологического подтверждения диагноза. К лечебным ПС относятся: проведение проводника за область стриктуры с целью выполнения бужирован, проведение различных видов литотрипсии панкреатолитов (электрогидравлическая или лазерная литотрипсия). Для проведения панкреатоскопии применяли две системы: Наиболее ранней системой для проведения ПС был панкреатоскоп СHF-BP30 производства Olympus (Япония). Аппарат является фиброволоконным, для вывода изображения на монитор использовали дополнительный видеоадаптер. В дальнейшем компания Boston Scientific Company (США) представила электронную систему дочернего эндоскопа (система SpyGlass DS) с набором инструментов: биопсийные щипцы и ультрантонкая корзинка Дормиа для проведения биопсии из опухолевого субстрата или литоэкстракции вирсунголитов под контролем зрения. С 2012 по 2021 годы в отделении эндоскопии ГБУЗ «ККБ№ 2» было выполнено 44 панкреатоскопии. Результаты и обсуждения Из 44 панкреатоскопий было выполнено 10 диагностических манипуляций (при этом в одном случае была взята биопсия под визуальным контролем). Лечебных ПС было выполнено 19, их них у 15 пациентов была выполнена контактная электрогидравлическая литотрипсия (ЭГЛТ) конкрементов ГППЖ, у 3 пациентов бужирование стриктур ГППЖ, у 1 пациента балонная дилятация стриктуры ГППЖ. В одном случае была выполнена литоэкстракция вирсунголита под визуальным контролем при помощи ультратонкой корзинки типа Дормиа. Неудачных манипуляций было 14: в 2 случаях не удалось провести бужирование стриктур ГППЖ, 2 неудачи проведение ЭГЛТ, в 10 случаях не удалось провести панкреатоскопию (в 1 случае в свзяи с отеком слизистой ГППЖ, в 7 случаях в связи со стриктурой дистального отдела и в двух случаях в связи с блоком дистального отдела ГППЖ. Осложнений ПС было 5 (11,4%): в трех случаях (6,8%) острый постманипуляционный панкреатит (ОПМП), в 1 случае (2,3%) панкреонекроз и в 1 случае (2,3%) перфорация Рис. 3. КТ 20.12.20 холангиогенные абсцессы печени Рис. 5. КТ 07.03.21 в просвете правого долевого протока пластиковый стент, внутрипеченочные абсцессы отсутствуют Рис. 4. КТ 20.12.20 холангиогенные абсцессы печени Рис. 6. КТ 07.03.21 в просвете правого долевого протока пластиковый стент, внутрипеченочные абсцессы отсутствуют Рис. 7. Стриктура общего печеночного протока Рис. 8. Конкремент блокирующий левый долевой проток Рис. 9. Конкремент в сегментарном протоке правой доли печени Рис. 10. Удаление конкрементов корзиной Micro-Catc Рис. 11. Удаление конкрементов корзиной Micro-Catch Рис. 12. Удаление конкрементов корзиной Micro-Catch ГППЖ. Все пациенты были пролечены консервативно и выписаны из стационара в удовлетворительном состоянии. Итого эффективных вмешательств было 30 (68,2%), неэффективных 14 (31,8%). Осложнения были отмечены у 5 пациентов (11,4%) Выводы 1. Панкреатоскопия относится к эффективным и высокотехнологичным методам диагностики и лечения при заболеваниях поджелудочной железы. Эффективность по нашим данным достигает 68,2%. 2. Данные вмешательства выполняются, когда традиционные методы диагностики и лечения оказываются не эффективными 3. Наличие инструментального канала и биопсийных щипцов для взятия прицельной биопсии позволяет установить точную локализацию опухолевого процесса с ее гистологической верификацией. 4. Контактная электрогидравлическая литотрипсия – высокотехнологический метод, позволяющий выполнить малоинвазивное лечение у пациентов с панкреатолитиазом (с эффективностью, по нашим данным до 88,2%). При этом наличие ультратонкой корзинки Дормиа позволяет провести литоэкстракцию фрагментов разрушенных конкрементов под контролем зрения. 5. Прямая визуализация у пациентов с доброкачественными рубцовыми стриктурами повышает возможность их малоинвазивного лечения. ХОЛЕДОХОЛИТОЭКСТРАКЦИЯ СИСТЕМОЙ SPYGLASS ПРИ РЕЗИДУАЛЬНОМ ХОЛЕДОХОЛИТИАЗЕ И ПОСЛЕОПЕРАЦИОННОЙ СТРИКТУРЕ ОБЩЕГО ПЕЧЕНОЧНОГО ПРОТОКА Гладышев Д. В., Попов К. И., Болдырева Е. В., Рыженкова И. С., Эфендиев А. О., Трусов И. А., Врублевская С. Н., Лоханова М. А. СПБ ГБУЗ Городская больница № 40 г. Санкт-Петербург, г. Сестрорецк г. Санкт-Петербург, г. Сестрорецк ■ Гладышев Д. В. ■ Попов К. И. ■ Болдырева Е. В. ■ Трусов И. А. Возможности электронной видеосистемы SpyGlass (Boston Scientific Company, США) (рисунок 1) широко используются в диагностике и лечении резидуального холедохолитиаза. Внешний диаметр SpyScope 3,34 мм, диаметр рабочего канала 1,2 мм. Малый диаметр аппарата позволяет осмотреть долевые, сегментарные желчные и главный панкреатический протоки, а наличие инструментального канала дает возможность выполнять прицельную биопсию и лечебные манипуляции. В настоящий момент в России не зарегистрированы корзины Boston Scientific Company, совместимые с системой SpyGlass для удаления конкрементов под контролем холедохоскопа. Для удаления конкрементов впервые в нашей стране была использована нитиноловая корзина «Micro-Catch» (MTW, Германия), диаметр тубуса 1 мм, длина 240 см. (рисунок 2). Клиническое наблюдение В СПБ ГБУЗ «Городская больница № 40» поступила пациентка К. 32 лет с клинической картиной механической желтухи и холангита. 13.05.2014 года в больнице другого региона в экстренном порядке выполнена лапароскопическая холецистэктомия, дренирование брюшной полости по поводу флегмонозного калькулезного холецистита. В раннем послеоперационном периоде появились признаки биллиарной гипертензии с подъемом прямого билирубина до 106 mmol/l. МСКТ: блок на уровне проксимальных отделов холедоха, биллиарная гипертензия. 16.05.2014 года выполнена неудачная попытка ЭРХПГ. На фоне проводимой консервативной терапии – без положительной динамики. 26.05.2014 года выполнена операция: диагностическая лапароскопия, на которой верифицировано повреждение холедоха. операция завершена наружным дренированием холедоха Т-образным дренажем. 28.05.2014 года пациентка выписана с улучшением. Через месяц удален дренаж из подпеченочного пространства. В 2019 году удален Т-образный дренаж из холедоха. В течении года пациентка жалоб не предъявляла. 20.12.2020 года больная отметила повышение температуры до 40 гр. С, в экстренном порядке была госпитализирована в СПБ ГБУЗ «Городская больница № 40». КТ картина: выраженная биллиарная гипертензия на фоне конкрементов общего печеночного протока, пневмобилия, холангиогенные абсцессы печени (рисунок 3, 4). В анализах крови лейкоцитоз 30,49 10^9/л, билирубинемия 85,6 мкмоль/л. В экстренном порядке выполнено ЭРХПГ: при контрастировании холедох 0,7 см, в области общего печеночного протока стриктура протяженностью 0,4 см, суживает просвет до 0,3 см, долевые протоки расширены до 0,9 см, в просвете холедоха и общего печеночного протока конкременты до 0,8 см. в диаметре. Выполнена литоэкстракция конкрементов из холедоха дистальнее стриктуры корзиной Дормиа. Удалить конкременты из общего печеночного протока не удалось. После баллонной дилятации стриктуры в правый долевой проток установлен пластиковый стент 7 Fr. 12 см., в левый долевой проток установлен назобилиарный дренаж. В хирургическом отделении пациентка получала инфу- зионно-дезинтоксикационную, спазмолитическую, антисекреторную, антибактериальную терапию, на фоне которой отмечена положительная динамика. На 15-е сутки удален назобилиарный дренаж. Выписана на 20-е сутки в удовлетворительном состоянии. 07.03.2021 года пациентка госпитализирована в плановом порядке. КТ от 07.03.2021 года: внутрипеченочные желчные протоки расширены, в общем печеночном протоке единичные (до 3) конкременты диаметром до 8 мм., в просвете правого долевого протока пластиковый стент, внутрипеченочные абсцессы отсутствуют (рисунок 5, 6). 08.03.2021 года выполнено ЭРХПГ, холангиоскопия с использованием системы SpyGlass: стриктура протяжённостью 3 мм. общего печеночного протока (рисунок 7). SpyScope проведен за стриктуру, левый долевой проток блокирован конкрементом 0,8 см. в диаметре (рисунок 8), пройти за конкремент не удалось. В сегментарном протоке правой доли печени визуализирован конкремент 0,5 см. в диаметре (рисунок 9). Через рабочий канал SpyScope проведена корзина «Micro-Catch» (MTW, Германия), под контролем зрения конкременты захвачены корзиной и удалены (рисунок 10, 11, 12). При контрольном осмотре в долевых и сегментарных желчных протоках конкрементов нет. Холедох протезирован пластиковым стентом 10 Fr. 12 см. Послеоперационный период без осложнений. 15.03.2021 года выписана в удовлетворительном состоянии. Выводы 1. Внедрение системы SpyGlass при сложных стриктурах гепатикохоледоха и внутрипеченочного холелитиаза является современной альтернативой сложным полостным операциям, снижает травматичность вмешательства и сроки госпитализации. 2. Нитиноловая корзина «Micro-Catch» (MTW, Германия) совместима с системой SpyGlass (Boston Scientific Company, США), расширяет ее возможности в лечении холедохои вирсунголитиаза. ЖЕЛЧЕИСТЕЧЕНИЕ И НАРУЖНЫЙ ЖЕЛЧНЫЙ СВИЩ: КОГДА ХИРУРГИЯ, А КОГДА ЭНДОСКОПИЯ? Жданов А. В., Корымасов Е. А., Барилко Е. В., Лежнев М. А. ФГБОУ ВО СамГМУ Минздрава России, СамГМУ ЧУЗ Клиническая больница РЖД-медицина г. Самара Введение Желчнокаменная болезнь, осложненная холециститом, является одной из распространенных проблем современной хирургии. Ежегодно в нашей стране проводится большое количество хирургических вмешательств по поводу ЖКБ. Частота осложнений при этом достаточно низкая, однако случившиеся осложнения несут жизнеугрожающий характер. Количество осложнений резко возрастает при проведении операций на внепеченочных желчных протоках. Одним из таких осложнений является формирование желчного свища. Классическая хирургия диктует в этом случае проведение наружного дренирования желчных протоков, либо реконструктивные операции на желчных путях, что несет в себе дополнительный риск и ухудшение качества жизни больного. Материал и методы Анализирован опыт лечения пациентов с послеоперационными наружными билиарными свищами (n-22). В двух случаях наблюдали пациентов с наружными билиарными свищами, сформировавшимися после выполнения холедохолитомии и дренирования желчного протока по Керу. В обоих случаях наблюдалась несостоятельность холедохостомы и формирование наружного желчного свища. Пациентам предпринимались попытки лечения патологии, традиционным хирургическим способом. Выполнена релапаротомия, повторное формирование холедохостомы. Однако несостоятельность холедохостомы вновь проявлялась, и наблюдалось формирование рецидивного наружного желчного свища. У 8 пациентов наблюдали желчеотделение после выполненной лапароскопической холецистэктомии. При этом уже в ближайший послеоперационный период наблюдалось поступление желчи из дренажа подпеченочного пространства. У од- ного пациента наблюдалось желчеистечение после правосторонней гемигепатэктомии, при этом свищевой ход существовал более 1.5 месяцев без тенденции к закрытию и имел хронический характер. У 12 пациентов наблюдалась негермитичность холедохостомы и отделение желчи помимо дренажа холедоха. При возникновении желчного отделяемого по дренажу из подпеченочного пространства у пациентов после релапаротомии по поводу несостоятельности холедохостомы, проводили транспапиллярное вмешательство и оценивали размер дефекта холедоха. В обоих случаях был выявлен дефект стенки протока более одного сантиметра длинной. При этом дренаж желчного протока не выполнял своей функции. Желчь отделялась через дефект стенки холедоха и улавливалась контрольным дренажом. Далее выполнялось удаление холедохостомы, выполнялась папиллотомия и устанавливался полностью покрытый билиарный саморасширяющийся стент диаметром 1 см. Стент позиционировался таким образом, чтоб его проксимальный конец находился на 2-3 см выше области дефекта холедоха, но не выше области бифуркации желчных протоков. Стент размещался в холедохе на срок, не превышающий один месяц с момента удаления контрольного дренажа и полного прекращения поступления желчи. Удаление стента производилось в плановом порядке во время ЭГДС. Далее производили контрольную холангиографию. В случаях наблюдения желчеистечения после лапароскопической холецистэктомиии, в 7 случаях из 8 было обусловлено не герметичностью пузырного протока. В 1 случае выявлен дефект стенки холедоха длинной около 8мм в проекции пузырного протока. При этом не наблюдалось расширения холедоха более 7мм ни в одном случае. Вероятно, причиной несотоятельности культи пузырного протока было не плотное клипирование. Пациентам ука- Рис .1. Резидуальный холедохолитиаз, негерметичность культи пузырного протока Рис .2. Резидуальный холедохолитиаз, негермитичность культи пузырного протока занной группы произведено стентирование холедоха пластиковым стентом 10fr диаметром необходимой длины. Верхний край стента позиционировался выше пузырного протока на 2-3 см. При этом допускалось расположение проксимального края стента в долевых протоках печени. Стент удалялся через 1 мес после прекращения поступления желчи по контрольному дренажу. Контрольный дренаж брюшной полости удалялся сразу после прекращения поступления желчи. Мы наблюдали дистальную миграцию билиарного стента у двух пациентов. Этим больным производилось рестентирование холедоха пластиковым стентом большей длинны. Стентирование холедоха пластиковым эндопротезом так же выполнялось всем пациентам с негермитичностью холедохостомы. Во всех описанных случаях, удалось выполнить стентирование холедоха, технический успех был 100% Результаты и обсуждения Установка саморасширяющегося покрытого стента позволила добиться герметичности билиарного тракта у обоих больных. При этом протяженный дефект стенки холедоха полностью закрывался уже за 4-5 недель. Желчеотделение полностью купировалось сразу же после стентирования. Это позволило удалить контрольный дренаж и стабилизировать больного. Удаление стента производили через 4-5 недель после купирования желчеотделения. При контрльной холангиографии выхода контрастного вещества за пределы холедоха не наблюдалось. Пациентам с наружными свищами после лапароскопической холецистэктомии удалось купировать желчеистечение в 7 из 8 случаев сразу же после установки билиарного эндопротеза. В одном случае мы наблюдали протяженный дефект стенки желчного протока, связанный с ожогом холедоха, стентирование холедоха пластиковым стентом было неэффективным, в виду дефекта протока, занимающего практически половину окружности нерасширенного Рис. 3. Несостоятельность холедохостомы Рис. 4. Саморасширяющийся стент холедоха холедоха. Пациент был оперирован, сформирована холедохостома. В случаях успешного купирования желчного свища, связанного с несостоятельностью культи пузырного протока, пластиковый стент удалялся через 4-5 недель после прекращения желчеотделения в амбулаторном порядке. Контрольной холангиографии не производилось, т. к. оснований для не герметичности желчного протока не было. У пациента, перенесшего гемигепатэктомю, наблюдали формирование хронического билиарного свища, обусловленного несостоятельностью культи правого долевого протока печени. Несмотря на хронический характер патологии, стентирование пластиковым стентом позволило купировать наружный отток желчи уже в течении первых суток с момента эндопротезарования. Дренаж брюшной полости был удален через двое суток после стентирования холедоха. Положительный клинический эффект был достигнут у 21 (95.4%) больных. Заключение 1. Стентирование саморасширяющимися стентами с покрытием при протяженных продольных дефектах стенки холедоха, позволяет добиться быстрого купирования желчеистечения и создает благоприятные условия для закрытия свища. 2. При формировании несостоятельности культи пузырного протока у пациентов, перенесших холецистэктомию, стентирование палстиковым стентом 10фр диаметром, позволило быстро купировать желчеистечение. 3. Стентирование желчных протоков при формировании послеоперационных билиарных свищей является наиболее безопасным и эффективным способом купирования осложнения. 4. Выполнение транспапиллярного вмешательства должно рассматриваться как основная операция при формировании наружного желчного свища, т. к. в большинстве случаев позволяет получить положительный эффект, не подвергая больного реконструктивным операциям на желчных путях. ИНТЕРВЕНЦИОННАЯ ЭНДОСОНОГРАФИЯ В ХИРУРГИЧЕСКОЙ ПАНКРЕАТОЛОГИИ: ОБНАДЕЖИВАЮЩИЕ РЕЗУЛЬТАТЫ ПЕРВОГО ОПЫТА Жданов А. В., Корымасов Е. А., Колесник И. В., Барилко Е. В., Лежнев М. А. ФГБОУ ВО СамГМУ Минздрава России, СамГМУ ЧУЗ Клиническая больница РЖД-медицина г. Самара Актуальность Успехи лечения острого панкреатита привели к тому, что в последнее десятилетие увеличилось число пациентов с таким относительно благоприятным исходом этого заболевания как постнекротическая псевдокиста. Тем не менее, существование кисты само по себе таит серьезную опасность в виде разрыва и сдавления желчных протоков с развитием механической желтухи, а частота осложнений при их хирургическом лечении (кровотечения, несостоятельность анастомозов, формирование стойких панкреатических свищей) достигает 20%. Многие из перечисленных осложнений являются сами по себе опасными состояниями. Внедрение малоинвазивных методик будет способствовать улучшению результатов лечения и охвату большего числа пациентов. Цель Обсудить первые результаты применения интервенцинной эндосонографии в лечении пациентов с панкреатическими псевдокистами. Материалы и методы В течении года интервенционные вмешательства под контролем эндоультрасонографии (ЭУС) выполнены у 7 пациентов (5 мужчины и 2 женщины, в возрасте от 34 до 56 лет) с постнекротическими кистами поджелудочной железы. У всех пациентов в анамнезе был перенесенный острый панкреатит. Размер кист варьировал от 5,5 см до 12 см. У всех пациентов был стойкий болевой синдром, увеличение объемного образования верхних отделов живота. Еще у одного больного 43 лет был стойкий наружный панкреатический свищ в результате спонтанного разрыва кисты поджелудочной железы. Вмешательство проводили при помощи конвексного эхондоскопа. Дренирование кисты поджелудочной железы осуществлялось через заднюю стенку желудка под эндосонографическим наведением при помощи цистотома с установкой пластикового дренажа диаметром 10fr. У пациента с панкреатическим свищем выполнена пункция главного панкреатического протока через заднюю стенку желудка с целью произведения панкреатографии и определения локализации свища и определения дальнейшей тактики. Эндоскопическая ретроградная панкреатография у данного больного не удалась в связи с плотным кальцинированным образованием головки поджелудочной железы. Результаты и обсуждения Полное спадение кисты отмечено уже в первые сутки после вмешательства у всех больных. При исследовании материала кистозного содержимого атипичных клеток В содержимом кисты не выявлено ни в одном случае. Во всех случаях при лабораторном исследовании содержимого кисты выявлено высокое значении a-амилазы в диапазоне 5250-6500ед/л, что подтверждало. Дренаж был удален через 1.5-2 месяца после контрольной компьютерной томографии. Рецидива кистозного образования не отмечено ни у одного больного. У пациента с наружным панкреатическим свищем удалось определить его топографию на уровне хвоста поджелудочной железы. Доступ в панкреатический проток осуществлялся пункционной иглой 19G. Далее через иглу введен проводник 0,025, по проводнику заведен цистотом. Была предпринята попытка выполнения панкреатогастростомии под контролем ЭУС. Однако плотность железы не позволила провести цистотом в панкреатический проток, множественные кальцинаты в паренхиме железы не позволяли реканализировать просвет протока. Осложнений трансгастрального дренирования кист поджелудочной железы и пункции не отмечено ни у одного больного. Выводы и рекомендации Трансгастральная пункция и дренирование панкреатических псевдокист под эндоскопическим ультразвуковым наведением является эффективным методом малоинвазивного лечения, позволяющее добиться окончательного излечения пациентов. Важным условием успеха является отсутствие связи с главным панкреатическим протоком либо восстановление его проходимости в проксимальном отделе. Метод является весьма перспективным и заслуживает активного внедрения в широкую хирургическую практику. РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ЭКСТРАКОРПОРАЛЬНОЙ УДАРНОВОЛНОВОЙ ЛИТОТРИПСИИ В ЛЕЧЕНИИ «СЛОЖНОГО» ХОЛЕДОХОЛИТИАЗА Захарова Я. С.1,2, Будзинский С. А.3,4, Ташкинов Н. В.2, Косенко П. М.2, Федоров Е. Д.3,4, Шаповальянц С.Г.3,4, Адаев А. М.1 1КГБУЗ Городская клиническая больница № 10 МЗ ХК 2ФГБОУ ВО Дальневосточный государственный медицинский университет МЗ РФ 3ГБУЗ города Москвы Городская клиническая больница № 31 ДЗ г. Москвы 4ФГБОУ ВО Российский национальный исследовательский медицинский университет им. Н. И. Пирогова МЗ РФ г. Москва, Хабаровск Актуальность В настоящее время эндоскопическая папиллосфинктеротомия (ЭПСТ) с последующей экстракцией конкрементов желчных протоков считаются общепризнанным стандартом в лечении холедохолитиаза (ХЛ). Полной санации билиарного дерева при применении эндоскопических методик удается достичь в 90-98% наблюдений [1]. Трудности при эндоскопической литоэкстракции (ЛЭ) обычно возникают в случаях «сложного» ХЛ, к которому относят крупный ХЛ с размером конкрементов свыше 15 мм; множественный ХЛ (3 и более камней); сочетание ХЛ с измененной или нестандартной анатомией верхних отделов желудочно-кишечного тракта и парапапиллярной зоны, а также наличие стриктур и ангуляций желчевыводящих протоков с супрастенотическим расположением конкрементов [2]. При этом частота неудач при использовании внутрипротоковой механической литотрипсии, считающейся основным методом традиционного эндоскопического лечения «сложного» ХЛ, достигает 20% [3]. В подобных клинических ситуациях возможно и показано применение альтернативных малоинвазивных методов фрагментации конкрементов. Такими техническими подходами являются экстракорпоральная ударно-волновая литотрипсия (ЭУВЛ), а также лазерная и электрогидравлическая контактная литотрипсия, при использовании которых полной санации желчных протоков можно достичь по данным литературы в 80-95% случаев. Немаловажно, что самая низкая частота осложнений наблюдается именно при применении методики ЭУВЛ (8,4%) [4]. Цель Оценить возможности применения методики ЭУВЛ при лечении пациентов со «сложным» ХЛ. Материал и методы Произведен анализ результатов применения ЭУВЛ у пациентов со «сложным» ХЛ, находившимся на лечении в ГКБ № 31 г. Москвы и ГКБ № 10 г.Хабаровска в период с 01.2017 по 01.2020 гг. Данная методика была использована в 15 наблюдениях (13 женщин, 2 мужчин). Возраст пациентов варьировался от 61 до 82 лет и в среднем составлял 71,8 ± 7,4 лет. У 10 (66,7%) пациентов имелась клиника острой механической желтухи, у двоих (13,3%) из них наблюдались явления гнойного холангита; показатели билирубина составляли 14,5-131,2 мкмоль/л, в среднем 53,9 ± 31,4 мкмоль/л. Во всех случаях была выявлена дилатация желчных протоков от 15 до 40мм, в среднем 24,5 ± 8,3мм. Одиночные конкременты обнаружены в 8 (53,3%) наблюдениях, 2 камняу 3 (20%) пациентов, а множе- ственный ХЛ (3 конкремента)в 4 (26,7%) случаях. Диаметр билиарных камней варьировался от 15 до 50мм, средний их размер составил 29,4 ± 11,7 мм. Показательно, что в группу исследования вошло 4 (26,6%) больных с измененной анатомией верхних отделов желудочно-кишечного тракта и области большого сосочка двенадцатиперстной кишки (БСДК): парапапиллярные дивертикулы выявлены в 3 (20%) наблюдениях. При этом у 1 из пациентов имелось сочетание парапапиллярного дивертикула со стриктурой терминального отдела холедоха. Анамнестически перенесенная резекция желудка по Бильрот-II имела место еще в 1 (6,6%) случае. Всем больным первоначально была выполнена эндоскопическая ретроградная холангиографии (ЭРХГ) с последующей ЭПСТ и попыткой транспапиллярного удаления конкрементов (Рис. 1). При этом в 8 (53,3%) случаях вмешательство было дополнено баллонной дилатацией области ЭПСТ, а в 13 (86,7%) наблюдениях была предпринята попытка механической внутрипротоковой литотрипсии. Однако, учитывая размеры камней, а также имевшиеся у ряда больных анатомические особенности, затруднявшие ЛЭ разрешить ХЛ типичным эндоскопиче- ским способом не представлялось возможным. В связи с этим у всех 15 (100%) пациентов первичное эндоскопическое вмешательство было завершено назобилиарным дренированием, целью которого являлось возобновление адекватного желчеоттока из проксимальных отделов билиарного тракта, разрешение клинической картины острой механической желтухи и холангита, а также возможность проведения прецизионной рентген-навигации во время последующей ЭУВЛ. Все дистанционные экстракорпоральные процедуры проводились под в\в седацией с сохранением спонтанного дыхания с использованием литотрипторов Dornier Compact Delta II (Германия)и Sonolith (Франция). Количество подаваемых импульсов за один сеанс варьировалось от 2500 до 3500, интенсивность составляла до 5 (52,0 мПа, 0,72 мДж/мм кВ, 52,0 мДж), постоянный контроль положения и динамики состояния конкрементов холедоха осуществлялся с помощью интраоперационного контрастирования через назобилиарный дренаж (Рис. 2). После констатации положительного эффекта от проведенной ЭУВЛ, заключавшегося в фрагментации камней ОЖП, через 1-2 суток от вмешательства выполнялась контрольная ЭРХГ с оценкой результативности проведенной дистанционной литотрипсии (Рис. 3). При подтверждении состоявшегося разрушения конкрементов производилось ретроградное транспапиллярное извлечение их фрагментов с использованием корзинки Дормиа, ревизионного баллона или механического литотриптора (Рис. 4 А-Б) Результаты В нашем наблюдении количество сеансов ЭУВЛ составляло от 1 до 3. Так, 1 сеанс был проведен в 6 (40%) слу- чаях, 2 – также у 6 (40%) пациентов, а 3 сеанса – у 3 (20%) больных. Эффективной фрагментации конкрементов и последующей полной эндоскопической санации желчных протоков удалось достигнуть у 7 пациентов (46,7%); частичный эффект от ЭУВЛ и, как следствие, неполная санация, требующая применения других альтернативных методов лечения «сложного» ХЛ, также наблюдалась в 7 случаях (46,7%); полное отсутствие эффекта от дробления отмечено лишь у 1 больного (6,6%). Неудачи применения метода дистанционной литотрипсии были связаны: с множественным ХЛ и слишком крупными размерами конкрементов – в 5 (33,3%) случаях, выявленным синдромом Мириззи – в 2 (13,3%) наблюдениях, а также невозможностью проведения эндоскопического вмешательства вследствие измененной анатомии верхних отделов желудочно-кишечного тракта – у 1 (6,7%) пациента после резекции желудка по Бильрот II, сеансу ЭУВЛ у которого предшествовало наружно-внутреннее дренирование, однако доступ к БСДК в последующем осуществить не удалось. В 1 случае при проведении ЭУВЛ (6,7%) наблюдалось осложнение, заключавшееся в развитии ретродуоденальной перфорации на стенке, противоположной расположению БСДК, что потребовало проведения интенсивной консервативной терапии с установкой назоинтестинального зонда и последующим выздоровлением больного. В 7 (46,7%) случаях неэффективности методики ЭУВЛ пациентам были выполнены альтернативные вмешательства, направленные на разрешение «сложного» ХЛ: в 2 наблюдениях была успешно применена контактная лазерная литотрипсия с последующей эндоскопической ЛЭ, 2 пациентам выполнена лапароскопическая холедохолитотомия, а еще 3 прооперированы в объеме лапаротомии, холедохолитотомии, наружного дренирования холедоха. Заключение ЭУВЛ является перспективной малоинвазивной методикой в лечении «сложного» ХЛ, позволяющей по нашим данным достичь полной санации желчных протоков в 46,7% наблюдений. Успех данного технического подхода зависит от размеров, количества и расположения конкрементов желчных протоков, анатомических особенностей зоны БСДК, а также количества проводимых сеансов. При этом частота осложнений при использовании данного метода лечения составила 6,7%, что практически не отличается от средних литературных показателей (8,4%). В случае неэффективности применения ЭУВЛ, альтернативой разрешения «сложного» ХЛ могут служить контактные способы внутрипротоковой литотрипсии при проведении пероральной транспапиллярной холангиоскопии, либо традиционные хирургические вмешательства. Литература 1. Manes G, et al Endoscopic management of common bile duct stones: European Society of Gastrointestinal Endoscopy (ESGE) guideline. Endoscopy. 2019 May;51(5):472-49 2. Карпов О. Э., Ветшев П. С., Бруслик С. В., Маады А. С. Сочетанное применение ретроградного и антеградного доступов при сложном холедохолитиазе // Анналы хирургической гепатологии. 2013; 18 (1): 59-62. 3. Михин А. И., Орлов С. Ю., Василенко К. В., Сажин А. В. Эндоскопическое лечение пациентов старческого возраста со сложным холедохолитиазом// Эндоскопическая хирургия. 2019; 25(1): 53-60 4. Veld JV, van Huijgevoort NCM, Boermeester MA et al. A systematic review of advanced endoscopy-assisted lithotripsy for retained biliary tract stones: laser, electrohydraulic or extracorporeal shock wave // Endoscopy. 2018. Sep;50(9):896-909 ЭНДОСКОПИЧЕСКИЕ ВМЕШАТЕЛЬСТВА В ЛЕЧЕНИИ ПАЦИЕНТОВ С ХОЛЕДОХОЛИТИАЗОМ И ПАРАПАПИЛЛЯРНЫМ ДИВЕРТИКУЛОМ Мусинов И.М.1, А.Е. Чикин А.Е.2, Кольцов В.А.2, Апэрече Б. С.2 1ФГБВОУ ВО Военно-медицинская академия им. С. М. Кирова МО РФ 2СПб ГБУЗ Александровская больница г. Санкт-Петербург ■ Мусинов И.М. ■ Чикин А.Е. ■ Кольцов В.А. ■ Апэрече Б. С. Актуальность Холедохолитиаз (ХЛ) встречается у 8-35% больных с желчнокаменной болезнью (ЖКБ) [1]. Большую часть пациентов с ХЛ составляют больные пожилого и старческого возраста, у которых в 50-83% наблюдается парапапиллярный дивертикул (ППД), ухудшающий результаты лечения чреспапиллярными методами [2]. Опасность перфорации дивертикула при выполнении эндоскопической папиллосфинктеротомии (ЭПСТ) нередко ограничивает выполнение полного рассечения большого сосочка двенадцатиперстной кишки, что сопровождается дополнительной травматичностью во время литоэкстракции (ЛЭ), большим количеством осложнений, а нередко вынуждает прекратить выполнение процедуры [3]. Ограниченная ЭПСТ, дополненная эндоскопической баллонной папиллодилатацией (ЭБПД), создает лучшие условия для ЛЭ, но эффективность ее применения требует уточнения [4]. Цель исследования Улучшить результаты лечения пациентов с ППД и ХЛ путем использования ограниченной ЭПСТ, дополненной ЭБПД. Материалы и методы Основную группу составили 42 больных с ХЛ и наличием ППД, находившиеся на лечении на базе кафедры военно-морской хирургии Военно-медицинской академии им. С. М. Кирова в Санкт-Петербургском государственном бюджетном учреждении здравоохранения «Городская Александровская больница» и в Санкт-Петербургском государственном бюджетном учреждении здравоохранения «Городская клиническая больница № 31» с 2017 по 2019 г. и которым для лечения выполнялась ограниченная ЭПСТ, дополненная ЭБПД. Контрольной группой служили результаты лечения 56 больных с аналогичной патологией, которым была выполнена традиционная ЭПСТ. В основной и контрольной группах преобладали женщины – 30 (71,4%) и 33 (58,9%) пациента соответственно. Больных пожилого и старческого возраста было большинство – 90,4% (37 больных) в основной группе и 80,3% (45 больных) – в контрольной группе. Среди больных преобладали пациенты с легкой механической желтухой (МЖ) – 69,1% в основной и 51,8% – в контрольной группе. МЖ средней степени тяжести наблюдалась в 19% и 23,2% случаев соответственно. Тяжелая МЖ была у 7,1% больных в группе сравнения. В основной группе пациентов с тяжелой МЖ не наблюдалось. Пациентов с нормальным уровнем билирубина было 11,9% в основной группе и 17,9% – в контрольной группе больных. У всех этих больных желтуха наблюдалась в анамнезе заболевания. Впервые ограниченная ЭПСТ, дополненная ЭБПД, выполнена в 85,7% случаев, повторная, после неудачной первичной ЭПСТ, – в 14,3% случаев. ЭПСТ по первичным показаниям у больных контрольной группы выполнена в 87,5% случаях и у 12,5% пациентов повторно после первичной ЭПСТ. Для оценки расположения ППД использовалась классификация J. Boix и соавт. (2006) [5]. В основной группе интрадивертикулярное расположение было у 42,9% больных, в контрольной – у 33,9%, на границе дивертикула – у 30,9% и 50% больных соответственно, вне дивертикула – у 26,2% и 16,1% пациентов. Сопутствующие заболевания наблюдались у 92,6% больных с ограничен- ной ЭПСТ, дополненной ЭБПД, у 83,9% пациентов с традиционной ЭПСТ. В группе сравнения ЭПСТ проводилась на максимально возможную длину. У больных с ЭБПД ограниченная ЭПСТ выполнялась на 1/3 или 1/2 продольной складки. Для проведения баллонной дилатации использовались баллоны с радиальным расширением диаметром от 10 до 15 мм, длиной 5,5 см, фирмы «Boston Scientific». Время дилатации составляло 15-30 сек. Статистическую обработку осуществляли с помощью программы STATA. Результаты Устранение МЖ выполнено у 42 (100%) больных основной и у 54 (96,4%) больных контрольной группы (р>0,05). У 39 (92,9%) пациентов основной группы проведена полная ЛЭ. Еще у 3 (7,1%) больных произведено стентирование ОЖП в связи с частичным удалением конкрементов. Полная ЛЭ в контрольной группе выполнена у 52 (92,9%) пациентов. Еще 2 (3,6%) больным проведено стентирование ОЖП в связи с неполной МЛ и ЛЭ. ЛЭ после ЭПСТ не была проведена 2 (3,6%) больным из-за перфорации стенки дивертикула, что потребовало выполнения открытого оперативного вмешательства. Наблюдалась еще одна перфорация двенадцатиперстной кишки после повторной ЭПСТ и ЛЭ, которая выявлена на следующие сутки после выполнения процедуры (таблица). В основной группе летальных исходов не наблюдалось, в контрольной группе летальность составила 3,6% (р>0,05) и не была связана с проводимой чреспапиллярной операцией. В основной группе имелось только два (4,8%) осложнения, в то время как в контрольной их было 13 у 10 больных (р=0,012). Однако достоверные различия в послеоперационных осложнениях наблюдались только при остром панкреатите (р=0,043). Кровотечения в основной и контрольных группах возникали из папиллотомного разреза. Одиночные конкременты у больных основной и контрольной группы встречались в 54,8% и 48,2% случаев, множественные – в 45,2% и 51,8% случаев (p>0,05) соответственно. Ограниченная ЭПСТ, дополненная ЭБПД, выполнена у 16 (38,1%) больных с размерами конкрементов менее одного сантиметра и у 40 (71,5%) пациентов – в контрольной группе (р=0,001). При размерах камней от 1 до 1,5 см ЭПСТ с ЭБПД произведена у 16 (38,1%) больных, а ЭПСТ – у 11 (19,6%) пациентов (р=0,043). При конкрементах свыше 1,5 см частичная ЭПСТ, дополненная ЭБПД, выполнена у 10 (23,8%) больных в основной группе и только у 5 (8,9%) больных с традиционной ЭПСТ контрольной группы (р=0,043). Следовательно только ЭПСТ выполнялась чаще при мелком ХЛ. Для удаления конкрементов диаметром до 1 см МЛ после выполнения ЭПСТ не требовалась. Потребность в МЛ при размерах конкрементов от 1 до 1,5 см составила 45,5% (5 из 11 больных). В остальных 55,5% случаев конкременты диаметром от 1 до 1,5 см ввиду их рыхлости были удалены фрагментарно. Ограниченная ЭПСТ, дополненная ЭБПД, позволила произвести ЛЭ конкрементов диаметром до 1,5 см всем больным, что статистически отличается от контрольной группы больных (р=0,003). Полная МЛ и ЛЭ у больных основной группы при размерах конкрементов более 1,5 см произведена в 40% Таблица – Характеристика осложнений после выполнения сосочковых операций Осложнения Количество Достоверность различий Основная группа (n=42) Контрольная группа (n=56) число % число % Кровотечение 1 – 2 3,6 p>0,05 – эндоскопический гемостаз 1 2,4 2 3,6 p>0,05 Острый панкреатит 1 2,4 8 14,3 р=0,043 – легкий 1 2,4 5 8,9 p>0,05 – средней степени – – 3 5,4 p>0,05 Перфорация – – 3 5,4 p>0,05 – папиллотомом – – 2 3,6 p>0,05 – проводником – – 1 1,8 p>0,05 ИТОГО 2 4,8 13 23,2 р=0,012 случаев (у 4 из 10 больных). Еще у 3 (30%) больных ввиду рыхлости конкремента(ов) он был удален с помощью корзины Дормиа. И еще у трех (30%) пациентов потребовалось стентирование ОЖП ввиду неполной ЛЭ после МЛ. Следовательно, потребность в МЛ после выполнения ограниченной ЭПСТ с ЭБПД при размерах конкрементов более 1,5 см составила 70%. После выполнения ЭПСТ при размерах конкрементов более 1,5 см одному больному выполнена полная ЛЭ после МЛ, еще в двух случаях после МЛ конкременты были удалены частично, что потребовало стентирования ОЖП. Общая потребность в МЛ в данном случае составила 60% (3 из 5 больных) (p>0,05). Таким образом, широкое сообщение с ОЖП после ограниченной ЭПСТ, дополненной ЭБПД, способствует более эффективной ЛЭ и снижает вероятность развития послеоперационных осложнений. ЭПСТ при наличии ППД в ряде случаев сопровождается недостаточным рассечением БСДК, что затрудняет удаление конкрементов из ОЖП, дополнительно травмирует область БСДК и увеличивает вероятность развития острого панкреатита. Выводы Выполнение ограниченной папиллосфинктеротомии, дополненной эндоскопической баллонной дилатацией, и только эндоскопической папиллосфинктеротомии у больных с холедохолитиазом и парапапиллярным дивертикулом привело к полной литоэкстракции в 92,9% случаев, а к адекватному дренированию общего желчного протока в 100% и 96,4% наблюдений соответственно. Применение баллонной дилатации после ограниченной папиллосфинктеротомии достоверно снижает потребность в механической литотрипсии и число послеоперационных осложнений по сравнению с применением только эндоскопической папиллосфинктеротомии. Литература 1. Testoni, P. Papillary cannulation and sphincterotomy techniques at ERCP: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline // Endoscopy. 2016. Vol. 48, № 7. P. 657-683. 2. Barakat, M. T. Escalating complexity of endoscopic retrograde cholangiopancreatography over the last decade with increasing reliance on advanced cannulation techniques // World J. Gastroenterol. 2020. Vol. 26, № 41. P. 6391-6401. 3. Yue, P. Clinical significance of different periampullary diverticulum classifications for endoscopic retrograde cholangiopancreatography cannulation // World J. Gastroenterol. 2020. Vol. 26, № 19. P. 2403-2415. 4. Itoi, T. Japan Gastroenterological Endoscopy Society guidelines for endoscopic papillary large balloon dilation // Dig. Endosc. 2018. Vol. 30, № 3. P. 293-309. 5. Boix, J. Impact of periampullary duodenal diverticula at endoscopic retrograde cholangiopancreatography: a proposed classification of periampullary duodenal diverticula // Surg. Laparosc. Endosc. Percutan. Tech. 2006, Vol. 16, P. 208-211. БАЛЛОННАЯ ДИЛАТАЦИЯ В ЛЕЧЕНИИ БОЛЬНЫХ С МЕХАНИЧЕСКОЙ ЖЕЛТУХОЙ И ПАРАПАПИЛЛЯРНЫМ ДИВЕРТИКУЛОМ Кольцов В.А.2, Мусинов И.М.1 1ФГБВОУ ВО Военно-медицинская академия им. С.М. Кирова МО РФ 2СПб ГБУЗ Александровская больница г. Санкт-Петербург ■ Мусинов И.М. ■ Кольцов В.А. Актуальность Парапапиллярный дивертикул (ППД) снижает эффективность проведения ретроградных операций при холедохолитиазе (ХЛ) [1, 2]. Часто в связи с невозможностью выполнения полноценной эндоскопической папиллосфинктеротомии (ЭПСТ) литоэкстракция (ЛЭ) приводит к травмированию области терминального отдела холедоха, что сопровождается развитием осложнений до 30,8% случаев [3]. Применение эндоскопической баллонной папиллодилатации (ЭБПД) после ограниченной ЭПСТ создает широкий доступ в общий желчный проток (ОЖП) и упрощает проведение ЛЭ, но результативность ее применения у пациентов с ХЛ и ППД требует уточнения [4]. Цель исследования Определить эффективность использования ограниченной ЭПСТ с ЭБПД у пациентов с ХЛ и ППД. Материалы и методы В работе представлены результаты лечения 42 больных с ХЛ и ППД, находившиеся на лечении с 2017 по 2019 годы в Санкт-Петербургском государственном бюджетном учреждении здравоохранения «Городская Александровская больница», которым выполнена ограниченная ЭПСТ, дополненная ЭБПД. Средний возраст пациентов составил 73,1±4,1 года. Ограниченная ЭПСТ с ЭБПД выполнена в 71,4% случаев женщинам, 28,6% – мужчинам. Легкая степень тяжести механической желтухи наблюдалась у 29 (69,1%) больных, средняя – у 8 (19%) пациентов. У 5 (11,9%) больных механическая желтуха наблюдалась в анамнезе. Болевой синдром присутствовал у 95,2% больных. Впервые ограниченная ЭПСТ с ЭБПД выполнена у 36 (85,7%) больных, повторная, после неудачной первичной ЭПСТ, – у 6 (14,3%) пациентов. У 9 (21,4%) больных в анамнезе была произведена холецистэктомия. Дивертикул оценивали в зависимости от расположения большого сосочка двенадцатиперстной кишки (БСДК) [5]. Интрадивертикулярное расположение БСДК наблюдалось у 18 (42,9%) пациентов, на границе дивертикула – у 13 (30,9%) больных и у 11 (26,2%) пациентов БСДК располагался вне ППД. Наличие ХЛ у пациентов с ППД явилось показанием для проведения чрессосочкового вмешательства. После предоперационной подготовки проводилась ретроградная холангиопанкреатография с ограниченной ЭПСТ на 1/2 или 1/3 продольной складки. Далее с помощью баллона с радиальным расширением (Boston Scientific, США) выполнялась дилатация терминального отдела холедоха баллонами от 10 мм до 15 мм в диаметре и ЛЭ конкрементов. Механическая литотрипсия (МЛ) проводилась при необходимости. Результаты Ограниченная ЭПСТ с ЭБПД выполнена у 16 (38,1%) больных с размерами конкрементов менее одного сантиметра в диаметре, у 16 (38,1%) пациентов – при размерах камней от 1 до 1,5 см и у 10 (23,8%) больных – при конкрементах свыше 1,5 см. Множественный ХЛ был у 45,2% пациентов, одиночный – у 54,8% больных. Полное устранение ХЛ произведено у 39 (92,9%) больных, а купирование механической желтухи – у 42 (100%) пациентов. У 3 (7,1%) больных конкремент диаметром более 1,5 см не удалось разрушить во время МЛ и операция закончилась стентированием холедоха. Ограниченная ЭПСТ, дополненная ЭБПД, позволила произвести ЛЭ конкрементов диаметром до 1,5 см всем больным без выполнения МЛ. Потребность в МЛ при конкрементах более 1,5 см возникла у 7 (70%) пациентов и была результативна у 4 (40%) из них. Осложнения после проведенного эндоскопического лечения наблюдались у 2 (4,8%) больных. У одного пациента развилось активное кровотечение при проведении ЭПСТ, которое было остановлено эндоскопическим способом. У второго больного в связи с трудной селективной канюляцией ОЖП возник острый панкреатит легкой степени. Летальных исходов в анализируемой группе больных не было. Выводы 1. Использование ограниченной ЭПСТ с баллонной дилатацией при наличии ППД в 92,9% случаев приводит к устранению холедохолитиаза и сопровождается небольшим количеством послеоперационных осложнений. 2. Ограниченная ЭПСТ с баллонной дилатацией может быть рекомендована для лечения больных с холедохолитиазом и ППД. Литература 1. Mu, P. Does periampullary diverticulum affect ERCP cannulation and post-procedure complications? an up-to-date meta-analysis/ P. Mu, P. Yue, F. Li [et al.] // Turk. J. Gastroenterol. – 2020. – Vol. 31, № 3. – P.193-204. 2. Хрусталева, М.В. Эндоскопические транспапиллярные методы лечения холедохолитиаза / М.В. Хрусталева, М.А. Дехтяр, Г.К. Ягубян // Анналы хирургической гепатологии. – 2015. – Т. 20, № 4. – С. 74-80. 3. Алтыев, Б.К. Технические особенности эндоскопической ретроградной панкреатохолангиографии и папиллосфинктеротомии при дивертикулах папиллярной области / Б.К. Алтыев, А.М. Хожибоев, Б.Б. Хакимов, О.И. Шелаев // Вестник экстренной медицины. – 2010. – № 4. – С. 19-22. 4. Clemente Junior, C.C. Comparison between endoscopic sphincterotomy vs endoscopic sphincterotomy associated with balloon dilation for removal of bile duct stones: A systematic review and meta-analysis based on randomized controlled trials / C.C. Clemente Junior, W.M. Bernardo, T.P. Franzini [et al.] // World J Gastrointest Endosc. – 2018. – Vol. 10, № 8. – P. 130-144. 5. Boix, J. Impact of periampullary duodenal diverticula at endoscopic retrograde cholangiopancreatography: a proposed classification of periampullary duodenal diverticula // Surg. Laparosc. Endosc. Percutan. Tech. – 2006. – Vol.16. – P. 208–211. ЭНДОСКОПИЧЕСКОЕ ДРЕНИРОВАНИЕ ГЛАВНОГО ПАНКРЕАТИЧЕСКОГО ПРОТОКА ПРИ ПАНКРЕОНЕКРОЗЕ Котовский А. Е. 1,3, Глебов К. Г.2,3, Дюжева Т. Г.1, Хоконов М. А.3, Магомедова Б. М.1, Махмудова А. К.3 1МГМУ им. И. М. Сеченова 2РГМУ им. Н. И. Пирогова 3ГКБ № 15 им. О. М. Филатова г. Москва ■ Котовский А. Е. ■ Глебов К. Г. ■ Дюжева Т. Г. ■ Хоконов М. А. ■ Магомедова Б. М. ■ Махмудова А. К. В комплексном лечении больных панкреонекрозом важное значение имеет ликвидация гипертензии в панкреатических протоках и создание благоприятных условий для оттока панкреатического секрета. Эндоскопическое транспапиллярное дренирование главного панкреатического протока является одним из методов декомпрессии. Материал и методы Дренирование главного панкреатического протока выполнено у 16 больных, из 19 пациентов, поступивших в клинику через 24-56 часов от момента начала приступа ОП. У 6 больных выявлена билиарная этиология заболевания, у других 10 причиной ОП был прием алкоголя. Диагностический алгоритм включал проведение УЗИ, КТ с болюсным внутривенным контрастированием, лапароскопию, исследование активности α-амилазы крови. ЭД ГПП осуществляли после ЭРПХГ, папиллотомии. Алгоритм диагностики и эндоскопического лечения у больных пакреонекрозом представлен на схеме 1. Всем больным в качестве доступа к желчным и панкреатическим протокам была выполнена эндоскопическая папиллосфинктеротомия, после которой была осуществлена реканализация главного панкреатического протока в зоне поперечного панкреонекроза. Характер эндоскопических вмешательств представлен в табл. 1. У больных механической желтухой, клиническими и эндоскопическими признаками холангита выполняли назобилиарное дренирование и стентирование желчных протоков при одномоментной декомпрессии панкреатического протока. С целью изучения локализации дренажа в главном панкреатическом протоке, его диаметра и целостности протоковой системы поджелудочной железы (выход контрастного вещества за пределы железы) проводили фистулопанкреатикографию. В последующем изучали объем отделяющейся по дренажам желчи и панкреатического секрета. Результаты У 16 из 19 больных удалось выполнить папиллотомию и эндоскопическое дренирование главного панкреатического протока. У 3 больных в связи с выраженной деформацией двенадцатиперстной кишки и отеком в зоне большого сосочка осуществить канюляцию отверстия папиллы и провести назопанкреатический дренаж не удалось. По данным панкреатикои фистулопанкреатикографии главный панкреатический проток имел диаметр 1-3 мм, контрастировался на всем протяжении, у 2 больных отмечалось поступление контрастного вещества за пределы поджелудочной железы: у 1 больной с глубоким некрозом перешейка отмечали стойкое депо контрастного вещества (размеры 3,0 х 1,0 см) в парапанкреатическом пространстве в области тела железы, у другого больного (КТ некрозы тела и хвоста ПЖ) контрастное вещество выходило за пределы поджелудочной железы по всему периметру ее поражения. В то же время на холангиограммах у всех больных имелись признаки тубулярного сужения дистального отдела общего желчного протока, характерные для панкреатита, диаметр гепатикохоледоха составлял 7-13 мм, у 6 больных диагностированы мелкие камни гепатикохоледоха. В первые сутки после ЭД ГПП у 10 больных по катетеру отмечали поступление прозрачного панкреатического сока (α-амилаза более 2500 е/л) в объеме 5-50 мл, затем количество секрета увеличивалось и достига- ло 400-800 мл в сутки. Было отмечено, что параллельно с увеличением объема секрета улучшалась клиническая картина заболевания: уменьшились признаки интоксикации, восстановились лабораторные показатели. В последующем эти больные были выписаны. У 1 больного (эндоскопическое дренирование главного панкреатического протока проведено через 56 часов от начала Табл. 1 Виды вмешательства Кол-во больных Папиллотомия + реканализация зоны некроза + назопанкреатическое дренирование 4 Папиллотомия + реканализация зоны некроза + назопанкреатическое дренирование + назобилиарное дренирование (при механической желтухе) 4 Папиллотомия + реканализация зоны некроза + стентирование панкреатического протока 2 Папиллотомия + реканализация зоны некроза + стентирование панкреатического и желчного протоков (при механической желтухе) 4 Папиллотомия + реканализация зоны некроза + назопанкреатическое дренирование + стентирование желчного протока 2 заболевания, по данным панкреатикографии отмечен массивный затек контрастного вещества за пределы железы) поступления панкреатического секрета по дренажу не отмечали, прогрессировала полиорганная недостаточность, которая явилась причиной смерти на 5 сутки от начала заболевания. У 1 больной на протяжении 3 суток после эндоскопического дренирования главного панкреатического протока по дренажу выделялось 150-200 мл секрета, затем его количество резко сократилось до 5 мл в сутки, несмотря на адекватное стояние дренажа. Развился инфицированный парапанкреонекроз (активность α-амилазы в парапанкреатической жидкости была низкой). Больная умерла на стадии гнойных осложнений, несмотря на санацию забрюшинного пространства. Заключение 1. Диагностика панкреонекроза должан основываться на клинико-лабораторных исследований с обязательным выполнением КТ с болюсным контрастированием. 2. Эндоскопические дренирующие операции следует выполнять в более ранние сроки (не позднее 48 часов от начала панкреонекроза) 3. На первом этапе эндоскопического вмешательства после реканализации зоны панкреонекроза целесообразно выполнять назопанкреатическое дренирование, которое дает возможность осуществления динамического мониторинга за состоянием поджелудочной железы и ее протоковой системы. ЭНДОСКОПИЧЕСКОЕ ВНУТРИПРОСВЕТНОЕ ДРЕНИРОВАНИЕ ЗОН ПАНКРЕАТОГЕННОЙ ДЕСТРУКЦИИ ПРИ КРУПНООЧАГОВОМ ПАНКРЕОНЕКРОЗЕ Куликов Ю. Д., Тетерин Ю. С., Ярцев П. А., Аскеров А. Ч. ПИУВ-филиал ФГБУДПО Российская медицинская академия непрерывного профессионального образования ГБУЗ НИИ СП им. Н. В. Склифосовского ДЗМ г. Москва ■ Куликов Ю. Д. ■ Тетерин Ю. С. ■ Ярцев П. А. ■ Аскеров А. Ч. Актуальность Деструктивные формы острого панкреатита (ОП) являются наиболее тяжелыми и встречаются в 25-30% случаях. В ранние сроки они проявляются парапанкреатическим инфильтратом, который в дальнейшем трансформируется в абсцесс, перитонит или флегмону забрюшинной клетчатки, что требует их адекватного дренирования с последующими санационными вмешательствами. В настоящее время предложены следующие доступы: чрескожный под УЗ-наведением, лапароскопический, лапаротомический, эндоскопический. Внутрипросветное дренирование является новым и малоизученным методом лечения. Материалы и методы За период с 2011 по 2021 год в НИИ СП имени Н. В. Склифосовского 22 пациентам с крупноочаговым панкреонекрозом было выполнено эндоскопическое транслюминальное дренирование. Из них 12 мужчин (55%) и 10 женщин (45%). Под ЭУС-наведением сформировали соустье меж ду полостью желудка/двенадцатиперстной кишки и зоной панкреатогенной деструкции, между ними устанавливали покрытый саморасширяющийся стент (HANAROSTENT) диаметром 1,4 см. Под рентген контролем через просвет стента в полость деструкции устанавливался цистоназальный дренаж диаметром 7Fr для ежедневных санаций полости 0,05% раствором хлоргексидина объемом 100,0 мл. При наличии связи жидкостного скопления (ЖС) с протоковой системой поджелудочной железы, выполнялось стентирование главного панкреатического протока пла- стиковыми панкреатическими стентами диаметром 7 Fr фирмы Olympus. Полученные результаты У 12 пациентов (55%) эндоскопическое дренирование зон панкреатогенной деструкции явилось окончательным методом хирургического лечения панкреонекроза. Реанимационных койко-дней составило 14 ± 13 суток. Общее количество койко-дней составило 47 ± 11 суток. Из 22 больных у 10 (45%) при контрольном УЗИ отмечались недренируемые в просвет желудка отроги со взвесью и секвестрами. Выявленные скопления потребовали дополнительного чрескожного дренирования под УЗ-наведением. У 3 больных (14%) при контрастировании полости отмечалась связь с протоковой системой поджелудочной железы, что потребовало выполнить этим пациентам панкреатодуоденальное стентирование пластиковым стентом диаметром 7 Fr. У всех пациентов после внутрипросветного дренирования определяли свободный газ в брюшной полости. Несмотря на это им было продолжено консервативное лечение, которое включало в себя постановку назогастрального зонда, коррекцию водно-электролитных нарушений и адекватное обезболивание. На 3-е сутки при контрольном рентгенологическом исследовании свободный газ в брюшной полости не определяется. У 4 пациентов (18%) ранний послеоперационный период осложнился кровотечением из зоны некротической деструкции. Двум из них была выполнена ангиография и эндоваскулярная эмболизиция a. Gastroduodenalis, одному – эндоскопический гемостаз, еще одному – эндоскопический гемостаз и ангиография с последующей эндоваскулярной эмболизицией a. Gastroduodenalis. У 1 (5%) пациента после эндоскопической санации с некрсеквестрэктомией в свободной брюшной полости определялось большое количество жидкости, в связи с чем выполнено чрескожное дренирование брюшной полости под УЗ-наведением. На 5-е сутки при контрольном УЗИ свободной жидкости в брюшной полости не определяется. Летальный исход наступил у 4 (18%) пациентов. У 3 больных причиной смерти явилась полиорганная недо- статочность. У четвертого больного причиной смерти явилась тяжелая внутрибольничная пневмония, развившаяся на 32 сутки после дренирования. Выводы Эндоскопическое дренирование крупноочагового панкреонекроза является перспективным минимально инвазивным методом в лечении панкреонекроза и может быть окончательным хирургическим методом лечения в 55%. Наличие свободного газа после манипуляции является ожидаемым и не является показанием к хирургической агрессии. СЛУЧАЙ МЕТАСТАЗА БЕСПИГМЕНТНОЙ МЕЛАНОМЫ В БОЛЬШОЙ ДУОДЕНАЛЬНЫЙ СОСОЧЕК Светлых Е. Д.; Колокольникова К. В.; Зиньковская А. Е.; Антон В. Г. Ленинградский областной клинический онкологический диспансер им. Л. Д. Романа г. Санкт-Петербург ■ Светлых Е. Д. ■ Колокольникова К. В. ■ Зиньковская А. Е. ■ Антон В. Г. Меланома – одна из самых агрессивных злокачественных опухолей, отличающаяся быстрым ростом и высоким потенциалом метастазирования. Это обусловлено тем, что меланоциты, являясь клетками нервного гребня, в эмбриогенезе наиболее активно расселяются по всем структурам организма, отсюда в канцерогенезе такая склонность к быстрому метастазированию в фактически любую локализацию, что не характерно для любых других опухолей, имеющих излюбленные зоны для секундарных изменений. Метастазы меланомы кожи в кишечник довольно редки, и преимущественно локализуются в прямой или тонкой кишке. В тонкой кишке опухоль может быть единичной или множественной, представляя собой диффузную инфильтрацию стенки кишки, внутрипросветную опухоль или интрамуральное поражение. Окраска опухоли может содержать совсем мало пигмента или не содержать его вовсе (беспигментная, или ахроматическая, меланома). Метастазирование меланомы в тонкую кишку прижизненно удается выявить лишь у 1-4% пациентов, в то время как по данным аутопсий частота обнаружения метастазов меланомы в тонкой кишке составляет до 60% [1,2,3]. В литературе описаны случаи диагностики первичной меланомы тонкой кишки, однако большинство ученых склонны считать такие наблюдения связанными с метастазированием меланомы из невыявленного первичного очага. Отсутствие первичной опухоли у части больных объясняется тем, что при появлении первых метастазов она не только перестает расти, но и под влиянием иммунной системы подвергается обратному развитию вплоть до полного регресса [4]. Клинические симптомы меланомы тонкой кишки неспецифичны. Больных могут беспокоить абдоминальные боли, тошнота, рвота, анемия и потеря веса. Течение за- болевания нередко осложняют кишечные кровотечения, перфорация, механическая кишечная непроходимость и инвагинация [5]. Пациентка Т, 52 года; из анамнеза и медицинской документации известно, что пациентка наблюдается с апреля 2019 г., когда при плановом обследовании было выявлено образование верхней доли левого легкого. При МРТ головного мозга от 24.06.2019 г. выявлена картина двух метастатических узлов на кортикомедуллярной границе правой лобной доли. 02.07.2019 г. выполнена диагностическая торакотомия слева, биопсия опухоли, атипичная резекция верхней доли. Морфологически подтвержден метастаз беспигментной меланомы. 19.07.2019 г. выполнен сеанс стереотаксической радиохирургии. С декабря 2019 г. по июль 2020 г. проведено 25 циклов иммунотерапии Ниволумабом. После 25-го цикла у пациентки возникла клиника иммуно-опосредованного гепатита 3 ст. Кроме того, в этот же период выявлен вирусный гепатит С с минимальной активностью, не требующий специального лечения (консультирована инфекционистом). При контрольной МСКТ органов грудной клетки и брюшной полости от 06.05.2020 г. выявлено уменьшение размеров очагов в легких. При МСКТ органов грудной клетки и брюшной полости от 16.11.2020 г. выявлено уменьшение размеров внутригрудных лимфоузлов, в остальном без значимой динамики. Пациентке рекомендовано динамическое наблюдение. В январе 2021 г. пациентка отметила появление кожного зуда, желтушность кожных покровов. При контрольной МСКТ органов грудной клетки и брюшной полости от 16.02.2021 г. выявлена отрицательная динамика в виде появления образования в панкреато-дуоденальной зоне с признаками сдавления, инвазии петель кишечника, хо- ледоха. В феврале 2021 года пациентке выполнено наружно-внутреннее дренирование желчных протоков для купирования холестаза. 24.03.2021 г. выполнена эзофагогастродуоденоскопия и эндосонография панкреатобилиарной зоны: В зоне БДС определяется опухолевая инфильтрация протяженностью более 4.0 см с наличием в ее толще функционирующей дренажной трубки. Выполнена биопсия опухоли ДПК. При выполнении ЭУС в режиме 7.5МГц из просвета желудка: Тело и хвост поджелудочной железы с ровными контурами, структура ее однородная. Панкреатический проток в теле расширен до 34 мм. Головка ПЖ увеличена в размерах, структура ее неоднородная, контур ее неровный. Главный панкреатический проток в головке поджелудочной железы – 4.5мм. По нижнему контуру крючковидного отростка, ниже ВБА лоцируется мягкотканное образование с перинодулярной васкуляризацией, размерами 24х22 мм. Произведена ТИП образования иглой 22G. Цитологическое исследование: цитологическая картина пигментной меланомы. Гистологическое исследование: фрагменты слизистой оболочки ДПК с разрастанием структур изъязвленной беспигментной эпителиоидноклеточной меланомы. Вывод Данный случай показывает сложность своевременной диагностики метастазов меланомы, непредсказуемость их появления и крайне быстрый экспансивный рост на фоне перерыва в таргетной терапии. Для постановки правильного диагноза необходимо использовать все возможные диагностические методы, начиная с общего осмотра больного на предмет наличия первичной меланомы, также помнить обо всех визуальных методах обследования, включая эндоскопические. Своевременная диагностика позволяет более эффективно действовать в выборе методов лечения в каждом индивидуальном случае. Литература 1. Blecker D., Abraham S., Furth E. E., Kochman M. L. Melanoma in the gastrointestinal tract // Am. J. Gastroenterol. 1999. Vol. 94. N12. Р. 3427-3433. 2. Krüger S., Noack F., Blöchle C., Feller A. C. Primary malignant melanoma of the small bowel: a case report and review of the literature // Tumori. 2005. Vol. 91. N1. Р. 73-76. 3. Wysocki W. M., Komorowski A. L., Darasz Z. Gastrointestinal metastases from malignant melanoma: report of a case // Surg. Today. 2004. Vol. 34. N6. Р. 542-546. 4. Sciacca V., Ciorra A. A., Di Fonzo C., Rossi R. et al. Long-term survival of metastatic melanoma to the ileum with evidence of primary cutaneous disease after 15 years of follow-up: a case report // Tumori. 2010. Vol. 96. N4. Р. 640-643. 5. Ачкасов Е. Е., Пугаев А. В., Мельников П. В., Алекперов С. Ф. и др. Инвагинационная тонкокишечная непроходимость, обусловленная метастазами меланомы в тонкую кишку // Хирургия. 2013. № 1. С. 83-87. ЭФФЕКТИВНОСТЬ ТОНКОИГОЛЬНОЙ ПУНКЦИИ ПОД КОНТРОЛЕМ ЭНДОСКОПИЧЕСКОЙ УЛЬТРАСОНОГРАФИИ НОВООБРАЗОВАНИЙ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ Солоницын Е. Г.1, Данилов И. Н.1, Камалова В. Ф.1, Ванян А. В.2, Поддымова А. В.1 1НМИЦ им.В.А.Алмазова 2ФГБУЗ Клиническая больница № 122 имени Л. Г. Соколова г. Санкт-Петербург Очаговые новообразования поджелудочной железы (ПЖ) – гетерогенная группа неоплазий. Учитывая современные представления о различном прогнозе разных неоплазий, дооперационная морфологическая диагностика приобретает все более важное значение. Эндоскопическая ультрасонография с тонкоигольной аспирационной пункцией (ЭУС-ТАП) позволяет безопасно выполнять забор материала для морфологического исследования. Улучшение методик получения материала является важной задачей в обследовании и наблюдении данной группы пациентов. Нами было проведено ретроспективное когортное исследование результатов ЭУС-ТАП при очаговых образованиях ПЖ. Исследование проводилось с 2014 по 2020 года на базе 2-х учреждений: ФГБУ «НМИЦ им. В. А. Алмазова» и ФГБУ «КБ№ 122 им. Л. Г. Соколова». В исследование было включено 244 пациента; 127 мужчин и 117 женщин, средний возраст составил 59,22±12,52 года. На материале ЭУС-ТАП у пациентов выполнялось цитологическое, гистологическое и иммуногистохмимическое исследование. Выборка была разделена на 3 подгруппы: солидные (N=166), кистозные (N=38) и кистозно-солидные (N=51) образования. Информативным морфологическое исследование было в 69,3%, сомнительным в 14,3%, неинформативным в 16,4%. Исследование расценивалось как неинформативное в случае невыявления признаков опухолевого процесса ввиду нескольких причин: описание лишь воспалительных изменений паренхимы и стромы (хронический псевдотуморозный панкреатит), в связи с отсутствием достаточного для исследования клеточного материала, и ввиду повреждения материала, не позволяющего адекватно приготовить и оценить полученный материал. Всего в общей выборке у 244 пациентов было выполнено 454 морфологических исследования. Из них 211 цитологических исследований, 149 гистологических и 94 иммуногистохимических. Информативность изолированного цитологического исследования составляла 17,5%, а в комбинации с другими методами – 82,5%. Эффективность рассчитывалась для тех исследований, в которых был известен окончательный морфологический диагноз (по результатам исследования операционного материала, повторной пункции, результатам долговременного скрининга). Чувствительность ЭУС-ТАП составила 90%, специфичность – 81,08%, прогностическая ценность положительного результата – 96,77%, прогностическая ценность отрицательного результата – 56,25% и точность – 82,98%. Наименьшие показатели точности были в группе кистозных образований – 66,67% по сравнению с солидными – 86,36% и кистозно-солидными – 87,5%. Самым сильным фактором, влияющим на информативность, являлся тип образования (x2=38,39, df=6, p=9.39e-07). Визуальные признаки панкреатита достоверно снижали информативность в группе солидных образований (p=0,0026). Такие факторы как возраст, пол, локализация и размер образования не влияли на информативность ЭУС ТАП. Осложнения имели место только в группе кистозных образований и составили 1,6% (4/244). Летальных исходов не было. Результаты нашего исследования показали высокую информативность и безопасность ЭУС ТАП для морфологической диагностики новообразований поджелудочной железы. Материал, полученный при ЭУС-ТАП, является достаточным для проведения на нем цитологического, гистологического и иммуногистохимического исследования. Сопутствующий хронический панкреатит достоверно снижает информативность ЭУС-ТАП в группе солидных образований. ЭУС-ТАП кистозных образований ассоциирован с наименьшей информативностью и наибольшим количеством осложнений. Таким образом, если принимается решение о пункции кистозного образования, то морфологические методы нужно дополнять биохимическими и молекулярно-биологическими исследованиями. ЭУС-ТАП является эффективным и безопасным методом забора материала при новообразованиях поджелудочной железы. КОМПЛЕКСНОЕ ЛЕЧЕНИЕ РАКА ГЕПАТОПАНКРЕАТОБИЛИОДУОДЕНАЛЬНОЙ ЗОНЫ, ОСЛОЖНЕННОГО МЕХАНИЧЕСКОЙ ЖЕЛТУХОЙ С ПРИМЕНЕНИЕМ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ Цеймах А. Е.1, Лазарев А. Ф.1,2, Секержинская Е. Л.2, Куртуков В. А.3, Мищенко А. Н.3, Теплухин В. Н.3, Шойхет Я. Н.1 1ФГБОУ ВО «Алтайский государственный медицинский университет» МЗ РФ 2ФГБУ «Российский онкологический научный центр имени Н. Н. Блохина» МЗ РФ 3КГБУЗ Городская больница № 5 г. Барнаул ■ Цеймах А. Е. ■ Мищенко А. Н. ■ Секержинская Е. Л. ■ Теплухин В. Н. ■ Куртуков В. А. ■ Шойхет Я. Н. Цель исследования Повысить эффективность комплексного паллиативного лечения рака гепатопанкреатобилиарной зоны, осложненного механической желтухой, с использованием фотодинамической терапии (ФДТ). Материалы и методы В сравнительное проспективное исследование включено 216 больных с механической желтухой опухолевого генеза, морфологически верифицированной, которым не было показано радикальное лечение, разделенных на две группы, статистически значимо не отличавшихся по возрасту, полу, уровню билирубинемии до лечения, этиологии желтухи. В основной группе, включавшей 41 пациента, было проведено комплексное хирургическое лечение с применением ФДТ. В группе сравнения, включавшей 175 пациентов, было проведено комплексное лечение без применения ФДТ. Комплексное лечение в обеих группах включало: чрескожную катетеризацию желчных протоков под ультразвуковым и рентгеновским контролем, наложение обходных билиодигестивных анастамозов; дезинтоксикационную, спазмолитическую, гепатопротекторную, инфузионную, антибактериальную терапию. У всех пациентов основной группы проводилась двухэтапная паллиативная ФДТ. Первым этапом проводилась системная ФДТ. В процессе инфузии через периферический доступ в кубитальную вену надвенно проводилось лазерное облучение крови монохроматическим светом с λ=662-665 нм с экспозиционной дозой света 1200-1400 Дж/см2. По истечении 3-5 ч с момента окончания инфузии вторым этапом осуществлялась локальная ФДТ путем облучения монохроматическим светом с λ=662 нм с экспозиционной дозой света 220 Дж/см2 через антеградный и/или Рис. 1 Рис. 2 Рис. 3 Рис. 4 Рис. 5 Рис. 6 ретроградный доступ в зависимости от нозологии (до- ступности опухоли). У всех больных основной группы со злокачественным новообразованием головки поджелудочной железы проводилась диагностика размеров новообразования до, в течение 3-7 дней после ФДТ с помощью мультиспиральной компьютерной томографии органов брюшной полости с внутривенным болюсным контрастированием (МСКТ ОБП с внутривенным болюсным контрастированием); до, в течение 3-7 дней и месяца после ФДТ с помощью ультразвукового исследования органов брюшной полости (УЗИ ОБП). Результаты Выявлено статистически значимое уменьшение размеров злокачественного новообразования головки поджелудочной железы в течение месяца после ФДТ по данным УЗИ ОБП с 40,00 (32,75;49,75) до 31,00 (29,50; 35,00) (р = 0,043), на 3-7 день по данным МСКТ ОБП с 42,50 (34,90; 53,50) до 38,00 (31,50; 50,50) (p = 0,039). Медиана выжи- ваемости в основной группе статистически значимо превышала группу сравнения: 539 (–; 153) в основной группе и 141 (287;38) в группе сравнения (p < 0,001), что проиллюстрировано на сравнительном графике функций выживания Каплан-Мейер (Рис. 1). Для иллюстрации приводим следующее клиническое наблюдение: Больному, 75 лет, после дообследования по данным УЗИ ОБП, холангиографии (Рис. 2), МСКТ ОБП с внутри- венным болюсным контрастированием (Рис. 3) и биопсии опухоли гепатикохоледоха был поставлен окончательный морфологически верифицированный клинический диагноз «Рак слизистой оболочки общего желчного протока (аденокарцинома) стадия IV T3N1M1. Метастаз в S5 печени. Механическая желтуха». Больному было проведено наружное дренирование желчных протоков под ультразвуковым контролем, антеградное стентирование гепатикохоледоха, локальная антеградная и эндоскопическая, а так же системная фотодинамическая терапия с контролем результатов лечения после операции по данным УЗИ ОБП, холангиографии (Рис. 4), МСКТ ОБП с внутривенным болюсным контрастированием (Рис. 5) и холедохоскопии (Рис. 6). По данным послеоперационного обследования выявлено восстановление просвета гепатикохоледоха более чем на 50% по данным холангиографии и холедохоскопии, исчезновение метастаза печени по данным УЗИ ОБП и МСКТ ОБП с внутривенным болюсным контрастированием. Клиника механической желтухи купирована. Выводы Паллиативное лечение с применением ФДТ злокачественных новообразований панкреатобилиарной зоны, осложненных механической желтухой, позволяет уменьшить наибольший размер новообразования головки поджелудочной железы, увеличить выживаемость у той категории больных, которым не показано радикальное оперативное лечение. CMOS CMOSматрица высокого разрешения в сочетании с многоступенчатой обработкой цвета, видеопроцессором HD-350, дают криСТаПьно четкое эндоскоnичеаrое изображение с низким уровнем "шума" Smart Workflow Интерфейс системы HD-35{] интуитивно понятен и помогает врачам с легкостью редаКJ111ровать отчёты, записывать видео и фото на USBносители, управлять файлами пациентов по протоколу локально :.\ сети DICOM. Clean and Clear Дополнительный канал для подачи воды WaterJet. помоrает поддерживать четкий эндоскопическийобзор, смывая слизь и кровь. SonoScape ООО «СОНОСКЕЙП МЕДИЦИНА РУС» 420108, Республика Татарстан, г. Ка3ань, ул. Мазита гафури, д. 50, этаж 1, помещение 38 Горячая линия: 8 (800) 511-94-32 E-mail: russia@sonoscape.net Марии некая больница Главный врач Врач-хирург высшей категории, доктор медицинских наук, профессор Завражнов Анатолий Анатольевич ЛЕЧЕБНО-ДИАГНОСТИЧЕСКИЕ ВОЗМОЖНОСТИ ЭНДОСКОПИИ ОТДЕЛЕНИЕ РАСПОЛАГЛЕТ ВСЕМИ ДОСТУПНЫМИ СРЕЛСТВАМИ ДЛЯ ОСУШЕСТВЛЕНИЯ ЭНДОСКОПИЧЕСКОЙ ОСТАНОВКИ КРОВОТЕЧЕНИЙ: 1. Лигирование варикозно -расширенных вен 2. Наложение эндоскопических гемостатических клипс 3. Инъекционный метод гемостаза 4. Аргона-плазменная и электрокоагуляция 5. Применение гемостатических склерозантов 6. Напыление на кровоточащую поверхность специальных гемостатических порошков с высокой адгезивной способностью ДИАГНОСТИЧЕСКИЕ ВОЗМОЖНОСТИ ЭНДОСКОПИЧЕСКОГО ОТДЕЛЕНИЯ 1. Высокоразрешающая цифровая колоноскопия с дополни тельным и методами исследования ( осмотр в узком спектре света, осмотр в режиме двойного фокуса) исследование позволяет выявить минимальные воспалительные или неопластические изменения слизистой толстой кишки в том числе ранние формы злокачественных неоплазий, выпол нить прицельный забор материала на гистологическое исследовании е, определить возможность и метод эндоско пического удаления. 2. Высокоразрешающая цифроваяэзофагогастродуоденоско пия с дополнительными методами исследования ( осмотр в узком спектре света, осмотр в режиме двойного фокуса) исследование позволяет выявить минимальные воспали тельные или неоnластические изменения слизистой толстой кишки в том числе ранние формы злокачественных неопла зий, выполнить прицельный забор материала на гистологиисследование, определить возможность и метод эндоскопического удаления, проведение экспресс-теста на Helicobacter pylory 3. Эндоскопическая улырасонография подслизистых образо ваний верхних отделов пищеварительного тракта, заболева ний панкреатобилиарной зоны с возможностью тонкоиголь ной пункции для морфологической верификации диагноза. 4. Диагностическая бронхоскопия с возможностью трансброн хиальной тонкоигольной пункции для получения материала для морфологического подтверждения диагноза 5. Диагностическая однобалонная знтероскопиядиагностика заболеваний тонкой кишки. ЛЕЧЕБНЫЕ ВОЗМОЖНОСТИ ЭНДОСКОПИЧЕСКОГО ОТДЕЛЕНИЯ 1. Лечение пациентов с ахалазией кардии любой стадии (дилатация, пероральная миотомия) 2. Эндоскоп ическое лечение пациентов с дивертикулом Ценкреа 3. Эндоскопическое лечении пациентов с рубцовыми стрик турами пищевода и толстой кишки любой этиологии (бужи рование, дилатация, стентирование) 4. Удаление доброкачественных (полипы) и ранних форм злокачественных новообразований толстой кишки и верхних отделов пищеварительного тракта методом резек· ции слизистой и диссекции в подслизистом слое 5. Эндоскопическое удаление аденомы большого дуоденаль наго соска 6. Эндоскопическое удаление камней из желчевыводящих протоков, папилосфинктеротомия, ретроградная халангио панкреатография 7. Эндоскопическое стентирование желчевыводящих и панк реатических протоков при доброкачественных и злокаче ственных стенозах. 8. Эндоскопическая установка гастостомы Эндоскопическая установка саморасправляющихся стентов --:::.. . Jl-i-.1.;11·· -.., пр и опухолевых стенозах пищевода и толстой кишки 10. Эндоскопическое удаление подслизсто расположенных образований. ǹǵDzǸǹǧȆ ǯ ǹǵǴDZǧȆ DZǯǿDZǧ МОВИПРЕП® отлицндR видимость ТОЧНЫЙ ДИАГНОЗ еЭффективнан подготовка к операцинм и диагностическим исследованиям "5 е Благоприятный профиль безопасности1 4 е Оптимальный объём раствора дли приёма 3 [окраwённаА мнпрукциА по примененм111 1оргош ,.,.. ,,.,_,,МОВ!ГРЕГ' l OilPREP'I г,,.• .,..._..1i11•н•111111i111: il.r. r.pfi.. DA R к .nr.,.i-+ r.ia1,1pr. r D/1" Нс, pii!Ji.i n fia, ,t а1р111 q, hфс, IК-1111.11 i.nop ,i-+ H.i, А ui p11t1: IIUI рCTIIн••• ••11•1: J1DJ)llllIOK ДЛtl n р пш вл Hlltl PiillЗВDpil Д.Л,1 п11ие 1о1 а НУТ]: ь. 11111 , rr••·· ·••11:111: мгIIJIDr ел зэsr, н три 11h.ii11 eЗRC!lf.lhlii, а1р111 'lnnpид N,il/11.11 'Q' nр111д ,ilC: CI Бlill,IC A,il lilt,n1i:1, а1р111 iflCМCp6a,- n111l IIII кl'IP•11i1e1i1e1i1••r nо,11н 1т□в1,1анпм,аг1,1 :: ш1 ec:нlit-.i 111ссг-е,11Оеа litfll,,I оn 1iir.iitp, Зli.11ОС:наг tснс -peliтrt o.n□r111 iec11□м п rм lri' r Лt,llfllШ!ИIIIM 1'11.JJt 1012) .. on pc, BliЬll
Рекомендуемые статьи
Синдром Бернара-Горнера
птоз, миоз и энофтальм при повреждении симпатического нерва (С7—Тh11) при осложненных дивертикулах, опухолях пищевода или метастазах в позвоночник.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.










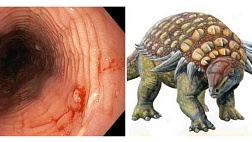





.jpg)





.png)

















Комментарии