- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Диагностика раннего рака желудка с помощью эндоскопии с усилением изображения: системный подход
| Авторы: | Masaki Miyaoka1, Kenshi Yao1, Hiroshi Tanabe2, Takao Kanemitsu1, Kensei Otsu3, Kentaro Imamura3, Yoichiro Ono3, Satoshi Ishikawa3, Tatsuhisa Yasaka3, Toshiharu Ueki3, Atsuko Ota2, Seiji Haraoka2, Akinori Iwashita2 1 2020г. |
| Об авторах: |
1. 1Department of Endoscopy, 2Department of Pathology, 3Department of Gastroenterology, Fukuoka University Chikushi Hospital, Chikushino City, Fukouka, Japan |
Аннотация:
В этой статье представлен обзор принципов системы классификации «сосуд плюс поверхность» (VS) для объяснения диагностической системы раннего рака желудка с использованием увеличивающей эндоскопии с усилением изображения.












Полный текст статьи:
Система классификации VC
Система классификации «сосуд плюс поверхность» (VS) является общепризнанной диагностической системой для дифференциации раковых и нераковых поражений с использованием увеличительной эндоскопии; эта система была предложена Yao et al. в 2009 году ( 1 ). Полезность этой системы для диагностики раннего рака желудка подтверждена доказательствами высокого уровня ( 4 , 5 ).). Наиболее полезные свойства этой диагностической системы заключаются в следующем: (I) она позволяет диагностировать мельчайшие раки размером ≤5 мм и ранние раки желудка поверхностного плоского (0–IIb) типа среди гастритоподобных раков (поверхностный тип раннего рака желудка, 0–II типы), который невозможно диагностировать с помощью обычной эндоскопии; (II) позволяет предоперационно определить необходимые границы раннего рака желудка.
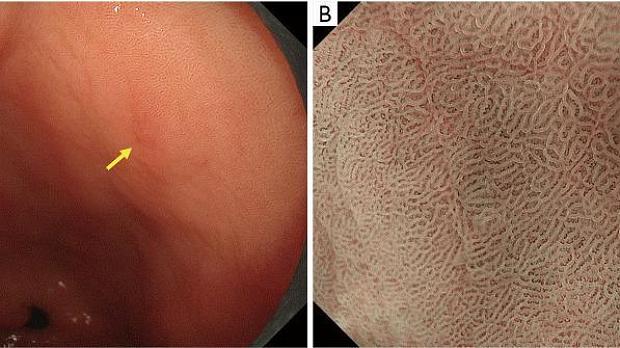
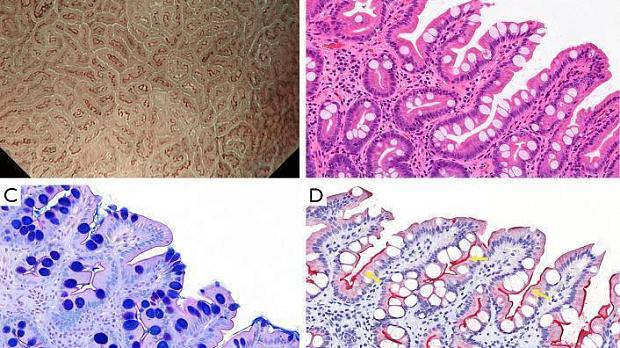
Основополагающим принципом системы классификации ВС является оценка микроваскулярного (МВ) и микроповерхностного (МС) паттернов с использованием анатомических терминов для анализа результатов эндоскопии желудка с увеличением ( рис. 1 ). Термины, используемые для анализа паттерна МВ, включают следующее: (I) субэпителиальная капиллярная сеть (SEC), (II) собирательная венула (CV) и (III) микрососуды (MV). Термины, используемые для анализа паттерна MS, включают следующее: (I) эпителий маргинальных крипт (MCE), (II) отверстие крипты (CO), (III) промежуточная часть между криптами (IP), (IV) светло-голубой гребень (LBC) и (V) белое непрозрачное вещество (WOS).
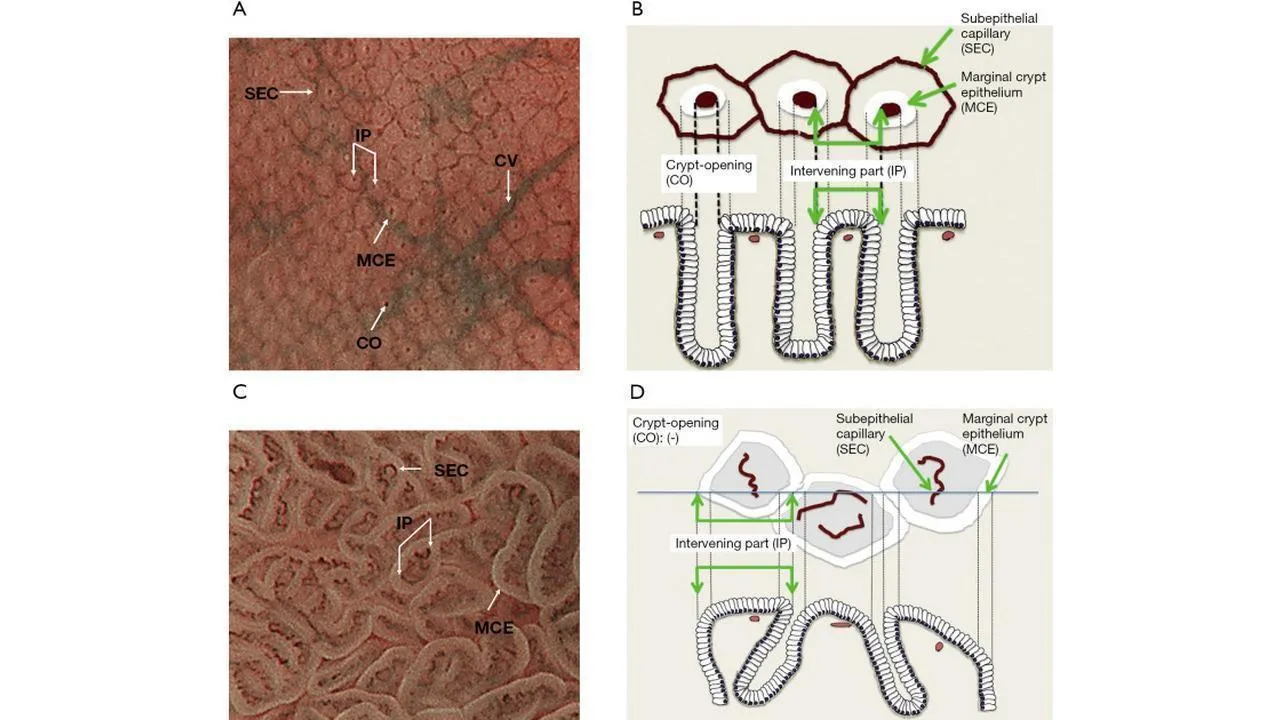
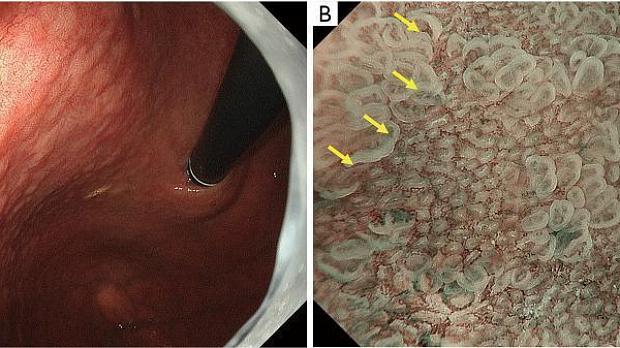
Рисунок 1. Микроанатомия, визуализированная с помощью эндоскопии с увеличением и узкоспектральной визуализацией (NBI) в желудке. (A) Увеличение эндоскопического изображения нормальной слизистой оболочки фундальной железы желудка с NBI. (B) Соответствие между увеличенным эндоскопическим изображением с NBI и гистологическими данными нормальной слизистой оболочки фундальной железы желудка. (C) Увеличение эндоскопического изображения с NBI нормальной слизистой оболочки пилорического отдела желудка. (D) Соответствие между NBI-комбинированным увеличительным эндоскопическим изображением и гистологическими данными нормальной слизистой оболочки пилорического отдела желудка. NBI, узкополосная визуализация; SEC, субэпителиальный капилляр; MCE, эпителий маргинальных крипт; СО, открытие склепа; CV, собирательная венула; ИП, промежуточная часть. [Перепечатано из ( 14 )].
Согласно системе классификации VS, характерные эндоскопические признаки раннего рака желудка включают наличие четкой демаркационной линии между раковой и нераковой слизистой оболочкой и наличие нерегулярного рисунка МК и/или нерегулярного рисунка МС внутри демаркационной линии. Демаркационная линия определяется как пограничная линия, распознаваемая по резкому изменению паттерна МВ или РС между пораженными и неповрежденными областями. Паттерны MV и MS оцениваются отдельно относительно того, являются ли они регулярными, нерегулярными или отсутствуют, и поражения, которые соответствуют следующим диагностическим критериям, диагностируются как злокачественные, тогда как те, которые не соответствуют, диагностируются как нераковые.
Диагностические критерии
I. Наличие нерегулярного рисунка МК с демаркационной линией;
II. Наличие неправильной картины MS с демаркационной линией.
Поражения, которые соответствуют критерию (I) или (II) (или обоим), диагностируются как раковые поражения, тогда как другие диагностируются как нераковые поражения.
Сообщалось, что 97% случаев раннего рака желудка теоретически соответствуют этим диагностическим критериям ( 1 ).
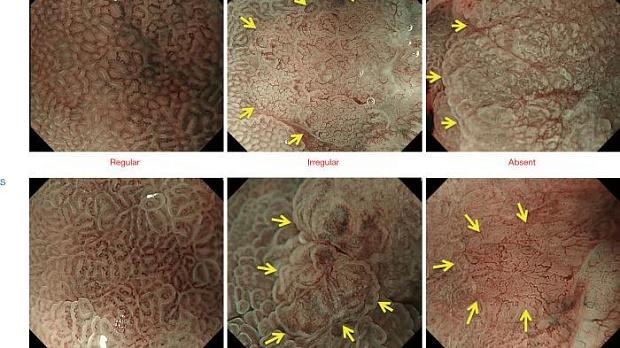
Как было показано ранее, паттерны MV и MS можно разделить на три категории: регулярные/нерегулярные/отсутствующие ( рис. 2 ).). При регулярном паттерне МВ капилляры под каждым эпителием имеют морфологию замкнутой петли (полигональной) или разомкнутой петли, демонстрируя правильное расположение симметрично распределенных однородных форм. Между тем, нерегулярный паттерн МК характеризуется закрытой петлей (полигональной), разомкнутой петлей, извилистой, разветвленной или неправильной морфологией. МВ имеют неоднородную форму и распределены асимметрично, что свидетельствует о неправильном расположении. Случаи, в которых нет наблюдаемых субэпителиальных МВ, расцениваются как отсутствие паттерна МВ. В таких случаях паттерн MS (показывающий такие особенности, как MCE, WOS и LBC) вместо паттерна MV используется в качестве индикатора для увеличения эндоскопической диагностики ( 2 ).
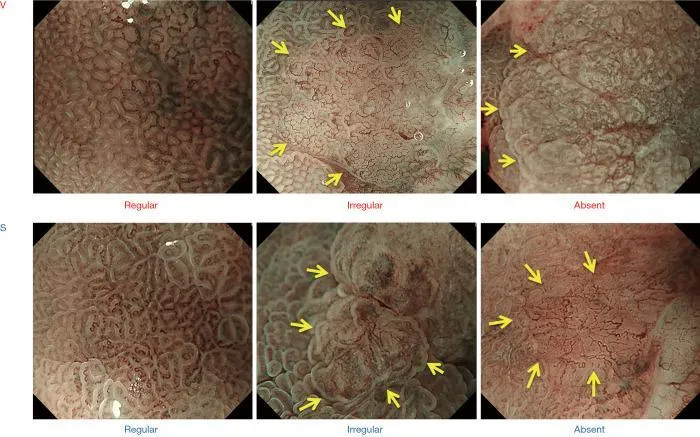
Рис. 2. Классификация ВС с использованием эндоскопии с увеличением и NBI. Микрососудистый паттерн (V) классифицируется как правильный/нерегулярный/отсутствующий, как и микроповерхностный паттерн (S) (желтые стрелки обозначают демаркационную линию). VS, сосуд плюс поверхность; NBI, узкополосная визуализация. [Перепечатано из ( 3 )].
Хотя MCE часто используется для оценки паттерна MS, другие данные, такие как CO, IP, LBC и WOS, также могут быть использованы, если они присутствуют. В регулярном паттерне MS морфология каждого MCE изогнута или овальна, демонстрируя однородные формы, симметричное распределение и регулярное расположение. При нерегулярной картине MS морфология каждого MCE изогнута или овальна, или в редких случаях ворсинчатая, демонстрирующая гетерогенные формы, асимметричное распределение и неправильное расположение. Когда паттерн MS, включая MCE, не наблюдается, случай расценивается как отсутствие паттерна MS. В таких случаях картина МК обязательно хорошо визуализируется; поэтому особенности картины МК вместо картины МС используются в качестве индикаторов для увеличения эндоскопической диагностики ( 1 ).
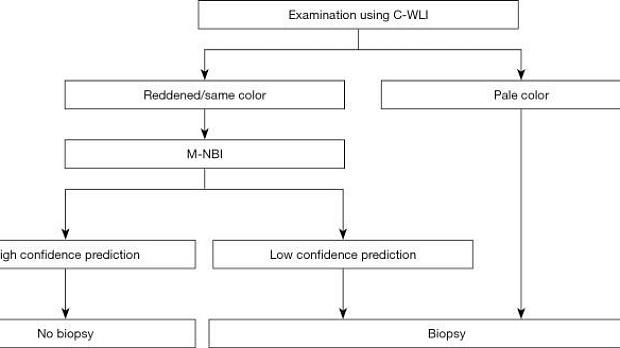
В многоцентровом проспективном исследовании также было показано, что некоторые поражения трудно обнаружить при эндоскопии с увеличением с использованием системы классификации VS ( 5 ). Такие поражения представляют собой обесцвеченные, плоские недифференцированные раковые образования. Принимая во внимание клинические ограничения, мы предложили клиническую стратегию, как показано на рисунке 3 .
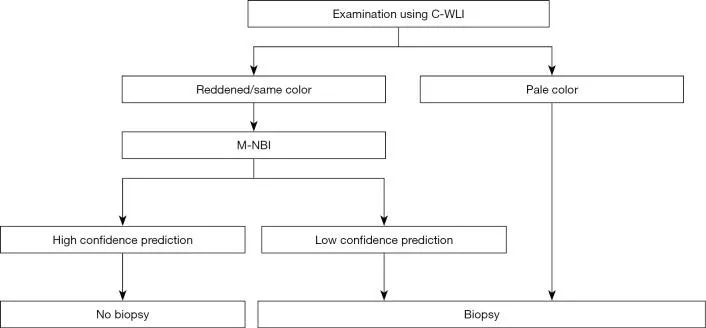
Рис. 3. Стратегия увеличения эндоскопии с NBI при скрининговой гастроскопии. C-WLI, обычная эндоскопия с визуализацией в белом свете; M-NBI, увеличительная эндоскопия с узкоспектральной визуализацией; NBI, узкополосная визуализация. [Перепечатано из ( 5 )].
В частности, мы предположили, что биопсия необходима при обесцвеченных, плоских поражениях слизистой оболочки, тогда как увеличительная эндоскопия желудка может использоваться в качестве оптической биопсии в случаях других поражений, если существует прогноз с высокой степенью достоверности. Алгоритм простой диагностики рака желудка с эндоскопией с увеличением (MESDA-G), описанный ниже, также следует применять в соответствии с этой клинической стратегией. На рис. 4 показан обесцвеченный плоский рак желудка недифференцированного типа, который трудно диагностировать с помощью эндоскопии с увеличением с использованием системы классификации VS.
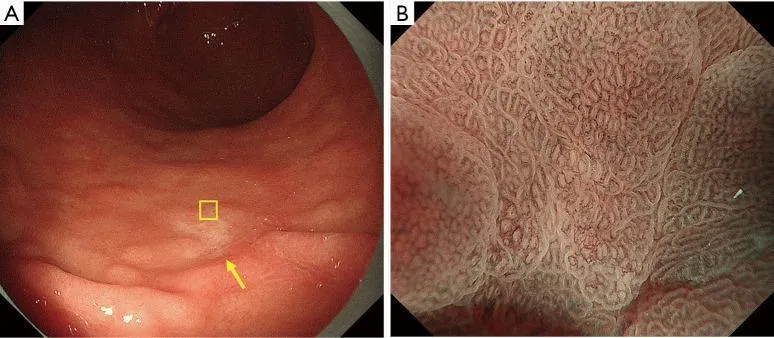
Рисунок 4 Сложный случай увеличительной эндоскопической диагностики с использованием системы классификации ВС. Демаркационная линия отсутствует, неправильная картина МВ отсутствует, неправильная картина МС отсутствует. (A) Обычное эндоскопическое изображение. На большой кривизне антрального отдела желудка имеется четко очерченное слегка вдавленное бледное образование (желтая стрелка). (B) Увеличение эндоскопического изображения с NBI [максимальное увеличение области желтого квадрата (A)]. Было установлено, что нет резких изменений в капиллярах под эпителием слизистой оболочки или MCE в обеих слизистых оболочках на фоне поражения. Соответственно демаркационная линия отсутствует. Формы отдельных микрососудов однородны, имеют симметричное распределение и правильное расположение. Таким образом, паттерн расценивали как обычный паттерн МК. Что касается рисунка МС, эпителий маргинальных крипт имеет овальную форму, показывая однородные формы, симметричное распределение и регулярное расположение. Таким образом, картина расценивалась как обычная картина РС. Таким образом, поражение имело регулярный паттерн МВ плюс регулярный паттерн МС без демаркационной линии, и в соответствии с системой классификации ВС был поставлен диагноз доброкачественного поражения. Однако гистологически поражение было диагностировано как перстневидно-клеточная карцинома. Эти обесцвеченные недифференцированные раковые образования представляют собой сложные случаи для диагностики с помощью эндоскопии с увеличением, требующей биопсии для установления окончательного диагноза. VS, сосуд плюс поверхность; МВ, микрососудистый; МС, микроповерхность; NBI, узкополосная визуализация; MCE, маргинальный эпителий крипт. Таким образом, поражение имело регулярный паттерн МВ плюс регулярный паттерн МС без демаркационной линии, и в соответствии с системой классификации ВС был поставлен диагноз доброкачественного поражения. Однако гистологически поражение было диагностировано как перстневидно-клеточная карцинома. Эти обесцвеченные недифференцированные раковые образования представляют собой сложные случаи для диагностики с помощью эндоскопии с увеличением, требующей биопсии для установления окончательного диагноза. VS, сосуд плюс поверхность; МВ, микрососудистый; МС, микроповерхность; NBI, узкополосная визуализация; MCE, маргинальный эпителий крипт. Таким образом, поражение имело регулярный паттерн МВ плюс регулярный паттерн МС без демаркационной линии, и в соответствии с системой классификации ВС был поставлен диагноз доброкачественного поражения. Однако гистологически поражение было диагностировано как перстневидно-клеточная карцинома. Эти обесцвеченные недифференцированные раковые образования представляют собой сложные случаи для диагностики с помощью эндоскопии с увеличением, требующей биопсии для установления окончательного диагноза. VS, сосуд плюс поверхность; МВ, микрососудистый; МС, микроповерхность; NBI, узкополосная визуализация; MCE, маргинальный эпителий крипт. Эти обесцвеченные недифференцированные раковые образования представляют собой сложные случаи для диагностики с помощью эндоскопии с увеличением, требующей биопсии для установления окончательного диагноза. VS, сосуд плюс поверхность; МВ, микрососудистый; МС, микроповерхность; NBI, узкополосная визуализация; MCE, маргинальный эпителий крипт. Эти обесцвеченные недифференцированные раковые образования представляют собой сложные случаи для диагностики с помощью эндоскопии с увеличением, требующей биопсии для установления окончательного диагноза. VS, сосуд плюс поверхность; МВ, микрососудистый; МС, микроповерхность; NBI, узкополосная визуализация; MCE, маргинальный эпителий крипт.
MESDA-G с использованием системы классификации VS
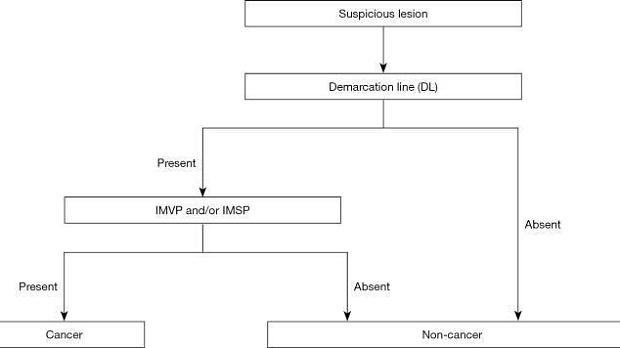
Хотя в Японии и других странах были предложены многочисленные диагностические системы, направленные на усиление эндоскопической диагностики раннего рака желудка, не было достигнуто консенсуса в отношении установленного и стандартизированного набора диагностических критериев или диагностической системы. На этом фоне Подкомитет по рекомендациям Японской гастроэнтерологической ассоциации провел систематический обзор и выбрал термины и диагностическую систему, которые будут использоваться для расширения эндоскопической диагностики желудка в доказательной медицине. Следовательно, система классификации VS была принята в качестве диагностической системы вместе с анатомическими терминами, используемыми для этой системы. На этой основе была предложена MESDA-G ( 3). Этот алгоритм был одобрен Японской гастроэнтерологической ассоциацией, Японским обществом гастроэнтерологической эндоскопии, Японской ассоциацией рака желудка и Всемирной эндоскопической организацией, и был достигнут консенсус в отношении его статуса стандартизированного алгоритма. На рис. 5 показан алгоритм. Во-первых, эндоскопия с увеличением в белом свете используется для осмотра внутренней части желудка в соответствии с протоколом систематического скрининга желудка ( 15 ) для проведения обследований на предмет любых поражений, указывающих на ранний рак желудка. При обнаружении такого подозрительного поражения следует провести эндоскопию с увеличением для дифференциации раковых и нераковых поражений. Более конкретно, наличие/отсутствие демаркационной линии следует определять с помощью увеличительной эндоскопии (Рисунок 5 ). Если демаркационная линия не определяется, поражение должно быть диагностировано как нераковое. Если есть демаркационная линия, паттерны MV и MS внутри демаркационной линии должны быть исследованы отдельно на предмет того, являются ли они правильными, нерегулярными или отсутствуют. Если выявляется неправильный паттерн МК и/или нерегулярный паттерн МС, поражение диагностируется как рак, тогда как, если эти паттерны не идентифицируются, поражение диагностируется как доброкачественное. Это действительно простой и понятный алгоритм. На рисунках 6-8 представлены фактические результаты эндоскопии, чтобы показать процедуры, выполненные для диагностики на основе MESDA-G.
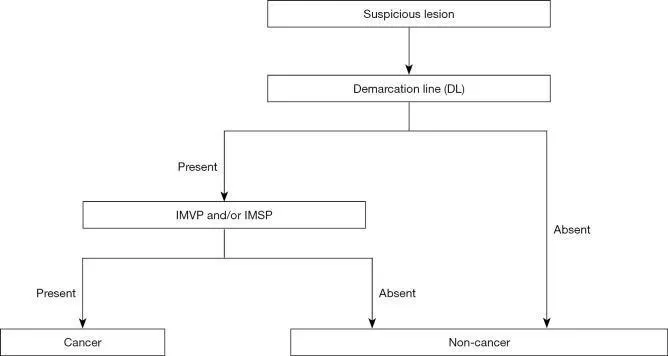
Рисунок 5. Простой диагностический алгоритм эндоскопии с увеличением для раннего рака желудка (MESDA-G). VS, сосуд плюс поверхность; IMVP, нерегулярный микрососудистый рисунок; IMSP, неправильный рисунок микроповерхности. [Перепечатано с некоторыми изменениями из ( 3 )].
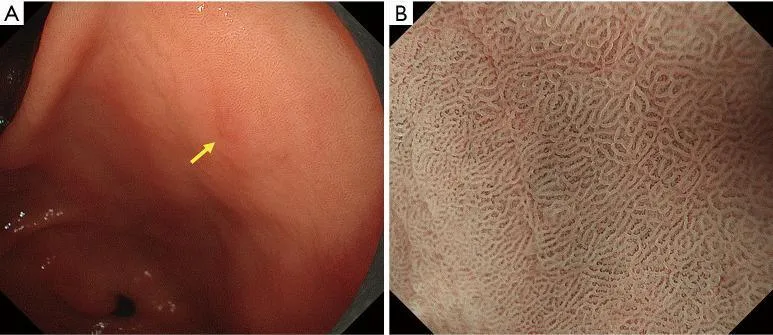
Рисунок 6 Пример применения MESDA-G (I). Демаркационная линия: отсутствует. (A) Обычное эндоскопическое изображение. На задней стенке антрального отдела желудка имеется плоское красноватое поражение слизистой оболочки (желтая стрелка). (B) Увеличение эндоскопического изображения с NBI. Субэпителиальные капилляры постепенно расширяются в областях от некрасноватого до красноватого цвета. Кроме того, происходит постепенное изменение формы МКЭ. Более конкретно, нет идентифицируемого резкого изменения в пограничной области между паттернами MV и MS. Таким образом, демаркационная линия была сочтена отсутствующей. Диагноз неракового поражения был поставлен в соответствии с MESDA-G. MESDA-G, простой диагностический алгоритм эндоскопии с увеличением при раке желудка; NBI, узкополосная визуализация; MCE, эпителий маргинальных крипт; МВ, микрососудистый; МС, микроповерхность.
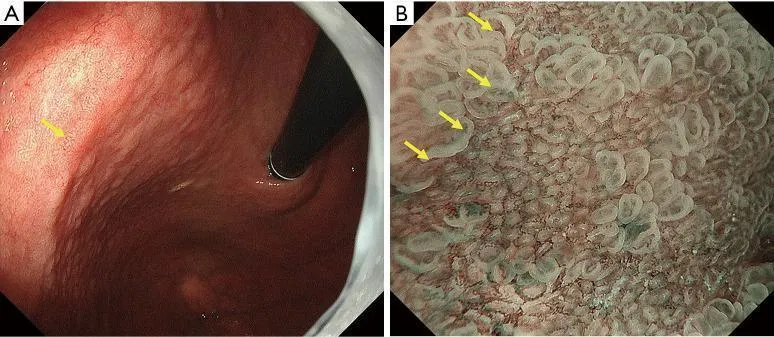
Рисунок 7Пример применения MESDA-G (II). Демаркационная линия: присутствует; неправильный паттерн МК: отсутствует; неправильный паттерн МС: отсутствует. (A) Обычное эндоскопическое изображение. Регионарное, слегка вогнутое красноватое поражение присутствует на задней стенке тела желудка (желтая стрелка). (B) Увеличение эндоскопического изображения с NBI. Наблюдается резкое изменение паттернов МВ и МС в месте, указанном желтыми стрелками. А именно, демаркационная линия присутствует. В этом случае классификация ВС паттернов МВ и МС внутри демаркационной линии проводилась в соответствии с MESDA-G, чтобы судить о наличии или отсутствии неправильного паттерна МК и/или неправильного паттерна МС. В картине МВ формы отдельных микрососудов однородны, демонстрируя симметричное распределение и правильное расположение. Следовательно, в этом случае было сочтено, что у него обычная картина МК. Что касается рисунка MS, MCE имеет овальную морфологию, показывая однородные формы, симметричное распределение и правильное расположение. В железистых отверстиях регулярно расположены правильные светло-голубые гребни. На основании этих данных было установлено, что случай имеет регулярный характер рассеянного склероза. Таким образом, поражение было оценено как имеющее регулярный паттерн MV плюс регулярный паттерн MS в соответствии с системой классификации VS, что привело к диагнозу неракового поражения. MESDA-G, простой диагностический алгоритм эндоскопии с увеличением при раке желудка; МВ, микрососудистый; МС, микроповерхность; NBI, узкополосная визуализация; VS, сосуд плюс поверхность; MCE, маргинальный эпителий крипт. и обычная аранжировка. В железистых отверстиях регулярно расположены правильные светло-голубые гребни. На основании этих данных было установлено, что случай имеет регулярный характер рассеянного склероза. Таким образом, поражение было оценено как имеющее регулярный паттерн MV плюс регулярный паттерн MS в соответствии с системой классификации VS, что привело к диагнозу неракового поражения. MESDA-G, простой диагностический алгоритм эндоскопии с увеличением при раке желудка; МВ, микрососудистый; МС, микроповерхность; NBI, узкополосная визуализация; VS, сосуд плюс поверхность; MCE, маргинальный эпителий крипт. и обычная аранжировка. В железистых отверстиях регулярно расположены правильные светло-голубые гребни. На основании этих данных было установлено, что случай имеет регулярный характер рассеянного склероза. Таким образом, поражение было оценено как имеющее регулярный паттерн MV плюс регулярный паттерн MS в соответствии с системой классификации VS, что привело к диагнозу неракового поражения. MESDA-G, простой диагностический алгоритм эндоскопии с увеличением при раке желудка; МВ, микрососудистый; МС, микроповерхность; NBI, узкополосная визуализация; VS, сосуд плюс поверхность; MCE, маргинальный эпителий крипт. в результате диагностируется нераковое поражение. MESDA-G, простой диагностический алгоритм эндоскопии с увеличением при раке желудка; МВ, микрососудистый; МС, микроповерхность; NBI, узкополосная визуализация; VS, сосуд плюс поверхность; MCE, маргинальный эпителий крипт. в результате диагностируется нераковое поражение. MESDA-G, простой диагностический алгоритм эндоскопии с увеличением при раке желудка; МВ, микрососудистый; МС, микроповерхность; NBI, узкополосная визуализация; VS, сосуд плюс поверхность; MCE, маргинальный эпителий крипт.
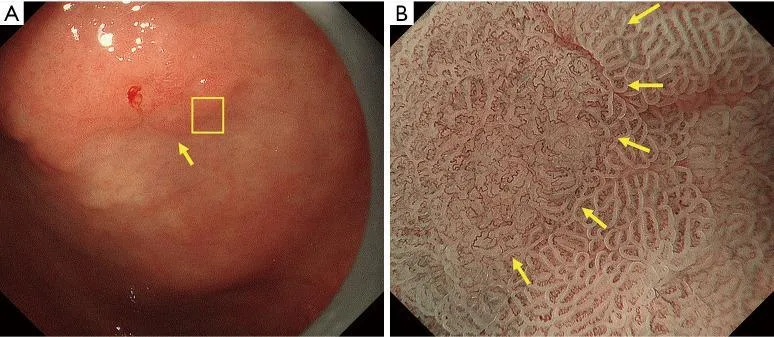
Рисунок 8Пример применения MESDA-G (III). Демаркационная линия: присутствует; неправильный паттерн МК: присутствует; нерегулярный МС: присутствует. (A) Обычное эндоскопическое изображение. На малой кривизне антрального отдела желудка имеется четко очерченное вдавленное поражение, сопровождающееся неравномерным покраснением (желтая стрелка). (B) Эндоскопическое изображение с увеличением с помощью NBI [область желтого квадрата на (A)]. В приграничной области видна четкая демаркационная линия (желтые стрелки). Что касается структуры МК внутри демаркационной линии, то каждый микрососуд имеет неправильную петлевую морфологию. Микрососуды имеют неоднородную форму, асимметричное распределение и неправильное расположение. Таким образом, картина была расценена как неправильная картина МК. Что касается картины рассеянного склероза, то есть некоторые области, лишенные MCE, которые были сочтены имеющими отсутствующую картину рассеянного склероза. В областях, где виден MCE, каждый имеет дугообразную морфологию МКЭ, то есть формы МКЭ неоднородны, с асимметричным распределением и неправильным расположением. Было сочтено, что случай имел отсутствующий/нерегулярный паттерн рассеянного склероза. Основываясь на этих результатах, картина была расценена как неправильная картина МК плюс отсутствующая / нерегулярная картина МС в соответствии с системой классификации VS, и был поставлен диагноз рака. MESDA-G, простой диагностический алгоритм эндоскопии с увеличением при раке желудка; МВ, микрососудистый; МС, микроповерхность; NBI, узкополосная визуализация; MCE, эпителий маргинальных крипт; VS, сосуд плюс поверхность. паттерн был расценен как неправильный паттерн МК плюс отсутствующий/нерегулярный паттерн РС в соответствии с системой классификации VS, и был поставлен диагноз рака. MESDA-G, простой диагностический алгоритм эндоскопии с увеличением при раке желудка; МВ, микрососудистый; МС, микроповерхность; NBI, узкополосная визуализация; MCE, эпителий маргинальных крипт; VS, сосуд плюс поверхность. паттерн был расценен как неправильный паттерн МК плюс отсутствующий/нерегулярный паттерн РС в соответствии с системой классификации VS, и был поставлен диагноз рака. MESDA-G, простой диагностический алгоритм эндоскопии с увеличением при раке желудка; МВ, микрососудистый; МС, микроповерхность; NBI, узкополосная визуализация; MCE, эпителий маргинальных крипт; VS, сосуд плюс поверхность.
Характерные признаки слизистой оболочки желудка при увеличительной эндоскопии с усилением изображения
WOS
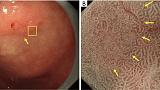
WOS представляет собой белое вещество, скрывающее субэпителиальные МВ, присутствующие в поверхностном слое слизистой оболочки, четко визуализируемые при эндоскопии с увеличением и узкоспектральной визуализацией (NBI). О присутствии WOS в слизистой оболочке желудка впервые сообщили Yao et al. в 2008 г. Это открытие часто обнаруживается при кишечной метаплазии в слизистой оболочке хронического гастрита и в эпителиальных опухолях желудка (аденома или рак) с кишечным фенотипом ( 2 , 16 , 17 ). Природа WOS — это явление, которое определяется как белое вещество, наблюдаемое за счет сильного рассеяния или отражения проецируемого света от эндоскопии на мельчайших каплях жира, скопившихся в эпителии и под ним ( 18 , 19 ).). При наличии СОС проецируемый свет не может достигать субэпителиальных МК, что приводит к плохой видимости сосудов. Различия в морфологических особенностях СВО служат полезными индикаторами при дифференциальной диагностике рака и аденомы. Более конкретно, раковые поражения имеют нерегулярный WOS, тогда как аденоматозные поражения низкой степени имеют регулярный WOS ( 2 ). Кроме того, сообщалось, что WOS-положительные эпителиальные опухоли желудка имеют слизистый характер некоторого кишечного фенотипа (кишечного типа или желудочно-кишечного фенотипа) ( 18 ) и что WOS служит индикатором рака дифференцированного типа, поскольку WOS отсутствует в рак недифференцированного типа ( 20 ). Рисунки 9 и 10показать фактические результаты эндоскопии.
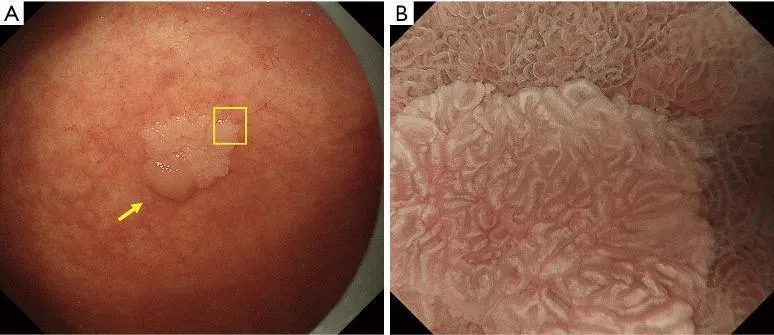
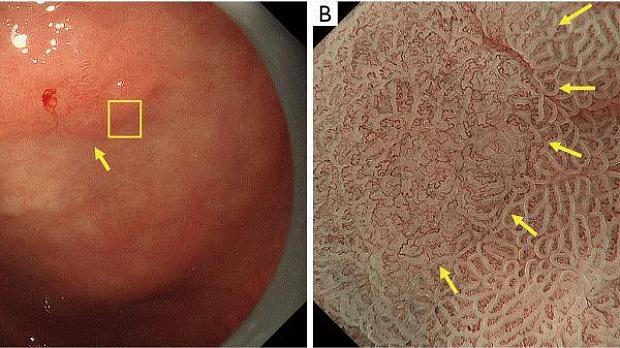
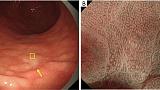
Рисунок 9Аденома низкой степени злокачественности с обычным WOS (не рак). (A) Обычное эндоскопическое изображение (белый свет). Плоско-возвышенное обесцвеченное образование (желтая стрелка) присутствует на передней стенке в нижней части тела желудка. (B) Увеличение эндоскопического изображения с NBI [максимальное увеличение области желтого квадрата (A)]. ВОС внутри демаркационной линии очень плотный и большой и локализован в промежуточной части. WOS показывает однородные формы, симметричное распределение и регулярное расположение, что позволяет судить о регулярном шаблоне MS (обычный WOS). Микрососудистые структуры не видны из-за наличия СОС; поэтому паттерн был расценен как отсутствующий паттерн МК. В соответствии с классификационной системой ВС результатом был отсутствующий паттерн МВ плюс регулярный паттерн МС с демаркационной линией, и был поставлен диагноз неракового поражения. Гистологически поражение представляло собой тубулярную аденому низкой степени злокачественности. WOS, белое непрозрачное вещество; NBI, узкополосная визуализация; МС, микроповерхность; МВ, микрососудистый; VS, сосуд плюс поверхность.
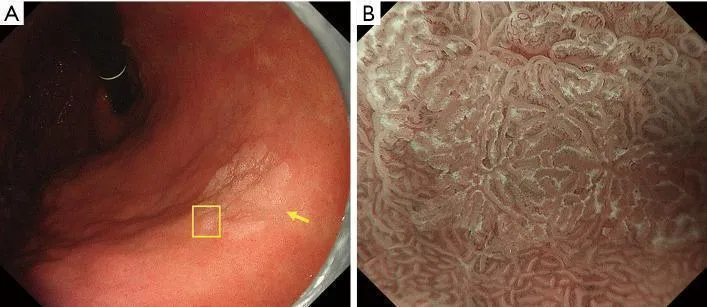
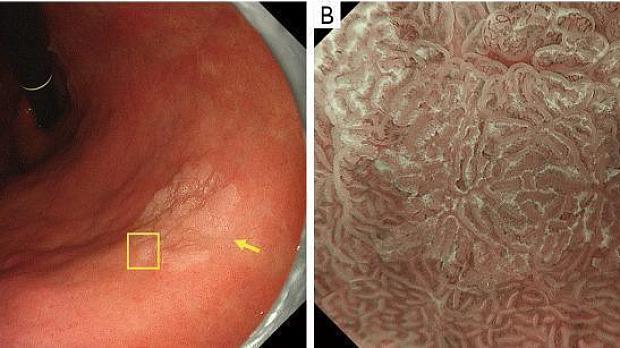
Рисунок 10Высокодифференцированная аденокарцинома (рак) имеет нерегулярный WOS. (A) Обычное эндоскопическое изображение (белый свет). На малой кривизне в нижней части тела желудка имеется бесцветное возвышающееся образование (желтая стрелка). (B) Эндоскопическое изображение с увеличением с помощью NBI [максимальное увеличение области желтого квадрата, показанное на (A)]. WOS внутри демаркационной линии показывает неоднородные формы, симметричное распределение и неравномерное расположение, что приводит к суждению о неправильной структуре MS (нерегулярный WOS). Микрососудистые структуры не видны из-за наличия СВО, и картина была расценена как отсутствие паттерна МК. В соответствии с классификационной системой ВС результатом был отсутствующий паттерн МК плюс нерегулярный паттерн МС с демаркационной линией, что привело к диагностике рака. Гистопатологически, поражение представляло собой очень хорошо дифференцированную тубулярную аденокарциному. WOS, белое непрозрачное вещество; NBI, узкополосная визуализация; МС, микроповерхность; МВ, микрососудистый; VS, сосуд плюс поверхность.
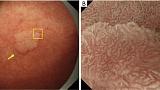
LBC
Было показано, что увеличительная эндоскопия с NBI полезна для диагностики кишечной метаплазии ( 21-23 ) . Сравнение эндоскопии с увеличением с NBI и эндоскопии с увеличением в белом свете показало превосходство первого над вторым для правильной диагностики кишечной метаплазии ( 24 ). Знак LBC был впервые описан Uedo et al. в 2006 году ( 25 ). Согласно их отчету, LBC определяется как сине-белые линии света, наблюдаемые на краю MCE при эндоскопии с увеличением с NBI ( рис. 11 ).). Признак LBC считается феноменом, возникающим, когда щеточная кайма абсорбирующей эпителиальной поверхности гистопатологически CD10-положительной кишечной метаплазии отражает узкополосный свет, имеющий центральную длину волны 415 нм. Что касается диагностической способности LBC для гистопатологической кишечной метаплазии, сообщаемая чувствительность и специфичность составляют 89% и 93% соответственно ( 25 ). Кроме того, Канемицу и соавт. использовали комбинацию LBC и WOS для диагностики кишечной метаплазии и сообщили о чувствительности и специфичности 87,5% и 93,8% соответственно ( 17 ). Более того, метаанализы, включая исследования, проведенные за пределами Японии, также подтвердили превосходную диагностическую способность LBC при диагностике кишечной метаплазии.26-28 ) . _ Признак LBC также полезен для определения границы опухоли; граница без LBC часто совпадает с границей опухоли ( рис. 12 ).
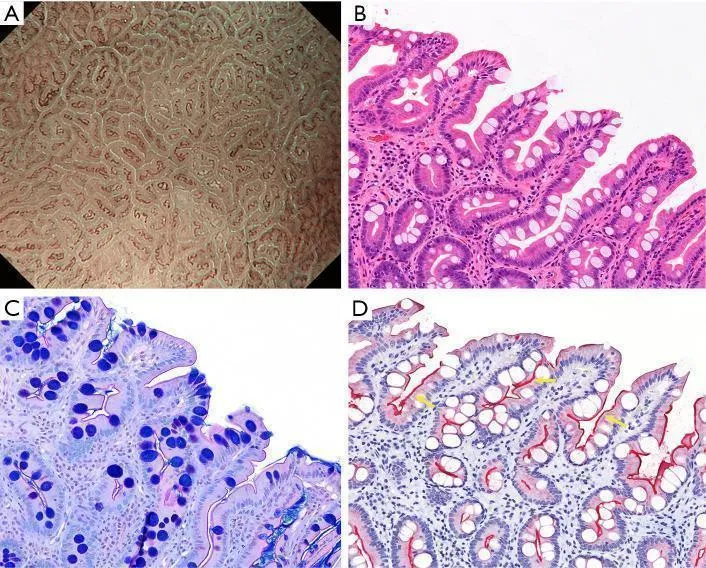
Рисунок 11 Слизистая оболочка, положительная на LBC. (A) Увеличение эндоскопического изображения с NBI, показывающее LBC на краю MCE. (B) Гистопатологический вид с окрашиванием гематоксилином и эозином (H&E) (увеличение × 20), показывающий бокаловидные клетки в эпителии крипт и щеточную кайму, видимую на поверхности эпителия. (C) Гистопатологический вид с окрашиванием альциановым синим периодической кислотой-Шиффом (увеличение × 20), показывающим бокаловидные клетки и четко видимую щеточную границу. (D) Иммуногистохимическое окрашивание (CD10, увеличение ×20): щеточная кайма (желтые стрелки) на поверхности абсорбирующего эпителия кишечной метаплазии становится CD10-положительной. LBC, светло-голубой гребень; NBI, узкополосная визуализация; MCE, маргинальный эпителий крипт. [Перепечатано из ( 17 )].
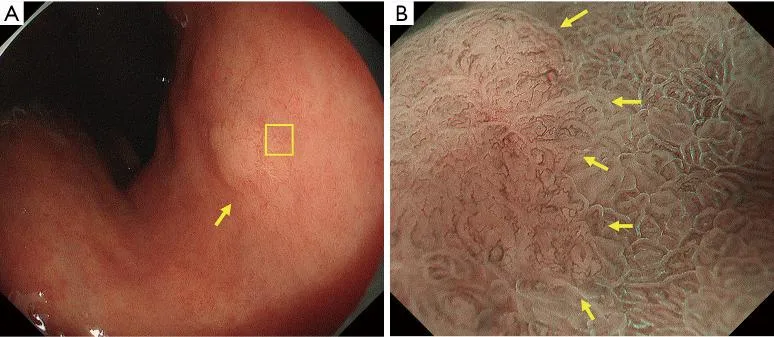
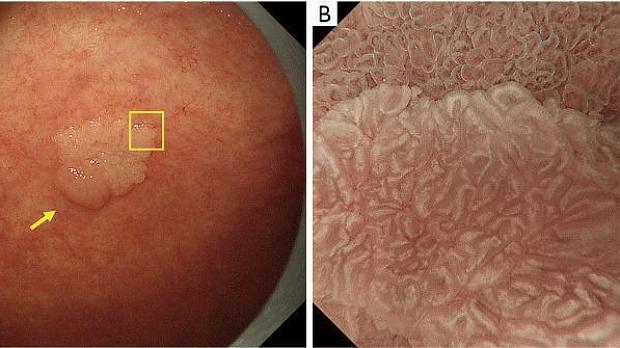
Рисунок 12. Аденома низкой степени злокачественности (не рак), при которой LBC используется для границы опухоли. (A) Обычное эндоскопическое изображение (белый свет). На малой кривизне тела желудка имеется обесцвеченное плоское образование (желтая стрелка). (B) Эндоскопическое изображение с увеличением с помощью NBI [максимальное увеличение области желтого квадрата, показанное на (A)]. Вокруг поражения имеется LBC-положительная кишечная метаплазия, а линия прекратившейся LBC соответствует границе опухоли (желтые стрелки). Опухоль представляла собой тубулярную аденому низкой степени злокачественности. LBC, светло-голубой гребень; NBI, узкополосная визуализация.
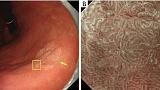
Внешний вид белого глобуса (WGA)
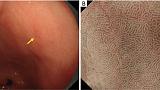
АЗП, если он присутствует внутри демаркационной линии, является высокоспецифичным признаком эндоскопии с увеличением, что позволяет провести дифференциальную диагностику между раковыми и нераковыми поражениями дифференцированного типа. WGA определяется как небольшое (размером ≤1 мм) белое шаровидное образование непосредственно под эпителием, обнаруживаемое при эндоскопии с увеличением с NBI. О WGA впервые сообщили Doyama et al. в 2015 году ( 29). Это соответствует так называемому внутрижелезистому некротическому мусору, который представляет собой заметно расширенный проток опухолевой железы, содержащий оставшийся эозинофильный некротический материал, наблюдаемый при тщательном гистопатологическом исследовании. WGA является высокоспецифичным онкомаркером для увеличительной эндоскопии. Другими словами, наличие АЗП позволяет провести дифференциальную диагностику между раковыми и нераковыми поражениями дифференцированного типа, такими как аденома низкой степени злокачественности и гастрит, с высокой специфичностью ( рис. 13 ).
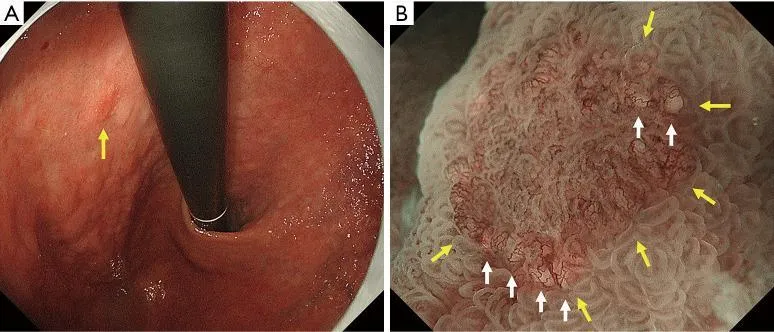
Рис. 13. Случай с WGA. (A) Обычное эндоскопическое изображение (белый свет). На задней стенке малой кривизны в верхней части тела желудка имеется покрасневшее регионарное плоское поражение слизистой оболочки (желтая стрелка), а в краевых областях поражения видны белые пятна. (B) Увеличение эндоскопического изображения с NBI. Было подтверждено, что белые пятна, наблюдаемые при обычной эндоскопии (белый свет), представляют собой АЗП (белые стрелки). АЗП обычно обнаруживается в раковой слизистой оболочке очень близко к демаркационной линии (желтые стрелки). WGA, внешний вид белого шара; NBI, узкополосная визуализация.
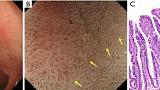
Сосуды внутри эпителиального круга (VEC)
Сообщалось, что патологическое исследование показывает более высокую биологическую злокачественность папиллярной аденокарциномы, чем тубулярной аденокарциномы. Однако с помощью обычной эндоскопии диагностировать папиллярную аденокарциному не удалось. Канемицу и др. наблюдал ранний рак желудка с помощью эндоскопии с увеличением и заметил специфическое обнаружение того, что кровеносные сосуды присутствуют под поверхностным эпителием промежуточной части, окруженной круговой MCE. Они назвали это «паттерн сосудов внутри эпителиального круга (VEC)» и сообщили, что этот паттерн характерен для рака дифференцированного типа, показывающего гистологически папиллярную структуру ( 30 ) ( рис. 14 ).). Кроме того, они сообщили о сосуществовании рака недифференцированного типа и/или подслизистой инвазии примерно в четверти резецированных гистологических образцов раннего рака желудка с положительным паттерном VEC и предположили, что паттерн VEC, наблюдаемый при эндоскопии с увеличением, может быть полезным. маркер для прогнозирования высокой степени злокачественности до операции ( 30 ).
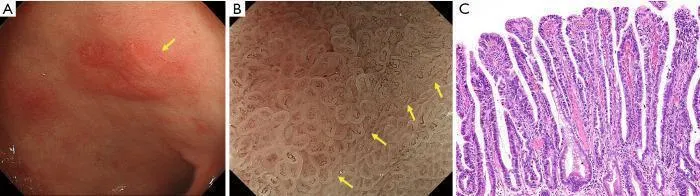
Рис. 14. Представление шаблона VEC. (A) Обычные эндоскопические данные в белом свете раннего рака желудка (тип 0–IIa). Поверхностное возвышающееся поражение (желтая стрелка) присутствует на малой кривизне антрального отдела желудка. (B) Увеличение эндоскопического изображения с NBI. В пределах демаркационной линии (желтые стрелки) виден рисунок ВЭК. Неравномерный микрососудистый рисунок наблюдается в круглой промежуточной части между криптами, выстланными круговым эпителием краевых крипт. (C) Гистопатологические данные. Окраска гематоксилином и эозином (H&E) (увеличение ×40). Высокодифференцированная экзофитная карцинома с удлиненными пальцевидными отростками, выстланными цилиндрическими или кубическими клетками, поддерживаемыми фиброваскулярной соединительной тканью. NBI, узкополосная визуализация; ВЭК, сосуды в пределах эпителиального круга. [Перепечатано с (30)].
Таким образом, в этой статье была описана диагностическая система для эндоскопии с увеличением изображения для раннего рака желудка и других репрезентативных результатов. Хотя подробности здесь не упоминались, следует подчеркнуть, что стандартная техника наблюдения за слизистой оболочкой желудка при максимальном увеличении необходима для точной диагностики с помощью эндоскопии с увеличением.
Список литературы:
- Yao K, Anagnostopoulos GK, Ragunath K. Magnifying endoscopy for diagnosing and delineating early gastric cancer. Endoscopy 2009;41:462-7.
- Yao K, Iwashita A, Tanabe H, et al. White opaque substance within superficial elevated gastric neoplasia as visualized by magnification endoscopy with narrow-band imaging: a new optical sign for differentiating between adenoma and carcinoma. Gastrointest Endosc 2008;68:574-80.
- Muto M, Yao K, Kaise M, et al. Magnifying endoscopy simple diagnostic algorithm for early gastric cancer (MESDA-G). Dig Endosc 2016;28:379-93.
- Ezoe Y, Muto M, Uedo N, et al. Magnifying narrow band imaging is more accurate than conventional white-light imaging in diagnosis of gastric mucosal cancer. Gastroenterology 2011;141:2017-25.e3.
- Yao K, Doyama H, Gotoda T, et al. Diagnostic performance and limitations of magnifying narrow-band imaging in screening endoscopy of early gastric cancer: a prospective multicenter feasibility study. Gastric Cancer 2014;17:669-79.
- Yamada S, Doyama H, Yao K, et al. An efficient diagnostic strategy for small, depressed early gastric cancer with magnifying narrow-band imaging:a post-hoc analysis of a prospective randomized controlled trial. Gastrointest Endosc 2014;79:55-63.
- Maki S, Yao K, Nagahama T, et al. Magnifying endoscopy with narrow-band imaging is useful in the differential diagnosis between low-grade adenoma and early cancer of superficial elevated gastric lesions. Gastric Cancer 2013;16:140-6.
- Miwa K, Doyama H, Ito R, et al. Can magnifying endoscopy with narrow band imaging be useful for low grade adenomas in preoperative biopsy specimens? Gastric Cancer 2012;15:170-8.
- Fujiwara S, Yao K, Nagahama T, et al. Can we accurately diagnose minute gastric cancers (≤5 mm)? Chromoendoscopy (CE) vs magnifying endoscopy with narrow band imaging (M-NBI). Gastric Cancer 2015;18:590-6.
- Zhang Q, Wang F, Chen ZY, et al. Comparison of the diagnostic efficacy of white light endoscopy and magnifying endoscopy with narrow band imaging for early gastric cancer: a meta-analysis. Gastric Cancer 2016;19:543-52.
- Dohi O, Yagi N, Majima A, et al. Diagnostic ability of magnifying endoscopy with blue laser imaging for early gastric cancer: a prospective study. Gastric Cancer 2017;20:297-303.
- Dohi O, Yagi N, Yoshida S, et al. Magnifying Blue Laser Imaging versus Magnifying Narrow-Band Imaging for the Diagnosis of Early Gastric Cancer: A Prospective, Multicenter, Comparative Study. Digestion 2017;96:127-34.
- Yoshimizu S, Yamamoto Y, Horiuchi Y, et al. Diagnostic performance of routine esophagogastroduodenoscopy using magnifying endoscope with narrow-band imaging for gastric cancer. Dig Endosc 2018;30:71-8.
- Yao K. Zoom gastroscopy: magnifying endoscopy in the stomach. Tokyo: Springer; 2013:66-7.
- Yao K. The endoscopic diagnosis of early gastric cancer. Ann Gastroenterol 2013;26:11-22. [PubMed]
- Matsushita M, Mori S, Uchida K, et al. “White opaque substance” and “light blue crest” within gastric flat tumors or intestinal metaplasia: same or different signs? Gastrointest Endosc 2009;70:402-3.
- Kanemitsu T, Yao K, Nagahama T, et al. Extending magnifying NBI diagnosis of intestinal metaplasia in the stomach: the white opaque substance marker. Endoscopy 2017;49:529-35.
- Yao K, Iwashita A, Nambu M, et al. Nature of white opaque substance in gastric epithelial neoplasia as visualized by magnifying endoscopy with narrow-band imaging. Dig Endosc 2012;24:419-25.
- Ueo T, Yonemasu H, Yada N, et al. White opaque substance represents an intracytoplasmic accumulation of lipid droplets: immunohistochemical and immunoelectron microscopic investigation of 26 cases. Dig Endosc 2013;25:147-55.
- Ueo T, Yonemasu H, Yao K, et al. Histologic differentiation and mucin phenotype in white opaque substance-positive gastric neoplasias. Endosc Int Open 2015;3:E597-604.
- Song J, Zhang J, Wang J, et al. Meta-analysis: narrow band imaging for diagnosis of gastric intestinal metaplasia. PLoS One 2014;9:e94869.
- Ang TL, Fock KM, Teo EK, et al. The diagnostic utility of narrow band imaging magnifying endoscopy in clinical practice in a population with intermediate gastric cancer risk. Eur J Gastroenterol Hepatol 2012;24:362-7. [PubMed]
- Lage J, Pimentel-Nunes P, Figueiredo PC, et al. Light-NBI to identify high-risk phenotypes for gastric adenocarcinoma: do we still need biopsies? Scand J Gastroenterol 2016;51:501-6.
- Dutta AK, Sajith KG, Pulimood AB, et al. Narrow band imaging versus white light gastroscopy in detecting potentially premalignant gastric lesions: a randomized prospective crossover study. Indian J Gastroenterol 2013;32:37-42.
- Uedo N, Ishihara R, Iishi H, et al. A new method of diagnosing gastric intestinal metaplasia: narrow-band imaging with magnifying endoscopy. Endoscopy 2006;38:819-824.
- Savarino E, Corbo M, Dulbecco P, et al. Narrow-band imaging with magnifying endoscopy is accurate for detecting gastric intestinal metaplasia. World J Gastroenterol 2013;19:2668-75.
- Rerknimitr R, Imraporn B, Klaikeaw N, et al. Non-sequential narrow band imaging for targeted biopsy and monitoring of gastric intestinal metaplasia. World J Gastroenterol 2011;17:1336-42.
- Wang L, Huang W, Du J, et al. Diagnostic yield of the light blue crest sign in gastric intestinal metaplasia: a meta-analysis. PLoS One 2014;9:e92874.
- Doyama H, Yoshida N, Tsuyama S, et al. The “white globe appearance” (WGA): a novel marker for a correct diagnosis of early gastric cancer by magnifying endoscopy with narrow-band imaging (M-NBI). Endosc Int Open 2015;3:E120-4.
- Kanemitsu T, Yao K, Nagahama T, et al. The vessels within epithelial circle (VEC) pattern as visualized by magnifying endoscopy with narrow-band imaging (ME-NBI) is a useful marker for the diagnosis of papillary adenocarcinoma: a case-controlled study. Gastric Cancer 2014;17:469-77.
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.
















.jpg)




.png)















Комментарии