- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Эндоскопическая диагностика и лечение органического стеноза трахеи: методические рекомендации
| Авторы: | Новиков В.Н. Ложкина Н.В. Тришкин Д.В. 2016г. |
Анонс:
Органические стенозы трахеи остаются одной из наиболее сложных и драматичных проблем современной медицины. Медленно нарастающая асфиксия при ясном сознании и неэффективности консервативного лечения и даже трахеостомии, мучительная смерть от удушья - таков удел этих больных, большинство которых составляют люди трудоспособного возраста. Единственным способом помочь им является срочная реканализация трахеи, для чего используются различные физические факторы: механическое воздействие, высокочастотный электроток, высокоэнергетическое лазерное излучение (Новиков В.Н. с соавт., 2009; Яицкий Н.А. с соавт.,2012). В последнее десятилетие для реканализации трахеи при рубцовом и опухолевом стенозах широко применяются: аргон – плазменная коагуляция, радиочастотная абляция (Яицкий Н.А. с соавт.,2012), криохирургия (Топольницкий Е.Б. с соавт., 2012). Бужирование трахеи меньше повреждает интактные отделы, позволяет быстро (в течение 30 с – 1 мин) восстановить просвет дыхательного пути у больных с критическим стенозом трахеи и стабилизировать состояние пациентов (Новиков В.Н. с соавт., 2009; Яицкий Н.А. с соавт.,2012). Одним из перспективных методов эндоскопической коррекции трахеостеноза является эндопротезирование стентами различных конструкций и конфигураций, которые вводятся в просвет трахеи после восстановления проходимости. В качестве эндопротезов используются латексные или силиконовые трубки, которые устанавливаются в просвет трахеи на длительный срок с целью моделирования достаточного для адекватного дыхания просвета трахеи. В последние годы для пролонгированной протекции используются саморасправляющиеся нитиноловые стенты (Елезов А.А. с соавт., 2004; Новиков В.Н. с соавт., 2009; Яицкий Н.А. с соавт., 2009, 2012; Malvè M. et al., 2011). Эффективность лечения опухолевого стеноза 72 – 95% (Dutau H. et al., 2004; Husain S.A. et al., 2007).
Полный текст статьи:
ДИАГНОСТИКА СТЕНОЗА ТРАХЕИ
Техника ригидной трахеоскопии и внутрипросветные анатомические ориентиры
Показания. В настоящее время преимущественно используется в качестве доступа при эндотрахеальных операциях.
Противопоказания. Повреждения и анкилозы нижней челюсти, черепа и шейных позвонков, заболевания полости рта, не позволяющие провести через рот жесткую трубку, девиация трахеи, противопоказания к выполнению общего обезболивания.
Техника ригидной бронхоскопии и внутрипросветные анатомические ориентиры. Бронхоскопия ригидными бронхоскопами Фриделя, различными модификациями KARL STORZ – ENDOSKOPE и R. WOLF выполняется в условиях наркоза с миорелаксантами и искусственной вентиляцией легких.
Положение больного − лежа на спине. Бронхоскоп вводят в улучшенном положении Джексона при максимальном сближении осей рта, глотки и трахеи (рис. 1). Нижнюю челюсть оттягивают вверх.
Введя бронхоскоп в полость рта, обнаруживают первый анатомический ориентир − язычок мягкого неба. Продвигая бронхоскоп по спинке языка, достигают второго анатомического ориентира – надгортанника (рис.2).
Его легко приподнимают, отдавливая к корню языка. Третьим анатомическим ориентиром служат голосовые складки (рис.12), преодолев которые попадают в трахею, характеризующуюся поперечным расположением хрящевых колец (рис. 3).
Дойдя до четвертого анатомического ориентира – гребня бифуркации трахеи (рис. 4), − далее приступают к ориентировочному исследованию бронхов.
Изучением стенок трахеи может быть начата или закончена диагностическая бронхоскопия. Особое внимание следует обращать на форму просвета и ее изменения во время выдоха, тонус мембранозной части трахеальной стенки, конфигурацию и состояние гребня бифуркации трахеи, подвижность и вид устьев главных бронхов.
Показания и техника трахеоскопии гибкими эндоскопами
Трахеоскопия может выполняться как фибробронхоскопами, так и видеобронхоскопами. Фибробронхоскопы и видеобронхоскопы выпускаются такими производителями, как «Olympus», «Fujifilm», «Pentax»,
«KARL STORZ – ENDOSKOPE», «Aohua» и др.
Показания. Диагностическая трахеоскопия: подозрение на опухоль или воспалительный процесс в трахее, инородное тело, контроль состояния трахеостомы или эндопротеза. Лечебная трахеоскопия: санация трахеи и бронхов, извлечение мелких инородных тел, парабронхиальное введение лекарственных веществ.
Техника трахеоскопии. Наиболее часто используется трансназальное введение бронхоскопа (рис. 5).
Анестезия слизистой оболочки носовых ходов и гортаноглотки осуществляется путем ингаляции 10% раствора лидокаина. Через нижний носовой ход тубус проводят в полость ротоглотки, после чего визуализируются надгортанник и голосовая щель (рис. 6).
Голосовые связки, трахею и бронхи анестезируют с помощью инстилляции 10−15 мл 2% раствора лидокаина. Анестетик вводят через катетер, проведенный через инструментальный канал бронхоскопа. При узких носовых ходах, гипертрофии носовых раковин и другой патологии полости носа бронхоскоп проводят трансорально с использованием ротоблокатора. Приближаясь к надгортаннику, эндоскоп ориентируют в дорсовентральном направлении изгиба. Надгортанник обходят сзади, согнув конец в дорсальном направлении. Через голосовую щель легче пройти ближе к задней ее комиссуре (рис. 6), где связки во время вдоха расходятся шире.
Продвигая эндоскоп вдоль трахеи, осматривая ее стенки, его медленно вращают против часовой стрелки и обратно, сгибая конец. Это дает возможность осмотреть стенки трахеи по спирали с взаимно перекрещивающимися витками. Для лучшего определения формы гребень бифуркации трахеи осматривают с разных расстояний при дорсовентральном направлении и сгибании конца эндоскопа вверх и вниз. Затем эндоскоп разворачивают под углом 90 градусов и изучают устья главных бронхов, сравнивают цвет их слизистой оболочки, количество секрета, ширину просвета, подвижность.
Осложнения. Анафилактический шок на введение местных анестетиков, при котором необходима реанимационная помощь в условиях специализированного отделения анестезиологии и реанимации. Ларингоспазм, наличие которого требует немедленного прекращения исследования, а в случае сохранения признаков ларингоспазма – интубации трахеи.
Поляризованный свет в диагностике заболеваний трахеи (NBI, CBI)
Физический принцип. NBI (Narrowband imaging) − оптическая технология повышения качества изображения, которая использует особенности узкого спектра света, что увеличивает контрастность сосудистого русла и поверхности слизистой оболочки. Система предназначена для изображения объекта не в естественном (белом) свете, а в узком спектре синего (400-440 нм) и зеленого (540-560 нм) цветов.
CBI (Compound band image) – режим освещения с помощью двух волн определенной длины (420 нм и 520 нм) и специального оптического фильтра.
Взаимодействие световой волны с различными типами ткани зависит от ее длины. Более короткие волны проникают только в поверхностные слои слизистой оболочки, а более длинные – глубже, в подслизистый слой. Свет с длиной волны 400-440 нм поглощается капиллярными сосудами слизистой оболочки, которые окрашиваются на экране в коричневый цвет. Волны 520 нм и 540-560 нм поглощаются кровеносными сосудами, которые расположены глубже − в подслизистом слое. Эти сосуды окрашиваются на изображении в голубой цвет.
В неопластическом процессе плотность поверхностных капилляров слизистой оболочки становится более высокой.
Внутрипросветная анатомия в норме и патологии в режиме CBI отражены на рис. 7−11.
Аутофлюоресцентная диагностика заболеваний трахеи
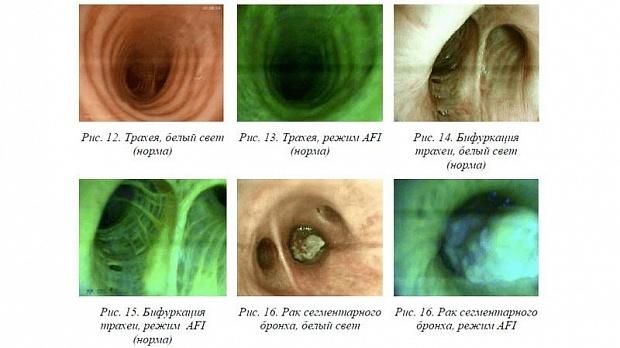
Аутофлюоресцентная эндоскопия (AFI) – это современный неинвазивный метод исследования слизистых оболочек, используемый с целью ранней диагностики злокачественной трансформации эпителиальных структур.
Физический принцип метода основан на возбуждении собственной флюоресценции (аутофлюоресценции) слизистой оболочки посредством света из синей зоны оптического спектра (375-440 нм). С этой целью используют специальные источники света, такие как ксеноновая лампа или полупроводниковый лазер. Аутофлюоресценция здоровых тканей наблюдается в зеленой части спектра в диапазоне от 470 до 800 нм. Разница в длине волны между светом возбуждения (синим) и эмитируемым светом позволяет выявить флюоресценцию. Флюоресцентный профиль, присущий тканям, зависит от гистологической структуры и биохимического состава, будучи всегда суммой одиночных спектров их элементов.
Источниками флюоресценции в тканях являются:
· энзимы: флавинмононуклеотид, флавиндинуклеотид, никотинамидадениндинуклеотид, никотинамидаденин- динуклеотидфосфат;
· структурные протеины: коллаген, эластин, кератин;
· эндогенные порфирины.
Эпителий предраковых и злокачественных образований излучает свечение меньшей интенсивности, чем эпителий нормальной слизистой оболочки. Разница между аутофлюоресценцией новообразований и нормального эпителия вызвана изменениями в физическом строении ткани, объеме циркулирующей крови, содержании в ткани флюоресцирующих веществ. В процессе онкогенеза происходят значительные изменения в свойствах тканей, в результате чего флюоресцентная картина трансформируется. В клетках злокачественных опухолей вследствие более высокой скорости метаболизма наблюдаются изменения в процессе окисления, накапливаются нефлюоресцирующие формы энзимов, вызывая снижение интенсивности света. Изменение спектра флюоресценции связано, главным образом, с прогрессирующим утолщением эпителия нормальной слизистой оболочки – от различных стадий эпителиальной дисплазии до инвазивной карциномы.
Показания. Подозрение на эпителиальную неоплазию, определение распространения поражения эпителиальных структур.
Вид технического устройства, внутрипросветная анатомия в норме и патологии в белом свете и в режиме аутофлюоресценции отражены на рис. 12– 16.
Диагностическую программу у пациентов с признаками стеноза трахеи можно представить в виде следующих положений:
1. Анализ клинических признаков заболевания и эндоскопической картины, гистоморфологическое исследования биоптатов и опе- рационного материала (ретроспективно).
2. Экстренное эндоскопическое обследование, которое позволяет адекватно оценить характер патологического процесса и обосновать лечебную тактику.
3. КТ, трансбронхиальная и трансэзофагеальная эндосонография, тонкоигольная биопсия осуществляются после ликвидации вентиляционных нарушений по показаниям.
4. Использование режимов CBI и аутофлюоресценции позволяет оперативно распознать генез стеноза и определить правильную тактику.
ТЕХНИКА ЛЕЧЕБНЫХ ЭНДОБРОНХИАЛЬНЫХ ВМЕШАТЕЛЬСТВ
В настоящее время для оперативной бронхоскопии используются различные тубусы и инструменты (рис. 17).
Реканализация трахеи и бронхов при их рубцовом стенозе
Показания. Наличие циркулярного или в виде «паруса» рубцового
сужения трахеи.
Техника реканализации. Операция выполняется через жесткий тубус бронхоскопа. Рубцовая ткань резецируется точечным электродом в режиме «смешанный» в пределах ткани рубца (рис. 18).
Контактная дезинтеграция высокоэнергетическим эндоскопическим лазером осуществляется по этой же схеме. Непременным условием является разрушение только патологически измененных тканей! Бужирование суженного участка осуществляется с помощью пищеводных бужей нарастающего диаметра и/или тубусов бронхоскопа.
Осложнения: перфорация трахеи, требующая экстренного хирургического лечения – ушивания дефекта трахеи и дренирования переднего средостения.
Реканализация трахеи и бронхов при неопластическом стенозе
Показания. Наличие злокачественной опухоли трахеи или бронхов, суживающей просвет (рис. 19).
Техника реканализации. Операция выполняется через жесткий тубус дыхательного бронхоскопа. Фрагменты опухолевой ткани, свободно расположенные в просвете трахеи и бронхов, удаляются диатермической петлей. Основной массив опухоли подвергается удалению точечным электродом (рис. 20), тубусом бронхоскопа (рис. 21) и щипцами (рис. 22).
Эвакуация детрита и крови осуществляется электроотсосом, а при неэффективности этого – путем промывания бронхов физиологическим раствором через катетер с широким просветом. Кровотечение (часто возникающее) останавливают с помощью аппликаций 0,1% раствора адреналина, точечной коагуляции, тампонады бронха или компрессии стенок трахеи надувной манжетой эндотрахеальной трубки.
Особое распространение в свое время получила реканализация путем лазерной дезинтеграции эндобронхиальной части злокачественной опухоли. На участок опухолевой ткани с помощью пилотного лазера устанавливается маркер красного цвета. Затем, увеличивая энергию излучения (желательно плавно регулировать мощность прибора), добиваются полной дезинтеграции маркированного фрагмента. Преимуществами этого метода следует считать отсутствие детрита и наличие гемостатического эффекта.
Осложнения: перфорация опухоли с развитием медиастинита, что предусматривает хирургическое лечение – дренирование переднего средостения.
Установка эндобронхиального стента Дюмона
Стент Дюмона представляет собой синтетическую трубку с шиповидными фиксаторами на наружной поверхности, повторяющую по форме различные ветвления трахеобронхиального дерева (рис. 23).
Показания. Рубцовый или опухолевый стеноз трахеи и бронхов, трахеомаляция.
Техника установки стента Дюмона. Через просвет стента Дюмона проводится крепкая лигатура, в результате чего образуется петля, фиксирующая его дистальный конец. Одна нить находится внутри просвета, вторая – снаружи. После этого оба конца нити выводятся через просвет тубуса и рукояти ригидного бронхоскопа и закрепляются, в результате чего стент фиксируется на дистальной части тубуса (рис. 24).
Под общим обезболиванием с миоплегией и инжекционной вентиляцией легких при прямой ларингоскопии тубус с фиксированным эндопротезом проводится через голосовые связки и под контролем зрения устанавливается в намеченной зоне. Тубус бронхоскопа удаляется, после чего путем подтягивания части нити, расположенной снаружи трубчатого стента, она извлекается. Можно установить эндопротез с помощью эндоскопических щипцов с фиксатором (рис. 25) или специального аппликатора.
Эндопротезирование трахеи и бронхов саморасправляющимися стентам
Показания. Рубцовый или опухолевый стеноз трахеи и бронхов, трахеомаляция.
Техника установки стента. В настоящее время используются тонкостенные саморасправляющиеся стенты «Polyphlex», «Hanarostent»,
«Endoflex» (рис. 25−27), которые устанавливаются в суженном участке с помощью специального доставляющего устройства. В случае многоуровневого поражения возможно одновременное использование стентов различных конструкций.
При опухолевом поражении бифуркации трахеи оптимальным вариантом можно считать установку специального саморасправляющегося бифуркационного протектора (рис. 28−30).
ОБОСНОВАНИЕ АЛГОРИТМА ЭНДОСКОПИЧЕСКОГО ЛЕЧЕНИЯ ОРГАНИЧЕСКОГО СТЕНОЗА ТРАХЕИ
Нами изучено течение заболевания и влияет лечебных мероприятий у 161 пациента с органическим стенозом трахеи, из которых у 97 это состояние было обусловлено постинтубационным циркулярным рубцом, у 64 - злокачественным новообразованием.
Характеристика пациентов с рубцовым стенозом трахеи. Причина возникновения: продленная интубация трахеи – у 83, длительное существование трахеостомы – у 14. Локализация: подскладочное пространство и шейный отдел трахеи – 5, шейный отдел трахеи – 79, грудной отдел трахеи – 11, двухуровневый стеноз – 2. Степень сужения по М.И. Перельману (1972): II степень – у 34, III степень – у 63. Протяженность суженного участка: от 1 до 2 см - у 15, от 2 до 4 см – у 66, более 4 см – у 16. Возраст пациентов: от 16 до 68 лет. Мужчин – 66, женщин – 31.
Характеристика пациентов с рубцовым стенозом трахеи. Причина возникновения: у 48 - плоскоклеточный рак, у 8 аденокарцинома, у 5 – мелкоклеточный, у 3 - экспансия железисто – кистозного рака щитовидной железы. Локализация: один из главных бронхов с экспансией на трахею – 22, бифуркация трахеи с поражением двух главных бронхов – 25, единственный главный бронх – 3, шейный и грудной отдел трахеи - 14. Выраженность сужения: субкомпенсированное – 29, декомпенсированное – 35. Протяженность суженного участка: до 2 см - 12, от 2 до 4 см - 42, более 4 см – 10. Возраст пациентов: от 27 до 89 лет. Мужчин - 52, женщин – 12.
Алгоритм лечения асимметричного рубцового стеноза шейного отдела трахеи (n = 3)
· Механическое и электрохирургическое удаление массива рубца (рис. 31).
· Бужирование модифицированными пищеводными бужами или тубусом бронхоскопа (n = 2).
· Гемостаз точечным электродом в режиме «фульгурация».
Алгоритм лечения циркулярного рубцового стеноза шейного отдела трахеи (n = 81)
· Электродеструкция наиболее массивной части рубца (продолжительность процесса более 5 месяцев).
· Бужирование суженной зоны модифицированными пищеводными бужами или тубусом бронхоскопа (n = 81).
· Эндопротезирование стентом Дюмона (n = 74) (рис. 32) или саморасправляющимся нитиноловым стентом (n = 4) (рис. 34).
· Трахеостомия с последующей установкой Т – образного протектора (n = 3).
· Резекция трахеи (n = 52).
Осложнения стентирования протектором Дюмона (n=21) (рис. 33)
Резекция трахеи (n = 52)
· Трахео – трахеальный анастомоз – 49.
· Перстеневидно – трахеальный анастомоз – 2.
· Щитовидно – трахеальный анастомоз – 1.
Рестеноз – 3 (стабилизация после протекции стентом Дюмона – 1, ререзекция с наложением перстневидно – трахеального анастомоза) - 2 (рис. 35).
Алгоритм лечения циркулярного рубцового стеноза грудного отдела трахеи (n = 11)
· Электродеструкция наиболее массивной части рубца (продолжительность процесса более 5 месяцев)
· Бужирование суженной зоны модифицированными пищеводными бужами или тубусом бронхоскопа
· Эндопротезирование стентом Дюмона (n = 9) или саморасправляющимся нитиноловым стентом (n = 2)
· Циркулярная резекция трахеи (n = 9)
Алгоритм лечения двухуровневого рубцового стеноза трахеи (n = 2)
· Протекция саморасправляющимся + силиконовым стентом по типу
«стент в стент» (n = 1)
· Протекция двумя силиконовыми стентами (n = 1)
· Резекция трахеи, трахео - трахеальный анастомоз (n = 1)
Отдаленные результаты лечения (1 -16 лет) (n =97)
· Стабилизация просвета после удаления рубца в виде «паруса» отмечена у 3 (3,1%) пациентов.
· Стабилизация просвета после длительной протекции - у 29 (30,0%).
· Оперированы в благоприятных условиях (снижение активности хондро
-перихондрита, стабилизация сопутствующего заболевания) – 62 (63,9%).
· Длительная протекция стентом Дюмона – у 3 (3,0%).
Летальность
Умерло 6 больных после эндопротезирования трахеи от причин, не связанных с основным заболеванием, и 1 пациентка через 8 лет после резекции трахеи от осложнений трахео – пищеводного свища.
Таким образом, при асимметричном рубцовом стенозе шейного отдела трахеи показано механическое или электрохирургическое удаление массива рубца и бужирование модифицированными пищеводными бужами или тубусом бронхоскопа, при циркулярном рубцовом стенозе трахеи - электродеструкция наиболее ригидных участков рубцового кольца, бужирование суженной зоны модифицированными пищеводными бужами или тубусом ригидного бронхоскопа и эндопротезирование стентами различных конструкций, а после стабилизации состояния - резекция трахеи.
Тактика при стенозе трахеи, обусловленном внутрипросветным ростом опухоли (n = 20)
· Реканализация трахеи: крупные фрагменты удаляли с помощью диатермической петли, мелкие фрагменты подвергали лазерной дезинтеграции с помощью высокоэнергетического лазера «Радуга 1» (n = 2) и электродеструкции в режиме «резание» (n = 7) с последующим бужированием модифицированными пищеводными бужами или тубусом ригидного бронхоскопа.
· Протекция трахеи или трахеи и левого главного бронха линейным стентом Дюмона (n =16) или саморасправляющимся нитиноловым стентом (Polyflex, Hanarostents, Endoflex) (n = 4).
Результат
В раннем послеоперационном периоде умерло двое больных: один в результате перфорации опухоли в средостение и один от тромбоэмболии легочной артерии. В 2 случаях после стабилизации состояния выполнено радикальное хирургическое лечение – циркулярная резекция трахеи. Продолжительность жизни остальных пациентов этой группы от 2 месяцев до 2 лет (в среднем 7 месяцев).
У троих наших больных на 2, 4 и 6 месяцах соответственно отмечены парез голосовых складок (n = 2) и формирование трахео – пищеводного свища (n =
1) в результате дальнейшей экспансии опухолевого процесса. 1 пациенту установлен саморасправляющийся пищеводный нитиноловый стент, 2 – выполнена эндоскопическая гастростомия, что позволило продлить их жизнь на срок от 1,5 до 3 месяцев.
Тактика при стенозе трахеи, обусловленном инфильтративным ростом опухоли (n = 37) (рис. 36)
· Реканализация трахеи и бронхов: удаление внутрипросветно расположенной части опухолевой ткани с помощью точечного электрода в режиме «резание» (n = 4), бужирование трахеи и бронхов модифицированный пищеводными бужами или тубусами ригидного бронхоскопа (n = 28).
· Протекция трахеи и левого главного бронха стентом Дюмона (n = 11) и саморасправляющимся нитиноловым стентом (n = 11), двух главных бронхов силиконовыми эндопротезами (n = 5) (рис. 37), сочетание протекции трахеи и наиболее сохранного главного бронха саморасправляющимся нитиноловыми стентами (n = 2), сочетание протекции трахеи саморасправляющимся стентом и наиболее сохранного главного бронха силиконовым (n = 3), саморасправляющимся бифуркационным нитиноловым стентом Endoflex (n = 5).
Осложнения протекции (n = 4, 11%)
· Дислокация саморасправляющегося стента, потребовавшая коррекции его положения, (n=2).
· Трохее – пищеводный свищ, потребовавший эндопротезирования пищевода саморастравляющимся стальным стентом, (n=1).
· Профузное кровотечение со смертельным исходом после установки трубчатого силиконового стента у пациентки с экспансией железисто– кистозного рака щитовидной железы на трахею (n=1).
Результат
Радикальное хирургическое лечение – резекция бифуркации трахеи (n=1). Продолжительность жизни остальных больных от 4 месяцев до 1,5 лет (в среднем 7 месяцев). В течение всего периода жизни у больных сохранялась адекватная вентиляция.
Тактика при компрессии паратрахеальным опухолевым образованием (n = 7) (рис. 38)
· Осторожное бужирование трахеи модифицированными пищеводными бужами и тубусом ригидного бронхоскопа.
· Эндопротезированием стентом Дюмона (n = 3) (рис. 39)0 или нитиноловым саморасправляющимся протектором (n = 4).
Результат
Продолжительность жизни больных от 4 до 8 месяцев (в среднем 6 месяцев). В течение всего периода жизни у больных сохранялась адекватная вентиляция.
Таким образом,
· бужирование, а в ряде случаев внутрипросветное высоко-энергетическое лазерное воздействие и электрохирургию, в сочетании с эндопротезированием можно считать ведущим способом экстренной коррекции суб – и декомпенсированного органического стеноза трахеи различного генеза;
· ликвидация трахеостеноза в ургентной ситуации требует одновременного использования всех перечисленных методик, что в свою очередь диктует необходимость оснащения лечебных учреждений соответствующей техникой.
Список литературы:
1. Елезов А.А. Эндоскопическое эндопротезирование в лечении рубцовых стенозов / А.А. Елезов, М.А. Русаков, В.Д. Паршин // Грудная и сердечно - сосудистая хирургия. - 2004. - № 3. - С. 59 – 63.
2. Новиков В.Н. Алгоритм экстренной эндоскопической коррекции декомпенсированных органических стенозов трахеи / В.Н. Новиков, Д.В. Тришкин, Н.В. Ложкина, А.С. Нагаев // Медицина экстремальных ситуаций. – 2009. – Т. 27. - № 1. – С. 36 – 41.
3. Топольницкий Е.Б. Применение криохирургических и лимфотропных технологий в комплексном лечении постинтубационных стенозов трахеи / Е.Б. Топольницкий, Г.Ц. Дамбаев // Вестник оториноларингологии. - 2012. - № 1. - С. 31 - 33.
4. Яицкий Н.А. Роль эндоскопических методов в лечении рубцовых стенозов трахеи / Н.А. Яицкий, В.А. Герасин, А.В. Герасин, А.А. Русанов // Вестник хирургии им. И.И. Грекова. - 2012. - Т. 171. - № 3. С. 11-15.
5. Яицкий Н.А. Эндопротезирование трахеи при злокачественных новообразованиях / Н.А. Яицкий, А.Л. Акопов, В.В. Соколов и др. // Вестник хирургии им. И.И. Грекова. - 2009. - Т. 168. - № 4. - С. 101-105.
6. Dutau H. Use of the Dumon Y – stent in the management of malignat disease involving the carina: a retrospective review of 86 patients / H. Dutau, B. Toutblanc, C. Lamb, L. Seijo // Chest. – 2004. – Vol. 126. – P. 951 – 957.
7. Husain S.A. Long – term follow – up of ultraflex metallic stents in benign and malignant central airway obstruction / S.A. Husain, D. Finch, M. Ahmed et al. // Ann. thorac. Surg. – 2007. – Vol. 83. – P. 1251 – 1256.
Статьи по теме
Рекомендуемые статьи
Синдром Бернара-Горнера
птоз, миоз и энофтальм при повреждении симпатического нерва (С7—Тh11) при осложненных дивертикулах, опухолях пищевода или метастазах в позвоночник.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.

















.jpg)





.png)
















Комментарии