- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Эндоскопическая Киотская классификация инфекции Helicobacter pylori и диагностика риска рака желудка
| Авторы: | Toyoshima O, Nishizawa T, Koike K. 2020г. |
Аннотация:
Последние достижения в эндоскопической технологии позволяют детально наблюдать за слизистой оболочкой желудка.
Введение:
Рак желудка является третьим по распространенности раком в мире и занимает третье место по смертности. Если рак желудка обнаружен на ранней стадии, его можно вылечить путем эндоскопической диссекции подслизистой оболочки [ 1 , 2 ] . Хотя периодическое эндоскопическое исследование имеет важное значение для выявления ранних стадий рака желудка, эффективное наблюдение требует идентификации групп высокого риска [ 3 - 7 ] . Генетические риски рака желудка, как сообщается, включают синдром наследственного рака, единичные нуклеотидные полиморфизмы, и семейную историю [ 8 - 12 ] . Экологические риски включаютИнфекция Helicobacter pylori , курение, чрезмерное потребление соли и недостаток овощей. Среди них, связь между пилори H. инфекцией и развитием рака желудка хорошо известна, и H.pylori , вирулентные факторы (CagA, VACA, ICEA и DUPA) известны [ 13 - 16 ] . Международное агентство по изучению рака классифицировало инфекцию H. pylori как канцероген типа I и считается основной причиной рака желудка. С другой стороны, H.pylori , ликвидация уменьшает риск развития рака желудка [ 17 - 20 ] . Следовательно, точная оценкаСтатус инфекции H. pylori важен. В настоящее время для диагностики статуса инфекции H. pylori необходимо эндоскопическое обследование . В 2013 году Японское общество гастроэнтерологической эндоскопии выступило за Киотскую классификацию, новую систему классификации эндоскопического гастрита.
Благодаря достижениям в области эндоскопических технологий, теперь можно наблюдать слизистую желудка с мельчайшими подробностями. Сегодня эндоскопия используется в диагностике гастрита для определения наличия / отсутствия инфекции H. pylori и оценки риска рака желудка. Киотская классификация эндоскопических результатов была поддержана, когда 85- й Конгресс Японского общества гастроэнтерологической эндоскопии проводился в Киото в 2013 году.
| Киотская классификация | балл |
| Атрофия | |
| Нет, C1 | 0 |
| C2 и C3 | 1 |
| O1-O3 | 2 |
| Кишечная метаплазия | |
| Нет | 0 |
| Антрум | 1 |
| Тело и антральный отдел | 2 |
| Увеличенные складки | |
| Отсутствие | 0 |
| Присутствие | 1 |
| Узловатость | |
| Отсутствие | 0 |
| Присутствие | 1 |
| Диффузное покраснение | |
| Нет | 0 |
| Мягкая (с RAC) | 1 |
| Тяжелая форма | 2 |
| Киото сумма | 0-8 |
Таблица 1 Рейтинг Киотского протокола.
Эндоскопическая атрофия (классификация Кимура-Такемото)
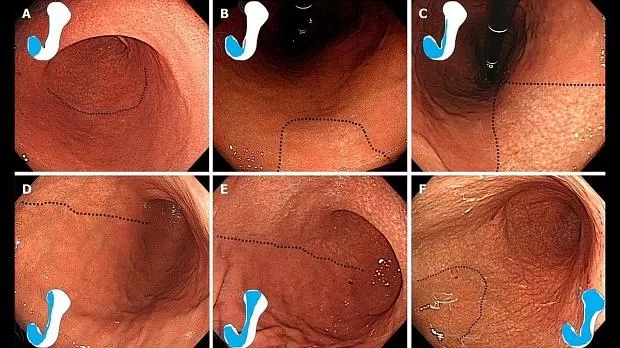
Атрофия включает «патологическую» атрофию и «эндоскопическую» атрофию. Атрофия патологически определяется как потеря железистой ткани [ 23 ] . В Киотской классификации принята классификация эндоскопической атрофии Кимуры-Такемото [ 24 ] . Kimura и др. [ 24 ] определили видимую капиллярную сеть, низкий уровень шума и желтовато-бледный цвет как атрофические признаки, а диффузное покраснение с большой высотой слизистой оболочки как признаки отсутствия атрофии. Мы показываем эндоскопические изображения и схематическую диаграмму на рисунке 1 . Сообщалось, что «эндоскопическая» атрофия хорошо коррелирует с «патологической» атрофией [ 25 - 29 ].. По классификации Киотского протокола неатрофия (C0) и C1 были оценены как оценка атрофии 0, C2 и C3 как оценка атрофии 1 и от O1 до O3 как оценка атрофии 2.Рисунок 1
Рис. 1. Классификация эндоскопической атрофии Кимуры-Такемото. Атрофические границы обозначены пунктирной линией. A: C1 (Атрофия ограничивается антральным отделом); B: C2 (Атрофия ограничивается малой областью малой кривизны тела); C: C3 (Атрофия существует в большей части меньшей кривизны тела, но не выходит за пределы кардии); D: O1 (Атрофия распространяется на глазное дно над кардией. Атрофическая граница тела проходит между малой кривизной и передней стенкой); E: O2 (Атрофическая граница тела лежит на передней стенке); F: O3 (Атрофия широко распространена с границей между передней стенкой и большей кривизной).
Эндоскопическая кишечная метаплазия
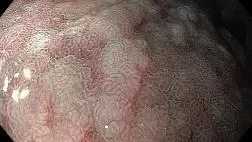
Кишечная метаплазия обычно выглядит серовато-белыми и слегка приподнятыми бляшками, окруженными пятнистыми розовыми и бледными участками слизистой оболочки, образующими неровную неровную поверхность (рис. 2А ). Внешний вид ворсинок, беловатая слизистая оболочка и шероховатая поверхность слизистой оболочки являются полезными индикаторами для эндоскопической диагностики кишечной метаплазии [ 30 ] . Эндоскопия с улучшенным изображением, включая узкополосную визуализацию (NBI), синюю лазерную визуализацию и связанную цветную визуализацию, улучшила видимость эндоскопических результатов и точность эндоскопической диагностики кишечной метаплазии [ 31 - 39 ]. Белое вещество непрозрачным на поверхности эпителия и светло - голубой гребень на слизистую оболочку эпителиального ободка визуализировали с использованием увеличенного NBI связаны с кишечной метаплазией [ 40 - 42 ] .
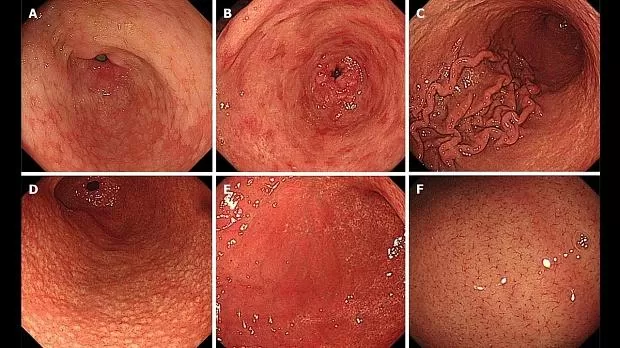
фигура 2
Рисунок 2 Эндоскопические данные по Киотской классификации. A: кишечная метаплазия; B: краснота, похожая на карту; C: увеличенные складки; D: узловатость; E: диффузное покраснение; F: Регулярное расположение собирающихся венул на слабо увеличенном изображении.
Картообразное покраснение (синоним пятнистой пятнистой эритемы) определяется как множественные плоские или слегка вдавленные эритематозные поражения, которые имеют различные формы, размеры и красную плотность (рис. 2B ) [ 6 , 43 ] . При использовании биоптатов с карпообразным покраснением часто наблюдается кишечная метаплазия (87,3%) [ 43 ] . Считается, что механизм появления покраснения, похожего на карту, заключается в усилении контраста между неатрофической слизистой оболочкой и атрофической слизистой оболочкой после исчезновения диффузного покраснения после успешного устранения [ 21 ].. Картообразное покраснение не всегда обнаруживается после искоренения. Однако когда это наблюдается, практически нет сомнений в том, что это свидетельствует о постэрадикационной слизистой оболочке желудка [ 22 ] .
Увеличенные складки
Увеличенная складка определяется как складка шириной 5 мм или более, которая не сплющивается или лишь частично сплющивается при вдувании желудка (рис. 2С ). Гиперплазия ругала - синоним увеличенных складок.По классификации Киото отсутствие и наличие увеличенных складок оценивалось как 0 и 1 баллов за увеличенные складки соответственно.
Узловатость
Узловой гастрит характеризуется милиарным паттерном, напоминающим «гусиную плоть», в основном расположенную в антральном отделе (рис. 2D ). Узловатость становится более отчетливой после использования спрея индигокармина. Лимфоидные фолликулы и / или интенсивная инфильтрация воспалительных клеток наблюдаются в образцах биопсии с узловатостью [ 44 ] . Узловой гастрит преобладает у женщин и постепенно улучшается с возрастом. Высокий сывороточный H.pylori , титр антител коррелирует с шаровидности [ 45 - 49 ] .В шкале Киотской классификации отсутствие и наличие узловатости оценивалось как балл 0 и 1 соответственно.
Диффузное покраснение
Диффузное покраснение относится к однородному покраснению с непрерывным расширением, наблюдаемому в неатрофической слизистой оболочке, в основном в теле (рис. 2E ), и типично для эндоскопического поверхностного гастрита [ 22 , 24 ] . Застой и расширение субэпителиальной капиллярной сети в слизистой оболочке желудка с воспалительным изменением цвета поверхности слизистой оболочки на красный [ 50 ] . Поскольку на оценку степени диффузного покраснения влияет настройка эндоскопа и монитора, объективная оценка может быть затруднена.С другой стороны, RAC - это состояние, при котором собирающие венулы расположены в теле. Издалека он выглядит как множество точек. С близкого расстояния он выглядит как регулярный узор в форме морских звезд (рис. 2F ).
По классификации Киотского протокола отсутствие диффузного покраснения оценивалось как оценка диффузного покраснения 0, легкое диффузное покраснение или диффузное покраснение при RAC как оценка диффузного покраснения 1 и сильное диффузное покраснение или диффузное покраснение без RAC как оценка диффузного покраснения 2.
Рейтинг Киото
Шкала Киотской классификации гастрита основана на сумме баллов пяти эндоскопических результатов и варьируется от 0 до 8 (Таблица 1 ). Считается, что высокий балл отражает повышенный риск инфекции H. pylori и рака желудка. В исследовании, в котором оценивалась полезность и удобство Киотской классификации, мини-лекция повысила точность эндоскопической диагностики [ 51 ] .ДИАГНОСТИКА ИНФЕКЦИИ HELICOBACTER PYLORI ПО ЭНДОСКОПИЧЕСКИМ НАБЛЮДЕНИЯМ
Есть несколько сообщений о том, чтобы исследовать взаимосвязь между эндоскопическими находками и H. пилорите инфекциями [ 52 - 56 ] . В таблице 2 приведены диагностические значения Киотской классификации инфекции H. pylori [ 57 - 62 ] . Увеличенные складки имели относительно хорошую прогностическую ценность (56,2–86,0%). Хотя узловатость имела низкую чувствительность (6,4–32,1%) для инфекции H. pylori , она имела отличную специфичность для текущей инфекции (95,8–98,8%). Диффузное покраснение имело хорошую прогностическую ценность (65,6–91,5%). RAC имел высокую чувствительность к отсутствию инфекции (86,7–100%).Таблица 2 Диагностическая ценность Киотской классификацииинфекции Helicobacter pylori .
| Эндоскопические данные | Ref . | Год | Кол-во предметов | Чувствительность | Специфика | PPV | ЧПС |
| Диагностика текущей инфекции H. pylori | |||||||
| Увеличенные складки | Като и др. [ 59 ] | 2013 | 275 | 58,5 | 79,5 | 76,9 | 62,2 |
| Увеличенные складки | Мао и др. [ 60 ] | 2016 г. | 256 | 60,2 | 92,3 | 86,0 | 74,6 |
| Увеличенные складки | Йошии и др. [ 61 ] | 2019 г. | 498 | 23,1 | 96,6 | 56,2 | 87,0 |
| Узловатость | Laine et al [ 57 ] | 1995 г. | 52 | 32,1 | 95,8 | 90,0 | 54,8 |
| Узловатость | Като и др. [ 59 ] | 2013 | 275 | 5,3 | 98,8 | 75,0 | 59,4 |
| Узловатость | Йошии и др. [ 61 ] | 2019 г. | 498 | 6.4 | 98,3 | 41,7 | 84,9 |
| Диффузное покраснение | Като и др. [ 59 ] | 2013 | 275 | 83,4 | 66,9 | 73,8 | 78,4 |
| Диффузное покраснение | Мао и др. [ 60 ] | 2016 г. | 256 | 57,5 | 95,8 | 91,5 | 74,7 |
| Диффузное покраснение | Йошии и др. [ 61 ] | 2019 г. | 498 | 60,0 | 94,7 | 65,6 | 93,3 |
| Диагностика отрицательной инфекции H. pylori | |||||||
| RAC | Яги и др. [ 58 ] | 2002 г. | 557 | 91,1 | 97,9 | 95,0 | 96,2 |
| RAC | Като и др. [ 59 ] | 2013 | 275 | 93,6 | 48,0 | 87,0 | 66,8 |
| RAC | Мао и др. [ 60 ] | 2016 г. | 256 | 86,7 | 90,2 | 87,5 | 89,6 |
| RAC | Гарсес-Дуран и др. [ 62 ] | 2019 г. | 140 | 100,0 | 49,0 | 47,3 | 100,0 |
Yoshii et al [ 61 ] сообщили, что эндоскопическая атрофия имеет специфичность 75,5% для диагностики перенесенной инфекции H. pylori . Кроме того, кишечная метаплазия и покраснение, похожее на карту, также имеют более высокую специфичность (92,6% и 98,0% соответственно) для диагностики перенесенной инфекции H. pylori .
Диагностика инфекции H. pylori по шкале Киотской классификации
В нескольких исследованиях изучалась взаимосвязь между общей шкалой Киотской классификации и инфекцией H. pylori . Мы сообщили о связи между общим баллом по классификации Киотского протокола и титром сывороточных антител к H. pylori [ 48 ] . По Киотскому протоколу были получены значения 0,1, 0,4, 1,9 и 2,3 для титров антитела H. pylori отрицательно-низкий, отрицательный-высокий, положительно-низкий и положительно-высокий соответственно. Показатели Киотского протокола увеличились в соответствии с титром антител к H. pylori . У субъектов с высоким отрицательным титром антител к H. pylori по классификации Киото была отличная область под кривой рабочих характеристик приемника (0,886) для прогнозирования H. pylori.инфекция с пороговым значением 2. Оценка по Киотскому протоколу ≥ 2 позволяет прогнозировать инфекцию H. pylori с точностью до 90% [ 63 ] . В 870 субъектов без истории H. Pylori эрадикационной терапии, H. пилори уровней инфекции у пациентов с Киото классификации десятков 0, 1, 2 и ≥ было 1,5%, 45% и 82% соответственно [ 64 ] .
Высокие баллы по Киотскому протоколу не всегда соответствуют активной инфекции H. pylori . Ложный диагноз может быть вызван либо спонтанной отрицательной конверсией, либо непреднамеренной эрадикацией. В случаях спонтанной отрицательной конверсии суровые условия кишечной метаплазии спонтанно устраняют инфекцию H. pylori . В случае непреднамеренной ликвидации инфекция H. pylori ликвидируется после лечения других инфекционных заболеваний антибиотиками.
По сути, балл по классификации Киотского протокола ≥ 2 указывает на инфекцию H. pylori . С другой стороны, 0 баллов по классификации Киото указывает на отсутствие инфекции H. pylori .
РИСК РАКА ЖЕЛУДКА ОЦЕНКА НА ОСНОВЕ ЭНДОСКОПИЧЕСКИХ ДАННЫХ КЛАССИФИКАЦИИ КИОТО
Есть несколько сообщений об оценке риска рака желудка на основании результатов эндоскопии [ 65 - 69 ] . Три японских когортных исследования выявили связь эндоскопической атрофии с заболеваемостью раком желудка (таблица 3 ). Они показали , что заболеваемость раком желудка легкой, умеренной и тяжелой атрофии 0,04% -0,10% / год, 0,12% -0,34% / год и 0,31% -1,60% / год, соответственно [ 70 - 72 ] . Shichijo et al [ 71 ] сообщили, что заболеваемость раком была чрезвычайно высокой, поражая 16,0% пациентов с тяжелой атрофией в течение 10-летнего периода. Риск рака желудка увеличивается в зависимости от степени атрофии желудка.Таблица 3 Заболеваемость раком желудка в зависимости от эндоскопической атрофии.
| Ref . | численность населения | Кол-во предметов | Количество раковых заболеваний | Продолжительность, год | Заболеваемость раком желудка,% / год | ||
| Незначительный | Умеренный | Тяжелая форма | |||||
| Take et al [ 70 ] , 2011 г. | Постэрадикация при язвенной болезни | 1674 | 28 | 5,6 | 0,04 | 0,28 | 0,62 |
| Шичиджо и др. [ 71 ] , 2016 г. | Пост ликвидации | 573 | 21 год | 6.2 | 0,07 1 | 0,34 1 | 1,60 1 |
| Каджи и др. [ 72 ] , 2019 г. | Медицинское обследование | 12941 | 63 | 3,7 | 0,10 | 0,16 | 0,31 |
| Пост ликвидации | 2571 | 20 | 3,7 | 0,06 | 0,12 | 0,42 | |
В таблице 4 показано отношение шансов рака желудка в зависимости от наличия или отсутствия результатов эндоскопии согласно Киотской классификации [ 49 , 73 - 75 ] . Атрофия желудка (открытого типа) была связана с раком желудка с отношением шансов 7,2–14,2 [ 76 , 77 ] .
| Эндоскопические данные | Ref . | численность населения | Кол-во предметов | Соотношение шансов |
| Атрофия | Масуяма и др. [ 76 ] , 2015 г. | Без искоренения | 27777 | 14,2 1 |
| Атрофия | Секикава и др. [ 77 ] , 2016 г. | Скрининг | 1823 г. | 7,2 1 |
| Кишечная метаплазия | Сугимото и др. [ 74 ] , 2017 г. | Эндоскопический гастрит | 1200 | 5.0 |
| Увеличенные складки | Нисибаяси и др. [ 73 ] , 2003 г. | Положительный результат на H. pylori | 276 | 5.0 |
| Узловатость | Нисикава и др. [ 49 ] , 2018 г. | Положительный результат на H. pylori | 674 | 13,9 |
| RAC | Маджима и др. [ 75 ] , 2019 г. | Пост ликвидации | 194 | 0,4 |
Поперечное исследование показало отношение шансов 5,0 для увеличенных складок на 5 мм или более у пациентов с раком желудка с контрольной группой, инфицированной H. pylori [ 73 ] . Это также указывает на сдвиг вверх в распределении ширины желудочных складок у H. pylori- позитивных пациентов с раком желудка до отношения шансов 35,5 у пациентов с шириной складки 7 мм. Вызванное воспалением метилирование ДНК различных генов участвует в развитии рака желудка при гастрите с увеличенными складками [ 50 , 73 , 79 - 85 ] . Сообщается, что увеличение складок связано с раком желудка диффузного типа [73 , 86 ] .
Nishikawa et al [ 49 ] сообщили о соотношении шансов 13,9 для рака желудка у H. pylori- позитивных пациентов с узловатой формой. В исследовании с участием пациентов в возрасте до 29 лет, инфицированных H. pylori , узловатость обеспечила отношение шансов 64,2 для рака желудка. Сообщается, что узловатость связана с раком диффузного типа [ 49 , 87 ] .
Сообщалось, что RAC отрицательно связан с раком желудка (отношение шансов: 0,4) [ 75 ] .
Риск рака желудка оценивается по шкале Киотской классификации
Сугимото и др. [ 74 ] представили взаимосвязь между общим баллом по классификации Киото и риском рака желудка. В их поперечном исследовании общая оценка по Киотской классификации пациентов с раком желудка и без него составила 4,8 и 3,8 соответственно. Это исследование предполагает, что рейтинг Киотского протокола ≥ 4 может указывать на риск рака желудка.
Полный текст статьи:
Основной совет: согласно Киотской классификации результаты эндоскопических исследований основаны на инфекции Helicobacter pylori (H. pylori) . Оценка по классификации Киото представляет собой сумму баллов пяти эндоскопических результатов (атрофия, кишечная метаплазия, увеличенные складки, узловатость и диффузное покраснение с регулярным расположением собирающих венул или без него) и колеблется от 0 до 8. Считается, что высокий балл чтобы отразить более высокий риск текущей инфекции H. pylori и рака желудка. 0 баллов по классификации Киотского протокола означает отсутствие инфекции H. pylori . Рейтинг Киотского протокола ≥ 2 указывает на текущую инфекцию H. pylori . Рейтинг Киотского протокола ≥ 4 может указывать на риск рака желудка.
Вывод:
Список литературы:
2. Драганов П.В. , Ван А.Ю., Осман М.О., Фуками Н. Обновление клинической практики института AGA: эндоскопическая подслизистая диссекция в США. Clin Gastroenterol Hepatol . 2019; 17 : 16-25.e1. [ PubMed ] [ DOI ]
3. Нисидзава Т. , Сузуки Х., Арано Т., Йошида С., Ямасита Х, Хата К., Канай Т., Яхаги Н., Тоошима О. Характеристики рака желудка, обнаруженного в течение 1 года после успешного искоренения Helicobacter pylori . J Clin Biochem Nutr . 2016; 59 : 226-230. [ PubMed ] [ DOI ]
4. Мальфертхайнер П. , Меграуд Ф., О'Морайн К.А., Гисберт Дж. П., Койперс Э. Дж., Аксон А. Т., Баззоли Ф., Гасбаррини А., Атертон Дж., Грэм Д. Ю., Хант Р., Моайеди П., Роккас Т., Рагге М., Селград М., Суэрбаум С. Сугано К., Эль-Омар Э.М.; Европейская группа по изучению хеликобактер и микробиоты и консенсусная группа. Управление инфекцией Helicobacter pylori - Маастрихтский доклад V / Флорентийский консенсус. Кишечник . 2017; 66 : 6-30. [ PubMed ] [ DOI ]
5. Сакитани К. , Нисидзава Т., Арита М., Ёсида С., Катаока Ю., Оки Д., Ямасита Н., Исомура Ю., Тоошима А., Ватанабэ Н., Иидзука Т., Сайто Ю., Фудзисаки Дж., Яхаги Н., Коике К., Тоёсима О. Раннее обнаружение рака желудка после эрадикации Helicobacter pylori по данным эндоскопического наблюдения. Helicobacter . 2018; 23 : e12503. [ PubMed ] [ DOI ]
6. Бэнкс М. , Грэм Д., Янсен М., Готода Т., Кода С., ди Пьетро М., Уэдо Н., Бхандари П., Причард Д. М., Койперс Э. Дж., Родригес-Хусто М., Новелли М. Р., Рагунат К., Шеперд Н., Динис-Рибейро М. Рекомендации Британского общества гастроэнтерологов по диагностике и ведению пациентов с риском аденокарциномы желудка. Кишечник . 2019; 68 : 1545-1575. [ PubMed ] [ DOI ]
7. Пиментел-Нуньес П. , Либаниу Д., Маркос-Пинто Р., Арейя М., Лея М., Эспозито Г., Гарридо М., Кикусте И., Мегро Ф., Матисяк-Будник Т., Аннибале Б., Дюмонсо Д. М., Баррос Р., Флежу Д. Ф., Карнейро Ф. , van Hooft JE, Kuipers EJ, Dinis-Ribeiro M. Управление предраковыми состояниями эпителия и поражениями желудка (MAPS II): Европейское общество эндоскопии желудочно-кишечного тракта (ESGE), Европейская группа изучения хеликобактер и микробиоты (EHMSG), Европейское общество Патология (ESP) и обновленное руководство Sociedade Portuguesa de Endoscopia Digestiva (SPED), 2019 г. Эндоскопия . 2019; 51 : 365-388. [ PubMed ] [ DOI ]
8. Исследовательская группа проекта «Геном тысячелетия для рака» . Сакамото Х, Йошимура К., Саеки Н., Катай Х, Симода Т, Мацуно Й, Сайто Д., Сугимура Х, Таниока Ф, Като С., Мацукура Н., Мацуда Н., Накамура Т, Хёдо И., Нишина Т, Ясуи В., Хиросе Х. , Hayashi M, Toshiro E, Ohnami S, Sekine A, Sato Y, Totsuka H, Ando M, Takemura R, Takahashi Y, Ohdaira M, Aoki K, Honmyo I, Chiku S, Aoyagi K, Sasaki H, Ohnami S, Yanagihara K, Yoon KA, Kook MC, Lee YS, Park SR, Kim CG, Choi IJ, Yoshida T, Nakamura Y, Hirohashi S. Генетическая изменчивость PSCA связана с восприимчивостью к раку желудка диффузного типа. Нат Жене . 2008; 40 : 730-740. [ PubMed ] [ DOI ]
9. Таникава К. , Урабе Й., Мацуо К., Кубо М., Такахаши А., Ито Х, Тадзима К., Каматани Н., Накамура Ю., Мацуда К. Исследование ассоциации генома выявляет два локуса восприимчивости к язве двенадцатиперстной кишки в популяции Японии. Нат Жене . 2012; 44 : 430-434, S1-S2. [ PubMed ] [ DOI ]
10. Хан Ма , О МГ, Чой Ай Джей, Пак С.Р., Рю К.В., Нам Б.Х., Чо С.Дж., Ким К.Г., Ли Дж.Х., Ким Ю.В. Связь семейного анамнеза с рецидивом рака и выживаемостью у пациентов с раком желудка. J Clin Oncol . 2012; 30 : 701-708. [ PubMed ] [ DOI ]
11. Нисидзава Т. , Сузуки Х., Сакитани К., Ямасита Х., Йошида С., Хата К., Канадзава Т., Фудзивара Н., Канаи Т., Яхаги Н., Тойосима О. Семейный анамнез является независимым фактором риска прогрессирования атрофии желудка у пациентов с Helicobacter pylori . США Европейский Gastroenterol J . 2017; 5 : 32-36. [ PubMed ] [ DOI ]
12. Тоошима О , Таникава К., Ямамото Р., Ватанабе Х., Ямасита Х, Сакитани К., Йошида С., Кубо М., Мацуо К., Ито Х, Коике К., Сето Й, Мацуда К. Снижение экспрессии PSCA, вызванное инфекцией Helicobacter pylori, может способствовать прогрессирование в тяжелый гастрит. Oncotarget . 2018; 9 : 3936-3945. [ PubMed ] [ DOI ]
13. Ямаока Y . Механизмы заболевания: факторы вирулентности Helicobacter pylori. Нат Рев Гастроэнтерол Гепатол . 2010; 7 : 629-641. [ PubMed ] [ DOI ]
14. Hatakeyama M . Helicobacter pylori CagA и рак желудка: парадигма случайного канцерогенеза. Клеточный микроб-хозяин . 2014; 15 : 306-316. [ PubMed ] [ DOI ]
15. Талеби Безмин Абади А. , Перес-Перес Г. Роль dupA в вирулентности Helicobacter pylori . Мир J Gastroenterol . 2016; 22 : 10118-10123. [ PubMed ] [ DOI ]
16. Imkamp F , Lauener FN, Pohl D, Lehours P, Vale FF, Jehanne Q, Zbinden R, Keller PM, Wagner K. Быстрая характеристика детерминант вирулентности в Helicobacter pylori, выделенных от пациентов с неатрофическим гастритом, с помощью секвенирования следующего поколения. J Clin Med . 2019; 8. [ PubMed ] [ DOI ]
17. Нисидзава Т. , Сузуки Х, Маэкава Т., Харада Н., Тойокава Т., Кувай Т., Охара М., Судзуки Т., Каваниши М., Ногути К., Йошио Т., Кацусима С., Цурута Х, Масуда Е., Танака М., Катаяма С., Кавамура Н. , Nishizawa Y, Hibi T, Takahashi M. Двойная терапия для эрадикации Helicobacter pylori третьей линии и прогнозирование дыхательного теста с мочевиной. Мир J Gastroenterol . 2012; 18 : 2735-2738. [ PubMed ] [ DOI ]
18. Нисидзава Т. , Судзуки Х. Канцерогенез желудка и основные молекулярные механизмы: Helicobacter pylori и новая таргетированная терапия. Biomed Res Int . 2015; 2015 : 794378. [ PubMed ] [ DOI ]
19. Ли Ю.К. , Чианг Т.Х., Чжоу СК, Ту Ю.К., Ляо В.К., Ву М.С., Грэм Д.Й. Связь между эрадикацией Helicobacter pylori и заболеваемостью раком желудка: систематический обзор и метаанализ. Гастроэнтерология . 2016; 150 : 1113-1124.e5. [ PubMed ] [ DOI ]
20. Кишикава Х. , Одзиро К., Накамура К., Катаяма Т., Арахата К., Такарабе С., Миура С., Канаи Т., Нисида Дж. Атрофический гастрит, вызванный прошлой инфекцией Helicobacter pylori: отдельное заболевание в малоизученной популяции без истории ликвидации. Helicobacter . 2020; 25 : e12669. [ PubMed ] [ DOI ]
21. Като М. , Сузуки Х, Уоррен Р., Маршалл Б. Эндоскопические данные о инфекции H. pylori. Сузуки Х, Уоррен Р., Маршалл Б. Helicobacter pylori . Токио: Springer Japan 2016; 157-167 Доступно по ссылке : https://link.springer.com/chapter/10.1007/978-4-431-55705-0_10 .
22. Харума К. , Като М., Иноуэ К., Мураками К., Камада Т. Киотская классификация гастрита. 1-е изд. Токио, Япония: Медицинский центр Нихон, 2017.
23. Диксон М.Ф. , Гента Р.М., Ярдли Дж. Х., Корреа П. Классификация и классификация гастрита. Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994. Am J Surg Pathol . 1996; 20 : 1161-1181. [ PubMed ] [ DOI ]
24. Кимура К. , Такемото Т. Эндоскопическое распознавание атрофической границы и его значение при хроническом гастрите. Эндоскопия . 1969; 3 : 87-97.
25. Михара М. , Харума К., Камада Т., Комото К., Йошихара М., Суми К., Кадзияма Г. Роль эндоскопических данных для диагностики инфекции Helicobacter pylori: оценка в стране с высокой распространенностью атрофического гастрита. Helicobacter . 1999; 4 : 40-48. [ PubMed ] [ DOI ]
26. Naylor GM , Gotoda T, Dixon M, Shimoda T, Gatta L, Owen R, Tompkins D, Axon A. Почему в Японии высока заболеваемость раком желудка? Сравнение гастрита между пациентами из Великобритании и Японии. Кишечник . 2006; 55 : 1545-1552. [ PubMed ] [ DOI ]
27. Quach DT , Le HM, Nguyen OT, Nguyen TS, Uemura N. Тяжесть эндоскопической атрофии желудка может помочь предсказать стадию гастрита при оценке гастрита. J Gastroenterol Hepatol . 2011; 26 : 281-285. [ PubMed ] [ DOI ]
28. Quach DT , Le HM, Hiyama T, Nguyen OT, Nguyen TS, Uemura N. Связь между эндоскопической и гистологической атрофией желудка и кишечной метаплазией. Helicobacter . 2013; 18 : 151-157. [ PubMed ] [ DOI ]
29. Kono S , Gotoda T, Yoshida S, Oda I, Kondo H, Gatta L, Naylor G, Dixon M, Moriyasu F, Axon A. Может ли эндоскопическая атрофия предсказать гистологическую атрофию? Историческое исследование в Великобритании и Японии. Мир J Gastroenterol . 2015; 21 : 13113-13123. [ PubMed ] [ DOI ]
30. Фукута Н. , Ида К., Като Т., Уэдо Н., Андо Т., Ватанабэ Х., Симбо Т.; Исследовательская группа по изучению эндоскопической диагностики кишечной метаплазии желудка. Эндоскопическая диагностика желудочно-кишечной метаплазии: проспективное многоцентровое исследование. Dig Endosc . 2013; 25 : 526-534. [ PubMed ] [ DOI ]
31. Ang TL , Pittayanon R, Lau JY, Rerknimitr R, Ho SH, Singh R, Kwek AB, Ang DS, Chiu PW, Luk S, Goh KL, Ong JP, Tan JY, Teo EK, Fock KM. Многоцентровое рандомизированное сравнение эндоскопии с высоким разрешением в белом свете и узкополосной визуализации для выявления поражений желудка. Eur J Gastroenterol Hepatol . 2015; 27 : 1473-1478. [ PubMed ] [ DOI ]
32. Сака А. , Яги К., Нимура С. Определение стадии гастрита на основе OLGA и OLGIM с использованием узкополосной эндоскопии с увеличением. Dig Endosc . 2015; 27 : 734-741. [ PubMed ] [ DOI ]
33. Пиментел-Нунес П. , Либаниу Д., Лаге Дж., Абрантес Д., Коимбра М., Эспозито Дж., Хормози Д., Пеппер М., Драсовян С., Уайт-Дж. Р., Добру Д., Буксбаум Дж., Рагунат К., Аннибале Б., Динис-Рибейро М. А. многоцентровое проспективное исследование использования узкополосной визуализации в режиме реального времени в диагностике предраковых состояний и поражений желудка. Эндоскопия . 2016; 48 : 723-730. [ PubMed ] [ DOI ]
34. Sha J , Wang P, Zhu B, Zhu M, Li X, Gao F. Уксусная кислота, улучшенная узкополосная визуализация для диагностики кишечной метаплазии желудка. PLoS One . 2017; 12 : e0170957. [ PubMed ] [ DOI ]
35. Оно С. , Като М., Цуда М., Миямото С., Абико С., Шимидзу И., Сакамото Н. Лавандовый цвет в связанном цветовом изображении позволяет неинвазивно обнаруживать метаплазию кишечника желудка. Пищеварение . 2018; 98 : 222-230. [ PubMed ] [ DOI ]
36. Такеда Т. , Асаока Д., Нодзири С., Нишияма М., Икеда А., Ятагай Н., Исидзука К., Хиромото Т., Окубо С., Судзуки М., Накадзима А., Накатсу Й, Комори Х, Акадзава Ю., Накагава Ю., Изуми К., Мацумото К. , Уэяма Х., Сасаки Х., Шимада Й., Мацумото К., Осада Т., Ходжо М., Като М., Нагахара А. Связанная цветная визуализация и Киотская классификация гастрита: оценка видимости и надежности между оценками. Пищеварение . 2019; 1-10. [ PubMed ] [ DOI ]
37. Эспозито Г. , Пиментель-Нуньес П., Анджелетти С., Кастро Р., Либанио Д., Галли Г., Ланер Е., Ди Джулио Е., Аннибале Б., Динис-Рибейро М. Эндоскопическая оценка метаплазии желудочно-кишечного тракта (EGGIM): многоцентровое валидационное исследование. Эндоскопия . 2019; 51 : 515-521. [ PubMed ] [ DOI ]
38. Dohi O , Majima A, Naito Y, Yoshida T, Ishida T, Azuma Y, Kitae H, Matsumura S, Mizuno N, Yoshida N, Kamada K, Itoh Y. Может ли эндоскопия с улучшенным изображением улучшить диагностику Киотской классификации гастрита в клинические условия? Dig Endosc . 2019 ;. [ PubMed ] [ DOI ]
39. Chiu PWY , Uedo N, Singh R, Gotoda T, Ng EKW, Yao K, Ang TL, Ho SH, Kikuchi D, Yao F, Pittayanon R, Goda K, Lau JYW, Tajiri H, Inoue H. Азиатский консенсус по стандартам диагностической верхней эндоскопии при неоплазии. Кишечник . 2019; 68 : 186-197. [ PubMed ] [ DOI ]
40. Uedo N , Ishihara R, Iishi H, Yamamoto S, Yamamoto S, Yamada T., Imanaka K, Takeuchi Y, Higashino K, Ishiguro S, Tatsuta M. Новый метод диагностики кишечной метаплазии желудка: узкополосная визуализация с увеличительной эндоскопией. Эндоскопия . 2006; 38 : 819-824. [ PubMed ] [ DOI ]
41. Канемицу Т. , Яо К., Нагахама Т., Имамура К., Фудзивара С., Уэки Т., Чуман К., Танабе Х., Ацуко О, Ивашита А., Симокава Т., Учита К., Канесака Т. Расширение диагностики кишечной метаплазии желудка с помощью NBI: маркер белого непрозрачного вещества. Эндоскопия . 2017; 49 : 529-535. [ PubMed ] [ DOI ]
42. Togo K , Ueo T, Yao K, Wada K, Honda H, Inoue S, Fukuda M, Yanai Y, Yonemasu H, Murakami K. Белое непрозрачное вещество, видимое при увеличении узкополосной визуализации, связано с состояниями внутрижелудочной кислоты. Endosc Int Open . 2018; 6 : E830-E837. [ PubMed ] [ DOI ]
43. Нагата Н. , Шимбо Т., Акияма Дж., Накашима Р., Ким Х.Х., Йошида Т., Хошимото К., Уэмура Н. Предсказуемость кишечной метаплазии желудка с помощью пятнистой пятнистой эритемы при эндоскопии. Gastroenterology Res . 2011; 4 : 203-209. [ PubMed ] [ DOI ]
44. Ачют Б.Р. , Мурчунг Н., Шривастава А.Н., Гупта Н.К., Миттал Б. Риск развития лимфоидных фолликулов у пациентов с хроническим антральным гастритом: роль эндоскопических особенностей, гистопатологические параметры, статус CagA и полиморфизмы гена интерлейкина-1. Inflamm Res . 2008; 57 : 51-56. [ PubMed ] [ DOI ]
45. Миямото М. , Харума К., Йошихара М., Хияма Т., Сумиока М., Нисисака Т., Танака С., Чаяма К. Узловой гастрит у взрослых вызывается инфекцией Helicobacter pylori. Dig Dis Sci . 2003; 48 : 968-975. [ PubMed ] [ DOI ]
46. Чен MJ , Ван TE, Чанг WH, Liao TC, Lin CC, Shih SC. Узловой гастрит: эндоскопический индикатор инфекции Helicobacter Pylori. Dig Dis Sci . 2007; 52 : 2662-2666. [ PubMed ] [ DOI ]
47. Номура С , Терао С, Адачи К., Като Т, Ида К., Ватанабэ Х, Симбо Т; Исследовательская группа по установлению эндоскопической диагностики хронического гастрита. Эндоскопическая диагностика активности и воспаления слизистой оболочки желудка. Dig Endosc . 2013; 25 : 136-146. [ PubMed ] [ DOI ]
48. Тойосима О , Нисидзава Т., Сакитани К., Ямакава Т., Такахаши И., Ямамичи Н., Хата К., Сето Й, Койке К., Ватанабе Х., Судзуки Х. Титр сывороточных антител против Helicobacter pylori и его связь с клубочностью желудка, атрофией и возраст: перекрестное исследование. Мир J Gastroenterol . 2018; 24 : 4061-4068. [ PubMed ] [ DOI ]
49. Nishikawa I , Kato J, Terasoma S, Matsutani H, Tamaki H, Tamaki T., Kuwashima F, Nakata H, Tomeki T, Matsunaka H, Ibata Y, Yamashita Y, Maekita T., Higashi K, Ichinose M. Узловой гастрит в сочетании с Развитие рака желудка до и после эрадикации Helicobacter pylori . JGH Open . 2018; 2 : 80-86. [ PubMed ] [ DOI ]
50. Uchiyama K , Ida K, Okuda J, Asai Y, Ohyama Y, Kuroda M, Matsumoto N, Takami T., Ogawa T., Takaori K. Корреляция индекса гемоглобина (IHb) слизистой оболочки желудка с инфекцией Helicobacter pylori (H. pylori) и воспаление слизистой оболочки желудка. Сканд Дж Гастроэнтерол . 2004; 39 : 1054-1060. [ PubMed ] [ DOI ]
51. Sakae H , Iwamuro M, Okamoto Y, Obayashi Y, Baba Y, Hamada K, Gotoda T, Abe M, Kono Y, Kanzaki H, Kawano S, Kawahara Y, Tanaka T., Yanai H, Okada H. Оценка полезности и Удобство Киотской классификации гастритов в эндоскопической диагностике статуса инфекции Helicobacter pylori. Пищеварение . 2019; 1-8. [ PubMed ] [ DOI ]
52. Зулло А. , Хассан С., Ромити А., Джусто М., Герриеро С., Лоренцетти Р., Кампо С. М., Томао С. Последующее наблюдение за кишечной метаплазией в желудке: когда, как и почему. Мир J Gastrointest Oncol . 2012; 4 : 30-36. [ PubMed ] [ DOI ]
53. Watanabe K , Nagata N, Nakashima R, Furuhata E, Shimbo T., Kobayakawa M, Sakurai T, Imbe K, Niikura R, Yokoi C, Akiyama J, Uemura N. Прогностические данные для неинфицированного Helicobacter pylori, -инфицированного и -излученного желудка слизистая оболочка: валидационное исследование. Мир J Gastroenterol . 2013; 19 : 4374-4379. [ PubMed ] [ DOI ]
54. Song H , Ekheden IG, Zheng Z, Ericsson J, Nyrén O, Ye W. Заболеваемость раком желудка среди пациентов с предраковыми поражениями желудка: наблюдательное когортное исследование в западной популяции с низким уровнем риска. BMJ . 2015; 351 : h3867. [ PubMed ] [ DOI ]
55. Олмез С. , Аслан М., Эртен Р., Саяр С., Байрам И. Распространенность кишечной метаплазии желудка и распространение инфекции, атрофии, дисплазии и рака Helicobacter pylori в ее подтипах. Гастроэнтерол Рес Прак . 2015; 2015 : 434039. [ PubMed ] [ DOI ]
56. Genta RM , Sonnenberg A. Helicobacter-негативный гастрит: отдельная сущность, не связанная с инфекцией Helicobacter pylori. Алимент Pharmacol Ther . 2015; 41 : 218-226. [ PubMed ] [ DOI ]
57. Лейн Л. , Коэн Х., Слоан Р., Марин-Соренсен М., Вайнштейн В.М. Согласие между наблюдателями и прогностическая ценность результатов эндоскопических исследований H. pylori и гастрита у здоровых добровольцев. Gastrointest Endosc . 1995; 42 : 420-423. [ PubMed ] [ DOI ]
58. Яги К. , Накамура А., Секин А. Характерные эндоскопические и увеличенные эндоскопические данные в нормальном желудке без инфекции Helicobacter pylori. J Gastroenterol Hepatol . 2002; 17 : 39-45. [ PubMed ] [ DOI ]
59. Като Т , Яги Н., Камада Т, Симбо Т, Ватанабэ Х, Ида К.; Исследовательская группа по установлению эндоскопической диагностики хронического гастрита. Диагностика инфекции Helicobacter pylori слизистой оболочки желудка по эндоскопическим признакам: многоцентровое проспективное исследование. Dig Endosc . 2013; 25 : 508-518. [ PubMed ] [ DOI ]
60. Мао Т. , Ван И, Инь Ф, Чжао К., Ян Л., Дин Х, Тянь З. Ассоциация эндоскопических характеристик слизистой оболочки желудка с инфекцией Helicobacter pylori у китайских пациентов. Гастроэнтерол Рес Прак . 2016; 2016 : 6539639. [ PubMed ] [ DOI ]
61. Йошии С. , Мабе К., Ватано К., Оно М., Мацумото М., Оно С., Кудо Т., Нодзима М., Като М., Сакамото Н. Достоверность эндоскопических характеристик для диагностики статуса инфекции Helicobacter pylori на основе Киотской классификации гастрита. Dig Endosc . 2020; 32 : 74-83. [ PubMed ] [ DOI ]
62. Гарсес-Дуран Р. , Гарсия-Родригес А., Кордова Х., Куатрекасас М., Хинес А., Гонсалес-Суарес Б., Араухо И., Ллах Дж., Фернандес-Эспаррах Г. Связь между регулярным сбором венул пилорин и отсутствием хеликобактерий. европейское население. Gastrointest Endosc . 2019; 90 : 461-466. [ PubMed ] [ DOI ]
63. Тоошима О. , Нисидзава Т., Арита М., Катаока Ю., Сакитани К., Йошида С., Ямасита Н., Хата К., Ватанабе Н., Сузуки Н. Инфекция Helicobacter pylori у субъектов, отрицательных по антителам с высоким титром в сыворотке. Мир J Gastroenterol . 2018; 24 : 1419-1428. [ PubMed ] [ DOI ]
64. Nishizawa T , Sakitani K, Suzuki H, Yamakawa T., Takahashi Y, Yamamichi N, Watanabe H, Seto Y, Koike K, Toyoshima O. Комбинация титра сывороточных антител к Helicobacter pylori и баллов по классификации Киото может обеспечить более точный диагноз. из H пилори . США Европейский Gastroenterol J . 2019; 7 : 343-348. [ PubMed ] [ DOI ]
65. Уэмура Н. , Окамото С., Ямамото С., Мацумура Н., Ямагути С., Ямакидо М., Танияма К., Сасаки Н., Шлемпер Р.Дж. Инфекция Helicobacter pylori и развитие рака желудка. N Engl J Med . 2001; 345 : 784-789. [ PubMed ] [ DOI ]
66. Возьмите S , Mizuno M, Ishiki K, Hamada F, Yoshida T, Yokota K, Okada H, Yamamoto K. Семнадцатилетний эффект искоренения Helicobacter pylori на профилактику рака желудка у пациентов с язвенной болезнью; проспективное когортное исследование. J Gastroenterol . 2015; 50 : 638-644. [ PubMed ] [ DOI ]
67. Сакитани К. , Хирата И., Сузуки Н., Ситидзё С., Янаи А., Серизава Т., Сакамото К., Аканума М., Маеда С., Ямаджи И., Ивамото Ю., Кавадзу С., Коике К. Рак желудка, диагностированный после эрадикации Helicobacter pylori у пациентов с сахарным диабетом . BMC Gastroenterol . 2015; 15 : 143. [ PubMed ] [ DOI ]
68. Тоошима О , Ямаджи Й, Йошида С., Мацумото С., Ямасита Х, Канадзава Т., Хата К. Эндоскопическая атрофия желудка тесно связана с развитием рака желудка после искоренения Helicobacter pylori. Surg Endosc . 2017; 31 : 2140-2148. [ PubMed ] [ DOI ]
69. Ситидзё С. , Хирата Ю. , Ниикура Р., Хаякава Ю. , Ямада А., Койке К. Связь между раком желудка и Киотской классификацией гастрита. J Gastroenterol Hepatol . 2017; 32 : 1581-1586. [ PubMed ] [ DOI ]
70. Возьмите S , Mizuno M, Ishiki K, Yoshida T, Ohara N, Yokota K, Oguma K, Okada H, Yamamoto K. Долгосрочный риск рака желудка после успешного искоренения Helicobacter pylori. J Gastroenterol . 2011; 46 : 318-324. [ PubMed ] [ DOI ]
71. Shichijo S , Hirata Y, Niikura R, Hayakawa Y, Yamada A, Ushiku T., Fukayama M, Koike K. Гистологическая кишечная метаплазия и эндоскопическая атрофия являются предикторами развития рака желудка после уничтожения Helicobacter pylori. Gastrointest Endosc . 2016; 84 : 618-624. [ PubMed ] [ DOI ]
72. Кадзи К. , Хашиба А., Уотани К., Ямагути Ю., Уэно Т, Оно К., Такабатаке I, Вакабаяси Т., Дояма Х, Ниномия I, Кирияма М., Охьяма С., Йонешима М., Кояма Н., Такеда Й, Ясуда К. Атрофический гастрит полезен для стратификации риска при эндоскопическом скрининге рака желудка. Am J Gastroenterol . 2019; 114 : 71-79. [ PubMed ] [ DOI ]
73. Нисибаяси Х. , Канаяма С., Киёхара Т., Ямамото К., Миядзаки Ю., Ясунага Ю., Шиномура Ю., Такешита Т., Такеучи Т., Моримото К., Мацудзава Ю. Инфузионный гастрит, вызванный Helicobacter pylori, связан с повышенной мутагенностью желудочного сока. повышенное окислительное повреждение ДНК и повышенный риск рака желудка. J Gastroenterol Hepatol . 2003; 18 : 1384-1391. [ PubMed ] [ DOI ]
74. Сугимото М. , Бан Х, Итикава Х, Сахара С., Оцука Т., Инатоми О, Бамба С., Фурута Т., Андох А. Эффективность Киотской классификации гастрита в выявлении пациентов с высоким риском рака желудка. Intern Med . 2017; 56 : 579-586. [ PubMed ] [ DOI ]
75. Мадзима А. , Дохи О, Такаяма С., Хиросе Р., Иноуэ К., Йошида Н., Камада К., Учияма К., Исикава Т., Такаги Т., Ханда О, Кониси Х., Наито Ю., Ито Й. Связанные цветные изображения выявляют важные факторы риска, связанные с с раком желудка после успешной ликвидации Helicobacter pylori. Gastrointest Endosc . 2019; 90 : 763-769. [ PubMed ] [ DOI ]
76. Масуяма Х , Йошитаке Н., Сасай Т., Накамура Т., Масуяма А., Дзуики Т., Курашина К., Миеда М., Сунада К., Ямамото Х., Тогаши К., Терано А., Хираиши Х. Взаимосвязь между степенью эндоскопической атрофии слизистой оболочки желудка и канцерогенный риск. Пищеварение . 2015; 91 : 30-36. [ PubMed ] [ DOI ]
77. Сэкикава А. , Фукуи Х, Сада Р., Фукухара М, Маруи С., Танке Г., Эндо М, Охара Й, Мацуда Ф, Накадзима Дж., Хенми С., Сайто С., Цумура Т., Маруо Т., Кимура Т., Осаки Ю. Атрофия желудка и ксантелазма являются маркерами для прогнозирования развития рака желудка на ранней стадии. J Gastroenterol . 2016; 51 : 35-42. [ PubMed ] [ DOI ]
78. Чанг С.Дж. , Пак MJ, Кан С.Дж., Кан Х.Й., Чунг Г.Э., Ким С.Г., Юнг Х.С. Влияние ежегодного эндоскопического скрининга на клинико-патологические характеристики и методы лечения рака желудка в регионе с высокой заболеваемостью в Корее. Int J Cancer . 2012; 131 : 2376-2384. [ PubMed ] [ DOI ]
79. Yasunaga Y , Shinomura Y, Kanayama S, Higashimoto Y , Yabu M, Miyazaki Y, Kondo S, Murayama Y, Nishibayashi H, Kitamura S, Matsuzawa Y. Повышенная выработка интерлейкина 1 бета и фактора роста гепатоцитов может способствовать фовеолярной гиперплазии в увеличенных размерах. складчатый гастрит. Кишечник . 1996; 39 : 787-794. [ PubMed ] [ DOI ]
80. Yasunaga Y , Shinomura Y, Kanayama S, Higashimoto Y , Yabu M, Miyazaki Y, Murayama Y, Nishibayashi H, Kitamura S, Matsuzawa Y. Производство интерлейкина-1 бета слизистой оболочки и секреция кислоты при гастрите с увеличенными складками. Алимент Pharmacol Ther . 1997; 11 : 801-809. [ PubMed ] [ DOI ]
81. Миядзаки Т. , Мураяма И., Шиномура Ю., Ямамото Т., Ватабе К., Цуцуи С., Киёхара Т., Тамура С., Хаяси Н. Гиперметилирование промотора гена E-кадгерина при гастрите с увеличенной складкой, вызванном H. pylori. Helicobacter . 2007; 12 : 523-531. [ PubMed ] [ DOI ]
82. Ямамото Э , Тойота М, Сузуки Х, Кондо Й, Саномура Т, Мураяма Й, Охе-Тойота М, Маруяма Р, Нодзима М, Ашида М, Фуджи К., Сасаки Й, Хаяши Н., Мори М, Имаи К., Токино Т, Shinomura Y. LINE-1 гипометилирование связано с повышенным метилированием CpG-островков при гастрите с увеличенной складкой, связанном с Helicobacter pylori. Биомаркеры эпидемиологии рака Пред . 2008; 17 : 2555-2564. [ PubMed ] [ DOI ]
83. Судзуки М. , Сузуки Х., Минегиси Й., Ито К., Нисизава Т., Хиби Т. Х. Эрадикационная терапия против пилори увеличивает экспрессию RUNX3 в железистых эпителиальных клетках при увеличенном гастрите. J Clin Biochem Nutr . 2010; 46 : 259-264. [ PubMed ] [ DOI ]
84. Ямамото Э. , Судзуки Х., Такамару Х., Ямамото Х., Тойота М., Шиномура Ю. Роль метилирования ДНК в развитии рака желудка диффузного типа. Пищеварение . 2011; 83 : 241-249. [ PubMed ] [ DOI ]
85. Tahara T , Tahara S, Horiguchi N, Kato T, Shinkai Y, Okubo M, Terada T, Yoshida D, Funasaka K, Nagasaka M, Nakagawa Y, Kurahashi H, Shibata T, Tsukamoto T, Ohmiya N. Ген антигена стволовых клеток простаты Полиморфизм связан с метилированием ДНК промотора H. pylori в неопухолевом эпителии желудка. Рак Prev Res (Phila) . 2019; 12 : 579-584. [ PubMed ] [ DOI ]
86. Ватанабэ М. , Като Дж., Иноуэ И., Ёсимура Н., Ёсида Т., Мукубаяси К., Дегучи Х., Эномото С., Уэда К., Маэкита Т., Игучи М., Тамай Х, Уцуномия Х, Ямамичи Н., Фудзиширо М., Иване М., Текешита Т. , Mohara O, Ushijima T, Ichinose M. Развитие рака желудка в неатрофическом желудке с высокоактивным воспалением, идентифицированным по уровням пепсиногена и антитела Helicobacter pylori в сыворотке крови вместе с эндоскопическим гиперпластическим гастритом ругалей. Int J Cancer . 2012; 131 : 2632-2642. [ PubMed ] [ DOI ]
87. Камада Т. , Танака А., Яманака И., Манабе Н., Кусуноки Х., Миямото М., Танака С., Хата Дж., Чаяма К., Харума К. Узловой гастрит с инфекцией Helicobacter pylori тесно связан с диффузным раком желудка у молодых пациентов. Пищеварительная эндоскопия . 2007; 19 : 180-184.
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.














.jpg)





.png)



.jpg)















Комментарии 1