Анонс:
Эозинофильный эзофагит (ЭоЭ) — это хроническое иммуноопосредованное заболевание пищевода, характеризующееся симптомами эзофагеальной дисфункции и выраженной эозинофильной инфильтрацией слизистой оболочки органа.
Диагностика ЭоЭ основывается на
- · данных клинической картины заболевания (дисфагия, эпизоды вклинения пищи в пищевод, боль в грудной клетке без связи с глотанием), а также
- · на совокупности эндоскопических и гистологических признаков.
Критерием установления диагноза служит эозинофильная инфильтрация слизистой оболочки пищевода с плотностью эозинофилов ≥ 15 в поле зрения микроскопа при большом увеличении (×400) по крайней мере в одном из биоптатов (около 60 эозинофилов в мм2).
Вспомогательное значение для диагноза имеют:
- · исследование общего IgE,
- · эозинофилия периферической крови,
- · результаты кожных аллергопроб.
Полный текст статьи:
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА ЭОЗИНОФИЛЬНОГО ЭЗОФАГИТА
В 93 % наблюдений заболевание характеризуется наличием патогномоничных эндоскопических признаков, однако только эндоскопическая картина, без последующей гистологической верификации, не являются основанием для установления диагноза ЭоЭ.
Эндоскопическими признаками ЭоЭ различной степени тяжести являются:
- фиксированные концентрические сужения пищевода,
- продольная линейная исчерченность,
- очаговый отек слизистой оболочки,
- белесоватые участки экссудативного налета (эозинофильные микроабсцессы) на поверхности слизистой оболочки,
- специфические стриктуры [27–29].
В соответствии с предложенным набором признаков и степени их выраженности ЭоЭ определяется и стадируется эндоскопически с использованием критериев EREFS:
- E (exudate) — экссудаты (степени 0–2),
- R (rings) — концентрические сужения (степени 0–3),
- E (edema) — отек (степени 0–2),
- F (furrows) — борозды (степени 0–2),
- S (strictures) — стриктуры (степени 0–1).
E (exudate)
Наиболее ранний эндоскопический признак ЭоЭ - белесоватые участки экссудативного налета на поверхности слизистой оболочки пищевода, обусловленные специфической эозинофильной инфильтрацией. Подобные проявления ЭоЭ зачастую принимаются врачами-эндоскопистами за признаки грибкового или бактериального эзофагита или вообще не принимаются во внимание.
Стадирование:
| Е 0 — отсутствие экссудативного налета |
Е 1 — незначительное количество участков экссудативного налета (менее 10% поверхности слизистой оболочки пищевода)
 |
|
Е 2 — значительное количество участков экссудативного налета (более 10% поверхности слизистой оболочки пищевода)

|
R (rings)
Множественные фиксированные концентрические сужения пищевода (не исчезающие при прохождении перистальтической волны) обусловлены фиброзом слизистой оболочки вследствие длительно существующей эозинофильной инфильтрации, при этом пищевод начинает напоминать трахею (так называемая «трахеизация пищевода»).
Стадирование:
| R 0 — отсутствие фиксированных концентрических сужений |
R 1 — незначительные фиксированные концентрические сужения
 |
R 2 — умеренные фиксированные концентрические сужения, не мешающие проведению стандартного видеоэндоскопа
 |
R 3 — выраженные фиксированные концентрические сужения, не позволяющие провести эндоскоп в желудок
 |
E (edema)
Отек слизистой оболочки пищевода достаточно сложно обнаружить при стандартном эндоскопическом исследовании. Только осмотр в узкоспектральном режиме позволяет оценить наличие или отсутствие видимой васкуляризации слизистой оболочки пищевода вследствие ее утолщения. Кроме того, данный признак может наблюдаться и при других заболеваниях пищевода, в частности при ГЭРБ, и, соответственно, он должен оцениваться вместе с другими признаками.
Стадирование:
|
E 0 — отсутствие отека (капилляры слизистой оболочки пищевода четко видны)

|
E 1 — слабый отек (потеря четкости визуализации капилляров слизистой оболочки пищевода)
 |
E 2 — выраженный отек (отсутствие видимых капилляров слизистой оболочки пищевода)
 |
F (furrows)
Продольная линейная исчерченность (продольные борозды) - более поздний эндоскопический признак ЭоЭ. Она обусловлена реактивными изменениями слизистой оболочки пищевода в ответ на эозинофильную инфильтрацию.
Стадирование:
|
F 0 — отсутствие продольных борозд
|
|
F 1 — неглубокие продольные борозды

|
F 2 — продольные борозды с четко определяемой глубиной
 |
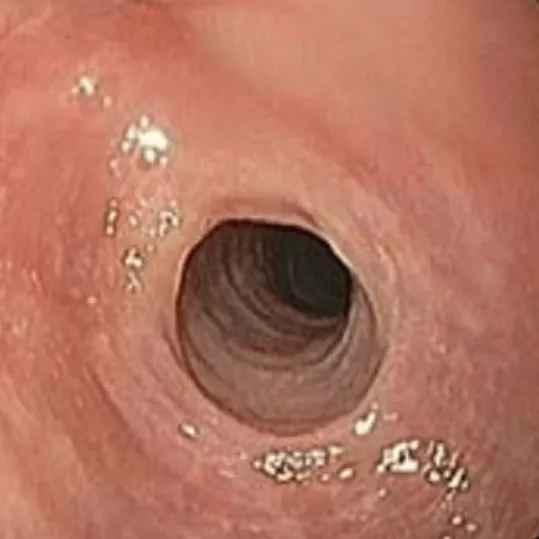
S (strictures)
Наиболее поздним признаком длительно существующего ЭоЭ является наличие рубцовых стриктур — терминального варианта фиброза слизистой оболочки пищевода. Зачастую данное проявление ЭоЭ коррелирует с одновременным наличием ГЭРБ.
Стадирование:
|
S 0 — отсутствие рубцовых стриктур
|
S 1 — наличие рубцовых стриктур
 |
Такой подход к стадированию ЭоЭ позволяет в первую очередь оценивать тяжесть течения ЭоЭ, а во-вторых, по изменению кода – оценивать эффективность проводимой терапии [29].
НАПРИМЕР, эндофото нескольких пациентов ДО и ПОСЛЕ терапии ГКС. Отмечается положительная динамика эндоскопических признаков, которые мы регистрируем, используя критерии EREFS!
, 78–83-min.png)

.
1 из 2 id=686783
#EndoQuiz: Проверьте Ваши знания?

.
2 из 2 id=686783
#EndoQuiz: Проверьте Ваши знания?
Открыт общий доступ к полному тексту статьи
свернуть
Список литературы:
Литература / References
1. Трухманов А.С., Ивашкина Н.Ю. Эозинофильный эзофагит. В кн. Ивашкин В.Т. (ред.) Рациональная фармакотерапия заболеваний органов пищеварения. 2-е изд.
М.: Литерра, 2011. С. 267–9 [Trukhmanov A.S., Ivashkina N.Yu. Eosinophilic esophagitis. In: Ivashkin V.T.
(ed.) Rational pharmacotherapy of digestive system diseases. 2nd ed. Moscow: Literra, 2011. P. 267–9 (In Rus.)].
2. Ивашкин В.Т., Баранская Е.К., Кайбышева В.О.,
Иванова Е.В. и др. Эозинофильный эзофагит: обзор
литературы и описание собственного наблюдения. Рос
журн гастроэнт гепатол колопроктол. 2012;22(1):71–81
[Ivashkin V.T., Baranskaya E.K., Kaibysheva V.O.,
Ivanova E.V. et al. Eosinophilic esophagitis: A literature
review and the description of the authors’ experience. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2012;22(1):71–81 (In Rus.)].
3. Lucendo A.J., Molina-Infante J., Arias Á. et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management
in children and adults. United European Gastroenterol J.
2017;5(3):335–58. DOI: 10.1177/2050640616689525
4. Dellon E.S., Gonsalves N., Hirano I. et al. ACG clinical
guideline: evidenced based approach to the diagnosis and
management of esophageal eosinophilia and eosinophilic
esophagitis. Am J Gastroenterol. 2013;108:679–92.
5. Cianferoni A., Spergel J.M., Muir A. Recent advances in
the pathological understanding of eosinophilic esophagitis.
Expert Rev Gastroenterol Hepatol. 2015;9(12):1501–10.
DOI: 10.1586/17474124.2015.1094372
6. Hill D.A., Spergel J.M. The Immunologic Mechanisms
of Eosinophilic Esophagitis. Curr Allergy Asthma Rep.
2016;16(2):9. DOI: 10.1007/s11882-015-0592-3
7. Spergel J.M. New genetic links in eosinophilic esophagitis. Genome Med. 2010;2(9):60.
8. Dellon E.S., Hirano I. Epidemiology and Natural History of Eosinophilic Esophagitis. Gastroenterology.
2018;154(2):319–32.e3. DOI: 10.1053/j.gastro.2017.06.067
9. Параскевова А.В., Шелковникова И.И., Лапина Т.Л.,
Трухманов А.С. и др. Пациент 68 лет и пациентка
52 лет с эозинофильной инфильтрацией пищевода. Рос
журн гастроэнт гепатол колопроктол 2017;27(4):62–74
[Paraskevova A.V., Shelkovnikova I.I., Lapina T.L.,
Trukhmanov A.S. et al. Two cases of eosinophilic infiltration of the esophagus: 68 year-old male and 52 year-old
female patients. Ross z gastroenterol gepatol koloproktol.
2017;27(4):62–74 (In Rus.)]. DOI: 10.22416/1382-4376-
2017-27-4-62-74
10. Dellon E.S. Epidemiology of eosinophilic esophagitis.
Gastroenterol Clin North Am. 2014;43:201–18.
11. Prasad G.A., Alexander J.A., Schleck C.D. et al. Epidemiology of eosinophilic esophagitis over three decades in
Olmsted County, Minnesota. Clin Gastroenterol Hepatol.
2009;7:1055–61.
12. Kapel R.C., Miller J.K., Torres C. et al. Eosinophilic esophagitis: a prevalent disease in the United States that affects all age groups. Gastroenterology. 2008;134:1316–21.
13. Castro Jimenez A., Gomez Torrijos E., Garcia Rodriguez R. et al. Demographic, clinical and allergological
characteristics of Eosinophilic Esophagitis in a Spanish central region. Allergol Immunopathol (Madr).
2014;42:407–14.
14. van Rhijn B.D., Verheij J., Smout A.J. et al. Rapidly
increasing incidence of eosinophilic esophagitis in a large
cohort. Neurogastroenterol Motil. 2013;25:47–52.
15. Arias A., Perez-Martinez I., Tenias J.M. et al. Systematic review with meta-analysis: the incidence and prevalence of eosinophilic oesophagitis in children and adults
in population-based studies. Aliment Pharmacol Ther.
2016;43:3–15.
16. González-Cervera J., Arias Á., Redondo-González O.
et al. Association between atopic manifestations and eosinophilic esophagitis: a systematic review and meta-analysis.
Ann Allergy Asth Immunol. 2017;118(5):582–90.e2. DOI:
10.1016/j.anai.2017.02.006
17. Remedios M., Campbell C., Jones D.M. et al. Eosinophilic esophagitis in adults: clinical, endoscopic, histologic
findings, and response to treatment with fluticasone propionate. Gastrointest Endosc. 2006;63:3–12.
18. Croese J., Fairley S.K., Masson J.W. et al. Clinical and
endoscopic features of eosinophilic esophagitis in adults.
Gastrointest Endosc. 2003;58:516–22.
19. Spergel J.M., Brown-Whitehorn T.F., Beausoleil J.L.
et al. 14 years of eosinophilic esophagitis: clinical features and prognosis. J Pediatr Gastroenterol Nutr.
2009;48:30–6.
20. Dellon E.S., Speck O., Woodward K. et al. Distribution
and variability of esophageal eosinophilia in patients undergoing upper endoscopy. Mod Pathol. 2015;28:383–90.
21. Fiocca R., Mastracci L., Engström C. et al. Long-term
outcome of microscopic esophagitis in chronic GERD patients treated with esomeprazole or laparoscopic antireflux surgery in the LOTUS trial. Am J Gastroenterol.
2010;105:1015–23.
22. Dellon E.S., Liacouras C.A., Molina-Infante J., Furuta G.T. et al. Updated International Consensus Diagnostic
Criteria for Eosinophilic Esophagitis: Proceedings of the
AGREE Conference. Gastroenterology. 2018;155(4):1022–
33.e10. DOI: 10.1053/j.gastro.2018.07.009
23. Lucendo A.J., Arias A., Tenias J.M. Relation between
eosinophilic esophagitis and oral immunotherapy for food
allergy: a systematic review with meta-analysis. Ann
Allergy Asthma Immunol. 2014;113(6):624–9. DOI:
10.1016/j.anai.2014.08.004
24. Schlag C., Miehlke S., Heiseke A., Brockow K. et
al. Peripheral blood eosinophils and other non-invasive biomarkers can monitor treatment response in eosinophilic oesophagitis. Aliment Pharmacol Ther. 2015
Nov;42(9):1122–30. DOI: 10.1111/apt.13386
25. Hines B.T., Rank M.A., Wright B.L., Marks L.A.
et al. Minimally invasive biomarker studies in eosinophilic esophagitis: A systematic review. Ann Allergy Asthma Immunol. 2018;121(2):218–28. DOI:
10.1016/j.anai.2018.05.005
26. Pelz B.J., Wechsler J.B, Amsden K., Johnson К. et al.
IgE-associated food allergy alters the presentation of
pediatric eosinophilic esophagitis. Clin Exp Allergy.
2016;46(11):1431–40.
27. Hirano I., Moy N., Heckman M.G. et al. Endoscopic
assessment of the oesophageal features of eosinophilic oesophagitis: validation of a novel classification and grading
system. Gut. 2013;62:489–95.
28. Kim H.P., Vance R.B., Shaheen N.J. et al. The prevalence and diagnostic utility of endoscopic features of eosinophilic esophagitis: a meta-analysis. Clin Gastroenterol
Hepatol. 2012;10:988–96.
29. Hirano I. Role of advanced diagnostics for eosinophilic
esophagitis. Dig Dis. 2014;32(1–2):78–83.
30. Liacouras C.A., Spergel J.M., Ruchelli E. et al. Eosinophilic esophagitis: A 10-year experience in 381 children.
Clin Gastroenterol Hepatol. 2005;3:1198–206.
31. Saffari H., Peterson K.A., Fang J.C. et al. Patchy eosinophil distributions in an esophagectomy specimen from
a patient with eosinophilic esophagitis: Implications for endoscopic biopsy. J Allergy Clin Immunol. 2012;130:798–
800.
32. Nielsen J.A., Lager D.J., Lewin M. et al. The optimal
number of biopsy fragments to establish a morphologic diagnosis of eosinophilic esophagitis. Am J Gastroenterol.
2014;109:515–20.
33. Salek J., Clayton F., Vinson L. et al. Endoscopic appearance and location dictate diagnostic yield of biopsies
in eosinophilic oesophagitis. Aliment Pharmacol Ther.
2015;41:1288–95.
34. Dellon E.S., Speck O., Woodward K. et al. Distribution
and variability of esophageal eosinophilia in patients undergoing upper endoscopy. Mod Pathol. 2015;28:383–90.
35. Kim H.P., Dellon E.S. An Evolving Approach to the Diagnosis of Eosinophilic Esophagitis. Gastroenterol Hepatol
(N Y). 2018 Jun;14(6):358–66. 36. Saffari H., Hoffman L.H., Peterson K.A. et al. Electron
microscopy elucidates eosinophil degranulation patterns in
patients with eosinophilic esophagitis. J Allergy Clin Immunol. 2014;133:1728–34.
37. Capocelli K.E., Fernando S.D., Menard-Katcher C.
et al. Ultrastructural features of eosinophilic oesophagitis: impact of treatment on desmosomes. J Clin Pathol.
2015;68:51–6.
38. Collins M.H. Histopathologic features of eosinophilic esophagitis and eosinophilic gastrointestinal diseases. Gastroenterol Clin North Am. 2014;43:257–68.
39. Anyane-Yeboa A., Wang W., Kavitt R.T. The Role of
Allergy Testing in Eosinophilic Esophagitis. Gastroenterol
Hepatol (N Y). 2018 Aug;14(8):463–9.
40. Syed A., Maradey-Romero C., Fass R. The relationship
between eosinophilic esophagitis and esophageal cancer.
Dis Esophagus. 2017;30(7):1–5. DOI: 10.1093/dote/
dox050
41. Lucendo A.J., Arias A., Molina-Infante J. Efficacy of
proton pump inhibitor drugs for inducing clinical and histologic remission in patients with symptomatic esophageal
eosinophilia: a systematic review and meta-analysis. Clin
Gastroenterol Hepatol. 2016;14:13–22.
42. Molina-Infante J., Ferrando-Lamana L., Ripoll C. et al.
Esophageal eosinophilic infiltration responds to proton
pump inhibition in most adults. Clin Gastroenterol Hepatol. 2011;9:110–7.
43. Liacouras C.A., Furuta G.T., Hirano I. et al. Eosinophilic esophagitis: updated consensus recommendations for
children and adults. J Allergy Clin Immunol. 2011;128:3–
20.
44. Gómez-Torrijos E., García-Rodríguez R., CastroJiménez A. et al. The efficacy of step-down therapy in
adult patients with proton pump inhibitor-responsiveoesophageal eosinophilia. Aliment Pharmacol Ther. 2016
Feb;43(4):534–40. DOI: 10.1111/apt.13496
45. Schaefer E.T., Fitzgerald J.F., Molleston J.P. et al.
Comparison of oral prednisone and topical fluticasone in
the treatment of eosinophilic esophagitis: a randomized trial in children. Clin Gastroenterol Hepatol. 2008;6:165–73.
46. Tan N. Di, Xiao Y.L., Chen M.H. Steroids therapy for
eosinophilic esophagitis: Systematic review and meta-analysis. J Dig Dis. 2015;16:431–42.
47. Sawas T., Dhalla S., Sayyar M. et al. Systematic review with meta-analysis: pharmacological interventions
for eosinophilic oesophagitis. Aliment Pharmacol Ther.
2015;41:797–806.
48. Murali A.R., Gupta A., Attar B.M. et al. Topical steroids
in eosinophilic esophagitis: systematic review and metaanalysis of placebo controlled randomized clinical trials.
J Gastroenterol Hepatol. 2015;31:1111–9.
49. Chuang M.-Y.A., Chinnaratha M.A., Hancock D.G.
et al. Topical steroid therapy for the treatment of eosinophilic esophagitis (EoE): a systematic review and metaanalysis. Clin Transl Gastroenterol. 2015;6:e82.
50. Straumann A., Conus S., Degen L. et al. Long-term
budesonide maintenance treatment is partially effective for
patients with eosinophilic esophagitis. Clin Gastroenterol
Hepatol. 2011;9:400–9.
51. Greuter T., Safroneeva E., Bussmann C. et al. Maintenance Treatment Of Eosinophilic Esophagitis With
Swallowed Topical Steroids Alters Disease Course Over
A 5-Year Follow-Up Period In Adult Patients. Clin Gastroenterol Hepatol. 2018:S1542-3565(18)30598-6. DOI:
10.1016/j.cgh.2018.05.045
52. Eluri S., Runge T.M., Hansen J. et al. Diminishing Effectiveness of Long-Term Maintenance Topical Steroid Therapy
in PPI Non-Responsive Eosinophilic Esophagitis. Clin Transl
Gastroenterol. 2017;8(6):e97. DOI: 10.1038/ctg.2017.27
53. Moawad F.J., Cheatham J.G., DeZee K.J. Meta-analysis: the safety and efficacy of dilation in eosinophilic oesophagitis. Aliment Pharmacol Ther. 2013;38:713–20.
54. Kagalwalla A.F., Sentongo T.A., Ritz S. et al. Effect
of six-food elimination diet on clinical and histologic
outcomes in eosinophilic esophagitis. Clin Gastroenterol
Hepatol. 2006;4:1097–102.
55. Arias A., Gonzalez-Cervera J., Tenias J.M. et al. Efficacy
of dietary interventions for inducing histologic remission in
patients with eosinophilic esophagitis: a systematic review
and meta-analysis. Gastroenterology. 2014;146:1639–48.
56. Molina-Infante J., Arias A., Barrio J. et al. Four-food
group elimination diet for adult eosinophilic esophagitis:
A prospective multicenter study. J Allergy Clin Immunol.
2014;134:1093–99.
57. Molina-Infante J., Modolell I., Alcedo J. et al. Step-up
empiric elimination diet for pediatric and adult eosinophilic esophagitis: the 2–4–6 study. United Eur Gastroenterol
J. 2016;(Suppl 5):A126.
58. Gonsalves N., Yang G.-Y., Doerfler B. et al. Elimination
diet effectively treats eosinophilic esophagitis in adults;
food reintroduction identifies causative factors. Gastroenterology. 2012;142:1451–5.
59. Lucendo A.J., Arias A., Gonzalez-Cervera J. et al. Empiric 6-food elimination diet induced and maintained prolonged remission in patients with adult eosinophilic esophagitis: a prospective study on the food cause of the
disease. J Allergy Clin Immunol. 2013;131:797–804.
60. Kagalwalla A.F., Shah A., Li B.U.K. et al. Identification of specific foods responsible for inflammation in children with eosinophilic esophagitis successfully treated with
empiric elimination diet. J Pediatr Gastroenterol Nutr.
2011;53:145–9.
61. Safroneeva E., Straumann A., Coslovsky M. et al. Symptoms have modest accuracy in detecting endoscopic and
histologic remission in adults with eosinophilic esophagitis.
Gastroenterology. 2016;150:581–90.
, 78–83-min.png)








, 78–83-min.png)























.jpg)




.png)
















Комментарии