- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Эозинофильный эзофагит: современный взгляд на проблему и собственные клинические наблюдения
| Авторы: | В. О. Кайбышева 1 С. В. Кашин 2 Е. Л. Никонов 3 2019г. |
| Об авторах: |
1. ФГБОУ ВО «РНИМУ им. Н.И. Пирогова», Москва, Россия 2. ФГБОУ ВО «РНИМУ им. Н.И. Пирогова», Москва, Россия; ГБУЗ «Ярославская областная клиническая онкологическая больница», Ярославль, Россия 3. ФГБОУ ВО «РНИМУ им. Н.И. Пирогова», Москва, Россия |
Аннотация:
Цель — представить современные тенденции в диагностике и лечении эозинофильного эзофагита (ЭоЭ).
Полный текст статьи:
Введение
Непрерывно меняющиеся условия существования современного человека, технологический прогресс, модернизация сельского хозяйства, нацеленная на увеличение производительности, появление генетически модифицированных продуктов, неблагоприятная экологическая ситуация, повсеместное применение антибактериальных препаратов оказывают неизбежное влияние на изменение структуры заболеваемости.
Все чаще врачи-клиницисты и ученые медики сталкиваются с некогда редкими или неизвестными нозологиями. Одним из таких заболеваний является эозинофильный эзофагит (ЭоЭ) — хроническое иммуновоспалительное заболевание пищевода с неизвестной этиологией и клинической картиной, во многом напоминающей гастроэзофагеальную рефлюксную болезнь (ГЭРБ) [1].
В ряде заболеваний пищевода в странах Европы и в США ЭоЭ уже несколько десятилетий занимает второе по распространенности место после ГЭРБ. ЭоЭ является главной причиной дисфагии и острых эпизодов вклинения пищи в пищевод у детей и лиц молодого возраста.
Первые описания эозинофилии пищевода были опубликованы в 70-х годах прошлого века (Р. Лэндерс), в начале 90-х годов ЭоЭ был выделен в отдельный клинико-морфологический синдром [2—4], характеризующийся дисфагией на фоне персистирующего эозинофильного воспаления (более 15 эозинофилов в поле зрения при увеличении ×400) в толще слизистой оболочки и подслизистого слоя пищевода.
С момента выделения ЭоЭ в отдельную нозологическую форму частота установления диагноза «эозинофильный эзофагит» стала нарастать в экспоненциальной прогрессии, что привело к лавинообразному увеличению числа научных публикаций и распространенности этого заболевания. В дальнейшем накопленные данные о клинических, эндоскопических и гистологических особенностях нового заболевания нашли свое отражение в нескольких экспертных документах и клинических рекомендациях европейских и американских научных обществ (2007, 2011, 2013, 2014 гг.) по диагностике и лечению ЭоЭ у детей и взрослых [5—8].
Определение
ЭоЭ — хроническое, медленно прогрессирующее иммуноопосредованное заболевание пищевода, характеризующееся выраженным эозинофильным воспалением слизистой оболочки пищевода, развитием подслизистого фиброза, клинически проявляющееся нарушением глотания (дисфагия, обтурация пищевода пищевым комком, рвота проглоченной пищей и др.) [1, 9, 10].
Этиология и патогенез
С патофизиологической точки зрения ЭоЭ — это хроническое Th2-ассоциированное заболевание пищевода, характеризующееся развитием выраженного эозинофильного воспаления (более 15 эозинофилов в поле зрения микроскопа высокого разрешения с увеличением ×400) в слизистой оболочке пищевода и подслизистого фиброза, клинически проявляющееся дисфункцией пищевода (затруднения при приеме пищи у детей (рвота, поперхивание, отказ от еды) и дисфагия у подростков и взрослых).
В формировании ЭоЭ имеет место патогенетическое влияние трех групп факторов [9,11]:
— генетическая предрасположенность к развитию иммунного ответа (при контакте с чужеродными антигенами) по пути активации Т-хелперов 2-го типа (Th2);
— нарушение барьерной функции слизистой оболочки пищевода (воспаление, расширение межклеточных пространств, нарушение синтеза белков плотных контактов), способствующее более глубокой пенетрации антигенов в толщу слизистой оболочки;
— сенсибилизация к воздушным и пищевым антигенам.
Клиническая картина
ЭоЭ является медленно прогрессирующим заболеванием, в связи с чем характер и выраженность жалоб значительно отличаются в зависимости от возраста больного и длительности анамнеза заболевания (табл. 1)
Таблица 1. Симптомы ЭоЭ у детей и взрослых [15]
[12—14].
Симптомы у детей раннего возраста неспецифичны и включают срыгивания, тошноту и рвоту, возникающие во время еды, затруднения при проглатывании определенной пищи (морепродукты, яйца, орехи и др.), боли в животе, отставание в физическом развитии (редко).
Дети подросткового возраста предъявляют жалобы, более характерные для ГЭРБ: на изжогу, боли за грудиной, необходимость длительно пережевывать пищу и запивать ее водой («медленно едящие и много пьющие» пациенты).
Взрослые пациенты страдают от симптомов, свидетельствующих о прогрессирующем сужении просвета пищевода: дисфагия, загрудинные боли и эпизоды вклинения пищи в пищевод. Описаны также случаи спонтанного разрыва пищевода, возникшие у больных ЭоЭ на фоне обтурации пищевым комком (синдром Бурхаве, Boerhaave’s Syndrome) [15—19].
Дисфагия у больных ЭоЭ может возникать остро (при застревании пищевого комка твердой консистенции) или беспокоить пациентов постоянно, вынуждая изменять пищевое поведение.
У взрослых пациентов эпизоды острой дисфагии возникают чаще вследствие длительно текущего воспалительного процесса с развитием стенозов и стриктур пищевода, в связи с чем приступ острой обтурационной дисфагии, случившийся на фоне полного здоровья, должен насторожить врача в отношении возможного диагноза ЭоЭ. Необходимо помнить, что ЭоЭ является наиболее распространенной причиной острой обтурационной дисфагии у взрослых [9]!
Небольшая доля больных детского возраста, несмотря на отсутствие у них склеротических изменений пищевода, также может испытывать остро возникающие симптомы дисфагии, которые обусловлены функциональными изменениями, а именно преходящим эзофагоспазмом.
Хроническая персистирующая дисфагия у больных ЭоЭ, постепенно прогрессирующая с течением времени, вынуждает пациентов избирательно подходить к выбору продуктов питания, принимать пищу полужидкой или кашицеобразной консистенции, длительно пережевывать пищу и обильно запивать ее. Зачастую данные симптомы у детей остаются незамеченными либо воспринимаются как шалость, хотя при внимательном рассмотрении они являются основным ключом в постановке диагноза ЭоЭ [9].
Таким образом, дисфагия при ЭоЭ может иметь длительный анамнез, родом из детства, либо манифестировать остро. Этот тягостный симптом значительно влияет на самочувствие больных, снижает качество жизни, приводя к необходимости применения различных компенсаторных приемов при приеме пищи [9].
Опросники для оценки выраженности симптомов ЭоЭ
Разработано несколько опросников для оценки тяжести и активности симптомов, эффективности терапии ЭоЭ.
Индекс активности ЭоЭ: опросник, заполняемый пациентами самостоятельно на 1-й, 7-й, 30-й дни наблюдения. Опросник предназначен для взрослых пациентов, которые в обозначенные дни документируют частоту возникновения, интенсивность, продолжительность дисфагии, эпизоды острой обтурационной дисфагии, время, затрачиваемое на прием пищи, появление загрудинной боли, необходимость длительного пережевывания пищи, отмечают плохо переносимые продукты питания. Индекс активности ЭоЭ, полученный при оценке вышеперечисленных пунктов, показал достаточно высокую корреляцию с данными эндоскопического и гистологического исследований [15, 20, 21].
Опросник для оценки дисфагии клиники Мейо (Mayo Dysphagia Questionnaire): валидизированный опросник, оригинальная версия которого была разработана для оценки выраженности дисфагии у больных со стриктурами пищевода. Опросник содержит 28 пунктов и требует около 10 мин на заполнение. В исследованиях, посвященных сопоставлению результатов опросника с данными гистологического исследования, была выявлена значительная вариабельность результатов, что не позволяет использовать его для контроля за активностью заболевания [15, 22].
Педиатрическая шкала оценки симптомов (Pediatric Quality of Life Inventory; PedsQL): включает оценку симптомов, их возрастную вариабельность, качество жизни [23,24].
Несмотря на то что данные опросники широко используются в научных исследованиях, их применение в клинической практике затруднено. На сегодняшний день разработаны пациенто-ориентированные опросники, содержащие меньшее количество вопросов. Одним из таких опросников является Опросник по оценке дисфагии (The Dysphagia Symptom Questionnaire) [15, 25], содержащий всего 3 вопроса, ответы на которые пациенты дают ежедневно в течение 30 дней.
— Ели ли Вы сегодня твердую пищу?
— Наблюдали ли Вы сегодня, что пища при глотании продвигается слишком медленно или застревает в горле или грудной клетке?
— Приходилось ли Вам сегодня использовать какие- то дополнительные приемы, чтобы проглотить пищу?
Инструментальная диагностика эозинофильного эзофагита
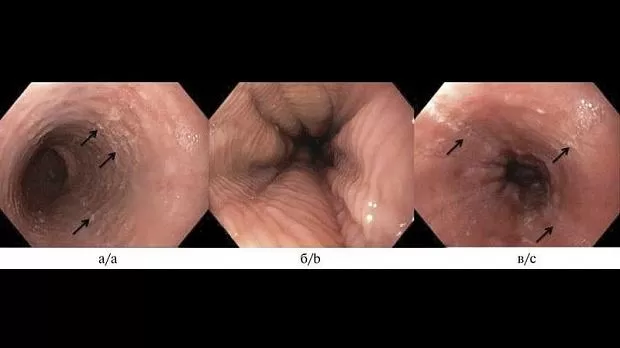
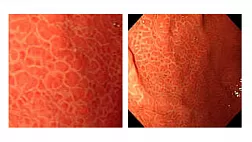
При проведении ЭГДС у больных с ЭоЭ обнаруживаются неспецифические признаки активного воспалительного процесса на всем протяжении пищевода: отек и контактная ранимость слизистой оболочки пищевода, белесый экссудат (эозинофильные микроабсцессы), линейные продольные борозды (рис. 1).
Рис. 1. Эндоскопические особенности ЭоЭ: a — отек, белый экссудат, белесые точки (эозинофильные микроабсцессы), узловатость (нодулярность); б — множественные концентрические кольца («трахеевидный» пищевод); в — продольные борозды. а — acute inflammatory with edema, white exudate; b — rings; c — furrows.
У взрослых больных ЭоЭ в дополнение к вышеперечисленным признакам нередко обнаруживаются изменения, отражающие развитие подслизистого фиброза: множественные концентрические кольца («трахеевидный» или «кошачий» пищевод), стриктуры и сужения пищевода [26—28].
С целью повышения информативности ЭГДС в диагностике ЭоЭ, стандартизации методики оценки степени и характера поражения пищевода была разработана эндоскопическая шкала EREFS, описывающая 5 главных эндоскопических признаков ЭоЭ: Exudates — экссудат, Rings — кольца, Edema — отек, Furrows — борозды, Strictures — стриктуры (табл. 2)
Таблица 2. Эндоскопическая шкала EREFS при оценке ЭоЭ
[26].
Диагностическая ценность шкалы EREFS была оценена в проспективном мультицентровом исследовании, показавшем высокую степень межисcледовательской согласованности получаемых данных [29, 30]. Однако корреляция результатов EREFS с гистологическими данными оказалась недостаточно высока. Связано это с тем, что вышеперечисленные эндоскопические признаки не являются специфичными только для ЭоЭ, поскольку встречаются и при других заболеваниях пищевода [28, 30—32].
Использование современного оборудования высокого разрешения значительно увеличивает диагностическую ценность эндоскопического исследования, позволяя устанавливать верный диагноз до 95% больных ЭоЭ. Тем не менее, согласно современным рекомендациям, всем больным с подозрением на ЭоЭ при проведении ЭГДС должна быть выполнена множественная биопсия из дистального и проксимального отделов пищевода для последующего гистологического исследования образцов ткани [10, 15, 26].
Гистологическое исследование включает осмотр биоптатов с использованием микроскопа высокого разрешения (×400), окраска гематоксилином и эозином. Для получения корректных гистологических результатов необходимо производить биопсию не менее чем в 6—8 участках из дистального и среднего/проксимального отделов пищевода. Биоптат должен включать эпителий на всю его глубину и собственную пластинку слизистой оболочки. Данные рекомендации обусловлены тем, что воспалительные изменения при ЭоЭ носят фокальный характер и захватывают в равной степени как дистальный, так и проксимальный участки пищевода [1, 15, 33].
Важно, что биопсию необходимо производить не только из макроскопически измененных участков слизистой оболочки пищевода, но и из нормальных участков, так как в них зачастую обнаруживаются значительные гистологические изменения. Для дифференциальной диагностики с другими заболеваниями, ассоциированными с эозинофилией пищевода, при первом эндоскопическом обследовании рекомендуется забор биоптатов из желудка и двенадцатиперстной кишки (табл. 3).
Таблица 3. Заболевания, ассоциированные с эозинофилией пищевода
Согласно современным международным рекомендациям [10], при гистологическом исследовании биоптатов из пищевода главным критерием установления диагноза ЭоЭ служит интраэпителиальная эозинофильная инфильтрация с количеством эозинофилов в поле зрения микроскопа высокого разрешения (×400) не менее 15 (рис. 2, 3,
Рис. 2. Морфологическое исследование биоптата из проксимального отдела пищевода. Окраска гематоксилином и эозином. а — скопления эозинофильных лейкоцитов (×200); б — скопления эозинофильных лейкоцитов более 60 в поле зрения; эозинофильное поверхностное наслоение («пластообразование») (×400); по степени эозинофильного воспаления степень поражения 3 балла, стадия поражения 3 балла; по степени эозинофильного «пластообразования» степень поражения 2 балла, стадия поражения 2 балла. Proximal part of esophagus. a — eosinophilic inflammation: intraepithelial eosinophils; b — eosinophilic inflammation: peak eosinophil count more that 60.
Рис. 3. Морфологическое исследование биоптата из дистального отдела пищевода. Окраска гематоксилином и эозином. а — скопления эозинофильных лейкоцитов, ×200; б — скопления эозинофильных лейкоцитов более 60 в поле зрения, ×400. Степень поражения: 3 балла, стадия поражения: 3 балла. Distal part of esophagus. a — eosinophilic inflammation: intraepithelial eosinophils; b — eosinophilic inflammation: peak eosinophil count more that 60.
б) [10, 13, 15].
Важно, что факт обнаружения большого количества эозинофилов в слизистой оболочке пищевода при гистологическом исследовании не может служить единственным критерием диагноза ЭоЭ. Существует большое разнообразие заболеваний, протекающих с эзофагеальной эозинофилией: ГЭРБ, эозинофильный гастроэнтерит, целиакия, болезнь Крона, лучевой и инфекционный эзофагит (грибковые и паразитарные инфекции), гиперэозинофильный синдром, лекарственный эзофагит, васкулиты, ахалазия кардии, системные заболевания соединительной ткани, злокачественные опухоли [1, 13]. Изолированная эозинофильная инфильтрация слизистой оболочки пищевода без ключевого симптома заболевания — дисфагии не может служить критерием ЭоЭ.
Таким образом, диагноз «эозинофильный эзофагит» может быть установлен только при совокупности клинических симптомов дисфункции пищевода и гистологического подтверждения эозинофильной инфильтрации пищевода, после обязательного исключения заболеваний, сопровождающихся эозинофилией пищевода (рис. 4).
Рис. 4. Диагностический алгоритм ЭоЭ [13].
Необходимо помнить, что у пациентов, получающих лечение антисекреторными препаратами или глюкокортикостероидами, число эозинофилов может быть повышено незначительно или вовсе не превышать норму (5 эозинофилов в поле зрения) [10]. Кроме того, в активной стадии заболевания происходит массивная дегрануляция эозинофилов в толще слизистой оболочки пищевода, что также может снижать число видимых эозинофилов. Немаловажную роль играют и технические особенности микроскопов (разные размеры участка ткани, осматриваемого при высоком увеличении), различной технологией окраски и фиксации биоптатов. Высокая вариабельность числа эозинофилов в слизистой оболочке пищевода в зависимости от вышеперечисленных факторов значительно затрудняет диагностику ЭоЭ. В связи с этим рассматривается вопрос о необходимости введения новых диагностических показателей, таких как плотность эозинофильной инфильтрации (число эозинофилов в 1 мм2) и активность эозинофильных протеолитических ферментов (эозинофильная пероксидаза и нейротоксин) в единице участка ткани.
Дополнительными гистологическими критериями ЭоЭ являются эозинофильные микроабсцессы (рис. 5),
Рис. 5. Эозинофильные абсцессы. Степень поражения 3 балла. Стадия поражения 3 балла. Биоптат из проксимального отдела пищевода, окраска гематоксилином и эозином (а — ×400, б — ×200). Intraepithelial eosinophil group or aggregate (a — ×400, b — ×200).
гиперплазия базального слоя эпителия, расширение межклеточных пространств (рис. 6),
Рис. 6. Расширенные межклеточные пространства: округлые перицелюллярные пространства в плоском эпителии пищевода, в которых иногда определяются межклеточные мостики. Степень поражения 2 балла, стадия поражения 2 балла. Биоптат из проксимального отдела пищевода. Окраска гематоксилином и эозином. (×400).
расположение эозинофилов в поверхностных слоях эпителия, мастоцитарная и лимфоцитарная инфильтрация, удлинение сосочков и фиброз собственной пластинки слизистой оболочки (рис. 7)
Рис. 7. Фиброз собственной пластинки слизистой оболочки (ФСП). Гиперплазия базального слоя эпителия. Волокна собственной пластинки утолщены, их диаметр превышает диаметр ядер клеток базального слоя. По степени фиброза собственной пластинки слизистой — степень поражения 3 балла, стадия поражения 3 балла. По степени гиперплазии базального слоя эпителия степень поражения 2 балла, стадия поражения 3 балла. Биоптат из проксимального отдела пищевода, окраска по Маллори (×400).
[10].
Для стандартизации гистологической оценки биоптатов была разработана система балльной оценки (тяжесть и распространенность оценивается в диапазоне от 0—3 баллов) восьми наиболее характерных гистологических изменений, обнаруживаемых у больных с ЭоЭ. Данная шкала, получившая условное название «Оценочная шкала ЭоЭ-специфичных гистологических показателей» (EoE-specific histologic scoring system — EoEHSS), включает оценку плотности эозинофильной инфильтрации, гиперплазии базального слоя эпителия, наличия эозинофильных абсцессов, поверхностного расположения эозинофилов в слизистой оболочке, расширения межклеточных пространств, повреждения поверхностных слоев эпителия, наличия дискератоза, фиброза собственной пластинки слизистой оболочки [15, 34].
Применение шкалы EoEHSS позволяет достичь согласованности в работе морфологов, а также верифицировать диагноз у пациентов, получающих противовоспалительную терапию на момент проведения биопсии (табл. 4).
Таблица 4. Система балльной оценки биоптатов при ЭоЭ (EoEHSS) Примечание. ПЭЧ — пиковое эозинофильное число при оценке участка с наиболее выраженными воспалительными изменениями; РМП — расширенные межклеточные пространства; ЭА — эозинофильные абсцессы; ПН — поверхностное наслоение; ППЭ — повреждение поверхностного эпителия; ФСП — фиброз собственной пластинки слизистой оболочки; 1 — в норме в биоптатах пищевода интраэпителиальные эозинофилы отсутствуют, поэтому наличие любого количества интраэпителиальных эозинофилов рассматривается как патологическое изменение; балльная шкала эозинофильного воспаления основана на количестве эозинофилов в одном поле зрения при большом увеличении (×400); 2 — базальный слой плоского эпителия пищевода состоит из тесно расположенных мелких клеток, в норме его толщина составляет менее 15% общей толщины эпителия; верхняя граница базального слоя определяется как уровень, на котором ядра базальных клеток отделены друг от друга расстоянием, равным или превышающим диаметр ядра базальной клетки; 3 — интраэпителиальные скопления или агрегаты эозинофилов, в которых клетки образуют солидные структуры; эпителиальная архитектоника нарушена таким образом, что соседние эозинофилы не разделены эпителиальной тканью; 4 — линейное распределение (расположение) как минимум трех эозинофилов в верхней трети многослойного эпителия слизистой оболочки пищевода параллельно поверхности; 5 — округлые перицеллюлярные пространства в плоском эпителии пищевода, в которых определяются межклеточные мостики; балльная шкала РМП основана на степени увеличения микроскопа, необходимой для обнаружения межклеточных мостиков; 6 — изменения тинкториальных свойств поверхностного эпителия, проявляющиеся усилением (более темный оттенок красного) окрашивания клеток поверхностного слоя эпителия при наличии или отсутствии эозинофильной инфильтрации; балльная шкала ППЭ основана на выраженности эозинофильной инфильтрации в поврежденном поверхностном эпителии; 7 — появление отдельных эпителиальных клеток с ярко-эозинофильной цитоплазмой и мелким округлым гиперхромным ядром; балльная шкала основана на количестве клеток с явлениями дискератоза; 8 — утолщение соединительнотканных волокон собственной пластинки слизистой оболочки; волокна собственной пластинки, расположенные поодиночке и имеющие диаметр менее размера ядер клеток базального слоя, рассматривались как нормальные; сцепленные друг с другом волокна обычного диаметра, а также волокна, имеющие диаметр, равный или превышающий размер ядер клеток базального слоя, рассматривались как патологичные; балльная шкала ФСП основана на степени утолщения волокон.
Таблица 4 (окончание). Система балльной оценки биоптатов при ЭоЭ (EoEHSS) Примечание. ПЭЧ — пиковое эозинофильное число при оценке участка с наиболее выраженными воспалительными изменениями; РМП — расширенные межклеточные пространства; ЭА — эозинофильные абсцессы; ПН — поверхностное наслоение; ППЭ — повреждение поверхностного эпителия; ФСП — фиброз собственной пластинки слизистой оболочки; 1 — в норме в биоптатах пищевода интраэпителиальные эозинофилы отсутствуют, поэтому наличие любого количества интраэпителиальных эозинофилов рассматривается как патологическое изменение; балльная шкала эозинофильного воспаления основана на количестве эозинофилов в одном поле зрения при большом увеличении (×400); 2 — базальный слой плоского эпителия пищевода состоит из тесно расположенных мелких клеток, в норме его толщина составляет менее 15% общей толщины эпителия; верхняя граница базального слоя определяется как уровень, на котором ядра базальных клеток отделены друг от друга расстоянием, равным или превышающим диаметр ядра базальной клетки; 3 — интраэпителиальные скопления или агрегаты эозинофилов, в которых клетки образуют солидные структуры; эпителиальная архитектоника нарушена таким образом, что соседние эозинофилы не разделены эпителиальной тканью; 4 — линейное распределение (расположение) как минимум трех эозинофилов в верхней трети многослойного эпителия слизистой оболочки пищевода параллельно поверхности; 5 — округлые перицеллюлярные пространства в плоском эпителии пищевода, в которых определяются межклеточные мостики; балльная шкала РМП основана на степени увеличения микроскопа, необходимой для обнаружения межклеточных мостиков; 6 — изменения тинкториальных свойств поверхностного эпителия, проявляющиеся усилением (более темный оттенок красного) окрашивания клеток поверхностного слоя эпителия при наличии или отсутствии эозинофильной инфильтрации; балльная шкала ППЭ основана на выраженности эозинофильной инфильтрации в поврежденном поверхностном эпителии; 7 — появление отдельных эпителиальных клеток с ярко-эозинофильной цитоплазмой и мелким округлым гиперхромным ядром; балльная шкала основана на количестве клеток с явлениями дискератоза; 8 — утолщение соединительнотканных волокон собственной пластинки слизистой оболочки; волокна собственной пластинки, расположенные поодиночке и имеющие диаметр менее размера ядер клеток базального слоя, рассматривались как нормальные; сцепленные друг с другом волокна обычного диаметра, а также волокна, имеющие диаметр, равный или превышающий размер ядер клеток базального слоя, рассматривались как патологичные; балльная шкала ФСП основана на степени утолщения волокон.
ЭГДС с множественной биопсией при ЭоЭ является незаменимым методом, позволяющим установить диагноз, контролировать активность воспалительного и фибротического процессов с течением времени, эффективность лечения. Необходимость частых эндоскопических вмешательств значительно снижает качество жизни пациентов, увеличивает расходы. На сегодняшний день получены многообещающие результаты применения альтернативных методов диагностики ЭоЭ, основанных на оценке концентрации протеолитических ферментов эозинофилов, адсорбированных на специальной заглатываемой нити или губке [35, 36].
Другим методом малоинвазивной диагностики ЭоЭ является так называемая «диагностическая панель ЭоЭ», включающая анализ 96 генов в образцах ткани из пищевода. Специфичность и чувствительность генетического тестирования составляют 98 и 96% соответственно. Методика имеет важные преимущества перед ЭГДС: нет необходимости в проведении множественных биопсий, диагноз может быть установлен вне зависимости от степени эозинофильного воспаления слизистой оболочки, в том числе на фоне противовоспалительной терапии [37].
Рентгенологическое исследование пищевода с контрастированием
Рентгеноконтрастное исследование пищевода в диагностике ЭоЭ является дополнительным методом, позволяющим с высокой точностью выявить проксимальные и дистальные стриктуры пищевода, оценить их протяженность, диаметр пищевода в месте сужения, принять решение о необходимости дилатации или бужирования [38, 39].
Поскольку контроль за эффективностью терапии включает частые эндоскопические вмешательства с проведением множественных биопсий, перед учеными и клиницистами остро стоит вопрос поиска менее инвазивных методов диагностики ЭоЭ.
Импедансометрия и импедансопланиметрия пищевода
Активный воспалительный процесс в толще слизистой оболочки пищевода при ЭоЭ обусловливает наличие экссудата на поверхности эпителия. Известно, что жидкость, в том числе воспалительный экссудат, является хорошим проводником для переменного электрического тока, в связи с чем снижение базального уровня импеданса (сопротивления переменному электрическому току) на поверхности слизистой оболочки пищевода может отражать активность воспалительного процесса.
В исследовании с участием 20 больных ЭоЭ (10 больных в стадии активного воспаления, 10 больных в стадии ремиссии) и группы контроля применение импедансометрии пищевода выявило статистически значимое (р<0,001) снижение импеданса у больных ЭоЭ в активной стадии заболевания по сравнению с больными в стадии ремиссии (1909 Ом vs 4349 Ом) и с группой контроля (1909 Ом vs 5530 Ом). Причем выраженность снижения импеданса коррелировала с тяжестью эозинофильной инфильтрации. Чувствительность и специфичность метода составили 90 и 91% соответственно [40].
Еще одной инновационной методикой, с помощью которой возможно косвенно оценить выраженность склеротических изменений стенки пищевода, является метод EndoFLIP (functional lumen impedance planimetry).
Метод EndoFLIP основан на данных импедансоманометрии высокого разрешения, получаемых в период растяжения стенки пищевода внутрипищеводным баллоном. Снижение растяжимости стенки пищевода, обнаруженное при проведении планиметрии у больных ЭоЭ, коррелирует с выраженностью фибротических изменений и служит своеобразным маркером прогрессии заболевания.
Необходимость использования дополнительных методов для диагностики выраженности подслизистого фиброза продиктована тем, что ЭГДС в большинстве случаев оказывается несостоятельна в диагностике стриктур пищевода на ранних стадиях. Проведение множественных биопсий также далеко не всегда позволяет выявить фибротические изменения стенки пищевода в связи с их очаговым характером [41, 42].
Цитогубка
Обнадеживающие результаты были получены при использовании минимально инвазивных методик, таких как String Test и Cytosponge. String Test — заглатываемая пациентом капсула, из которой при растворении в желудке освобождается нить, длиной до 90 см, адсорбирующая протеолитические ферменты эозинофильных гранул с поверхности слизистой оболочки пищевода. Активность ферментов в дальнейшем оценивается лабораторными методами. Процедура не требует анестезии, хорошо переносится, извлечение нити происходит через 1—12 ч [35]. В исследовании, посвященном сравнению результатов теста у детей, страдающих ГЭРБ, активным ЭоЭ или ЭоЭ в стадии ремиссии, было показано наличие значимой корреляции между концентрацией адсорбированных на нить протеолитических ферментов эозинофилов (нг/мл) со степенью эозинофильной инфильтрации слизистой оболочки пищевода [35].
Cytosponge — желатиновая капсула с нитью, при растворении которой в желудке высвобождается губка диаметром до 3 см с выраженными абразивными свойствами. Губка в процессе вытягивания за нить позволяет получить микрообразцы ткани из пищевода, которые затем подвергаются иммуноцитохимическому анализу [36].
Показатели периферической крови в диагностике эозинофильного эзофагита
При проведении общего анализа крови эозинофилия наблюдается у 30—80% больных ЭоЭ, а абсолютное число эозинофилов в периферической крови статистически значимо коррелирует со степенью эозинофильной инфильтрации слизистой оболочки пищевода и заметно уменьшается при достижении гистологической ремиссии ЭоЭ на фоне лечения ИПП или топическими стероидами [42—48]. К сожалению, эозинофилия не является специфичной только для ЭоЭ, в связи с чем этот показатель необходимо оценивать с учетом возраста пациента, наличия аллергических заболеваний, времени года (цветение трав и деревьев) и других факторов, способных повлиять на изменение числа эозинофилов в крови.
Методики, связанные с оценкой сывороточной концентрации других потенциальных биомаркеров ЭоЭ (сывороточный IgE, провоспалительные цитокины (ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-9, ИЛ-13), ферменты эозинофильных гранул, эотаксин-3, тимический стромальный лимфопоэтин, факторы роста опухолей и др.) также оказались непригодны для диагностики ЭоЭ и контроля за активностью воспалительного процесса. Несмотря на то что данные биологически активные вещества принимают непосредственное участие в патогенезе ЭоЭ, их уровень в сыворотке крови слабо коррелирует со степенью эозинофильного воспаления в слизистой оболочке пищевода [15, 43—49].
Исследование мочи в диагностике эозинофильного эзофагита
3-Бромтирозин является биомаркером, отражающим активность эозинофилов. Уровень 3-бромтирозина в моче больных ЭоЭ в 93 раза выше, чем у здоровых добровольцев, и в 13 раз выше, чем у больных с атопическими заболеваниями. Необходимы дальнейшие исследования, подтверждающие диагностическую ценность 3-бромтирозина при ЭоЭ [50].
Нерешенные вопросы в диагностике эозинофильного эзофагита
На сегодняшний день диагноз и оценка эффективности терапии ЭоЭ базируются на данных, полученных при проведении ЭГДС и анализе биоптатов из пищевода. Однако, так ли важна роль эозинофилов (крайне специфичной и малочисленной популяции лейкоцитов) в патогенезе заболевания или их появление в толще слизистой оболочки пищевода отражает лишь верхушку айсберга?
Интересна серия клинических наблюдений, которая описывает случаи персистирующей дисфагии среди членов семей больных ЭоЭ, у которых при морфологическом исследовании биоптатов слизистой оболочки пищевода выявлялась мастоцитарная и лимфоцитарная инфильтрация, повышение экспрессии генов, входящих в транскриптом ЭоЭ, однако (несмотря на характерные симптомы) число эозинофилов было в пределах нормы или повышено незначительно [51].
С разработкой современных лекарственных препаратов, регулирующих пролиферацию, созревание эозинофилов, снижающих активность эозинофильного воспаления, ученые столкнулись с проблемой их низкой клинической эффективности, что также породило сомнения в роли эозинофилов в патогенезе ЭоЭ. Так, например, препараты меполизумаб и резлизумаб, являющиеся моноклональными антителами к ИЛ-5 и на 90% снижающие эозинофильную инфильтрацию слизистой оболочки пищевода, оказались малоэффективны в отношении купирования симптомов у больных ЭоЭ. Более того, на фоне лечения данными препаратами воспалительная инфильтрация слизистой оболочки пищевода Т-лимфоцитами и мастоцитами сохранялась [52—54].
Требуются дальнейшие исследования, посвященные роли других (кроме эозинофилов) клеточных популяций в патогенезе ЭоЭ [15].
Лечение эозинофильного эзофагита
Целями терапии ЭоЭ являются достижение клинической (купирование дисфагии) и гистологической ремиссии заболевания, предотвращение развития осложнений (стриктуры пищевода). Под гистологической ремиссией ЭоЭ подразумевают разрешение эозинофильного воспаления (менее 15 эозинофилов в поле зрения микроскопа высокого разрешения).
Современная концепция лечения больных ЭоЭ включает медикаментозную терапию, диетические ограничения и при необходимости — проведение эндоскопической дилатации пищевода.
Медикаментозная терапия эозинофильного эзофагита
Медикаментозная терапия ЭоЭ базируется на назначении топических кортикостероидов или/и ИПП.
Впервые системные кортикостероиды для лечения детей с ЭоЭ были применены в 1998 г. [55]. Несколько месяцев спустя были опубликованы данные об успешном применении топических кортикостероидов у 4 детей с ЭоЭ [56].
На сегодняшний день опубликовано 11 рандомизированных исследований, несколько систематических обзоров и метаанализов, большинство из которых свидетельствуют о высокой эффективности топических стероидов в индукции гистологической ремиссии у больных ЭоЭ, независимо от их возраста [57—71]. На основании накопленных данных современные рекомендации указывают на предпочтительные к использованию препараты, их дозировку (табл. 5)
Таблица 5. Дозы топических кортикостероидов для индукции и поддержания ремиссии у больных ЭоЭ [10]
[10] и способ применения.
Так, при использовании аэрозоля флутиказона необходимо сделать впрыск и глоток, задерживая дыхание. Перед применением будесонида рекомендуется приготовить густую суспензию (смешать 1—2 мг будесонида с 5 мг сукралозы). Доза будесонида у детей должна корректироваться с учетом веса и возраста. В течение 30—60 мин после применения топических стероидов важно воздержаться от приема пищи и жидкостей во избежание удаления лекарственного препарата со слизистой оболочки пищевода.
Особую важность в повышении эффективности лечения играет лекарственная форма препарата, обеспечивающая наиболее продолжительный контакт слизистой оболочки пищевода с действующим веществом. В исследовании E. Dellon и соавт. [62] при лечении будесонидом в дозе 1 мг в течение 8 нед удалось достигнуть гистологической ремиссии у 64% больных, использовавших лекарственный препарат в виде густого сиропа, и лишь у 27% больных, применявших небулайзер. Объясняется это более длительной аппликацией сиропа (по сравнению с аэрозолем) будесонида на слизистой оболочке дистального отдела пищевода (что было доказано с помощью сцинтиграфии). Системные кортикостероиды в лечении ЭоЭ в настоящее время не используются [10].
В связи с тем что ЭоЭ — хроническое, персистирующее заболевание, большинству больных ЭоЭ для поддержания ремиссии необходима длительная поддерживающая терапия.
Единственное существующее на сегодняшний день рандомизированное двойное слепое плацебо- контролируемое исследование по оценке эффективности длительной поддерживающей терапии ЭоЭ топическими стероидами среди 28 взрослых больных, получавших в течение 50 нед будесонид 0,5 мг или плацебо, показало неоднозначные результаты [72]. Лишь у 36% больных, принимавших будесонид, к концу исследования удалось поддержать гистологическую ремиссию с числом эозинофилов менее 5 в поле зрения, тогда как в группе плацебо рецидив заболевания наблюдался у всех пациентов.
Аналогичное исследование среди детей [73], достигших гистологической ремиссии (менее 1 эозинофила в поле зрения микроскопа высокого разрешения) на фоне применения высоких доз флутиказона (1760 мкг/сут) показало, что продолжение приема половинной дозы препарата позволяет поддерживать ремиссию у 73% больных детей.
Критерии выбора пациентов, которым показана поддерживающая терапия:
— малый диаметр пищевода;
— прогрессирование стриктур;
— скорый рецидив после отмены терапии;
— повторяющиеся эпизоды вклинения пищи в пищевод;
— сопутствующие заболевания, осложняющие проведение дилатации пищевода;
— перфорации пищевода в анамнезе.
Топические стероиды отличаются достаточно высоким профилем безопасности. Доказанным побочным эффектом их применения является развитие кандидоза пищевода у 10% больных [10]. В проведенных плацебо-контролируемых исследованиях не удалось выявить статистически значимых различий в частоте развития кандидоза пищевода у больных с ЭоЭ, принимающих топические стероиды и плацебо. Так, кандидоз пищевода развивался у 5—26% больных на фоне кратковременной терапии полными дозами кортикостероидов/плацебо [10] и у 0—5% при длительной поддерживающей терапии [10]. Как правило, кандидоз пищевода протекал бессимптомно и являлся случайной находкой при плановых эндоскопических исследованиях. Число лиц, которых необходимо пролечить (NNT), чтобы у одного из них развился кандидоз, составляет 9 [68].
Терапия кандидоза пищевода проводится нистатином или флуконазолом per os. Различий в частоте развития кандидоза в зависимости от применяемой лекарственной формы (небулайзер или густая суспензия) выявлено не было [62].
Тем не менее существуют некоторые опасения, касающиеся возможного влияния заглатываемых топических стероидов на секрецию эндогенного кортизола, особенно у детей.
В одном из наблюдательных исследований прием флутиказона пропионата в дозе 220—880 мкг/сут или будесонида в дозе 0,5—1 мг/сут в течение 8—43 нед не оказывал влияния на уровень сывороточного кортизола [74]. По другим данным, при применении флутиказона пропионата в дозе более 440 мкг/сут 6 мес и более у 10% детей наблюдалось снижение функциональной активности коры надпочечников и секреции кортизола [75]. Еще одно исследование [76], проведенное среди детей, принимавших будесонид, показало субоптимальные уровни сывороточного кортизола у 43% больных, вне зависимости от длительности лечения.
Учитывая имеющиеся на сегодняшний день данные, пациентам детского возраста, принимающим высокие дозы топических стероидов, рекомендовано проведение мониторирования уровня сывороточного кортизола для предотвращения развития надпочечниковой недостаточности.
Ингибиторы протонной помпы
За последние 15 лет была опубликована целая серия ретроспективных наблюдений и метаанализов, подтверждающих развитие клинико-гистологической ремиссии не менее чем у половины больных ЭоЭ детей и взрослых на фоне приема ИПП [77—81].
Эффективность ИПП при ЭоЭ объясняется их способностью восстанавливать барьерную функцию слизистой оболочки пищевода, что препятствет глубокому проникновению экзогенных антигенов в толщу слизистой оболочки, а также наличием у ИПП собственной противовоспалительной активности.
В связи с тем что нарушение барьерной функции слизистой оболочки пищевода признано одним из ключевых факторов патогенезаЭоЭ, а также учитывая высокую частоту сочетанного течения ГЭРБ и ЭоЭ, применение ИПП в лечении больных ЭоЭ является терапией первой линии.
Воздействие агрессивного рефлюктата при ГЭРБ приводит к повреждению слизистой оболочки пищевода и более глубокой пенетрации антигенов, высвобождению медиаторов воспаления клетками лейкоцитарного ряда, стимулирует увеличение продолжительности жизни эозинофилов. Заживление слизистой оболочки под влиянием ИПП предупреждает дальнейшую антигенную стимуляцию иммунокомпетентных клеток в слизистой оболочке пищевода и тем самым тормозит воспалительный процесс [9].
Собственная противовоспалительная активность ИПП основана на блокировании стимулированной (цитокинами Т-хелперов 2-го типа) экспрессии эотаксина-3 в эпителиальных клетках слизистой оболочки пищевода, угнетении экспрессии молекул сосудистой адгезии, функции нейтрофилов и продукции провоспалительных цитокинов [82].
Интересно, что еще совсем недавно пациентов, отвечающих на терапию ИПП облегчением симптомов и нормализацией гистологической картины, не относили к ЭоЭ, а включали в группу больных эзофагеальной эозинофилией, разрешающейся при терапии ИПП. Последние несколько лет были ознаменованы большим количеством исследований, призванных внести ясность в проблему эозинофилии пищевода, разрешающейся в ответ на терапию ИПП. Большинство работ показали отсутствие каких бы то ни было отличий в клинических проявлениях, эндоскопических, гистологических, функциональных (рН-метрия пищевода) и молекулярно-генетических особенностях у больных ЭоЭ и больных с эзофагеальной эозинофилией, отвечающей на терапию ИПП. Ключевым пунктом, позволившим сделать вывод о том, что эзофагеальная эозинофилия, разрешающаяся на фоне терапии ИПП, является лишь одним из фенотипов ЭоЭ, явился генетический анализ. На сегодняшний день расшифровано несколько генетических аномалий, приводящих к развитию эозинофильной инфильтрации слизистой оболочки пищевода: гены, ответственные за экспрессию веществ-хемоаттрактантов (гены эотаксина 3), «барьерных» молекул (desmoglein 1), генов, контролирующих ремоделирование тканей (periostin) и генов, ответственных за функционирование мастоцитов (carboxypeptidase A). Мутации в данных генах обнаруживаются с одинаковой частотой при обоих фенотипах ЭоЭ (отвечающем и не отвечающем на терапию ИПП) [10, 13].
Согласно последним международным консенсусным документам, эзофагеальная эозинофилия, разрешающаяся на фоне антисекреторной терапии, является одним из фенотипических проявлений ЭоЭ, а не отдельным заболеванием [10, 13].
На сегодняшний день в терапии взрослых больных ЭоЭ рекомендовано применение ИПП 2 раза в день (в дозах, эквивалентных 20—40 мг омепразола). Для индукции ремиссии тяжелого эзофагита у детей рекомендовано назначение ИПП из расчета 1 мг/кг на 1 прием 2 раза в день в течение 8 нед [13].
Декслансопразол в лечении ЭоЭ представляется перспективным препаратом в связи с его высокой антисекреторной активностью и безопасностью. Декслансопразол (дексилант) представляет собой правовращающий (R–) стереоизомер лансопразола. R-изомер метаболизируется в печени значительно медленнее, чем S-изомер, что обусловливает значительно более выраженное и стойкое антисекреторное действие препарата [83].
Отличительными особенностями препарата дексилант является его лекарственная форма: капсулы двойного отсроченного высвобождения dual delayed release (DDR). Каждая капсула DDR состоит из двух типов гранул, высвобождающих активное вещество на различных уровнях рН (5,5 и 6,75) [84]. Первый тип гранул (25% от дозы препарата) был разработан для быстрого высвобождения препарата после того, как гранулы достигнут проксимальной части двенадцатиперстной кишки, в то время как гранулы второго типа (75% от дозы препарата) проводятся дальше по пищеварительному тракту до дистального отдела тонкой кишки [84, 85]. В результате фармакокинетический профиль декслансопразола характеризуется наличием двух пиков, в отличие от традиционных ИПП, для которых характерно наличие лишь одного пика. Формирование двух пиков Tmax: 1—2 ч, 4—5 ч обеспечивает устойчивую концентрацию препарата в крови и пролонгированное действие препарата, в частности среднесуточное поддержание интрагастрального рН более 4 [86, 87]. Декслансопразол — это не просто энантиомер лансопразола в более высокой дозе. За счет использования технологии модифицированного высвобождения меняется характер зависимости концентрации от времени, Tmax наступает позже. Подобные свойства позволяют декслансопразолу обеспечить более длительное снижение секреции желудочного сока по сравнению с другими ИПП, что особенно важно для пациентов с ЭоЭ, поскольку позволяет добиться полной репарации слизистой оболочки пищевода [86—90], что в свою очередь предотвращает проникновение пищевых и воздушных антигенов в толщу слизистой оболочки пищевода.
Другим ключевым свойством декслансопразола, позволяющим считать данный ИПП препаратом выбора в лечении больных ЭоЭ, является высокий профиль безопасности препарата. Значительное количество клинических исследований, наблюдений и обзоров позволило доказать, что декслансопразол является одним из самых безопасных препаратов из группы ИПП [91—96]. Так, например, при оценке данных, полученных в рандомизированных клинических исследованиях с участием 4270 пациентов, принимавших декслансопразол в дозах 30 мг (n=455), 60 мг (n=2311), а также 1363 пациентов, принимавших лансопразол 30 мг, и 896 человек, принимавших плацебо, оказалось, что частота побочных эффектов и нежелательных явлений на фоне приема лансопразола, декслансопразола и плацебо статистически не отличалась [90]. Выводом данной работы явилось утверждение о том, что декслансопразол является препаратом, безопасность применения которого сопоставима с лансопразолом [90—93]. Интересны также данные об отсутствии влияния декслансопразола на интервал QT, полученные при применении высоких доз препарата (300 мг) у здоровых добровольцев [94]. Следует отметить, что декслансопразол одобрен к применению для терапии различных форм ГЭРБ в дозировках 30 мг и 60 мг, в том числе и у детей с 12 лет, согласно инструкции по медицинскому применению [129].
Обзор литературы, посвященный проблеме реакций гиперчувствительности в ответ на прием различных ИПП, проведенный за период с 1986 по 2012 г., позволил выявить 118 случаев реакции гиперчувствительности — в диапазоне от кожных реакций до анафилактического шока. Наиболее часто возникновение IgE-опосредованных реакций гиперчувствительности было связано с приемом омепразола, кроме того, данные реакции описаны на прием эзомепразола, рабепразола и лансопразола. Однако на сегодняшний день не известно ни одного зарегистрированного случая реакции гиперчувствительности на фоне лечения декслансопразолом, что является крайне важным для пациентов с изначально скомпрометированным иммунным статусом и склонных к аллергическим и атопическим реакциям [96].
Вопрос о длительности терапии и дозах ИПП, необходимых для поддержания ремиссии, по сей день остается открытым. Рецидив клинической симптоматики и активизация эозинофильного воспаления возникают в среднем через 3—6 мес после отмены ИПП. Рекомендовано постепенное снижение дозы ИПП до достижения минимально эффективной дозировки для каждого конкретного пациента [97]. Данная рекомендация основана на упомянутом выше проспективном наблюдении за детьми с эозинофилией пищевода, у которых в 78% случаев удалось добиться поддержания клинико-гистологической ремиссии в течение 1 года даже на фоне низкой дозы ИПП [80].
Мультицентровое исследование среди 75 взрослых также показало, что даже минимальные дозы ИПП позволяют поддерживать ремиссию у 73% больных. В случае возникновения рецидива на фоне малых доз ИПП, повышение дозы приводило к купированию симптоматики и нормализации гистологической картины [98]. Требуются дополнительные, более длительные исследования о дозах и длительности терапии ИПП для поддержания ремиссии ЭоЭ.
Ингибиторы лейкотриеновых рецепторов
Антагонист лейкотриеновых рецепторов D4 (Montelukast), используемый в высоких дозах (до 100 мг) [99] у взрослых и стандартных дозах у детей [100], приводит к значимому улучшению клинической симптоматики, однако несостоятелен в индукции гистологической ремиссии.
В рандомизированном контролируемом исследовании эффективность монтелукаста в поддержании ремиссии, индуцированной приемом системных кортикостероидов (20 мг/сут), была сопоставима с плацебо [101]. В серии проспективных наблюдений за взрослыми больными, у которых ремиссия была достигнута на фоне применения топических стероидов, применение монтелукаста в качестве поддерживающей терапии привело к рецидиву эозинофильного воспаления в течение 3-месячного периода [102].
На сегодняшний день применение антагонистов лейкотриеновых рецепторов для лечения или поддержания ремиссии ЭоЭ не рекомендовано.
Антагонисты CRTH2-рецепторов
Первое поколение антагонистов рецепторов CRTh2 было разработано с целью предотвращения эффектов простагландина D2 на Т-хелперы 2-го типа и эозинофилы.
В рандомизированном двойном слепом плацебо-контролируемом исследовании по лечению 26 взрослых больных ЭоЭ с применением селективного антагониста CRTh2-рецептора (препарат OC000459 100 мг 2 раза в сутки 8 нед) были показаны умеренное улучшение клинической симптоматики и небольшое снижение степени эозинофильной инфильтрации (в среднем на 33%) слизистой оболочки пищевода. Несмотря на то что за 8 нед лечения не удалось достичь гистологической или клинической ремиссии ни у одного из пациентов, хороший профиль безопасности препарата послужил стимулом для дальнейших разработок и исследований в этом направлении [103]. В настоящее время проходят исследования второго поколения антагонистов рецепторов CRTh2.
Антитела к интерлейкинам
Антитела к ИЛ-5 уменьшают эозинофильную инфильтрацию в слизистой оболочке пищевода, не влияя на выраженность клинических симптомов ЭоЭ. Эффективность моноклональных антител к ИЛ-5 — меполизумаб (mepolizumab) и реслизумаб (reslizumab) при ЭоЭ была оценена в 3 рандомизированных плацебо-контролируемых исследованиях [52—54], включавших больных детей, подростков и взрослых. Было показано, что антитела к ИЛ-5 на 90% снижают эозинофилию периферической крови, на 55% — выраженность эозинофильной инфильтрации слизистой оболочки пищевода. Однако, несмотря на высокую активность новых препаратов в отношении эозинофильного воспаления на фоне лечения, не удалось достигнуть разрешения клинической симптоматики заболевания, которая сохранялась наряду со значительной воспалительной инфильтрацией слизистой оболочки пищевода неэозинофильными лейкоцитами. Применение антител к ИЛ-5 для лечения ЭоЭ на сегодняшний день не рекомендовано.
Применение другого биологического препарата, представленного антителами к ИЛ-13 (препарат QAX576), в рандомизированном двойном слепом плацебо-контролируемом исследовании позволило снизить эозинофильную инфильтрацию слизистой оболочки пищевода в среднем на 60%. Эффект препарата сохранялся около 6 мес, было зафиксировано некоторое улучшение клинической симптоматики. Анализ биоптатов из слизистой оболочки пищевода больных, получавших данный препарат, позволил зафиксировать снижение активности ЭоЭ-ассоциированных генов, таких как эотаксин-3, периостин, а также нормализацию работы генов, ответственных за осуществление барьерной функции эпителия пищевода [104].
Вторая стадия плацебо-контролируемого исследования еще одного препарата, содержащего моноклональные антитела к ИЛ-13 (RPC4046), показала его высокую эффективность в снижении эозинофилии пищевода, улучшении эндоскопической картины, а главное — в купировании дисфагии. Благоприятный профиль безопасности, влияние на выраженность жалоб делают антитела к ИЛ-13 перспективными для дальнейших исследований [105].
Несмотря на то что в ответ на воспаление в многослойном плоском эпителии пищевода возникает массивная экспрессия фактора некроза опухоли, при применении антител к фактору некроза опухоли альфа (инфликсимаб) у больных с ЭоЭ не удалось достичь купирования клинической симптоматики и разрешения эозинофилии пищевода [106]. Использование инфликсимаба для лечения ЭоЭ не рекомендовано.
Иммуносупрессоры
Согласно данным пилотного исследования, включавшего всего 3 пациентов со стероидорезистентной формой ЭоЭ, назначение азатиоприна и 6-меркаптопурина позволило достичь ремиссии заболевания и обеспечить ее поддержание на длительный срок [107]. Требуются дальнейшие исследования.
Диета при эозинофильном эзофагите
Неоспоримые преимущества диетической терапии ЭоЭ включают отсутствие побочных эффектов, невысокую стоимость, эффективность (особенно у детей) в достижении не только клинической, но и гистологической ремиссии. Недостатками применения диет для лечения ЭоЭ являются значительное снижение качества жизни пациентов, вынужденных пожизненно придерживаться строгих ограничений, социальная дезадаптация, необходимость проведения ЭГДС в случае введения новых пищевых продуктов в рацион (для контроля за активностью воспалительного процесса).
В лечении ЭоЭ используются несколько диетических режимов.
1. Элементная диета (аминокислотная смесь) приводит к полной гистологической ремиссии у большинства больных ЭоЭ детей и у 80—90% больных взрослого возраста. Элементная диета применяется для лечения больных ЭоЭ только в случае неэффективности медикаментозной терапии и элиминационных диет.
Элементная диета включает употребление в пищу специально приготовленных аминокислотных смесей с минимальной антигенной активностью (на фоне полного исключения из рациона любой другой пищи). Первые доказательства высокой эффективности элементной диеты были получены среди 10 больных детей с выраженной эозинофильной инфильтрацией слизистой оболочки пищевода, не разрешающейся на фоне медикаментозной терапии [108]. В данном исследовании применение элементной диеты в течение 6 нед привело к достижению гистологической ремиссии у 8 из 10 детей, у 2 больных наблюдались выраженное улучшение клинической картины и снижение степени эозинофильного воспаления.
Последующие работы и метаанализ нескольких наблюдательных исследований, оценивающий эффективность различных диетических режимов при ЭоЭ, установили, что применение элементной диеты приводит к достижению гистологической ремиссии у 90,8% (95% CI 84,7—95,5%) больных ЭоЭ [109].
Столь высокая эффективность элементной диеты, к сожалению, омрачается рядом сопутствующих факторов, не позволяющих применять ее у большинства пациентов.
Вкус смесей зачастую требует применения назогастрального зонда для их введения у детей, а более чем 1/3 взрослых отказываются от диеты в течение 4 нед [110, 111]. Необходимость полностью исключить из рациона привычную пищу вызывает значительный моральный дискомфорт, социальную дезадаптацию, выраженное снижение качества жизни.
Таким образом, реалии применения аминокислотных смесей в качестве лечебной тактики при ЭоЭ таковы, что использоваться они могут главным образом у грудных детей с выраженными клиническими симптомами и эозинофильным воспалением слизистой оболочки пищевода, не разрешающимися на фоне медикаментозной терапии.
2. Элиминационные диеты с исключением продуктов, вызывающих аллергию у конкретного индивида. Элиминационная диета способствует индукции гистологической ремиссии менее чем у 1/3 взрослых больных ЭоЭ.
Элиминационная диета составляется индивидуально для каждого пациента с ЭоЭ, основываясь на данных аллергологического тестирования (кожные скарификационные и аппликационные пробы). При элиминационной диете из рациона больного исключаются продукты, доказавшие свой аллергенный потенциал у конкретного пациента.
Первые исследования, направленные на оценку эффективности элиминационной диеты в детской популяции, показали достаточно хорошие результаты: достижение клинико-гистологической ремиссии у 49—53% детей с ЭоЭ. Однако последующие работы выявили гораздо менее обнадеживающие показатели эффективности элиминационной диеты [112—117].
В среднем ремиссии на фоне элиминационной диеты удается достичь у 45,5% (95% CI 35,4—55,7%) больных с ЭоЭ, причем эффективность данного терапевтического подхода у взрослых больных значительно ниже, чем у детей [109].
3. Эмпирическая диета с исключением из рациона продуктов с высоким аллергенным потенциалом (яйца, молоко, соя, орехи, пшеница, рыба и др). Эмпирическая диета эффективна в среднем у 67,2% больных, что сопоставимо с терапией топическими глюкокортикостероидами (63,3%).
Изначально в основу данного диетического режима были положены сведения о продуктах питания, наиболее часто вызывавших аллергические реакции в детской популяции Чикаго (США): белок коровьего молока, пшеница, яйца, соя, арахис и лесной орех, рыба, морепродукты. Первое опубликованное исследование, оценивающее эффективность эмпирической диеты у больных ЭоЭ, показало превосходные результаты: гистологическая ремиссия на фоне пищевых ограничений (без применения медикаментозной терапии) была достигнута у 74% детей [118]. В дальнейшем сходные результаты были получены и в множестве других работ. Более того, метаанализ, рассматривающий эффективность диетических режимов при ЭоЭ, показал, что гистологическая ремиссия на фоне эмпирической диеты с исключением 6 продуктов наблюдается в среднем у 72% пациентов (95% CI 66—78%) независимо от их возраста [109].
При детальном рассмотрении эмпирическая диета с исключением 6 продуктов оказалась не лишена серьезных недостатков: значительные диетические ограничения и необходимость частых повторных эндоскопических вмешательств при введении в рацион хотя бы одного из запрещенных продуктов [109]. Постепенно в попытках уйти от столь строгого режима питания и расширить рацион (путем введения нового продукта с последующим эндоскопическим контролем за состоянием слизистой оболочки пищевода) было выявлено, что у большинства пациентов (65—85%) с ЭоЭ триггерами рецидива являются всего лишь 1—2 продукта [119, 120].
Наиболее часто эозинофильное воспаление индуцировалось у больных ЭоЭ после употребления в пищу коровьего молока, глютена, яиц, сои/бобовых, тогда как роль орехов, рыбы и морепродуктов оказалась не столь значительной. Основываясь на полученных данных, была разработана новая эмпирическая диета с исключением 4 продуктов: коровьего молока, глютена, яиц, сои и бобовых [120].
Проспективное мультицентровое исследование [120] по оценке эффективности диеты с исключением 4 продуктов среди взрослых показало достижение ремиссии у 54% больных ЭоЭ. Результаты диеты в детской популяции оказались еще более обнадеживающими: ремиссия наблюдалась у 71% больных [119]. Важно, что в обеих работах наиболее частым триггером (особенно у детей) активации эозинофильного воспаления в пищеводе было коровье молоко. Интересно, что взрослые чаще всего реагировали на коровье молоко или глютен (или на оба продукта одновременно) [120], тогда как у 74% детей триггером оказался лишь 1 продукт (чаще всего — коровье молоко) [119]. Исключение коровьего молока из рациона приводило к гистологической ремиссии у 61—65% больных детей [121—123].
В настоящее время дискутируется вопрос о возможности ступенчатого подхода к диетическим ограничениям: исключение 1 или 2 продуктов (молоко, глютенсодержащие злаки) на начальном этапе лечения с постепенным расширением списка запрещенных продуктов у пациентов, не достигших гистологической ремиссии на фоне более либеральной диеты [123].
Ступенчатая диетотерапия у больных ЭоЭ оценена в клиническом исследовании (2016): исключение коровьего молока и глютенсодержащих злаков приводило к ремиссии у 40% больных. У пациентов, не достигших ремиссии на фоне такого режима, в последующем исключались из рациона 4 продукта (ремиссия у 52%). Далее, в случае неудачи, вводилась более строгая диета с ограничением 6 продуктов (ремиссия у 65%) [124].
Эндоскопическое лечение при стриктурах и/или стенозе пищевода
Дисфагия у пациентов с ЭоЭ может быть обусловлена как активным воспалительным процессом в слизистой оболочке пищевода, так и развитием фиброзных изменений в подслизистом слое с исходом в образование стриктур. Медикаментозная противовоспалительная терапия в большинстве случаев позволяет уменьшить клинические проявления заболевания, в случае же развития тяжелых фибротических изменений стенки пищевода разрешение дисфагии возможно только после проведения эндоскопического лечения.
Эндоскопические вмешательства при дисфагии на фоне стриктур пищевода (при диаметре пищевода <13 мм) включают бужирование или баллонную дилатацию пищевода.
Эндоскопическая дилатация не оказывает влияния на иммуновоспалительный процесс в слизистой оболочке, данная процедура призвана лишь снизить выраженность дисфагии, вызванной необратимыми фибротическими изменениями стенки пищевода, в связи с чем эндоскопическое лечение не может быть использовано в качестве терапии первой линии (за исключением ургентных ситуаций и декомпенсированных стенозов) и должно проводиться в плановом порядке только после курса медикаментозной терапии [125].
При ургентных ситуациях, повторяющихся вклинениях пищи в пищевод, терминальных сужениях пищевода допустимо проведение дилатации пищевода без предварительной противовоспалительной терапии, что, однако, увеличивает риск осложнений. Компенсированные и субкомпенсированные стриктуры пищевода подлежат дилатации только после снижения активности эозинофильного воспаления (гистологическая ремиссия) на фоне лечения ИПП или топическими глюкокортикостероидами [15].
До 75% больных испытывают загрудинные боли в течение нескольких дней после процедуры, о чем они должны быть предупреждены заранее. Дилатация пищевода значительно улучшает качество жизни большинства больных, приводя к разрешению дисфагии. Длительность положительного эффекта (исчезновение дисфагии) после процедуры составляет в среднем 2 года. Вероятность развития осложнений (кровотечение, перфорация) эндоскопического лечения не превышает 0,1—0,3% [126].
Профилактика стриктур включает раннее начало лечения и назначение длительной поддерживающей терапии. Отсутствие медикаментозной терапии приводит к развитию стриктур у 71—85% больных ЭоЭ (при длительности заболевания около 20 лет) [127], в то время как своевременное назначение топических кортикостероидов может не только предотвращать, но и вызывать обратное развитие фиброза [128].
Стратегия терапии эозинофильного эзофагита
Решение о выборе базисного препарата (ИПП, топические стероиды) и диетического режима для лечения ЭоЭ рекомендовано принимать совместно с пациентом, обсудив с ним все положительные и отрицательные стороны имеющихся вариантов.
Известно, что дети и подростки с трудом придерживаются диетических ограничений, в связи с чем более рациональным для них будет назначение топических кортикостероидов. Справедливо это и для пациентов с тяжелыми симптомами заболевания, у которых диета, как единственный метод лечения, скорее всего будет неэффективна.
Важно, что терапия пациентов с ЭоЭ может со временем изменяться (при желании пациента, возникновении побочных эффектов и пр.), поскольку существуют данные, показывающие, что достижение ремиссии на фоне ИПП не исключает эффективности топических стероидов или диеты, и наоборот.
Эффективность медикаментозной терапии и диетических режимов должна быть обязательно оценена через 6—12 нед после начала лечения путем проведения ЭГДС с биопсией.
Решение о необходимости эндоскопической дилатации рекомендуется проводить пациентам со стриктурами и стенозом пищевода (при диаметре пищевода <13 мм) после пробного курса медикаментозной терапии. Эндоскопическая дилатация пищевода не может быть единственным лечебным мероприятием у больных с ЭоЭ, она должна проводиться на фоне базисной противовоспалительной терапии ИПП или топическими кортикостероидами.
Клинические наблюдения
Пациентка Г., 30 лет, обратилась к терапевту с жалобами на затруднения при проглатывании твердой пищи, сухой кашель во время еды, ощущение инородного тела в пищеводе, изжогу 3—4 раза в неделю.
Из анамнеза болезни известно, что кашель во время еды и изжога беспокоят около 9 лет, к врачам не обращалась, не обследовалась. Для купирования изжоги самостоятельно принимала антацидные препараты в режиме «по требованию» с кратковременным положительным эффектом. Около 4 лет назад появилась дисфагия при приеме твердой или сухой пищи (мясо, рыба, картофель, яблоко, печенье). Для облегчения самочувствия пациентка обильно запивала пищу водой, длительно пережевывала пищу, принимала измельченную пищу, запрокидывала голову во время еды, использовала технику задержки дыхания, подпрыгивания на месте. Через 1,5 года после начала симптомов появились эпизоды острого «ущемления» пищи в пищеводе, купируемые искусственной или естественной рвотой.
Из анамнеза жизни известно, что пациентка родилась и проживает в Санкт-Петербурге, домохозяйка. Не курит, алкоголь не употребляет. Наследственность не отягощена. В детстве страдала крапивницей, отеком Квинке при укусах пчелы. Около 4 лет пациентку беспокоят также эпизодические зудящие высыпания на груди, спине и животе, расцениваемые дерматологом как проявление аллергического дерматита (рис. 8).
Рис. 8. Поражение кожи у больной ЭоЭ.
В 2012 г. было диагностировано первичное бесплодие, выявлена гиперандрогения (повышение тестостерона в 100 раз), в связи с чем в течение 1 года пациентка получала метипред 4 мг/сут. После родов в 2014 г. уровень тестостерона нормализовался.
Объективный статус: состояние удовлетворительное, сознание ясное, положение активное. Телосложение гиперстеническое. Рост 160 см, масса тела 82 кг, индекс массы тела 32 кг/м2, температура тела 36,8 °С. Кожные покровы физиологической окраски, эритематозные зудящие высыпания на коже груди, спины и живота. Над легкими выслушивается везикулярное дыхание, хрипов нет, ЧД — 16 в 1 минуту. Тоны сердца ясные, ритмичные, ЧСС 68 в 1 минуту, АД 110 и 70 мм рт.ст. Язык влажный, обложен белым налетом в прикорневой зоне. Живот участвует в акте дыхания, не вздут, увеличен за счет подкожной жировой клетчатки, болезненный в эпигастрии. Симптомы раздражения брюшины отсутствуют. Печень не выступает из-под края реберной дуги, селезенка не пальпируется. Симптом поколачивания отрицательный с обеих сторон. Отеков нет.
По результатам лабораторных исследований: общий и биохимический анализы крови, мочи и кала без значимых отклонений от норм, отмечается повышение уровня IgE в сыворотке крови в 1,5 раза.
Учитывая длительный анамнез заболевания, жалобы на дисфагию, пациентке было рекомендовано проведение ЭГДС (впервые за 9 лет с появления первых симптомов заболевания).
Данные ЭГДС: слизистая пищевода рыхлая, отечная, контактно ранимая, на всем протяжении покрыта белесоватым густым налетом в виде отдельных точечных очагов, визуализируются нерезко выраженные кольцевидные складки. Биопсия не осуществлялась. Заключение: эндоскопические признаки кандидозного эзофагита.
Пациентке была назначена антифунгальная терапия (флуконазол 150 мг/сут) в течение 2 нед, антисекреторная терапия (омепразол 20 мг/сут). После проведенного лечения жалобы пациентки сохранялись, рекомендовано повторное эндоскопическое исследование.
Контрольная ЭГДС (через 2 нед после начала терапии флуконазолом): слизистая оболочка пищевода бледно-розовая, рыхлая, отечная, с очаговыми единичными белыми налетами (выполнен мазок-отпечаток, посев на грибы, биопсия из проксимального отдела и средней трети пищевода), нерезко выраженными кольцевидными складками, не исчезающими при прохождении перистальтической волны и максимальной инсуффляции воздуха. Зубчатая линия нечеткая, расположена на уровне пищеводно-желудочного перехода. Заключение: эндоскопическая картина может соответствовать кандидозному эзофагиту. Подозрение на ЭоЭ (рис. 9).
Рис. 9. Эндоскопические особенности ЭоЭ у больной Г., 30 лет. Отсутствие сосудистого рисунка, выраженный отек слизистой оболочки пищевода (степень 2), нерезко выраженные фиксированные концентрические сужения просвета пищевода — «трахеевидный» пищевод (степень 1, единичные очаги белого налета, покрывающие менее 10% поверхности пищевода (степень 1), отсутствие продольных борозд и рубцовых стриктур (степень 0). E2R1E1F0S0.
Цитологическое исследование мазков-отпечатков не выявило активных форм грибов Candida (дрожжевых клеток, псевдомицелия и мицелия).
По результатам морфологического исследования биоптатов из пищевода (рис. 10, 11)
Рис. 10. Гистологическое исследование биоптата из пищевода больной Г. а — скопления эозинофилов в поверхностных слоях эпителия с формированием эозинофильных микроабсцессов; б — гиперплазия базального слоя многослойного плоского эпителия, значительное количество эозинофильных лейкоцитов в средней и верхней трети эпителиального пласта. Окраска гематоксилином и эозином, ×200. a — accumulation of eosinophils in the superficial epithelial layers (eosinophilic microabscesses); b — hyperplasia of the basal layer of stratified squamous epithelium, advanced number of eosinophilic leukocytes in the middle and upper third of the epithelial layer. Staining with hematoxylin and eosin, ×200.
Рис. 11. Гистологическое исследование биоптата из пищевода больной Г.: скопления эозинофилов в поверхностных слоях эпителия с формированием эозинофильных микроабсцессов. Fig. 11. Histological examination of the esophageal specimen in patient G.: accumulation of eosinophils in the superficial epithelial layers (eosinophilic microabscesses). Окраска гематоксилином и эозином, ×400. Staining with hematoxylin and eosin, ×400.
выявлена гиперплазия базального слоя многослойного плоского эпителия, значительное количество эозинофильных лейкоцитов (более 25 в поле зрения микроскопа) преимущественно в средней и верхней трети эпителиального пласта, скопления эозинофилов в поверхностных слоях эпителия с формированием эозинофильных микроабсцессов.
На основании жалоб, данных анамнеза, объективного исследования, результатов лабораторных и инструментальных исследований был установлен клинический диагноз «эозинофильный эзофагит».
Пациентке была рекомендована замена омепразола на декслансопразол (60 мг 1 раз в сутки), назначен топический кортикостероид флутиказон (по 250 мг 2 впрыск-глотка 2 раза в сутки).
Через 2 нед приема препаратов пациентка отметила улучшение самочувствия в виде полного купирования изжоги, уменьшения проявлений дисфагии. Через 6 нед лечения жалобы купированы полностью, дисфагия не беспокоит.
При контрольном эндоскопическом обследовании через 2 мес наблюдается положительная динамика в виде отсутствия белесоватого налета, сохраняется отек слизистой оболочки пищевода. По результатам контрольной биопсии микроскопическая картина (рис. 12)
Рис. 12. Гистологическое исследование биоптата из пищевода больной Г. после курса терапии кортикостероидами и ИПП: единичные эозинофилы (2—5 в поле зрения). Fig. 12. Histological examination of the esophageal specimen in patient G. after the therapy with corticosteroids and proton pump inhibitors: single eosinophils (2—5 in sight). Окраска гематоксилином и эозином, ×400. Staining with hematoxylin and eosin, ×400.
соответствует поверхностному эзофагиту со слабым воспалительным компонентом, с единичными эозинофильными лейкоцитами (2—5 в поле зрения при ×400).
После проведения ЭГДС пациентке было рекомендовано динамическое наблюдение с проведением ЭГДС 1 раз в 2 года, прием ИПП (декслансопразол 60 мг 1 раз в сутки) длительно.
Пациент В., 27 лет, при обращении (в октябре 2018 г.) предъявлял жалобы на изжогу, затруднения при глотании твердой пищи, ощущение кома или препятствия по ходу пищевода после еды. Жалобы беспокоят около 6 мес, ранее не обследовался, не лечился. Из анамнеза жизни известно, что пациент родился и проживает в Ярославле, вредных привычек не имеет, страдает ожирением 2-й степени, гипертонической болезнью 2-й степени, 2-й стадии с 23 лет, постоянно принимает периндоприл 4 мг/сут и индапамид 1,25 мг/сут. Наследственность по атопическим и онкологическим заболеваниям не отягощена.
Объективный статус: состояние удовлетворительное, сознание ясное, положение активное. Телосложение гиперстеническое. Рост 176 см, масса тела 105 кг, ИМТ 35 кг/м2, температура тела 36,5 °С. Кожные покровы физиологической окраски, чистые. Над легкими везикулярное дыхание, хрипов нет, ЧД 17 в мин. Тоны сердца ясные, приглушены, акцент II тона на аорте, ЧСС 70 в мин, АД на момент исследования — 110 и 70 мм рт.ст. Язык сухой, обложен белым налетом, сосочки языка выражены. Живот участвует в акте дыхания, вздут, болезненный в эпигастрии. Симптомы раздражения брюшины отсутствуют. Печень не выступает из-под края реберной дуги, селезенка не пальпируется. Симптом поколачивания отрицательный с обеих сторон. Отеков нет.
По данным лабораторных исследований: в анализе кала бензидиновая проба (на скрытую кровь) отрицательна, эозинофилы не обнаружены; в клиническом анализе крови — умеренный лейкоцитоз (10,7·109/л), СОЭ 9 мм/ч, в биохимическом анализе крови — без отклонений от нормы. С-реактивный белок и ревматоидный фактор в пределах референсных значений.
По данным ЭГДС (рис. 13):
Рис. 13. Эндоскопические особенности ЭоЭ у больного В., 27 лет: отсутствие сосудистого рисунка, выраженный отек слизистой оболочки пищевода (степень 2), отсутствие фиксированных колец (степень 0), единичные очаги белого налета, покрывающие менее 10% поверхности пищевода (степень 1), неглубокие вертикальные борозды (степень 1), отсутствие рубцовых стриктур (степень 0). E2R0E1F1S0.
слизистая оболочка пищевода отечная, сосудистый рисунок не прослеживается, в проксимальном отделе визуализируются очаги белесоватого налета (кандидозный эзофагит? эозинофильные микроабсцессы?), в дистальном отделе рельеф пищевода с наличием вертикальных борозд. Проведена биопсия из проксимального и дистального отделов пищевода.
При морфологическом исследовании гистологического материала: интраэпителиальная эозинофильная инфильтрация слизистой оболочки проксимального отдела пищевода (от 15 до 75 в поле зрения при увеличении ×400) с формированием эозинофильных микроабсцессов, с дегрануляцией эозинофильных лейкоцитов, сопровождающаяся отеком слизистой оболочки; пролиферация базального слоя эпителия и дискератоз. Признаков грибкового поражения не обнаружено (рис. 14).
Рис. 14. Гистологическое исследование биоптата из пищевода больного В.: значительное количество эозинофильных лейкоцитов в толще многослойного плоского эпителия (более 60 в поле зрения), скопления эозинофилов в поверхностных слоях эпителия с формированием эозинофильных микроабсцессов. Окраска гематоксилином и эозином. a — ×100; б — ×200. Staining with hematoxylin and eosin. a — ×100, b — ×200.
На основании жалоб, анамнеза, данных инструментального обследования пациенту был установлен клинический диагноз «эозинофильный эзофагит». Согласно современным принципам терапии ЭоЭ, больному было назначено лечение: элиминационная диета с исключением 6 продуктов, декслансопразол 60 мг/сут. Для оценки эффективности терапии рекомендовано проведение повторного эндоскопического обследования с биопсией через 8 нед.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы:
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.














.jpg)





.png)


.jpg)
















Комментарии