- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Гетеротопия слизистой оболочки желудка в проксимальном отделе пищевода: исторический ракурс и современный взгляд
| Авторы: | Долгушина А.И. , Хихлова А.О., Олевская Е.Р. 1 Хихлова А.О., Олевская Е.Р., Науменко О.В. 2 2021г. |
| Об авторах: |
1. ФГБОУ ВО ЮУГМУ Минздрава России, Челябинск 2. ГБУЗ «ЧОКБ», Челябинск |
Аннотация:
Гетеротопия слизистой оболочки желудка (СОЖ) в проксимальном отделе пищевода, представляющая собой участки эктопической слизистой, характерной для желудка, по данным аутопсии диагностируется значительно чаще, чем визуализируется эндоскопически, и нередко сопровождается клинической симптоматикой. Обзор посвящен вопросам этиологии и патогенеза гетеротопии СОЖ в проксимальном отделе пищевода, анализу распространенности патологии и клинических проявлений. Представлена современная клинико-патологическая классификация, включающая пять отдельных групп на основе клинических, эндоскопических и гистологических характеристик гетеротопии СОЖ в пищеводе. Рассмотрены данные литературы о связи гетеротопии СОЖ в верхнем отделе пищевода с функциональными расстройствами желудочно-кишечного тракта, пищеводом Барретта, а также о ее неопластическом потенциале. Особое внимание уделено вопросам диагностики гетеротопии СОЖ в пищеводе, основанной на прицельном осмотре шейного отдела пищевода с использованием современных возможностей эндоскопической аппаратуры. В статье представлены принципы медикаментозной терапии и эндоскопического лечения симптомных пациентов с гетеротопией СОЖ в проксимальном отделе пищевода. Обзор демонстрирует важность осведомленности клиницистов о данной патологии и мультидисциплинарного подхода к ведению данных пациентов.
Ключевые слова: гетеротопия, слизистая оболочка желудка, верхняя треть пищевода, inlet patch, эзофагогастродуоденоскопия, радиочастотная абляция.
Введение:
Гетеротопия, т. е. атипичная локализация, слизистой оболочки желудка (СОЖ) может встречаться в любом отделе желудочно-кишечного тракта (ЖКТ), включая прямую кишку и желчный пузырь. Гетеротопия СОЖ в верхние отделы пищевода, которая в англоязычной литературе известна под термином «inlet patch», представляет собой островок эктопической слизистой, характерной для желудка, в проксимальном отделе пищевода на уровне верхнего пищеводного сфинктера или дистальнее на несколько сантиметров (рис. 1, 2) [1]. В редких случаях локусы гетеротопии встречаются во всех отделах пищевода [2, 3].


Впервые случай обнаружения в верхнем отделе пищевода желез, содержащих париетальные клетки, описан в 1805 г. патологом Schmidt [1]. Благодаря развитию эндоскопических технологий представление о данной проблеме в настоящее время значительно расширено, однако многие вопросы до сих пор остаются малоизученными. В частности, исследователи значительно расходятся во мнениях о частоте «inlet patch». Так, по данным аутопсий гетеротопия СОЖ в проксимальном отделе пищевода встречается в 0,7–70% случаев [1], по данным эндоскопического исследования частота также колеблется в широких пределах и составляет от 0,1% до 14,5% [4–6].
Сведения об особенностях развития эзофагеальной гетеротопии СОЖ в зависимости от возраста и пола неоднозначны. H. Takeji et al. [1] считают, что с возрастом поражение может регрессировать, и отмечают его большую частоту у лиц мужского пола. Работы других исследователей не демонстрируют существенных возрастно-гендерных различий [7].

Полный текст статьи:
Патогенез и патоморфология
Патогенез гетеротопии СОЖ в верхнюю треть пищевода неизвестен. Предложено три гипотезы развития данной патологии. Большинство авторов придерживаются мнения о врожденном происхождении «inlet patch» [8, 9]. На 11-й неделе эмбриогенеза цилиндрический эпителий замещается многослойным плоским, распространяясь в дистальном и проксимальном направлениях со средней части пищевода, при этом проксимальный участок пищевода подвергается трансформации последним [8]. Данную теорию подтверждают следующие факты: во‑первых, при иммуногистохимическом анализе показано, что в локусах гетеротопии имеются клетки, характерные для СОЖ эмбриона [8, 10]; во‑вторых, распространенность гетеротопии СОЖ в верхнюю треть пищевода не увеличивается с возрастом, а, по некоторым данным, чаще встречается у детей [8].
Другая теория предполагает приобретенный характер метапластической трансформации плоскоклеточного эпителия вследствие хронического кислотного воздействия при гастроэзофагеальном рефлюксе, аналогично развитию пищевода Барретта [11].
В качестве еще одного варианта происхождения гетеротопии СОЖ рассматривается разрыв ретенционных кист желез эпителия проксимального отдела пищевода (рис. 3, 4) [12].
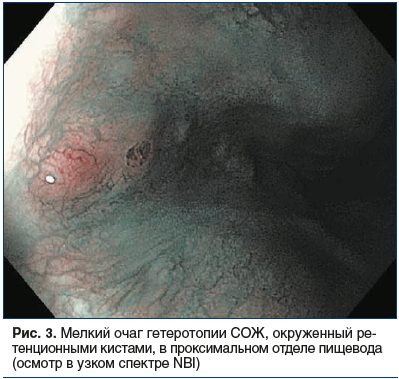
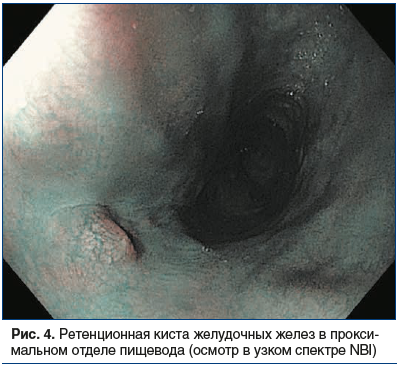
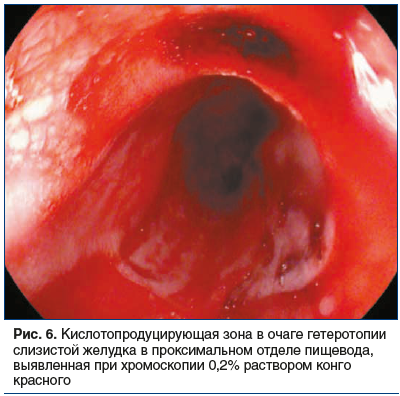
Чаще всего эпителий в эктопированном локусе соответствует фундальному и кардиальному гистологическому типам, реже — антральному (рис. 5). В исследовании U. Peitz et al. [6] было отмечено, что кардиальный тип эпителия характерен для небольших гетеротопий, в то время как фундальный тип чаще встречается в гетеротопиях крупного размера. Существенным является то, что «inlet patch» при наличии париетальных клеток может продуцировать некоторое количество кислоты (рис. 6) [13]. Следует отметить, что анатомическая близость к слизистой оболочке гортани и ее высокая чувствительность к кислотному повреждению, даже при слабокислой секреции, могут приводить к появлению симптомов. Кроме того, как было показано, продукция слизи даже в отсутствие кислоты индуцирует ларингофарингеальные симптомы [14].Гиперацидность также может индуцировать хроническое воспаление и ульцерацию слизистой пищевода, расположенной вокруг участка эктопированной СОЖ, и являться редкой причиной развития стриктур.Морфологически «inlet patch» часто ассоциирован с воспалительной инфильтрацией гранулоцитами и плазматическими клетками. Другие гистологические изменения включают атрофию, метаплазию, дисплазию и аденокарциному [8]. В 2004 г. B.H. von Rahden была предложена классификация, позволившая структурировать морфологические и клинические проявления гетеротопии СОЖ (табл. 1) [2].

![Таблица 1. Клинико-патологическая классификация гетеротопии СОЖ в пищевод [2] Таблица 1. Клинико-патологическая классификация гетеротопии СОЖ в пищевод [2]](https://www.rmj.ru/upload/medialibrary/89d/87-5.png)
Участки гетеротопии могут быть колонизированы Helicobacter pylori (Нр) [4]. Распространенность хеликобактериоза в очагах эктопированной в пищевод СОЖ достигает 82% [11]. Показатели инфицированности, вероятно, коррелируют с распространенностью инфекции Нр в общей популяции. Хотя роль Нр в данной ситуации остается неясной, можно предположить, что он может вызывать изменения, подобные тем, которые наблюдаются в желудке: атрофию, метаплазию, дисплазию и карциному [8].
Диагностика
Основным методом диагностики гетеротопии СОЖ в верхнюю треть пищевода является эзофагогастродуоденоскопия (ЭГДС) с биопсией. К сожалению, очаги гетеротопии часто пропускаются во время эндоскопии, поскольку проксимальный отдел пищевода или игнорируется, или осматривается бегло [15]. Вероятно, этот факт и объясняет значительное различие данных о распространенности, полученных на основании аутопсии и эндоскопических исследований. При ЭГДС участки СОЖ в проксимальном отделе пищевода визуализируются как округлые или овальные пятна лососевого цвета, бархатистого вида, чаще одиночные, реже встречаются парные и множественные. Поверхность может быть гладкой или зернистой, плоской или слегка приподнятой. Нечасто эктопированная СОЖ представляет собой участок депрессии слизистой оболочки. Большинство «inlet patch» расположены на боковых стенках, как правило, на несколько сантиметров дистальнее верхнего пищеводного сфинктера (на уровне 16–21 см от резцов). Размеры могут варьировать от микроскопических до 3–5 см (см. рис. 1, 2).
Ряд исследований показывает, что эндоскопия с узкоспектральной визуализацией (NBI) увеличивает частоту обнаружения гетеротопии примерно в 3 раза по сравнению со стандартной эндоскопией белого света (рис. 7) [11, 16]. В исследовании C.L. Cheng et al. [17], включавшем 99 пациентов с гетеротопией СОЖ в верхней трети пищевода, мелкие очаги гетеротопии у 54% обследуемых при использовании узкого спектра выявлены против 17%, обнаруженных в белом свете. Эти результаты позволяют уверенно рекомендовать использование виртуальной хромоэндоскопии для диагностики «inlet patch» [16].
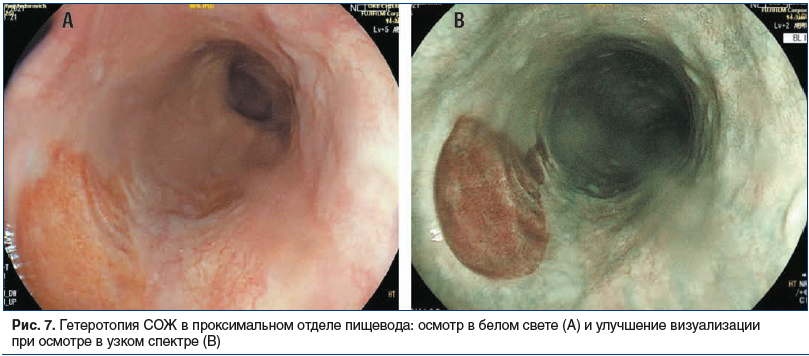
С. Blanco et al. [15] предложили использовать частоту выявления участков гетеротопии в проксимальной части пищевода как критерий качества выполнения эндоскопии верхних отделов ЖКТ по аналогии с критерием adenoma detection rate (ADR) при колоноскопии.
Клинические проявления
Клинические проявления у пациентов с эзофагеальной гетеротопией СОЖ в большинстве случаев отсутствуют. Появление симптомов обусловлено ларингофарингеальным рефлюксом (ЛФР) или осложнениями, связанными с «inlet patch» (перфорации, стриктуры, свищи, а также нео-пластическая трансформация).
Наибольшую сложность для диагностики вызывают пациенты с симптомами, обусловленными ЛФР: дисфагия, одинофагия, регургитация, охриплость голоса, дискомфорт в горле, першение, жжение, хронический кашель, ощущение «кома» в горле [18]. По данным V. Chong et al. [8], клинические проявления присутствуют у 73,1% пациентов с «inlet patch», доминируют жалобы на боль в горле, охриплость и изжогу. В работах J.S. Baudet et al. [19] и O.K. Poyrazoglu et al. [20] при наличии гетеротопии СОЖ у пациентов чаще встречается дисфагия, по данным U. Weickert et al. [21] — рецидивирующая охриплость, дисфагия и изжога. В большом исследовании W.L. Neumann et al. [22], включавшем ретроспективный анализ 487 229 пациентов, подвергшихся эндоскопии, показано, что дисфагия, одинофагия, респираторные симптомы и ощущение «кома» являются наиболее частыми симптомами [22]. В литературе отмечена ассоциация гетеротопии СОЖ в верхние отделы пищевода с хроническими отитами и синуситами, бронхиальной астмой [8]. T. Talih et al. [23] предположили, что гетеротопия СОЖ в верхней трети пищевода могла явиться причиной загрудинных болей у пациента, имитирующих приступ нестабильной стенокардии, нуждающейся в проведении коронарной ангиографии. Большинство исследователей указывают на необходимость дальнейших исследований для изучения потенциальной связи клинических симптомов как с локализацией и/или размерами «inlet patch», так и с морфологическими особенностями гетеротопированной слизистой оболочки [8, 10, 24].
Гетеротопия СОЖ и функциональные расстройства ЖКТ
В настоящее время нет четкой позиции, касающейся характера связи пищеводной гетеротопии СОЖ и функциональных расстройств ЖКТ, прежде всего, функциональной диспепсии и неэрозивной гастроэзофагеальной рефлюксной болезни (ГЭРБ). Требует уточнения, насколько наблюдаемые симптомы могут быть обусловлены наличием «inlet patch» или отнесены к проявлениям функциональных расстройств. Тем не менее у определенных категорий пациентов информирование о присутствии гетеротопии СОЖ может помочь успокоить их и уменьшить тяжесть симптомов.
В качестве одного из возможных патогенетических механизмов появления симптомов рассматривается альтерация гетеротопической СОЖ колонизировавшим ее Hр [10]. Кроме того, имеются данные о нарушении моторики пищевода у пациентов с «inlet patch» [13].
Один из наиболее интересных симптомов — ощущение «кома» в горле (globus sensation), которое встречается у пациентов с «inlet patch» с частотой 1,6–23,1% и более распространено у женщин [10]. Такие больные могут длительно лечиться у психиатров, так как широко известно, что globus sensation считается психогенной проблемой [25]. Ощущение «кома» в горле может возникать из-за повышения давления в верхнем пищеводном сфинктере (ВПС) за счет раздражающего действия «inlet patch» или вследствие рефлекторного сокращения ВПС благодаря дыхательному защитному механизму, вероятно, связанному с рефлюксом. При этом причиной симптомов может быть не только выработка кислоты клетками «inlet patch», но и секреция муцина [14]. Данный факт подтверждается наличием симптомов у пациентов с кардиальным типом гетеротопированной СОЖ и отсутствием эффекта от ингибиторов протонной помпы (ИПП) у некоторых больных. Значимость симптомов ЛФР признана клиницистами и привела к изменению Римских критериев IV функциональных гастроинтестинальных расстройств. В дифференциально-диагностический перечень состояний, сопровождающихся ощущением «кома» в горле, внесен «inlet patch» [26].
Гетеротопия СОЖ и пищевод Барретта
Одной из тем для дискуссий является ассоциация эзофагеальной гетеротопии СОЖ с пищеводом Барретта. Ряд исследований демонстрирует отсутствие связи, другие авторы констатируют ее наличие [6, 22]. B. Avidan et al. [1] в исследовании «случай — контроль» (53 пациента с «inlet patch» и 4882 — с отсутствием гетеротопии) показали, что пищевод Барретта в 4 раза чаще встречался у пациентов с гетеротопией СОЖ (34% против 9%).
Гетеротопия СОЖ и аденокарцинома пищевода
Наиболее серьезным вопросом является изучение связи гетеротопии СОЖ с аденокарциномой пищевода. В систематическом обзоре литературы, выполненном в 2017 г. M. Orosey et al. [27], описано всего 43 случая аденокарциномы в проксимальном отделе пищевода, возникшей в локусе желудочной гетеротопии, подавляющее большинство пациентов были мужского пола. Средний возраст пациентов составил 63,6±11,3 года. Другие авторы также демонстрируют низкую частоту неоплазий в «inlet patch» — 0–1,56% [28]. На основании этих данных в 2017 г. Британское общество гастроэнтерологов и Ассоциация верхней гастроинтестинальной хирургии Великобритании и Ирландии заключили, что «inlet patch» не требует динамического наблюдения и рутинной биопсии [29]. Большинство исследований показывает, что риск злокачественной трансформации гетеротопированной СОЖ в пищевод не зависит от возраста, расы, массы тела и употребления алкоголя, существенное значение имеет курение (23,7 пачка/лет против 16,3 пачка/лет, p=0,006) [30]. В 2019 г. французские исследователи [31] сообщили, что среди пациентов с выявленной мутацией гена CDH1, ассоциированного с высоким риском развития наследственного рака желудка диффузного типа, «inlet patch» обнаружен и морфологически верифицирован у 50%. Однако в этой группе пациентов не зафиксировано ни одного случая рака пищевода на фоне «inlet patch» [31]. Вслед за этой публикацией P. Leclercq et al. [24] предположили, что островок цилиндроклеточного эпителия в верхней трети пищевода представляет собой потенциальную опасность в отношении развития аденокарциномы у пациентов — носителей мутации гена CDH1, в том числе подвергшихся профилактической гастрэктомии, что обусловливает необходимость прицельного эндоскопического осмотра с забором гистологического материала эктопированной СОЖ в проксимальном отделе пищевода [24].
Лечение
Единого подхода к терапии пациентов с пищеводной гетеротопией СОЖ не разработано. Практически все авторы склоняются к мнению, что бессимптомная желудочная гетеротопия пищевода не требует лечения [1]. При наличии жалоб показана кислотосупрессивная терапия ИПП для купирования симптомов, обусловленных секрецией кислоты. Длительность назначения ИПП четко не определена, но считается оправданной тактика, применяемая при лечении ГЭРБ: терапия «step-down» или «step-up» в течение 4–8 нед., с последующим назначением ИПП по требованию. Если, несмотря на высокую дозу ИПП, есть рецидивы, добавление антагонистов Н2-рецепторов вечером может предотвратить ночной кислотный прорыв. Интересно, что одно исследование показало уменьшение размеров локуса гетеротопии после курса ИПП [11].
Неэффективность консервативных мер является показанием к полному эндоскопическому либо хирургическому удалению очагов гетеротопии, причем эндоскопические абляционные методы являются предпочтительными.
В последние годы появилось несколько публикаций об использовании радиочастотной абляции (РЧА) для лечения гетеротопии СОЖ в проксимальном отделе пищевода [32].В 2015 г. R.H. Cartabuke сообщил об успешном выполнении эндоскопической мукозальной резекции участка высокой дисплазии в «inlet patch» в сочетании с РЧА всей области гетеротопии, локализованной на расстоянии от 19 до 22 см от резцов и охватывающей 75% окружности пищевода. Последующее обследование через 6 мес. показало полную эрадикацию участка гетеротопии [18].
A. Meining et al. [33] изучили влияние аргоно-плазменной коагуляции (АПК) (мощность коагуляции составила 60 Вт, скорость потока аргона — 2 л/мин) на купирование симптомов у 10 пациентов с наличием гетеротопированной СОЖ и жалобами на чувство «кома» в горле и/или боль в горле. Авторы отметили существенное улучшение самочувствия больных, практически полное исчезновение указанных симптомов через 8 нед. после проведенной терапии [33]. В проспективном рандомизированном исследовании пациентов с аналогичными жалобами M. Bajbouj et al. [14] продемонстрировали, что у 82% пациентов, которым выполнили АПК, значительно уменьшился дискомфорт в горле, а у 90% эндоскопически зафиксировано полное исчезновение участков гетеротопии по сравнению с отсутствием таковых у пациентов группы контроля [14]. На следующем этапе исследования по истечении 27 мес. наблюдения АПК оценена как успешная у 74% пациентов[34]. В метаанализе 6 исследований по применению АПК у симптомных пациентов с гетеротопией СОЖ в верхнюю треть пищевода ответ на терапию был зафиксирован более чем у 80% пациентов. Медиана времени наблюдения в этих исследованиях составляла от 1 мес. до 36 мес. [14].
При наличии осложнений, таких как стриктуры и фиброз, показана биопсия для исключения малигнизации и проведение дилатации. Y. Shimamura et al. [35] продемонстрировали случай успешной баллонной дилатации стриктуры проксимального отдела пищевода, обусловленной наличием циркулярного «inlet patch» протяженностью 3 см у пациента 67 лет с дисфагией.
Наличие дисплазии и рака в локусе гетеротопии требует выполнения алгоритмов, принятых в онкологии, предусматривающих сочетание хирургического вмешательства с химиолучевой терапией.
Эндоскопическая резекция слизистой оболочки была описана в 1 случае дисплазии высокой степени [18] и у 6 пациентов с ранней формой аденокарциномы пищевода [36]. У двух из этих пациентов не было никаких признаков заболевания в течение 12 мес. и 31 мес. наблюдения соответственно.
Заключение
Клиническое значение гетеротопии СОЖ в верхние отделы пищевода является недостаточно изученным. Совершенствование эндоскопического исследования, прицельный осмотр проксимальной части пищевода позволят уточнить частоту эзофагеального «inlet patch». Имеющиеся данные указывают на связь пищеводной гетеротопии СОЖ с симптомами ЛФР, данные о связи «inlet patch» с функциональными расстройствами ЖКТ и пищеводом Барретта противоречивы. В настоящее время развиваются подходы к терапии пациентов с пищеводной гетеротопией СОЖ, включая широкий спектр современных эндоскопических методик. Привлечение внимания клиницистов к этой проблеме и проведение дальнейших исследований могут послужить основой для совершенствования лечебно-диагностических подходов к гетеротопии СОЖ в верхние отделы пищевода.
Список литературы:
2. Lupu V.V., Ignat A., Paduraru G. et al. Heterotopic Gastric Mucosa in the Distal Part of Esophagus in a Teenager: Case Report. Medicine (Baltimore). 2015;94(42): e1722. DOI: 10.1097/MD.0000000000001722.
3. Макушина А.А., Трухманов А.С., Сторонова О.А. и др. Клиническое наблюдение пациентки с множественными эрозиями пищевода и очагами кислотопродуцирующей желудочной гетеротопии в верхне-, средне- и нижнегрудном отделах пищевода, обсемененными H. pylori, в сочетании с H. pylori-ассоциированным гастритом. Вопросы детской диетологии. 2020;18(1):64–69. [Makushina A.A., Trukhmanov A.S., Storonova O.A. et al. A case report of a patient with multiple erosions of the esophagus and multiple acid-producing gastric heterotopia in the upper, middle and lower esophagus, contaminated by H. pylori in combination with chronic H. pylori-associated gastritis. Pediatric Nutrition. 2020;18(1):64–69 (in Russ.)]. DOI: 10.20953/ 1727-5784-2020-1-64-69.
4. Alagozlu H., Simsek Z., Unal S. et al. Is there an association between Helicobacter pylori in the inlet patch and globus sensation? World J Gastroenterol 2010;16:42–47. DOI: 10.3748/wjg.v16.i1.42.
5. López-Colombo A., Jiménez-Toxqui M., Gogeascoechea-Guillén P.D. et al. Prevalence of esophageal inlet patch and clinical characteristics of the patients. Rev Gastroenterol Mex. 2019;84(4):442–448. DOI: 10.1016/j.rgmx.2018.07.003.
6. Peitz U., Vieth M., Evert M. et al. The prevalence of gastric heterotopia of the proximal esophagus is underestimated, but preneoplasia is rare — correlation with Barrett’s esophagus. BMC Gastroenterol. 2017;17:87. DOI: 10.1186/s12876-017-0644-3.
7. Fang Y., Chen L., Chen D.F. et al. Prevalence, histologic and clinical characteristics of heterotopic gastric mucosa in Chinese patients. World J Gastroenterol. 2014;20(46):17588–17594. DOI: 10.3748/wjg.v20.i46.17588.
8. Chong V.H. Heterotopic gastric mucosal patch of the proximal esophagus. In: Gastrointestinal Endoscopy. Croatia: InTech Publishing. 2011:125–148.
9. Behrens C., Yen P.P. Esophageal inlet patch. Radiol Res Pract. 2011;2011:460890. DOI: 10.1155/2011/460890.
10. Ciocalteu A., Popa P., Ionescu M., Gheonea D.I. Issues and controversies in esophageal inlet patch. World J Gastroenterol. 2019;25(30):4061–4073. DOI: 10.3748/wjg.v25.i30.4061.
11. Chong V.H. Clinical significance of heterotopic gastric mucosal patch of the proximal esophagus. World J Gastroenterol. 2013;19(3):331–338. DOI: 10.3748/wjg.v19.i3.331.
12. Meining A., Bajbouj M. Erupted cysts in the cervical esophagus result in gastric inlet patches. Gastrointest Endosc. 2010;72(3):603–605. DOI: 10.1016/j.gie.2010.05.008.
13. Korkut E., Bektaş M., Alkan M. et al. Esophageal motility and 24-h pH profiles of patients with heterotopic gastric mucosa in the cervical esophagus. Eur J Intern Med. 2010;21(1):21–24. DOI: 10.1016/j.ejim.2009.10.009.
14. Bajbouj M., Becker V., Eckel F. et al. Argon plasma coagulation of cervical heterotopic gastric mucosa as an alternative treatment for globus sensations. Gastroenterology. 2009;137(2):440–444. DOI: 10.1053/j.gastro.2009.04.053.
15. Blanco C., Teusabá E., Russi K. A case report of circumferential presentation with stricture of heterotopic gastric mucosa in the cervical esophagus. Revista Colombiana de Gastroenterologia. 2015;30(2):225–231.
16. Al-Mammari S., Selvarajah U., East J.E. et al. Narrow band imaging facilitates detection of inlet patches in the cervical oesophagus. Dig Liver Dis. 2014;46(8):716–719. DOI: 10.1016/j.dld.2014.05.001.
17. Cheng C.L., Lin C.H., Liu N.J. et al. Endoscopic diagnosis of cervical esophageal heterotopic gastric mucosa with conventional and narrow-band images. World J Gastroenterol. 2014;20(1):242–249. DOI: 10.3748/wjg.v20.i1.242.
18. Cartabuke R.H., Thota P.N. High-grade dysplasia in thoracic inlet patch treated by focal endoscopic mucosal resection and radiofrequency ablation. Gastrointest Endosc. 2015;81(5):1297–1298. DOI: 10.1016/j.gie.2014.12.004.
19. Baudet J.S., Alarcón-Fernández O., Sánchez Del Río A., Aguirre-Jaime A., León-Gómez N. Heterotopic gastric mucosa: a significant clinical entity. Scand J Gastroenterol. 2006;41(12):1398–1404. DOI: 10.1080/00365520600763094.
20. Poyrazoglu O.K., Bahcecioglu I.H., Dagli A.F. et al. Heterotopic gastric mucosa (inlet patch): endoscopic prevalence, histopathological, demographical and clinical characteristics. Int J Clin Pract. 2009;63(2):287–291. DOI: 10.1111/j.1742-1241.2006.01215.x.
21. Weickert U., Wolf A., Schröder C. et al. Frequency, histopathological findings, and clinical significance of cervical heterotopic gastric mucosa (gastric inlet patch): a prospective study in 300 patients. Dis Esophagus. 2011;24(2):63–68. DOI: 10.1111/j.1442-2050.2010.01091.x.
22. Neumann W.L., Luján G.M., Genta R.M. Gastric heterotopia in the proximal oesophagus («inlet patch»): Association with adenocarcinomas arising in Barrett mucosa. Dig Liver Dis. 2012;44(4):292–296. DOI: 10.1016/j.dld.2011.11.008.
23. Talih T., Arslan E., Talih G., Sipahi M. Inlet patch mimicking unstable angina pectoris. Turk J Surg. 2020;36(2):229–232. DOI: 10.5578/turkjsurg.4165.
24. Leclercq P., Jadot V., Bours V. et al. Inherited CDH1 pathogenic variant: is there a place for surveillance of esophageal gastric inlet patch? Therap Adv Gastroenterol. 2020;13:1756284820916399. DOI: 10.1177/1756284820916399.
25. Harvey P.R., Theron B.T., Trudgill N.J. Managing a patient with globus pharyngeus. Frontline Gastroenterol. 2018;9(3):208–212. DOI: 10.1136/flgastro-2017-100844.
26. Drossman D.A. Functional gastrointestinal disorders: history, pathophysiology, clinical features and Rome IV. Gastroenterology. 2016: S0016–5085 (16) 00223–7. DOI: 10.1053/j.gastro.2016.02.032.
27. Orosey M., Amin M., Cappell M.S. A 14-Year Study of 398 Esophageal Adenocarcinomas Diagnosed Among 156,256 EGDs Performed at Two Large Hospitals: An Inlet Patch Is Proposed as a Significant Risk Factor for Proximal Esophageal Adenocarcinoma. Dig Dis Sci. 2018;63(2):452–465. DOI: 10.1007/s10620-017-4878-2.
28. Sahin G., Adas G., Koc B. et al. Is cervical inlet patch important clinical problem? Int J Biomed Sci. 2014;10(2):129–135.
29. Rodríguez-de-Santiago E., Frazzoni L., Fuccio L. et al. Digestive findings that do not require endoscopic surveillance — Reducing the burden of care: European Society of Gastrointestinal Endoscopy (ESGE) Position Statement. Endoscopy. 2020;52(6):491–497. DOI: 10.1055/a-1137-4721.
30. Govani S.M., Metko V., Rubenstein J.H. Prevalence and risk factors for heterotopic gastric mucosa of the upper esophagus among men undergoing routine screening colonoscopy. Dis Esophagus. 2015;28(5):442–447. DOI: 10.1111/dote.12221.
31. Jadot V., Segers K., Bours V. et al. Cancer gastrique diffus héréditaire. Série de 8 patients appartenant à une même famille et revue de la littérature [Hereditary diffuse gastric cancer: case serie of 8 patients from a single family and literature review]. Rev Med Liege. 2019;74(3):134–138.
32. Dunn J.M., Sui G., Anggiansah A., Wong T. Radiofrequency ablation of symptomatic cervical inlet patch using a through-the-scope device: a pilot study. Gastrointest Endosc. 2016;84(6):1022–1026.e2. DOI: 10.1016/j.gie.2016.06.037.
33. Meining A., Bajbouj M., Preeg M. et al. Argon plasma ablation of gastric inlet patches in the cervical esophagus may alleviate globus sensation: a pilot trial. Endoscopy. 2006;38(6):566–570. DOI: 10.1055/s-2006-925362.
34. Klare P., Meining A., von Delius S. et al. Argon plasma coagulation of gastric inlet patches for the treatment of globus sensation: it is an effective therapy in the long term. Digestion. 2013;88(3):165–171. DOI: 10.1159/000355274.
35. Shimamura Y., Winer S., Marcon N. A Giant Circumferential Inlet Patch With Acid Secretion Causing Stricture. Clin Gastroenterol Hepatol. 2017;15(4):A22–A23. DOI: 10.1016/j.cgh.2016.10.004.
36. Kadota T., Fujii S., Oono Y. et al. Adenocarcinoma arising from heterotopic gastric mucosa in the cervical esophagus and upper thoracic esophagus: two case reports and literature review. Expert Rev Gastroenterol Hepatol. 2016;10(3):405–414. DOI: 10.1586/17474124.2016.1125780.
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.
















.jpg)




.png)

















Комментарии