- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Клиническое применение расправляющихся металлических стентов в просвете желудочно-кишечного тракта
| Авторы: | Kevin McGrath, MD 2001г. |
Введение:
Поддержание просвета желудочно-кишечного тракта (ЖКТ) в открытом состоянии является наиважнейшей задачей лечения пациентов с его обструкцией злокачественной природы. Установка эндопротезов, как паллиативное лечение устраняющее симптомы обструкции и позволяющее продолжать пероральное питание, может значительно улучшить качество жизни таких пациентов. Последние достижения в области технологических разработок вывели само-расправляющиеся металлические стенты (СМС) на первое место среди средств эндоскопического поддержания просвета ЖКТ в открытом состоянии.
Этот обзор посвящен обсуждению различных видов стентов, клиническим показаниям для установки СМС и возможным направлениям развития этой технологии в будущем. Применение металлических стентов при панкреобилиарной обструкции в этом обзоре затрагиваться не будет.



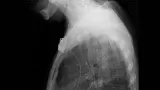

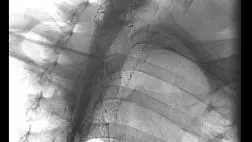
Полный текст статьи:
Современный дизайн стентов
В недавнем прошлом для паллиативного лечения дисфагии злокачественного характера использовались ригидные пластиковые эндопротезы. Эти массивные устройства требовали общей анестезии для их установки и ассоциировались с высоким уровнем осложнений [1]. В связи с уменьшением диаметра "систем доставки" СМС могут быть легко установлены в амбулаторных условиях с использованием только седации пациента. С появлением более удобных для использования стентов наблюдается повышение степени безопасности и легкости, с которыми эти устройства могут быть установлены.
Более ранние, с отсутствием покрытия (чисто металлические), виды стентов давали возможность прорастания опухоли через ячейки проволочной сетки, что приводило к прочной фиксации стента в месте установки. В отличие от них, стенты с покрытием эффективно предупреждали врастание опухоли, но имели более высокий уровень миграции. Т.к. целью применения СМС является поддержание просвета органа в открытом состоянии, должен быть достигнут оптимальный баланс между уровнем миграции и врастания опухоли. Современные виды стентов обычно включают среднюю секцию с покрытием и непокрытые более широкие края, обеспечивающие их фиксацию.
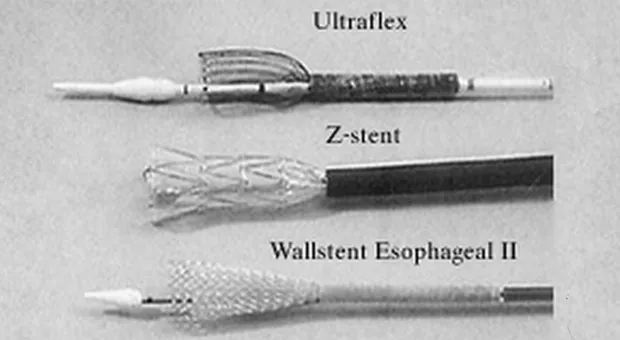
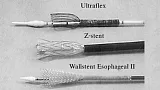
Четыре различных вида СМС в настоящее время доступно в США (рис. 1-2).
- Z-стенты (Wilson-Cook, Winston-Salem, North Carolina) состоящие из "клеток" сделанных из нержавеющей стальной проволоки и согнутых в 2 см сегменты "зигзагообразной" конфигурации. Этот стент с уритановым покрытием имеет диаметр 18 мм с 25 мм выступающими краями и перед установкой должен быть сжат в систему доставки размером 28F [2]. Z-стенты имеют хорошую расширяющую силу, а их новые виды имеют антирефлюксный клапан необходимый при установке стента в область гастроэзофагиального соединения.
- Wallstent (Boston Scientific/Microvasive, Natick, Massachusetts) представляет собой плетенный проволочный стент, который за последнее время претерпел значительные изменения. Оригинальный вариант напоминал гантели и представлял собой два коаксиальных стента с манжетообразными краями. Стент второго поколения - Wallstent Esophageal II , уменьшился в размерах по сравнению с предшественником. Он доступен в вариантах 10 см и 15 см длинной, предварительно заряженный в катетер системы доставки размером 18F. Этот стент может быть вновь возращен в систему доставки и перемещен, если из нее выведено не более 50 % его длинны [3].
- Пищеводный стент Ultraflex (Boston Scientific/Microvasive, Natick, Massachusetts) представляет собой вязанный нитиноловый протез с выступающим проксимальным краем (23 мм или 28 мм). Версия этого устройства с покрытием имеет участок непокрытого нитинола, в форме проволочных петель на каждом конце, следовательно, отсутствуют острые края. Стент хорошо гнется и заряжается в систему доставки размером 28F с удобным для пользователя механизмом освобождения. Он устанавливается путем потягивания за кольцо прикрепленное к нити держащей стент в закрытом состоянии, таким образом, она раскручивая и медленно освобождает стент. Стент Ultraflex выпускается в вариантах открытия с дистальной и проксимальной сторон. Новая его модель, обладающая большей силой расширения чем оригинальная, медленно расправляется до своего полного диаметра в течении нескольких дней [4,5].
- Esophacoil (Medtronic/Instent, Eden Prairie, Minnesota) представляет собой стент в виде пружины состоящей из одиночной плоской никель-титановой проволоки плотно скрученной в спираль и с выступающими краями. Система доставки имеет размеры 30F и дает выбор начала открытия с центра, а также с дистального или проксимального конца. Хотя этот стент обладает наибольшей силой радиального расширения, он имеет и наибольший уровень ретракции (укорочения) после установки [6].
Клиническое применение
Заболевания пищевода
Существуют два общепринятых показания для установки СМС в пищеводе: паллиативное лечение злокачественной дисфагии и закрытие пищеводно-респираторного свища злокачественной природы. Использование СМС в лечении доброкачественный стриктур пищевода дискутабельно.
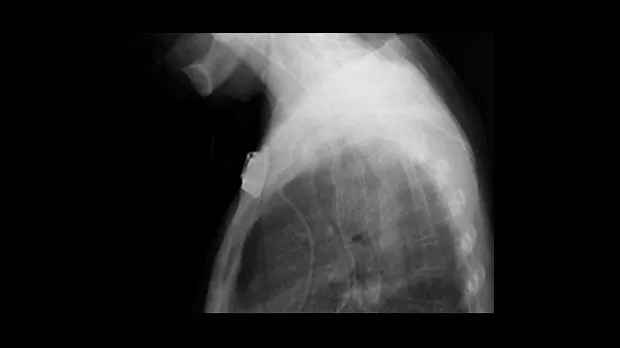
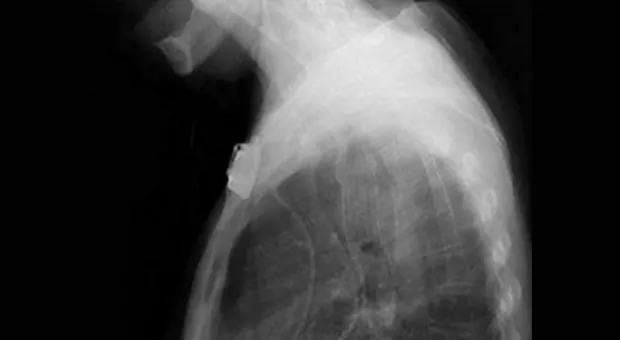
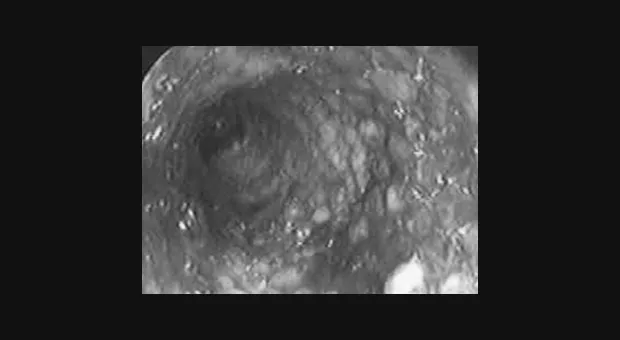
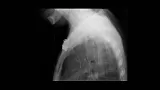
Обструкция пищевода злокачественной природы. Восстановление просвета пищевода является основой паллиативного лечения пациентов с некурабильным раком пищевода (рис. 3-4).
Возможность применения СМС для этой группы пациентов четко установлено [1,7-9]. Установка стента до противоопухолевой терапии относительно противопоказано т.к. уменьшение размеров опухоли в результате лечения может увеличить вероятность миграции стента. До установки стента необходимо выполнить полное эндоскопическое обследование для определения распространения опухолевой стриктуры в проксимальном и дистальном направлении. Дилатация, в качестве первого шага, может быть необходима для проведения полного обследования, но оптимальная степень дилатации перед установкой СМС не определена. Учитывая наличие современных систем доставки обычно рекомендуется дилатация по крайней мере до 12 см, когда это возможно. В случае опухоли полностью закрывающей просвет, когда дилатация невозможна, для создания просвета перед постановкой стента может использоваться лазерная терапия. В нашей практике мы воздействуем на полностью обтурирующие опухоли фотодинамической терапией (ФТ) для создания просвета и устанавливаем стент в плановом порядке примерно через 4 недели. Nd:YAG лазер может также использоваться для создания просвета, хотя при его применении уровень перфорации выше, чем при ФТ [10].
Большинство стентов частично сокращается и следовательно, учитывая такое их сокращения после установки, необходимо использовать стент по крайней мере на 4-6 см длиннее чем пораженный сегмент. Проксимальные и дистальные границы стриктуры могут быть отмечены путем инъекции контраста или установкой рентген контрастных маркеров. Инъекция в прилежащие к опухоли нормальные ткани пищевода (вместо опухолевых тканей) может замедлить исчезновение водо-растворимого контраста. В нашей клинике, при установке стента непосредственно рядом с верхним или нижнем пищеводным сфинктером мы также проводим дополнительную инъекцию контраста для того чтобы отметить точку где мы хотим освободить стент. Это действие наиболее полезно при использовании стента Ultraflex. После маркировки протяженности опухоли, жесткий проводник проводится через стриктуру и эндоскоп извлекается.
При стентировании проксимального отдела или средней части пищевода рациональным подходом является оставление последнего (наибольшего) дилататора для оценки ухудшения респираторной функции, в связи со смещением опухоли. Если такое ухудшение имеет место то установка эндотрахиального стента, обеспечивающего сохранения просвета дыхательных путей, должно предшествовать установки пищеводного стента.
Система доставки стента затем проводится по проводнику и при достижении необходимой позиции производится установка стента, под контролем рентгеноскопии. Извлечение системы доставки должно проводиться с осторожностью, чтобы не сместить стент. Затем положение проксимального края стента должно быть верифицировано эндоскопически, но прохождение через установленный стент эндоскопом не рекомендуется из-за возможного его смещения. В нашем эндоскопическом отделении большинство стентов устанавливаются в амбулаторных условиях. Пациент находиться под наблюдением 2 часа после процедуры и при стабильном состоянии и возможности перорально принимать жидкости выписывается с дачей ряда диетических рекомендаций.
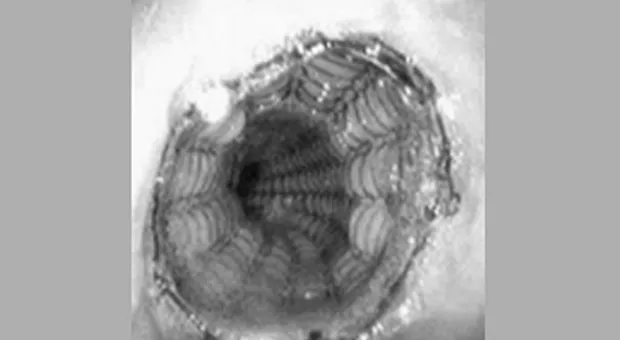
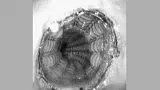
Установка СМС в области гастроэзофагиального соединения является проблематичной по двум причинам: увеличенном риске миграции (т.к. только проксимальная часть стента играет якорную функцию) и в связи с возникающем в результате установки стента гастроэзофагиальном рефлюксом. Один из вариантов Z-стента (см. рис. 5) содержит односторонний клапан для предупреждения рефлюкса (Пищеводный Z-стент с антирефлюксным клапаном, Wilson-Cook) [11]. Хотя система установки Z-стента достаточно громоздка, он может являться стентом выбора при необходимости преодоления гастроэзофагиального соединения.
Злокачественные пищеводно-респираторные свищи. Рак поражающий проксимальную и среднюю часть пищевода связан с риском эрозирования в трахею и бронхи. В дополнение к этом, первичный рак легких может также приводить к образованию свищей в пищевод. Закрытие пищеводно-респираторных свищей злокачественной природы является установленным показанием к использованию СМС [7,9,12]. Необходимо использовать только стенты с покрытием способные "запечатать" дефект. При установке стента по этому показанию, абсолютно необходимо оценить ухудшение респираторной функции во время дилатации. При развитии респираторных нарушений установка эндотрахеального стента должно быть выполнено до установки пищеводного стента. В течении 24 часов после установки пищеводного стента необходимо провести тест с пероральным приемом бария, с целью документирования факта закрытия свища.
Доброкачественные заболевания пищевода. Из-за легкости установки клиническое применение СМС расширилось до использования в паллиативном лечении доброкачественных стриктур. Имеются сообщения об использовании СМС в паллиативном лечении рефрактерных стриктур [13, 16], ахалазии [17], для закрытия пищеводно-трахеальных свищей [12, 17] и при спонтанном разрыве пищевода [18, 20]. Однако использование СМС при доброкачественных заболеваниях дискутабельно. Опыт такого использования ограничен и, следовательно, существует недостаток данных об отдаленных результатах. В связи с высоким уровнем осложнений и повторных вмешательств, рутинное использование СМС при доброкачественных стриктурах пищевода в настоящее время поддержано быть не может [13, 21]. Хотя недавние исследования и показали значительное уменьшение степени дисфагии у таких больных, у 50 % пациентов наблюдались осложнения требующие повторного вмешательства [22]. Однозначен факт, что риск и польза установки стента должны быть предельно внимательно взвешены при решении вопроса об его использовании у пациента этой группы.
Гастродуоденальная обструкция
Гастродуоденальная обструкция злокачественной природы может развиваться в результате внутрипросветного роста опухоли или сдавления извне. Это может произойти в случае первичных опухолей желудка и ДПК, прорастания опухолевых клеток из соседних органов (рак поджелудочной железы) или сдавления пораженными метастазами лимфатическими узлами [23]. Этим пациентам может быть выполнено паллиативное хирургическое вмешательство (гастроеюностомия), но многие из них находятся в ослабленном состоянии и имеют плохой краткосрочный прогноз, таким образом, риск хирургического вмешательства в этой группе достаточно высок [24].
За последние 7 лет, СМС были установлены с целью паллиативного лечения более чем 100 пациентам с гастродуоденальной или тонкокишечной обструкцией злокачественной природы. Несмотря на небольшой опыт, применение СМС при этой патологии доказало свою эффективность - примерно 90 % пациентов отмечали уменьшение тошноты, рвоты и улучшение питания [23,25-27]. Для стентирования по этим показаниям использовались пищеводные стенты, но большинство из них имеют покрытие. Системы доставки для стентов с покрытием обычно больше по размерам и более жесткие, делая установку тем более трудной, чем дистальнее она производится.
Недавно на рынок поступили эндопротезы Wallstent Enteral (Boston Scientific/Microvasive, Natick, Massachusetts), специально созданные для паллиативного лечения злокачественной обструкции ДПК и толстой кишки. Это оригинальное устройство, сходное с билиарным протезом Wallsten устанавливается через систему доставки размером 10F которая может быть проведена через эндоскоп с рабочим каналом диаметром 3,5 мм. Для сохранения гибкости и небольшого диаметра, дающих возможность эндоскопической установки, этот стент выпускается без покрытия [3]. Обычно проблемы с врастание опухоли, ведущим к повторной обструкции, не возникает, принимая во внимание низкую ожидаемую продолжительность жизни пациентов, у которых используются эти стенты [23,25]. Установка стентов с покрытием в ДПК может вести к билиарной обструкции и холангиту.
Wallstent Enteral стент имеет длину 6 см или 9 см и различный внутренний диаметр. Система доставки проводится по проводнику размером 0,035- или 0,038-inch через фиброскоп под контролем рентгеноскопии и под эндоскопическим контролем (рис. 6) [3].
Рекомендуется сначала определить проксимальную и дистальную границы стриктуры путем введения водо-растворимого контраста по билиарному катетеру. Затем границы могут быть промаркированы рентген контрастными маркерами установленными на пациента или путем инъекции контраста в слизистую. Проводник может быть проведен либо через билиарный катетер или непосредственно через эндоскоп, в зависимости от морфологии стриктуры. Обычно необходимость баллонной дилатации стриктуры отсутствует [25]. Для установки стента необходим ассистент, снимающий "ножны" стента тем временем как эндоскопист сохраняет правильную его позицию. После процедуры пациент может принимать жидкость и медленно переходить на низко-шлаковую диету, при ее переносимости.
Колоректальная обструкция
Основными показаниями к установки СМС в толстой и прямой кишке являются: (1) предоперационная декомпрессия острой злокачественной обструкции, что позволяет очистить кишку для проведения одноэтапной хирургической резекции и (2) длительная декомпрессия толстой кишки у пациента с не резецируемой опухолью с обструкцией [23].
До 30 % пациентов со злокачественными колоректальными заболеваниями испытывают симптомы обструкции [28, 29]. Экстренная хирургическая резекция по поводу острой толстокишечной обструкции злокачественной природы связанна с летальностью варьирующей от 7,2 % до 22,4 % [28, 30]. Установка толстокишечного стента дает возможность проведения подготовки, стабилизации пациента и выполнения плановой, одноэтапной хирургической операции [31].
Стент Wallstent Enteral был первым одобренным для использования при злокачественной колоректальной обструкции в 1996 году 1996 [3]. Он является наиболее широко используемым в настоящее время толстокишечным стентом. В литературе имеются свидетельства о 125 случаях его установки [31]. Хотя пищеводные стенты и используются в левой части толстой кишки и прямой кишке, при попытке установки их в петлистые дистальные отделы толстой кишки могут возникнуть проблемы с проведением [23, 31, 32]. Учитывая возможность установки через эндоскоп, стент Wallstent Enteral является единственным металлическим стентом который может быть установлен в поперечно-ободочную и правую половину толстой кишки [33]. Он устанавливается путем сходным с его установкой в дистальной части тонкой кишки. Баллонная дилатация не рекомендуется из-за увеличения риска перфорации [32]. Nd:YAG лазер может быть использован для увеличения диаметра просвет перед установкой стента, но повышение эффективности вмешательства при его использовании не доказано [34]. Ни баллонная дилатация, ни лазерная деструкция являются обычно рекомендуемыми вмешательствами проводящимися перед стентированием толстой кишки [34].
Клизма с водо-растворимым контрастом выполняется после процедуры или на следующий день для проверки проходимости просвета кишки и отсутствия затеков. Очистка кишки может быть начата после подтверждения факта проходимости.
Эффективность СМС в паллиативном лечении или в обеспечении предоперационной подготовки у пациентов со злокачественной колоректальной обструкцией достигает 90 % [23, 31, 32]. Стент может также быть установлен в условиях доброкачественной (например, дивертикулярной) обструкции для восстановления просвета органа и обеспечения очистки кишки перед оперативным вмешательством. Стентирование заведомо доброкачественной стриктуры другой этиологии противопоказано.
Потенциальные осложнения
Осложнения связанные с установкой стента включают перфорацию, боль в груди, кровотечение, миграцию стента, врастание/обрастание опухолью и формирование свища. Из-за постоянно меняющегося дизайна, сложно сравнить уровень осложнений при применении различных стентов. Хотя можно сделать несколько общих выводов.
Снижение диаметра систем доставки сделало перфорацию редкой и обычно связанной с предшествующей баллонной дилатацией. Боль в груди видимо, связанна с экспансивным давлением стента и обычно проходит через несколько дней. Большинству пациентов с болью в груди их удается эффективно снять наркотическими препаратами. Пациенты также могут испытывать чувство инородного тела при проксимальной установки стента. В результате этого установка стента в пределах 2 см от верхнего пищеводного сфинктера относительно противопоказана. Уровень миграции стентов с покрытием выше (3-31 %) [8,9,13,35] и при ней может потребоваться удаление, в том числе и хирургическое, эндопротеза. Однако некоторые стенты смещаясь в желудок не вызывают каких либо симптомов, а некоторые без осложнений выходят через прямую кишку [13]. Частота врастания опухоли очевидна выше при использовании стентов без покрытия, но обрастание стента с дистального или проксимального конца может наблюдаться и при использовании стентов с покрытием. Врастание/обрастание опухолью зависит от пролиферации опухоли, длительности наблюдения, вида стента и возможно от предшествующей терапии [5]. Это осложнение может ликвидироваться коаксиальной установкой другого стента [36, 37], лазеротерапией [38, 39], аргоновой плазменной коагуляцией [40], фотодинамической терапией [41] и дилатацией [36].
Установка толстокишечных стентов связанно с 5 % уровнем перфорации [31]. Дилатация злокачественных колоректальных стриктур не показана из-за увеличения риска перфорации. Уровень перфорации должен снизиться в течение времени из-за использования стентов Wallstent Enteral и избежания дилатации как до, так и после стентирования. Уровень миграции в толстой кишке высок (до 40 %), видимо вследствие усиления перистальтики. Стент обычно может быть легко извлечен или самостоятельно выйти через прямую кишку без последствий [23].
Направления будущего развития
Технология производства и дизайн стентов продолжают постоянно развиваться с целью улучшение параметров их безопасности. Разработка надежных, перерабатывающихся биологически стентов привело бы к прогрессу в лечении рефрактерных доброкачественных стриктур. Было разработано устройство в виде пружины изготовленное из поли-L-лактида, материала из которого изготавливаются адсорбируемые шовные материалы, но его клинические испытания закончились провалом из-за спадения и фрагментации стента [42, 43].
Легко удаляемые стенты также были бы полезны. Хотя в литературе существуют сообщения об успешном эндоскопическом извлечение стентов [17, 19, 20, 44], все выпускаемые в настоящее время стенты являются "постоянными" эндопротезами и их удаление связанно с определенным риском [45]. Стенты импрегнированные химиотерапевтическими агентами или состоящие из радиоактивной проволоки могут также иметь преимущества в лечении злокачественной обструкции.
Вывод:
Список литературы:
- Knyrim K, Wagner HJ, Bethge N, et al. A controlled study of an expansile metal stent for palliation of esophageal obstruction due to inoperable cancer. N Engl J Med. 1993;329:1302-1307.
- Rahmani EY, Rex DK, Lehman GA. Z-stent for malignant esophageal obstruction. Gastrointest Endosc Clin N Am. 1999;9:395-402.
- McIntee BE. The Wallstent endoprothesis. Gastrointest Endosc Clin N Am. 1999;9:373-381.
- Hoffman D. The Ultraflex esophageal and Diamond biliary stents. Gastrointest Endosc Clin N Am. 1999;9:383-393.
- Mokhashi MS, Hawes RH. The Ultraflex stents for malignant esophageal obstruction. Gastrointest Endosc Clin N Am. 1999;9:413-422.
- Mayoral W, Fleischer DE. The Esophacoil stent for malignant esophageal obstruction. Gastrointest Endosc Clin N Am. 1999;9:423-430.
- Nelson DB, Axelrad AM, Fleischer DE, et al. Silicone covered Wallstent prototypes for palliation of malignant esophageal obstruction and digestive-respiratory fistulas. Gastrointest Endosc. 1997;45:31-37.
- Kozarek RA, Raltz S, Marcon N, et al. Use of the 25 mm flanged esophageal Z stent for malignant dysphagia: a prospective multicenter trial. Gastrointest Endosc. 1997;46:156-160.
- Raijman I, Siddique I, Ajani J, et al. Palliation of malignant dysphagia and fistulae with coated expandable metal stents: experience with 101 patients. Gastrointest Endosc. 1998;48:172-179.
- Lightdale CJ, Heier SK, Marcon NE, et al. Photodynamic therapy with porfimer sodium versus thermal ablation with Nd:YAG laser for palliation of esophageal cancer: a multicenter randomized trial. Gastrointest Endosc. 1995;42:507-512.
- Esophageal Z-stent with Dua anti-reflux valve (package insert). Winston-Salem, NC: Wilson-Cook; 1999.
- Dumonceau JM, Cremer M, Lalmand B, Deviere J. Esophageal fistula sealing: choice of stent, practical management, and cost. Gastrointest Endosc. 1999;49:70-78.
- Sandha GS, Marcon NE. Expandable metal stents for benign esophageal obstruction. Gastrointest Endosc Clin N Am. 1999;9:437-446.
- Cwikiel W, Willen R, Stridbeck H, et al. Self-expanding stent in the treatment of benign esophageal strictures: experimental study in pigs and presentation of clinical cases. Radiology. 1993;187:667-671.
- Tan BS, Kennedy C, Morgan R, et al. Using uncovered metallic endoprostheses to treat recurrent benign esophageal strictures. Am J Roentgenol. 1997;169:1281-1284.
- Song HY, Park SI, Do YS, et al. Expandable metallic stent placement in patients with benign esophageal strictures: results of long-term follow-up. Radiology. 1997;203:131-136.
- Lee JG, Hsu R, Leung JW. Are self-expanding metal mesh stents useful in the treatment of benign esophageal stenoses and fistulas? An experience of 4 cases. Am J Gastroenterol. 2000;95:1920-1925.
- Adam A, Watkinson AF, Dussek J. Boerhaave syndrome: to treat or not to treat by means of insertion of a metallic stent. J Vasc Interv Radiol. 1995;6:741-746.
- Yuasa N, Hattori T, Kobayashi Y, et al. Treatment of spontaneous esophageal rupture with a covered self-expanding metal stent. Gastrointest Endosc. 1999;49:777-780.
- Eubanks PJ, Hu E, Nguyen D, et al. Case of Boerhaave's syndrome successfully treated with a self-expanding metallic stent. Gastrointest Endosc. 1999;49:780-783.
- McGrath KM. To stent or not to stent. Am J Gastroenterol. 2000;95:1857-1859.
- Fiorini A, Fleischer D, Valero J, et al. Self-expandable metal coil stents in the treatment of benign esophageal strictures refractory to conventional therapy: a case series. Gastrointest Endosc. 2000;52:259-262.
- Mauro MA, Koehler RE, Baron TH. Advances in gastrointestinal intervention: the treatment of gastroduodenal and colorectal obstructions with metallic stents. Radiology. 2000;215:659-669.
- Weaver D, Winczek R, Bowman D, et al. Gastrojejunostomy: is it helpful for patients with pancreatic cancer? Surgery. 1987;107:608-613.
- Soetikno RM, Carr-Locke DL. Expandable metal stents for gastric-outlet, duodenal, and small-intestinal obstruction. Gastrointest Endosc Clin N Am. 1999;9:447-458.
- Yates MR, Morgan DE, Baron TH. Palliation of malignant gastric and small intestinal strictures with self-expandable metal stents. Endoscopy. 1998;30:266-272.
- Soetikno RM, Lichtenstein DR, Vandervoort J, et al. Palliation of malignant gastric outlet obstruction using an endoscopically placed Wallstent. Gastrointest Endosc. 1998;47:267-270.
- Deans GT, Krukowski ZH, Irwin ST. Malignant obstruction of the left colon. Br J Surg. 1994;81:1270-1276.
- MacKenzie S, Thomson SR, Baker LW. Management options in malignant obstruction of the left colon. Surgery. 1992;174:337-345.
- Runkel NS, Schlag P, Schwarz V, et al. Outcome after emergency surgery for cancer of the large intestine. Br J Surg. 1991;78:183-188.
- Lo SK. Metallic stenting for colorectal obstruction. Gastrointest Endosc Clin N Am. 1999;9:459-477.
- Baron TH, Dean PA, Yates MR, et al. Expandable metal stents for the treatment of colonic obstruction: techniques and outcomes. Gastrointest Endosc. 1998;47:277-286.
- Campbell KL, Hussey JK, Eremin O. Expandable metallic stent application in obstructing carcinoma of the proximal colon. Dis Colon Rectum. 1997;40:1391-1393.
- Spinelli P, Mancini A. Use of self-expanding metal stents for palliation of rectosigmoid cancer. Gastrointest Endosc. 2001;53:203-206.
- Kozarek RA, Raltz S, Brugge WR, et al. Prospective multicenter trial of esophageal Z-stent placement for malignant dysphagia and tracheoesophageal fistula. Gastrointest Endosc. 1996;44:562-567.
- Acunas B, Rozanes I, Akpinar S, et al. Palliation of malignant esophageal strictures with self-expanding nitinol stents: drawbacks and complications. Radiology. 1996;199:648-652.
- Lagattolla NR, Rowe PH, Anderson H, et al. Restenting malignant oesophageal strictures. Br J Surg. 1998;85:261-263.
- Cwikiel W, Tranberg KG, Cwikiel M, et al. Malignant dysphagia: Palliation with esophageal stents -- long-term results in 100 patients. Radiology. 1998;207:513-518.
- Dorta G, Binek J, Blum AL, et al. Comparison between esophageal Wallstent and Ultraflex stents in the treatment of malignant stenoses of the esophagus and cardia. Endoscopy. 1997;29:149-154.
- Grund KE, Storek D, Becker HD. Highly flexible self-expanding meshed metal stents for palliation of malignant esophagogastric obstruction. Endoscopy. 1995;27:486-494.
- Scheider DM, Siemans M, Cirocco M, et al. Photodynamic therapy for the treatment of tumor ingrowth in expandable esophageal stents. Endoscopy. 1997;29:271-274.
- Goldin E, Fiorini A, Ratan Y, et al. A new biodegradable and self-expanding stent for benign esophageal strictures [abstract]. Gastrointest Endosc. 1996;43:294.
- Fry SW, Fleischer DE. Management of a refractory benign esophageal stricture with a new biodegradable stent. Gastrintest Endosc 1997;45:179-182.
- Axelrad AM, Fleischer DE, Gomes M. Nitinol coil esophageal prosthesis: advantages of removable self-expanding metallic stents. Gastrointest Endosc. 1996;43:155-160.
- Segalin A, Bonavina L, Siardi C, et al. Can the expandable esophageal metal Endocoil stent be safely removed? Endoscopy. 1997;29:337-339.
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.














.jpg)





.png)



.jpg)

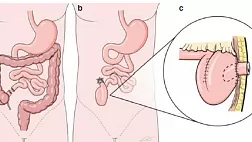













Комментарии