- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: КОМБИНИРОВАННОЕ СТЕНТИРОВАНИЕ ТРАХЕИ И ПИЩЕВОДА
| Авторы: | Дробязгин Е.А., Судовых И.Е., Чикинев Ю.В. 1 2019г. |
| Об авторах: |
1. ГБУЗ НСО «Государственная Новосибирская областная клиническая больница», Новосибирск, Россия |
Аннотация:
Цель исследования — оценка результатов комбинированного стентирования пищевода и трахеи.
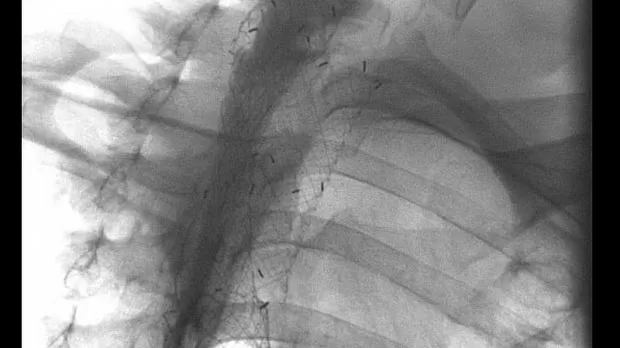
Полный текст статьи:
Комбинированное стентирование трахеи и пищевода
д.м.н., проф. Е.А. Дробязгин1,2,3, к.м.н. И.Е. Судовых2, д.м.н., проф. Ю.В. Чикинев1,2
1 ФГБОУ ВО «Новосибирский государственный медицинский университет» Минздрава России, Новосибирск, Россия
2 ГБУЗ НСО «Государственная Новосибирская областная клиническая больница», Новосибирск, Россия
3 ФГБУ «Национальный медицинский исследовательский центр им. академика Е.Н. Мешалкина» Минздрава России
Введение. Причиной дисфагии у онкологических пациентов может быть опухоль пищевода, кардиального отдела желудка, опухоль средостения или его метастатическое поражение, что может потребовать стентирования пищевода [1-3]. В случаях прорастания опухоли в трахею и бронхи, развивается дыхательная недостаточность, возникают пищеводно-респираторные соустья, которые так же может быть разрешены путем стентирования трахеи или бронхов. Возникновение дыхательной недостаточности возможно вместе с дисфагией, раньше и позже ее [4-7]. Возникновение дыхательной недостаточности возможно вместе с дисфагией, раньше и позже ее. Для подобных ситуаций в современной литературе встречается понятие двойного, комбинированного или параллельного стентирования [2-4, 7-9]. Эти вмешательства являются сложными, но достаточно эффективными, позволяя обеспечить проходимость пищевода и дыхательных путей, улучшить уровень качества жизни пациентов, обеспечивая проведения лечения [2,5,8,10].
Материалы и методы. В клинике кафедры госпитальной и детской хирургии лечебного факультета НГМУ, в отделении торакальной хирургии ГБУЗ НСО «Государственная Новосибирская областная клиническая больница» находилось на лечении 202 пациентов, которым в период с января 2004 по май 2017 года было выполнено стентирование пищевода (149 мужчин и 53 женщин) в возрасте от 36 до 92 лет.
Показаниями к имплантации стента были: рак пищевода у 101 пациента, рак кардиального отдела желудка с переходом на пищевод у 57, сдавление пищевода извне у 15 (метастазы рака молочной железы у 2, рака матки у 1, рак легкого у 10, опухоль средостения у 2), рецидивы рака в области пищеводного анастомоза у 26 (после гастрэктомии у 14, после операции Льюиса у 7, после экстирпации пищевода и пластики толстой кишкой у 1, рецидив рака после его экстирпации и пластики желудочным стеблем у 4), рак желудка у 2, рак культи желудка у 1.
В 8 случаях пациентам выполнено стентирование пищевода и трахеи. Среди пациентов 7 мужчин и 1 женщина в возрасте от 49 до 82 лет. Данные по пациентам, представлены в таблице 1.
Таблица 1. Данные по пациентам, которым проведено комбинированное стентирование
У большинства пациентов (6) был плоскоклеточный рак средней пищевода. У 1 пациента причиной дисфагии и дыхательной недостаточность было сдавление пищевода и трахеи метастатическими лимфатическими узлами после ранее выполненной операции Льюиса. В другом случае дисфагия и дыхательная недостаточность возникли на фоне центрального рака правого легкого с прорастанием в средостение, сдавлением трахеи и пищевода. У последних двух пациентов при поступлении была дыхательная недостаточность и дисфагия. Стентирование пищевода металлическим саморасправляющимся стентом ранее было выполнено 6 пациентам. Применялись саморасправляющиеся металлические стенты диаметром 22 мм (у 5 пациентов) и 18 мм (1 пациент). Длина стента была как минимум на 4 см больше протяженности опухолевого поражения (от 10 до 14 см). Второе вмешательство проведено в сроки от 2 дней до 7 месяцев после первого.
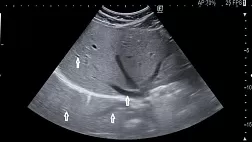
Результаты и обсуждение. Для уточнения характера изменений в трахео-бронхиальном дереве выполнялась фибротрахеобронхоскопия и томография трахеи.
Всем пациентам проведены эндоскопические интервенционные вмешательства, целью которых являлось восстановление питания и дыхания.
В двух случаях при наличии дисфагии и диспноэ первым этапом выполнена установка саморасправляющегося металлического стента в трахею под эндоскопическим контролем. Длина стента 6 см, диаметр 20 и 22 мм. Через 2 и 4 дня после этого была выполнена установка металлического саморасправляющегося стента в пищевод. Длина стентов по 12 см и диаметр 18 мм. Из-за «высокой» локализации верхнего края сужения по отношению к глоточно-пищеводному переходу применены асимметричный и шеечный стенты. Установка стентов осуществлена под рентгенологическим контролем. Осложнений в процессе выполнения вмешательств не было. Проходимость пищевода была восстановлена.
В остальных случаях (6) после ранее выполненного стентирования пищевода (от 2 до 9 месяцев после стентирования пищевода), проведено стентирование трахеи. Причиной появления дыхательной недостаточности было сдавление трахеи (у 4 пациентов) и прорастание опухоли в трахею (у 2, в том числе с возникновением трахеопищеводного свища. Все изменения подтверждены при Р-КТ органов грудной клетки и фибротрахеобронхскопии.
Длина участка сужения в 5 случаях составила 3,5 см и у одного пациента 4 см. При сдавлении трахеи (4 пациента) устанавливались саморасправляющиеся полностью покрытые металлические стенты длиной 6 см и диаметром 20 (1) и 22 мм (3 пациента). При прорастании опухоли в просвет трахеи с сужением ее просвета в одном случае выполнено стентирование металлическим саморасправляющимся стентом (длина 6 см, диаметр 20 мм), в другом после предварительного бужирования суженного участка трахеи тубусами ригидного бронхоскопа Friedel был установлен силиконовый стент 10х16 мм типа Dumon, длиной 6 см. Осложнений в процессе проведения вмешательства не было.
При проведении имплантации стента в трахею предпочтение отдавалось вмешательствам на самостоятельном дыхании под эндоскопическим контролем (7 пациентов) с применением внутривенной и местной анестезии. Такой способ установки стента сложнее технически, но проще для пациента, особенно при сдавлении трахеи извне, когда существует риск возникновения асфиксии при использовании тотальной внутривенной анестезии с введением миорелаксантов. Во всех случаях при использовании этого способа у половины пациентов была II степень сужения (от 1/2 до 2/3 от ее нормального диаметра), у второй половину сужение носило критический характер (III степень – более 2/3 от ее нормального диаметра). Несмотря на это, фибробронхоскоп с умеренным сопротивлением или свободно проводился ниже участка сужения. После этого по металлической струне-проводнику в зону сужения заводился стент в доставочном устройстве с его постепенным раскрытием. Во всех 7 наблюдениях стенты были установлены в правильную позицию. Практически сразу же после установки (через 5-10 минут) происходило уменьшение одышки и восстановление дыхания. Полное раскрытие стента происходило в течение 10-12 часов, что контролировалось томографией трахеи и фибротрахеобронхоскопией.
Дополнительное установка трахеального стента проведена через 6 месяцев после первого стентирования трахеи из-за продолжения роста опухоли, обрастании верхнего края стента и сдавлении трахеи извне. Вмешательство выполнено по типу «стент в стент» (длина 6 см, диаметр 20 мм).
Все пациенты были успешно выписаны из стационара для продолжения лечения онколога. В четырех случаях проводилась конформная лучевая терапия на проекцию опухоли. Срок жизни с момента выполнения второго вмешательства составил от 8 до 10 месяцев.
Выводы. Комбинированное стентирование позволяет эффективно восстановить проходимость трахеи и пищевода для продолжения дальнейшего лечения, но последовательность проведения вмешательств является индивидуальной и определяется выраженностью дисфагии и дыхательной недостаточности (интервал между вмешательствами зависит от их выраженности). Наблюдение в динамике является обязательным у данной категории пациентов для купирования осложнений или проведения вмешательств по типу «стент в стент». Оптимальным видом анестезии при установке трахеального стента можно считать комбинацию местной анестезии и нейролептаналгезии.
Список литературы:
- Isohata N, Naritaka Y, Asaka S, Shimakawa T, Miyaki A, Yamaguchi K, Murayama M, Katsube T, Ogawa K. Three cases of the malignant esophageal stenosis successfully treated with the Niti-S™ esophageal stent. Gan To Kagaku Ryoho. 2011;38(12):2417-2419.
- Nasir BS, Tahiri M, Kazakov J, Thiffault V, Ferraro P, Liberman M. Palliation of concomitant tracheobronchial and esophageal disease using a combined airway and esophageal approach. Ann Thorac Surg. 2016;102(2):400-406. https://doi.org/10.1093/icvts/ivt466
- Nam DH, Shin JH, Song HY, Jung GS, Han YM. Malignant esophageal-tracheobronchial strictures: parallel placement of covered retrievable expandable nitinol stents. Acta Radiol. 2006;47(1):3-9.
- Schweigert M, Posada-González M, Dubecz A, Ofner D, Muschwerk H, Stein HJ. Recurrent oesophageal cancer complicated by tracheo-oesophageal fistula: improved palliation by means of parallel tracheal and oesophageal stenting. Interact Cardiovasc Thorac Surg. 2014;18(2):190-106. https://doi.org/10.1093/icts/ivt466
- Hürtgen M, Herber SC. Treatment of malignant tracheoesophageal fistula. Thorac Surg Clin. 2014;24(1):117-127. https://doi.org/10.1016/j.thorsurg.2013.09.006
- Wang H, Li D, Zhang N, Zou H, Luo L, Ma H, Zhou Y, Li J, Liang S. Sealing of airway fistulas for metallic covered z-type stents. Zhongguo Fei Ai Za Zhi. 2011;14(8):679-684. https://doi.org/10.3779/j.issn.1009-3419.2011.08.08
- Hamai Y, Hihara J, Emi M, Okita R, Shimizu K, Okada M. Successful management of multiple esophagorespiratory fistulas using two types of stent: report of a case. Surg Today. 2011;41(4):560-562. https://doi.org/10.1007/s00595-009-4298-9
- Nomori H, Horio H, Imazu Y, Suemasu K. Double stenting for esophageal and tracheobronchial stenosis. Ann Thorac Surg. 2000;70(6):1803-1807.
- Lee P, Kupeli E, Mehta AC. Airway stents. Clin Chest Med. 2010;31(1):141-150. https://doi.org/10.1016/j.ccm.2009.08.002
- Paganin F, Schouler L, Cuissard L, Noel JB, Becquart JP, Besnard M, Verdier L, Rousseau D, Arvin-Berod C, Bourdin A. Airway and esophageal stenting in patients with advanced esophageal cancer and pulmonary involvement. PLoS One. 2008;3(8):e3101. https://doi.org/10.1371/journal.pone.0003101
Рекомендуемые статьи
Синдром Крона
неспецифические гранулёмы в пищеводе.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.
















.jpg)




.png)















Комментарии