- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: ОБЗОР СОВРЕМЕННЫХ КОНЦЕПЦИЙ КИШЕЧНОЙ МЕТАПЛАЗИИ ЖЕЛУДКА И РАКА ЖЕЛУДКА

Полный текст статьи:
Обзор современных концепций кишечной метаплазии желудка и рака желудка.
Кишечная метаплазия желудка является предраковым изменением слизистой оболочки желудка и связана с повышенным риском дисплазии и рака. В патогенезе прогрессирования от предраковых состояний к аденокарциноме желудка кишечного типа, согласно предложенного каскада Correa, считают переход от нормального эпителия желудка через воспаление, атрофию, внутрислизистую карциному, и наконец, к инвазивной карциноме. Множественные факторы риска были связаны с развитием взаимосвязи кишечной метаплазии желудка, включая инфекцию желудка H. pylori, генетических факторов, экологической среды, ревматических болезней, табакокурения, питания, желчного рефлюкса и кишечной микробиоты. Во всем мире в странах с высоким уровнем заболеваемости разработаны руководящие принципы скрининга.
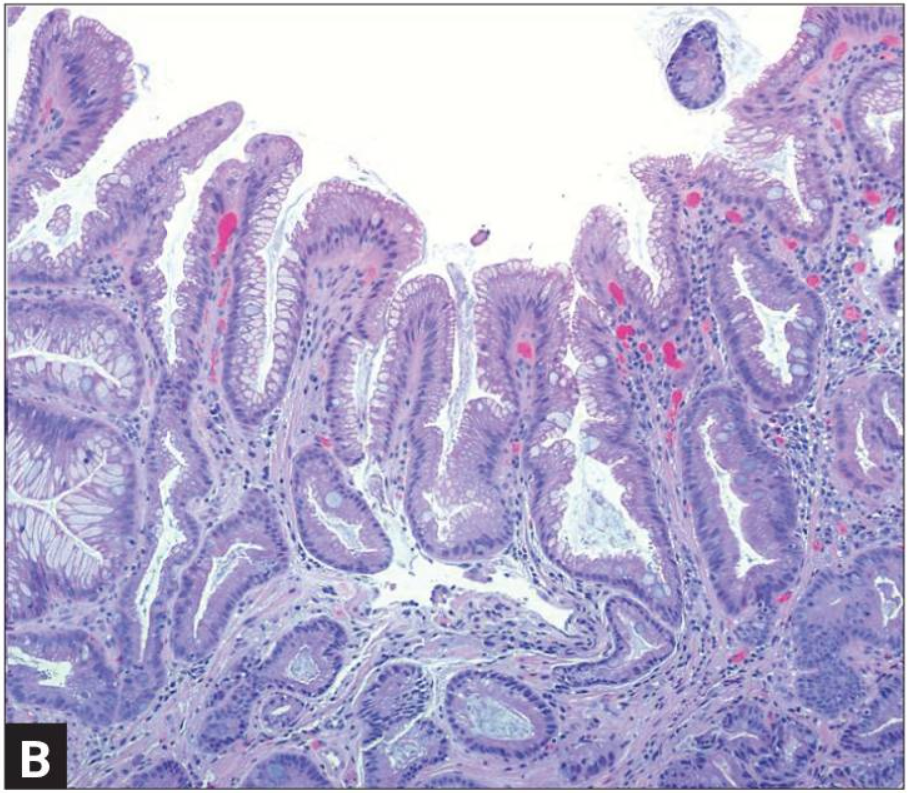
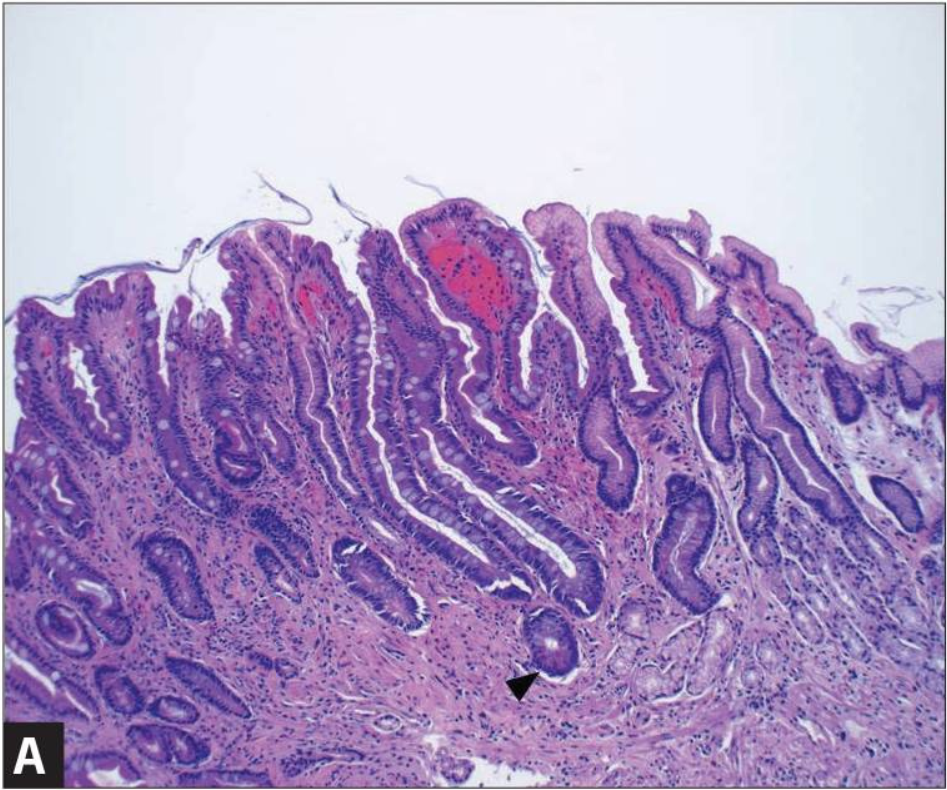
Кишечная метаплазия желудка определяется как замена поверхностного, фовеолярного, и/или железистого эпителия кислотопродуцирующей или антральной слизистой желудка кишечным эпителием. Кишечная метаплазия желудка характеризуется анатомически как ограниченный процесс, если он находится в одной области желудка или как обширный, если вовлечены две области желудка. Гистологически кишечная метаплазия желудка считается либо полной, либо неполной. Полный (I тип) кишечная метаплазия определяется слизистой оболочкой тонкой кишки со зрелыми абсорбирующими клетками, бокаловидными клетками (Гоблета) и щеточной каймой. Неполная (II тип) кишечная метаплазия секретирует сиаломуцины и сходна с толстокишечным эпителием с цилиндрическими “промежуточными” клетками на различных стадиях дифференцировки, неравномерными каплями муцина и отсутствием щеточной каймы.
Самый высокий риск развития рака желудка связан с неполным и / или обширной кишечной метаплазией желудка. Систематический обзор, который включал 10 наблюдательных исследований по всей Европе, Азии и Латинской Америке в диапазоне от 10 месяцев до 19 лет наблюдения, показал, что риск рака желудка составляет в 4-11 раз выше при наличии неполной метаплазии по сравнению с ее отсутствием.
Первым изменением в гистологическом каскаде является либо активное хроническое воспаление неатрофического хронического гастрита, характеризующегося наличием желез, либо мультифокальный атрофический гастрит. Последующие гистологические изменения прогрессируют через появление полной метаплазии, неполной метаплазии, дисплазии низкой и высокой степени с последующей карциномой. В Нидерландах было проведено общенациональное когортное исследование для оценки риска развития рака желудка, связанного с различными предраковыми поражениями желудка. Атрофический гастрит, кишечная метаплазия, умеренно выраженная дисплазия, и высокая дисплазия были связаны с ежегодной заболеваемостью рака желудка в 0,1%, 0,25%, 0,6%, и 6,0%, соответственно. Заболеваемость раком желудка, ассоциированным с кишечной метаплазией желудка, в систематических обзорах колеблется от 0% до 10%, причем переменный диапазон обусловлен различными размерами выборки и периодами наблюдения.
Эндоскопический Скрининг и Наблюдение
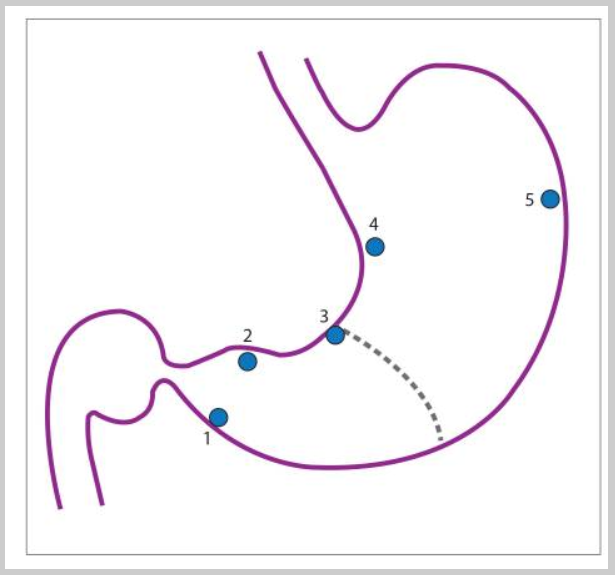
Пациентам с высоким риском рекомендовано пройти эндоскопическое обследование с картированием биопсий по модифицированной Сиднейской системе (MSS) из 5 точек - антрального отдела (большая кривизна, малая кривизна), угол желудка и тело желудка (большая кривизна, малая кривизна). Следует отметить, что биопсии тела особенно ценны после длительного лечения ингибиторами протонной помпы, так как кислотопродуцирующая слизистая оболочка может быть изолировано инфицирована H. pylori. Биопсии с угла желудка также особенно важны, так как они, скорее всего, выявят максимальную атрофию, кишечную метаплазию и предраковую дисплазию. De Vries и его коллеги провели проспективное многоцентровое исследование в 2010 году. Золотым стандартом считалось получение 12 биопсий. На основе MSS (5 биопсий) выявили 90% пациентов с кишечной метаплазией желудка и 50% пациентов с дисплазией, в отличие от 97% и 100%, соответственно, когда было получено не менее 7 биопсий. De Vries и его коллеги пришли к выводу, что по крайней мере 9 биопсий, в том числе из кардии, необходимы для адекватного наблюдения предраковых поражений в популяции с низкой частотой рака желудка, к которым относятся европеоиды и белые американцы не испанского, африканского или восточноазиатского происхождения.
В настоящее время ASGE не рекомендуют общее наблюдение за людьми с кишечной метаплазией желудка, если не присутствуют другие факторы риска рака желудка, например, семейного анамнеза рака желудка и азиатского происхождения. Однако, европейский партнер, ESGE, рекомендует лечение H. pylori, если установлено, что пациент заражен бактериями, с последующим картированием биопсий по выявлению дисплазии каждые 3 года. Если слабая дисплазии (LGD) обнаруживается у пациента с кишечной метаплазией желудка, то ЭГДС с картированием необходима в течение 1 года для оценки эндоскопически видимых поражений. Пациентам с подтвержденной дисплазией высокой степени (HGD) при отсутствии эндоскопически видимого поражения рекомендуется повторное ЭГДC через 6-12 месяцев для наблюдения видимых поражений. Эти пациенты с поражениями должны пройти надлежащее либо хирургическую, либо эндоскопическую резекцию из-за высокой вероятности сосуществования инвазивной аденокарциномы, так как 25% пациентов с дисплазией высокой степени могут спрогрессировать до аденокарциномы в течение 1 года.
David S. Jencks, Jason D. Adam, Marie L. Borum, Joyce M. Koh, Sindu Stephen, David B. Doman. Overview of Current Concepts in Gastric Intestinal Metaplasia and Gastric Cancer. Gastroenterol Hepatol (NY). 2018 Feb; 14(2): 92–101.
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.














.jpg)





.png)


.jpg)














Комментарии