- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Поражение толстой кишки, обусловленное вирусами семейства Herpesviridae.
| Авторы: | Аникина М.С. 1 2018г. |
| Об авторах: |
1. врач-эндоскопист ГБУЗ НСО «ГНОКБ» |
Полный текст статьи:
Поражение толстой кишки, обусловленное вирусами семейства Herpesviridae.
Аникина М.С. врач-эндоскопист ГБУЗ НСО «ГНОКБ»
Распространенность герпесвирусных инфекций неуклонно возрастает во всем мире. Считается, что к 18 годам 60 - 90% жителей городов инфицируются одним или несколькими типами клинически значимых герпесвирусов. Рост заболеваемости в значительной мере связан с распространением бессимптомной и недиагностированной герпетической инфекции. Это вызвано легкостью распространения инфекции (возможны контактно-бытовой, половой, воздушно-капельный, вертикальный, трансфузионный и трансплантационный механизмы передачи). Универсальный тропизм герпесвирусов обусловил значительный полиморфизм клинических проявлений, которые попадают в поле зрения врачей различных специальностей. [5]
В настоящее время известно около 200 в разной степени изученных герпесвирусов. Это крупные оболочечные ДНК-содержащие вирусы. Из них патогенными для человека являются 8 типов:
1.Вирус простого герпеса – ВПГ тип 1 (Herpes simplex virus тип 1 – HSV-1), или герпесвирус человека ГВЧ-1.
2. Вирус простого герпеса – ВПГ тип 2 (HSV-2), или ГВЧ-2.
3. Вирус ветряной оспы – опоясывающего герпеса (Varicella-zoster virus – VZV), или ГВЧ-3.
4. Вирус Эпштейна-Барр – ВЭБ (Epstein-Barr virus – EBV), или ВГЧ-4.
5. Цитомегаловирус – ЦМВ (CMV), или ГВЧ-4.
6. Герпесвирус человека тип 6 – ГВЧ-6 (Human herpesvirus – HHV6).
7. Герпесвирус человека тип 7 – ГВЧ-7 (HHV7).
8. Герпесвирус человека тип 8 – ГВЧ-8 (HHV8).
Все они относятся к семейству Herpesviridae, которое делится на три подсемейства: α-herpesviruses, β-herpesviruses и γ-herpesviruses, в зависимости от характера поражения вирусом клетки, скорости репликации, места латенции и персистенции.
Альфа-вирусы (вирус простого герпеса 1 и 2 типа, вирус варицела Зостер). Характеризуются быстрой репликацией, 4—8 часов), способностью к цитолизу и бессимптомным персистированием в нейрональных клетках.
Бета-вирусы (цитомегаловирус, герпесвирус человека тип 6, герпесвирус человека тип 7) Медленно реплицируются, вызывают цитомегалическую трансформацию клеток, а основными очагами латенции являются моноциты и их предшественники, эндотелиальные клетки сосудов микроциркуляторного русла, альвеолярные макрофаги, Т-лимфоциты и стромальные клетки костного мозга.
Гамма-вирусы (вирус Эбштейн-Барр (синоним ВГЧ4), ВГЧ-8). Трансформирующие вирусы человека, способствующие развитию злокачественного перерождения клеток. Пожизненно персистируя в В-лимфоцитах или находясь в латентном состоянии, обладают способностью делать их злокачественными.
Персистенция бета- и гамма-вирусов в иммунокомпетентентных клетках может приводить к развитию вторичной иммунной недостаточности с выраженной депрессией клеточного иммунитета.
Формы взаимодействия герпесвирусов с организмом хозяина различны. Инфекционный процесс может протекать:
1 В острой форме.
2 В хронической форме (более 6 месяцев).
3 В инаппарантной (бессимптомной) форме.
4 В форме медленной вирусной инфекции — длительный инкубационный период (месяцы и годы) с последующим медленным прогрессирующим течением, с развитием тяжелых клинических симптомов и в итоге — смертью больного.
Уникальным биологическим свойством всех ГВ человека является их способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой непрерывное и цикличное размножение (репликацию) вируса в инфицированных клетках тропных тканей, что является причиной развития инфекционного процесса. Латенция герпесвирусов клинически себя не проявляет, а диагностируется только при наличии специфических IgG против вируса (серопозитивность) в невысоких титрах, а сам вирус в этот период в периферической крови не определяется даже таким высокочувствительным методом, как ПЦР. В состоянии латенции нарушается полный цикл репродукции вируса, и он находится в клетках хозяина в виде субвирусных структур. [4; 5]
Таблица 1 Классификация клинических форм заболеваний, обусловленных герпесвирусами [4]
|
Вирус |
Первичная инфекция |
Реактивация после латенции |
|
1 |
2 |
3 |
|
Вирус простого герпеса I типа — ВПГ-1-ВГЧ-1 — HSV-1 |
Герпес кожи. Лабиальный герпес. Гингивостоматит. Офтальмогерпес. Генитальный герпес. Неонатальный герпес. Энцефалит (редко). Невропатии |
Рецидивирующий орально-лабиальный герпес. Рецидивирующий аногенитальный герпес. Энцефалит. Эзофагит, гастрит. Гепатит. Пневмониты. Невропатии |
|
Вирус простого герпеса II типа — ВПГ-2-ВГЧ-2 — HSV-2 |
Генитально-ректальный герпес. Неонатальный герпес. Менингоэнцефалит. Крестцовый радикулит |
Генитальный герпес. Менингоэнцефалит. Хроническая кожно-слизистая форма |
|
Вирус варицелла зостер-ВВЗ — вирус герпеса человека III типа — ВГЧ3-VZV |
Ветряная оспа |
Опоясывающий герпес. Постгерпетическая невралгия |
|
Вирус герпеса человека IV типа — ВГЧ-4 — Эпштейна-Барр вирус — ЭБВ-EBV |
Инфекционный мононуклеоз. Саркома мышц. Энцефалит у новорожденных. Лимфоидная интерстициальная пневмония у детей
|
Инфекционный мононуклеоз. Гепатит. Лимфома Беркитта. Назофарингиальная карцинома. Волосатая лейкоплакия языка. EBV-ассоциированный лимфопролиферативный синдром. В-клеточная лимфома. Синдром хронической усталости и иммунной депрессии. Аутоиммунная патология |
|
Вирус герпеса человека V типа — ВГЧ-5 — Цитомегаловирус — ЦМВ-СМV |
Гетерофильно-негативный мононуклеоз. Васкулит. Неоатальная CMV-инфекция. Субклиническая инфекция
|
Гетерофильно-негативный мононуклеоз. CMV-ретинит. CMV-гепатит. CMV-пневмония. CMV-энцефалит. CMV-колит/холангит. CMV-адреналовая недостаточность. Реакция отторжения трансплантата. Атеросклероз |
|
Вирус герпеса обезьян В |
Летальный энцефаломиелит при инфицировании людей |
|
|
Вирус герпеса человека VI типа — ВГЧ-6-HHV-6 |
Внезапная экзантема у детей. Гетерофильно-негативный мононуклеоз. Васкулит |
Гетерофильно-негативный мононуклео. Гепатит. Лимфопролиферативные заболевания. Интерстициальная пневмония у лиц с иммунодефицитом. Энцефалит. Злокачественные новообразования. Синдром хронической усталости и иммунной депрессии. Аутоиммунная патология. Психозы |
|
Вирус герпеса человека VII типа — ВГЧ-7-HHV-7 |
Возможна экзантема у детей |
Синдром хронической усталости и иммунной депрессии. Заболевания кожи и ЦНС аутоиммунной природы. Рак желудка |
|
Вирус герпеса человека VIII типа — ВГЧ-8-HHV-8 |
Нет информации |
Саркома Капоши. Неходжкинская В-лимфома. Лимфопролеферативное заболевание болезнь Кастлемана |
Таким образом, поражение слизистых нижних отделов желудочно-кишечного тракта может быть обусловлено вирусами простого герпеса 1 и 2 типа, цитомегаловирусом (ВГЧ 5 типа) и вирусом герпеса человека 8 типа.
Герпесвирусы 1 и 2 типов
Герпетическая инфекция, вызванная вирусом простого герпеса (ВПГ, Herpes simplex virus — HSV), — это заболевания с пожизненной персистенцией вирусов в нервных клетках (особенно в нервных ганглиях), характеризующиеся периодическими обострениями с появлением клинических признаков, локализующихся на постоянных для каждого больного «Locus minoris» — глаза, кожа, слизистые. Более чем 90 % населения планеты являются носителями ВПГ. Первичная герпетическая инфекция (ГИ) возникает при первом контакте человека с ВПГ. После короткого инкубационного периода (от 2 до 14 дней) в крови начинают определяться антитела к ВПГ, и у 80—90 % лиц первичное инфицирование протекает в латентной форме. У 10—20 % лиц имеют место клинические проявления инфекции, для которых характерен общеинфекционный синдром с лихорадкой и другими признаками интоксикации, респираторные проявления или афтозный стоматит. Возможны поражения кожи и слизистых, в том числе конъюнктивы или роговицы. Первичная ГИ, независимо от клинической формы проявления и места поражения, сопровождается проникновением ВПГ в ганглии дорсальных корешков и реже — в вегетативные ганглии и завершается их острой инфекцией с последующим установлением латентности в нейронах.
Вторичная (рецидивирующая) ГИ встречается в любом возрасте после первичного герпеса. Поскольку рецидивы возникают на фоне наличия противовирусных антител, то они протекают со слабовыраженным общеинфекционным синдромом и, как правило, на фоне болезней и/или состояний, снижающих иммунитет.
В зависимости от распространенности процесса клинически выделяются следующие формы вирусной инфекции:
1. Локализованная форма, при которой отмечается так называемый "замкнутый круг хождения вируса: входные ворота - нервный ганглий - входные ворота". Как правило, при обострении заболевания патологические изменения всегда локализуются в одном месте.
2. Распространенная форма, при которой наблюдаются отсевы вируса из очага первичной инвазии в близлежащие зоны (например, лабиальный герпес – герпетический эзофагит)
3. Генерализованные формы (висцеральная и диссеминированная), которые наиболее часто встречаются у иммунокомпрометированных пациентов.
Толстая кишка может вовлекаться в патологический процесс при распространной или генерализованных формах заболевания. Как правило, у пациента с распространенной формой имеются признаки локального вирусного поражения кожных покровов, гениталий и т.д. Но при этом отсутствие внешних герпетических высыпаний не должно уменьшать подозрение на ВПГ-колит, так как внешние проявления на момент диагностики не имеют более 30% пациентов. ВПГ является второй по распространенности причиной проктита, передающегося половым путем. В таком случае развивается локализованная форма инфекции. При этом изменения захватывают 5-15 дистальных сантиметров прямой кишки. ВПГ проктит может быть вызван ВПГ-1 или ВПГ-2, но примерно в 70% случаев вызывается ВПГ-2. Отмечено, что обострения при инфицировании ВПГ-2 встречаются в 8-10 раз чаще, чем при ВПГ-1. Клиническая картина герпетического колита характеризуется сильными абдоминальными болями, диареей и лихорадкой. К симптомам герпетического проктита относятся боли в аноректальной области, тенезмы, слизисто-гнойный экссудат и гематохезия. Кроме этого ВПГ-проктит может проявляться запорами, крестцовыми парестезиями, затруднением мочеиспускания, что возможно вызвано дисфункциями вегетативной нервной системы, связанными с нейротропным действием возбудителя[9; 15]
В течение заболевания выделяют две стадии: 1 стадия - везикулов и 2 стадия - образования дефектов слизистой оболочки.
Макроскопически при 1-й стадии обнаруживаются характерные изменения слизистой оболочки пораженного сегмента толстой кишки: множественные рассеянные или сгруппированные пузырьки диаметром 0,1-0,3 см с серозным или мутным содержимым. Пузырьки склонны к слиянию. Окружающая слизистая оболочка может быть не изменена или с явлениями очагового умеренно выраженного поверхностного воспаления.
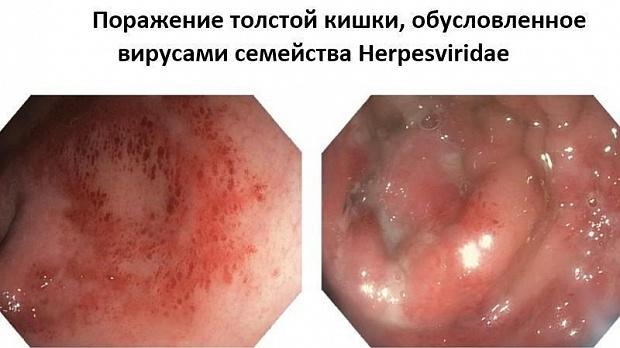
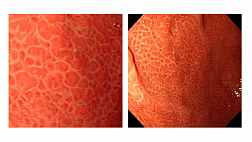
При колоноскопии во 2-й стадии заболевания имеются множественные поверхностные дефекты слизистой оболочки округлой формы, размерами до 0,5 см с четко очерченными эритематозными приподнятыми краями и некротическим налетом в дне ("вулканические" изъязвления). При тяжелых генерализованных формах инфекции дефекты слизистой оболочки сливаются с образованием обширной изъязвленной поверхности (Морозова СВ., Пархоменко Ю.Г., 2002). Контактная кровоточивость выражена умеренно, на окружающей слизистой оболочке имеются множественные субэпителиальные кровоизлияния. При морфологическом исследовании тканей, взятых из краев изъязвления, на фоне воспалительной инфильтрации слизистой оболочки выявляются типичные для этой инфекции гигантские клетки с мультинуклеацией и феноменом "глаза совы" или (в более поздние сроки) внутриядерные включения, окруженные светлой зоной (Cirillo N.W. et al., 1993). Таким образом, для герпетических колитов характерны следующие эндоскопические признаки: поражение имеет сегментарный характер, сегменты короткие, могут локализоваться в любом анатомическом отделе, но чаще обнаруживаются в прямой кишке. Макроскопические изменения в пределах пораженного сегмента однородны. (Рис.1) При хроническом прогрессирующем течении заболевания отмечаются протяженные поражения толстой кишки с элементами герпетического процесса на разных стадиях его развития. [3: 9]
Рис.1 герпетический проктит [9]
Эндоскопическая картина слизистой оболочки прямой кишки. (а) эритема, рыхлость и множественные язвенные поражения слизистой оболочки прямой кишки. (B) кроме множественных язв на поверхности слизистой присутствует слизисто-гнойный экссудат.
Клинически распознавание герпетической инфекции в типичных случаях основывается на выявлении характерной сыпи в виде группы мелких пузырьков на фоне инфильтрирации. Для подтверждения диагноза используют методы выделения вируса и серологические реакции для выявления антител. Внутриядерные вирусные включения можно обнаружить при микроскопии окрашенных по Романовскому-Гимзе соскобов и биоптатов основания везикул. Однако такие включения обнаруживаются лишь у 60% больных герпетической инфекцией. Наиболее чувствительным и достоверным методом является выделение вируса на культуре тканей. Серологические реакции (РСК, реакция нейтрализации) имеют малую информативность. Нарастание титра антител в 4 раза и более можно выявить лишь при первичной инфекции, при рецидивах лишь у 5% больных отмечается нарастание титра. Наличие положительных реакций без динамики титров можно выявить у многих здоровых людей (за счет латентной герпетической инфекции). Важно одновременно использовать несколько методов диагностики. В качестве скринингового метода рекомендуется использовать метод ПЦР, иммуноферментный анализ (ИФА) и реакцию иммунофлюоресценции (РИФ), а в качестве подтверждающего — метод выделения ВГ на чувствительных клеточных культурах. Вирусологический метод является «золотым стандартом» в диагностике ГВИ. Отличительной особенностью данного метода является высокая степень достоверности полученных результатов, а также высокая чувствительность (85— 100 %) и специфичность (100 %), возможность получения чистой культуры возбудителя для его дальнейшего изучения, в частности испытания чувствительности к антивирусньм препаратам; недостатком — длительность проведения (от 2 до 5—14 дней). [2; 4]
ЦИТОМЕГАЛОВИРУСНАЯ ИНФЕКЦИЯ
Цитомегаловирусная инфекция (ЦМВИ) — общее инфекционное заболевание, вызываемое β -герпесвирусом человека, характеризующееся многообразием форм (от бессимптомных до генерализованных), морфологически проявляющееся образованием в слюнных железах, висцеральных органах и ЦНС цитомегалов — гигантских клеток с типичными внутриядерными и цитоплазматическими включениями. Инфекция относится к антропонозам. Отличается различными механизмами передачи: капельный, гемоконтактный, контактный. Пути передачи: воздушно-капельный; артифициальный (парентеральный); контактно-бытовой (в том числе при непосредственном контакте со слюной); половой; вертикальный, трансфузионный, трансплантационный. Иммунитет нестойкий, нестерильный. Механизм развития ЦМВИ зависит от дозы вируса, путей заражения, возраста пациента, генетических особенностей и состояния иммунитета в момент заражения.
Входными воротами для ЦМВ служат слизистые оболочки дыхательных путей, пищеварительного тракта, половых органов, конъюнктива глаз, поврежденная кожа.
При персистенции ЦМВ выделяют две стадии: стадию продуктивной репликации и стадию латенции. Обе стадии персистирующей инфекции не являются стабильными в течение жизни человека, сменяя одна другую. В популяции не менее 10 % населения являются вирусовыделителями. Реактивация ЦМВИ обычно не сопровождается какими-либо симптомами и для организма человека протекает незаметно.
Классификация ЦМВИ
А. Приобретенная:
1. Латентные.
2. Манифестные:
а) локализованная — сиалоаденит;
б) генерализованные: мононуклеозоподобная; легочная; церебраль-
ная; почечная; печеночная; желудочно-кишечная; комбинированная.
Б. Врожденная:
1. Латентные.
2. Манифестные.
По тяжести:
• легкая форма; • cреднетяжелая форма.
Критерии тяжести:
• выраженность синдрома интоксикации; • выраженность местных изменений.
По течению:
А. По длительности:
1. острое (до 3 мес.);
2. затяжное (до 2 лет);
3. хроническое (более 2 лет).
Б. По характеру:
1. гладкое;
2. негладкое:
— с осложнениями;
— с обострениями;
— с наслоением вторичной инфекции;
— с обострением хронических заболеваний.
Цитомегаловирус оказывает цитопатическое действие на железистые элементы, фибробласты, эндотелиальные и мышечные клетки. При этом в толстой кишке, как правило, поражаются глубокие слои слизистой оболочки (кишечные крипты) и капилляры. Проникая в ядра клеток, возбудитель размножается с образованием гигантских клеток с ядерными и цитоплазматическими включениями, похожими на совиный глаз. После этого вирус отпочковывается от ядра в цитоплазму и выходит за пределы клетки, вызывая ее патологическое изменение и гибель. Обнаружение подобных клеток в моче, слюне или других выделениях считается патогномоничным признаком цитомегаловирусной инфекции. [3; 10; 12; 17]
Цитомегаловирусный колит связан с реактивацией латентной инфекции и может развиться как у иммунокомпрометированных, так и у иммунокомпетентных пациентов. При этом иммунокомпетентные пациенты обычно более старшего возраста, с большим количеством сопутствующей патологии. Клинически цитомегаловирусный колит проявляется болями в животе, гематохезией и диареей. Диарея чаще наблюдается у больных с иммунодефицитом, в то время как гематохезия больше характерна для иммунокомпетентных больных. [10] Многие авторы указывают на реактивацию цитомегаловирусной инфекции у больных хроническими воспалительными заболеваниями кишечника, что более характерно для неспецифического язвенного колита, но так же встречается и при болезни Крона. Однако, единого мнения на роль CMV в увеличении частоты рецидивов ХВЗК нет. Хотя в последнее время считается важным определение вирусной нагрузки методами количественной ПЦР для решения вопроса о назначении противовирусной терапии больным с рефрактерным течением ХВЗК и признаками реактивации цитомегаловирусной инфекции. [7; 14; 17]
Поражение толстой кишки при цитомегаловирусном колите сегментарное. Изменения могут затрагивать любые отделы толстой кишки или представлены панколитом, но чаще в патологический процесс вовлекается правая или левая половина. Макроскопические изменения при цитомегаловирусном колите коррелируют со степенью тяжести заболевания. При легкой форме они имеют неспецифический характер. Слизистая оболочка пораженного сегмента бледно-розового цвета, шероховатая, мелкозернистая, с обедненным сосудистым рисунком. Контактная кровоточивость отсутствует.
При среднетяжелой форме на фоне рыхлой зернистой слизистой оболочки видны единичные или множественные поверхностные дефекты размерами от 0,2-0,3 до 0,5-0,6 см, окруженные венчиком гиперемии (афты). Изъязвления не склонны к слиянию. Сосудистый рисунок представлен крупными стволами 1-2-го порядка. Контактная кровоточивость не выражена, однако в некоторых случаях определяются единичные субэпителиальные геморрагии.
При тяжелой форме выявляются множественные, глубокие изъязвления различной формы, размеров. Язвы могут быть округлой формы, диаметром до 1 см в виде «следов от пробойника» или неправильной разветвленной формы («географические язвы»).
Окружающая слизистая оболочка рыхлая, зернистая, в некоторых случаях отмечается очаговая умеренная гиперемия с множественными субэпителиальными кровоизлияниями. Контактная кровоточивость выражена слабо (Lim R.V., Raskin J.D., 2003). Осложнения в большинстве случаев отмечаются при тяжелых формах течения заболевания, наиболее частые из них — кровотечение и перфорация кишечной стенки. Учитывая сходность эндоскопической картины, цитомегаловирусный колит следует дифференцировать с болезнью Крона, иерсиниозным колитом и амебиазом толстой кишки.
Особый интерес вызывает диагностика цитомегаловирусного колита на фоне хронических воспалительных заболеваний кишечника. Hirayama Y и соавт. [7] опубликовали исследование, в ходе которого были выявлены наиболее патогномоничные эндоскопические симптомы, позволяющие заподозрить CMV-инфекцию у больных с активным неспецифическим язвенным колитом. Наличие панколита в данном исследовании чаще было связано с цитомегаловирусной инфекцией. Однофакторный анализ показал, что глубокие язвы, язвы в виде «следа от пробойника», географические язвы и спонтанное кровотечение чаще встречаются у ЦМВ-инфицированных пациентов, чем у ЦМВ-негативных. Глубокую язву определяли как глубокое изъязвление до мышечного слоя со слегка приподнятыми краями. Язва в виде «следов от пробойника» определялась как изъязвление округлой формы с четкими ровными краями. Географическими язвами называли изъязвления неправильной разветвленной формы. Изъязвления, направленные вдоль оси толстой кишки определяли как продольные язвы. Обширные дефекты слизистой с продольным или поперечным распространением, захватывающее более ¼ окружности кишки определяли как «дефект слизистой». При этом продольные язвы и обширные дефекты слизистой чаще встречались у ЦМВ-негативных пациентов.
Рис.2 Эндоскопическая картина CMV-колита на фоне активного НЯК [7]
А-C: глубокая язва; D-G: язвы в форме «следов от пробойника»; H-J: географические язвы; K: продольные язвы; L: дефект слизистой.
В литературе встречаются немногочисленные сообщения о псевдоопухолевых поражениях толстой кишки, обусловленных цитомегаловирустной инфекцией. [8; 16] Так Jacob S и Zayyani NR описывают случай выявления на колоноскопии изъязвленного стелющегося полиповидного образования аноректальной зоны у иммунокомпетентной пациентки 76 лет, обратившейся по поводу болей в прямой кишке, гематохезии, анемии. (Рис.3) Был заподозрен рак прямой кишки, но гистопатологическое исследование выявило многочисленные полипоидные кусочки грануляционной ткани и частично изъязвленные фрагменты слизистой оболочки аноректальной зоны с интенсивным воспалением. В грануляционной ткани определялись отек, многочисленные пролиферирующие капилляры с утолщенными эндотелиальными клетками, молодые фибробласты, нейтрофилы, гистиоциты, включая несколько многоядерных гигантских клеток, лимфоциты и плазматические клетки. Тщательное исследование выявило отдельные крупные базофильные внутриядерные включения в фибробластах, соответствующие изменениям при ЦМВ. Проведение иммуногистохимического (ИГХ) окрашивание с антителами ЦМВ на парафиновых срезах в специализированной лаборатории подтвердили диагноз. Признаков неопластической патологии не было. На контрольном осмотре после двухнедельного курса противовирусной терапии выявлен полный регресс изменений слизистой аноректальной зоны.
Рис.3 Псевдоопухолевое образование прямой кишки, обусловленное ЦМВ-инфекцией. [8]
Изъязвленное стелющееся полиповидное образование аноректальной зоны.
Рис.4 Результаты гистологического исследования [8]
Микроскопия высокого разрешения (*1000), Н и Е, цитомегаловирусное внутриклеточное включение в стромальном фибробласте (указано стрелкой)
Золотым стандартом диагностики цитомегаловирусной природы колита является морфологическое исследование биоптатов пораженной слизистой, которое выявляет специфические для ЦМВ изменения: цитомегалические клетки (3-4-кратное увеличение мононуклеаров) с характерным и гомогенными внутриядерными ("глаз совы") и гранулярными цитоплазматическими включениями. (Рис.4) Кроме того, отмечается воспалительная клеточная инфильтрация слизистой оболочки, соответствующая хроническому процессу и васкулиты. Для повышения информативности гистологического метода необходима множественная биопсия (8-10 фрагментов) измененной слизистой оболочки. При наличии глубоких язвенных дефектов с целью профилактики развития перфорации кишечной стенки используется комбинация гистологического и цитологического методов обследования. Для морфологического исследования тканевой материал забирается из краев изъязвления, для цитологического (браш-биопсия) - из его дна. Широкое распространение получает иммуногистохимическое исследование биоптатов с помощью иммунопероксидазного и иммунофлюоресцентного окрашивания на антиген ЦМВ с использованием моноклональных антител и/или гибридизации ДНК. Это позволяет значительно увеличить чувствительность морфологического метода. Цитомегаловирусная природа поражения может быть установлена также при помощи полимеразной цепной реакции (ПЦР) и иммунопероксиразного теста (ИПТ). Считается, что в сравнении с гистологическим исследованием они обладают большей чувствительностью и специфичностью (Морозова СВ., Пархоменко Ю.Г., 2002; Шахгильдян В.И., 2003). [3; 4; 12]
Вирус герпеса человека 8-го типа (ВГЧ-8)
ВГЧ-8 относится к γ-герпесвирусам. По строению сходен с другими герпесвирусами. Клетками-мишенями являются эндотелий капилляров и В-лимфоциты. Этот вирус выступает как этиологический агент, провоцирующий развитие одной из форм первичной лимфомы, а именно неходжкинской В-лимфомы, формирующей плевральные, перикардиальные или абдоминальные полости с лимфоматозным кровотечением и отсутствием выраженных опухолевых масс. Антиген к вирусу обнаруживают у 25—40 % взрослых, у ВИЧ-инфицированных больных (особенно у гомосексуалистов) до 90 %. Этот вирус также связан с поликлональной многоочаговой болезнью Кастельмана (лимфопролиферативное заболевание) и саркомой Капоши (СК). Методом ПЦР у больных саркомой Капоши вирус обнаруживали в кожных соскобах, лимфатической ткани, семенной жидкости, в мононуклеарных клетках периферической крови.
Таким образом, ВГЧ-8 является этиологическим агентом всех клинических форм саркомы Капоши. Саркома Капоши (ангиосаркома Капоши, множественная идиопатическая геморрагическая саркома) – системное опухолевое многоочаговое заболевание сосудистого генеза с преимущественным поражением кожи, лимфатических узлов и внутренних органов, впервые описанная в 1872 году венгерским дерматологом Морицем Капоши. Саркома Капоши (СК) является новообразованием эндотелиальной природы. Выделяют следующие клинические формы: СПИД-ассоциированная (эпидемическая) СК, классическая (средиземноморская) СК, эндемическая (африканская) СК и трансплантант-ассоциированная СК. Элементы СК чаще появляются на нижних конечностях. Сначала они имеют вид маленьких пятен, которые увеличиваются до пальпируемых узлов. Размер элементов варьирует от нескольких миллиметров до 10 см и более, цвет — от красно-коричневого до черного. При генерализации элементы появляются на слизистых оболочках мягкого и твердого неба, глотки, конъюнктивы, респираторного и пищеварительного трактов. Эпидемический (СПИД-ассоциированный) тип. СК– наиболее часто встречающееся онкологическое заболевание у ВИЧ инфицированных пациентов. Среди ВИЧ инфицированных людей СК выявляется примерно в 20 тысяч раз чаще, чем среди общей популяции, и в 300 раз чаще, чем среди пациентов с иммунодефицитами, вызванными другими причинами. СК развивается при инфицировании вирусом простого герпеса 8 типа (ВГ 8 типа) и наличии иммунодефицита. После обнаружения ВГ 8 типа при отсутствии высокоактивной антиретровирусной терапии (ВААРТ) СК развивается через 3-4 года. В основе механизма развития СК лежит повышение чувствительности к цитокинам, регулирующим процессы ангиогенеза и лимфангиогенеза, обусловленные действием ВИЧ и ВГ 8 типа. При СПИД ассоциированной СК возможно поражение внутренних органов (табл.2) Желудочно-кишечный тракт затрагивается примерно в 40% случаев, органы дыхания (трахея, бронхиальное дерево, плевра, легочная паренхима) – в 20 50% случаев, что может привести к развитию легочной недостаточности в результате лимфангита, эндобронхиальной обструкции и ателектаза. Однако причиной смерти больных, как правило, являются не сама СК, а другие вторичные заболевания. СК, возникшая на фоне ВААРТ, характеризуется менее агрессивным течением. [1; 4]
Таблица 2
Заболеваемость, клинические проявления и диагностика СК у ВИЧ-инфицированных больных (Дж. Барлетт, 2010г.) [1]
|
Локализация |
Частота* |
Клинические проявления |
Диагностика |
|
Кожные покровы |
95% |
Багровые или черно-коричневые узелки на коже или на слизистоых оболочках +/- отек |
Типичные по внешнему виду элементы + результаты биопсии |
|
Полость рта |
30% |
Обычно на небе или на деснах |
Типичные по внешнему виду элементы + результаты биопсии (предпочтительно проводить биопсию кожных элементов |
|
ЖКТ |
40% |
Боль, кровотечение или обструкция. В большинстве случаев протекает бессимптомно. В большинстве случаев у пациентов есть элементы СК на коже. Может развиваться на любой стадии. |
Диагноз устанавливается при обнаружении геморрагических узелков во время эндоскопического исследования. Биопсия часто дает отрицательный результат. При положительном результате биопсии кожных элементов следует предположить возможность поражения ЖКТ |
|
Легкие |
20-50% |
Одышка, кашель, свистящее дыхание, кровохарканье; возможно поражение паренхимы легких, поражение слизистой бронхов, плевральный выпот. Плевральный выпот серозно-кровянистый, цитологическое исследование дает отрицательный результат. Рентгенография грудной клетки: диффузные или узелковые инфильтраты. |
Диагноз устанавливается при помощи КТ и бронхоскопии. Эндобронхиальное поражение – красные выпуклые элементы на стенках бронхов – биопсия часто дает отрицательный результат. |
СК может встречаться в любом отделе желудочно-кишечного тракта от глотки до прямой кишки, но чаще всего возникает в желудке и тонком кишечнике или дистальных отделах толстой кишки. У 20% пациентов поражение ЖКТ бывает мультифокальным, с локализацией как в верхних, так и в нижних отделах. Макроскопические изменения варьируют от красных пятнисто-папулезных элементов на слизистой до более темных узелковых или полиповидных поражений. В более тяжелых случаях могут наблюдаться кратероподобные образования с депрессией или изъязвлением в центре с выраженной контактной кровоточивостью. (Рис. 5, Рис.6) [1;11]
Для гистологической картины СК характерны два признака: беспорядочное новообразование сосудов и пролиферация веретенообразных клеток. Патоморфологическая картина висцеральных поражений при СК практически не отличается от таковой кожных очагов: хаотичные разрастания веретенообразных клеток вокруг новообразованных сосудистых каналов и щелей. При этом требуется дифференциальная диагностика с другими веретеноклеточными опухолями (гастроинтестинальными стромальными опухолями, веретеноклеточной меланомой и ангиосаркомой) Наличие ВГЧ8 типа является обязательным для СК и служит дифференциально-диагностическим критерием. (Рис.7[МА1] )
Рис. 5 Саркома Капоши (СК) слепой кишки. [6]
Рис.6 Эндоскопическая картина СК слепой кишки (осмотр в режиме i-scan; Pentax) [13]
в устье червеобразного отростка выявлено полиповидное образование 7 мм с четкой демаркационной линией и небольшой эрозией на поверхности
Рис.7[МА2] Гистологическая картина СК [13]
Гистология выявила пролиферирующие веретенообразные клетки, проникающие в собственную пластинку слизистой и щелевидные сосудистые каналы, содержащие эритроциты.
Выводы:
1. Распространенность вирусов семейства Herpesviridae крайне высока, инфицированность среди населения достигает 90%.
2. Поражение слизистых нижних отделов ЖКТ может быть вызвано вирусом простого герпеса 1 и 2 типа, цитомегаловирусом (ВГЧ 5 тип) и вирусом герпеса человека 8 типа.
3. В результате развиваются герпетический колит (ВПГ 1,2 тип), цитомегаловирусный колит (ВГЧ 5 тип) и кишечная форма саркомы Капоши (ВГЧ 8 тип)
4. В большинстве случаев поражение слизистой толстой кишки происходит в результате реактивации латентной вирусной инфекции.
5. Чаще поражение толстой кишки вирусами семейства Herpesviridae развивается у иммунокомпрометированных больных, однако герпетический и цитомегаловирустный колит могут поражать и иммунокомпетентных пациентов.
6. Выраженный полиморфизм макроскопических проявлений герпетического и цитомегаловирустного колита требует дифференциальной диагностики с другими инфекционными колитами и хроническими воспалительными заболеваниями кишечника, что особенно сложно, учитывая нередкое протекание цитомегаловирусного колита на фоне ХВЗК.
7. Саркому Капоши и редкую псевдоопухолевую форму цитомегаловирустного колита нужно дифференцировать с новообразованиями толстой кишки.
8. Морфологическое исследование биоптатов из зоны герпесвирусного поражения обладают высокой специфичностью, но для повышения чувствительности нужно проводить забор большого количества биоптатов.
Статьи по теме:
- Смотрите эндоскопические иллюстрации Цитомегаловирус в разделе EndoAtlas
Список литературы:
1. Рассохин В.В., Крестьянинова А.Р. Саркома Капоши: диагностика и лечение. ПРАКТИЧЕСКАЯ ОНКОЛОГИЯ •Т. 13, №2 – 2012 practical-oncology.ru
2. Руководство по инфекционным болезням (в 3 частях) Под ред. Ю.В. Лобзина Издательство: СПб.: Феникс: 2001г. – 932с. [Текст]
3. Сотников В.Н., Разживина А.А., Веселов В.В., Кузьмин А.И. и др. Колоноскопия в диагностике заболеваний толстой кишки// М: Экстрапринт, 2006г.-280 с. [Текст]
4. Филатова, Т. Г. Герпесвирусная инфекция : учеб. пособие для студентов 5—6-го курсов (специальности 060101 «Лечебное дело», 060103 «Педиатрия») / Т. Г. Филатова. — Петрозаводск : Изд-во ПетрГУ, 2014. — 51 с. ISBN 978-5-8021-2013-2
5. Чигвинцева Е.А. Роль представителей семейства Herpesviridae в патологии урогенитального тракта автореф. по ВАК 14.00.11, кандидат медицинских наук Научная библиотека диссертаций и авторефератов disserCat http://www.dissercat.com/content/rol-predstavitelei-semeistva-herpesviridae-v-patologii-urogenitalnogo-trakta#ixzz53ONivKh5
6. Atassi T1, Montgomery E. Images in clinical medicine. Cecal Kaposi's sarcoma. N Engl J Med. 2003 Dec 11;349(24):2340. PMID: 14668460 DOI: 10.1056/NEJMicm010829
7. Hirayama Y, Ando T, Hirooka Y, Watanabe O, Miyahara R, Nakamura M, Yamamura T, Goto H. Characteristic endoscopic findings and risk factors for cytomegalovirus-associated colitis in patients with active ulcerative colitis. World J Gastrointest Endosc. 2016 Mar 25;8(6):301-9. doi: 10.4253/wjge.v8.i6.301. PMID: 27014426 Free PMC Article
8. Jacob S, Zayyani NR Cytomegalovirus colitis masquerading as rectal malignancy in an immunocompetent patient. Indian J Pathol Microbiol. 2015 Jan-Mar;58(1):80-2. doi: 10.4103/0377-4929.151195. PMID: 25673600 Free Article
9. Kristen E. Sandgren, Nathan B. Price, Warren P. Bishop, and Patrick J. McCarthy, “Herpes Simplex Proctitis Mimicking Inflammatory Bowel Disease in a Teenaged Male,” Case Reports in Pediatrics, vol. 2017, Article ID 3547230, 4 pages, 2017. doi:10.1155/2017/3547230
10. Le PH, Lin WR, Kuo CJ, Wu RC, Hsu JT, Su MY, Lin CJ, Chiu CT. Clinical characteristics of cytomegalovirus colitis: a 15-year experience from a tertiary reference center. Ther Clin Risk Manag. 2017 Dec 15;13:1585-1593. doi: 10.2147/TCRM.S151180. eCollection 2017. PMID: 29290686
11. Lee AJ, Brenner L, Mourad B, Monteiro C, Vega KJ, Munoz JC. Gastrointestinal Kaposi's sarcoma: Case report and review of the literature. World J Gastrointest Pharmacol Ther. 2015 Aug 6;6(3):89-95. doi: 10.4292/wjgpt.v6.i3.89. PMID: 26261737 Free PMC Article
12. Nakase H, Herfarth H. Cytomegalovirus Colitis, Cytomegalovirus Hepatitis and Systemic Cytomegalovirus Infection: Common Features and Differences. Inflamm Intest Dis. 2016 Apr;1(1):15-23. Epub 2016 Jan 23. PMID: 27243020 Free PMC Article
13. Neumann H1, Vieth M2, Mönkemüller K3. Infectious colon polyp in patient with human immunodeficiency virus. Endoscopy. 2014;46 Suppl 1 UCTN:E439-40. doi: 10.1055/s-0034-1377502. Epub 2014 Oct 14. PMID: 25314183 DOI: 10.1055/s-0034-1377502
14. Pillet S, Pozzetto B, Roblin X. Cytomegalovirus and ulcerative colitis: Place of antiviral therapy. World J Gastroenterol. 2016 Feb 14;22(6):2030-45. doi: 10.3748/wjg.v22.i6.2030. Review. PMID: 26877608 Free PMC Article
15. Steven E. Goodell, M.D., Thomas C. Quinn, M.D., Emmanuel Mkrtichian, P.A.-C, Michael D. Schuffler, M.D., King K. Holmes, M.D., Ph.D., and Lawrence Corey, M.D. Herpes Simplex Virus Proctitis in Homosexual Men — Clinical, Sigmoidoscopic, and Histopathological Features N Engl J Med 1983; 308:868-871April 14, 1983DOI: 10.1056/NEJM198304143081503
16. Vegunta AS, Dasar SK, Joshi SK, Rao RV. Spontaneous Partial Vanishing Cytomegalovirus Pseudotumour of Colon in an Immunocompetent Patient. J Clin Diagn Res. 2015 Aug;9(8):TD07-9. doi: 10.7860/JCDR/2015/13803.6363. Epub 2015 Aug 1. PMID: 26436017 Free PMC Article
17. Weng MT, Tung CC, Lee YS, Leong YL, Shieh MJ, Shun CT, Wang CY, Wong JM, Wei SC. Cytomegalovirus colitis in hospitalized inflammatory bowel disease patients in Taiwan: a referral center study. BMC Gastroenterol. 2017 Feb 13;17(1):28. doi: 10.1186/s12876-017-0586-9. PMID: 28193173
Статьи по теме
Рекомендуемые статьи
Синдром Бурхаве
Спонтанный разрыв пищевода - характеризуется спонтанным разрывом всех слоев стенки пищевода. Первое описание данного состояния дано голландским врачом Германом Бурхаве (Hermann Boerhaave) в 1724 г.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.













.jpg)





.png)
















Комментарии