- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Современный алгоритм диагностики и ведения пациентов с хроническим атрофическим гастритом и кишечной метаплазией желудка
| Авторы: | Драпкина О.М., Кашин С.В., Куваев Р.О., Кайбышева В.О., Крайнова Е.А., Шепель Р.Н., Никонов Е.Л. 2023г. |
Введение:
Эндоскопическое исследование верхних отделов пищеварительного тракта с морфологическим исследованием биоптатов слизистой оболочки желудка является важным этапом диагностики предраковой патологии желудка, начальных стадий рака желудка и отбора пациентов для последующего лечения и динамического наблюдения в рамках программы диспансеризации взрослого населения. Согласно приказу Министерства здравоохранения Российской Федерации от 27.04.21 №404н
45 лет эзофагогастродуоденоскопии (ЭГДС), которая при необходимости может проводиться с применением анестезиологического пособия, в том числе в медицинских организациях, оказывающих специализированную медицинскую помощь в условиях дневного стационара. Основными задачами ЭГДС являются выявление и типирование хронического гастрита, инфекции Helicobacter pylori, предопухолевой патологии желудка, оценка распространенности предопухолевых состояний слизистой оболочки и их стадирование, а также обнаружение ранних форм рака желудка и выполнение стандартизированного протокола биопсии. Однако алгоритм проведения эндоскопического исследования и биопсии, необходимость применения современных оптических технологий диагностики предопухолевых состояний слизистой оболочки и порядок
наблюдения пациентов с атрофическим гастритом и предраковыми изменениями слизистой оболочки желудка не определен. Новый алгоритм эндоскопической диагностики и ведения пациентов, основанный на отечественных и международных стандартах, позволит повысить эффективность выполнения ЭГДС и наблюдения пациентов в рамках диспансеризации взрослого населения в Российской Федерации

Ключевые аспекты диагностики, наблюдения и лечения предраковых изменений и состояний слизистой оболочки желудка:
— пациенты с хроническим атрофическим гастритом с кишечной метаплазией или без метапластических изменений составляют группу риска по развитию аденокарциномы желудка, поэтому необходима своевременная диагностика этих патологических состояний, выделение групп риска и адекватное наблюдение за больными с хроническим гастритом [3];
— хронический гастрит, вызванный инфекцией H. pylori, в том числе у «бессимптомных» лиц, можно рассматривать как показание к проведению эрадикационной терапии инфекции H. pylori в качестве этиотропного лечения и оппортунистического скрининга для профилактики рака желудка. Показаниями к обязательному проведению антигеликобактерной терапии служат язвенная болезнь желудка и двенадцатиперстной кишки, MALT-лимфома желудка, ранний рак желудка с эндоскопической резекцией [4];
— атрофический гастрит должен быть установлен при морфологическом исследовании, вне зависимости от этиологии гастрита. Наличие кишечной метаплазии при морфологическом исследовании биоптатов слизистой оболочки желудка почти всегда указывает на диагноз атрофического гастрита [5];
— координация действий гастроэнтеролога, эндоскописта и морфолога является важным аспектом диагностики хронического гастрита и предраковых состояний и изменений слизистой оболочки желудка, причины развития гастрита, степени распространенности атрофических изменений;
— при выполнении эндоскопического исследования необходимо определять основные признаки атрофического гастрита, такие как очаговые или диффузные бледные участки слизистой оболочки, хорошо видимые сосуды на фоне истонченной слизистой оболочки, уменьшение или отсутствие складок слизистой оболочки и, при наличии, очаги кишечной метаплазии;
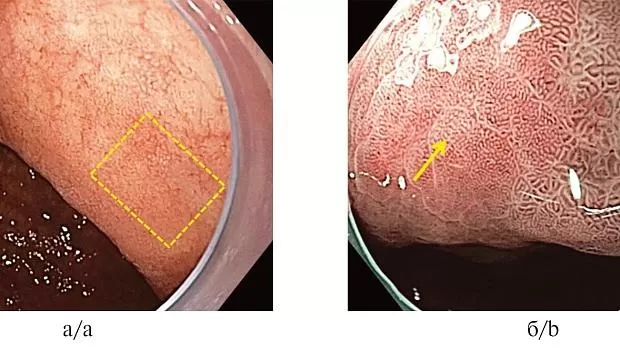
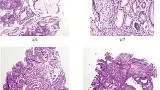
— возможности эндоскопии высокого разрешения в сочетании с хромоскопией (включая цифровое и оптическое контрастирование получаемого изображения) выше, чем при использовании эндоскопии в белом световом режиме в диагностике хронического гастрита, распространенности атрофии, включая стадирование предраковых состояний и изменений слизистой оболочки желудка [6]. Для лучшего выявления участков атрофии, метаплазии и неоплазии, проведения прицельной биопсии необходимо использовать виртуальную (оптическую или цифровую) хромоскопию [7]. Очаги кишечной метаплазии при использовании узкоспектральных оптических технологий диагностики могут иметь характерные эндоскопические признаки в виде «светло-голубых гребней» и «белого матового вещества», что позволяет врачу-эндоскописту выполнять прицельную биопсию для типирования гастрита (рис. 1, 2 на цв. вклейке) [8, 9];
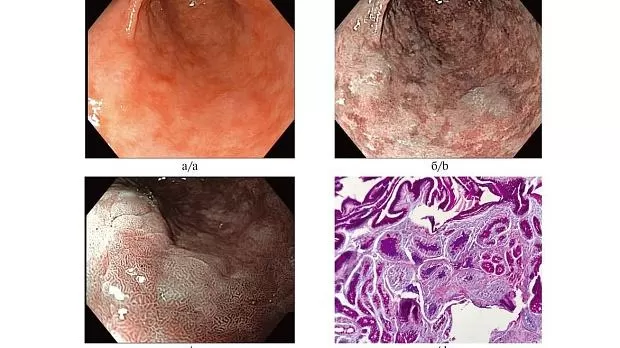
Рис. 1.Эндоскопическая диагностика хронического антрального атрофического гастрита с помощью новых оптических технологий.
а —эндоскопия высокого разрешения в белом свете: неровный рельеф поверхности слизистой оболочки антрального отдела желудка, множественные участки бледно-розового цвета; б — эндоскопия с использованием узкоспектрального режима (режим NBI): определяются множественные участки с светло-синей окраской поверхности эпителия; в — увеличительная эндоскопия в режиме близкого фокуса в комбинации с узкоспектральным режимом NBI: участки с виллезным типом рисунка поверхности эпителия и «светло-голубыми гребнями» (характерно для кишечной метаплазии); г —гистологическое исследование (окраска гематоксилином и эозином, увеличение ×150): очаги кишечной метаплазии.
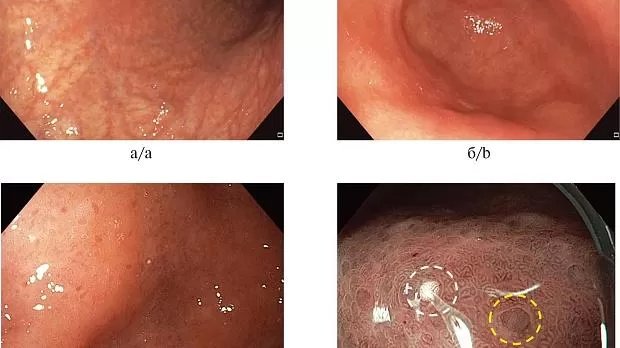
Рис. 2.Эндоскопическая диагностика хронического атрофического аутоиммунного гастрита с поражением тела желудка.
а — эндоскопия в белом свете (тело желудка): отсутствие желудочных складок, бледность слизистой оболочки, визуализация сосудов подслизистого слоя (характерные признаки атрофии); б — эндоскопия в белом свете (антральный отдел желудка): отсутствие признаков атрофии; в — эндоскопия в белом свете (свод желука): множественные точечные очаги слизистой оболочки; г — эндоскопия в узком спектре света с увеличением (свод желудка): белые точечные включения (характерный признак аутоиммунннго гастрита [14], отмечено белым кругом) и бледные округлые очаги в виде клубочков (гломусные образования — «glomus-like lesion», характерный признак аутоиммунного гастрита [15], отмечено желтым кругом); д — гистологическое исследование (биопсия из белых точечных включений, окраска гематоксилином и эозином, увеличение ×150): расширенные фундальные железы, заполненные непрозрачным содержимым.
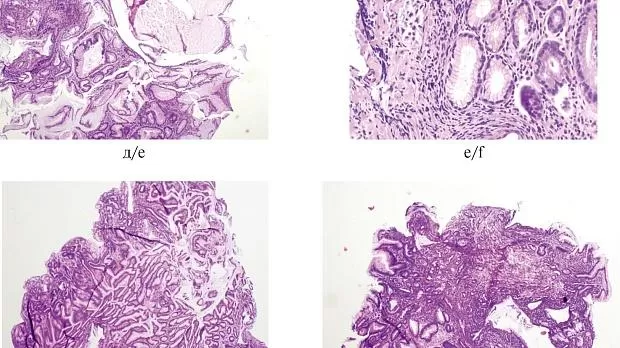
Рис. 2.Эндоскопическая диагностика хронического атрофического аутоиммунного гастрита с поражением тела желудка (продолжение).
д — гистологическое исследование (биопсия из белых точечных включений, окраска гематоксилином и эозином, увеличение ×150): расширенные фундальные железы, заполненные непрозрачным содержимым; е — гистологическое исследование (биопсия из гломусных образований, окраска гематоксилином и эозином, увеличение ×150): очаги гиперплазии ECL-клеток; ж — гистологическое исследование слизистой оболочки тела желудка (окраска гематоксилином и эозином, увеличение ×150): выраженная атрофия слизистой оболочки тела желудка; з — гистологическое исследование слизистой оболочки тела желудка (окраска гематоксилином и эозином, увеличение ×150): слизистая оболочка антрального отдела желудка без атрофии.
— виртуальная (оптическая или цифровая) хромоскопия должна по возможности использоваться при проведении биопсии для стадирования атрофического процесса, а также для выявления подозрительных участков неоплазии и проведения прицельной биопсии. Проведение прицельной биопсии также целесообразно для точного подтверждения очагов атрофии и кишечной метаплазии и выполнения биопсии для диагностики наличия инфекции H. pylori (вне очагов атрофии и метаплазии);
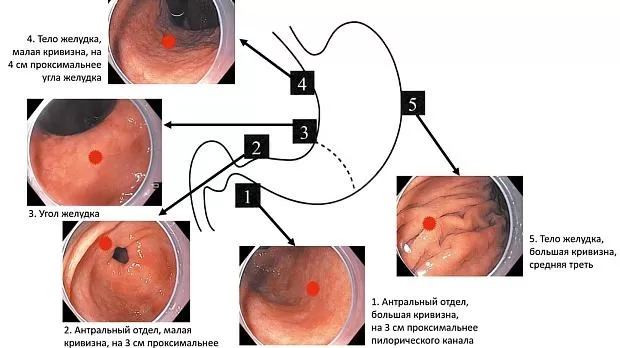
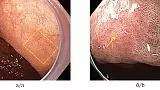
— для типирования гастрита, определения степени распространенности атрофии, достоверной оценки предраковых заболеваний желудка во время эндоскопического исследования необходимо выполнение биопсии, по меньшей мере, из четырех точек: из антрального отдела и тела желудка по малой и большой кривизне [10, 11]. Биоптаты из тела и антрального отделов желудка следует размещать в отдельные маркированные флаконы. Биопсии также должны быть подвергнуты все патологически измененные участки, подозрительные на неоплазию (рис. 3, 4 на цв. вклейке);
Рис. 3. Протокол выполнения биопсии в соответствии с модифицированной Сиднейской системой.
Рис. 4. Применение оптических технологий диагностики хронического атрофического гастрита и выполнения прицельной биопсии патологических участков слизистой оболочки желудка.
а — эндоскопическая картина слизистой оболочки нижней трети тела желудка в белом светом режиме без оптического увеличения изображения; б — эндоскопическая картина слизистой оболочки нижней трети тела желудка в узкоспектральном (NBI) светом режиме с оптическим 70-кратным увеличением получаемого изображения: возможность точной дифференцировки изменений слизистой оболочки и выполнения прицельной биопсии с целью диагностики зоны кишечной метаплазии/атрофии (белая стрелка) и зоны для диагностики в биоптате инфекции Helicobacter pylori (желтая стрелка).
— при выявлении эндоскопических признаков аутоиммунного гастрита (локализация атрофических изменений в фундальном отделе желудка) и/или морфологическом подтверждении диагноза особое внимание врача-эндоскопистадолжно быть уделено поиску нейроэндокринных опухолей, которые могут иметь микроскопические размеры. При наличии признаков аутоиммунного гастрита пациент должен быть направлен к терапевту/гастроэнтерологу для дальнейшего обследования (определения антител к париетальным клеткам и внутреннему фактору, хромогранина А, дефицита витамина В и железа, а также признаков анемии);
— пациенты с признаками пернициозной анемии должны быть направлены на эндоскопическое исследование с целью диагностики аутоиммунного гастрита, обязательного выполнения биопсии для топографической оценки атрофических изменений, выявления нейроэндокринных опухолей и ранних форм неоплазии слизистой оболочки желудка;
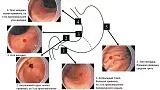
— пациентам с умеренными атрофическими изменениями (участки атрофии и/или кишечной метаплазии), поражающими только антральный отдел желудка, после успешной эрадикационной терапии H. pylori дальнейшее динамическое эндоскопическое наблюдение не требуется ввиду отсутствия риска развития рака желудка (при отсутствии других факторов риска, таких как неблагоприятный наследственный анамнез по раку желудка, неполная кишечная метаплазия, персистирующая инфекция H. pylori) (рис. 5 на цв. вклейке);
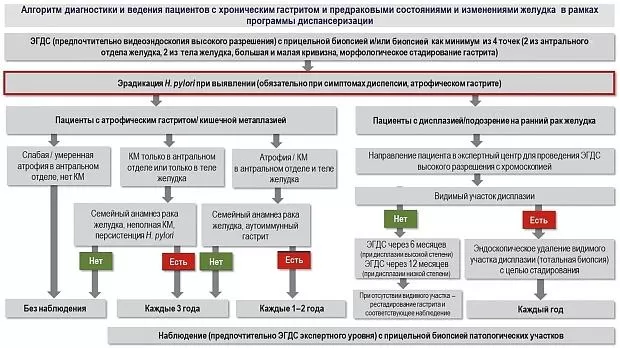
Рис. 5.Алгоритм диагностики и ведения пациентов с хроническим гастритом в рамках программы диспансеризации.
ЭГДС — эзофагогастродуоденоскопия; НЭО — нейроэндокринная опухоль; КМ — кишечная метаплазия.
— пациентам с единичными очагами кишечной метаплазии, но имеющим другие факторы риска (такие как: неблагоприятный наследственный анамнез по раку желудка, неполная кишечная метаплазия, персистирующая инфекция H. pylori) показано эндоскопическое наблюдение 1 раз в 3 года с использованием хромоскопии и проведением прицельной биопсии. Пациентам с распространенными стадиями атрофического гастрита (с множественными участками атрофии и /или кишечной метаплазии слизистой оболочки желудка) рекомендовано эндоскопическое исследование экспертного уровня 1 раз в 3 года (см. рис. 5) [12]. Уточним, эндоскопическое исследование экспертного уровня — исследование, проведенное эндоскопом с высоким разрешением и возможностью «виртуальной» хромоскопии обученным специалистом с соблюдением критериев качества;
— пациентам с дисплазией без видимого при эндоскопии патологического участка необходимо безотлагательное проведение повторного эндоскопического исследования экспертного уровня с хромоскопией/оптической или цифровой виртуальной хромоскопией;
— пациентам с видимым при эндоскопии патологическим участком дисплазии высокой и низкой степени (аденомы/полипа с дисплазией), раннего рака желудка или нейроэндокринной опухоли на фоне аутоиммунного гастрита показано стадирование неопластического процесса и проведение для этой цели эндоскопической резекции патологического очага (см рис. 5) [13];
— при выполнении гастроскопии пациентам с аутоиммунным гастритом необходимо проводить скрининг нейроэндокринных опухолей 1-го типа, которые могут быть удалены эндоскопически при наличии соответствующих онкологических показаний;
— в случае выявления инфекции H. pylori проведение эрадикации рекомендуется больным с неатрофическим и атрофическим гастритом, а также больным после эндоскопического лечения неоплазий желудка. Целью эрадикационной терапии является регрессия воспалительных и атрофических изменений, предотвращение прогрессии неопластических изменений;
— динамическое эндоскопическое наблюдение с интервалами 1—3 года показано пациентам с атрофическим гастритом в соответствии с риском прогрессии предраковых изменений и развития рака желудка (см. рис. 1);
— специалисты, проводящие диспансеризацию, должны оценивать показатели уровня железа и витамина B12 в крови;
— у пациентов с атрофическим гастритом вне зависимости от этиологии (особенно при локализации атрофических изменений в фундальном отделе желудка) при выявлении изменений показателей крови необходимо проводить дифференциальную диагностику атрофии, связанной с аутоиммунным гастритом, а также выявлять наличие других аутоиммунных заболеваний (например, аутоиммунного тиреоидита);
— в Российской Федерации, как в регионе с высокой распространенностью H. pylori ассоциированного гастрита, атрофического гастрита и рака желудка, скрининг и наблюдение за больными с предраковыми изменениями могут стать экономически эффективной стратегией.
Авторы заявляют об отсутствии конфликта интересов.
Полный текст статьи:
Драпкина О.М., Кашин С.В., Куваев Р.О., Кайбышева В.О., Крайнова Е.А., Шепель Р.Н., Никонов Е.Л. Современный алгоритм диагностики и ведения пациентов с хроническим атрофическим гастритом и кишечной метаплазией желудка. Профилактическая медицина. 2023;26(1):7‑10.
Список литературы:
от 27.04.2021 г. №404н «Об утверждении Порядка проведения профилактического медицинского осмотра и диспансеризации определенных групп
взрослого населения». Ссылка активна на 30.11.22.
Prikaz Ministerstva zdravoohraneniya Rossijskoj Federacii ot 27.04.2021 g.
№404n «Ob utverzhdenii Poryadka provedeniya profilakticheskogo medicinskogo osmotra i dispanserizacii opredelennyh grupp vzroslogo naseleniya». Accessed November 30, 2022. (In Russ.).
https://publication.pravo.gov.ru/Document/View/0001202106300043
2. Кашин С.В., Кайбышева В.О., Крайнова Е.А., Иваников И.О., Федоров Е.Д. Основные положения новых европейских рекомендаций
«Принципы диагностики, лечения и наблюдения пациентов с предраковыми состояниями и изменениями желудка». Значение рекомендаций для российских специалистов. Доказательная гастроэнтерология. 2020;9(3):16-31.
Kashin SV, Kaibysheva VO, Krainova EA, Ivanikov IO, Fedorov ED. The
main provisions of the new European recommendations «Principles of diagnosis, treatment and observation of patients with precancerous conditions
and stomach changes». The importance of recommendations for Russian
specialists. Dokazatel’naya gastroenterologiya. 2020;9(3):16-31. (In Russ.).
https://doi.org/10.17116/dokgastro2020903116
3. Pimentel-Nunes P, Libânio D, Marcos-Pinto R, Areia M, Leja M, Esposito G, Garrido M, Kikuste I, Megraud F, Matysiak-Budnik T, Annibale B,
Dumonceau JM, Barros R, Fléjou JF, Carneiro F, van Hooft JE, Kuipers
EJ, Dinis-Ribeiro M. Management of epithelial precancerous conditions
and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study
Group (EHMSG), European Society of Pathology (ESP), and Sociedade
Portuguesa de EndoscopiaDigestiva (SPED) guideline update 2019. Endoscopy. 2019;51(4):365-388. (In Russ.).
https://doi.org/10.1055/a-0859-1883
4. Ивашкин В.Т., Маев И.В., Лапина Т.Л., Шептулин А.А., Трухманов А.С., Баранская Е.К., Абдулхаков Р.А., Алексеева О.П., Алексеенко С.А., Дехнич Н.Н., Козлов Р.С., Кляритская И.Л., Корочанская Н.В., Курилович С.А., Осипенко М.Ф., Симаненков В.И., Ткачев А.В., Хлынов И.Б., Цуканов В.В. Клинические рекомендации
Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции Helicobacter pylori у взрослых. Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2018;28(1):55-70.
Ivashkin VT, Maev IV, Lapina TL, Sheptulin AA, Truhmanov AS, Baranskaya EK, Abdulhakov RA, Alekseeva OP, Alekseenko SA, Dekhnich NN,
Kozlov RS, Klyaritskaya IL, Korochanskaya NV, Kurilovich SA, Osipenko MF, Simanenkov VI, Tkachev AV, Hlynov IB, Cukanov VV. Diagnostics
and treatment of Helicobacter pylori infection in adults: clinical guidelines of
the russian gastroenterological association. Rossijskij zhurnal gastroenterologii, gepatologii i koloproktologii. 2018;28(1):55-70.(In Russ.).
5. Shah SC, Piazuelo MB, Kuipers EJ, Li D. AGA Clinical Practice Update
on the Diagnosis and Management of Atrophic Gastritis: Expert Review.
Gastroenterology. 2021;161(4):1325-1332.e7.
https://doi.org/10.1053/j.gastro.2021.06.078
6. Pimentel-Nunes P, Libânio D, Lage J, Abrantes D, Coimbra M, Esposito G, Hormozdi D, Pepper M, Drasovean S, White JR, Dobru D, Buxbaum
J, Ragunath K, Annibale B, Dinis-Ribeiro M. A multicenter prospective
study of the real-time use of narrow-band imaging in the diagnosis of premalignant gastric conditions and lesions. Endoscopy. 2016;48:723-730.
https://doi.org/10.1055/s-0042-108435
7. Куваев Р.О., Никонов Е.Л., Кашин С.В. Helicobacterpylori-ассоциированный хронический гастрит: новые технологии эндоскопической диагностики. Доказательная гастроэнтерология. 2015;4(1-2):19-24.
Kuvaev RO, Nikonov EL, Kashin SV. Helicobacter pylori-associated chronic gastritis: the new technologies for endoscopic diagnostics. Dokazatel’naya
gastroenterologiya. 2015;4(1-2):19-24. (In Russ.).
https://doi.org/10.17116/dokgastro201541-219-24
8. Куваев Р.О., Никонов Е.Л., Кашин С.В., Видяева Н.С., Бишопс Р. Современные стандарты обучения оптической диагностике в эндоскопии верхних отделов пищеварительного тракта: основные положения
рекомендаций Европейского общества гастроинтестинальной эндоскопии. Доказательная гастроэнтерология. 2021;10(1):11-16.
Kuvaev RO, Nikonov EL, Kashin SV, Vidyaeva NS, Bishops R. Current standards for optical diagnosis training in upper gastrointestinal endoscopy: European society of gastrointestinal endoscopy position statement. Dokazatel’naya gastroenterologiya. 2021;10(1):11-16. (In Russ.).
https://doi.org/10.17116/dokgastro20211001111
9. Dekker E, Houwen BBSL, Puig I, Bustamante-Balén M, Coron E, Dobru DE, Kuvaev R, Neumann H, Johnson G, Pimentel-Nunes P, Sanders DS,
Dinis-Ribeiro M, Arvanitakis M, Ponchon T, East JE, Bisschops R.Curriculum for optical diagnosis training in Europe: European Society of Gastrointestinal Endoscopy (ESGE) Position Statement. Endoscopy. 2020;52(10):
899-923. Erratumin: Endoscopy. 2020;52(10):C10.
https://doi.org/10.1055/a-1231-5123
10. Bisschops R, Areia M, Coron E, Dobru D, Kaskas B, Kuvaev R, Pech O,
Ragunath K, Weusten B, Familiari P, Domagk D, Valori R, Kaminski MF,
Spada C, Bretthauer M, Bennett C, Senore C, Dinis-Ribeiro M, Rutter MD.
Performance measures for upper gastrointestinal endoscopy: A European
Society of Gastrointestinal Endoscopy (ESGE) Quality Improvement Initiative. Endoscopy. 2016;48(9):843-864.
https://doi.org/10.1055/s-0042-113128
11. Bisschops R, Areia M, Coron E, Dobru D, Kaskas B, Kuvaev R, Pech O,
Ragunath K, Weusten B, Familiari P, Domagk D, Valori R, Kaminski MF,
Spada C, Bretthauer M, Bennett C, Senore C, Dinis-Ribeiro M, Rutter MD.
Performance measures for upper gastrointestinal endoscopy: A European
Society of Gastrointestinal Endoscopy quality improvement initiative. United European Gastroenterology Journal. 2016;4(5):629-656.
https://doi.org/10.1177/2050640616664843
12. Ивашкин В.Т., Маев И.В., Лапина Т.Л., Федоров Е.Д., Шептулин А.А.,
Трухманов А.С., Кононов А.В., Абдулхаков Р.А., Алексеева О.П., Алексеенко С.А., Андреев Д.Н., Баранская Е.К., Дехнич Н.И., Кляритская И.Л., Козлов Р.С., Коган Е.А., Королев М.П., Корочанская Н.В.,
Курилович С.А., Ливзан М.А., Осипенко М.Ф., Павлов П.В., Пирогов С.С., Сарсенбаева А.С., Симаненков В.И., Тертычный А.С., Ткачев А.В., Успенский Ю.П., Хлынов И.Б., Цуканов В.В. Клинические
рекомендации Российской гастроэнтерологической ассоциации и ассоциации «Эндоскопическое общество РЭНДО» по диагностике и лечению гастрита, дуоденита. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2021;31(4):70-99.
Ivashkin VT, Maev IV, Lapina TL, Fedorov ED, SHeptulin AA, Truhmanov AS, Kononov AV, Abdulhakov RA,Alekseeva OP, Alekseenko SA, AndreevDN, Baranskaya EK, Dekhnich NI, Klyaritskaya IL, Kozlov RS, Kogan EA, Korolev MP, Korochanskaya NV, Kurilovich SA, Livzan MA, Osipenko MF, Pavlov PV, Pirogov SS, Sarsenbaeva AS, Simanenkov VI,
Tertychnyj AS, Tkachev AV, UspenskijYuP, Hlynov IB, Cukanov VV. Clinical recommendations of Russian gastroenterological association and
RENDO endoscopic society on diagnosis and treatment of gastritis and duodenitis. Rossijskij zhurnal gastroenterologii, gepatologii i koloproktologii. 2021;
31(4):70-99.(In Russ.).
https://doi.org/10.22416/1382-4376-2021-31-4-70-99
13. Куваев Р.О., Ткаченко О.Б., Сидорова А.Н., Крайнова Е.А., Кашин С.В., Куваева А.А. Аденома желудка, сформировавшаяся на фоне хронического атрофического аутоиммунного гастрита в отсутствие
Helicobacterpylori: клинический случай диагностики и лечения. Доказательная гастроэнтерология. 2020;9(4):83-88.
Kuvaev RO, Tkachenko OB, Sidorova AN, Krajnova EA, Kashin SV, Kuvaeva AA. Diagnosis and treatment of the gastric adenoma and Helicobacter
pylori-negative atrophic gastritis: clinical case. Dokazatel’naya gastroenterologiya. 2020;9(4):83-88. (In Russ.).
https://doi.org/10.17116/dokgastro2020904183
14. Terao S, Suzuki S, Yaita H, Kurahara K, Shunto J, Furuta T, Maruyama Y,
Ito M, Kamada T, Aoki R, Inoue K, Manabe N, Haruma K. Multicenter
study of autoimmune gastritis in Japan: Clinical and endoscopic characteristics. Digestive Endoscopy. 2020;32(3):364-372.
https://doi.org/10.1111/den.13500
15. Kuvaev R, Kashin S, Kraynova E. A new indicator for autoimmune gastritis
by magnifying image enhanced endoscopy: «Glomus like» lesions of the gastric corpus. Digestive Endoscopy. 2022;34(suppl 1):52.
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.
















.jpg)




.png)
















Комментарии