- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Желчнокаменная болезнь: эпидемиологические данные, ключевые аспекты патогенеза и коморбидности, актуальные терапевтические мишени
| Авторы: | Никитин И.Г. 1 Волнухин А.В. 2 2020г. |
| Об авторах: |
1. ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, Москва, Россия 2. ФГАОУ «НМИЦ «ЛРЦ» Минздрава России, Москва, Россия |
Полный текст статьи:
Введение
Желчнокаменная болезнь (ЖКБ) известна врачам уже на протяжении нескольких веков. Впервые данное заболевание было описано Антонио Бенивьени в 1507 г. [1]. В современной медицине под ЖКБ, или холелитиазом, принято понимать хроническое заболевание с генетической предрасположенностью, при котором наблюдается образование камней в желчных путях [2].
Эпидемиологические данные
По данным статистики, в Европе и США ЖКБ страдают 15–20% жителей [3–6]. Эти цифры можно экстраполировать и на Россию. Вместе с тем справедливо будет заметить, что распространенность холелитиаза в разных странах отличается значительной вариабельностью, что определяется генетическими и внешними факторами [5].
Являясь причиной наибольшего числа госпитализаций среди всех заболеваний желудочно-кишечного тракта, ЖКБ также занимает позицию одной из наиболее затратных для здравоохранения болезней пищеварительной системы [3–7].
К основным факторам риска холелитиаза относятся: пожилой возраст; женский пол; беременность; прием эстрогенов в период постменопаузы; высококалорийная диета, богатая легкоусвояемыми углеводами и бедная клетчаткой; избыточная масса тела или ожирение; наследственная предрасположенность [7, 8].
Несмотря на то, что заболевание встречается преимущественно в возрасте старше 40 лет, отмечается повсеместная тенденция к его омоложению. Все чаще данный диагноз ставится в детском и подростковом возрасте. Данный факт связывают прежде всего с увеличением распространенности у этой категории пациентов ожирения, гиподинамии, сахарного диабета, а также с ранней беременностью [4].
По составу камни делят на холестериновые и пигментные. Локализоваться они могут в желчном пузыре, реже — в общем желчном протоке и внутрипеченочных желчных путях. В 80% случаев заболевание протекает бессимптомно и камни обнаруживаются случайно при ультразвуковом исследовании [9]. Из них 80–90% состоят преимущественно из холестерина [7, 8].
Желчнокаменная болезнь и коморбидная патология
Появляется все больше данных, характеризующих ЖКБ не только как самостоятельное заболевание, но и как коморбидную патологию, имеющую тесную этиологическую и патогенетическую связь с другими болезнями. Она может способствовать их развитию и прогрессированию, влиять на исходы. Возможна и обратная связь: определенные заболевания и состояния могут служить дополнительным фактором риска камнеобразования.
Доказано, что пациенты с холелитиазом, особенно женского пола и молодого возраста, имеют более высокий риск развития сердечно-сосудистых и цереброваскулярных заболеваний [4, 10, 11].
Выявлена прямая связь между ЖКБ и раком желчного пузыря, а также раком желудка, гепатоцеллюлярной карциномой, холангиокарциномой, раком поджелудочной железы, колоректальным раком [12].
Установлено, что при наличии ЖКБ риск смерти от всех причин и от онкологической патологии повышается на 30%, а смерти от сердечно-сосудистых заболеваний — на 40% [13].
Ввиду анатомического и физиологического единства гепатобилиарной системы особого внимания заслуживает сочетание холелитиаза с заболеваниями печени. По имеющимся данным, наличие хронического заболевания печени увеличивает вероятность развития ЖКБ в 1,2–5 раз. При этом распространенность холелитиаза растет пропорционально увеличению класса печеночной недостаточности по Чайлду — Пью [6]. Корреляция была установлена для вирусных гепатитов В и С, что, вероятно, связано с прямым повреждающим действием вируса на клетки стенки желчного пузыря. В отношении алкогольной болезни печени однозначные выводы сделать сложно ввиду противоречивости данных, свидетельствующих либо об отсутствии влияния алкоголя на литогенез, либо о его профилактическом потенциале в умеренных дозах [14–17].
Наиболее сильная взаимосвязь определена для холелитиаза и неалкогольной жировой болезни печени (НАЖБП), особенно у пациентов женского пола. При наличии ЖКБ распространенность НАЖБП в 2 раза выше, чем в общей популяции [18], так же как и выше распространенность воспалительной формы заболевания — неалкогольного стеатогепатита [19]. Примечательно, что холецистэктомия не решает проблему, а является независимым фактором риска НАЖБП [20].
В свою очередь, НАЖБП — это независимый фактор риска ЖКБ, который увеличивает вероятность заболевания более чем на 50% [20]. Дополнительными факторами, способствующими камнеобразованию у этих пациентов, являются старший возраст, высокие значения индекса массы тела и женский пол [21]. При этом распространенность холелитиаза прогрессивно увеличивается по мере возрастания стадии НАЖБП [22] и стадии фиброза: на стадии 0–II составляет 15%, на стадии III — 29%, а на стадии IV (цирроз) — 56% [19].
Ключевые аспекты патогенеза ЖКБ и коморбидной патологии
Образование холестериновых камней в желчном пузыре неразрывно связано с нарушением обмена холестерина. Холестерин в организм поступает извне с пищей, а также синтезируется в печени (эндогенный холестерин). Пищевой холестерин всасывается в тонкой кишке в кровь. Попав в системный кровоток, в составе липопротеидов низкой плотности, хиломикронов и липопротеидов высокой плотности он доставляется в гепатоциты. Абсорбированный и синтезированный холестерин составляет пул внутрипеченочного холестерина. Далее его метаболизм осуществляется тремя путями. Холестерин подвергается этерификации и депонируется в гепатоцитах, включается в состав липопротеидов очень низкой плотности и поступает в системный кровоток, используется для синтеза желчных кислот, в составе которых затем выводится с желчью; секретируется с желчью в неизмененном виде. Регуляция синтеза холестерина, желчных кислот и секреции холестерина с желчью осуществляется через фарнезоидные Х-рецепторы. Попадая вместе с желчью в желчные канальцы, холестерин, желчные кислоты и фосфолипиды формируют простые мицеллы (1–2 нм), смешанные мицеллы (4–8 нм), небольшие однослойные везикулы (40–100 нм) или большие многослойные везикулы (300–500 нм) [23].
В формировании холестериновых камней ключевая роль принадлежитинсулинорезистентности, гипергликемии / сахарному диабету, дислипидемии и ожирению [8]. На фоне инсулинорезистентности повышается синтез эндогенного холестерина в печени и его секреция с желчью, что ведет к перенасыщению последней холестерином; нарушается обратный транспорт холестерина в печень в составе липопротеидов высокой плотности; снижается уровень желчных кислот, препятствующих камнеобразованию; отмечается нарушение моторики и эвакуаторной функции желчного пузыря [4, 19]. Аналогичное негативное влияние на опорожнение желчного пузыря, синтез холестерина и состав желчи оказывают гипертриглицеридемия, сахарный диабет и ожирение [21]. Таким образом эти факторы риска реализуют свой литогенный потенциал.
Перенасыщение холестерином и стаз желчи создают условия для образования кристаллов холестерина в просвете желчного пузыря — нуклеации. Ускоряют этот процесс повышенная секреция муцина в просвет желчного пузыря и воспаление его стенки, развивающееся с участием таких медиаторов, как интерлейкин (ИЛ) 6, ИЛ-10, ИЛ-12 (р70), ИЛ-13, фактор некроза опухоли альфа (ФНО-α) и ряд других [24].
Агрегация кристаллов холестерина и их конгломерация с муцином ведут к образованию микроскопических камней, из которых со временем формируются холестериновые камни.
Дополнительными патогенетическими факторами, способствующими реализации данного патогенетического каскада, могут быть определенные генетические полиморфизмы, повышенное всасывание пищевого холестерина и реабсорбция желчного холестерина, вялая перистальтика кишечника, изменение качественного и количественного состава кишечной микробиоты [4].
Более высокая распространенность ЖКБ у женщин обусловлена влиянием эстрогенов, заключающимся в повышении синтеза холестерина и снижении образования желчных кислот [4].
С точки зрения патогенеза связь холелитиаза с сердечно-сосудистыми и цереброваскулярными заболеваниями объясняется общими патогенетическими факторами инсулинорезистентностью, ожирением, сахарным диабетом / гипергликемией, дислипидемией, воспалением и общими генетическими полиморфизмами. В основе связи с онкологической патологией могут быть воспаление и нарушение оттока желчи [5, 6, 11, 19, 21].
При хронических заболеваниях печени повышенный риск камнеобразования в желчном пузыре связан с поражением гепатоцитов, следствием чего являются снижение синтеза и нарушение транспорта желчных кислот, уменьшение секреции аполипопротеинов АI и AII [6]. Немаловажная роль при этом может принадлежать воспалению, обусловливающему повреждение клеток печени и нарушение моторики желчных путей [25].
В основе коморбидности НАЖБП и холелитиаза прежде всего находятся общие метаболические нарушения — сахарный диабет 2 типа, центральное ожирение и инсулинорезистентность [18, 21]. Весомый вклад во взаимное отягчающее влияние двух заболеваний вносит воспаление, запускающее развитие стеатогепатита и фиброгенез в печени, а также поддерживающее литогенез в желчном пузыре [11, 22]. Кроме того, механизм камнеобразования при НАЖБП может быть запущен нарушением липидного обмена, угнетением окисления жирных кислот и усилением липогенеза [26].
После холецистэктомии меняется метаболизм желчных кислот и их регулирующее влияние на обмен глюкозы и липидов в печени через фарнезоидные Х-рецепторы и TGR5. Кроме того, снижается уровень фактора роста фибробластов 19 (FGF19), регулирующего синтез желчных кислот и липогенез в печени, который секретируется преимущественно слизистой оболочкой желчного пузыря [27–29]. Все это может стать причиной развития НАЖБП.
Таким образом, можно констатировать, что образование холестериновых камней в желчном пузыре является следствием сочетанного влияния целого ряда местных и общих факторов, а саму ЖКБ следует рассматривать как проявление системных нарушений метаболического и воспалительного генеза.
Актуальные терапевтические мишени
В соответствии с последними рекомендациями Российской гастроэнтерологической ассоциации [2] при бессимптомном течении ЖКБ показаны наблюдательная тактика, коррекция питания и образа жизни. Следует придерживаться низкоуглеводной диеты, богатой растительным белком, грубой клетчаткой и растительными маслами. Допускается умеренное потребление алкоголя (при отсутствии других противопоказаний). Также необходима адекватная физическая активность, целью которой являются достижение и поддержание нормальной массы тела.
При появлении клинических симптомов методом выбора становится хирургическое лечение — холецистэктомия, которая выполняется открытым или лапароскопическим доступом. Риски для жизни и здоровья пациента, связанные с выполнением холецистэктомии, невысокие. Смертность после операции составляет менее 1%, постхолецистэктомический синдром развивается примерно у 10% пациентов. Возможные негативные последствия холецистэктомии связаны с потерей желчного пузыря как естественного резервуара и нарушением транскишечного транспорта желчных кислот и их сигнальной функции через фарнезоидные Х-рецепторы [4]. Кроме того, после перенесенной холецистэктомии имеет место риск развития НАЖБП.
У ограниченного числа пациентов возможно применение неинвазивного метода — чрескожной ударно-волновой литотрипсии.
У некоторых пациентов может быть применен пероральный литолиз с использованием урсодезоксихолевой кислоты (УДХК) при соблюдении определенных условий: наличии холестериновых камней диаметром менее 20 мм и при функционирующем желчном пузыре [2].
Вопрос назначения УДХК для первичной профилактики камнеобразования является дискуссионным. Тем не менее в рандомизированном контролируемом исследовании было продемонстрировано достоверное снижение риска камнеобразования на фоне приема в течение 24 мес. УДХК после выполнения хирургической операции по формированию обходного желудочного анастомоза [30]. Ряд специалистов считают возможным назначение УДХК коротким курсом с профилактической целью при высоком риске билиарного сладжа или камнеобразования, например после быстрого значительного похудания или бариатрической операции [7]. Этот тезис находит отражение в клинических рекомендациях Европейской ассоциации по изучению болезней печени [3].
Урсодезоксихолевая кислота
УДХК в настоящее время широко применяется для перорального литолиза у пациентов с холелитиазом. Однако первое документальное подтверждение успешного растворения холестериновых камней связано с применением в 1972 г. другой желчной кислоты — хенодезоксихолевой (ХДХК) [31]. Обладая не меньшей эффективностью и повышенной безопасностью, более гидрофильная УДХК быстро заместила ХДХК в клинической практике и именно на основании ее применения сформирована современная база знаний в области перорального литолиза [8].
История использования УДХК для лечения ЖКБ берет свое начало в Китае, где столетиями применяли желчь взрослых черных медведей для лечения различных гепатобилиарных расстройств [8]. В начале XX в. из желчи белого медведя была выделена ХДХК, которая первоначально получила название «урсохолеиновая кислота». В 1927 г. из желчи медведя была выделена собственно УДХК. Название происходит от латинского «urso» (медведь) и связано с тем, что УДХК является основной желчной кислотой медвежьей желчи [32].
УДХК представляет собой гидрофильную желчную кислоту. Ее основные фармакологические эффекты при холелитиазе связаны со способностью снижать насыщение желчи холестерином за счет подавления его кишечной абсорбции и реабсорбции, угнетения синтеза в печени и уменьшения секреции в желчь. Кроме того, УДХК уменьшает всасывание гидрофобных эндогенных желчных кислот из тонкой кишки, растворяет их соли и оказывает желчегонное действие. Это обеспечивает защиту клеточных мембран от их токсического влияния и предотвращает холестаз [8, 33, 34].
Диапазон доз УДХК, имеющих доказанную эффективность при растворении холестериновых камней, находится в пределах 8–10 мг на 1 кг массы тела. При превышении максимальной дозы эффективность действия не увеличивается [32]. В клинических исследованиях была продемонстрирована возможность растворения холестериновых камней и уменьшения их на 1 мм в месяц в 30–60% случаев [35–37]. Полное растворение мелких камней (<5 мм) через 6 мес. отмечалось в 90% случаев [38]. В исследовании, где УДХК назначалась в дозе 600 мг/сут в течение месяца пациентам с холестериновыми камнями диаметром менее 15 мм, полное растворение было достигнуто в 43,2% случаев, частичное — в 16,2% [39]. В другом исследовании применение УДХК при билиарном сладже в течение 3–6 мес. предотвращало камнеобразование [37]. В многолетнем исследовании было продемонстрировано, что назначение УДХК способствует снижению частоты билиарной боли и холецистита независимо от растворения камней [40].
Урсодезоксихолевая кислота в комбинации с глицирризиновой кислотой
Несмотря на широкую доступность и хорошие результаты хирургического лечения ЖКБ, пероральный литолиз сохраняет свою целевую популяцию пациентов, что обусловливает актуальность оптимизации существующих терапевтических подходов. Современные представления об этиологии и патогенезе ЖКБ, а также коморбидной патологии свидетельствуют о необходимости комплексного подхода к медикаментозному растворению холестериновых камней. Лекарственная терапия должна иметь определенные свойства:
действовать на наиболее значимые с точки зрения развития и прогрессирования холелитиаза терапевтические мишени;
оказывать местное действие на желчеобразование и желчевыделение и системное — на метаболические процессы и развитие воспалительных реакций в организме;
быть тропной к тканям органов желчевыделения, печени, а возможно, и другим тканям.
В качестве наиболее актуальных точек приложения лекарственных препаратов для перорального литолиза в настоящее время рассматриваются:
ингибирование синтеза холестерина в печени;
угнетение всасывания холестерина в кишечнике;
воздействие на фарнезоидные Х-рецепторы;
подавление секреции холестерина с желчью;
модификация кишечной микробиоты;
нормализация моторики желчного пузыря;
подавление продукции медиаторов воспаления [4].
Поиск таких лекарственных препаратов может идти двумя путями: 1) разработка и синтез принципиально новых молекул, обладающих перечисленными фармакологическими эффектами; 2) создание новых комбинаций хорошо изученных действующих веществ с объединением и усилением необходимых свойств.
В качестве одного из возможных решений в области совершенствования перорального литолиза следует рассматривать фиксированную комбинацию УДХК и глицирризиновой кислоты (ГК).
ГК, или глицирризин, является сапонином корня солодки, который используется в медицине уже более 3000 лет. Более того, солодка включена в состав ряда препаратов традиционной китайской медицины, применяемых в терапии ЖКБ с целью купирования воспаления и восстановления функции печени [21, 41].
Химическое строение ГК было установлено в 1930-х гг. [42]. Она является амфифильной молекулой, гидрофильная часть которой представлена двумя остатками глюкуроновой кислоты, а гидрофобная — остатком глицирретовой кислоты [41].
В контексте применения при ЖКБ среди известных эффектов ГК наибольший интерес представляют противовоспалительный, гепатопротекторный, антифибротический и антиканцерогенный.
Противовоспалительное действие связано с ингибированием медиаторов воспаления — ИЛ-1β, ИЛ-6, ФНО-α, простагландина Е2, а также с антиоксидантным эффектом, выражающимся в ингибировании реактивных кислородных частиц. Гепатопротекторное действие реализуется через угнетение некроза и апоптоза клеток печени за счет подавления активности ФНО-α и каспазы-3 соответственно. Также ГК оказывает прямое воздействие на гепатоциты, предотвращая патологические изменения проницаемости клеточных мембран. Замедление прогрессирования фиброза печени при введении ГК объясняется подавлением продукции коллагена звездчатыми клетками, а также разрушением активированных клеток Ито через систему натуральных киллеров. Антиканцерогенный эффект связан с запуском механизмов апоптоза раковых клеток [41, 43, 44].
Иногда обсуждается вопрос о токсичности ГК со ссылками на единичные сообщения в источниках невысокого качества, без доказанной связи таких случаев с применением этого вещества. Убедительным опровержением и свидетельством того, что ГК не является токсичным веществом, может служить тот факт, что в исследовании с участием здоровых добровольцев пероральный прием ГК в дозе 2 мг/кг в сутки в течение 8 нед. не вызывал никаких токсических эффектов [45]. Косвенно это подтверждается и тем, что в США и Евросоюзе ГК в меньших, чем терапевтические, дозах разрешена для повседневного использования как пищевая добавка и в косметологии [46, 47].
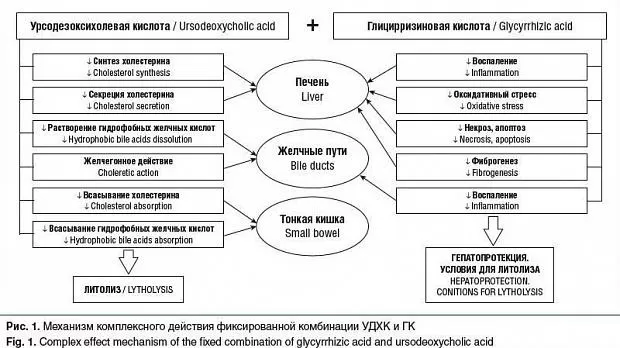
Рациональность комбинации УДХК и ГК для перорального литолиза обусловлена возможностью суммирования их фармакологических эффектов. УДХК преимущественно оказывает воздействие на местный обмен холестерина и желчных кислот, а также улучшает функциональное состояние желчных путей. Тем самым она влияет непосредственно на процесс камнеобразования, угнетая его и способствуя растворению камня. Что касается ГК, то она формирует благоприятные условия для реализации литолитического действия УДХК и нейтрализует сопутствующие ЖКБ патологические процессы в печени и других органах. Так, местный противовоспалительный эффект служит дополнительным защитным фактором в отношении литогенеза и триггером для литолиза. Одновременное влияние на патологические процессы в печени предотвращает прогрессирование как заболеваний печени на фоне ЖКБ, так и ЖКБ на фоне болезни печени. Подавляя воспаление на системном уровне, ГК обладает потенциалом для снижения рисков, связанных с развитием коморбидной патологии. Схема комплексного механизма действия УДХК и ГК при холестериновых камнях представлена на рисунке 1.
В 2019 г. впервые в России и в мире была зарегистрирована фиксированная комбинация ГК и УДХК в форме капсул, содержащих действующие вещества в количестве 35 мг и 250 мг соответственно [48]. На доклиническом этапе исследований на модели холестаза было установлено, что фиксированная комбинация в сравнении с монопрепаратом УДХК эффективнее влияет на динамику активности аланинаминотрасферазы, аспартатаминотрасферазы, γ-глутамилтранспептидазы, щелочной фосфатазы, уровня прямого и непрямого билирубина, а также на гистологическую картину печени. На основании этого был сделан вывод о синергическом действии ГК и УДХК в составе фиксированной комбинации. Лекарственный препарат прошел клинические исследования в объеме, регламентированном действующим законодательством в сфере обращения лекарственных средств, и в соответствии с правилами надлежащей клинической практики. Комбинация запатентована в качестве средства для лечения и профилактики острого и хронического гепатита и холестаза [49] и согласно официальной инструкции по медицинскому применению может назначаться при ЖКБ в целях перорального литолиза.
Заключение
ЖКБ является местным проявлением системных метаболических нарушений и воспаления в организме. В качестве коморбидной патологии оказывает влияние на развитие, прогрессирование и исходы сердечно-сосудистых, цереброваскулярных заболеваний, болезней печени и рака. Хирургическое лечение, несмотря на доступность и эффективность, не решает всех проблем. Пероральный литолиз сохраняет свою актуальность и нуждается в оптимизации, основным направлением которой является обеспечение комплексного воздействия. Одним из решений может быть недавно зарегистрированная в РФ фиксированная комбинация УДХК и ГК. Препарат может быть использован: у пациентов с билиарным сладжем; пациентов с холестериновыми камнями размером менее 20 мм и функционирующим желчным пузырем — бессимптомных и имеющих клинические симптомы, при невозможности хирургического лечения; в послеоперационном периоде после холецистэктомии для снижения риска камнеобразования в желчных протоках; у пациентов с повышенным риском камнеобразования для первичной профилактики. В настоящее время в условиях реальной клинической практики продолжается изучение долгосрочной эффективности и безопасности препарата, в т. ч. у различных групп пациентов, а также при коморбидных заболеваниях.
Список литературы:
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.
















.jpg)




.png)















Комментарии