- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Документы и приказы: Эозинофильный эзофагит. Взрослые. Клинические рекомендации 2025 - 2027
Полный текст статьи:
Министерство
Здравоохранения
Российской Федерации
Клинические рекомендации Эозинофильный эзофагит
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: K20
Год утверждения (частота пересмотра): 2025 Пересмотр не позднее: 2027
ID: 1000_1
Возрастная категория: Взрослые, Дети
Специальность:
Разработчик клинической рекомендации Российская ассоциация аллергологов и клинических иммунологов, Союз педиатров России, Российская Гастроэнтерологическая Ассоциация, Общероссийская общественная организация "Российское научное медицинское общество терапевтов", Автономная некоммерческая организация "Общество детских гастроэнтерологов, гепатологов и нутрициологов", Общероссийская общественная организация "Российское общество патологоанатомов", Ассоциация "Эндоскопическое общество "РЭндО", Российское общество профилактики неинфекционных заболеваний, Ассоциация детских аллергологов и иммунологов России
Одобрено Научно-практическим Советом Минздрава России
Оглавление
· Список сокращений
· Термины и определения
· 1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
· 1.1 Определение заболевания или состояния (группы заболеваний или состояний)
· 1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
· 1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
· 1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
· 1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
· 1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
· 2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
· 2.1 Жалобы и анамнез
· 2.2 Физикальное обследование
· 2.3 Лабораторные диагностические исследования
· 2.4 Инструментальные диагностические исследования
· 2.5 Иные диагностические исследования
· 3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
· 4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
· 5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
· 6. Организация оказания медицинской помощи
· 7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
· Критерии оценки качества медицинской помощи
· Список литературы
· Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
· Приложение А2. Методология разработки клинических рекомендаций
· Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
· Приложение Б. Алгоритмы действий врача
· Приложение В. Информация для пациента
· Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Список сокращений
|
АтД |
Атопический дерматит |
|
АР |
Аллергический ринит |
|
БА |
Бронхиальная астма |
|
ВЗК |
Воспалительные заболевания кишечника |
|
ГЭРБ |
Гастроэзофагеальная рефлюксная болезнь |
|
ГКС |
Глюкокортикоиды |
|
ЖКТ |
Желудочно-кишечный тракт |
|
ИПН |
Ингибиторы протонного насоса |
|
ИЛ (IL) |
Интерлейкин |
|
НПС |
Нижний пищеводный сфинктер |
|
УДД |
Уровень достоверности доказательств |
|
УУР |
Уровень убедительности рекомендаций |
|
ЭоЭ |
Эозинофильный эзофагит |
|
ЭГДС |
Эзофагогастродуоденоскопия |
|
CRTh2 |
Молекула, гомологичная хемоаттрактантному рецептору |
|
FLG |
Филаггрин |
|
Ig |
Иммуноглобулин |
|
ILC2 |
Лимфоидные клетки 2 типа |
|
PGD |
Простагландин |
|
TGF |
Фактор роста опухолей |
|
Th |
Т-хелперы |
|
TNF |
Фактор некроза опухоли |
|
TSLP |
Thymic stromal lymphopoietin (тимический стромальный лимфопоэтин) |
|
TSLPR |
Thymic stromal lymphopoietin receptor (рецептор к тимическому стромальному лимфопоэтину) |
# – Применение лекарственного препарата в соответствии с показателями (характеристиками), не указанными в инструкции по его применению (off-label), осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), при условии подписанного информированного добровольного согласия одним из родителей или иным законным 4 представителем и несовершеннолетним в возрасте старше 15 лет или несовершеннолетним больным наркоманией в возрасте старше 16 лет (согласно ФЗ №323-ФЗ от 21.11.2011г).
** – Препарат входит в перечень жизненно необходимых и важнейших лекарственных препаратов (Распоряжение Правительства РФ от 12.10.2019 № 2406-р «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, перечня лекарственных препаратов для медицинского применения, в том числе лекарственных препаратов для медицинского применения, назначаемых по решению врачебных комиссий медицинских организаций, перечня лекарственных препаратов, предназначенных для обеспечения лиц, больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, гемолитико-уремическим синдромом, юношеским артритом с системным началом, мукополисахаридозом I, II и VI типов, лиц после трансплантации органов и (или) тканей и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи» (с изменениями на 15 января 2025 года)
Термины и определения
Не применяются.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Эозинофильный эзофагит – хроническое, медленно-прогрессирующее иммуноопосредованное (Т2 типа) заболевание пищевода, характеризующееся выраженной эозинофильной инфильтрацией слизистой оболочки пищевода (15 и более эозинофильных лейкоцитов в поле зрения микроскопа высокого разрешения при увеличении х 400 или более 60 в 1 мм2), развитием субэпителиального и подслизистого фиброза, клинически проявляющееся дисфункцией пищевода (дисфагия, обтурация пищевода пищевым комком, рвота проглоченной пищей и др.) [1-10].
Диагноз «эозинофильный эзофагит» следует дифференцировать с другими заболеваниями, сопровождающимися эозинофилией пищевода (например, паразитарные и грибковые инфекции, болезнь Крона, гиперэозинофильный синдром, ахалазия, системные заболевания соединительной ткани и др.). Наряду с эозинофилами в процесс воспаления при ЭоЭ вовлечены различные субпопуляции лейкоцитов (лимфоциты, тучные клетки), эпителиальные клетки, фибробласты, гладкомышечные клетки и другие. Указание же в названии заболевания на эозинофильный характер воспаления призвано подчеркнуть появление и преобладание в составе инфильтрата в слизистой оболочке пищевода нехарактерных для данного отдела пищеварительной трубки клеток лейкоцитарного ряда – эозинофилов [21].
Важно, что из определения ЭоЭ исключен термин «антиген-опосредованное» заболевание, использовавшийся ранее [21]. Согласно накопленным на сегодняшний день данным, не существует однозначного представления о том, что служит триггером развития эозинофильного воспаления в слизистой оболочке пищевода: воздействие пищевых и респираторных антигенов на иммунокомпрометированный организм или же нарушение барьерной функции слизистой оболочки пищевода, способствующее более глубокому проникновению экзогенных антигенов в толщу слизистой оболочки и инициации иммунного воспаления.
Более того, было показано, что терапия ингибиторами протонного насоса, восстанавливая целостность эпителиального барьера, во многих случаях приводит не только к клинической, но и к гистологической ремиссии ЭоЭ. По этой же причине эзофагеальную эозинофилию, разрешающуюся при терапии ИПН, решено более не относить к отдельной нозологической форме, поскольку клинически, эндоскопически, гистологически и даже генетически она неотличима от ЭоЭ и, по всей видимости, является фенотипическим подтипом ЭоЭ [21].
Заболевание имеет относительно невысокую распространенность, которая по усредненным оценкам составляет 10-40 на 100000 человек [10]. Однако его развитие существенно нарушает качество жизни пациентов за счет характерных симптомов – дисфагии, острых эпизодов вклинения пищи в пищевод [1,2,3].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
В настоящее время ЭоЭ рассматривается как Т2-ассоциированное воспалительное заболевание, характеризующееся эозинофильной инфильтрацией, рубцеванием и сужением просвета пищевода, а также его дисфункцией. Патогенез ЭоЭ обусловлен Т2-воспалением на всех стадиях заболевания от отека и экссудации слизистой оболочки пищевода до формирования стриктур. К факторам, играющим роль в формировании ЭоЭ, относятся [5,110,111,138]:
· генетическая предрасположенность к развитию иммунного ответа по пути активации Т-хелперов 2 типа;
· нарушение барьерной функции слизистой оболочки пищевода (воспаление, расширение межклеточных пространств, нарушение синтеза белков плотных контактов), способствующее более глубокой пенетрации антигенов в толщу слизистой оболочки;
· сенсибилизация к респираторным и пищевым антигенам.
У детей определенную роль могут играть перинатальные факторы риска: лихорадочные состояния матери во время беременности, недоношенность, рождение путем кесарева сече-ния; после родов – антибиотикотерапия [185]. ЭоЭ достоверно чаще наблюдается у детей с врожденной атрезией пищевода в анамнезе (9,5%-17%) [186].
Роль T2 воспаления является центральной в понимании патогенеза ЭоЭ.
Этиопатогенез ЭоЭ связан с вовлечением звеньев адаптивного и врожденного иммунитета. При воздействии респираторных и пищевых аллергенов на слизистую оболочку пищевода у лиц с имеющейся генетической предрасположенностью к атопии и/или нарушением эпителиального барьера происходит высвобождение эпителиальных цитокинов (аларминов) TSLP, ИЛ-25, ИЛ-33, которые приводят к усилению функций антигенпрезентирующих клеток. Антигенпрезентирующие клетки поглощают антиген, процессируют его и в последующем представляют Т0-лимфоцитам, что приводит к их активации и дифференцировке в Т2-лимфоциты, синтезирующие ИЛ-4, ИЛ-5, ИЛ-13, ИЛ-9. ИЛ-4 вызывает пролиферацию В-лимфоцитов, играет роль в переключении синтеза антител на изотип IgE. IgE, синтезированные плазматическими клетками, фиксируются на высокоаффинных рецепторах FcέRI на мембране тучных клеток. При повторном контакте происходит перекрестное связывание антител с аллергеном, что приводит к дегрануляции тучных клеток и высвобождению преформированных медиаторов, в первую очередь, гистамина, и возникновению гистамин-опосредованных реакций. Воспаление в дальнейшем усиливается при образовании вновь синтезируемых медиаторов (производных арахидоновой кислоты). В то же время, согласно современным представлениям, IgE-зависимый механизм не играет ведущую роль в патогенезе ЭоЭ. Кроме того, ИЛ-4 участвует в дифференцировке T0-лимфоцитов в Т2-лимфоциты.
Наряду с этим в процесс вовлекаются звенья врожденного иммунитета – врожденные лимфоидные клетки 2 типа (ILC2). Данные клетки продуцируют аналогичный спектр цитокинов, за исключением ИЛ-4.
Перечисленные выше цитокины играют ключевую роль в развитии Т2- воспаления при ЭоЭ: их уровень коррелирует со степенью эозинофилии слизистой пищевода. ИЛ-5 является важным фактором, обуславливающим выживаемость и увеличение продолжительности жизни эозинофилов, а также, как и ИЛ-4 и ИЛ-13, способствует миграции эозинофилов в ткани. Известно, что ИЛ-13, оказывая влияние на эпителиальные клетки, приводит к увеличению синтеза эотаксина 3, который является эозинофил-активирующим хемокином, и периостина. Кроме того, ИЛ-13 приводит к гиперплазии базальных клеток, отложению коллагена, ремоделированию ткани, повреждению эпителиального барьера за счет снижения экспрессии десмосомального протеина десмоглеина [138,139]. У пациентов с ЭоЭ отмечается повышенная экспрессия ИЛ-13.
Таким образом формируется эозинофильная инфильтрация стенки, и в первую очередь – слизистой оболочки пищевода. Происходит дегрануляция эозинофилов, высвобождение белков с ферментативной активностью, в том числе главного основного белка, обладающего свойствами гистаминазы, катионного белка, эозинофильной пероксидазы, эозинофильного нейротоксина. Протеолитические ферменты эозинофилов оказывают выраженное деструктивное действие на эпителий, собственную пластинку слизистой оболочки пищевода и подслизистый слой (рисунок 1).
Рисунок 1. Патогенез эозинофильного эзофагита (адаптировано с O'Shea KM, Aceves SS, Dellon ES, Gupta SK, Spergel JM, Furuta GT, Rothenberg ME. Pathophysiology of Eosinophilic Esophagitis. Gastroenterology. 2018): факторы внешней среды (пищевые, воздушные антигены, микроорганизмы), контактируя с антигенпрезентирующими клетками в слизистой оболочке пищевода, стимулируют продукцию цитокинов (ИЛ-4, тимический стромальный лимфопоэтин (TSLP)). Данные цитокины детерминируют дифференцировку наивных Т-лимфоцитов по пути образования Т-хелперов 2 типа. Секреция Т-хелперами 2 типа цитокинов (ИЛ-13, ИЛ-5 и др.) запускает каскад иммунологических реакций с участием эозинофилов, мастоцитов, В-лимфоцитов и др.
Повреждение слизистой оболочки и подслизистого слоя пищевода иммунокомпетентными клетками постепенно приводит к вовлечению в процесс фибробластов, миоцитов и эндотелиоцитов, развитию гиперплазии базального слоя эпителия и гладкомышечных клеток, активации фиброзогенеза и ангионеогенеза в подслизистом слое, что обуславливает потерю эластичности соединительной и мышечной ткани, ремоделированию стенки пищевода, развитию стриктур [2,3,4,5,106].
Существует много фактов, свидетельствующих, что среди внешне-средовых триггеров развития ЭоЭ ведущую роль играют антигенные протеины (аллергены), индуцирующие T2-тип иммунных реакций. Специфическое аллергологическое обследование с использованием кожного тестирования и определения аллерген-специфических IgE выявило сенсибилизацию у 75-80% пациентов с ЭоЭ, что превышает общепопуляционные показатели в три раза. Среди сопутствующих ЭоЭ аллергических заболеваний регистрируются аллергический ринит (АР) у 40-80% больных, бронхиальная астма (БА) – у 14-75%, атопический дерматит (АД) – у 4-60 % пациентов. Нередко в анамнезе больных ЭоЭ отмечаются оральный аллергический синдром как проявление перекрестной пыльцевой/пищевой аллергии и клинические симптомы IgE-опосредованной пищевой сенсибилизации.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
По данным систематического обзора и метаанализа, опубликованного в 2023 г и оценивающего эпидемиологию эозинофильного эзофагита с 1976 по 2022 год в мире, заболеваемость ЭоЭ составляет на сегодняшний день 5,31 заболевших на 100000 человек в год (95% ДИ, 3,98-6,63; число исследований – 27, выборка 42191506 человек) [10].
ЭоЭ страдают преимущественно мужчины (75% больных) белой расы (более 90% больных). ЭоЭ встречается во всех возрастных группах, однако чаще в молодом возрасте (средний возраст больных составляет 36-42 года). Прослеживается определенная наследственная предрасположенность: наличие родственников первой степени родства с ЭоЭ повышает риск развития заболевания. ЭоЭ – это хроническое персистирующее заболевание, в связи с чем наблюдается неизбежный ежегодный прирост распространенности ЭоЭ. В среднем распространенность ЭоЭ составляет 40 случаев на 100 000 человек (95% ДИ, 31,10-48,98) [10,111,165].
Распространенность ЭоЭ значительно варьирует в зависимости от географического расположения страны: она максимальна в странах Западной Европы и Северной Америки, значительно ниже в Японии и Китае. Описаны случаи заболевания в Южной Америке, Корее, Турции, Ближнем Востоке, данных по распространенности ЭоЭ в Индии и странах Африки нет [5-16].
Распространенность ЭоЭ варьирует не только в различных географических зонах, но и в группах больных с различными клиническими симптомами. Так, среди лиц, прошедших ЭГДС, ЭоЭ обнаруживается в среднем у 2,4-6,6%. При этом у пациентов с рефрактерной изжогой ЭоЭ выявляется при проведении ЭГДС в 1-8% случаев, у больных с жалобами на некардиальную боль в грудной клетке – в среднем в 6%, у больных с абдоминальной болью – в 4%, при пищевой аллергии – в 5% случаев [10,112].
Среди пациентов с жалобами на дисфагию вероятность обнаружения ЭоЭ при эндоскопическом обследовании значительно выше – 12-23%. У больных с острыми эпизодами вклинения пищи в пищевод ЭоЭ диагностируется не менее чем в 50% случаев [10,112].
В России масштабные эпидемиологические исследования не проводились [5-16,106].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
K20 Эзофагит
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
В настоящее время отсутствует единая классификация эозинофильного эзофагита. С точки зрения клинической значимости стоит выделять эозинофильный эзофагит без осложнений и эозинофильный эзофагит с развитием стриктур и стенозов.
По степени клинико-морфологической активности заболевания выделяют (см. приложение Г4):
· Неактивный ЭоЭ;
· ЭоЭ слабой степени активности;
· ЭоЭ средней степени активности;
· ЭоЭ с высокой активностью.
Различают также 3 фенотипа (эндотипа) ЭоЭ [113,114]:
· Легкий (ЭoЭ1) – с нормальной эндоскопической картиной или слабо выраженными эндоскопическими и гистологическими изменениями, с хорошим ответом на лечение;
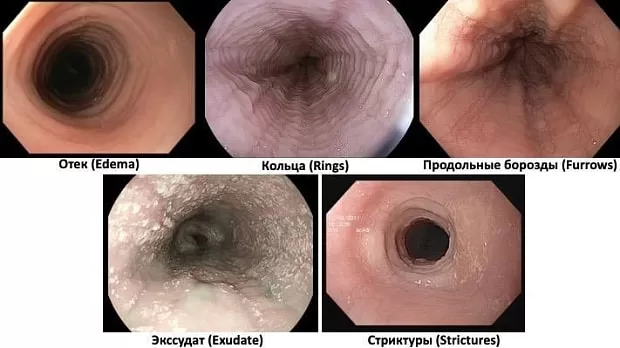
· Воспалительный фенотип (ЭoЭ2) – с выраженными воспалительными изменениями, выявляемыми при ЭГДС (отек, экссудат, продольные борозды), выраженной эозинофильной инфильтрацией, экспрессией воспалительных цитокинов, плохим ответом на терапию;
· Фибростенозирующий фенотип (ЭoЭ3) – с выраженными фибростенотическими изменениями стенки пищевода, выявляемыми при ЭГДС (кольца, стриктуры, стеноз), развитием фиброза (коллагеновых волокон) в подслизистом слое, обнаруживаемом при патологоанатомическом исследовании и наименьшей экспрессией генов эпителиальной дифференцировки.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Характер и выраженность жалоб значительно отличаются в зависимости от возраста пациента и продолжительности заболевания (таблица 1). Симптомы ЭоЭ у детей раннего возраста неспецифичны и включают срыгивания, тошноту и рвоту, возникающие во время еды, затруднения при проглатывании определенной пищи (орехи, яйца, сухое мясо и др.), боли в животе, отставание в физическом развитии (редко).
Дети подросткового возраста и взрослые предъявляют жалобы на необходимость длительно пережевывать пищу и запивать ее водой («медленно-едящие и много пьющие» пациенты), эпизоды застревания пищи при глотании, часто их беспокоят ГЭРБ -подобные жалобы: изжога и боли за грудиной [115].
Таблица 1. Симптомы ЭоЭ у детей и взрослых
|
Состояние |
Симптомы у детей первых лет жизни |
Симптомы у детей дошкольного и школьного возраста |
Симптомы у подростков /взрослых |
|
Нарушение проглатывания пищи |
Поперхивание при кормлении, повторные срыгивания |
Дисфагия |
Дисфагия |
|
Эпизоды вклинения пищи в пищевод |
Редко |
Часто |
Часто |
|
Дополнительные симптомы |
Рвота, вздутие живота, боли в животе |
Боль в животе/груди/горле, тошнота, рвота, изжога |
Упорная изжога, ощущение кома в горле |
|
Психо-эмоциональное состояние |
Беспокойный сон |
Беспокойный сон |
Может не меняться, но возможны страхи и фобии приема некоторых продуктов, нахождения в обществе |
|
Пищевое поведение |
Отказ от приема пищи |
Снижение аппетита, избирательный подход к еде, длительное пережевывание пищи, обильное питье во время еды, отказ от пищи |
Исключение из рациона твердых и объемных продуктов, измельчение пищи на маленькие кусочки, длительное пережевывание пищи |
|
Физическое развитие |
От отсутствия набора веса до дефицита массы и развития белково-энергетической недостаточности, возникает необходимость госпитализации для коррекции питания |
Наблюдается дефицит массы тела, вплоть до белково-энергетической и витаминной недостаточности, быстро компенсируется за счет назначения специальных смесей |
Колебания веса небольшие и некритичные, физическое развитие не страдает. |
Для детей характерен преимущественно воспалительный фенотип ЭоЭ, но в подростковом возрасте могут доминировать признаки фибростенотического фенотипа, обусловленного развитием стриктуры пищевода. Взрослые пациенты страдают от симптомов, свидетельствующих о прогрессирующем сужении просвета пищевода: дисфагия, загрудинные боли и эпизоды вклинения пищи в пищевод. Описаны также случаи спонтанного разрыва пищевода, возникшие у больных ЭоЭ на фоне обтурации пищевым комком (синдром Бурхаве) (рисунок 2) [18,20].
Рисунок 2. Симптомы ЭоЭ у детей и взрослых (адаптировано с O'Shea KM, Aceves SS, Dellon ES, Gupta SK, Spergel JM, Furuta GT, Rothenberg ME. Pathophysiology of Eosinophilic Esophagitis. Gastroenterology. 2018)
Дисфагия у пациентов с ЭоЭ может возникать остро (при застревании пищевого комка твердой консистенции) или беспокоить пациентов постоянно, вынуждая изменять пищевое поведение [1,3,4,17-21,166,167].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза заболевания/состояния:
Диагноз «эозинофильный эзофагит» устанавливают при выявлении совокупности:
· клинических симптомов дисфункции пищевода (дисфагия и/или вклинение пищи в пищевод – у взрослых; рвота, упорные срыгивания, трудности при кормлении и глотании, абдоминальная боль – у детей);
· характерной эндоскопической картины (отек, кольца, экссудат, продольные борозды, стриктуры);
· патоморфологического подтверждения эозинофильной инфильтрации пищевода (с количеством эозинофилов 15 и более в поле зрения при большом увеличении (х400) – (или ≥15 эозинофилов/0,3 мм2 или >60 эозинофилов/мм2 при отсутствии других причин эозинофилии пищевода) [1,2,21,116,166,167,168].
Комментарии: Проведение эндоскопического исследования пищевода у лиц с характерной симптоматикой с обязательным выполнением патологоанатомического исследования не менее 6 биоптатов из дистального и среднего/проксимального отделов пищевода является обязательным диагностическим минимумом для установления диагноза «эозинофильный эзофагит».
Патологоанатомическое исследование включает осмотр биоптатов, окрашенных гематоксилином и эозином. Главным критерием установления диагноза ЭоЭ служит интраэпителиальная эозинофильная инфильтрация с количеством эозинофилов в поле зрения микроскопа высокого разрешения 15 и более при увеличении х 400 (или ≥15 эозинофилов/0,3 мм2 или >60 эозинофилов/мм2) [116].
Важно, что факт обнаружения большого количества эозинофилов в слизистой оболочке пищевода не может служить единственным критерием диагноза «эозинофильный эзофагит». Существует ряд заболеваний, протекающих с эзофагеальной эозинофилией: ГЭРБ, эозинофильный гастроэнтерит, целиакия, болезнь Крона, лучевой и инфекционный эзофагит (грибковые и паразитарные инфекции), гиперэозинофильный синдром, лекарственный эзофагит, васкулиты, ахалазия кардии, системные заболевания соединительной ткани, злокачественные опухоли (таблица 2) [1,2,3,21].
Таблица 2. Заболевания, ассоциированные с эозинофилией пищевода [1,21,116]
|
Заболевание |
Диагностические критерии |
|
Эозинофильный гастроэнтерит или колит |
Эозинофильная инфильтрация слизистой оболочки желудка и двенадцатиперстной кишки, толстой кишки |
|
Болезнь Крона |
Экстраэзофагеальные поражения, подтвержденные данными колоноскопии, компьютерной томографии, морфологического исследования |
|
Паразитарные и грибковые инфекции |
Экстраэзофагеальные симптомы и данные микробиологических исследований (крови, стула, слюны и т.д.) |
|
Ахалазия |
Клинические особенности (дисфагия, рвота), данные манометрии пищевода, рентгенологического исследования пищевода |
|
Гиперэозинофильный синдром |
Число эозинофилов в периферической крови >1,5 x 109/л, эозинофильно-обусловленные поражения внутренних органов (сердечно-сосудистая система, нервная система, кожа, желудочно-кишечный тракт, дыхательная система) |
|
Лекарственная гиперчувствительность |
Сыпь, лихорадка, лимфаденопатия, мультиорганные поражения, разрешение симптоматики после отмены лекарственного препарата |
|
Целиакия |
Данные морфологического исследования слизистой оболочки тонкой кишки, данные серологического исследования (антитела к тканевой трансглутаминазе, эндомизию) |
|
Васкулиты; Пемфигоид; Системные заболевания соединительной ткани; Болезнь трансплантат против хозяина |
Системные проявления |
Таким образом, диагноз «эозинофильный эзофагит» может быть установлен только по совокупности клинических симптомов дисфункции пищевода и патологоанатомического подтверждения эозинофильной инфильтрации пищевода, после обязательного исключения заболеваний, сопровождающихся эозинофилией пищевода (алгоритм диагностики представлен в Приложении Б).
2.1 Жалобы и анамнез
· Рекомендуется тщательно оценить жалобы и анамнез пациента с подозрением на эозинофильный эзофагит, так как эти данные служат неотъемлемой, а в ряде случаев критически важной частью обследования пациентов [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Клинические проявления ЭоЭ (подробно описаны в разделе 1.6 настоящих рекомендаций) у взрослых пациентов и подростков включают дисфагию при приеме твердой пищи, необходимость длительно жевать пищу, измельчать и блендировать, обильно запивать пищу жидкостью, эпизоды вклинения пищи в пищевод (эпизоды острой обтурационной дисфагии), загрудинную боль, не связанную с глотанием. Для детей раннего и дошкольного возраста более характерны жалобы на срыгивание съеденной пищей, изжогу и отрыжку, рвоту, боль в животе, частый отказ от пищи, задержка физического развития [21-26]. Разработаны опросники для оценки тяжести и активности симптомов, эффективности терапии ЭоЭ (см. приложение Г1).
2.2 Физикальное обследование
· Пациентам с подозрением на эозинофильный эзофагит рекомендуется физикальное обследование (осмотр кожных покровов, перкуссия, пальпация, аускультация при заболеваниях пищевода, желудка, двенадцатиперстной кишки и органов дыхания), измерение массы тела и роста для определения нутритивного статуса и признаков атопических заболеваний [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Характерные изменения в объективном статусе пациента с ЭоЭ отсутствуют. Однако, при внимательном физикальном обследовании могут быть обнаружены дефицит питания, отставание в физическом развитии, наличие признаков атопических заболеваний кожи, пищевой аллергии, заболеваний органов дыхания (бронхиальная астма). Несмотря на поражение слизистой оболочки пищевода, изменения слизистой оболочки полости рта отсутствуют.
2.3 Лабораторные диагностические исследования
· Пациентам с подозрением на эозинофильный эзофагит рекомендуется выполнить общий (клинический) анализ крови развернутый для исключения других заболеваний, сопровождающихся эозинофилией пищевода, оценки эозинофилии периферической крови [115].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: При проведении общего (клинического) развернутого анализа крови эозинофилия наблюдается у 5-50% пациентов с ЭоЭ [116]. Эозинофилия не является специфичной только для ЭоЭ, в связи с чем этот показатель необходимо оценивать с учетом возраста пациента, наличия аллергических заболеваний, времени года (цветение трав и деревьев) и других факторов, способных повлиять на изменение числа эозинофилов в крови [115].
2.4 Инструментальные диагностические исследования
· Всем пациентам с подозрением на эозинофильный эзофагит рекомендовано проведение ЭГДС с диагностической целью [1,21,117,166,167].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Эндоскопическая шкала EREхFS (приложение Г3, приложение А3, рисунки 1, 1а, 1б,1в,1г,1д), оценивает 5 главных эндоскопических признаков ЭоЭ (Edema-отек, Rings-кольца, Exudates-экссудат, Furrows-борозды, Strictures-стриктуры) в баллах [33,118,119,120,121,188]. У 10=25% пациентов с ЭоЭ при эндоскопии пищевода видимых патологических изменений не определяется [117], в связи с чем эндоскопическое исследование пищевода не может служить единственным критерием установления диагноза ЭоЭ без патологоанатомического исследования биоптатов из пищевода [122,123]
· Всем пациентам с подозрением на эозинофильный эзофагит рекомендовано при ЭГДС проводить биопсию пищевода с помощью эндоскопии с забором не менее 6 биоптатов из наиболее изменённых участков слизистой оболочки (по 3 из дистального и среднего/проксимального отделов пищевода) с целью установления диагноза [1,21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Всем пациентам с подозрением на ЭоЭ при проведении ЭГДС должна быть выполнена множественная биопсия пищевода с помощью эндоскопии.
Показаниями для проведения биопсии пищевода с помощью эндоскопии служат:
1. Эндоскопическая картина, характерная для эозинофильного эзофагита;
2. Наличие характерных клинических симптомов ЭоЭ даже в случае нормальной эндоскопической картины;
3. Симптомы ГЭРБ у детей (изжога, загрудинная боль, срыгивание), рефрактерные к терапии ИПН, даже в случае нормальной эндоскопической картины.
Для получения корректных патоморфологических результатов необходимо производить биопсию не менее, чем в 6-8 участках из дистального и среднего/проксимального отделов пищевода (из наиболее измененных участков слизистой оболочки). Биоптат должен включать эпителий на всю его глубину и, по возможности, собственную пластинку слизистой оболочки (для оценки степени субэпителиального фиброза) [1,3,27-33].
· Пациентам с подозрением на эозинофильный эзофагит перед проведением диагностической ЭГДС с биопсией пищевода с помощью эндоскопии рекомендуется отмена ИПН и глюкокортикоидов (если позволяет состояние) как минимум за 3 недели до эндоскопического исследования для предотвращения ложных результатов при диагностике ЭоЭ [1,166,167,168].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Прием ИПН, топических или системных глюкокортикоидов может значительно изменять эндоскопическую и гистологическую картину заболевания. В случае, если пациенту с подозрением на ЭоЭ планируется диагностическая ЭГДС, необходимо (если позволяет состояние пациента) отменять медикаментозную терапию как минимум за 3 недели до эндоскопического исследования [1,168].
· Всем пациентам, поступившим в лечебно-профилактическое учреждение в экстренном порядке с дисфагией, связанной с вклинением пищевого комка в пищевод, после извлечения/низведения пищевого комка и устранения дисфагии рекомендуется произвести (даже при отсутствии явных стенотических поражений (опухоль; рубцовая стриктура) и характерных эндоскопических признаков ЭоЭ) множественную биопсию слизистой оболочки дистального и среднего/проксимального отделов пищевода (не менее 6 биоптатов) c помощью эндоскопии с целью установления диагноза и дифференциальной диагностики причины вклинения [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
· Всем пациентам с эпизодом острого вклинения пищевого комка в пищевод, даже в случае спонтанного разрешения непроходимости, рекомендовано проведение ЭГДС для дифференциальной диагностики причины вклинения и биопсии слизистой оболочки пищевода с помощью эндоскопии (не менее 6 биоптатов; по 3 из дистального и среднего/проксимального отделов пищевода) с целью установления диагноза [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Выполнение биопсии в момент извлечения застрявшего пищевого болюса технически невозможно в связи с отсутствием подготовки к эндоскопическому исследованию. В связи с чем пациент должен быть приглашен на плановое повторное эндоскопическое исследование с биопсией из пищевода в ближайшее время [175-184].
Для получения корректных патоморфологических результатов необходимо производить биопсию не менее, чем в 6=8 участках из дистального и среднего/проксимального отделов пищевода (из наиболее измененных участков слизистой оболочки). Биоптат должен включать эпителий на всю его глубину и, по возможности, собственную пластинку слизистой оболочки (для оценки степени субэпителиального фиброза) [1,3,27-33].
· Всем пациентам детского возраста с типичными симптомами ГЭРБ, рефрактерными к терапии ИПН и отсутствии иных причин отсутствия эффекта от лечения, рекомендовано проведение ЭГДС с биопсией пищевода с помощью эндоскопии для исключения эозинофильного эзофагита [1,129,130].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: У пациентов детского возраста при ЭоЭ часто наблюдается нормальная эндоскопическая картина в пищеводе (до 21-42,8%), поэтому при проведении ЭГДС у детей с неспецифическими симптомами со стороны верхних отделов пищеварительного тракта следует рассмотреть проведение биопсии из пищевода с помощью эндоскопии (даже при отсутствии визуальных признаков ЭоЭ) [1,32].
Особое внимание следует уделить пациентам детского возраста с типичными симптомами ГЭРБ, рефрактерными к терапии ИПН, поскольку в 30% случаев ЭоЭ у детей сопровождается изжогой [31,129].
· Всем пациентам с подозрением на ЭоЭ рекомендовано проведение патологоанатомического исследования биопсийного материала из пищевода с целью подтверждения диагноза [1,21,117,124,166,167].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Патологоанатомическое исследование включает осмотр биоптатов, окрашенных гематоксилином и эозином с подсчетом количества эозинофилов при большом увеличении (х400) [1,21,117,124,125]. Главным критерием установления диагноза ЭоЭ служит интраэпителиальная эозинофильная инфильтрация с количеством эозинофилов в поле зрения микроскопа при большом увеличении – 15 и более (или ≥ 60 эозинофилов на 1 мм2) (приложение А3: рисунок 2а).
Дополнительными гистологическими критериями ЭоЭ являются эозинофильные микроабсцессы, гиперплазия базального слоя эпителия, расширение межклеточных пространств, расположение эозинофилов в поверхностных слоях эпителия, мастоцитарная и лимфоцитарная инфильтрация, удлинение сосочков и фиброз собственной пластинки слизистой оболочки (приложение А3) [1].
Для стандартизации гистологической оценки биоптатов целесообразно использовать систему балльной оценки восьми наиболее характерных гистологических изменений, обнаруживаемых у больных с ЭоЭ (приложение Г4: система балльной оценки биоптатов при ЭоЭ (EoEHSS)) [1,3,123,125-127].
· Пациентам с диагнозом «эозинофильный эзофагит» и стойкой дисфагией рекомендовано проведение рентгеноскопии пищевода с контрастированием с целью определения наличия и распространенности стриктур пищевода [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: Рентгеноскопия пищевода с контрастированием в диагностике ЭоЭ является дополнительным методом, позволяющим с высокой точностью выявить проксимальные и дистальные стриктуры пищевода, оценить их протяженность, диаметр пищевода в месте сужения, принять решение о необходимости баллонной дилатации стеноза пищевода или бужирования пищевода (приложение А3:рисунок 3) [120,128,129].
· Пациентам с ЭоЭ и дисфагией, сохраняющейся несмотря на адекватно проводимое лечение и отсутствие стриктур в пищеводе по данным ЭГДС, рекомендовано проведение функциональных методов исследования (пищеводная манометрия высокого разрешения, рН импедансометрия пищевода, импеданспланиметрия пищевода) с целью оценки функции пищевода и НПС и/или верификации ГЭРБ [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: Пищеводная манометрия позволяет оценить сократительную функцию пищевода и НПС. У пациентов с ЭоЭ при проведении манометрии нередко выявляются такие нарушения, как неэффективная моторика пищевода, эзофагоспазм, обструкция пищеводно-желудочного соединения. С помощью манометрии возможно проведение дифференциального диагноза между ахалазией пищевода и ЭоЭ. В некоторых случаях (для верификации сочетанной ГЭРБ) пациентам может быть проведена суточная рН-импедансометрия, которая позволяет выявить эпизоды кислых и некислых рефлюксов в пищевод, длительность экспозиции кислоты и болюса в пищеводе [129,130,131,140].
2.5 Иные диагностические исследования
· Пациентам с диагнозом «эозинофильный эзофагит» не рекомендовано рутинное проведение накожных исследований реакций на аллергены, исследование уровня общего иммуноглобулина Е в крови, исследование уровня антител к антигенам растительного, животного и химического происхождения в крови вследствие их низкой информативности при ЭоЭ [1,166,167,168].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Аллергологическое тестирование может быть проведено пациентам с ЭоЭ и сопутствующими аллергическими заболеваниями (аллергический ринит, бронхиальная астма, атопический дерматит), а также пациентам с подозрением на пищевую аллергию. Диагностика коморбидных аллергических заболеваний (БА, АтД, АР/конъюнктивит) рассматривается как необходимый компонент оценки атопической конституции у пациентов с ЭоЭ и проводится врачом-аллергологом-иммунологом. При подозрении на пищевую аллергию выполняются кожные тесты с аллергенами, определение специфических IgE, тесты элиминации-провокации [1,21].
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Целями терапии ЭоЭ являются достижение клинической (купирование симптомов ЭоЭ) и гистологической ремиссии заболевания, предотвращение развития осложнений (стриктуры пищевода).
После достижения ремиссии лечение не должно прекращаться с целью поддержания ремиссии и предотвращения рецидива симптомов и осложнений [1,21,166,167,168].
Под гистологической ремиссией ЭоЭ подразумевают разрешение эозинофильного воспаления (5-15 эозинофилов в поле зрения микроскопа высокого разрешения при увеличении х400 (в 0,3 мм)2 или менее 60 эозинофилов в 1 мм2). Под полной гистологической ремиссией понимают уменьшение количества эозинофилов <5 в поле зрения при большом увеличении (или в 0,3 мм2), что соответствует полю зрения при большом увеличении) [1,117,124].
Современная концепция лечения больных ЭоЭ включает медикаментозную терапию, диетические ограничения, и, при необходимости, проведение эндоскопической баллонной дилатации/эндоскопического бужирования стриктур и/или стеноза пищевода.
Диетические ограничения, ИПН и глюкокортикоиды являются терапией первой линии в лечении пациентов с ЭоЭ. Тактика лечения зависит от предпочтений пациента и может быть впоследствии изменена. Эндоскопическая дилатация (баллонная дилатация стеноза пищевода) или бужирование пищевода эндоскопическое проводятся пациентам со стриктурами и тяжелой дисфагией (эпизодами вклинения пищи в пищевод) независимо от типа применяемой базисной терапии [1,166,167].
Комментарии: До 50% больных с ЭоЭ отвечают на терапию ИПН установлением клинической и гистологической ремиссии (<15 эозинофилов в поле зрения микроскопа высокого разрешения). На сегодняшний день ИПН рассматриваются как препараты первой линии в терапии ЭоЭ в связи с высокой эффективностью, удобством применения (по сравнению с топической глюкокортикоидной терапией), безопасностью.
Решение о выборе метода лечения целесообразно принимать совместно с пациентом, обсудив с ним все положительные и отрицательные стороны альтернативных методов лечения (ИПН, топическая глюкокортикоидная терапия, эмпирическая диета) [1,21,166,167].
Топическая глюкокортикоидная терапия и диета являются терапией выбора для пациентов, не достигших ремиссии на фоне приема ИПН. В данном случае решение о тактике лечения должно приниматься исходя из возраста пациента, выраженности его симптомов и тяжести воспалительного процесса в слизистой оболочке пищевода [1,21,117]. Известно, что дети и подростки с трудом придерживаются диетических ограничений, в связи с чем, более рациональным для них будет назначение топических глюкокортикоидов. Справедливо это и для пациентов с тяжелыми симптомами заболевания, у которых диетические ограничения как монотерапия, скорее всего будут неэффективны.
Важно, что терапия пациентов с ЭоЭ может со временем изменяться (при желании пациента, возникновении побочных эффектов и проч.), поскольку существуют данные, показывающие, что достижение ремиссии на фоне ИПН не исключает эффективности глюкокортикоидов или диеты и наоборот [1,21,132,133].
Алгоритм лечения пациентов с ЭоЭ представлен в Приложении Б1 [1].
· Всем пациентам с установленным диагнозом «эозинофильный эзофагит» рекомендуется проведение терапии как можно в более ранние сроки с целью предотвращения развития осложнений (стриктуры), требующих эндоскопического лечения [1,166,167].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Отсутствие терапии после манифестации заболевания длительностью 2 года, приводит к развитию стриктур пищевода у 17%-19% больных, начало лечения через 20 лет после появления первых симптомов осложняется стриктурами у 71% пациентов. В то же время своевременное начало лечения позволяет предотвратить развитие фибростенотических изменений в стенке пищевода [35-37].
3.1 Диета
Опубликованный в 2023 г систематический обзор и мета-анализ 34 исследований с участием 1762 человек с использованием различных диетических режимов подтвердил, что диетотерапия является эффективным методом лечения пациентов с ЭоЭ, с общим показателем достижения гистологической ремиссии 53,8-60%. В лечении ЭоЭ диетотерапия лишь немого уступала в эффективности топическим ГКС, применение которых позволяет достичь гистологической ремиссии у 68,3%-76,8% пациентов [169-171].
В лечении ЭоЭ используются элементная диета и эмпирическая диета с исключением с исключением наиболее часто встречающихся пищевых триггеров (приложение Б).
· Рекомендовано длительное соблюдение диеты пациентам с ЭоЭ с целью достижения клинической и гистологической ремиссии без медикаментозной терапии [1,21,117,166,167,169,170,171,172].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: Диета может быть назначена в качестве первой линии терапии (монотерапия) ЭоЭ. Может быть использован один из следующих диетических режимов [1,21,47,53,54,117,124,169,170,171,172]:
1. Назначение полного энтерального питания на основе аминокислотной смеси.
2. Назначение эмпирической диеты с исключением 6 групп продуктов (молочные продукты, глютен, яйца, соя, рыба/моллюски и орехи/бобовые);
3. Назначение эмпирической диеты с исключением 4-х групп продуктов (молочные продукты, глютен, яйцо, соя);
4. Назначение эмпирической диеты с исключением 2-х групп продуктов (молочные продукты, глютен или яйца);
5. Назначение эмпирической диеты с исключением только молочных продуктов.
· Не рекомендовано рутинное сочетание диеты и медикаментозной терапии всем пациентам с ЭоЭ. Такая комбинация может быть рассмотрена только при неэффективности медикаментозной терапии [1,166,167,172].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Медикаментозная терапия и диета имеют сопоставимую эффективность в достижении гистологической ремиссии заболевания. Сочетание диеты и медикаментозной терапии может быть рассмотрено только в случае неэффективности монотерапии диетой или медикаментами [1,169-172].
· Пациентам с ЭоЭ не рекомендовано применение диет, основанных на данных аллергологического (накожных исследований реакций на аллергены (кожные скарификационные, аппликационные и прик-тесты), исследования уровня антител к антигенам растительного, животного и химического происхождения в крови (определение специфических IgE к продуктам)) тестирования в связи с их невысокой эффективностью в индукции и поддержании ремиссии в большинстве случаев [1,21,39,40,41,44,49,133,134,171,172].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Эффективность (гистологическая ремиссия) элиминационной диеты, основанной на результатах аллергологического тестирования у взрослых пациентов с ЭоЭ составляет 45,5% (данные мета-анализа 2014 г) – 45,7% (данные мета-анализа 2023 г) [39,49,169], причем эффективность данного подхода у взрослых значительно ниже, чем у детей [170,171]. В настоящее время считается нецелесообразным назначение таргетной диеты для лечения ЭоЭ в связи с ее невысокой эффективностью, за исключением случаев пищевой аллергии, доказанной с помощью аллергологического тестирования (кожные тесты, выявление специфических IgE, провокационные тесты) [1,133,172].
· Пациентам с ЭоЭ в случае не IgE-опосредованных реакций может быть рекомендована диета с исключением 6 групп продуктов питания (молоко животного происхождения, глютен, рыба и морепродукты, орехи, яйца, соя и бобовые) с целью достижения ремиссии [43-54,169–172].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
· Пациентам с ЭоЭ в случае не IgE-опосредованных реакций может быть рекомендована диета с исключением 4 групп (молоко животного происхождения, глютен, яйца, соя/бобовые) или 2 групп (молоко животного происхождения и глютен или молоко животного происхождения и яйца) продуктов питания с целью достижения ремиссии. Такая диета характеризуется более высоким уровнем приверженности пациентов, однако несколько меньшей эффективностью, чем диета с исключением 6 групп продуктов [39,43,45,46,47,48,49,52,135,136,169-172].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Назначение эмпирической диеты в качестве монотерапии при исключении 6 продуктов питания (молоко животного происхождения, глютен, рыба/морепродукты, орехи, яйца, бобовые/соя) приводит к индукции гистологической ремиссии у 61,3-63,9% пациентов, независимо от их возраста [39,169,172]. Диета с исключением 4 групп продуктов (молоко, глютен/пшеница, яйца и соя) – у 49,4%-54,7% [39,169], при исключении двух групп продуктов частота гистологической ремиссии составляет 44,3% (36,1-52,8%) [39].
Выбор диеты с исключением одной, 2-х, 4-х или 6 групп продуктов зависит от данных анамнеза, тяжести симптомов и предпочтения пациента и/или родителя. Диета должна назначаться и корректироваться с участием опытного врача-диетолога. При необходимости должны быть использованы специализированные продукты лечебного питания, обогащенные продукты (приложение Б, алгоритм 3) [1,46-52,137,173].
· Пациентам с ЭоЭ в случае неэффективности медикаментозной терапии и элиминационных диет рекомендовано рассмотреть назначение элементной диеты (аминокислотные смеси) с целью достижения ремиссии [1,21,141,142].
Для взрослой популяции Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Для детской популяции Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Элементная диета включает употребление в пищу специально приготовленных аминокислотных смесей с минимальной антигенной активностью (на фоне полного исключения из рациона любой другой пищи). Назначение полного энтерального питания (аминокислотная смесь) позволяет достичь клиническую, эндоскопическую и гистологическую ремиссию у 90,8% (95% ДИ 84,7-95,5%) пациентов с ЭоЭ детского и взрослого возраста [38,39,141,142]. Элементные диеты имеют ограниченную роль при эозинофильном эзофагите, они обладают высокой эффективностью, но низким уровнем соблюдения режима лечения и должны применяться для пациентов, невосприимчивых к другим видам лечения [1,38,39]. Назначение аминокислотных смесей может быть рассмотрено в качестве единственного источника питания у детей младше 1 года (в рацион которых еще не вводили густую пищу), а также в качестве дополнительного питания [142,143]. Для лечения ЭоЭ не следует использовать смеси на основе цельного коровьего белка, смеси на основе частичного или полного гидролиза белка, а также смеси на основе козьего молока и сои [1].
· При назначении диетических ограничений пациенту с ЭоЭ рекомендован прием (осмотр, консультация) врача-диетолога с целью снижения риска негативных последствий элиминационной диеты [143,144].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Диетические ограничения могут привести к снижению темпа роста у детей, потере массы тела у взрослых [145], а также к дефицитным состояниям (например, дефицит витамина Д и кальция) [146]. С целью снижения риска негативных последствий элиминационной диеты целесообразно включение в мультидисциплинарную команду, которая должна заниматься лечением пациентов с ЭоЭ, врача-диетолога [144,145]. В том случае, если ремиссия была достигнута на фоне диетотерапии, но продолжение соблюдения диеты неприемлемо для пациента, либо на фоне диетических ограничений развились дефицитные состояния, можно рассмотреть в качестве противорецидивной терапии переход на прием ИПН [132].
3.2. Медикаментозное лечение
· Пациентам с ЭоЭ рекомендовано рассмотреть пероральную монотерапию ИПН (#омепразол** или эквиваленты: #эзомепразол** и др.) в стандартной дозе (для взрослых 20 мг 2 раза в сутки, для детей 1 мг/кг 2 раза в сутки) на срок 8-12 недель для индукции клинической и гистологической ремиссии [1,21,55,62,166,167,168].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
· В случае достижения клинической и гистологической ремиссии пациентам с ЭоЭ, получающим ИПН, рекомендуется продолжить постоянный прием ИПН в минимально эффективной дозе с целью поддержания ремиссии [1,21,55–65,166,167].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: В терапии взрослых больных ЭоЭ возможно применение #омепразола** в стандартной суточной дозировке дважды в день (20 мг 2 раза в день) или эквивалентных доз других ИПН [1,3,21,59-62]. Для индукции ремиссии эзофагита у детей возможно назначение ИПН (#омепразола** или #эзомепразола**) из расчета 1 мг/кг на 1 прием дважды в день в течение 8 недель. Дозы ИПН у детей не должны превышать следующие: #эзомепразол** 40 мг в день или #омепразол** 40 мг 2 раза в день [1,2,166,167,168].
Мета-анализ по сравнению режима приема ИПН (один раз в день или два раза в день) показал незначительное повышение эффективности лечения при разделении суточной дозировки на 2 приема [62]. Продолжительность курса ИПН для индукции ремиссии – 8-12 недель [1].
ИПН индуцируют клиническую и гистологическую ремиссию у значительной доли взрослых и детей с ЭоЭ (50%-57%) [55,60,61,147,148].
После достижения ремиссии доза ИПН может быть снижена до минимальной эффективной дозы, решение о величине и длительности поддерживающей дозы принимается индивидуально для каждого конкретного пациента [1,3,21,55–65,149,150].
· Рекомендовано рассмотреть пероральную монотерапию #будесонидом** в стандартной дозе (для взрослых 2-4 мг в сутки, для детей при росте менее 150 см – 1 мг в сутки, при росте 150 см и более – 2 мг в сутки) на срок 8-12 недель для индукции ремиссии пациентам с ЭоЭ, не достигшим клинической и гистологической ремиссии на фоне приема ИПН [1,3,21,66-78,151–154,166,167].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
· В случае достижения клинической и гистологической ремиссии пациентам с ЭоЭ, получающим #будесонид**, рекомендуется продолжить прием #будесонида** в стандартной дозе (для взрослых 1-2 мг в сутки, для детей 1 мг в сутки) с целью поддержания ремиссии длительно (до 1 года и более) [1,3,21,66-78,104,105,137,151–154,166,167].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Препаратами выбора в индукции и поддержании гистологической ремиссии являются топические глюкокортикоиды.
Для лечения больных ЭоЭ используется густая суспензия #будесонида** (смешать 1-2 мг #будесонида** с 5 мг сукралозы (или с сиропом агавы/кленовым сиропом)) [151,152]. Более эффективен прием #будесонида** на ночь уже в постели, так как в горизонтальном положении препарат длительно находится в пищеводе и обеспечивается максимальный контакт со слизистой оболочкой [167].
В течение 30-60 минут после применения топических глюкокортикоидов важно воздержаться от приема пищи и жидкостей во избежание удаления лекарственного препарата со слизистой оболочки пищевода.
Дозы топических глюкокортикоидов для детей необходимо подбирать исходя из антропометрических показателей: для индукции ремиссии при росте менее 150 см назначается 1 мг #будесонида** в сутки, при росте 150 см и более – 2 мг #будесонида** в сутки (в один или два приема). В случае, если на такой дозе не удается достичь гистологической ремиссии, допустимо увеличить дозу до #4 мг в сутки (для детей старше 11 лет, рост более 150 см) [1,151,152,153,154].
После достижения ремиссии, подтвержденной гистологически, через 8-12 недель, возможно применение поддерживающей терапии в дозе 0,5 мг 2 раза в сутки или 1 мг 2 раза в сутки [1,66-79,166,167,168] в течение 1 года и более с последующей эндоскопической и гистологической оценкой [1,137,167]. Для поддерживающей терапии у детей должна подбираться минимально эффективная доза #будесонида** в зависимости от роста, веса и выраженности побочных эффектов [155]. В дальнейшем с целью снижения риска побочных эффектов можно рассмотреть 2 опции: снижение дозы глюкокортикоидов или переход на прием ИПН [1,166,167,168].
В инструкциях к доступным на территории РФ формам для топической глюкокортикоидной терапии отсутствует указание о применении этих препаратов с целью лечения ЭоЭ. В связи с этим перед назначением топической глюкокортикоидной терапии необходимо проведение врачебной комиссии и обсуждение с пациентами и/или законными представителями соотношения пользы и потенциального вреда назначаемых препаратов.
· Рекомендуется рассмотреть проведение мониторинга уровня кортизола (исследование уровня общего и свободного кортизола в крови, уровня свободного кортизола в моче) детям, получающим высокие дозы топической глюкокортикоидной терапии в течение длительного времени, а также в случае одновременного использования интраназальных глюкокортикоидов (например, с целью лечения аллергического ринита) – для своевременной диагностики и терапии надпочечниковой недостаточности [1,21].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Назначение #будесонида** в дозе 0,5-1 мг в сутки в течение 8-43 недель не приводит к снижению уровня кортизола. До настоящего времени не было зафиксировано отрицательного влияния применения топических глюкокортикоидов на темп роста у детей [155]. Тем не менее, имеются данные, что длительная (более 6 месяцев) глюкокортикоидная терапия может приводить к снижению функции коры надпочечников у 10% детей [80] и субоптимальному уровню стимулированного кортизола [81].
· Применение глюкокортикоидов (системных) для лечения ЭоЭ не рекомендовано вследствие риска развития побочных эффектов [1,21,66,156].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Доказано, что системные и топические глюкокортикоиды одинаково эффективны в достижении клинической и гистологической ремиссии ЭоЭ. Однако системные побочные эффекты, такие как повышение аппетита, увеличение массы тела, кушингоид развивались у 40% больных, принимавших преднизолон**. В то время как топическая глюкокортикоидная терапия сопровождалась кандидозом пищевода лишь у 15% больных [66].
· Рекомендовано рассмотреть дупилумаб** для лечения пациентов с ЭоЭ в возрасте от 1 года и старше массой тела от 5 кг и выше в дозировке для пациентов с массой тела от 5 до <15 кг по 200 мг каждые 3 недели; для пациентов с массой тела от 15 до <30 кг по 200 мг каждые 2 недели; для пациентов с массой тела от 30 до <40 кг по 300 мг каждые 2 недели; для пациентов с массой тела 40 кг и более по 300 мг 1 раз в неделю) с целью индукции и поддержания ремиссии [1,107,159, 162,166,167,168,174].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
Комментарии: Дупилумаб** представляет собой человеческие моноклональные антитела к субъединице альфа рецептора IL-4Rα – общей для IL-4 и 13 [97-102]. В 2023 г дупилумаб** зарегистрирован в РФ для лечения ЭоЭ. В клинических исследованиях дупилумаб** показал высокую эффективность в достижении клинической и гистологической ремиссии (58-62%) у детей от 1 года и взрослых с ЭоЭ [107,108,159,174]. Доля пациентов с гистологической ремиссией, наблюдаемой через 24 недели, сохранялась до 52-й недели [107,108,159]. Дупилумаб** характеризовался благоприятным профилем безопасности. Терапия дупилумабом** не требует проведения дополнительных лабораторных или инструментальных обследований и рутинного мониторинга лабораторных показателей до и во время лечения [159].
С целью оценки эффективности лечения (индукции ремиссии) дупилумаб** назначают на 12 недель, после чего проводят повторную ЭГДС с биопсией пищевода с помощью эндоскопии с описанием эндоскопической и гистологической динамики [167,168,169].
· В случае достижения клинической и гистологической ремиссии пациентам с ЭоЭ, получающим генно-инженерную биологическую терапию, рекомендуется продолжить лечение на постоянной основе (длительно), применявшимся для индукции ремиссии препаратом с целью поддержания ремиссии [1,159,166,167,168,174].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
· Не рекомендованы ингибиторы фактора некроза опухоли альфа (TNF-α), омализумаб**, меполизумаб**, реслизумаб**, бенрализумаб** для лечения ЭоЭ в связи с недостаточной эффективностью [1,21,91–101,160,166,167].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Использование препаратов бенрализумаб**, омализумаб**, меполизумаб**, реслизумаб** не показало эффективности в лечении пциентов с эозинофильным эзофагитом в клинических исследованиях [91-96,157,158,161, 160].
Бенрализумаб**, меполизумаб**, реслизумаб** не зарегистрированы в РФ и других странах для терапии пациентов с эозинофильным эзофагитом.
· Не рекомендовано применение азатиоприна** и меркаптопурина** для лечения ЭоЭ в связи с недостаточной эффективностью [1,21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: В литературе описано лишь 3 случая стероидо-резистентного течения ЭоЭ, при котором назначение азатиоприна** взрослым пациентам в дозе 2-2,5 мг и меркаптопурина** привело к индукции и поддержанию ремиссии. Однако после отмены терапии наступил рецидив [83].
· Не рекомендовано применение антигистаминных средств системного действия, а также монтелукаста и кромоглициевой кислоты** для лечения ЭоЭ в связи с неэффективностью [1,21].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Антигистаминные средства системного действия, кромоглициевая кислота**, монтелукаст оказались несостоятельны в купировании симптомов и влиянии на выраженность эозинофильного воспаления в слизистой оболочке пищевода у больных ЭоЭ [84-90].
· Пациентам с ЭоЭ рекомендовано оценивать эффективность медикаментозной терапии и диетических режимов через 8–12 недель после начала лечения путем проведения ЭГДС с множественной биопсией пищевода с помощью эндоскопии на фоне продолжающегося приема препаратов и/или соблюдения диеты и далее регулярно 1 раз в год или при значительном изменении терапии [1,21, 166, 167, 168].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Степень активности воспалительного процесса в слизистой оболочке пищевода при ЭоЭ не коррелирует с выраженностью симптомов заболевания. Для оценки эффективности лечения и контроля за активностью воспалительного процесса необходимо гистологическое исследование биоптатов. Критерием эффективности лечения служит достижение гистологической ремиссии заболевания (менее 15 эозинофилов в поле зрения при увеличении х400).
3.3. Эндоскопическое лечение
· Пациентам, у которых ЭоЭ осложнился развитием стриктур/стеноза просвета пищевода, приводящим к стойкой дисфагии и/или эпизодам вклинения пищевого комка в пищевод, рекомендовано проведение баллонной дилатации или бужирования пищевода эндоскопического для облегчения клинической симптоматики [1,21,166].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Эндоскопическая дилатация (баллонная дилатация стеноза пищевода) или бужирование пищевода показаны пациентам со стриктурами/стенозом просвета пищевода менее 13 мм после курса медикаментозной противовоспалительной терапии.
Баллонная дилатация стеноза пищевода приводит к разрешению дисфагии у 75% (95% CI 58-93%) пациентов [82]. Эндоскопическая дилатация (баллонная дилатацию стеноза пищевода) или бужирование пищевода не оказывают влияния на иммуновоспалительный процесс в слизистой оболочке пищевода, данная процедура проводится с целью снижения выраженности клинических симптомов, вызванных необратимыми фибротическими изменениями стенки пищевода [167,168].
3.4. Иное лечение
· Пациентам с ЭоЭ, не отвечающим на медикаментозную терапию и/или со значимыми проявлениями атопических заболеваний, рекомендуется прием (осмотр, консультация) врача-аллерголога-иммунолога с целью уточнения сопутствующей патологии и оптимизации ее терапии [1,166,167].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: сопутствующие атопические заболевания нередко встречаются у пациентов с ЭоЭ, оптимизация их терапии может быть полезна.
При выявлении атопических заболеваний проводится лечение согласно соответствующим клиническим рекомендациям.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Методы реабилитации при ЭоЭ не разработаны.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Первичная профилактика ЭоЭ не разработана. Вторичная профилактика направлена на предотвращение развития осложнений, таких как стриктуры и стенозы.
· Рекомендовано включать в программу профилактики своевременную диагностику заболевания, постоянную поддерживающую медикаментозную терапию и проведение ЭГДС с биопсией пищевода с помощью эндоскопии с периодичностью 1 раз в год [1,166,167,168].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
ЭоЭ не является противопоказанием для вакцинации.
6. Организация оказания медицинской помощи
Пациентам с ЭоЭ, в зависимости от необходимости, может быть оказана медицинская помощь любого вида, условия, формы, предусмотренных законодательством Российской Федерации.
Ведением пациентов с ЭоЭ обычно занимается врач-гастроэнтеролог с участием других врачей (врач-аллерголог-иммунолог, врач-педиатр, врач-терапевт) при необходимости.
Чаще госпитализация осуществляется в педиатрическое (дети до 18 лет)/терапевтическое или гастроэнтерологическое (взрослые) отделения, при необходимости – в отделение хирургического профиля в зависимости от доминирующих симптомов заболевания.
Показания для плановой госпитализации: нарастание дисфагии, при необходимости – подбор терапии и ее коррекция; системная терапия (в том числе с применением генно-инженерной биологической терапии) в условиях дневного и круглосуточного стационаров (для взрослых и детей).
Показания для экстренной/неотложной госпитализации: острая обтурационная дисфагия (эпизод вклинения пищи в пищевод).
Показания к выписке из стационара: удовлетворительное общее состояние, уменьшение выраженности дисфагии.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Эозинофильный эзофагит был выделен в отдельную нозологию лишь около 30 лет назад, в связи с чем данные о частоте развития осложнений или спонтанных ремиссий, прогнозе заболевания, сроках поддерживающей терапии по сей день остаются скудными и противоречивыми.
В целом ЭоЭ характеризуется доброкачественным течением. В литературе нет данных о развитии рака пищевода на фоне ЭоЭ. Другой особенностью заболевания является крайне медленное его прогрессирование. Скорее всего, это связано с тем, что выраженность дисфагии у пациентов с ЭоЭ зависит в первую очередь от фибротического ремоделирования стенки пищевода, которое при ЭоЭ происходит в течение нескольких лет/десятилетий. Кроме того, больные постепенно адаптируются к возникающим симптомам, более тщательно пережевывают пищу, обильно запивают ее водой, избегают продуктов с твердой и грубой текстурой.
Благоприятное течение заболевания подтверждается также данными о том, что даже кратковременное медикаментозное лечение ЭоЭ приводит к многомесячной ремиссии заболевания. Дилатация стриктур пищевода обеспечивает купирование дисфагии на срок до 1 года даже при отсутствии противовоспалительной медикаментозной терапии.
Существующая модель прогрессирования ЭоЭ отражает постепенный переход от воспалительных изменений к фиброзу и стенозу пищевода с развитием дисфагии у большинства больных ЭоЭ (рисунок 9). В случае своевременного начала медикаментозной терапии и диетических ограничений на ранних стадиях заболевания возможно замедление прогрессирования фибротических изменений. Описаны случаи возникновения спонтанных ремиссий заболевания (без применения медикаментозной терапии или диет), однако они нехарактерны для ЭоЭ и являются скорее исключением. Имеющиеся на современном этапе данные не позволяют сформулировать однозначные рекомендации относительно длительности поддерживающей терапии при ЭоЭ.
Рисунок 3. Естественное течение (при отсутствии лечения) ЭоЭ
Критерии оценки качества медицинской помощи
|
№ |
Критерии качества |
Оценка выполнения (да/нет) |
|
1 |
Проведена ЭГДС с биопсией пищевода с помощью эндоскопии, как минимум, из 2 отделов пищевода – дистального и среднего/проксимального (не менее 6 биоптатов) пациентам с подозрением на ЭоЭ. |
(да/нет) |
|
2 |
Назначена элиминационная диета и/или ИПН или топическая глюкокортикоидная терапия или дупилумаб** |
(да/нет) |
|
3 |
Проведена контрольная ЭГДС через 8-12 недель после назначения медикаментозной терапии или диеты с проведением множественной биопсии с помощью эндоскопии (не менее 6 биоптатов) для оценки эффективности лечения |
(да/нет) |
|
4 |
Проведена эндоскопическая дилатация (баллонная дилатацию стеноза пищевода) или бужирование пищевода эндоскопическое при повторяющихся эпизодах вклинения пищи в пищевод и/или тяжелой дисфагии, не купирующихся на фоне медикаментозной терапии и диеты |
(да/нет) |
|
6 |
Назначена постоянная поддерживающая медикаментозная терапия в минимально эффективной дозировке или эффективная диета |
(да/нет) |
|
7 |
Проведено эндоскопическое наблюдение (ЭГДС с биопсией пищевода с помощью эндоскопии) 1 раз в год (ежегодно) пациентам с диагностированным ЭоЭ |
(да/нет) |
Список литературы
1. Dhar A, Haboubi HN, Attwood SE, Auth MKH, Dunn JM, Sweis R, Morris D, Epstein J, Novelli MR, Hunter H, Cordell A, Hall S, Hayat JO, Kapur K, Moore AR, Read C, Sami SS, Turner PJ, Trudgill NJ. British Society of Gastroenterology (BSG) and British Society of Paediatric Gastroenterology, Hepatology and Nutrition (BSPGHAN) joint consensus guidelines on the diagnosis and management of eosinophilic oesophagitis in children and adults. Gut. 2022 Aug;71(8):1459-1487 https://doi.org/10.1136/gutjnl-2022-327326.
2. Ивашкин В.Т., Баранская Е.К., Кайбышева В.О., Трухманов А.С., Шептулин А.А. Клинические рекомендации по диагностике и лечению эозинофильного эзофагита. М., 2013. [Ivashkin V.T., Baranskaya E.K., Kaibysheva V.O., Trukhmanov A.S., Sheptulin A.A. Klinicheskie rekomendatsii po diagnostike i lecheniyu eozinofil'nogo ezofagita. M., 2013. (In Russ.)]
3. Эозинофильный эзофагит / В. О. Кайбышева, Л. М. Михалева, Е. Д. Федоров [и др.]. – Переработанное и дополненное издание. – Москва : Издательство «Медиа Сфера», 2024. – 180 с. – ISBN 978-5-89084-077-6. – EDN LYSCJD.
4. Диагностика и лечение эозинофильного эзофагита : Методические рекомендации / В. О. Кайбышева, О. М. Драпкина, И. В. Маев [и др.]. – Москва : ООО Силицея-Полиграф, 2024. – 58 с. – ISBN 978-5-605-25985-5. – DOI 10.15829/ROPNIZ-k7-2024. – EDN RMANOJ.
5. Кайбышева В.О., Михалева Л.М., Никонов Е.Л., Шаповальянц С.Г. Эпидемиология, этиология и патогенез эозинофильного эзофагита. Новейшие данные. Доказательная гастроэнтерология. 2019;8(2):5072.Kaibysheva VO, Mikhaleva LM, Nikonov EL, Shapoval’yants SG. Epidemiology, etiology and pathogenesis of eosinophilic esophagitis. The latest data. Russian Journal of Evidence-Based Gastroenterology. 2019;8(2):5072. (In Russ., In Engl.). https://doi.org/10.17116/dokgastro2019802150
6. Arias A, Perez-Martinez I, Tenias JM, Lucendo AJ. Systematic review with meta- analysis: the incidence and prevalence of eosinophilic oesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther 2016;43:3-15. https://doi.org/10.1111/apt.13441
7. van Rhijn BD, Verheij J, Smout AJ, Bredenoord AJ. Rapidly increasing incidence of eosinophilic esophagitis in a large cohort. Neurogastroenterol Motil 2013;25:47-5. https://doi.org/10.1111/nmo.12009
8. Warners M, de Rooij WE, Van Rhijn BD, Verheij J, Smout AJ, Bredenoord AJ. Large Increase in Incidence of Eosinophilc Esophagitis Over the Last 20 Years in the Netherlands: Results from a Nationwide Pathology Database. Gastroenterology 2017;152:862-863. https://doi.org/10.1016/S0016-5085(17)32964-5
9. Noel RJ, Putnam PE, Rothenberg ME. Eosinophilic esophagitis. N Engl J Med 2004;351:940-1.
10. Hahn JW, Lee K, Shin JI, Cho SH, Turner S, Shin JU, Yeniova AÖ, Koyanagi A, Jacob L, Smith L, Fond G, Boyer L, Lee SW, Kwon R, Kim S, Shin YH, Rhee SY, Moon JS, Ko JS, Yon DK, Papadopoulos NG. Global Incidence and Prevalence of Eosinophilic Esophagitis, 1976-2022: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2023 Dec;21(13):3270-3284.e77. doi: 10.1016/j.cgh.2023.06.005.
11. Prasad GA, Alexander JA, Schleck CD, Zinsmeister AR, Smyrk TC, Elias RM, Locke GR, Talley NJ. Epidemiology of eosinophilic esophagitis over three decades in Olmsted County, Minnesota. Clin Gastroenterol Hepatol 2009;7:1055-61. https://doi.org/10.1016/j.cgh.2009.06.023
12. Syed AA, Andrews CN, Shaffer E, Urbanski SJ, Beck P, Storr M. The rising incidence of eosinophilic oesophagitis is associated with increasing biopsy rates: a population-based study. Aliment Pharmacol Ther 2012;36:950-8. https://doi.org/10.1111/apt.12053
13. Dellon ES, Erichsen R, Baron JA, Shaheen NJ, Vyberg M, Sorensen HT, Pedersen L. The increasing incidence and prevalence of eosinophilic oesophagitis outpaces changes in endoscopic and biopsy practice: national population-based estimates from Denmark. Aliment Pharmacol Ther 2015;41:662-70. https://doi.org/10.1111/apt.13129
14. Giriens B, Yan P, Safroneeva E, Zwahlen M, Reinhard A, Nydegger A, Vavricka S, Sempoux C, Straumann A, Schoepfer AM. Escalating incidence of eosinophilic esophagitis in Canton of Vaud, Switzerland, 1993-2013: a population-based study. Allergy 2015;70:1633-9. https://doi.org/10.1111/all.12733
15. Straumann A, Simon HU. Eosinophilic esophagitis: escalating epidemiology? J Allergy Clin Immunol 2005;115:418-9. https://doi.org/10.1016/j.jaci.2004.11.006
16. Dellon ES, Liacouras CA, Molina-Infante J et al. Updated International Consensus Diagnos-tic Criteria for Eosinophilic Esophagitis: Proceedings of the AGREE Conference. Gastroen-terology. 2018 https://doi.org/10.1053/j.gastro.2018.07.009.
17. Straumann A, Katzka DA. Diagnosis and Treatment of Eosinophilic Esophagitis. Gastroen-terology. 2018 Jan;154(2):346-359. https://doi.org/10.1053/j.gastro.2017.05.066
18. Lucendo AJ, Friginal-Ruiz AB, Rodriguez B. Boerhaave's syndrome as the primary manifes-tation of adult eosinophilic esophagitis. Two case reports and a review of the literature. Dis Esophagus 2011;24:E11-5. https://doi.org/10.1111/j.1442-2050.2010.01167.x
19. Straumann A, Bussmann C, Zuber M, et al. Eosinophilic esophagitis: analysis of food impac-tion and perforation in 251 adolescent and adult patients. Clin Gastroenterol Hepatol 2008;6:598- 600. https://doi.org/10.1016/j.cgh.2008.02.003
20. Jackson WE, Mehendiratta V, Palazzo J, et al. Boerhaave's syndrome as an initial presenta-tion of eosinophilic esophagitis: a case series. Ann Gastroenterol 2013;26:166-169.
21. Lucendo AJ, Molina-Infante J, Arias Á, von Arnim U, Bredenoord AJ, Bussmann C, Amil Dias J, Bove M, González-Cervera J, Larsson H, Miehlke S, Papadopoulou A, Rodríguez-Sánchez J, Ravelli A, Ronkainen J, Santander C, Schoepfer AM, Storr MA, Terreehorst I, Straumann A, Attwood SE. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J. 2017; 5(3): 335-358. https://doi.org/10.1177/2050640616689525
22. Ивашкин В.Т., Баранская Е.К., Кайбышева В.О., Иванова Е.В., Федоров Е.Д. Эозинофильный эзофагит: обзор литературы и описание собственного наблюдени. РЖГГК;2012: 1. 71–81. [Ivashkin V.T., Baranskaya E.K., Kaibysheva V.O., Ivanova E.V., Fedorov E.D. Eozinofil'nyi ezofagit: obzor literatury i opisanie sobstvennogo nablyudeniya // RZhGGK. 2012: 1. 71–81. (In Russ.)]
23. Dellon ES, Gibbs WB, Fritchie KJ, et al. Clinical, endoscopic, and histologic findings distinguish eosinophilic esophagitis from gastroesophageal reflux disease. Clin Gastroenterol Hepatol 2009;7:1305–1313.
24. Remedios M, Campbell C, Jones DM, et al. Eosinophilic esophagitis in adults: clinical, endoscopic, histologic findings, and response to treatment with fluticasone propionate. Gastrointest Endosc 2006;63:3–12.
25. Croese J, Fairley SK, Masson JW, et al. Clinical and endoscopic features of eosinophilic esophagitis in adults. Gastrointest Endosc 2003;58:516–522.
26. Kahn J, Bussmann C, Beglinger C, et al. Exercise-induced chest pain: an atypical manifestation of eosinophilic esophagitis. Am J Med 2015;128:196–199. https://doi.org/10.1016/j.amjmed.2014.08.007
27. Gonsalves N, Policarpio-Nicolas M, Zhang Q, et al. Histopathologic variability and endoscopic correlates in adults with eosinophilic esophagitis. Gastrointest Endosc 2006;64:313–319.
28. Shah A, Kagalwalla AF, Gonsalves N, et al. Histopathologic variability in children with eosinophilic esophagitis. Am J Gastroenterol 2009;104:716–721.
29. Peery AF, Cao H, Dominik R, et al. Variable reliability of endoscopic findings with white-light and narrow-band imaging for patients with suspected eosinophilic esophagitis. Clin Gastroenterol Hepatol 2011;9:475–480. https://doi.org/10.1016/j.cgh.2011.02.026
30. Dellon ES, Speck O, Woodward K. The patchy nature of esophageal eosinophilia in eosinophilic esophagitis: Insights from pathology samples from a clinical trial. Gastroenterology 2012;142(Suppl):Su-1129. https://doi.org/10.1016/S0016-5085(12)61626-6
31. DeBrosse CW, Collins MH, Buckmeier Butz BK, et al. Identification, epidemiology, and chronicity of pediatric esophageal eosinophilia, 1982-1999. J Allergy Clin Immunol 2010;126:112–9.
32. Kim HP, Vance RB, Shaheen NJ, et al. The prevalence and diagnostic utility of endoscopic features of eosinophilic esophagitis: a meta-analysis. Clin Gastroenterol Hepatol 2012;10:988–996. https://doi.org/10.1016/j.cgh.2012.04.019
33. Hirano I, Moy N, Heckman MG, et al. Endoscopic assessment of the oesophageal features of eosinophilic oesophagitis: validation of a novel classification and grading system. Gut 2013;62:489-95. https://doi.org/10.1136/gutjnl-2011-301817
34. Dellon ES, Gibbs WB, Fritchie KJ, et al. Clinical, endoscopic, and histologic findings distin-guish eosinophilic esophagitis from gastroesophageal reflux disease. Clin Gastroenterol Hepa-tol 2009;7:1305-13; https://doi.org/10.1016/j.cgh.2009.08.030
35. Schoepfer AM, Safroneeva E, Bussmann C, et al. Delay in diagnosis of eosinophilic esophagitis increases risk for stricture formation in a time-dependent manner. Gastroenterology 2013;145:1230–2.
36. Lipka S, Kumar A, Richter JE. Impact of diagnostic delay and other risk factors on eosinophilic esophagitis phenotype and esophageal diameter. J Clin Gastroenterol 2016;50:134–40.
37. Warners MJ, Oude Nijhuis RAB, de Wijkerslooth LRH, et al. The natural course of eosinophilic esophagitis and long-term consequences of undiagnosed disease in a large cohort. Am J Gastroenterol 2018;113:836–44.
38. Peterson KA, Byrne KR, Vinson LA, et al. Elemental diet induces histologic response in adult eosinophilic esophagitis. Am J Gastroenterol 2013;108:759- 766. https://doi.org/10.1038/ajg.2012.468
39. Arias A, Gonzalez-Cervera J, Tenias JM, et al. Efficacy of dietary interventions for inducing histologic remission in patients with eosinophilic esophagitis: a systematic review and meta-analysis. Gastroenterology 2014;146:1639–1648. https://doi.org/10.1053/j.gastro.2014.02.006
40. Spergel JM, Beausoleil JL, Mascarenhas M, et al. The use of skin prick tests and patch tests to identify causative foods in eosinophilic esophagitis. J Allergy Clin Immunol 2002;109:363–368.
41. Spergel JM, Brown-Whitehorn TF, Cianferoni A, et al. Identification of causative foods in children with eosinophilic esophagitis treated with an elimination diet. J Allergy Clin Immunol 2012;130:461–467. https://doi.org/10.1016/j.jaci.2012.05.021
42. Kagalwalla AF, Shah A, Ritz S, et al. Cow’s milk protein-induced eosinophilic esophagitis in a child with gluten-sensitive enteropathy. J Pediatr Gastroenterol Nutr 2007;44:386–388. https://doi.org/10.1097/01.mpg.0000243430.32087.5c
43. Wolf WA, Jerath MR, Sperry SLW, et al. Dietary elimination therapy is an effective option for adults with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2014;12:1272–1279. https://doi.org/10.1016/j.cgh.2013.12.034
44. Molina-Infante J, Martin-Noguerol E, Alvarado-Arenas M, et al. Selective elimination diet based on skin testing has suboptimal efficacy for adult eosinophilic esophagitis. J Allergy Clin Immunol 2012;130:1200–1202. https://doi.org/10.1016/j.jaci.2012.06.027
45. Kagalwalla AF, Sentongo TA, Ritz S, et al. Effect of six-food elimination diet on clinical and histologic outcomes in eosinophilic esophagitis. Clin Gastroenterol Hepatol 2006;4:1097–1102.
46. Henderson CJ, Abonia JP, King EC, et al. Comparative dietary therapy effectiveness in remission of pediatric eosinophilic esophagitis. J Allergy Clin Immunol 2012;129:1570–1578. https://doi.org/10.1016/j.jaci.2012.03.023
47. Kagalwalla AF, Shah A, Li BUK, et al. Identification of specific foods responsible for inflammation in children with eosinophilic esophagitis successfully treated with empiric elimination diet. J Pediatr Gastroenterol Nutr 2011;53:145–149. https://doi.org/10.1097/MPG.0b013e31821cf503
48. Molina-Infante J, Arias A, Barrio J, et al. Four-food group elimination diet for adult eosinophilic esophagitis: A prospective multicenter study. J Allergy Clin Immunol 2014;134:1093–1099. https://doi.org/10.1016/j.jaci.2014.07.023
49. Philpott H, Nandurkar S, Royce SG, et al. Allergy tests do not predict food triggers in adult patients with eosinophilic oesophagitis. A comprehensive prospective study using five modalities. Aliment Pharmacol Ther 2016 ;44:223– 233. https://doi.org/10.1111/apt.13676
50. Kagalwalla AF, Amsden K, Shah A, et al. Cow’s milk elimination: a novel dietary approach to treat eosinophilic esophagitis. J Pediatr Gastroenterol Nutr 2012;55:711–716. https://doi.org/10.1097/MPG.0b013e318268da40
51. Kruszewski PG, Russo JM, Franciosi JP, et al. Prospective, comparative effectiveness trial of cow’s milk elimination and swallowed fluticasone for pediatric eosinophilic esophagitis. Dis Esophagus 2016;29:377–384. https://doi.org/10.1111/dote.12339
52. Molina-Infante J, Arias Á, Alcedo J, Garcia-Romero R, Casabona-Frances S, Prieto-Garcia A, Modolell I, Gonzalez-Cordero PL, Perez-Martinez I, Martin-Lorente JL, Guarner-Argente C, Masiques ML, Vila-Miravet V, Garcia-Puig R, Savarino E, Sanchez-Vegazo CT, Santander C, Lucendo AJ. Step-up empiric elimination diet for pediatric and adult eosinophilic esophagitis: The 2-4-6 study. J Allergy Clin Immunol. 2018;141(4):1365-1372. https://doi.org/10.1016/j.jaci.2017.08.038
53. Gonsalves N, Yang G-Y, Doerfler B, et al. Elimination diet effectively treats eosinophilic esophagitis in adults; food reintroduction identifies causative factors. Gastroenterology 2012;142:1451–1455. https://doi.org/10.1053/j.gastro.2012.03.001
54. Lucendo AJ, Arias A, Gonzalez-Cervera J, et al. Empiric 6-food elimination diet induced and maintained prolonged remission in patients with adult eosinophilic esophagitis: a prospective study on the food cause of the disease. J Allergy Clin Immunol 2013;131:797–804. https://doi.org/10.1016/j.jaci.2012.12.664
55. Moawad FJ, Veerappan GR, Dias JA, et al. Randomized controlled trial comparing aeroso-lized swallowed fluticasone to esomeprazole for esophageal eosinophilia. Am J Gastroenterol 2013;108:366–372. https://doi.org/10.1038/ajg.2012.443
56. Peterson KA, Thomas KL, Hilden K, et al. Comparison of esomeprazole to aerosolized, swal-lowed fluticasone for eosinophilic esophagitis. Dig Dis Sci 2010;55:1313–1319. https://doi.org/10.1007/s10620-009-0859-4
57. Cheng E, Zhang X, Huo X, Yu C, Zhang Q, Wang DH, Spechler SJ, Souza RF. Omeprazole blocks eotaxin-3 expression by oesophageal squamous cells from patients with eosinophilic oesophagitis and GORD. Gut. 2013 Jun;62(6):824-32. https://doi.org/10.1136/gutjnl-2012-302250.
58. Ngo P, Furuta GT, Antonioli DA, et al. Eosinophils in the esophagus--peptic or allergic eo-sinophilic esophagitis? Case series of three patients with esophageal eosinophilia. Am J Gas-troenterol 2006;101:1666–1670.
59. Dranove JE, Horn DS, Davis MA, et al. Predictors of response to proton pump inhibitor ther-apy among children with significant esophageal eosinophilia. J Pediatr 2009;154:96–100. https://doi.org/10.1016/j.jpeds.2008.07.042
60. Molina-Infante J, Ferrando-Lamana L, Ripoll C, et al. Esophageal eosinophilic infiltration re-sponds to proton pump inhibition in most adults. Clin Gastroenterol Hepatol 2011; 9: 110–117. https://doi.org/10.1016/j.cgh.2010.09.019
61. Gutierrez-Junquera C, Fernandez-Fernandez S, Cilleruelo ML, et al. High prevalence of re-sponse to proton-pump inhibitor treatment in children with esophageal eosinophilia. J Pediatr Gastroenterol Nutr 2016;62:704–710. https://doi.org/10.1097/MPG.0000000000001019
62. Lucendo AJ, Arias A, Molina-Infante J. Efficacy of proton pump inhibitor drugs for inducing clinical and histologic remission in patients with symptomatic esophageal eosinophilia: a sys-tematic review and meta-analysis. Clin Gastroenterol Hepatol 2016;14:13–22. https://doi.org/10.1016/j.cgh.2015.07.041
63. Cheng E, Zhang X, Wilson KS, Wang DH, Park JY, Huo X, Yu C, Zhang Q, Spechler SJ, Souza RF. JAK-STAT6 Pathway Inhibitors Block Eotaxin-3 Secretion by Epithelial Cells and Fibroblasts from Esophageal Eosinophilia Patients: Promising Agents to Improve In-flammation and Prevent Fibrosis in EoE. PLoS One. 2016 Jun 16;11(6):e0157376. https://doi.org/10.1371/journal.pone.0157376.
64. Dellon ES, Liacouras CA. Advances in clinical management of eosinophilic esophagitis. Gas-troenterology 2014;147:1238–1254. https://doi.org/10.1053/j.gastro.2014.07.055
65. Molina-Infante J, Rodriguez-Sanchez J, Martinek J, et al. Long-term loss of response in pro-ton pump inhibitor-responsive esophageal eosinophilia is uncommon and influenced by CYP2C19 genotype and rhinoconjunctivitis. Am J Gastroenterol 2015;110:1567–1575. https://doi.org/10.1038/ajg.2015.314
66. Schaefer ET, Fitzgerald JF, Molleston JP, et al. Comparison of oral prednisone and topical fluticasone in the treatment of eosinophilic esophagitis: a randomized trial in children. Clin Gastroenterol Hepatol 2008;6:165–173.
67. Alexander JA, Jung KW, Arora AS, et al. Swallowed fluticasone improves histologic but not symptomatic response of adults with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2012;10:742–749. https://doi.org/10.1016/j.cgh.2012.03.018
68. Gupta SK, Vitanza JM, Collins MH. Efficacy and safety of oral budesonide suspension in pediatric patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2015;13:66–76. https://doi.org/10.1016/j.cgh.2014.05.021
69. Dohil R, Newbury R, Fox L, et al. Oral viscous budesonide is effective in children with eosinophilic esophagitis in a randomized, placebo-controlled trial. Gastroenterology 2010;139:418–429. https://doi.org/10.1053/j.gastro.2010.05.001
70. Konikoff MR, Noel RJ, Blanchard C, et al. A randomized, double-blind, placebo- controlled trial of fluticasone propionate for pediatric eosinophilic esophagitis. Gastroenterology 2006;131:1381–1391.
71. Dellon ES, Sheikh A, Speck O, et al. Viscous topical is more effective than nebulized steroid therapy for patients with eosinophilic esophagitis. Gastroenterology 2012;143:321–324. https://doi.org/10.1053/j.gastro.2012.04.049
72. Butz BK, Wen T, Gleich GJ, et al. Efficacy, dose reduction, and resistance to high-dose fluticasone in patients with eosinophilic esophagitis. Gastroenterology 2014;147:324–333. https://doi.org/10.1053/j.gastro.2014.04.019
73. Miehlke S, Hruz P, Vieth M, et al. A randomised, double-blind trial comparing budesonide formulations and dosages for short-term treatment of eosinophilic oesophagitis. Gut 2016;65:390–399. https://doi.org/10.1136/gutjnl-2014-308815
74. Tan N Di, Xiao YL, Chen MH. Steroids therapy for eosinophilic esophagitis: Systematic review and meta-analysis. J Dig Dis 2015;16:431–442. https://doi.org/10.1111/1751-2980.12265
75. Sawas T, Dhalla S, Sayyar M, et al. Systematic review with meta-analysis: pharmacological interventions for eosinophilic oesophagitis. Aliment Pharmacol Ther 2015;41:797–806. https://doi.org/10.1111/apt.13147
76. Murali AR, Gupta A, Attar BM, et al. Topical steroids in eosinophilic esophagitis: systematic review and meta-analysis of placebo controlled randomized clinical trials. J Gastroenterol Hepatol 2015; 31:1111-1119. https://doi.org/10.1111/jgh.13281
77. Chuang M-YA, Chinnaratha MA, Hancock DG, et al. Topical steroid therapy for the treatment of eosinophilic esophagitis (EoE): a systematic review and meta- analysis. Clin Transl Gastroenterol 2015;6:e82. https://doi.org/10.1038/ctg.2015.9
78. Straumann A, Conus S, Degen L, et al. Long-term budesonide maintenance treatment is partially effective for patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2011;9:400–409. https://doi.org/10.1016/j.cgh.2011.01.017
79. Philla KQ, Min SB, Hefner JN, et al. Swallowed glucocorticoid therapy for eosinophilic esophagitis in children does not suppress adrenal function. J Pediatr Endocrinol Metab 2015;28:1101–1106. https://doi.org/10.1515/jpem-2014-0260
80. Golekoh MC, Hornung LN, Mukkada VA, et al. Adrenal insufficiency after chronic swallowed glucocorticoid therapy for eosinophilic esophagitis. J Pediatr 2016;170:240–245. https://doi.org/10.1016/j.jpeds.2015.11.026
81. Harel S, Hursh BE, Chan ES, et al. Adrenal suppression in children treated with oral viscous budesonide for eosinophilic esophagitis. J Pediatr Gastroenterol Nutr 2015;61:190–193. https://doi.org/10.1097/MPG.0000000000000848
82. Moawad FJ, Cheatham JG, DeZee KJ. Meta-analysis: the safety and efficacy of dilation in eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;38:713–720. https://doi.org/10.1111/apt.12438
83. Netzer P, Gschossmann JM, Straumann A, et al. Corticosteroid-dependent eosinophilic oesophagitis: azathioprine and 6-mercaptopurine can induce and maintain long-term remission. Eur J Gastroenterol Hepatol 2007;19:865–869.
84. Abonia JP, Blanchard C, Butz BB, et al. Involvement of mast cells in eosinophilic esophagitis. J Allergy Clin Immunol 2010;126:140–149. https://doi.org/10.1016/j.jaci.2010.04.009
85. Arias A, Lucendo AJ, Martinez-Fernandez P, et al. Dietary treatment modulates mast cell phenotype, density, and activity in adult eosinophilic oesophagitis. Clin Exp Allergy 2016;46:78–91. https://doi.org/10.1111/cea.12504
86. Liacouras CA, Spergel JM, Ruchelli E, et al. Eosinophilic esophagitis: A 10-year experience in 381 children. Clin Gastroenterol Hepatol 2005;3:1198–1206.
87. Attwood SEA, Lewis CJ, Bronder CS, et al. Eosinophilic oesophagitis: a novel treatment using Montelukast. Gut 2003;52:181–185.
88. Stumphy J, Al-Zubeidi D, Guerin L, Mitros F, Rahhal R. Observations on use of montelukast in pediatric eosinophilic esophagitis: insights for the future. Dis Esophagus. Australia; 2011;24(4):229–34. https://doi.org/10.1111/j.1442-2050.2010.01134.x
89. Alexander JA, Ravi K, Enders FT, Geno DM, Kryzer LA, Mara KC, Smyrk TC, Katzka DA. Montelukast Does not Maintain Symptom Remission After Topical Steroid Therapy for Eosinophilic Esophagitis. Clin Gastroenterol Hepatol. 2017;15(2):214-221.e2. https://doi.org/10.1016/j.cgh.2016.09.013
90. Lucendo AJ, De Rezende LC, Jimenez-Contreras S, et al. Montelukast was inefficient in maintaining steroid-induced remission in adult eosinophilic esophagitis. Dig Dis Sci 2011;56:3551–3558. https://doi.org/10.1007/s10620-011-1775-y
91. Straumann A, Bauer M, Fischer B, Blaser K, Simon H-U. Idiopathic eosinophilic esophagitis is associated with a Th2-type allergic inflammatory response. J Allergy Clin Immunol. 2001; 108(6): 954–61
92. O’Byrne PM, Inman MD, Parameswaran K. The trials and tribulations of IL-5, eosinophils, and allergic asthma. J Allergy Clin Immunol. 2001; 108(4):503–8.
93. Mishra A, Rothenberg ME. Intratracheal IL-13 induces eosinophilic esophagitis by an IL-5, eotaxin-1, and STAT6-dependent mechanism. Gastroenterology. 2003; 125(5):1419–27.
94. Straumann A, Conus S, Grzonka P, et al. Anti-interleukin-5 antibody treatment (mepolizumab) in active eosinophilic oesophagitis: a randomised, placebo- controlled, double-blind trial. Gut 2010;59:21–30. https://doi.org/10.1136/gut.2009.178558
95. Assa’ad AH, Gupta SK, Collins MH, et al. An antibody against IL-5 reduces numbers of esophageal intraepithelial eosinophils in children with eosinophilic esophagitis. Gastroenterology 2011;141:1593–1604. https://doi.org/10.1053/j.gastro.2011.07.044
96. Spergel JM, Rothenberg ME, Collins MH, et al. Reslizumab in children and adolescents with eosinophilic esophagitis: results of a double-blind, randomized, placebo-controlled trial. J Allergy Clin Immunol 2012;129:456–463. https://doi.org/10.1016/j.jaci.2011.11.044
97. Zuo L, Fulkerson PC, Finkelman FD, Mingler M, Fischetti CA, et al. IL-13 induces esophageal remodeling and gene expression by an eosinophil-independent, IL-13Rα2-inhibited pathway. J Immunol. 2010; 185(1):660–69. https://doi.org/10.4049/jimmunol.1000471
98. Doran E, Cai F, Holweg CTJ, Wong K, Brumm J, Arron JR. Interleukin-13 in Asthma and Other Eosinophilic Disorders. Front Med (Lausanne). 2017 Sep 19;4:139. https://doi.org/110.3389/fmed.2017.00139
99. Davis BP, Stucke EM, Khorki ME, et al. Eosinophilic esophagitis-linked calpain 14 is an IL-13- induced protease that mediates esophageal epithelial barrier impairment. JCI Insight 2016;1:86355. https://doi.org/10.1172/jci.insight.86355
100. Rothenberg ME, Wen T, Greenberg A, et al. Intravenous anti-IL-13 mAb QAX576 for the treatment of eosinophilic esophagitis. J Allergy Clin Immunol 2015;135:500-7. https://doi.org/10.1016/j.jaci.2014.07.049.
101. Blanchard C, Mishra A, Saito-Akei H, Monk P, Anderson I, Rothenberg ME. Inhibition of human interleukin-13-induced respiratory and oesophageal inflammation by anti-human-interleukin-13 antibody (CAT-354). Clin Exp Allergy. 2005; 35(8):1096–103.
102. Spergel BL, Ruffner MA, Godwin BC et al. Improvement in eosinophilic esophagitis when using dupilumab for other indications or compassionate use. Ann Allergy Asthma Immunol. 2022 May;128(5):589-593. doi: 10.1016/j.anai.2022.01.019. Epub 2022 Jan 25. PMID: 3508581
103. Laserna-Mendieta EJ, Casabona S, Guagnozzi D, et al. Efficacy of proton pump inhibitor therapy for eosinophilic oesophagitis in 630 patients: results from the EoEconnect registry. Aliment Pharmacol Ther 2020;52:798–807.
104. Lucendo AJ, Miehlke S, Schlag C, et al. Efficacy of budesonide orodispersible tablets as induction therapy for eosinophilic esophagitis in a randomized placebo-controlled trial. Gastroenterology 2019;157:74–86.
105. Straumann A, Lucendo AJ, Miehlke S, et al. Budesonide Orodispersible tablets maintain remission in a randomized, placebo-controlled trial of patients with eosinophilic esophagitis. Gastroenterology 2020;159:1672–85.
106. Валитова Э.Р., Эмбутниекс Ю.В., Березина О.И., Бордин Д.С., Хомерики С.Г., Казакова С.С. Эозинофильный эзофагит. Экспериментальная и клиническая гастроэнтерология. 2018;(10):115-119.
107. Study to Determine the Efficacy and Safety of Dupilumab in Adult and Adolescent Patients with Eosinophilic Esophagitis (EoE). Электронный ресурс: https://clinicaltrials.gov/ct2/show/NCT03633617.
108. Study to Investigate the Efficacy and Safety of Dupilumab in Pediatric Patients with Active Eosinophilic Esophagitis (EoE) (EoE KIDS). Электронный ресурс: https://clinicaltrials.gov/ct2/show/NCT04394351
109. Dellon ES, Khoury P, Muir AB, Liacouras CA, Safroneeva E, Atkins D, Collins MH, Gonsalves N, Falk GW, Spergel JM, Hirano I, Chehade M, Schoepfer AM, Menard-Katcher C, Katzka DA, Bonis PA, Bredenoord AJ, Geng B, Jensen ET, Pesek RD, Feuerstadt P, Gupta SK, Lucendo AJ, Genta RM, Hiremath G, McGowan EC, Moawad FJ, Peterson KA, Rothenberg ME, Straumann A, Furuta GT, Aceves SS. A Clinical Severity Index for Eosinophilic Esophagitis: Development, Consensus, and Future Directions. Gastroenterology. 2022 Jul;163(1):59-76. doi: 10.1053/j.gastro.2022.03.025. Epub 2022 May 20. PMID: 35606197; PMCID: PMC9233087.
110. Gomez Torrijos E, Gonzalez-Mendiola R, Alvarado M, Avila R, Prieto-Garcia A, Valbuena T, Borja J, Infante S, Lopez MP, Marchan E, Prieto P, Moro M, Rosado A, Saiz V, Somoza ML, Uriel O, Vazquez A, Mur P, Poza-Guedes P, Bartra J. Eosinophilic Esophagitis: Review and Update. Front Med (Lausanne). 2018 Oct 9;5:247. doi: 10.3389/fmed.2018.00247.
111. Barni S, Arasi S, Mastrorilli C, Pecoraro L, Giovannini M, Mori F, Liotti L, Saretta F, Castagnoli R, Caminiti L, Cianferoni A, Novembre E. Pediatric eosinophilic esophagitis: a review for the clinician. Ital J Pediatr. 2021 Nov 22;47(1):230. doi: 10.1186/s13052-021-01178-2
112. Young E., Philpott H. Pathophysiology of Dysphagia in Eosinophilic Esophagitis: Causes, Consequences, and Management. Dig Dis Sci. 2022; 67(4): 1101–1115
113. Shoda T, Wen T, Aceves SS, Abonia JP, Atkins D, Bonis PA, Caldwell JM, Capocelli KE, Carpenter CL, Collins MH, Dellon ES, Eby MD, Gonsalves N, Gupta SK, Falk GW, Hirano I, Menard-Katcher P, Kuhl JT, Krischer JP, Leung J, Mukkada VA, Spergel JM, Trimarchi MP, Yang GY, Zimmermann N, Furuta GT, Rothenberg ME; Consortium of Eosinophilic Gastrointestinal Disease Researchers (CEGIR). Eosinophilic oesophagitis endotype classification by molecular, clinical, and histopathological analyses: a cross-sectional study. Lancet Gastroenterol Hepatol. 2018 Jul;3(7):477-488. doi: 10.1016/S2468-1253(18)30096-7.
114. Keely S, Talley NJ. Endophenotyping eosinophilic oesophagitis: a new era for management? Lancet Gastroenterol Hepatol. 2018 Jul;3(7):449-450. doi: 10.1016/S2468-1253(18)30134-1.
115. Straumann A, Aceves SS, Blanchard C, Collins MH, Furuta GT, Hirano I. Pediatric and adult eosinophilic esophagitis: similarities and differences. Allergy. 2012 Apr. 67(4):477-90
116. Dellon ES, Gonsalves N, Hirano I, Furuta GT, Liacouras CA, Katzka DA. ACG clinical guideline: Evidenced based approach to the diagnosis and management of esophageal eosinophilia and eosinophilic esophagitis (EoE). The American journal of gastroenterology. 2013
117. Hirano I. Role of advanced diagnostics for eosinophilic esophagitis. Dig Dis. 2014;32(1-2):78-83.
118. Warners MJ, Hindryckx P, Levesque BG, Parker CE, Shackelton LM, Khanna R, Sandborn WJ, D'Haens GR, Feagan BG, Bredenoord AJ, Jairath V. Systematic Review: Disease Activity Indices in Eosinophilic Esophagitis. Am J Gastroenterol. 2017 Nov;112(11):1658-1669].
119. Gentile N, Katzka D, Ravi K, et al. Esophageal narrowing is common and frequently under-appreciated at endoscopy in patients with esophageal eosinophilia. Aliment Pharmacol Ther. 2014; 40:1333–1340.
120. Nelson MJ, Miller FH, Moy N, et al. Comparison of endoscopy and radiographic imaging for detection of esophageal inflammation and remodeling in adults with eosinophilic esophagitis. Gastrointest Endosc. 2018; 87:962–968.
121. Hassan M, Aceves S, Dohil R, et al. Esophageal compliance quantifies epithelial remodeling in pediatric patients with eosinophilic esophagitis. J Pediatr Gastroenterol Nutr. 2019; 68:559–565.
122. Collins MH, Martin LJ, Alexander ES, et al. Newly developed and validated eosinophilic esophagitis histology scoring system and evidence that it outperforms peak eosinophil count for disease diagnosis and monitoring. Dis Esophagus. 2017; 30:1–8.
123. Muir A, Falk GW. Eosinophilic Esophagitis: A Review. JAMA. 2021 Oct 5;326(13):1310-1318. doi: 10.1001/jama.2021.14920
124. Campora M, Mastracci L, Carlin L, Unti E, Parente P, Fassan M, Ferro J, Errico ME, Donofrio V, Grillo F. Pathologist's approach to paediatric and neonatal eosinophilic gastrointestinal disorders. Pathologica. 2022 Feb;114(1):79-88
125. Collins MH, Martin LJ, Alexander ES, Boyd JT, Sheridan R, He H, Pentiuk S, Putnam PE, Abonia JP, Mukkada VA, Franciosi JP, Rothenberg ME. Newly developed and validated eosinophilic esophagitis histology scoring system and evidence that it outperforms peak eosinophil count for disease diagnosis and monitoring. Dis Esophagus. 2017 Feb 1;30(3):1-8. doi: 10.1111/dote.12470. PMID: 26857345; PMCID: PMC5373936.
126. Zand Irani M, Talley NJ, Ronkainen J, Aro P, Andreasson A, Agreus L, Vieth M, Jones MP, Walker MM. Neutrophils, eosinophils, and intraepithelial lymphocytes in the squamous esophagus in subjects with and without gastroesophageal reflux symptoms. Hum Pathol. 2021 Sep;115:112-122.
127. Gentile N, Katzka D, Ravi K, Trenkner S, Enders F, Killian J, Kryzer L, Talley NJ, Alexander J. Oesophageal narrowing is common and frequently under-appreciated at endoscopy in patients with oesophageal eosinophilia. Aliment Pharmacol Ther. 2014 Dec;40(11-12):1333-40. doi: 10.1111/apt.12977.
128. Binkovitz LA, Lorenz EA, Di Lorenzo C, Kahwash S. Pediatric eosinophilic esophagitis: radiologic findings with pathologic correlation. Pediatr Radiol. 2010 May;40(5):714-9. doi: 10.1007/s00247-009-1484-2.
129. Gonzalez Ayerbe JI, Hauser B, Salvatore S, Vandenplas Y. Diagnosis and Management of Gastroesophageal Reflux Disease in Infants and Children: from Guidelines to Clinical Practice. Pediatr Gastroenterol Hepatol Nutr. 2019 Mar;22(2):107-121
130. Iwakiri K, Fujiwara Y, Manabe N, Ihara E, Kuribayashi S, Akiyama J, Kondo T, Yamashita H, Ishimura N, Kitasako Y, Iijima K, Koike T, Omura N, Nomura T, Kawamura O, Ohara S, Ozawa S, Kinoshita Y, Mochida S, Enomoto N, Shimosegawa T, Koike K. Evidence-based clinical practice guidelines for gastroesophageal reflux disease 2021. J Gastroenterol. 2022 Apr;57(4):267-285].
131. Sodikoff J, Hirano I. Proton pump inhibitor-responsive esophageal eosinophilia does not preclude food-responsive eosinophilic esophagitis. J Allergy Clin immunol 2016;137:631-633
132. Lucendo AJ, Arias A, Gonzalez-Cervera J, et al. Dual response to dietary/topical steroid and proton pump inhibitor therapy in adult patients with eosinophilic esophagitis. J Allergy Clin Immunol 2016; 137:931-934
133. J.M. Spergel Allergy testing in eosinophilic esophagitis. UpToDate. December 2022
134. Cotton CC, Erim D, Eluri S, et al. Cost utility analysis of topical steroids compared with die-tary elimination for treatment of eosinophilic esophagitis. Clin Gastroenterol Hepatol 2017; 15:841–9
135. Kagalwalla A, Amsden K, Makhija MM, et al. A multicenter study assessing the clinical, en-doscopic and histologic response to four food elimination diet for the treatment of eosino-philic esophagitis. Gastroenterology 2015;148(Suppl 1):S-30].
136. Hirano, E. S. Chan, M. Rank et al. AGA Institute and the Joint Task Force on Allergy-Immunology Practice Parameters Clinical Guidelines for the Management of Eosinophilic Esophagitis. Gastroenterology 2020; 158: 1776-1786
137. Khokhar D., Marella S., Idelman G., Chang J.W., Chehade M., Hogan S.P. Eosinophilic esophagitis: Immune mechanisms and therapeutic targets. Clin Exp Allergy. 2022; 52(10): 1142–1156.
138. Blanchard C, Stucke EM, Rodriguez‐Jimenez B, et al. A striking local esophageal cytokine expression profile in eosinophilic esophagitis. J Allergy Clin Immunol. 2011;127(1):208‐217
139. Blanchard C, Stucke EM, Burwinkel K, et al. Coordinate interaction between IL‐13 and epithelial differentiation cluster genes in eosinophilic esophagitis. J Immunol. 2010;184(7):4033‐4041.
140. Visaggi P, Ghisa M, Marabotto E, Venturini A, Stefani Donati D, Bellini M, Savarino V, de Bortoli N, Savarino E. Esophageal dysmotility in patients with eosinophilic esophagitis: pathogenesis, assessment tools, manometric characteristics, and clinical implications. Esophagus. 2023 Jan;20(1):29-38.
141. Warners MJ, Vlieg-Boerstra BJ, Verheij J, van Rhijn BD, Van Ampting MT, Harthoorn LF, de Jonge WJ, Smout AJ, Bredenoord AJ. Elemental diet decreases inflammation and improves symptoms in adult eosinophilic oesophagitis patients. Aliment Pharmacol Ther. 2017 Mar;45(6):777-787. doi: 10.1111/apt.13953. Epub 2017 Jan 23. PMID: 28112427; PMCID: PMC5324627
142. Peterson KA, Boynton KK. Which patients with eosinophilic esophagitis (EoE) should receive elemental diets versus other therapies? Curr Gastroenterol Rep 2014;16:364.
143. Groetch M, Venter C, Skypala I, et al. Dietary therapy and nutrition management of eosinophilic esophagitis: a work group report of the American Academy of allergy, asthma, and immunology. J Allergy Clin Immunol 2017;5:312–24
144. Cianferoni A, Shuker M, Brown-Whitehorn T, et al. Food avoidance strategies in eosinophilic oesophagitis. Clin Exp Allergy 2019;49:269-284
145. Sova C, Feuling MB, Baumler M, et al. Systematic review of nutrient intake and growth in children with multiple IgE-mediated food allergies. Nutr Clin Pract 2013;28:669–75.
146. Lucendo AJ, Molina-Infante J. Dietary therapy for eosinophilic esophagitis: chances and limitations in the clinical practice. Expert Rev Gastroenterol Hepatol. 2020 Oct;14(10):941-952. doi: 10.1080/17474124.2020
147. Vazquez-Elizondo G, Ngamruengphong S, Khrisna M, et al. The outcome of patients with oesophageal eosinophilic infiltration after an eight-week trial of a proton pump inhibitor. Aliment Pharmacol Ther 2013; 38: 1312–1319.
148. Dellon ES, Speck O, Woodward K, et al. Clinical and endoscopic characteristics do not reliably differentiate PPI-responsive esophageal eosinophilia and eosinophilic esophagitis in patients undergoing upper endoscopy: a prospective cohort study. Am J Gastroenterol 2013; 108: 1854–1860
149. Franciosi JP, Mougey EB, Dellon ES, Gutierrez-Junquera C, Fernandez-Fernandez S, Venkatesh RD, Gupta SK. Proton Pump Inhibitor Therapy for Eosinophilic Esophagitis: History, Mechanisms, Efficacy, and Future Directions. J Asthma Allergy. 2022 Feb 26;15:281-302. doi: 10.2147/JAA.S274524. PMID: 35250281; PMCID: PMC8892718
150. Gutiérrez-Junquera C, Fernández-Fernández S, Cilleruelo ML, et al. Long-term treatment with proton pump inhibitors is effective in children with eosinophilic esophagitis. J Pediatr Gastroenterol Nutr 2018;67:210–6
151. Aceves SS, Bastian JF, Newbury RO, Dohil R. Oral viscous budesonide: a potential new therapy for eosinophilic esophagitis in children. Am J Gastroenterol. 2007 Oct;102(10):2271-9; quiz 2280. doi: 10.1111/j.1572-0241.2007.01379.x. Epub 2007 Jun 20. PMID: 17581266
152. Bonis P.A.L., Gupta S.K. Treatment of eosinophilic esophagitis (EoE). UpToDate November 21, 2022
153. Dellon ES, Katzka DA, Collins MH, Hamdani M, Gupta SK, Hirano I; MP-101-06 Investigators. Budesonide Oral Suspension Improves Symptomatic, Endoscopic, and Histologic Parameters Compared With Placebo in Patients With Eosinophilic Esophagitis. Gastroenterology. 2017 Mar;152(4):776-786.e5. doi: 10.1053/j.gastro.2016.11.021.
154. Hirano I, Collins MH, Katzka DA, Mukkada VA, Falk GW, Morey R, Desai NK, Lan L, Williams J, Dellon ES; ORBIT1/SHP621-301 Investigators. Budesonide Oral Suspension Improves Out-comes in Patients With Eosinophilic Esophagitis: Results from a Phase 3 Trial. Clin Gastroenterol Hepatol. 2022 Mar;20(3):525-534.e10. doi: 10.1016/j.cgh.2021.04.022. Epub 2021 Apr 19. Erratum in: Clin Gastroenterol Hepatol. 2022 Oct;20(10):2418. PMID: 33887475
155. Andreae DA, Hanna MG, Magid MS, et al. Swallowed fluticasone propionate is an effective long-term maintenance therapy for children with eosinophilic esophagitis. Am J Gastroenterol 2016;111:1187–1197
156. Tomizawa Y, Melek J, Komaki Y, Kavitt RT, Sakuraba A. Efficacy of Pharmacologic Therapy for Eosinophilic Esophagitis: A Systematic Review and Network Meta-Analysis. J Clin Gastroenterol. 2018 Aug;52(7):596-606. doi: 10.1097/MCG.0000000000000878. PMID: 28787360.
157. Dellon ES, Spergel JM. Biologics in eosinophilic gastrointestinal diseases. Ann Allergy Asthma Immunol. 2023 Jan;130(1):21-27. doi: 10.1016/j.anai.2022.06.015. Epub 2022 Jun 20. PMID: 35738437; PMCID: PMC10191215.
158. Tamarit-Sebastian S, Ferrer-Soler FM, Lucendo AJ. Current options and investigational drugs for the treatment of eosinophilic esophagitis. Expert Opin Investig Drugs. 2022 Feb;31(2):193-210. doi: 10.1080/13543784.2022.2033207. Epub 2022 Jan 31. PMID: 35072575.
159. Dellon ES, Rothenberg ME, Collins MH, Hirano I, Chehade M, Bredenoord AJ, Lucendo AJ, Spergel JM, Aceves S, Sun X, Kosloski MP, Kamal MA, Hamilton JD, Beazley B, McCann E, Patel K, Mannent LP, Laws E, Akinlade B, Amin N, Lim WK, Wipperman MF, Ruddy M, Patel N, Weinreich DR, Yancopoulos GD, Shumel B, Maloney J, Giannelou A, Shabbir A. Dupilumab in Adults and Adolescents with Eosinophilic Esophagitis. N Engl J Med. 2022 Dec 22;387(25):2317-2330
160. Marc E. Rothenberg, Evan S. Dellon, Margaret H. Collins, Albert J. Bredenoord, Ikuo Hirano, Kathryn A. Peterson, Laura Brooks, Harald Fjallbrant, Hanna K. Grindebacke, Calvin N. Ho, Matthew Keith, Christopher McCrae, Wendy White, Catherine Datto. EFFICACY AND SAFETY OF BENRALIZUMAB IN ADULTS AND ADOLESCENTS WITH EOSINOPHILIC ESOPHAGITIS: RESULTS FROM THE 24-WEEK DOUBLE-BLIND PERIOD OF THE PHASE 3 MESSINA TRIAL. DDW 2023 Poster.
161. ClinicalTrials.gov Identifier: NCT04543409: A Multicenter, Randomized, Double-blind, Parallel-group, Placebo Controlled Study to Investigate the Use of Benralizumab for Eosinophilic Esophagitis. NCT04543409,A Study of Benralizumab in Patients With Eosinophilic Esophagitis,https://beta.clinicaltrials.gov/study/NCT04543409,Eosinophilic Esophagitis,BIOLOGICAL: Benralizumab|BIOLOGICAL: Matching placebo,AstraZeneca
162. Hudgens S, Evans C, Phillips E, Hill M. Psychometric validation of the Dysphagia Symptom Questionnaire in patients with eosinophilic esophagitis treated with budesonide oral suspension. J Patient Rep Outcomes. 2017;1(1):3. doi: 10.1186/s41687-017-0006-5. Epub 2017 Sep 12. PMID: 29757322; PMCID: PMC5934937.
163. Taft TH, Kern E, Kwiatek MA, Hirano I, Gonsalves N, Keefer L. The adult eosinophilic oesophagitis quality of life questionnaire: a new measure of health-related quality of life. Aliment Pharmacol Ther. 2011 Oct;34(7):790-8.
164. Ma, C.; Bredenoord, A.J.; Dellon, E.S.; Alexander, J.A.; Biedermann, L.; Hogan, M.; Guizzetti, L.; Zou, G.; Katzka, D.A.; Chehade, M.; et al. Reliability and Responsiveness of Endoscopic Disease Activity Assessment in Eosinophilic Esophagitis. Gastrointest. Endosc. 2022, 95, 1126–1137.e2.
165. Thel HL, Anderson C, Xue AZ, Jensen ET, Dellon ES. Prevalence and Costs of Eosinophilic Esophagitis in the United States. Clin Gastroenterol Hepatol. 2025 Feb;23(2):272-280.e8. doi: 10.1016/j.cgh.2024.09.031.
166. Dellon ES, Muir AB, Katzka DA, Shah SC, Sauer BG, Aceves SS, Furuta GT, Gonsalves N, Hirano I. ACG Clinical Guideline: Diagnosis and Management of Eosinophilic Esophagitis. Am J Gastroenterol. 2025 Jan 1;120(1):31-59. doi: 10.14309/ajg.0000000000003194. Epub 2025 Jan 2. PMID: 39745304.
167. Amil-Dias J, Oliva S, Papadopoulou A, Thomson M, Gutiérrez-Junquera C, Kalach N, Orel R, Auth MK, Nijenhuis-Hendriks D, Strisciuglio C, Bauraind O, Chong S, Ortega GD, Férnandez SF, Furman M, Garcia-Puig R, Gottrand F, Homan M, Huysentruyt K, Kostovski A, Otte S, Rea F, Roma E, Romano C, Tzivinikos C, Urbonas V, Velde SV, Zangen T, Zevit N. Diagnosis and management of eosinophilic esophagitis in children: An update from the European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN). J Pediatr Gastroenterol Nutr. 2024 Aug;79(2):394-437. doi: 10.1002/jpn3.12188. Epub 2024 Jun 24. PMID: 38923067.
168. Oliva S, Arrigo S, Bramuzzo M, Cisarò F, Dabizzi E, Di Nardo G, Gandullia P, Martinelli M, Mennini M, Monica F, Norsa L, Rea F, Renzo S, Romano C, Salvatore S, Savarino EV, Strisciuglio C, Tambucci R, Calabrese C, De Angelis P; Italian Society of Pediatric Gastroen-terology Hepatology and Nutrition (SIGENP), The Italian Association of Hospital Gastroen-terologists and Endoscopists (AIGO), The Italian Society of Gastroenterology (SIGE), and The Italian Society of Digestive Endoscopy (SIED). Eosinophilic esophagitis in children and adolescents: a clinical practice guideline. Ital J Pediatr. 2025 Jul 23;51(1):242. doi: 10.1186/s13052-025-02056-x. PMID: 40702503; PMCID: PMC12288368.
169. Mayerhofer C., Kavallar A.M., Aldrian D., Lindner A.K., Müller T., Vogel G.F. Efficacy of Elimination Diets in Eosinophilic Esophagitis: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2023;21(9):2197-2210.e3. https://doi.org/10.1016/j.cgh.2023.01.019
170. Cotton C.C., Eluri S., Wolf W.A., Dellon E.S. Six-Food Elimination Diet and Topical Ster-oids are Effective for Eosinophilic Esophagitis: A Meta-Regression. Dig Dis Sci. 2017;62(9):2408-2420. https://doi.org/10.1007/s10620-017-4642-7
171. Arias Á., Tejera-Muñoz A., Gutiérrez-Ramírez L., Molina-Infante J., Lucendo A.J. Efficacy of Dietary Therapy for Eosinophilic Esophagitis in Children and Adults: An Updated Sys-tematic Review and Meta-Analysis. Nutrients. 2024; 16(14):2231. https://doi.org/10.3390/nu16142231
172. Кайбышева, В. О. Лечение эозинофильного эзофагита: обзор литературы и описание собственных клинических наблюдений / В. О. Кайбышева, Е. Д. Федоров, С. Г. Ша-повальянц // Российский аллергологический журнал. – 2025. – Т. 22, № 1. – С. 23-43. – DOI 10.36691/RJA17001. – EDN KGCPXZ.
173. Wechsler J.B., Schwartz S., Arva N.C., Kim K.A., Chen L., Makhija M., et al. A Single-Food Milk Elimination Diet Is Effective for Treatment of Eosinophilic Esophagitis in Children. Clin Gastroenterol Hepatol. 2022 Aug;20(8):1748-1756.e11. https://doi.org/10.1016/j.cgh.2021.03.049
174. Chehade M. et al. Dupilumab for Eosinophilic Esophagitis in Patients 1 to 11 Years of Age. N Engl J Med. 2024 Jun 27;390(24):2239-2251. doi: 10.1056/NEJMoa2312282. PMID: 38924731
175. Kerlin P, Jones D, Remedios M, Campbell C. Prevalence of eosinophilic esophagitis in adults with food bolus obstruction of the esophagus. J Clin Gastroenterol. 2007;41:356-361.
176. Byrne KR, Panagiotakis PH, Hilden K, Thomas KL, Peterson KA, Fang JC. Retrospective Analysis of Esophageal Food Impaction: Differences in Etiology by Age and Gender. Dig Dis Sci. 2007.
177. Kirchner GI, Zuber-Jerger I, Endlicher E, Gelbmann C, Ott C, Ruemmele P, Scholmerich J, Klebl F. Causes of bolus impaction in the esophagus. Surg Endosc. 2011;25:3170-3174. https://doi.org/10.1007/s00464-011-1681-6
178. Sperry SL, Crockett SD, Miller CB, Shaheen NJ, Dellon ES. Esophageal foreign-body impac-tions: epidemiology, time trends, and the impact of the increasing prevalence of eosinophilic esophagitis. Gastrointest Endosc. 2011;74:985-991. https://doi.org/10.1016/j.gie.2011.06.029
179. Hurtado CW, Furuta GT, Kramer RE. Etiology of esophageal food impactions in children. J Pediatr Gastroenterol Nutr. 2011;52:43-46. https://doi.org/10.1097/MPG.0b013e3181e67072
180. Diniz LO, Towbin AJ. Causes of Esophageal Food Bolus Impaction in the Pediatric Popula-tion. Dig Dis Sci. 2011. https://doi.org/10.1007/s10620-011-1911-8 65. Mahesh VN, Hol-loway RH, Nguyen NQ. Changing epidemiology of food bolus impaction: is eosinophilic esophagitis to blame? J Gastroenterol Hepatol. 2013;28:963-966. https://doi.org/10.1111/jgh.12135
181. Heerasing N, Lee SY, Alexander S, Dowling D. Prevalence of eosinophilic oesophagitis in adults presenting with oesophageal food bolus obstruction. World J Gastrointest Pharmacol Ther 2015;6:244-247.https://doi.org/10.4292%2Fwjgpt.v6.i4.244
182. Philpott H, Nandurkar S, Thien F, Bloom S, Lin E, Goldberg R, Boyapati R, Finch A, Royce SG, Gibson PR. Seasonal Recurrence of Food Bolus Obstruction in Eosinophilic Esophagitis. Intern Med J. 2015;45:939-943. https://doi.org/10.1111/imj.12790
183. Hiremath GS, Hameed F, Pacheco A, Olive A, Davis CM, Shulman RJ. Esophageal Food impaction and eosinophilic esophagitis: a retrospective study, systematic review, and metaa-nalysis. Dig Dis Sci. 2015;60:3181-3193. https://doi.org/10.1007/s10620-015-3723-8
184. Gretarsdottir HM, Jonasson JG, Bjornsson ES. Etiology and management of esophageal food impaction: a population based study. Scand J Gastroenterol. 2015;50:513-518. https://doi.org/10.3109/00365521.2014.983159 70. Truskaite K, Dlugosz A. Prevalence of Eosinophilic Esophagitis and Lymphocytic Esophagitis in Adults with Esophageal Food Bo-lus Impaction. Gastroenterol Res Pract. 2016. https://doi.org/10.1155/2016/9303858
185. Jensen ET, Kuhl JT, Martin LJ, Rothenberg ME, Dellon ES. Prenatal, intrapartum, and post-natal factors are associated with pediatric eosinophilic esophagitis. J Allergy Clin Immunol. 2018;141(1):214‐222
186. Dhaliwal J, Tobias V, Sugo E, et al. Eosinophilic esophagitis in children with esophageal atre-sia. Dis Esophagus. 2014;27(4):340‐347
187. Franciosi JP, Hommel KA, Greenberg AB, et al. Development of the pediatric quality of life inventory eosinophilic esophagitis module items: qualitative methods. BMC Gastroenter-ol.2012;12(12):135
188. Cotton CC, Woosley JT, Moist SE, et al. Determination of a treatment response threshold for the eosinophilic esophagitis endoscopic reference score. Endoscopy. 2022;54(7):635‐643
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Драпкина О.М., академик РАН, профессор, д.м.н.; директор ФГБУ «НМИЦ ТПМ» Минздрава России, главный внештатный специалист по терапии и общей врачебной практике Минздрава России, заслуженный врач Российской Федерации, член президиума ВАК при Министерстве науки и высшего образования Российской Федерации, лауреат премии Правительства Российской Федерации в области образования, член Экспертного совета по здравоохранению Комитета Совета Федерации по Социальной политике Федерального Собрания Российской Федерации, заместитель председателя Научно-практического совета Министерства здравоохранения Российской Федерации, член Общественной палаты Российской Федерации.
Ивашкин В.Т., академик РАН, профессор, д.м.н.; заведующий кафедрой пропедевтики внутренних болезней, гастроэнтерологии и гепатологии, ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Министерства здравоохранения Российской Федерации (Сеченовский Университет); главный внештатный специалист гастроэнтеролог МЗ РФ; президент Российского общества по изучению печени (РОПИП).
Маев И.В., академик РАН, профессор, д.м.н.; заведующий кафедрой пропедевтики внутренних болезней и гастроэнтерологии, первый проректор Федерального государственного бюджетного образовательного учреждения высшего образования Российский университет медицины Министерства здравоохранения Российской Федерации (ФГБОУ ВО Российский университет медицины. Минздрава России, быв. МГМСУ им. А.И. Евдокимова), г. Москва.
Намазова-Баранова Л.С., академик РАН, профессор, д.м.н., президент Союза педиатров России; паст-президент EPA/UNEPSA; руководитель НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В. Петровского», заведующая кафедрой факультетской педиатрии ИМД ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), главный внештатный детский специалист по профилактической медицине Минздрава России.
Баранов А.А., академик РАН, профессор, д.м.н.; почетный президент Союза педиатров России, советник руководителя НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В. Петровского», профессор кафедры педиатрии и детской ревматологии КИДЗ им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), главный внештатный специалист педиатр Минздрава России.
Хаитов М.Р., академик РАН, д-р мед. наук, проф., директор ФГБУ "ГНЦ Институт иммунологии" ФМБА России; зав. каф. иммунологии МБФ, ФГАОУ ВО РНИМУ, им. Н.И. Пирогова Минздрава России (Пироговский Университет), Москва, Российская Федерация.
Михалева Л.М., член-корр. РАН, д.м.н., профессор, научный руководитель по патологической анатомии Научно-исследовательского института морфологии человека имени академика А.П. Авцына ФГБНУ "Российский научный центр хирургии имени академика Б.В. Петровского", Москва, Россия.
Кайбышева В.О., к.м.н., старший научный сотрудник научно-исследовательской лаборатории хирургической гастроэнтерологии и эндоскопии Института хирургии ФГАОУ ВО РНИМУ им. Н.И. Пирогова (Пироговский Университет), доцент кафедры гастроэнтерологии ФГУП "НМИЦ терапии и профилактической медицины" Минздрава России, врач-гастроэнтеролог ГБУЗ ГКБ №31 им академика Г.М. Савельевой ДЗ г Москвы.
Вишнева Е.А., д.м.н., профессор РАН, заместитель руководителя по науке НИИ педиатрии и охраны здоровья детей детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В. Петровского», профессор кафедры факультетской педиатрии ИМД ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), член Союза педиатров России, Москва.
Федоров Е.Д., д.м.н., профессор, главный научный сотрудник научно-исследовательской лаборатории хирургической гастроэнтерологии и эндоскопии Института хирургии ФГАОУ ВО РНИМУ им. Н.И.Пирогова (Пироговский Университет); ГБУЗ ГКБ №31 им. академика Г.М. Савельевой ДЗ г. Москвы.
Трухманов А.С., д.м.н., профессор, профессор кафедры пропедевтики внутренних болезней, гастроэнтерологии и гепатологии, ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Министерства здравоохранения Российской Федерации (Сеченовский Университет)
Лапина Т.Л., к.м.н, доцент кафедры пропедевтики внутренних болезней, гастроэнтерологии и гепатологии, ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Министерства здравоохранения Российской Федерации (Сеченовский Университет)
Маслёнкина К.С., к.м.н., старший научный сотрудник Научно-исследовательского института морфологии человека имени академика А.П. Авцына ФГБНУ "Российский научный центр хирургии имени академика Б.В. Петровского", Москва, Россия.
Алексеева А.А., к.м.н., заведующая многопрофильным педиатрическим дневным стационаром, ведущий научный сотрудник НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В. Петровского», член Союза педиатров России, Москва.
Балыкова Л.А., д.м.н., профессор, член-корреспондент РАН, директор Медицинского института, заведующая кафедрой педиатрии ФГБОУ ВО «Мордовского государственного университета им. Н.П. Огарёва», член Союза педиатров России, Саранск.
Бордин Д.С., д.м.н., зав. отделом патологии поджелудочной железы, желчных путей и верхних отделов пищеварительного тракта МКНЦ имени А.С. Логинова, профессор кафедры пропедевтики внутренних болезней и гастроэнтерологии, ФГБОУ ВО Московский государственный медико-стоматологический университет им. А.И. Евдокимова, Москва.
Будкина Т.Н., к.м.н., старший научный сотрудник, врач-эндоскопист отделения эндоскопических исследований ФГАУ «НМИЦ здоровья детей» Минздрава России.
Булгакова В.А., д.м.н., профессор кафедры факультетской педиатрии ИМД ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), заведующая отделом научно-информационного развития детей НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В. Петровского», член Союза педиатров России, Москва.
Вахлова И.В., д.м.н., профессор, декан педиатрического факультета, заведующая кафедрой госпитальной педиатрии ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России, член Союза педиатров России, Екатеринбург.
Валитова Э.Р., к.м.н., заведующая лабораторией функциональной диагностики заболеваний пищевода и желудка ЦНИИ гастроэнтерологии Московского клинического научного центра им. А.С. Логинова, г. Москва.
Вязанкина С.С., младший научный сотрудник, врач-аллерголог-иммунолог Лаборатории клинической иммунологии и нутрициологии ФГАУ «НМИЦ здоровья детей» Минздрава России.
Горбачев Е.В., к.м.н., врач-эндоскопист ГБУЗ ГКБ №31 им академика Г.М. Савельевой ДЗ г Москвы, ассистент кафедры госпитальной хирургии №2 лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова.
Иванова Е.В., д.м.н., главный научный сотрудник НИЛ хирургической гастроэнтерологии и эндоскопии Института хирургии ФГАОУ ВО РНИМУ им. Н.И. Пирогова (Пироговский Университет) Минздрава России, Руководитель центра экспертной эндоскопии и гастроэнтерологии клиники Медэксперт Плюс.
Ильина Н.И., д.м.н., профессор, заместитель директора по клинической работе, главный врач ФГБУ «ГНЦ Институт иммунологии» ФМБА России, профессор кафедры иммунологии ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, вице-президент Российской ассоциации аллергологов и клинических иммунологов, Москва.
Кайтукова Е.В., к.м.н., заместитель руководителя по медицинской деятельности, руководитель консультативно-диагностического центра для детей, старший научный сотрудник детей НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В. Петровского», доцент кафедры факультетской педиатрии ИМД ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), член Союза педиатров России, Москва.
Кирюхин А.П., к.м.н., врач-эндоскопист отделения диагностической и лечебной эндоскопии Университетской клинической больницы № 2, ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Министерства здравоохранения Российской Федерации (Сеченовский Университет).
Ковтун О.П., д.м.н., профессор, академик РАН, главный педиатр Уральского федерального округа, ректор ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России, вице-президент Союза педиатров России, Екатеринбург.
Комарова Е.В., д.м.н., заместитель руководителя по экспертизе инновационных методов лечения и реабилитации, врач-гастроэнтеролог, гл.н.с. отдела орфанных болезней и профилактики инвалидизирующих заболеваний НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В. Петровского», профессор кафедры факультетской педиатрии Института материнства и детства ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России (Пироговский Университет), член Союза педиатров России
Корниенко Е.А., д.м.н., профессор, профессор кафедры детских болезней им.профессора И.М. Воронцова Факультета послевузовского и дополнительного профессионального образования ФГБОУ ВО СПбГПМУ Минздрава России, главный внештатный специалист по детской гастроэнтерологии и эндоскопии Санкт-Петербурга, президент Ассоциации детских гастроэнтерологов Санкт-Петербурга "Диреал", Санкт-Петербург.
Куваев Р.О., к.м.н., врач-эндоскопист, гастроэнтеролог эндоскопического отделения ГБУЗ Ярославской области "Клиническая онкологическая больница".
Куличенко Т.В., д.м.н., профессор, руководитель НМИЦ по педиатрии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, профессор кафедры факультетской педиатрии ИМД ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), член Союза педиатров России, Москва.
Курбачева О.М., д.м.н., профессор, заведующая отделением № 85 бронхиальной астмы ФГБУ «ГНЦ Институт иммунологии» ФМБА России, член Российской ассоциации аллергологов и клинических иммунологов (РААКИ), Москва.
Левина Ю.Г., д.м.н., заведующая отделом клинической аллергологии и иммунологии НИИ педиатрии и охраны здоровья детей ФГБНУ «РНЦХ им. акад.Б.В. Петровского», профессор кафедры факультетской педиатрии ИМД ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), член Союза педиатров России, Москва.
Лохматов М.М., д.м.н., профессор кафедры детской хирургии и урологии – уроандрологии им. Л.П. Александрова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), заведующий отделением эндоскопических исследований ФГАУ «НМИЦ здоровья детей» Минздрава России.
Макарова С.Г., д.м.н., профессор, заместитель директора ФГАУ «НМИЦ здоровья детей» Минздрава России по научной работе, профессор кафедры педиатрии и общественного здоровья Института подготовки медицинских кадров ФГАУ «НМИЦ здоровья детей», главный внештатный специалист Минздрава России по медицинской помощи в образовательных организациях в ЦФО, г. Москва.
Ненашева Н.М., д.м.н., профессор, заведующая кафедрой аллергологии и иммунологии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» МЗ Российской Федерации, г. Москва.
Никонов Е.Л., д.м.н., профессор, заведующий кафедрой гастроэнтерологии Факультета дополнительного профессионального образования Российского национального исследовательского медицинского университета им. Н.И. Пирогова, г. Москва.
Новик Г.А., д.м.н., профессор, заведующий кафедрой педиатрии им. профессора И.М. Воронцова ФП и ДПО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России, главный внештатный детский специалист по профилактической медицине в Северо-Западном федеральном округе, член Союза педиатров России, Санкт-Петербург.
Павлов П.В., к.м.н., заведующий отделением диагностической и лечебной эндоскопии Университетской клинической больницы № 2, ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Министерства здравоохранения Российской Федерации (Сеченовский Университет).
Параскевова А.В., к.м.н., врач отделения функциональной диагностики Клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко, ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Министерства здравоохранения Российской Федерации (Сеченовский Университет).
Пирогов С.С., д.м.н, заведующий отделом эндоскопии МНИОИ им. П.А. Герцена, филиала ФГБУ «НМИЦ Радиологии» МЗ РФ, член экспертного совета МЗ РФ по специальности "Гастроэнтерология".
Привалова Т.Е., к.м.н., заведующая учебной частью, доцент кафедры факультетской педиатрии ИМД ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), член Союза педиатров России, Москва.
Приворотский В.Ф., д.м.н., профессор кафедры детских болезней им. профессора И.М.Воронцова Факультета послевузовского и дополнительного профессионального образования ФГБОУ ВО СПбГПМУ Минздрава России, Санкт-Петербург.
Румянцева Д.Е., к.м.н., врач отделения гастроэнтерологии клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко, ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Министерства здравоохранения Российской Федерации (Сеченовский Университет)
Селимзянова Л.Р., к.м.н., ведущий научный сотрудник детей НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В. Петровского», доцент кафедры факультетской педиатрии ИМД ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), доцент кафедры педиатрии и детской ревматологии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), член Союза педиатров России, Москва.
Смолкин Ю.С., д.м.н., профессор кафедры аллергологии и клинической иммунологии ГОУ ИПК ФМБА России. Президент Ассоциации детских аллергологов и иммунологов России.
Сторонова О.А., к.м.н., врач отделения функциональной диагностики Клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко, ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Министерства здравоохранения Российской Федерации (Сеченовский Университет)
Сурков А.Н., д.м.н., заведующий отделением гастроэнтерологии для детей НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В. Петровского», профессор кафедры факультетской педиатрии ИМД ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), врач-гастроэнтеролог, член Союза педиатров России.
Тертычный А.С., д.м.н., профессор, Институт клинической морфологии и цифровой патологии, ФГАОУ ВО «Первый Московский государственный университет им. И.М. Сеченова» Министерства здравоохранения Российской Федерации (Сеченовский Университет).
Ткаченко М.А., к.м.н., член Союза педиатров России.
Устинова Н.В., д.м.н., заведующая отделом социальной педиатрии и организации мультидисциплинарного сопровождения детей НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В. Петровского», ГБУЗ «Научно-практический центр психического здоровья детей и подростков им. Г.Е. Сухаревой ДЗМ», врач-психиатр, организатор здравоохранения, член Союза педиатров России, Москва.
Фомина Д.С., д.м.н., заведующая Центром аллергологии и иммунологии ГБУЗ «Городская клиническая больница № 52 Департамента здравоохранения города Москвы», доцент кафедры клинической иммунологии и аллергологии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), член Союза педиатров России, Москва.
Хавкин А.И., д.м.н., профессор, руководитель Московского областного центра детской гастроэнтерологии и гепатологии им. А.В. Мазурина Научно-исследовательского клинического института детства Министерства здравоохранения Московской области; профессор кафедры педиатрии болезней Медицинского института Белгородского государственного национального исследовательского университета, председатель Общества детских гастроэнтерологов, гепатологов и нутрициологов России, член Союза педиатров России.
Хакимова Р.Ф., д.м.н., профессор кафедры клинической иммунологии с аллергологией ФГБОУ ВО «Казанский государственный медицинский университет».
Шаповальянц С.Г., д.м.н., профессор, заведующий научно-образовательным центром «Абдоминальная хирургия и эндоскопия" и кафедрой госпитальной хирургии №2 лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова.
Эфендиева К.Е., к.м.н., заместитель руководителя по международным связям и образовательной деятельности, ведущий научный сотрудник НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В.Петровского», доцент кафедры факультетской педиатрии ИМД ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (пироговский Университет), ответственный секретарь Союза педиатров России, Москва.
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2. Методология разработки клинических рекомендаций
Предлагаемые рекомендации имеют своей целью довести до практических врачей современные представления об этиологии и патогенезе эозинофильного эзофагита, познакомить с применяющимся в настоящее время алгоритмом диагностики и лечения.
Целевая аудитория данных клинических рекомендаций:
1. Врачи-гастроэнтерологи
2. Врачи общей практики (семейные врачи)
3. Врачи-терапевты
4. Врачи-эндоскописты
5. Врачи-патологоанатомы
6. Врачи-педиатры
7. Врачи-аллергологи-иммунологи
8. Студенты медицинских ВУЗов, обучающиеся в ординатуре и аспирантуре
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
|
УДД |
Расшифровка |
|
1 |
Систематический обзор РКИ с применением мета-анализа |
|
2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
|
3 |
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
|
УУР |
Расшифровка |
|
А |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
В |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
С |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной̆ медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1. Приказ Минздравсоцразвития России от 16 апреля 2012 г. № 366н "Об утверждении Порядка оказания педиатрической помощи"
2. Приказ Минздрава России от 12 ноября 2012 г. № 906н "Об утверждении Порядка оказания медицинской помощи населению по профилю "гастроэнтерология"
3. Приказ Минздрава России от 24 ноября 2021 г. №1094н «Об утверждении Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, Порядка оформления указанных бланков, их учета и хранения, форм бланков рецептов, содержащих назначение наркотических средств или психотропных веществ, Порядка их изготовления, распределения, регистрации, учета и хранения, а также Правил оформления бланков рецептов, в том числе в форме электронных документов»
4. Распоряжение Правительства РФ от 31 декабря 2018 г. № 3053-р «Об утверждении перечня медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи, а также перечня медицинских изделий, отпускаемых по рецептам на медицинские изделия при предоставлении набора социальных услуг»
5. Международная статистическая классификация болезней и проблем, связанных со здоровьем (10-й пересмотр) (МКБ-10);
6. Приказ Минздрава России от 02.05.2023 № 205н «Об утверждении номенклатуры должностей медицинских работников и фармацевтических работников».
7. Приказ Минздравсоцразвития России от 23 июля 2010 г. № 541н. «Об утверждении Единого квалификационного справочника должностей руководителей, специалистов и служащих, раздел «Квалификационные характеристики должностей работников в сфере здравоохранения».
8. Федеральный закон от 25.12.2018 № 489 «О внесении изменений в статью 40 Федерального закона "Об обязательном медицинском страховании в Российской Федерации" и Федеральный закон "Об основах охраны здоровья граждан в Российской Федерации" по вопросам клинических рекомендаций».
9. Приказ Минздрава России от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации».
10. Приказ Минздрава России от 13.10.2017 № 804н "Об утверждении номенклатуры медицинских услуг".
11. Приказ Минздравсоцразвития РФ от 09.08.2005 № 494 «О порядке применения лекарственных средств у больных по жизненным показаниям»
12. Информационное письмо Минздрава России по возможности закупки лекарственного препарата по торговому наименованию (https://www.rosminzdrav.ru/news/2019/12/18/13043-minzdrav-podgotovil-informatsionnoe-pismo-po-vozmozhnosti-zakupki-lekarstvennogo-preparata-po-torgovomu-naimenovaniyu);
Информация о лекарственных средствах: https://grls.rosminzdrav.ru/, https://lk.regmed.ru/Register/EAEU_SmPC
Рисунок 1. Эндоскопические признаки эозинофильного эзофагита
Рисунок 1а: Эндофотографии градаций степени отёка по шкале EREхFS. Отек слизистой оболочки пищевода диагностируется и оценивается по снижению чёткости, обеднению или отсутствию сосудистого рисунка и бледности слизистой оболочки.
Степень 0: отёк отсутствует (сосудистый рисунок четкий);
Степень 1: лёгкая (обеднение или снижение чёткости сосудистого рисунка);
Степень 2: тяжёлая (отсутствие сосудистого рисунка).
Рисунок 1б: Эндофотографии градаций степени выраженности колец по шкале EREхFS. Кольца оцениваются по наличию и выраженности нерасправляющихся циркулярных сужений в просвете пищевода.
Степень 0: кольца отсутствуют;
Степень 1: лёгкая (тонкие формирующиеся циркулярные сужения);
Степень 2: умеренная (отчётливо выраженные циркулярные сужения, не препятствующие проведению стандартного взрослого диагностического эндоскопа диаметром 8,5-9 мм);
Степень 3: тяжёлая (отчётливо выраженные циркулярные сужения, препятствующие свободному проведению стандартного взрослого эндоскопа диаметром 8,5-9 мм).
Рисунок 1в. Эндофотографии градаций степени выраженности экссудата по шкале EREхFS. Экссудат оценивается по наличию и площади белых наложений/налёта на поверхности слизистой оболочки пищевода.
Степень 0: экссудат отсутствует;
Степень 1: лёгкая (белый налет, покрывающий <10% поверхности пищевода);
Степень 2: средняя (белый налет, покрывающий ≥10% и менее 25% поверхности пищевода);
Степень 3: тяжёлая (экссудат, покрывающий ≥25% поверхности пищевода).
Рисунок 1г: Эндофотографии градаций степени выраженности борозд по шкале EREхFS. Борозды оцениваются по наличию продольных линий/бороздок на слизистой оболочке пищевода и выраженности их глубины.
Степень 0: борозды отсутствуют;
Степень 1: лёгкая (вертикальные линии без видимого углубления);
Степень 2: тяжёлая (вертикальные линии с выраженным углублением/вдавлением в слизистой оболочке).
Рисунок 1д: Эндофотографии градаций стриктур по шкале EREхFS. Стриктуры пищевода оцениваются по наличию сужений пищевода, непроходимых для диагностического эндоскопа.
Степень 0: отсутствуют;
Степень 1: имеются.
Рисунок 2а. Патоморфологическое исследование биоптата из проксимального отдела пищевода, окраска гематоксилином и эозином.
А) Скопления эозинофильных лейкоцитов, увеличение х200;
Б) Скопления эозинофильных лейкоцитов более 60 в поле зрения, увеличение х400.
Рисунок 2б. Патоморфологическое исследование биоптата из пищевода, окраска гематоксилином и эозином, увеличение х400. Эозинофильные абсцессы.
Рисунок 2в. Патоморфологическое исследование биоптата из пищевода, окраска гематоксилином и эозином, увеличение х400. Расширенные межклеточные пространства: округлые перицелюллярные пространства в плоском эпителии пищевода, в которых иногда определяются межклеточные мостики.
Рисунок 2г. Патоморфологическое исследование биоптата из пищевода, окраска по Маллори, увеличение х200. Фиброз собственной пластинки слизистой оболочки
Рисунок 3. Рентгеноскопия пищевода с контрастированием: диаметр пищевода не превышает 9-10 мм на всем протяжении.
Приложение Б. Алгоритмы действий врача
Приложение Б1. Алгоритм диагностики эозинофильного эзофагита [1]
Приложение Б2. Алгоритм лечения эозинофильного эзофагита [1]
Приложение Б3. Алгоритм диетотерапии при ЭоЭ [1]
Приложение В. Информация для пациента
Что такое эозинофильный эзофагит (ЭоЭ)? Это состояние, поражающее пищевод (орган трубчатой формы, по которому пища поступает изо рта в желудок). При ЭоЭ в пищеводе скапливаются клетки, называемые «эозинофилами». Эозинофилы – это клетки, которые чаще всего задействованы при аллергических заболеваниях. В норме эозинофилы не обнаруживаются в пищеводе.
Точная причина развития ЭоЭ до сих пор неясна. Вероятна роль различных аллергенов, особенно пищевых, хотя встречаются ситуации чувствительности к аллергенам, находящимся во вдыхаемом воздухе (аэроаллергенам). Встречаются семейные случаи ЭоЭ, то есть, вероятна наследственная предрасположенность. ЭоЭ встречается в любом возрасте, в том числе, у взрослых.
Каковы проявления (симптомы) эозинофильного эзофагита? В зависимости от возраста человека проявления различаются.
У детей чаще отмечаются затруднения при кормлении (отказ от твердой пищи), тошнота и/или рвота, боль в животе, изжога, избирательность в еде.
У взрослых и подростков наблюдаются затруднения глотания (ощущения застревания пищи на уровне глотки или груди), медленный прием пищи, избегание твердой пищи, боли в груди или верхней части живота.
Как установить диагноз ЭоЭ? Проводится эзофагогастродуоденоскопия с осмотром слизистой оболочки пищевода. Во время этого исследования кроме осмотра необходимо взять образцы слизистой оболочки пищевода для последующего осмотра под микроскопом. Также, при необходимости, могут проводиться другие исследования по назначению врача.
Как лечится эозинофильный эзофагит? Лечение обычно включает диету или прием лекарств.
Диета: врач может посоветовать вам избегать ряд продуктов: молоко, пшеница и другие глютен-содержащие злаки, бобовые, яйца, некоторые орехи, морепродукты. Для оценки эффективности диеты через 8-12 недель будет проводиться повторное эндоскопическое исследование пищевода. Если по результатам эндоскопии с биопсией окажется, что диета была эффективной и достигнута ремиссия заболевания, то возможно постепенное введение в рацион по одному из исключенных продуктов. Как правило, в процессе лечения может потребоваться проведение нескольких эндоскопических исследований.
Лекарства и другие виды лечения: врач может назначить лекарства, которые способны подавить воспаление в пищеводе, уменьшить проявления болезни и снизить количество эозинофилов в пищеводе (для подтверждения эффективности лечения потребуется провести повторную эндоскопию пищевода с биопсией). В настоящее время показание «эозинофильный эзофагит» отсутствует в инструкции у большинства препаратов, которые применяются для его лечения. Например, могут применяться ингибиторы протонного насоса, также могут быть назначены внутрь лекарственные препараты, использующиеся при бронхиальной астме ингаляционно, в редких случаях возможно назначение других лекарственных препаратов. Каждому конкретному пациенту лекарственное лечение подбирается врачом индивидуально, на основании состояния пациента и ответа на проводимую ранее терапию.
Поскольку после отмены препаратов практически всегда возникает рецидив заболевания, то после достижения ремиссии потребуется постоянный прием поддерживающей дозы этого же препарата и/или введение диетических ограничений.
У некоторых людей ЭоЭ приводит к сужению пищевода (стриктуре пищевода). Для лечения этого осложнения проводят баллонную дилатацию стеноза пищевода: специальным баллоном небольшого диаметра расширяют суженный участок пищевода, нормализуя его проходимость. Эта процедура, как правило, выполняется под общим обезболиванием и быстро приводит к исчезновению симптомов (нарушение глотания, застревание пищи в пищеводе).
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Опросник для оценки выраженности дисфагии у пациентов с ЭоЭ
Источник: Hudgens S, Evans C, Phillips E, Hill M. Psychometric validation of the Dysphagia Symptom Questionnaire in patients with eosinophilic esophagitis treated with budesonide oral suspension. J Patient Rep Outcomes. 2017 [162]
Тип: опросник для оценки выраженности клинических симптомов (дисфагии)
Назначение: оценка дисфагии у пациентов с ЭоЭ
Содержание (шаблон): опросник по оценке дисфагии содержит 4 вопроса, ответы на которые пациенты дают ежедневно
|
Вопрос |
Вариант ответа |
Оценка |
|
1. После пробуждения сегодня утром Вы ели твердую пищу? |
Да |
- |
|
Нет |
- | |
|
2. После пробуждения сегодня утром Вы замечали, что пища медленно проходила вниз или застревала в горле или в груди? |
Нет |
0 |
|
Да |
2 | |
|
3. В самом трудном случае при проглатывании пищи сегодня (в течение последних 24 часов) Вам приходилось что-либо делать, чтобы пища прошла вниз или чтобы Вам стало легче? |
Нет, улучшение или исчезновение симптомов произошло само по себе |
0 |
|
Да, мне пришлось пить жидкость, чтобы стало легче |
1 | |
|
Да, мне пришлось кашлять и (или) натужиться, чтобы стало легче |
2 | |
|
Да, мне становилось легче только после рвоты |
3 | |
|
Да, мне пришлось обратиться за медицинской̆ помощью, чтобы стало легче |
4 | |
|
4.Следующий вопрос касается выраженности боли, которую Вы испытывали при глотании пищи. Опишите самую сильную боль, которую Вы испытывали сегодня при глотании пищи? |
Боли не было |
0 |
|
Слабая |
1 | |
|
Умеренная |
2 | |
|
Сильная |
3 | |
|
Очень сильная
|
4 |
Ключ (интерпретация): пациенты отмечают симптомы дисфагии за предшествующие 24 часа, отвечая на вопросы. Пациенты, ответившие «Да» на вопросы 1 и 2, переходят к вопросу 3. Вопрос 4 является отдельным пунктом (не учитывается при расчете суммарного балла шкалы). Максимальный балл шкалы составляет 84. Для расчета балла необходимо как минимум 8 заполнений опросника в течение 14 дней; средний показатель за день умножается на 14.
Формула для расчета балла опросника DSQ: [(Сумма баллов для вопросов 2 и 3) х 14] / количество заполнений опросника. Диапазон шкалы – от 0 до 84 баллов. Больший балл соответствует большей выраженности дисфагии. 0 соответствует отсутствию дисфагии. 84 соответствует частой тяжелой дисфагии.
Пояснения:
Например, пациент заполнил опросник 10 раз за последние 14 дней.
Для расчета можно поступить двумя способами.
Первый способ – необходимо суммировать баллы для ответов на вопросы 2 и 3 за все 10 заполнений, умножить эту сумму на 14, а полученный результат разделить на 10.
Второй способ – рассчитать среднее значение сумм для вопросов 2 и 3 за 10 заполнений, затем умножить это значение на 14.
Приложение Г2. Оригинальная классификация и оценочная шкала признаков эозинофильного эзофагита при проведении эндоскопического исследования при оценке эозинофильного эзофагита (ERExFS)
Оригинальное название: Original classification and grading system for the endoscopic assessment of the oesophageal features of eosinophilic oesophagitis
Источник (официальный сайт разработчиков, публикация с валидацией): Hirano I, Moy N, Heckman MG, Thomas CS, Gonsalves N, Achem SR. Endoscopic assessment of the oesophageal features of eosinophilic oesophagitis: validation of a novel classification and grading system. Gut. 2013 Apr;62(4):489-95 [33]
Тип: шкала оценки
Назначение: оценка выраженности эндоскопических признаков эозинофильного эзофагита при установлении диагноза и в процессе лечения
Содержание, ключ (интерпретация), пояснения: Данная шкала позволяет по сумме баллов оценить выраженность эндоскопических изменений при установлении диагноза, в процессе лечения и подбора поддерживающей дозы лекарственных препаратов или диеты. Подсчет баллов возможен как по всем 5 признакам (например, E1R1Ex2F1S0=5 баллов), так и отдельно по воспалительным показателям (отек, экссудат, продольные борозды), например, Е2Ex1F2=5 баллов и по фибростенотическим показателям (кольца и стриктуры), например, R2S1=3 балла. Снижение баллов по шкале ERExFS в процессе лечения позволит судить об эффективности лечения. Важно давать оценку по шкале ERExFS с учетом наиболее выраженных изменений.
Эндоскопическая шкала ERExFS при оценке эозинофильного эзофагита (по Hirano I в модификации Ma, C)
|
Отек (Edema) оценивается по четкости визуализации сосудистого рисунка | |
|
Степень 0 |
сосудистый рисунок четкий |
|
Степень 1 |
слабая (снижение четкости сосудистого рисунка) |
|
Степень 2 |
сильная (отсутствие сосудистого рисунка) |
|
Кольца (Rings) оценивается по наличию и выраженности кольцевидных циркулярных сужений просвета пищевода | |
|
Степень 0 |
кольцевидные сужения отсутствуют |
|
Степень 1 |
слабая (тонкие формирующиеся циркулярные кольца при растяжении пищевода при инсуффляции) |
|
Степень 2 |
умеренная (четкие циркулярные кольца, не препятствующие проведению стандартного взрослого эндоскопа диаметром 8,5-9мм) |
|
Степень 3 |
сильная (четкие циркулярные кольца, препятствующие свободному проведению стандартного взрослого эндоскопа диаметром 8,5-9мм) |
|
Экссудат (Exudates) оценивается по наличию белого налета на поверхности слизистой оболочки пищевода | |
|
Степень 0 |
экссудат отсутствует |
|
Степень 1 |
слабая (белый налет, покрывающий <10% поверхности пищевода) |
|
Степень 2 |
средняя (белый налет, покрывающий ≥10%, но менее 25% поверхности пищевода) |
|
Степень 3 |
сильная (белый налет, покрывающий более 25% поверхности пищевода)
|
|
Борозды (Furrows) оценивается по наличию вертикальных линий с углублением на слизистой оболочке пищевода | |
|
Степень 0 |
борозды (вертикальные линии) отсутствуют |
|
Степень 1 |
слабая (вертикальные линии без видимого углубления) |
|
Степень 2 |
сильная (вертикальные линии с выраженным углублением (вдавлением) в слизистую оболочку) |
|
Стриктуры (Strictures) оценивается по наличию сужений пищевода, непроходимых для эндоскопа | |
|
Степень 0 |
отсутствуют |
|
Степень 1 |
присутствуют |
Приложение Г3. Валидированная шкала ЭоЭ-специфичных гистологических показателей (EoEHSS)
Оригинальное название: Newly developed and validated eosinophilic esophagitis histology scoring system and evidence that it outperforms peak eosinophil count for disease diagnosis and monitoring
Источник (официальный сайт разработчиков, публикация с валидацией): Collins MH, Martin LJ, Alexander ES, Boyd JT, Sheridan R, He H, Pentiuk S, Putnam PE, Abonia JP, Mukkada VA, Franciosi JP, Rothenberg ME. Newly developed and validated eosinophilic esophagitis histology scoring system and evidence that it outperforms peak eosinophil count for disease diagnosis and monitoring. Dis Esophagus. 2017 Feb
Тип: шкала оценки
Назначение: стандартизация гистологической оценки биоптатов: плотности эозинофильной инфильтрации, гиперплазии базального слоя эпителия, наличия эозинофильных абсцессов, поверхностного расположения эозинофилов в слизистой оболочке, расширения межклеточных пространств, повреждения поверхностных слоев эпителия, наличия дискератоза, фиброза собственной пластинки слизистой оболочки.
Содержание, ключ (интерпретация), пояснения: тяжесть и распространенность каждого признака оценивается в диапазоне от 0-3 баллов
|
Гистологический критерий ЭоЭ |
Степень поражения |
Распространенность (стадия) |
|
Эозинофильное воспаление1 |
0 – интраэпителиальные эозинофилы отсутствуют |
0 – интраэпитэлиальные эозинофилы 0-14/ПЗР, х400. |
|
1 = ПЭЧ <15/ПЗР, х400 |
1 = ПЭЧ ≥15/ПЗР, х400 в <33% ПЗР, х400 | |
|
2 = ПЭЧ 15-59/ПЗР, х400 |
2 = ПЭЧ ≥15/ПЗР, х400 в 33-66% ПЗР, х400 | |
|
3 = ПЭЧ >60/ПЗР, х400 |
3 = ПЭЧ ≥15/ПЗР, х400 >66% ПЗР, х400 |
1 В норме в биоптатах пищевода интраэпителиальные эозинофилы отсутствуют, поэтому наличие любого количества интраэпителиальных эозинофилов рассматривается как патологическое изменение. Балльная шкала эозинофильного воспаления основана на количестве эозинофилов в одном поле зрения при большом увеличении (ПЗР, х400) – пиковое эозинофильное число (ПЭЧ) при оценке участка с наиболее выраженными воспалительными изменениями.
|
Гистологический критерий ЭоЭ |
Степень поражения |
Распространенность (стадия) |
|
Базальный слой плоского эпителия пищевода2 |
0 - гиперплазия базального слоя отсутствует |
0 - гиперплазия базального слоя отсутствует |
|
1 = базальная зона занимает >15%, но <30% общей толщины эпителия |
1 = базальная гиперплазия (любой степени>0) в <33% эпителия | |
|
2 = базальная зона занимает 33-66% общей толщины эпителия |
2 = базальная гиперплазия (любой степени>0) в 33-66% эпителия | |
|
3 = базальная зона занимает >66% общей толщины эпителия |
3 = базальная гиперплазия (любой степени>0) в >66% эпителия |
2 Базальный слой плоского эпителия пищевода состоит из тесно – расположенных мелких клеток, в норме его толщина составляет <15% общей толщины эпителия. Верхняя граница базального слоя определяется как уровень, на котором ядра базальных клеток отделены друг от друга расстоянием равным или превышающим диаметр ядра базальной клетки.
|
Гистологический критерий ЭоЭ |
Степень поражения |
Распространенность (стадия) |
|
Эозинофильные абсцессы (ЭА)3 |
0 = скопления эозинофилов не определяются |
0 = скопления эозинофилов не определяются |
|
1 = скопления 4-9 эозинофилов |
1 = ЭА (любая степень>0) в <33% эпителия | |
|
2 = скопления 10-20 эозинофилов |
2 = ЭА (любая степень>0) в 33-66% эпителия | |
|
3 = скопления >20 эозинофилов |
3 = ЭА (любая степень>0) в >66% эпителия |
3 Эозинофильные абсцессы – интраэпителиальные скопления или агрегаты эозинофилов, в которых клетки образуют солидные структуры. Эпителиальная архитектоника нарушена таким образом, что соседние эозинофилы не разделены эпителиальной тканью.
|
Гистологический критерий ЭоЭ |
Степень поражения |
Распространенность (стадия) |
|
Эозинофильное поверхностное наслоение «пластообразование»4 Бальная шкала для поверхностного наслоения (ПН) основывалась на количестве эозинофилов, формирующих слой |
0 = ПН отсутствует (менее 3 линейно расположенных эозинофилов) |
0 = ПН отсутствует |
|
1 = ПН 3-4 эозинофилов |
1 = ПН (любая степень>0) в <33% эпителия | |
|
2 = ПН 5-10 эозинофилов |
2 = ПН (любая степень>0) в 33-66% эпителия | |
|
3 = ПН >10 эозинофилов |
3 = ПН (любая степень>0) в >66% эпителия |
4 Эозинофильное поверхностное наслоение («пластообразование») – линейное распределение (расположение) как минимум трех эозинофилов в верхней трети многослойного эпителия слизистой оболочки пищевода параллельно поверхности.
|
Гистологический критерий ЭоЭ |
Степень поражения |
Распространенность (стадия) |
|
Расширенные межклеточные пространства (РМП)5 |
0 = РМП не определяется при любом увеличении |
0 = РМП не определяется при любом увеличении |
|
1= межклеточные мостики в РМП различимы только при увеличении х400 |
1 = РМП (любая степень>0) в <33% эпителия | |
|
2 = межклеточные мостики в РМП различимы при увеличении х200 |
2 = РМП (любая степень>0) в 33-66% эпителия | |
|
3 = межклеточные мостики в РМП различимы при увеличении х100 и менее |
3 = РМП (любая степень>0) в >66% эпителия |
5 Расширенные межклеточные пространства – округлые перицеллюлярные пространства в плоском эпителии пищевода, в которых определяются межклеточные мостики. Балльная шкала РМП основана на степени увеличения микроскопа, необходимой для обнаружения межклеточных мостиков.
|
Гистологический критерий ЭоЭ |
Степень поражения |
Распространенность (стадия) |
|
Повреждение поверхностного эпителия (ППЭ)6 |
0 = ППЭ не определяется |
0 = ППЭ не определяется |
|
1 = ППЭ без эозинофильного компонента |
1 = ППЭ (любая степень>0) в <33% эпителия | |
|
2 = ППЭ с любым количеством эозинофилов |
2 = ППЭ (любая степень>0) в 33-66% эпителия | |
|
3 = слущивание поврежденного поверхностного эпителия в сочетании с большим количеством эозинофилов |
3 = ППЭ (любая степень>0) в >66% эпителия |
6 Повреждение поверхностного эпителия (ППЭ): изменения тинкториальных свойств поверхностного эпителия, проявляющиеся усилением (более темный оттенок красного) окрашивания клеток поверхностного слоя эпителия при наличии или отсутствии эозинофильной инфильтрации. Балльная шкала ППЭ основана на выраженности эозинофильной инфильтрации в поврежденном поверхностном эпителии.
|
Гистологический критерий ЭоЭ |
Степень поражения
|
Распространенность (стадия) |
|
Дискератоз7 |
0 = Дискератоз не определяется |
0 = Дискератоз не определяется |
|
1= 1 клетка с дискератозом/ПЗР, х400 |
1 = Дискератоз (любой степени>0) в <33% эпителия | |
|
2 = 2-5 клеток с дискератозом/ПЗР, х400 |
2 = Дискератоз (любой степени>0) в 33-66% эпителия | |
|
3 = >5 клеток с дискератозом/ПЗР, х400 |
3 = Дискератоз (любой степени>0) в 66% эпителия эпителия |
7 Дискератоз-появление отдельных эпителиальных клеток с ярко-эозинофильной цитоплазмой и мелким округлым гиперхромным ядром. Балльная шкала основана на количестве клеток с явлениями дискератоза.
|
Гистологический критерий ЭоЭ |
Степень поражения |
Распространенность (стадия) |
|
Фиброз собственной пластинки слизистой оболочки (ФСП)8 |
0 = ФСП не определяется |
0 = ФСП не определяется |
|
1= волокна сцеплены друг с другом, пространство между ними не определяется |
1 = ФСП (любой степени>0) в <33% собственной пластинке слизистой | |
|
2 = диаметр волокон равен диаметру ядер клеток базального слоя |
2 = ФСП (любой степени>0) в 33-66% собственной пластинке слизистой | |
|
3 = диаметр волокон превышает диаметр ядер клеток базального слоя |
3 = ФСП (любой степени>0) в 66% собственной пластинке слизистой |
8 Фиброз собственной пластинки слизистой оболочки (ФСП): утолщение соединительнотканных волокон собственной пластинки слизистой оболочки. Волокна собственной пластинки, расположенные по одиночке и имеющие диаметр менее размера ядер клеток базального слоя, рассматривались как нормальные; сцепленные друг с другом волокна обычного диаметра, а также волокна, имеющие диаметр равный или превышающий размер ядер клеток базального слоя, рассматривались как патологичные. Балльная шкала ФСП основана на степени утолщения волокон.
Приложение Г4. Индекс клинико-морфологической активности эозинофильного эзофагита
Оригинальное название: A Clinical Severity Index for Eosinophilic Esophagitis
Источник (официальный сайт разработчиков, публикация с валидацией): Dellon ES, Khoury P, Muir AB, Liacouras CA, Safroneeva E, Atkins D, Collins MH, Gonsalves N, Falk GW, Spergel JM, Hirano I, Chehade M, Schoepfer AM, Menard-Katcher C, Katzka DA, Bonis PA, Bredenoord AJ, Geng B, Jensen ET, Pesek RD, Feuerstadt P, Gupta SK, Lucendo AJ, Genta RM, Hiremath G, McGowan EC, Moawad FJ, Peterson KA, Rothenberg ME, Straumann A, Furuta GT, Aceves SS. A Clinical Severity Index for Eosinophilic Esophagitis: Development, Consensus, and Future Directions. Gastroenterology. 2022
Тип: шкала
Назначение: определение клинико-морфологической активности ЭоЭ
Содержание (шаблон):
|
Баллы |
1 балл |
2 балла |
4 балла |
15 баллов |
|
Симптомы и осложнения | ||||
|
Симптомы |
Еженедельно |
Ежедневно |
Много раз за день или нарушают социальную активность |
- |
|
Осложнения |
- |
Вклинение пищи в пищевод с обращением в экстренным обращением за медицинской помощью (пациенты старше 18 лет) |
Вклинение пищи в пищевод с обращением в экстренным обращением за медицинской помощью (пациенты младше 18 лет) Госпитализация в связи с ЭоЭ |
Перфорация пищевода Отставание в росте, дефицит массы тела Рефрактерное течение ЭоЭ, необходимость прибегать к элементной диете, системным глюкокортикоидам, терапии иммуномодуляторами(L) |
|
Характеристики активности воспаления | ||||
|
Эндоскопические особенности (отек, борозды, экссудат) |
Локализованные |
Диффузные |
- |
- |
|
Гистологические особенности |
15-60 эозинофилов в поле зрения микроскопа высокого разрешения |
Более 60 эозинофилов в поле зрения микроскопа высокого разрешения |
- |
- |
|
Характеристики подслизистого фиброза | ||||
|
Эндоскопические особенности (кольца, стриктуры) |
Легко проходимы для эндоскопа |
Присутствуют, требуют дилатации или расширяются при затрудненном прохождении эндоскопа |
- |
Стандартный эндоскоп не проходит, повторяющиеся дилатации в возрасте старше 18 лет или хотя бы 1 дилатация в возрасте менее 18 лет |
|
Гистологические особенности |
- |
Гиперплазия базального слоя или фиброз собственной пластинки слизистой оболочки (дискератоз, повреждение поверхностных слоев эпителия) | ||
Ключ (интерпретация): неактивный ЭоЭ: менее 1 балла, легкая степень: 0-6 баллов, средняя: 7-14 баллов, высокая: более 15 баллов
Пояснения: Данная таблица заполняется на каждом визите пациента и оценивает клинико-морфологическую активность заболевания.
.
Последние клинические рекомендации на EndoExpert.ru
Материалы EndoExpert.ru по теме «Эозинофильный эзофагит»
- Проект. Клинические рекомендации ЭОЗИНОФИЛЬНЫЙ ЭЗОФАГИТ 2022 - 2025
- Маршрутизация: обследование и лечение пациентов с эозинофильным эзофагитом
- Эндоскопическая шкала EREFS при оценке эозинофильного эзофагита (Hirano, 2012 г.)
- ЭГДС с множественной биопсией из пищевода — глава из книги об эозинофильном эзофагите (2024)
- Эозинофильный эзофагит — «астма пищевода»
- Узкоспектральная эндоскопия (NBI): признаки при эозинофильном и лимфоцитарном эзофагите
- Эозинофильный эзофагит: современный взгляд на проблему и клинические наблюдения
Дополнительно
Эозинофильный эзофагит (EoE) — хроническое иммуновоспалительное заболевание пищевода. В эндоскопической практике важны системная оценка визуальных признаков, корректный протокол биопсии и сопоставление эндоскопической картины с клиникой и морфологией.
На странице EndoExpert.ru доступны клинические рекомендации и тематические материалы, включая маршрут ведения пациентов, а также публикации по эндоскопическим находкам и дополнительным методам визуализации.
Рекомендуемые статьи
Синдром Крона
неспецифические гранулёмы в пищеводе.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.

















.jpg)




.png)















Комментарии