- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Эндоскопическая и морфологическая характеристика заболеваний верхних отделов желудочно-кишечного тракта Показания и противопоказания к биопсии
| Авторы: | Кузин М. Н. 1 Субботин А. М. 2 Кузнецов С. С. 3 Ефимова Е. И. 4 Сметанина С. В. 5 2014г. |
| Об авторах: |
1. Заведующий отделением эндоскопии ГБУЗ НО «Нижегородский областной онкологический диспансер» 2. Председатель Нижегородского эн- доскопического общества, главный специалист по эндоскопии МЗ НО по г. Н.Новгороду, заведующий эндоскопическим отделением ГБУЗ НО «Город- ская клиническая больница №13» 3. д.м.н, профессор кафедры патологи- ческой анатомии НГМА, заведующий патологоанатомическим отделением ГБУЗ НО «Нижегородская областная клиническая больница им. Н.А.Семашко» 4. Врач-эндоскопист ГБУЗ НО «Нижегород- ский областной онкологический диспансер» 5. Заведующая централизованной ци- тологической лабораторией ГБУЗ НО «Нижегородский областной онкологи- ческий диспансер» |
Введение:
Эндоскопия на сегодняшний момент является одной из самых дина мично развивающихся отраслей медицины. К современным методам эндоскопической диагностики относятся: стандартная фиброэндоскопия или видеоэндоскопия, эндоскопия с высоким разрешением (HRE – high-resolution endoscopy), хромоэндоскопия, узкоспектральная эндоскопия (NBI – narrow- band imaging, FICE – Flexible spectral Imaging Color Enhancement, i-scan), увеличительная эндоскопия (х80–150); эндоцитоскопия (super-high- magnification video endoscope) с увеличением х450 и x1100; аутофлуоресцентная эндоскопия; эндоскопическая оптическая когерентная томография; эндоскопическая лазер – сканирующая конфокальная микроскопия (LCM) – метод оптической биопсии или виртуального гистологического исследования; флуоресцентная эндоскопия с 5-аминолевулиновой кислотой (метод фотодинамической диагностики); эндосонография. Но, несмотря на это, «золотым стандартом» в диагностике заболеваний желудочно-кишечного тракта остается эндоскопия с выполнением биопсии.
Даже при нормальной эндоскопической картине, гистологическое исследование может дать полезную информацию. Кроме того, эндоскопический анализ, дополненный морфологическими исследованиями, проводится с целью проведения динамического контроля за течением патологического процесса и определения эффективности проведенной терапии. Если эндоскопическая картина характерна для какой-либо определенной патологии и результаты биопсии не повлияют на тактику дальнейшего лечения, необходимость в ее выполнении отсутствует.
В то же время бывают ситуации, когда при проведении цитологического и/или гистологического исследования мы не получаем клинически ценной информации, что связано с различными причинами. Это те случаи, когда для подтверждения диагноза требуется повторное эндоскопическое исследование, иногда неоднократное, с выполнением биопсии.
По данным многих авторов (Соколов Л.К., 1971; Мельников Р.А., 1973; Kabayachi et. al., 1970) морфологический анализ биопсийного материала позволяет диагностировать рак желудка в 95-100%. Однако, как было замечено P.Hermanek (1973), ошибки щипцовой биопсии достигают 8-60%. К причинам, обуславливающим ошибочные результаты при исследовании биопсийного материала, относятся: неверный выбор участка для забора материала, взятие недостаточного количества фрагментов ткани, отсутствие подробного описания мест забора материала, предполагаемого диагноза и клинических проявлений заболевания. J.Deutsch (1999) утверждал, что при биопсии, выполненной из одной точки «язвы» желудка, подозрительной на ее злокачественный генез, вероятность постановки правильного диагноза составляет 70%, при биопсии в 8 точках эта вероятность повышается до 95 – 99%.
До сих пор остаётся не до конца решенным вопрос: «Сколько брать биоптатов?» Многочисленные практические рекомендации для эндоскопистов, преимущественно зарубежные, приводят достаточно вариабельные цифры. Причём, до последнего времени, большинство авторов придерживалось точки зрения о необходимости множественной биопсии. Понятно, что большему количеству биоптатов соответствует более достоверная информация о сути патологического процесса, но если брать условия наших клиник, где наблюдается существенный дефицит, как патологоанатомов, так и лаборантов-гистологов, чья работа нормирована, то патологоанатомические отделения физически не смогут своевременно исследовать большой объём материала. Кроме того, современные эндоскопические методики с использованием аппаратуры экспертного класса позволяют выполнить прицельную биопсию из локально измененных и наиболее подозрительных патологических участков слизистой оболочки, что также может сопровождаться уменьшением количества биоптатов.
В данном пособии мы постарались изложить краткую эндоскопическую картину при различных заболеваниях верхних отделов желудочно-кишечного тракта, показания и противопоказания к выполнению биопсии согласно международным стандартам и рекомендациям Российской гастроэнтерологической ассоциации, осветить некоторые особенности цитологических и гистологических заключений, дать основные понятия. В рекомендациях использованы материалы, опубликованные в различных источниках, и приведены собственные данные и рекомендации. Надеемся, что пособие будет полезно в Вашей повседневной работе.
Полный текст статьи:
2. БИОПСИЯ, ПОНЯТИЯ, ВИДЫ БИОПСИИ
БИОПСИЯ – (biopsia, био + греч Opsis – зрительное восприятие, зрение) – прижизненное взятие небольшого объема ткани и его морфологическое исследование, необходимое для диагностики, динамического наблюдения и контроля лечения.
Биопсийный материал формально подразделяется на операционный и диагностический. ОПЕРАЦИОННЫМ МАТЕРИАЛОМ считают ткани и органы, удалённые при хирургической операции. ДИАГНОСТИЧЕСКАЯ БИОПСИЯ проводится с целью постановки диагноза.
Биопсия в зависимости от способа её получения может быть:
а) инцизионная (син. – эксцизионная) – осуществляется путём иссечения кусочка ткани;
б) пункционная – материал получают путём пункции специальной иглой;
в) аспирационная – материал получают путём всасывания содержимого полых органов или полостей организма через иглу, катетером или другими специальными инструментами;
г) трепанобиопсия – материал получают при помощи специального инструмента;
д) кюретажная – материал получают с помощью выскабливания кюреткой;
е) стереотаксическая – производится путем введения микроинструментов строго в заданные структуры мозга с использованием системы стереотаксических координат, стереотаксических приборов;
ж) тотальная – биопсия всего патологически изменённого участка, осуществляется обычно при небольших, поверхностно расположенных патологических очагах;
з) трансуретральная – инцизионная биопсия (например, предстательной железы, стенки мочевого пузыря), проводится с помощью специальных инструментов (резектоскопа, оперативного цистоскопа), вводимых в мочеиспускательный канал.
Материал, полученный путем биопсии, называют биоптатом. В зависимости от особенностей способа получения материала биопсия может также быть:
открытой (или операционной) – инцизионная биопсия глубоко расположенных органов или тканей, при которой производится предварительное рассечение поверхностно расположенных тканей;
прицельной – биопсия производится из измененного участка под визуальным контролем.
В зависимости от срока ответа биопсия может быть плановой (ответ даётся через 4-5 дней) и срочной (ответ даётся через 20-30 минут). Срочная биопсия обычно производится в ходе хирургической операции для решения вопроса об объёме и характере оперативного вмешательства. Из-за особенностей гистологической обработки материала (быстрое глубокое охлаждение) она имеет свои особенности, в связи с чем в ряде случаев характер направляемого материала остаётся неясным и только после полной (плановой) проводки биопсийного материала выносится окончательное морфологическое заключение.
3. БИОПСИЯ В ЭНДОСКОПИИ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА (ЖКТ)
В гастроинтестинальной эндоскопии различают следующие виды биопсии:
1. Щипцовая биопсия – наиболее распространенная манипуляция при диагностическом исследовании верхних отделов ЖКТ. Процедура включает проведение биопсийных щипцов через рабочий канал эндоскопа в просвет органа, раскрытие бранш, захват кусочка ткани и отрыв его с последующим извлечением и помещением в емкость с раствором допустимого фиксатора. При таком виде биопсии рекомендуется учитывать возможное подтекание крови, возникающее из поврежденной ткани. Поэтому, если патологический очаг большой, следует начинать выполнять биопсию из тех участков, подкравливание из которых не будет мешать последующей прицельной биопсии. Множественная биопсия повышает диагностическую ценность эндоскопического исследования. Важны и такие аспекты, как размер биоптата, место забора, ориентация, фиксация и окрашивание препаратов. Предпочтительно использование щипцов с большими браншами.
2. Щеточная биопсия (браш-биопсия), чаще всего применяется при выявлении плоских образований, особенно в пищеводе. Процедура заключается в продвижении катетера со щеткой внутри через канал эндоскопа в просвет органа, выдвижение щетки, выполнении нескольких царапающих движений. Затем щетку вновь погружают в катетер и извлекают из аппарата. Полученный материал наносят на чистое предметное стекло. Цитологическое исследование препаратов, получаемых при щеточной биопсии, может быть полезным дополнением к щипцовой биопсии.
3. «Горячая» биопсия. Выполняется при высоком риске развития кровотечения (например, при биопсии хорошо кровоснабжаемых аденом) и представляет собой простой по технике исполнения способ деструкции мелких полипоидных и плоских образований, несущий в себе возможность одновременного получения материала для проведения морфологических исследований. Показания к ее самостоятельному применению должны быть ограничены в пользу петлевой электрорезекции. Однако она может быть использована при множественных мелких новообразованиях, невозможности проведения электрорезекции и как дополнение к ней для удаления мелких новообразований и дополнительной коагуляции зоны электрорезекции.
Процедура выполняется с использованием блока для электрокоагуляции специальными щипцами, покрытыми изоляционной оболочкой. Размеры и форма чашечек щипцов разнообразны. Захваченная в них ткань отсекается краями бранш и коагулируется по поверхности, причем биоптат внутри щипцов коагуляции не подвергается.
4. Аспирационная игольчатая (тонкоигольная) биопсия. Выполняется при необходимости получения ткани из глубоко лежащих слоев. Данный метод биопсии в большинстве случаев может быть применен только в сочетании с конвексной эндосонографией. Процедура заключается в проведении иглы через канал эндоскопа, выведении ее в просвет органа и, погружении в патологическую ткань. В дальнейшем проводится аспирация содержимого с помощью шприца или специального устройства, извлечение иглы и перенос ее содержимого на предметное стекло и/или в фиксирующий раствор с дальнейшим цитологическим и/или гистологическим исследованием. Аспирационная биопсия с помощью тонкой иглы под контролем эндоскопического ультразвукового исследования позволяет выполнить биопсию из подслизистых образований, а также образований, располагающихся за пределами полых органов ЖКТ (лимфоузлы, опухоли поджелудочной железы и др.).
5. Петлевая биопсия. Процедура выполняется диатермической петлей, которая проводится через рабочий канал эндоскопа в просвет органа, раскрывается, после чего происходит захват кусочка ткани и отсечение его в режиме коагуляции или в смешанном режиме коагуляции и резания. С внедрением в клиническую практику петлевой биопсии появилась возможность получения крупных фрагментов СО и патологических образований.
4. ТЕХНИКА ВЫПОЛНЕНИЯ ЩИПЦОВОЙ БИОПСИИ ПРИ ЭНДОСКОПИИ ВЕРХНИХ ОТДЕЛОВ ЖКТ
При выполнении биопсии необходимо соблюдать следующие правила.
1. Биопсия СО предпочтительно должна выполняться одноразовыми щипцами. В некоторых странах использование многоразового инструмента не допускается.
2. Использование щипцов большего размера предпочтительнее из-за более высокого качества морфологического анализа, и в то же время диагностическая информативность этого положения не доказана.
3. Преимущество захвата нескольких биоптатов в одни щипцы за один раз также не установлено.
4. Важно, чтобы биопсия была прицельной.
5. Захват биопсийного материала при возможности должен осуществляться при перпендикулярно ориентированных щипцах к поверхности СО. Поскольку это не всегда возможно, особенно в пищеводе, достичь лучших результатов позволяет выполнение биопсии следующим образом: фиксация биопсийных щипцов непосредственно у дистального края инструментального канала эндоскопа в сочетании с аспирацией или вспомогательной работой винтами.
6. Ассистирование при выполнении биопсии обязательно.
7. Сбор биопсийного материала в контейнер должен осуществляться с помощью специальных тонких палочек (использование игл запрещено из-за риска травматизации и заражения).
8. Биопсийный материал доставляется в гистологическую лабораторию в специальных контейнерах с раствором допустимого фиксатора (детальные указания в разделе «гистологическое исследование»). Контейнеры должны быть сразу подписаны (снабжены этикетками) и пронумерованы.
9. После выполнения исследования врач-эндоскопист заполняет направление на морфологическое исследование (порядок оформления направления на цитологическое и гистологическое исследования и требования, предъявляемые к ним, описаны в соответствующих разделах).
5. ПРОТИВОПОКАЗАНИЯ ДЛЯ ПРОВЕДЕНИЯ БИОПСИИ ПРИ ЭНДОСКОПИИ ВЕРХНИХ ОТДЕЛОВ ЖКТ
При определении показаний и противопоказаний для эндоскопического исследования необходимо руководствоваться следующими принципами:
А) риск развития осложнений не должен превышать диагностическую и лечебную эффективность;
Б) диагностические исследования должны иметь практическую значимость.
Противопоказания к эндоскопическим исследованиям делятся на абсолютные и относительные.
К абсолютным противопоказаниям для плановых эндоскопических исследований верхних отделов ЖКТ относятся:
1. агональное состояние;
2. острый период инфаркта миокарда;
3. острое нарушение мозгового кровообращения (в раннем периоде);
4. бессознательное состояние (за исключением состояния наркоза);
5. ситуации, когда исследование невозможно из-за резко выраженных анатомических изменений зоны пищевода (резко выраженная деформация шеи, зоб, аневризма аорты, стриктуры пищевода);
6. легочная и сердечная недостаточность III стадии. К относительным противопоказаниям относятся:
1. гипертоническая болезнь III стадии;
2. нестабильная стенокардия;
3. аневризма грудного отдела аорты;
4. общее тяжелое состояние больного;
5. острые воспалительные заболевания носа, носоглотки, миндалин, верхних дыхательных путей;
6. психические заболевания, которые могут вызвать неадекватное поведение пациента во время процедуры;
7. заболевания крови (гемофилия и другие состояния, сопровождающиеся нарушением свертываемости крови).
(Эндоскопическая диагностика и лечение заболеваний органов желудочно-кишечного тракта. Методические рекомендации. – СПб., 2006. – 178 с.).
Определение показаний и противопоказаний к эндоскопическому исследованию, особенно экстренному, находится в прямой зависимости от опыта врача-эндоскописта, оснащенности необходимым оборудованием, возможности оказания необходимого пособия пациенту. Кроме того, абсолютное противопоказание для эндоскопического исследования при определенных ургентных состояниях может стать относительным. Например, если у больного острым инфарктом миокарда развилось желудочно-кишечное кровотечение. В подобной ситуации риск от возможного оперативного вмешательства, равно как и от выжидательной тактики, несоизмеримо выше по сравнению с попыткой эндоскопической диагностики, гемостаза и коррекции медикаментозной терапии. Таким образом, абсолютным противопоказанием для экстренного эндоскопического исследования является только агональное состояние больного.
Противопоказаниями к биопсии при проведении эндоскопии верхних отделов ЖКТ являются:
биопсия из сосудистых поражений (варикозно-расширенные вены пищевода и желудка, сосудистые мальфармации, ангиодисплазии и гемангиомы);
активное кровотечение из патологического очага (но биопсия может быть выполнена на расстоянии от источника кровотечения);
подслизистые новообразования для выполнения щипцовой биопсии. Так как поверхностная биопсия щипцами будет в данной ситуации неинформативна, следует выполнять биопсию именно подслизистого образования. Это возможно только после предварительного рассечения СО над образованием и последующим глубоким захватом ткани, что сопряжено с высоким риском кровотечения или даже перфорации. Предпочтительнее выполнять эндоскопическую эндосонографию c тонкоигольной пункцией (EUSFNA);
биопсия из язвы при угрозе ее перфорации;
флегмонозные, некротические, коррозионные поражения пищевода, желудка и двенадцатиперстной кишки.
Приобретенные или медикаментозно индуцированные нарушения свертываемости крови (коагулопатии, применение антагонистов витамина К, антиагрегантов, гепарина и др.) не являются противопоказанием к выполнению биопсии и не требуют отмены корректно назначенных антикоагулянтов (за исключением, если соответствующие контролируемые показатели крови выходят за рамки рекомендованных).
Проведение расширенной биопсии (EMR, ESD) и выполнение трансназальных эндоскопических исследований при приобретенном или медикаментозно индуцированном нарушении свертываемости крови требует временной отмены препаратов с учетом риска тромбоэмболических нарушений.
Следует также отметить, что для эндоскопического исследования обязательно наличие добровольного информированного согласия на выполнение процедуры с согласием на проведение дополнительных методов исследования, в том числе биопсии. Возможны ситуации, когда больные категорически отказываются от выполнения биопсии.
6. БИОПСИЯ ПРИ ЗАБОЛЕВАНИЯХ ПИЩЕВОДА
Основой диагностики и активного выявления минимальных изменений СО пищевода является тщательное соблюдение протокола эндоскопического исследования с применением всех доступных дополнительных методов.
В настоящее время нет единой утвержденной методики для прицельной биопсии, позволяющей определить потенциально опасные зоны в плане риска развития дисплазии. Хромоскопия с метиленовым синим или 2% раствором уксусной кислоты позволяет визуализировать зоны кишечной метаплазии; хромоскопия с 1-2% водным раствором Люголя – участки воспаления, злокачественного поражения СО, кишечной или желудочной метаплазии, неоплазии высокой степени, которые в отличие от нормального эпителия не окрашиваются. Технологии осмотра в узком спектре света (NBI, FICE, i-scan) с функцией ZOOM позволяют идентифицировать зоны кишечной метаплазии и выявить очаги неоплазии высокой степени, так же как и при хромоскопии. Ни одна из вышеперечисленных методик не позволяет определить неоплазию низкой степени.
6.1. Показания к биопсии из слизистой оболочки пищевода
· Любые аномалии рельефа СО пищевода, выявленные при хромоскопии как йод-негативные участки.
· У пациентов группы риска по плоскоклеточному раку пищевода диагностика должна осуществляется с применением хромоскопии 1-2% водным раствором Люголя. Биопсия выполняется только из йод-негативных участков. К группе риска относятся пациенты:
с онкопатологией верхних дыхательных путей и гортаноглотки;
с синдромом Пламмера-Винсона (гипохромная анемия и циркулярный стеноз верхней трети пищевода);
с химическим ожогом пищевода в анамнезе (более 15 лет), особенно при наличии стеноза пищевода, с или без клинических проявлений;
с ахалазией пищевода более 15 лет;
с генетической предрасположенностью в развитии заболеваний пищевода (например, кератоз ладоней и подошв);
с хронической алкогольной или никотиновой интоксикацией (официально установленной).
· Смещение и нарушение формы Z-линии при подозрении на пищевод Барретта.
· Рубцовая деформация просвета пищевода.
· Признано, что следует выполнять биопсию:
из всех возвышающихся поражений СО пищевода;
из всех образований неопределенного генеза, особенно у иммунодепрессивных пациентов;
из всех изъязвлений пищевода;
из всех железистых эктопических очагов в верхней трети пищевода в случае наличия изъязвлений или ассоциированной пищеводной симптоматики;
рекомендуется проводить биопсию из СО верхней трети пищевода при отсутствии видимого поражения в случае герпетического дерматита для исключения поражения пищевода, а также при пищеводной симптоматике для диагностики эозинофильного эзофагита.
6.2. Биопсия при некоторых заболеваниях пищевода
6.2.1.Воспалительные заболевания пищевода
Эзофагит – воспалительное заболевание слизистой оболочки пищевода.
Причины развития:
гастроэзофагеальный рефлюкс содержимого желудка, который является причиной наиболее часто встречающего эзофагита, а именно рефлюксэзофагита;
алиментарный фактор – употребление чрезмерно горячей и острой пищи, злоупотребление крепкими спиртными напитками;
инфекционный фактор – грибы рода кандида, вирус простого герпеса, цитомегаловирус, туберкулез, сифилис и др.;
химический фактор – в результате ожога щелочью или кислотой, сильным окислителем типа перманганата калия, растворителями, воздействие профессиональных вредностей и др.;
физический фактор – вследствие лучевой терапии, травмы пищевода;
аллергический фактор.
Классификация эзофагитов
a. По происхождению: первичные и вторичные эзофагиты.
b. По течению: острые, подострые, хронические.
c. По характеру изменений СО (морфологические формы): катаральный, отечный, эрозивный, псевдомембранозный, геморрагический, эксфолиативный, некротический и флегмонозный.
d. По локализации: очаговые (локализованные), диффузные (распро-
страненные) и рефлюкс-эзофагиты (РЭ).
e. По степени тяжести: легкие, среднетяжелые, тяжелые.
f. По наличию осложнений: кровотечения, перфорация, спонтанный пневмоторакс, эмпиема плевры, периэзофагит, медиастинит, медиастинальный абсцесс.
Характеристика морфологических форм эзофагита представлена в таб.1.
Таблица 1. Характеристика морфологических форм эзофагита
|
Катаральная форма |
Характеризуется гиперемией СО пищевода, смазанностью сосудистого рисунка |
|
Отечная форма |
Характеризуется гиперемией и отёчностью СО пищевода. |
|
Эрозивная форма |
Чаще всего развивается при острых инфекционных болезнях и воздействия на стенку пищевода раздражающих веществ. |
|
Геморрагическая форма |
Развивается при некоторых инфекционных и вирусных болезнях (например, при сыпном эпидемическом тифе, гриппе). |
|
Псевдомембранозная форма |
Наблюдается при дифтерии, скарлатине. При этой форме фибринозный экссудат не спаян с подлежащими тканями. |
|
Эксфолиативная форма |
Наблюдается при дифтерии, скарлатине. При этой форме фибринозный экссудат прочно связан с подлежащими тканями. |
|
Некротическая форма |
Встречается при тяжёлом течении инфекционных болезней: корь, скарлатина, брюшной тиф и др., агранулоцитозе. Сопровождается образованием глубоких язв. |
|
Флегмонозная форма |
Образуется в результате внедрения в стенку пищевода инфицированного инородного тела, процесс может распространиться вдоль пищевода и в сторону средостения. |
6.2.1.1. Рефлюкс-эзофагит
Является проявлением гастроэзофагеальной рефлюксной болезни (ГЭРБ). Эндоскопическое исследование пищевода дифференцирует негативную/позитивную ГЭРБ, выявляет некоторые из причин заболевания, осложнения.
В практике используются две эндоскопические классификации РЭ.
Классификация Savary-Miller (1978) выделяет:
степень 0 (отсутствие видимых изменений);
степень 1 (изолированные дефекты СО с жёлтым основанием и красными краями, распространяющиеся по складкам вверх от Z-линии);
степень 2 (дефекты СО, сливающиеся между собой, но не захватывающие всю окружность пищевода);
степень 3 (распространение воспалительных и эрозивных изменений по всей окружности без сужения просвета);
степень 4 (сужение, препятствующее продвижению эндоскопа, могут быть обнаружены пищевод и язва Барретта).
По Лос-Анджелесской классификации (1997), в основу которой положена степень распространения, а не выраженности поражения, выделяют:
степень А (одно или несколько отграниченных повреждений (дефектов) СО длиной не более 5 мм, расположенных на вершинах складок пищевода и не распространяющихся на межскладочные пространства);
степень В (одно или несколько отграниченных повреждений (дефектов) СО длиной более 5 мм, расположенных на вершинах складок пищевода и не распространяющихся на межскладочные пространства);
степень С (повреждения (дефекты) СО, распространяющиеся на межскладочные пространства двух или большего числа складок пищевода, но занимающие в сумме менее 75% окружности);
степень D (повреждения (дефекты) СО, распространяющиеся на межскладочные пространства и занимающие более 75% окружности пищевода).
Согласно данной классификации осложнения эрозивного РЭ могут присутствовать на любой стадии или даже на неизмененной СО в отличие от классификации по Савари-Миллер, в которой они отнесены к 4-й степени. Кроме этого можно выделить катаральную форму рефлюкс-эзофагита, которая эндоскопически проявляется отечностью и белесоватостью СО, сглаженностью и исчезновением сосудистого рисунка.
Биопсия при обострении процесса часто бывает малоинформативна, так как активное воспаление СО делает более трудным отличие дисплазии от репаративных изменений. В связи с этим биопсию не рекомендуется выполнять до тех пор, пока любое активное воспаление, связанное с ГЭРБ, не будет скорректировано с помощью антисекреторной терапии (Sharma P., Sampliner R., 2006). Материал для гистологического исследования в данной ситуации забирается по показаниям (атипичное течение эрозивно-язвенного процесса, признаки пищевода Барретта, папилломатоз, подозрение на малигнизацию, неясные диагностические случаи).
Гистологически рефлюкс-эзофагит характеризуется отёком и воспалительной инфильтрацией (преимущественно – плазмоцитами и лимфоцитами) СО и подслизистого слоя, вакуольной дистрофией и акантозом эпителия. Выявляются склеротические и кистозные изменения СО, десквамация и складчатость эпителия, венозный застой, микрогематомы. Гистологические признаки всегда свидетельствуют о патологии, даже при отсутствии макроскопических (эндоскопических) изменений.
6.2.1.2. Пищевод Барретта
ПБ является единственным известным предопухолевым состоянием, несущим в себе потенциальную угрозу развития аденокарциномы пищевода. Частота ее развития увеличивается при ПБ в 40-125 раз по сравнению с общей популяцией, и по разным данным составляет от 0,41% до 0,61% в год.
ПБ характеризуется заменой плоского эпителия дистальной части пищевода выше пищеводно-желудочного перехода на цилиндрический, который может быть выявлен эндоскопически. На Всемирном конгрессе гастроэнтерологов (Монреаль, 2005) было принято следующее определение ПБ. Пищевод Барретта – это изменение в эпителии пищевода любой длины, которое может быть определено при эндоскопии и подтверждено наличием цилиндрической метаплазии при биопсии. Последнее определение ПБ было принято Американской гастроэнтерологической ассоциацией в 2011г., в соответствие с которым, ПБ – это состояние, при котором метаплазированный цилиндрический эпителий, предрасполагающий к развитию рака, замещает неороговевающий плоский эпителий, выстилающий дистальный отдел пищевода (Spechler S.J. et al., 2011). Описаны три варианта цилиндрического эпителия в пищеводе: переходный или кардиальный эпителий, который встречается на границе пищевода и желудка, эпителий фундального отдела желудка и специализированный кишечный эпителий по типу интестинальной метаплазии.
Согласно Монреальскому консенсусу по ГЭРБ (2006) необходимо обязательное гистологическое подтверждение цилиндроклеточной метаплазии, требуется множественная биопсия из близко расположенных участков для верификации диагноза ПБ и его протяженности. Именно нахождение цилиндрического эпителия в пищеводе является основанием для постановки диагноза «пищевод Барретта». Однако в соответствие с определением ПБ Американской гастроэнтерологической ассоциацией (2011) для его диагностики требуется наличие только кишечной метаплазии (КМ), т.к. это единственный тип эзофагеального цилиндрического эпителия, который четко предрасполагает к развитию рака пищевода (Spechler S. J. et al., 2011). В Монреальском консенсусе зафиксировано положение, что опасность возникновения аденокарциномы возрастает при наличии КМ протяженностью более 3 см. В 3/4 случаев протяженность интестинальной метаплазии составляет менее 3 см, т.е. в этой группе пациентов риск неоплазии – аденокарциномы минимален.
Следовательно, ПБ с большой протяженностью КМ – самый значимый идентифицируемый фактор риска аденокарциномы пищевода.
В пищеводе могут выявляться участки СО желудка (изолированные скопления гетеротопической СО желудочного типа), наиболее часто располагающиеся в верхней трети пищевода. Вероятнее всего, они представляют собой результат неполной замены цилиндрического эпителия плоским неороговевающим эпителием на этапе эмбриогенеза пищевода. Эти очаги не являются метаплазией (как при ПБ) и не связаны с ГЭРБ (Schapiro M., 2003).
В настоящее время для обнаружения ПБ применяются высокочувствительные эндоскопические технологии: эндоскопия с высоким разрешением, хромоэндоскопия, флуоресцентная эндоскопия, узкоспектральная эндоскопия, ZOOM-эндоскопия.
Дисплазия высокой степени и ранний рак визуально могут не отличаться, для их дифференцировки необходима биопсия (чувствительность 80%). Очевидно, что пациенты с выявленными изменениями – тяжелой дисплазией и/или ранним раком – должны детально обследоваться в специализированном центре с высокопрофессиональной эндоскопической и морфологической службой. Благодаря тщательному эндоскопическому исследованию и проводимому вслед за ним гистологическому анализу у большинства больных удается диагностировать патологию на ранних стадиях (чувствительность 80%). Эндоскопия с высоким разрешением позволяет, как правило, своевременно выявить участки неоплазии высокой степени и рак пищевода, в том числе при наличии ПБ.
На практике важна эндоскопическая оценка протяженности ПБ. Ориентиром является гастроэзофагеальный переход. Применяются Пражские критерии (2004) для оценки циркулярного (С) поражения и максимальной протяженности (М) по складкам ПБ. Сложности возникают при грыже пищеводного отверстия диафрагмы, стриктурах пищевода, опухолях. При любом размере интестинальной метаплазии у больных с ПБ может быть участок неоплазии (дисплазии).
Американская гастроэнтерологическая ассоциация (AGA) в 2011г. рекомендовала для пациентов с ПБ следующую периодичность эндоскопического наблюдения: нет дисплазии – 1 раз в 3-5 лет, при дисплазии низкой степени – 1 раз в 6-12 месяцев, при дисплазии высокой степени без проведения абляционной терапии – 1 раз в 3 месяца. Отмечается, что эндоскопическая оценка должна быть выполнена с использованием эндоскопии в белом свете и сопровождаться выполнением 4-квадрантной биопсии через каждые 2 см (Сиэтлский протокол, 1993). Биоптаты любых участков СО с отклонениями от нормы, с неровностями) должны поставляться морфологу отдельно. При выявлении дисплазии или подозрении на нее 4-квадрантная биопсия должна выполняться через каждый 1 см (Spechler S.J., 2011). Биоптаты должны помещаться в отдельные контейнеры с указанием их локализации в пищеводе при направлении на гистологическое исследование (расстояние от резцов и квадрант). Адекватно выполненной серией биопсий следует считать ту, которая выявляет плоский эпителий выше Z-линии (проксимально) и желудочную кислотопродуцирующую СО в наиболее дистальном биоптате (Ивашкин В.Т., Маев И.В., Трухманов А.С., 2011).
Именно данные гистологического анализа биопсийного материала и протяженность пищевода Барретта, по данным эндоскопии, являются основой для рекомендаций по наблюдению пациентов с данной патологией.
К большому сожалению, в наших условиях по многим причинам данные рекомендации практически никогда не соблюдаются. В тоже время, сейчас с развитием эндоскопической техники, наметились некоторые тенденции к пересмотру данных положений. И рекомендуемое эндоскопическое наблюдение со случайными биопсиями из четырех квадрантов у больных с пищеводом Барретта было подвергнуто сомнению после обзора данных из нескольких источников. Во-первых, абсолютный ежегодный риск развития аденокарциномы из ПБ низок 0,1% (Hvid-Jensen F., Pedersen L., Drewes A.M., 2011 г.). Во-вторых, рак пищевода – крайне редкая причина смерти больных с ПБ. Фактически, у этих пациентов та же самая продолжительность жизни, как и у населения в целом (Kahrilas PJ., 2011 г.). Рекомендуемая стратегия наблюдения за пациентами с ПБ, не уменьшила летальность от аденокарциномы пищевода и возможно пищевод Барретта – переоцененное состояние на Западе (Khek-Yu Ho, 2013 г.).
6.2.1.3. Поражение пищевода при инфекционных заболеваниях
• Кандидозный эзофагит – наиболее часто встречающаяся и наиболее изученная форма инфекционного эзофагита. Он вызывается возбудителями различных грибов, чаще всего рода Candida и наблюдается в 1–2 % случаев среди больных общего профиля. У пациентов с угнетением местного и общего иммунитета кандидозный эзофагит может являться первым клиническим проявлением. В частности, у больных СПИДом он наблюдается в 30–50 % случаев.
Эндоскопические изменения при кандидозном эзофагите достаточно типичны. Для них характерны гиперемия СО с наличием белесоватых наложений в виде бляшек, как правило, средней трети пищевода, которые могут переходить в сливающиеся линейные или узловые налеты, с изъязвлением СО. Без лечения могут развиваться пищеводные стриктуры, иногда приводящие к непроходимости пищевода.
Биопсия при характерной клинической картине не требуется, достаточно взятие мазка на цитологическое исследование.
• Цитомегаловирусный эзофагит. Частота цитомегаловирусных поражений составляет 10–20 % от всех инфекционных поражений пищевода. Он развивается только на фоне иммунодефицита. У больных СПИДом эзофагит цитомегаловирусной этиологии может развиться у 1–14 % пациентов. Повреждение пищевода при данной патологии часто сочетается с поражением других органов: сетчатки, легких, печени, толстой кишки. При эндоскопическом исследовании выявляются большие плоские или щелевидные язвы в средней трети пищевода. Они могут быть обширными, длиной до 10 сантиметров, глубокими и, как правило, единичными. При эзофагите цитомегаловирусной этиологии могут развиваться осложнения в виде массивного некроза эпителия, разрыва пищевода, кровотечения, стриктур, трахеобронхиальных фистул, диссеминации. Необходима биопсия с морфологической диагностикой, в том числе с полимеразно-цепной реакцией.
• Герпетический эзофагит – вызванный вирусом простого герпеса, встречается несколько реже – 2–5 % в структуре всех эзофагитов. Может быть результатом непосредственного распространения инфекции из ротовой полости и глотки в пищевод или возникнуть как осложнение в результате реактивации вируса. В этом случае вирус достигает СО пищевода по блуждающему нерву. Поражения пищевода, визуально наблюдаемые при эндоскопическом исследовании, носят более локальный характер. В процесс чаще вовлекается дистальный отдел, но по мере распространения эзофагита происходит диффузное повреждение всего пищевода. С помощью эндоскопии можно обнаружить множественные мелкие изъязвления овальной формы, размерами до 1–2 см в диаметре. Для герпетических эзофагитов характерны тяжелые осложнения, такие как массивный некроз эпителия, разрыв пищевода, кровотечение, стриктуры, трахео-бронхиальные фистулы.
Для точной постановки диагноза необходимо исследование секрета из пищевода, получаемого при эндоскопии с помощью цитологических и культуральных методов. При проведении ЭГДС у больных с герпетическим дерматитом необходимо брать биопсию (3-5 биоптатов) из СО верхней трети пищевода даже при отсутствии видимого поражения.
• Другие вирусные эзофагиты. Этиологическим фактором развития вирусного эзофагита может стать инфекция вирусом ветряной оспы, вирусом Эпштейна-Барра. Наблюдается, как правило, у иммунокомпрометированных больных. На первом плане – системные поражения органов – легкие, печень, мозг, что особенно характерно для вируса ветряной оспы. Диагноз устанавливается на основании ИГХ исследований щеточной биопсии СО пищевода.
• Туберкулезный эзофагит – наблюдается крайне редко, сочетается с поражением легких. Эзофагит может развиваться при проглатывании мокроты, инфицированной микобактериями, реже – у больных с иммунодефицитом – гематогенным или лимфогенным путем из легких и органов средостения. Эндоскопическая картина вариабельна, могут наблюдаться язвы, стриктуры, описаны объемные образования с изъязвлением, что требует дифференциальной диагностики со злокачественными новообразованиями. Иногда выявляется смещение пищевода увеличенными лимфоузлами средостения. Осложнениями туберкулезного эзофагита могут быть перфорация пищевода, фистулообразование. Диагноз устанавливается по данным множественной биопсии и обнаружения некротизирующих гранулем, микобактерий туберкулеза.
• Бактериальный эзофагит – описан при гранулоцитопении и бесконтрольном приеме антисекреторных препаратов. Часто развивается у больных с бактериемией, септическим состоянием. Эзофагоскопия выявляет ранимость СО, фибринозный налет, изъязвления. В биоптате наблюдаются скопления бактерий в подэпителиальном слое без выраженной воспалительной реакции. При выделении культуры – сапрофиты (Staph. aureus или Staph. epidermidis, Str. viridans, бациллы).
• Сифилитический эзофагит – поражение пищевода при третичном сифилисе. Сифилитическое поражение наиболее часто локализуется в верхней и средней трети пищевода. Возможны различные макроскопические формы.
Это может быть диффузное поражение, напоминающее по внешнему виду эзофагит и/или в виде специфических гумм, в части случаев – с поверхностным изъязвлением на вершине; в виде плоских или глубоких изъязвлений. Язвы формируются в результате специфического воспаления стенки пищевода с нарушением трофики СО и повреждения сосудов. Развивается подслизистый фиброз, приводящий к развитию рубцовых изменений с формированием стеноза.
Также сифилитическое поражение может быть локализованным, захватывать лишь одну из стенок пищевода, без заметного сужения его просвета, но чаще в виде кольца с диффузным поражением различной протяженности или неровного опухолевидного образования с изъязвлением на вершине или без него, очень редко в виде глубокого изъязвления без четких границ. При отсутствии лечения быстро нарастает инфильтрация стенок пищевода, уменьшаются и исчезают складки его СО, появляется ригидность пищевода в области поражения, быстро прогрессирует стеноз.
СО в области сифилитического поражения может быть в одних случаях отечной и гиперемированной, в других – оставаться бледноватой. Изъязвления СО пищевода чаще неглубокие, с нечеткими границами, чаще с продольной ориентацией. Дифференциальная диагностика сифилитического поражения пищевода должна проводиться, прежде всего, с раком пищевода, рефлюкс-эзофагитом, пептической язвой пищевода, с туберкулезом и грибковым поражением. Рекомендована множественная биопсия. При гистологическом исследовании фрагментов СО пищевода, полученных при проведении эзофагобиопсий, чаще всего ошибочно диагностируют рак пищевода или эзофагит.
• Лекарственный эзофагит – может возникать у людей любого возраста, принимающих химически агрессивные лекарственные средства. Эндоскопическая картина данной формы эзофагита является наиболее вариабельной и характеризуется одной или более одиночными язвами, как правило, достаточно больших размеров на фоне нормальной СО, прилегающей к изъязвлениям. Описано также наличие диффузного воспаления, обильного белесоватого экссудата, псевдоопухолей, фиброзных стриктур и даже развитие перфораций. Обычно поражается средняя треть пищевода, реже – нижние отделы. Наиболее частым местом повреждений является место перехода проксимальной части пищевода в среднюю, в котором амплитуда перистальтики относительно низкая, а пищевод сдавлен дугой аорты. Дистальный отдел пищевода может быть тоже вовлечен в патологический процесс, иногда с ограниченным поражением пищеводно-желудочного перехода, что позволяет дифференцировать этот вид эзофагита с рефлюкс-эзофагитом. В диагностике ведущая роль принадлежит анамнезу. Биопсия при язвенных поражениях обязательна в целях дифференциальной диагностики с опухолевыми поражениями пищевода и поражениями пищевода при других заболеваниях.
• Актиномикоз пищевода относится к весьма редким заболеваниям. Возникает в результате перехода патологического процесса с пораженных лучистым грибком соседних органов ротовой или грудной полостей на пищевод. Чаще поражаются средний и верхний отделы пищевода. Ввиду вовлечения в процесс околопищеводной клетчатки пищевод может оказаться как бы замурованным в твердых мозолистых массах. Последующее нагноение инфильтратов приводит к возникновению свищевых ходов, может сформироваться пищеводно-трахеальный свищ. Диагноз ставится на основании всей картины заболевания (учитывая поражения смежных пищеводу органов), данных эзофагоскопии, исследования выделяемого из свища (друзы и мицелий) и биопсии.
6.2.1.4. Поражение пищевода при системных и прочих заболеваниях
· Поражение пищевода при склеродермии. Основным патогенети-
ческим механизмом повреждения пищевода при склеродермии является нарушение его двигательной активности вследствие изменения структуры пищевода, замещение гладкой мускулатуры нижних двух третей пищевода плотной фиброзной тканью, что нарушает перистальтику, и приводит к затруднению прохождения пищевого комка по пищеводу. В патологический процесс вовлекается и нижний пищеводный сфинктер, что способствует рефлюксу желудочного содержимого и еще большему повреждению СО пищевода. В клинической картине эзофагита наиболее яркий синдром – дисфагия, которая развивается в достаточно ранние сроки заболевания. Степень выраженности дисфагии зависит от стадии и тяжести основного заболевания. Поражение пищевода диагностируется рентгенологически. Определяется сужение пищевода в нижней трети, ослабление перистальтики, замедление прохождения контрастного вещества по пищеводу, ригидность стенок. При эндоскопическом исследовании могут наблюдаться явления рефлюксэзофагита; возможно развитие пептических язв, стриктур, грыжи пищеводного отверстия диафрагмы. Морфологическое исследование малоинформативно.
· Аутоиммунные поражения. Различные заболевания кожи (приобретенный буллезный эпидермолиз, обыкновенная пузырчатка, рубцовый пемфигоид, плоский лишай) могут протекать с вовлечением в патологический процесс пищевода с развитием трудно купируемого эзофагита, как синдрома, чаще у женщин среднего возраста. Пузырчатка пищевода – редкое заболевание. Морфологически проявляется громадными буллами, после вскрытия которых образуются большие эрозированные поверхности, при адекватном лечении заживающие очень быстро. У больных появляется дисфагия, обусловленная проксимальными стриктурами пищевода; при этом могут отсутствовать ассоциированные с этими заболеваниями поражения кожи, слизистой оболочки рта и аногенитальной области. При эзофагоскопии отмечается диффузная эритема, образование пузырей в СО, легко шелушащейся и отделяемой от подслизистого слоя, белесоватых узелков или бляшек, а также стриктуры в проксимальном отделе пищевода. Для установления диагноза требуется выполнение множественной биопсии, позволяющей при проведении гистологического исследования установить точный диагноз заболевания.
· Эозинофильный эзофагит – недавно открытая патология пищевода, которая интенсивно изучается в последние годы. С 2000г. отмечен существенный рост заболеваемости эозинофильным эзофагитом в странах Европы, Азии, Северной Америки. Заболевание может диагностироваться в любом возрасте, однако наиболее часто диагностируется в детском возрасте, у мужчин до 40 лет. Отмечена высокая частота ассоциации эозинофильного эзофагита с атопическими и аллергическими заболеваниями, в первую очередь, – с бронхиальной астмой. Эозинофильный эзофагит – это иммуноопосредованное воспаление пищевода с участием эозинофилов, развивающееся на фоне аутоиммунных заболеваний. Довольно частым ошибочным диагнозом при наличии эзофагита у этих больных является ГЭРБ. Клиническая картина эозинофильного эзофагита неспецифична, характеризуется пищеводными и внепищеводными симптомами. Больные жалуются на дисфагию, ощущение «комка в горле», першение, изжогу, боли в груди. Затруднение глотания пищи наблюдается более чем у 90% больных с эозинофильным эзофагитом. На мысль об эозинофильном эзофагите наводит отсутствие положительной динамики гастроэзофагеальных симптомов на фоне традиционной медикаментозной терапии. Верифицировать диагноз можно только при эндоскопическом исследовании с последующим морфологическим подтверждением. В отличие от «классического» рефлюкс-эзофагита эозинофильный эзофагит не всегда связан с ГЭРБ. Для него характерно поражение пищевода на всем протяжении, а не только дистального отдела. На предполагаемый диагноз эозинофильного эзофагита указывают эндоскопические проявления: множественные кольца в просвете пищевода (так называемый «кошачий пищевод»), продольные бороздки или экссудат белого цвета. При гистологическом исследовании биоптатов СО пищевода выявляются эозинофильная инфильтрация с участками Т-клеточной активации в слизистом и подслизистом слоях, гипертрофия папиллярной и базальной зоны. Морфологические изменения ограничиваются только пищеводом, и не выявляются в желудке и двенадцатиперстной кишке. Эозинофилы в норме присутствуют в СО пищевода. Эозинофильная инфильтрация иногда может отмечаться и при рефлюксэзофагите, но ее уровень не превышает 5 эозинофилов в поле зрения, в то время как при эозинофильном эзофагите он достигает 15–25 в поле зрения.
· Поражение пищевода при болезни Крона (гранулематозный эзофагит) – наблюдается редко. Эндоскопические критерии: регионарное (прерывистое) поражение СО, симптом «булыжной мостовой» (сочетание глубоких продольно ориентированных язв и поперечно направленных язв c островками отечной гиперемированной СО), линейные язвы (язвы-трещины), афты, в некоторых случаях – стриктуры и устья свищей. Диагноз может быть установлен окончательно только после дифференциальной диагностики с другими заболеваниями. При поражении верхних отделов ЖКТ необходимо исключить рак, туберкулез, саркоидоз, лимфому, аденокарциному. Биопсия должна быть множественной; патогномоничным для болезни Крона является формирование неказеозных саркоидоподобных эпителиоидных гранулем с клетками Пирогова-Лангханса. Гранулемы находят приблизительно в 30 – 40% при гистологическом исследовании биопсийного материала, однако отсутствие гранулем не дает оснований для исключения болезни Крона. Гистологическое исследование позволяет видеть выраженную инфильтрацию собственной пластинки СО и подслизистой основы лимфоидными клетками, толстостенные сосуды с явлениями васкулита.
· Лучевой эзофагит – возникает вследствие патологического воздействия на организм радиационного излучения. Часто развивается после лучевой терапии на область грудины. Клинические проявления лучевого эзофагита не специфичны. Характерны боли в груди при глотании, дисфагия, которая нарастает при формировании стриктуры пищевода. Эндоскопическое исследование обнаруживает повреждение верхней и средней трети пищевода – выраженный отек, гиперемия СО, которая в последующем лишается эпителия и покрывается налетом. Диагноз основывается на данных анамнеза – воздействие радиационного излучения. Биопсия необходима только при возникновении недиагностированной ранее патологии в пищеводе.
· Ожоги, инородные тела пищевода – могут быть причиной развития тяжелых хронических форм эзофагитов. Травма пищевода может произойти вследствие механического повреждения стенки пищевода при различных манипуляциях и операциях: установка назо-гастрального зонда, эндоскопическая склеротерапия, эндоскопическое лигирование вен пищевода, а также при повреждении СО пищевода продуктами питания, инородными телами при проглатывании. После травмы или ожога пищевода рано развивается боль в грудной клетке, одинофагия (боль при глотании), повышается температура тела, в дальнейшем может появиться дисфагия, что должно нацелить врача на исключение у больного стриктуры пищевода. Травма пищевода – одна из причин образования крупных язвенных дефектов пищевода, выявляемых при эзофагоскопии. Вследствие повреждения пищевода различными химическими агентами, кислотами, щелочами, другими агрессивными жидкостями развивается тяжелое воспаление и некроз тканей. В дальнейшем по всей оси пищевода формируются стриктуры. В острый период биопсия противопоказана, в дальнейшем – по показаниям.
6.2.2. Опухолевые поражения пищевода
Гистологическая классификация опухолей пищевода (ВОЗ, 2010).
|
Эпителиальные опухоли | |
|
Плоскоклеточная папиллома |
8052/01 |
|
Интраэпителиальная неоплазия2 | |
|
Плоскоклеточная
| |
|
Раковые опухоли | |
|
Плоскоклеточный рак |
8070/3 |
|
Бородавчатый рак |
8051/3 |
|
Базальноклеточный рак |
8083/3 |
|
Веретеноклеточный рак |
8074/3 |
|
Аденокарцинома |
8140/3 |
|
Железистоплоскоклеточный рак |
8560/3 |
|
Мукоэпидермоидный рак |
8430/3 |
|
Аденокистозный рак |
8200/3 |
|
Мелкоклеточный рак |
8041/3 |
|
Недифференцированный рак |
8020/3 |
|
Другие | |
|
Карциноид |
8240/3 |
|
Неэпителиальные опухоли | |
|
Лейомиома |
8890/0 |
|
Липома |
8850/0 |
|
Зернистоклеточная опухоль (опухоль Абрикосова) |
9580/0 |
|
Гастроинтестинальная стромальная опухоль (ГИСО): |
8936/1 |
|
доброкачественная |
8936/0 |
|
с неопределенным потенциалом злокачественности |
8936/1 |
|
злокачественная |
8936/3 |
|
Лейомиосаркома |
8890/3 |
|
Рабдомиосаркома |
8900/3 |
|
Саркома Капоши |
9140/3 |
|
Злокачественная меланома |
8720/3 |
|
Другие | |
|
Вторичные опухоли |
Морфологический код Международной классификации онкологических заболеваний (МКБ-О (ICD-O)). Предусматривает пятизначное кодирование в пределах от М-8000/0 до М-9989/3. Морфологический код имеет 5 знаков: первые четыре обозначают гистологический тип, пятый – биологические свойства опухоли: /0 – доброкачественная опухоль; /1 неясно, доброкачественная или злокачественная опухоль; /2 – неинвазивный рак, /3 злокачественное новообразование, первичный очаг; /6 – ЗН, метастаз; /9 – ЗН, неясно, первичный или метастатический очаг.
ИЭН (интраэпителиальная неоплазия) не имеет общего кода в МКБ-О. Коды МКБ доступны только для поражений, отнесенных к категории железистой интраэпителиальной неоплазии класса III (8148/2), плоскоклеточный интраэпителиальной неоплазии, класс III (8077/2), а также плоскоклеточный рак in situ (8070/2).
6.2.2.1. Доброкачественные опухоли пищевода составляют до 0,5-5% от всех его опухолей. Гистогенетическая классификация доброкачественных опухолей пищевода представлена в приложениях.
Эпителиальные доброкачественные опухоли
· Аденома – крайне редкая опухоль пищевода. Может развиваться из собственных желез пищевода и в участках метаплазированного железистого эпителия. Макроскопически представляет собой округлое плотноватое полиповидное образование, возвышающееся над слизистой оболочкой, диаметром 0,2 – 1,0 см. Чаще на широком основании, может быть на ножке. Под микроскопом опухоль имеет тубулярный и папиллярный типы строения. Биопсия обязательна – от 1 до 3 кусочков в зависимости от размеров опухоли.
· Папиллома – опухоль, развивающаяся из многослойного плоского эпителия. Составляет 0,04 – 0,5 % от всех опухолей и опухолеподобных поражений пищевода. Считается, что основная причина развития – вирус папилломы человека и наличие повреждений СО пищевода. Диаметром от 1-2 мм до 1-3 см; на широком основании, реже на ножке; располагается обычно в средней или нижней трети пищевода. Возможно множественное поражение. Имеет четкие, ровные или бугристые контуры с характерным рельефом (сосочковый, бородавчатый или шагреневый). При гистологическом исследовании обнаруживаются папилломатозные разрастания многослойного плоского эпителия с нежной соединительнотканной стромой, содержащей небольшое количество тонкостенных сосудов. Биопсия обязательна – от 1 до 3-х кусочков в зависимости от размеров, часто опухоль, особенно на ножке, может быть полностью удалена при биопсии.
К опухолеподобным образованиям пищевода относятся кисты (энтерогенные, ретенционные, развившиеся из дистопированного желудочного эпителия, бронхогенные, паразитарные, кистозный эзофагит). Представляют собой тонкостенные образования, содержащие прозрачную желтоватую или опалесцирующую жидкость. Внешняя стенка кисты представлена фиброзной и гладкомышечной тканью, внутренняя – плоскоклеточным или цилиндрическим, мерцательным (при бронхогенных кистах) эпителием. Содержимое кисты может быть серозным, слизистым, серозно-гнойным, желеобразным. Могут быть одиночными и множественными, чаще диагностируются в средней и нижней трети пищевода. Нередко наблюдаются изъязвление и кровотечение в просвет кисты. При инфицировании микробной флорой кисты могут нагнаиваться. Описаны случаи злокачественной трансформации. В диагностике важная роль принадлежит эндосонографии – образование имеет анэхогенную структуру, лоцируется в подслизистом слое, при доплеровском исследовании кровоток, в отличие от сосудистых структур, не определяется. Биопсия не требуется.
Неэпителиальные (мезенхимальные) доброкачественные опухоли
· Лейомиома наиболее часто (60-70%) встречающаяся доброкачественная опухоль пищевода. Обычно развивается из мышечной оболочки, значительно реже из собственной мышечной пластинки СО или гладкомышечных элементов сосудистой стенки. Опухоль распространяется в толще пищеводной стенки между продольным и циркулярным мышечными слоями, в отдельных случаях наблюдается циркулярный рост. СО над опухолью сохранена, легко смещаема. Выявляется в виде выбухающего в просвет образования округлой или овальной формы на широком основании с гладкой поверхностью и четкими контурами. При инструментальной «пальпации» имеет плотноэластичную консистенцию и легко смещается. Как и все подслизистые опухоли пищевода, величина и форма лейомиомы не изменяются при дыхании. Имеет хорошо выраженную соединительно-тканную капсулу. Рост медленный. СО над опухолью хорошо смещается, подвижная, как правило, не изменена, но в ряде случаев может воспаляться вплоть до эрозирования и изъязвления. Различают лейомиомы в виде изолированного узла, с множественными узлами и распространенный лейомиоматоз. При эндосонографическом сканировании лейомиома представляет собой гипоэхогенное, однородное по своей эхоструктуре, с четкими контурами образование, локализующееся в пределах второго (мышечная пластинка слизистой) или четвертого (мышечный слой) слоев стенки ЖКТ. При изъязвлении опухоли возникает дефект СО, возможно развитие кровотечения из дефекта. Микроскопически лейомиома состоит из гладких мышечных волокон различной толщины, расположенных беспорядочно в виде завихрений.
· Липома – встречается очень редко, имеет правильную овальную форму. Расположена в подслизистом слое, реже – в мышечном. Состоит из жировой ткани со слабо выраженной стромой и дольчатостью. Эндосонографически липома представляет собой гиперэхогенное, гомогенное образование с четкими контурами, исходящее из третьего слоя стенки ЖКТ, который соответствует подслизистой оболочке.
· Фиброма – зрелая доброкачественная опухоль, состоящая из элементов соединительной ткани, а именно – из фибропластов, составляющих паренхиму опухоли, и соединительнотканных волокон с сосудами, составляющих строму. Чаще растет из адвентиции, может располагаться в толще стенки пищевода, иногда представлена полипоидной опухолью, имеющей ножку, плотной консистенции.
· Зернисто-клеточная опухоль (опухоль Абрикосова, миобластома). Генез опухоли неясен. Высказывается мнение о ее гистиоцитарном или нейрогенном происхождении. Обычно небольших размеров, имеет капсулу, локализуется в языке, коже, пищеводе. Опухоль состоит из компактно расположенных округлой формы клеток, с мелкозернистой цитоплазмой.
· Сосудистые опухоли (гемангиомы, лимфангиомы) – могут быть представлены капиллярной, кавернозной опухолью или опухолью смешанного строения.
· Неврогенные (невриномы, нейрофибромы) – развиваются из оболочки нервов и чаще всего локализуются в толще мышечного слоя. Имеют плотную консистенцию.
· Остеохондрома, миобластома, миксома, тератома – наиболее редко встречаемые опухоли.
Гистологическое строение доброкачественных опухолей обычно не оказывает заметного влияния на клиническую картину. Более показателен характер роста опухоли – внутрь просвета пищевода или внутрь его стенки. На этом признаке основано подразделение всех доброкачественных опухолей на внутристеночные и внутрипросветные. Обычно к первой группе относят лейомиомы, кисты, сосудистые опухоли, ко второй – фибромы, липомы, аденомы, папилломы. К осложнениям доброкачественных опухолей и опухолеподобных образований относятся кровотечение вследствие изъязвления СО, покрывающей опухоль, нагноение и перфорация кисты, малигнизация опухоли.
Как уже было сказано выше, при наличии интактной СО над новообразованием щипцовую биопсию при выполнении эзофагоскопии производить не надо. Биопсия щипцами будет в данном случае неинформативной; для информативного эндоскопического заключения следует выполнять биопсию именно подслизистого образования. Это возможно только после предварительного рассечения СО над образованием с последующим глубоким захватом, что сопряжено с высоким риском кровотечения или даже перфорации. Предпочтительнее выполнять эндоскопическую эндосонографию c тонкоигольной пункцией (EUS-FNA). Кроме того, это еще связано и с тем, что при оперативном лечении внутристеночных опухолей часто удается вылущить опухоль без повреждения покрывающей ее СО. Если же больному с подобным образованием ранее была проведена эзофагобиопсия, в СО над опухолью развиваются участки фиброза, что может привести к ее травматизации при хирургическом выделении опухоли и увеличению риска возникновения послеоперационных осложнений. Поэтому клиническое применение щипцовой биопсии показано лишь при внутрипросветных опухолях и при изъязвленных внутристеночных образованиях, когда СО над опухолью уже разрушена.
Также следует помнить, что стойкое сужение пищевода может быть вызвано сдавлением его просвета патологическими изменениями в соседних с ним органах заднего средостения, позвоночнике, щитовидной железе, трахее, левом главном бронхе, бифуркационных лимфатических узлах, сердце, плевре или диафрагме. В ряде случаев стенка пищевода может поражаться вторично вследствие перехода воспалительного процесса и развития периэзофагита или прорастания ее злокачественной опухолью, исходящей из соседних тканей и органов. Поэтому здесь на первый план в диагностике выходит выполнение эндосонографии, оценка данных КТ и МРТ. Проводить биопсию в данной ситуации противопоказано, за исключением прорастания опухолевой ткани из соседних органов.
6.2.2.2. Злокачественные опухоли пищевода
Составляют до 95% от всех опухолевых заболеваний пищевода.
· Рак пищевода. В структуре злокачественных опухолей пищевода рак занимает до 90-95%, а среди всех злокачественных опухолей человека 7-е место (по заболеваемости) и 3-е место в структуре причин смертности от онкологических заболеваний, уступая лишь раку желудка и раку легкого. Заболевание встречается чаще всего у лиц в возрасте старше 60 лет, женщины болеют в 2 – 5 раз реже мужчин.
Основными формами РП являются плоскоклеточный рак и аденокарцинома. Частота этих двух типов карцином различается в зависимости от географического региона, образа жизни и питания. Алкоголь, курение, нарушения диеты (копченая, острая, горячая пища и т.д.) увеличивают риск заболевания плоскоклеточным раком пищевода. Однако ни алкоголизм, ни курение не повышают риск заболевания аденокарциномой. Оба типа РП часто встречаются у больных с другими заболеваниями, но причины развития их отличаются. Риск заболеть плоскоклеточным раком увеличивается у больных с ахалазией пищевода. После продолжительного скрытого периода (от 30 до 50 лет) с момента химического повреждения пищевода такими веществами, как каустическая сода, риск появления плоскоклеточного рака также возрастает. У больных с излеченным раком СО полости рта или легкого возрастает риск появления второго плоскоклеточного рака в пищеводе.
С другой стороны, аденокарцинома особенно часто встречается у людей с пищеводом Барретта. Риск выявления нового случая аденокарциномы составляет примерно – 1 случай на 75 больных пищеводом Барретта в год. ПБ, в свою очередь, в основном встречается у людей с выраженными проявлениями гастроэзофагеального рефлюкса, и очевидно, что рефлюкс может быть причиной трансформации от плоскоклеточного к метапластическому типу эпителия СО пищевода.
Плоскоклеточный рак составляет до 60% – 90% злокачественных опухолей пищевода, и до недавнего времени был основной формой заболевания, аденокарцинома встречалась значительно реже (10-15 лет назад она составляла 5% – 25%), сейчас она составляет, особенно в развитых странах, до половины случаев рака пищевода. В США в 1975г. плоскоклеточный рак составлял 75%, за последние годы частота возникновения аденокарциномы пищевода у белого населения возросла на 450% и сейчас доля аденокарцином достигает 43% (Parkin et al., 2002).
Плоскоклеточный рак может развиться в любом отделе пищевода. Наиболее частая его локализация – средняя часть (от 40 до 65% случаев), несколько реже – нижняя (от 30 до 55%) часть пищевода; поражение органа в верхней трети отмечается лишь в 8-12% случаев. Недостаточно четко определена разница между раком нижней трети пищевода с переходом на кардию желудка, и наоборот (кардиоэзофагеальный рак). Часто используется понятие «геометрический центр опухоли», однако темпы роста опухоли вдоль стенки пищевода значительно выше, чем скорость поражения желудка. Поэтому если опухоль возникла из эпителия желудка и в процессе своего развития распространилась на пищевод, то через некоторое время размеры ее на пищеводе могут значительно превысить таковые на желудке. Для карциномы пищевода характерно распространение по подслизистому слою иногда до 10 см от центра опухоли без инвазии мышечного слоя.
Большинство аденокарцином расположены в дистальном отделе пищевода и предположительно развиваются из нормальной цилиндрической выстилки или метаплазированного эпителия при ПБ. Однако аденокарцинома может наблюдаться и в среднем отделе у пациентов с более распространенным ПБ, а также в шейном отделе, возникая при этом из островков эктопической СО желудка.
К предраковым заболеваниям пищевода относятся:
синдром Пламмера – Винсона (хронический эзофагит, обусловленный недостатком железа, с фиброзными изменениями стенки пищевода и дисфагией). Вероятность возникновения рака при этой патологии достигает 10% и, скорее всего, связана с травматизацией СО на фоне хронического эзофагита;
тилоз (локальная пламмарно–плантарная кератодермия), редкая наследственная патология, которая характеризуется развитием аномального плоского эпителия СО пищевода. Риск развития рака у этих больных в 5 – 10 раз выше, чем в популяции;
рубцовая стриктура пищевода. Развитие РП связано с постоянной травматизацией СО на фоне хронического эзофагита;
ахалазия пищевода или кардии (идиопатическое расстройство моторики пищевода, характеризующееся увеличением давления в нижней трети на фоне неполного расслабления нижнего пищеводного сфинктера). У этих пациентов риск развития РП увеличивается в 16 – 20 раз. Опухоль возникает, в среднем, через 15 – 17 лет от начала заболевания. Злокачественная трансформация СО развивается в дилатированном участке на фоне хронического раздражения неэвакуируемой пищей;
папилломавирусная инфекция является одной из основных причин рака пищевода в Азии и Южной Африке. ДНК вируса определяется у 17% больных РП в Китае; в странах с низкой заболеваемостью, где преобладает аденокарцинома, вирус не встречается;
ГЭРБ, приводящая к развитию пищевода Барретта – одной из наиболее частых причин аденокарциномы нижней трети пищевода;
лейкоплакия пищевода, представляющая собой очаговые гиперпластические разрастания, выступающие над поверхностью СО пищевода в виде белесоватых мозолистых утолщений. Однако в последние годы роль лейкоплакии в развитии РП подвергается сомнению.
В диагностике раннего РП необходимо придерживаться следующих правил. Осматривая СО при стандартном эндоскопическом исследовании, в первую очередь необходимо обратить внимание на наличие участков с измененной окраской, это могут быть пятна красного (серовато-розового/белого) цвета, незначительных изменениях микрорельефа.
Разработанный в последние годы метод NBI облегчает выявление этих новообразований в виде коричневых пятен. Наличие рака подозревают при выявлении 4 признаков во время детального осмотра красноватых пятен при эндоскопии в белом свете с увеличением или коричневых пятен при эндоскопии в режиме NBI: формирование четкого участка, исчезновение вида разветвленных сосудов зеленого цвета в этих новообразованиях, краевое возвышение окружающей СО, изменение сосудистого рисунка IPCL, появление типов IV-V-1. Выявление всех перечисленных признаков позволяет с большой долей вероятности заподозрить наличие рака in situ (категория IV по Венской классификации).
На втором этапе выполняется хромоэзофагоскопия с помощью абсорбционных красителей: раствора Люголя и метиленового синего. Метиленовый синий абсорбируется клетками при их интестинальной метаплазии и окрашивает измененную СО пищевода в голубой цвет. Раствор Люголя окрашивает клетки здорового, бледно-розового гликогенсодержащего плоского эпителия в коричневый цвет за счет связывания йода, а патологические измененные участки СО (эрозии, рубцы, язвы, рак и т.п.) остаются неокрашенными.
При визуальном описании макроскопического вида опухоли предпочтительно использовать Парижскую эндоскопическую классификацию опухолевых поражений пищевода, желудка и толстой кишки (2002), классификацию поверхностных неоплазий по JGCA (Японская классификация ранних раков) (см. приложение).
Эндоскопически дифференцировать различные морфологические формы опухоли не представляется возможным и наиболее информативным в этом плане является выполнение биопсии с последующим цитологическим и гистологическим исследованием. Злокачественные опухоли пищевода могут быть диагностированы с помощью биопсии в 95% случаев, за исключением тех ситуаций, когда обструкция препятствует адекватной визуализации и биопсии из патологического очага.
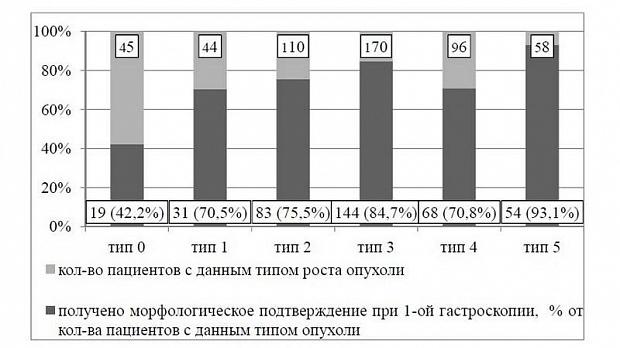
По результатам наших наблюдений за 2010-13гг. у 392 пациентов с выявленными при эндоскопии опухолями пищевода, подозрительными в отношении малигнизации, морфологический тип опухоли после биопсии был установлен в 95%, из них в 84% – плоскоклеточный рак, в 11% аденокарцинома и в 5% другие формы опухоли (GIST, мелкоклеточный рак, карциноид). И только у 5% пациентов мы не получили подтверждения злокачественного поражения при первом осмотре.
Рекомендуется забирать от 4 до 6 биоптатов. Дополнительно проводимая щеточная биопсия может повысить диагностические возможности.
· Другие формы злокачественных опухолей пищевода встречаются редко. Неэпителиальные злокачественные опухоли пищевода составляют не более 1 % от всех злокачественных новообразований этого органа.
Наиболее часто встречаются лейомиосаркома, значительно реже – рабдомиосаркома, карциносаркома, меланома. Для данной группы опухолей характерны те же клинические симптомы (местные и общие), что и при раке пищевода. Характерно довольно быстрое метастазирование в отдаленные органы (чаще всего в легкие). Злокачественные сосудистые опухоли довольно часто проявляются кровотечением. Лейомиосаркома и карциносаркома чаще локализуются в нижней половине пищевода, рабдомиосаркома – в верхнем его отделе. Меланома может поражать любой отдел пищевода. Рентгенологически и эндоскопически дифференцировать неэпителиальные злокачественные опухоли от рака пищевода очень сложно. Наиболее информативна в этом плане эзофагобиопсия с последующим цитологическим и гистологическим исследованием. Первичную меланому пищевода необходимо дифференцировать от его метастатического поражения. Принципы хирургического лечения этой группы опухолей такие же, как и при раке (резекция или экстирпация пищевода). Прогноз неблагоприятный (особенно при меланоме).
Несколько лучше прогноз у больных карциносаркомой, которая обычно захватывает поверхностные слои стенки пищевода и относительно поздно метастазирует.
· Гастроинтестинальная опухоль с локализацией в пищеводе встречаются крайне редко, составляя 1-2% ГИСО других локализаций, в большинстве же наблюдений в пищеводе выявляются истинные миогенные опухоли. По гистологическому строению ГИСО пищевода сходны с соответствующими опухолями желудка, однако для пищеводной локализации характерно более агрессивное течение заболевания – злокачественными оказываются более половины опухолей. Наиболее часто встречаются веретеноклеточный (62%), эпителиоидный (17%) и смешанный (21%) гистологические варианты строения ГИСО. Несмотря на различные варианты гистологического строения, все ГИСО считаются потенциально злокачественными. В настоящее время для определения степени злокачественности ГИСО пользуются критериями, предложенными C. Fletcher и соавт. и M. Miettinen и соавт., по которым высокий риск определяется размером опухоли более 5 см, количеством митозов более 5 в 50 полях зрения при увеличении 400 и инвазией опухолью слизистой. Иммуногистохимическим маркером степени злокачественности опухоли является также индекс экспрессии Ki-67, который достоверно возрастает выше 10% в опухолях высокого риска.
При визуальном осмотре ГИСО имеет более крупные по сравнению с другими неэпителиальными опухолями размеры, более плотную при инструментальной пальпации консистенцию. Слизистая оболочка в зоне образования может оставаться неизмененной, эластичной и подвижной при инструментальной пальпации. Зачастую на поверхности образования визуализируются изъязвления, обусловленные вторичным прорастанием опухоли, в зоне которых СО фиксирована, фрагментируется при взятии биопсии. Эндосонографически ГИСО представляет собой гипоэхогенное, чаще неоднородное по своей эхоструктуре образование, которое, как и лейомиома, может исходить как из второго (мышечная пластинка слизистого слоя), так и четвертого (собственно мышечный слой) гипоэхогенных слоев стенки пищеварительного тракта. При наличии изъязвления отмечаются нарушение целостности и инфильтрация слизистого слоя. Диагностическим критерием ГИСО является неоднородность эхоструктуры образования, наличие гиперэхогенных и анэхогенных участков.
В основе онкогенеза ГИСО лежит мутация гена С-кit. Клетками, экспрессирующими матричную РНК С-кit, являются клетки Кахаля, которые, как и клетки ГИСО, имеют положительную реакцию на С-кit протеин (CD
117) в 90 % наблюдений. В 46 – 100 % случаев отмечается положительная реакция клеток ГИСО на CD34. Следовательно, для верификации данной опухоли необходимо проведение ИГХ исследования, чувствительность и точность которого составляют 95% и 87% соответственно.
· Нейроэндокринные опухоли (НЭО) пищевода. НЭО образуют редкую и гетерогенную группу. До сих пор продолжаются споры о клиникоморфологических характеристиках и особенностях биологического поведения этих новообразований. Интерес специалистов к данной проблеме обусловливается и значительным увеличением (5-кратным в течение 30 лет) частоты НЭО (Yao J.C., 2008). К основным типам НЭО следует отнести эпителиальные новообразования, которые происходят из клеток диффузной эндокринной системы органов дыхания и пищеварения, способных продуцировать пептидные гормоны и биологически активные амины.
Большая часть НЭО представлена опухолями органов ЖКТ, включая поджелудочную железу. Эти новообразования составляют до 2% всех злокачественных новообразований пищеварительной системы и более 60% всех НЭО. Наиболее частыми локализациями в этой группе являются подвздошная кишка (17,1%), прямая кишка (16,3%), желудок (5,4%) и аппендикс (4,7%).
Принятые в настоящее время термины «нейроэндокринная опухоль» (НЭО) и «нейроэндокринная карцинома» (НЭК) базируются на наличии у всех нейроэндокринных клеток ЖКТ общих иммунофенотипических особенностей. В основе прежних классификаций НЭО ЖКТ лежали клинические проявления, что не отражало полиморфизма этих опухолей. Классификации НЭО ЖКТ (ВОЗ 2000, 2010) делят их в соответствии с локализацией, клиническими проявлениями, степенью дифференцировки, биологическим потенциалом опухолевых клеток и прогнозом. В последней классификации (ВОЗ 2010) по степени злокачественности НЭО разделили на 3 группы (Grade 1, 2 и 3) в соответствии с митотической и пролиферативной активностью опухолевых клеток (см. табл. 2, 3). В новой классификации суммированы успехи последних лет и учтены предложения признанных мировых экспертовпатологов и клиницистов. Распространенный на протяжении долгого времени общий для всех НЭО термин «карциноид» признан архаичным и его следует употреблять только для обозначения определенного типа опухолей. В группы G1-G2 входят высокодифференцированные опухоли НЭО ЖКТ, но отсутствует категория «опухоли неопределенной степени злокачественности», которая применялась в прежней классификации (ВОЗ, 2000) и не позволяла определиться с тактикой ведения подобных больных. Кроме того, в новой классификации больше не применяется термин «нейроэндокринная карцинома низкой степени злокачественности», а вместо него используется термин «нейроэндокринная опухоль – НЭО, G2». В соответствии с этим, вторая группа НЭО (G2) включает очень широкий спектр опухолей с индексом Ki-67 от 3 до 20%, которые существенно отличаются друг от друга по темпам роста, метастатическому потенциалу и прогнозу. К нейроэндокринным карциномам (G3) теперь относят только низкодифференцированные мелкои крупноклеточные опухоли с высоким митотическим индексом и индексом Ki-67, с наличием целого комплекса неблагоприятных факторов прогноза – отдаленные метастазы, инвазия сосудов и нервов, обширная инвазия окружающих органов и тканей, крупные размеры опухоли, некрозы, выраженный клеточный и ядерный полиморфизм. Обычно НЭК не дают эндокринных синдромов, реже их рост сопровождается неспецифическими симптомами, обусловленными продукцией различных эктопических гормональных продуктов, они отличаются большим разнообразием гистологических структур, клеточным и ядерным полиморфизмом. Это относится и к первичным опухолям, и к их метастазам.
В классификации 2010 г. введен совершенно новый термин – «смешанные аденонейроэндокринные карциномы». Эти опухоли морфологически и иммунофенотипически состоят из двух или более компонентов – с железистой и нейроэндокринной, реже – с нейроэндокринной и плоскоклеточной дифференцировкой. При постановке такого диагноза следует иметь в виду, что каждый из компонентов не должен составлять менее 30% опухоли.
Таблица 2. Сравнение классификаций НЭО ЖКТ.
|
ВОЗ, 1980 |
ВОЗ, 2000 |
ВОЗ, 2010 |
|
1.Карциноид |
1. Высокодифференцированная эндокринная опухоль 2. Высокодифференциро-ванная эндокринная
3. Низкодифференцированная эндокринная карцинома/ мелкоклеточная карцинома |
1. Нейроэндокринная опухоль G1 (карциноид) 2. Нейроэндокринная опухоль G2 3. Нейроэндокринная карцинома (крупноклеточный или мелкоклеточный тип) G3 |
|
2.Мукокарциноид 3.Смешанные типы карцинои-даденокарцинома |
4. Смешанная экзокринноэндокринная карцинома |
4. Смешанная аденонейроэндокринная карцинома |
|
4.Псевдоопухолевые поражения |
5. Опухолеподобные поражения |
5. Гиперпластические и пренеопластические поражения |
Таблица 3. Деление НЭО ЖКТ по степени злокачественности.
|
Степень злокачественности
|
Митотический индекс |
Индекс Ki-67 (%) |
|
G1 |
<2 |
≤2 |
|
G2 |
2-20 |
3-20 |
|
G3 |
>20 |
3-20 |
Согласно современным представлениям, все НЭО обладают злокачественным потенциалом, но различные типы опухолей могут значительно отличаться по биологическим особенностям.
Морфологическая диагностика основывается на классификации ВОЗ, а также – на критериях оценки прогноза НЭО. Кроме того, учитываются предложения Европейского общества по изучению нейроэндокринных опухолей (ENETS, European NeuroEndocrine Tumor Society), которое разработало дополнительную систему классификации TNM и определения злокачественности НЭО ЖКТ и поджелудочной железы (ENETS; 2006, 2007).
Кроме того, ВОЗ разработаны классификации, специфичные для конкретных анатомических локализаций, основанные на комплексе наиболее значимых прогностических факторов, к которым относятся глубина инвазии, наличие метастазов, размер первичной опухоли, инвазия кровеносных и лимфатических сосудов, нейроинвазия и митотическая активность, индекс пролиферации опухолевых клеток Ki-67 (MIB-1).
Основными критериями, положенными в основу TNM классификаций НЭО, разработанных ENETS и AJCC (American Joint Committee on Cancer), являются размеры опухоли, степень ее распространения, поражение регионарных лимфатических узлов, наличие отдаленных метастазов. Между системами ENETS и AJCC существуют незначительные различия, но основные ориентиры определения стадии аналогичны.
Предварительный диагноз НЭО может быть поставлен на основании клинической картины, рутинного гистологического исследования препаратов, окрашенных гематоксилином и эозином, а окончательная верификация – после ИГХ исследования. Клетки высокодифференцированных НЭО обычно экспрессируют нейроэндокринные маркеры – хромогранин А, синаптофизин, в большинстве случаев CD56 или N-CAM, а также CD99. Для того чтобы определить функциональный тип НЭО используют широкую панель маркеров к пептидам и/или аминам, обладающих активностью гормонов (инсулин, глюкагон, соматостатин, гастрин, серотонин, АКТГ и др.). НЭО верифицируют как «инсулиному», «глюкагоному», «гастриному», «карциноид» и т.д. в тех случаях, когда у пациента имеется не только сверхпродукция соответствующего гормона (определяемого биохимически и ИГХ), но и клинически имеется соответствующий гиперфункциональный синдром (см. табл. № 14 (приложения)). Если же клинический синдром отсутствует, то опухоль следует верифицировать как «инсулин-продуцирующая», «глюкагонпродуцирую-щая», «гастрин-продуцирующая» НЭО и т.д.
НЭК по гистологическому строению и по иммунофенотипу имеют много общего с аденокарциномами и другими злокачественными опухолями ЖКТ.
НЭО пищевода встречаются очень редко и составляют примерно 0,05% всех НЭО ЖКТ (Modlin I.M, Sandor A., 1997). Опухоли представлены следующими гистологическими типами: карциноид (высокодифференцированное эндокринное образование) и мелкоили крупноклеточная нейроэндокринная карцинома, реже встречается смешанная аденонейроэндокринная карцинома. Прогноз зависит от степени дифференцировки опухолевых клеток и от стадии опухоли.
Впервые карциноид пищевода описан Мак-Клауном в 1952 году. В дальнейшем появлялись новые сообщения о карциноиде этой локализации. Среди всех опухолей пищевода карциноид встречается в 1,3–2,4% случаев. Преимущественное поражение у мужчин. Отношение мужчин и женщин составляет 6:1. Возраст является широко переменным, в пределах от 30 – 82 лет, чаще 50 – 60 лет. Мелкоклеточный рак также чаще встречается у мужчин, чем у женщин (отношение 2:1). Возраст 60 – 70 лет. Большинство нейроэндокринных опухолей пищевода локализуются в нижней трети или в желудочно-пищеводном переходе. Карциноид чаще имеет большой размер (4-7 см) и глубоко инфильтрирует стенку пищевода. Различают фунгозную, папиллярную и изъязвленную формы поражения. Мелкоклеточные карциномы чаще в виде фунгозной или язвенной формы поражения, длиной от 4-х до 14-и см. Обычно больные жалуются на дисфагию, потерю веса, боль за грудиной. Очень редко при этой локализации наблюдается карциноидный синдром. Морфологически карциноиды представлены в виде солидных комплексов высокодифференцированных клеток. Мелкои крупноклеточные НЭК ничем не отличаются от своих аналогов в легких в соответствии с гистологическими и иммуногистохимическими особенностями, а также клиническим поведением. Часто отличаются очень агрессивным течением, ранним метастазированием и неблагоприятным прогнозом.
· Лимфома пищевода, особенно первичная, является редким заболеванием. Частота обнаружения лимфом пищевода не превышает 1% среди лимфом ЖКТ, которые, в свою очередь, составляют около 10% всех лимфом. Патологический процесс начинается в подслизистой лимфоидной ткани, затем распространяется, поражая СО. Вторичная лимфома пищевода является результатом распространения злокачественного процесса из верхней части желудка (дистальный отдел пищевода), медиастинальных лимфатических узлов (средняя треть пищевода), лимфатических узлов шеи (верхняя треть пищевода). Мужчины болеют несколько чаще, возраст, как правило, старше 50 лет. Клиническими проявлениями лимфомы пищевода являются дисфагия, одинофагия, боль в груди, снижение массы тела, лихорадка. При осложненном течении развиваются кровотечение, паралич голосовых связок, стриктуры, перфорация (особенно при Т-клеточной лимфоме), формирование трахеопищеводного свища. Рентгенологическое исследование, выявляющее утолщенные складки слизистой пищевода, язвы, полиповидные образования, стеноз, малоинформативно. Эндоскопическое исследование обнаруживает язвенные дефекты, полиповидные разрастания, подслизистые образования пищевода. Биопсия обязательна. Частота ложноотрицательных результатов морфологического исследования биоптатов достигает 30%. Ультразвуковое исследование выявляет диффузное, однородное, гипоэхогенное утолщение стенок пищевода или анэхогенные зоны. Дифференциальный диагноз проводят с острыми инфекционными эзофагитами (особенно при отсутствии эффекта проводимой терапии), раком пищевода, лейомиосаркомой пищевода, гастроэзофагеальной рефлюксной болезнью, ахалазией кардии.
Гистопатологические формы раковых опухолей пищевода
Плоскоклеточный рак пищевода (ПРП) определяется как проникновение неоплазированного плоского эпителия через эпителиальную базальную мембрану с распространением в собственную пластинку СО или более глубокие слои. Инвазия обычно начинается с карциномы in situ c пролиферацией неопластического эпителия, которые проникают в собственную пластинку СО с последующей диссоциацией в скопления маленьких карциноматозных клеток. Наряду с вертикальной опухолевой клеточной инфильтрацией обычно происходит и горизонтальный рост на прилегающую нормальную СО по периферии опухоли. Карцинома может распространиться на лимфатические сосуды и вены даже на ранней стадии заболевания. Частота инвазии на лимфатические и кровеносные сосуды увеличивается в соответствии с увеличением глубины инвазии. Опухолевые клетки в лимфатических сосудах и в кровеносных сосудах могут быть найдены в нескольких см за пределами основного роста опухоли. Карцинома, с инвазией в мышечный слой в дальнейшем может прорастать адвентицию и распространяться за ее пределы, с прорастанием в прилегающие органы или ткани, особенно трахею и бронхи, с формированием трахеои бронхоэзофагеальных свищей.
ПРП имеет разную микроскопическую структуру инвазии в зависимости от типа роста: «экспансивный рост» или «инфильтративный рост». Первый из них характеризуется обширным и равномерным фронтом инвазии с диссоциацией мелких или неопухолевых клеток, в то время как при инфильтративном варианте виден нерегулярный фронт инвазии и явная диссоциация опухолевых клеток.
Степень полиморфизма ядер, ороговения клеток, диспластической или воспалительной реакции стромы резко варьируют. Различают высокодифференцированный (ороговевающий) и низкодифференцированный (неороговевающий) ПРП.
Бородавчатый рак – редкий вариант плоскоклеточного рака, гистологически сопоставим с бородавчатыми карциномами других локализаций. Макроскопически имеет экзофитный, бородавчатый, по типу «цветной капусты» или папиллярный вид. Может локализоваться в любой части пищевода. Гистологически определяется как малигнизированная папиллярная опухоль, состоящая из хорошо дифференцированного и ороговевшего плоского эпителия с минимальной клеточной атипией, чаще с четкими, а не инфильтрированными краями. Бородавчатый рак пищевода растет медленно и локализовано, с очень низким метастатическим потенциалом.
Веретеноклеточный рак – нечастое злокачественное поражение определяется как плоскоклеточный рак с непостоянным саркомоподобным компонентом веретеноподобных клеток. Оно также известно под другими названиями – карциносаркома, псевдосаркоматозная плоскоклеточная карцинома и плоскоклеточный рак с веретеноклеточным компонентом. Макроскопически опухоль характеризуется полиповидным типом роста. Зрелые веретеноподобные клетки способны к созреванию, формированию костной ткани, хрящей и клеток скелетных мышц. В большинстве случаев постепенный переход между карциноматозным и саркоматозным компонентами выявляется на этапе обычной световой микроскопии. ИГХ и электронномикроскопические исследования показывают, что веретеноподобные саркоматозные клетки могут быть различной степени эпителиальной дифференцировки. Поэтому саркоматозный компонент может быть метапластическим.
Базалоидный рак – редкий вариант ПРП, идентичный базалоидному плоскоклеточному раку верхнего отдела дыхательного тракта. Представлен компактно расположенными клетками с гиперхромными ядрами и скудной базофильной цитоплазмой, картинами солидного роста, мелкими железистоподобными структурами и очагами комедоподобного некроза. Эта опухоль связана с ИЭН, инвазивным ПРП или островками плоскоклеточной дифференцировки среди базалоидных клеток. Базалоидный ПРП характеризуется высокой степенью апоптоза; прогноз аналогичен обычному ПРП. Градация степени злокачественности ПРП традиционно базируется на митотической активности, анизокариозе и степени дифференцировки клеток.
При высокодифференцированной опухоли клеточные и структурные признаки сходны с таковыми в нормальном плоском эпителии пищевода. Преобладают крупные дифференцированные ороговевающие плоские клетки. Наличие ороговения интерпретируют как признак высокой дифференцировки, хотя в норме плоский эпителий пищевода является неороговевающим. При низкодифференцированной опухоли преобладают клетки типа базальных с высокой митотической активностью. Умеренно-дифференцированные опухоли являются наиболее распространенным типом и составляют около двух третей всех ПРП. Однако, поскольку нет общепринятых критериев, значение различных параметров классификации относительное, классификация ПРП зависят от взгляда исследователя. При недифференцированном раке с помощью ультраструктурных и иммуногистохимических методов в части случаев обнаруживают признаки плоскоклеточной дифференцировки.
Аденокарцинома (АК) чаще локализована в нижней трети пищевода (развивается преимущественно в очагах цилиндроклеточной метаплазии при пищеводе Барретта), иногда опухоль ошибочно оценивают как АК кардиального отдела желудка. Очень редко АК локализована в средней и верхней трети пищевода, в последнем случае она возникает из врожденных островков эктопированного цилиндрического эпителия (10% случаев). Основными факторами прогноза при АК являются глубина инвазии стенки и наличие или отсутствие метастазов в удаленных лимфатических узлах. Для АК обычно характерен папиллярный и/или тубулярный рост; встречается слизистая АК пищевода
Железисто-плоскоклеточный рак – РП с компонентами высокодифференцированной АК со слизью и ороговевающего рака. Согласно гистологической классификации ВОЗ, при световой микроскопии второй компонент должен занимать >20% площади ткани опухоли. Двойная дифференцировка клеток опухоли может проявляться необычными сочетаниями: группы клеток цилиндрической формы с ацинарно-железистым расположением, но с плотной «сквамоидной» цитоплазмой; «жемчужины» со слизью; одиночные клетки с ядерно-цитоплазматической полярностью (железистая дифференцировка) и очень плотной цитоплазмой, даже кольцами ороговения.
Мукоэпидермоидный рак имеет двойную направленность дифференцировки: наличие плоских и секретирующих слизь клеток; кроме того, выявляют промежуточные клетки опухоли (гистологически опухоль аналогична мукоэпидермоидному раку слюнной железы). Макроскопически напоминает полип с гладкой поверхностью (высокодифференцированный вариант, обозначаемый как мукоэпидермоидная опухоль). Низкодифференцированный вариант опухоли (обозначаемый как мукоэпидермоидный рак) чаще имеет вид плотного белого экзофитного образования. Для опухоли характерен медленный местнодеструирующий рост; в зависимости от степени дифференцировки она может давать лимфогенные и гематогенные метастазы. Гистологически опухоль представлена солидными полями и пластами крупных полигональных клеток (напоминают шиповидный слой эпидермиса); видны небольшие ячейки клеток со слизью. Такие участки чередуются с многочисленными железистоподобными, иногда кистозно-растянутыми слизью полостями, выстланными кубическими, изредка цилиндрическими клетками, а также с пластами клеток промежуточного типа.
Аденокистозный рак – эпителиальная опухоль (старое название цилиндрома) характерного криброзного вида, гистологически идентичная раку слюнной железы. Считают, что опухоль происходит из миоэпителия. Одинаково часто обнаруживают у мужчин и женщин. Макроскопически опухоль имеет вид полипа, ткань плотная, белого или серо-розового цвета, достигает нескольких см в диаметре, характеризуется медленным ростом, склонностью к рецидивам и метастазам в регионарные лимфатические узлы; иногда возникают отдаленные метастазы. Гистологически характерны солидные поля, в которых мелкие округлые клетки с гиперхромными ядрами и скудной цитоплазмой формируют трубчатые структуры, напоминающие протоки без четкой базальной мембраны; некоторые «протоки» кистозно растянуты гиалиноподобными массами. Местами трубчатые структуры образованы клетками кубической и цилиндрической формы; видны многочисленные митозы; строма гиалинизирована.
Мелкоклеточный рак (низкодифференцированная эндокринная опухоль) – составляет около 0,05% случаев РП. Мелкоклеточный рак чаще встречается в возрасте 50-70 лет, локализуется в дистальной половине пищевода; проявляется грибовидным или изъязвленным образованием. При мелкоклеточном РП прогноз неблагоприятный, даже при небольшой первичной опухоли; обычно уже во время установления диагноза опухоль имеет метастазы. Временная ремиссия отмечена при химиотерапии; 5-летняя продолжительность жизни минимальная.
7. БИОПСИЯ ПРИ ЗАБОЛЕВАНИЯХ ЖЕЛУДКА.
7.1. Показания к биопсии из слизистой оболочки желудка
• Любое новообразование (рекомендуется брать биопсию не только из опухоли, но и из слизистой оболочки рядом с новообразованием).
• Любая язва желудка; по протоколу биопсия должна быть выполнена из дна и краев язвы.
• Рубцовые изменения.
• Эндоскопическая картина увеличенных желудочных складок для исключения лимфомы или диффузного рака желудка.
• Биопсия с целью выявления Helicobacter pylori (НР). Выполняется из СО антрального отдела и тела желудка.
• Для морфологического подтверждения типа гастрита (два фрагмента из антрума, два из тела желудка и один из угла желудка по малой кривизне).
7.2. Биопсия при некоторых заболеваниях желудка
7.2.1. Воспалительные заболевания желудка. Гастриты и гастропаты
Диагноз «гастрит» – диагноз морфологический и является гистологическим заключением, в то время как его эндоскопические характеристики – в противоположность эзофагиту и колиту – малозаметны или недостоверны. Диагноз ХГ выставляется только на основании результатов гистологического исследования. Корреляции между эндоскопической картиной (при использовании обычных видеоэндоскопов) и результатами гистологического исследования отсутствуют (Аруин,1998, Блок,2007). Соответственно для характеристики изменений СО желудка целесообразно использовать описательные термины (красная, застойная, узловатая и т.д.). Как исключение, в качестве эндоскопического диагноза приемлем термин «атрофия СО желудка», так как признаки атрофии с достаточной уверенностью могут быть определены эндоскопически.
Для характеристики некоторых типов диффузных изменений СО желудка, хорошо различаемых при эндоскопии, предпочтительно использовать термин ГАСТРОПАТИЯ (Маржатка, 1996). В последующих версиях Минимальной стандартной терминологии (МСТ 1.0, 2.0 и 3.0) это пояснение не подвергалось сомнению и подтверждалось авторами в виде включений данных терминов в раздел эндоскопических диагнозов.
Согласно МСТ 3.0 могут быть выставлены следующие эндоскопические диагнозы (согласно принятым нормам в России – эндоскопические заключения): гастропатия геморрагическая, гастропатия гипертрофическая, гастропатия застойная, гастропатия папулезная, гастропатия при портальной гипертензии, гастропатия эритематозная, гастропатия эрозивная.
Различают две основные формы гастрита – острый и хронический.
7.2.1.1. Острые гастриты
Острый гастрит – острое воспаление СО желудка, вызванное непродолжительным действием сильных раздражителей. Причинами острого гастрита могут стать чрезмерный прием алкоголя; употребление (случайно или преднамеренно) кислот, щелочей и других токсических веществ; употребление некоторых лекарств, в частности – НПВП; пищевое отравление; как осложнение тяжелых заболеваний, например, печеночной или почечной недостаточности, травм, ожогов, операций; некоторые инфекции – цитомегаловирусная, стафилококковая и др.; тяжелое радиационное поражение.
В зависимости от характера повреждения СО желудка и особенностей клинической картины различают катаральный, фибринозный, коррозивный и флегмонозный острые гастриты.
· Катаральный гастрит (простой, отечный, банальный гастрит) – острый гастрит, характеризующийся инфильтрацией лейкоцитов СО, воспалительной гиперемией, дистрофическими изменениями эпителия. Основная причина – пищевые интоксикации. СО желудка утолщена, отечная, полнокровная, покрыта большим количеством вязкой слизи, на поверхности ее – мелкоточечные кровоизлияния и эрозии. Иногда эрозии многочисленные, сливающиеся. В этих случаях говорят об остром эрозивном гастрите. Гастроскопия и биопсия при данном поражении, по разным причинам, выполняется редко. Микроскопические изменения: дистрофия, некробиоз и слущивание эпителия. СО пронизана серозным, серозно-слизистым или серознолейкоцитарным экссудатом. В собственном слое – полнокровие, отек, нейтрофильная инфильтрация. Железы изменяются незначительно, их секреторная деятельность подавлена.
· Фибринозный гастрит (дифтеритический гастрит) – острый гастрит, характеризующийся некротическими изменениями СО, пропитыванием зоны некроза фибринозно-гнойным экссудатом с формированием на поверхности слизистой оболочки пленки. Если некроз поверхностный, то пленка рыхло соединена с подлежащими тканями, легко снимается. Иногда развивается глубокий некроз, фибрин проникает на всю его глубину, пленка прочно фиксирована к подлежащим тканям. При удалении ее обнажаются многочисленные язвенные дефекты. Развивается при тяжелых инфекционных заболеваниях, при отравлениях сулемой, кислотами. Биопсия противопоказана.
· Коррозивный гастрит (некротический гастрит, токсико-химический
гастрит) – острый гастрит с некротическими изменениями тканей, развивающийся в результате попадания в желудок концентрированных кислот (при этом развивается коагуляционный некроз) или щелочей (колликвационный некроз), солей тяжелых металлов. Разрушается не только СО, но и глубже расположенные слои стенки, образуя многочисленные эрозии, острые, чаще перфоративные язвы. Биопсия противопоказана.
· Флегмонозный гастрит – острый гастрит с гнойным расплавлением стенки желудка и преимущественным распространением гноя по подслизистому слою. Возникает при травмах и как осложнение язвенной болезни, рака желудка, некоторых инфекционных болезней. Основным условием развития являются нарушение целостности слизистой оболочки, и переход воспаления на все слои стенки желудка. Биопсия противопоказана. Микроскопические изменения при гнойных гастритах: отек, полнокровие, кровоизлияния, массивная нейтрофильная инфильтрация с колонизацией бактериями подслизистого слоя; СО может быть интактной.
7.2.1.2. Хронические гастриты. Современная классификация
Хронический гастрит (ХГ) – длительно текущее рецидивирующее воспалительное поражение СО желудка, протекающее с её структурной перестройкой и нарушением секреторной (кислотои пепсинообразующей), моторной и инкреторной (синтез гастроинтестинальных гормонов) функций желудка, обусловленное действием как внешних (экзогенных), так и внутренних (эндогенных) факторов.
Новейшая история классификации ХГ берет начало с Сиднейской системы, которая была принята в 1990г. на Международном конгрессе гастроэнтерологов в Сиднее. Согласно этой классификации (см. приложения) выделяют три основных вида гастрита: острый, хронический и особые (специальные) формы. Решающее значение в диагностике гастритов придается этиологии, характеру морфологических изменений СО и преимущественной локализации этих изменений.
В 1994 г. в Хьюстоне был осуществлен пересмотр Сиднейской классификации и принята Модифицированная Сиднейская система – Хьюстонская классификация хронических гастритов (см. приложения). Были уточнены определения для характеристики основных изменений СО желудка, восстановлены исключенные из Сиднейской системы термины "неатрофический (или бывший поверхностный) гастрит" и "атрофический гастрит". Важной составляющей Модифицированной Сиднейской системы явилась визуальноаналоговая шкала, в которой указываются критерии оценки выраженности патологических изменений в СО желудка.
В 2005г. M.Rugge и R.M.Genta предложили использовать для классификации гастритов (АГ) систему оценки степени и стадии атрофического гастрита. Под степенью гастрита понималась выраженность суммарной воспалительной инфильтрации (нейтрофильными лейкоцитами и мононуклеарными клетками), под стадией – выраженность атрофии. Такая система должна была дать достаточно полную характеристику АГ и отразить его динамику: от обратимого воспаления на одном полюсе, до выраженной атрофии, ассоциированной с повышенным риском РЖ, – на другом. Для разработки системы оценки стадий АГ в 2005г. была образована международная группа, которая произвела критический пересмотр Модифицированной Сиднейской системы. Система определения стадий гастрита получила название OLGA – Operative Link for Gastritis Assessment. В ней применяется оценка гистологической выраженности атрофии и воспаления в антральном отделе (3 биоптата) и в теле желудка (2 биоптата) с последующим определением интегральных показателей – стадии и степени ХГ. Имеется в виду, что риск РЖ тем выше, чем выраженнее атрофия и чем больше объем поражения.
В 2008г. для определения стадий АГ группа OLGA предложила собственную визуально-аналоговую шкалу определения стадии атрофии СО желудка (Аруин, 2009). Если при биопсии найдена III – IV стадия, такого больного следует включить в группу риска РЖ. Принципиально важным для практического использования является прогнозирование риска развития РЖ, возможное на основании оценки лишь атрофических изменений СО, то есть еще до появления признаков эпителиальной неоплазии. Система может быть использована при эпидемиологических исследованиях, с помощью нее можно судить о динамике гастрита, в том числе под влиянием разных методов лечения и о корреляции с неинвазивными методами диагностики гастрита.
Гастроскопия относится к основным методам диагностики ХГ. Эндоскопически часто удается выявить ту или иную форму – поверхностный, атрофический, гипертрофический; определить распространенность процесса; стадию заболевания – обострение, ремиссия. Но, как было уже сказано выше, визуальная оценка состояния СО желудка не всегда совпадает с данными гистологического исследования ее биоптатов. И наиболее точная диагностика той или иной формы ХГ возможна только при гистологическом исследовании биоптатов. Оценивается толщина СО и глубина желез, число митозов и средний диаметр ядер, выраженность отека СО и ее клеточной инфильтрации, наличие метаплазии эпителия и т.д. Биопсия при диагностике ХГ обязательна, за исключением гастропатии при портальной гипертензии. Техника выполнения – два фрагмента из антрума по большой и малой кривизне, один из угла и два фрагмента из тела желудка по большой и малой кривизне. В некоторых рекомендациях биопсию рекомендуется брать вне большой и малой кривизны, особенно для диагностики инфекции НР, но в большинстве – именно с большой и малой кривизны, где имеется больший риск канцерогенной трансформации.
7.2.1.2.1. Неатрофический хронический гастрит. Воспалительная инфильтрация при этом типе гастрита располагается преимущественно в зоне ямок. Микроскопические изменения: лимфоплазмоклеточная инфильтрация, изредка с образованием лимфоидных фолликулов; в инфильтрате могут присутствовать эозинофильные и нейтрофильные лейкоциты; в цитоплазме эпителиальных клеток может снижаться содержание муцина, в них выявляются реактивные изменения – увеличение размеров ядер, размеров и количества ядрышек. В эпителии антральных желез или ямок могут выявляться субнуклеарные вакуоли – дистрофические изменения в ответ на повреждение.
Эндоскопическая картина зависит от степени инвазии Н.pylori (НР) и активности процесса. К специфическим признакам НР-инфекции можно отнести, наличие язв в желудке и, особенно, в ДПК, множественных разнокалиберных выбуханий на стенках СО антрального отдела желудка, гиперемию СО, наличие мутной слизи в просвете желудка, отек и утолщение складок антрального отдела желудка. Чувствительность и специфичность отдельных признаков может быть различной. Наиболее достоверными являются язвы луковицы ДПК (чувствительность и специфичность 100%) и наличие разнокалиберных выбуханий на стенках антрального отдела желудка (чувствительность 93%, специфичность 96%) (П.Л. Щербаков, 2002). Эти выбухания в антральном отделе бывают столь выраженными, что получили название «нодулярного гастрита». При высокой степени обсемененности СО Н.pylori и значительной активности процесса эндоскопически будут определяться несколько признаков: гиперемия СО, мутная слизь в желудке и выраженные выбухания на стенках СО. По мере стихания активности процесса и уменьшении степени инвазии выраженность эндоскопических признаков НРинфекции будет уменьшаться. При этом в первую очередь, содержимое желудка становится прозрачным и гиперемия СО значительно уменьшается. Медленнее других исчезают выбухания слизистой оболочки. Биопсия обязательна, по стандартной схеме – 2 кусочка с антрума, 1 с угла и 2 с тела желудка. Микроскопические изменения: извитые, спиралевидные палочки выявляются на поверхности слизи, вдоль микроворсинок эпителиальных клеток, не наблюдается инвазии. Бактерии обычно не встречаются в зоне кишечной метаплазии. В собственной пластинке СО хроническая лимфоплазмоклеточная инфильтрация с образованием лимфоидных фолликулов, часто регистрируется также нейтрофильная инфильтрация желез и поверхностного эпителия. Характерны реактивные (регенераторные) изменения эпителиальных клеток: укрупнение, гиперхромия ядер, уменьшение размеров, вакуолизация цитоплазмы, частые митозы.
7.2.1.2.2. Атрофический хронический гастрит (аутоиммунный, мультифокальный)
При таком варианте наблюдается атрофия желез (слабая, умеренная, выраженная) – частое явление при НР – ассоциированном и аутоиммунном гастритах. Первоначально железы уменьшаются в размерах, затем разрушаются; исчезают и условия для роста бактерий. Характерно появление метапластических изменений в СО антрального отдела, в теле и дне желудка. Кишечная метаплазия считается выраженной, если на зону метапластической перестройки приходится не менее 25% площади биоптата. Степени атрофических и метапластических изменений коррелируют между собой. В эпителии могут развиться диспластические изменения, прогрессирующие до рака. Хронические атрофические гастриты в свою очередь делятся на аутоиммунные и мультифокальные.
Аутоиммунный атрофический гастрит характеризуется очаговым или диффузным АГ тела желудка и неизмененной СО или поверхностным гастритом (НР-негативным) антрального отдела желудка (Ивашкин В.Т., 2002). У этой группы больных определяются: аутоантитела типа IgG к париетальным клеткам; аутоантитела типа IgG к ферменту К/Na-АТФазе в париетальной клетке с развитием умеренной или выраженной секреторной недостаточности; аутоантитела типа IgG к внутреннему фактору Кастла с развитием через 5-6 лет гиперхромной В-12-дефицитной анемии, к которой через 5-6 лет при отсутствии лечения анемии присоединяется фуникулярный миелоз спинного мозга с развитием пернициозной злокачественной анемии; гипопепсиногенемия I, гипергастринемия с последующей гиперплазией антральных G-клеток (Шамгунова Б.А. 2001). Эти изменения могут служить основой для развития РЖ (в условиях анацидности желудок заселяется кишечными бактериями, которые переводят нитраты в нитриты ─ потенциальные канцерогены первого порядка), возникает "диффузная" форма РЖ.
Мультифокальный атрофический гастрит характеризуется наличием множественных очагов атрофии СО в антруме, теле. При прогрессировании процесса атрофия может затрагивать всю поверхность желудка с развитием атрофического пангастрита. При мультифокальном АГ бактерия хеликобактер обнаруживается не всегда, в частности в выраженных очагах атрофии СО она, как правило, отсутствует. Изменения СОЖ в виде выраженной атрофии, метаплазии и последующей неоплазии (дисплазии) могут служить основой для развития "кишечной" формы РЖ (Ивашкин В.Т., 2002).
Эндоскопическими признаками атрофического гастрита является наличие мелкопятнистой СО, с чередованием углубленных серо-белых участков с нормальными и гиперплазированными желудочными полями розовокрасного цвета. Сосудистый рисунок резко выражен. На СО могут быть множественные приподнятые белесоватые очаги с иной (ворсинчатой) структурой поверхности кишечная метаплазия. Складки обычно сглажены.
7.2.1.2.3. Особые формы хронических гастритов
· Химический гастрит – в данную группу заболеваний включены достаточно разнородные виды гастритов, которые имеют различные особенности течения и подходы к лечению, но объединены одним патогенетическим механизмом развития – воздействием на СО желудка химических веществ, повреждающих желудочный эпителий. Выделяют реактивный рефлюксгастрит, этиология его – заброс желчи; гастрит, ассоциированный с приемом нестероидных противовоспалительных препаратов (НПВП).
Рефлюкс-гастрит рассматривается как своеобразная форма гастрита, связанного с выбросом содержимого ДПК в желудок, что приводит к повреждению его СО. «Истинный» рефлюкс-гастрит развивается только у больных, перенесших резекцию желудка. Причиной повреждения фундальной слизистой вблизи гастродуоденального анастомоза является воздействие желчных кислот. Рефлюкс-гастрит можно предполагать у больного на основании следующих критериев: обнаружения гиперемии культи желудка, отека и яркой гиперемии СО области анастомоза на фоне рефлюкса кишечного содержимого в культю желудка. Однако окончательный диагноз ставится морфологом. Морфологически в 94% выявляется локальный атрофический гастрит, может быть повреждение СО с образованием углубленных поражений. Часто видна резкая граница с зоной «банального» гастрита культи желудка, который имеет признаки (НР-позитивного) гастрита. Данный тип гастрита развивается в ранние сроки после операции, а спустя год, среди этой категории больных начинают проявляться признаки атрофического гастрита (Аруин Л.И.,1998).
Морфологическая картина, наблюдаемая при гистологическом исследовании биоптатов СО желудка, при НПВП-индуцированных гастропатиях неспецифична. Хотя НПВП могут вызывать своеобразные изменения СО (НПВП-индуцированный гастрит), сходные с гистологической картиной «химического» гастрита, у большинства больных эта патология маскируется гистологическими проявлениями хронического антрального гастрита, ассоциированного с H. pylori. В то же время, при НПВП-индуцированных гастропатиях язвы и множественные эрозии могут определяться на фоне минимально выраженных изменений СО, в отличие от H. pylori-ассоциированной язвенной болезни, при которой характерным фоном язвы является хронический активный гастрит (Карасёва Г. А., 2012).
Эндоскопическими признаками гастрита, ассоциированного с приемом НПВП являются: наличие гиперемии, отека, петехий, множественных углубленных дефектов слизистой оболочки и отсутствием характерного для язвенной болезни периульцерозного вала. Как правило, в биоптатах отсутствует H.Pylori. Данные изменения чаще в антруме, реже в теле (Аруин Л.И., 1998).
Возможные микроскопические изменения: выраженная гиперплазия (удлинение) ямок, фиброзно-мышечная гиперплазия собственной пластинки, отек собственной пластинки, дилатация и полнокровие капилляров поверхностных отделов СО, слабая мононуклеарная и гранулоцитарная инфильтрация собственной пластинки, отсутствие признаков поражения желез, вакуолизация цитоплазмы клеток покровно-ямочного эпителия. Фовеолярная гиперплазия сопровождается удлинением желудочных ямок с приобретением ими спиралевидной формы, исчезновением внутрицитоплазматической слизи, увеличением размеров и гиперхромией ядер выстилающих эпителиальных клеток.
· Радиационный гастрит – поражение гастродуоденальной зоны, развившееся в результате проведения лучевой терапии. Последствия и патологические изменения органов, связанные с облучением, могут манифестировать через 6 мес. после начала лечения, а могут возникнуть спустя много лет. Морфологически острый радиационный гастрит проявляется гиперемией, отеком СО, десквамацией эпителиальных клеток, острым эрозивно-язвенным повреждением. Хроническое лучевое поражение желудка характеризуется некрозами стенки желудка, глубокими пенетрирующими язвами, которые часто являются причиной желудочно-кишечного кровотечения. Для радиационного повреждения также характерен фиброз подслизистого слоя желудка с образованием стеноза выходного отдела желудка.
· Эозинофильный гастрит – редкое заболевание, сопровождающееся возникновением эозинофильных инфильтратов в слизистой оболочке желудочно-кишечного тракта, с минимальным вовлечением других органов и систем (сердце, легкие). Диагноз «эозинофильный гастрит» подразумевает исключение паразитарной этиологии заболевания, системных заболеваний соединительной ткани, злокачественных новообразований. Этиология возникновения данной формы гастроэнтерита до конца не выяснена. В качестве пусковых механизмов рассматривается пищевая или лекарственная аллергия. Как правило, особенно у детей, эозинофильные гастроэнтериты возникают в результате пищевой аллергии к молоку, соевым белкам, куриному яйцу, морепродуктам. В основе развития данного заболевания лежат IgEопосредованные иммунологические реакции, в результате которых происходит повреждение тканей и инфильтрация СО желудка эозинофилами. Этот тип гастрита часто ассоциируется с другими заболеваниями аллергической природы – атопическим дерматитом, экземой, псориазом, аллергическим риносинуситом, бронхиальной астмой.
Для постановки диагноза необходимо выявление патологического эозинофильного инфильтрата в СО желудка. Помимо эозинофильной инфильтрации, обнаруживают инфильтрацию полиморфноядерными лейкоцитами, лимфоцитами, макрофагами, IgE и плазматическими клетками. Микроскопические изменения: диффузная, полосовидная мономорфная эозинофильная инфильтрация, которая может быть трансмуральной; различной степени отек, некротизирующий ангиит.
· Лимфоцитарный гастрит – редкая форма хронического гастрита неустановленной этиологии, имеющая характерные морфологические проявления в виде скопления цитотоксических интраэпителиальных CD3+, CD8+ Т-лимфоцитов в покровно-ямочном эпителии СО желудка, отличающаяся неспецифическими эндоскопическими и клиническими проявлениями. В структуре всех гастритов эта форма составляет 1,5-4,5%. Возраст пациентов может быть крайне вариабельным. Лимфоцитарный гастрит чаще встречается у женщин. При эндоскопическом исследовании с биопсией лимфоцитарный гастрит находят у 1-4% пациентов с диспепсическими жалобами. Существуют различные гипотезы, которые пытаются объяснить патогенез хронического лимфоцитарного гастрита. Согласно одной из них лимфоцитарный гастрит развивается на фоне непереносимости глютена и некоторых лекарственных средств (например, тиклопидина). В развитии лимфоцитарного гастрита принимают участие идиопатические аутоиммунные механизмы. Сходство гистологической картины лимфоцитарного гастрита с целиакией дает основание предполагать развитие данной формы гастрита в результате воздействия внутрипросветных антигенов. Согласно другой теории лимфоцитарный гастрит является одной из форм HР-ассоциированного гастрита.
Лимфоцитарный гастрит диагностируют при гастроскопии и гистологическом исследовании биоптатов СО желудка. Лимфоцитарный гастрит имеет характерную локализацию. Это, как правило, пангастрит, который наблюдается у 80% пациентов, фундальный гастрит бывает реже, а изолированный антральный гастрит практически не встречается. Хронический лимфоцитарный гастрит может протекать с острыми или хроническими эрозиями. Эндоскопическая картина при лимфоцитарном гастрите характеризуется хроническими эрозиями с кратерообразной зоной некроза на вершине эрозии (вариолиформный гастрит) – чаще на фоне диффузного поверхностного гастрита. Нередко наблюдаются утолщенные складки СО желудка. При лимфоцитарном гастрите наблюдается выраженная лимфоцитарная инфильтрация желудочного эпителия, утолщение складок эпителия, могут обнаруживаться узелки (лимфоидные фолликулы), эрозии. Особенностью данной формы гастрита является массивная (более 30 лимфоцитов на 100 эпителиальных клеток) инфильтрация поверхностного и ямочного эпителия, а также собственной пластинки Т-лимфоцитами. Воспалительный лимфоплазмоцитарный инфильтрат в собственной пластинке СО выражен в разной степени. Неспецифические эрозии с фибрином и относительно небольшой полиморфноядерной инфильтрацией.
· Гранулематозный гастрит – достаточно редкая находка. Это морфологический диагноз, который подразумевает наличие гранулемы в биоптате СО желудка. Спектр заболеваний, при которых может быть обнаружена гранулема, достаточно широк. Так называемые неинфекционные гранулемы могут наблюдаться при болезни Крона, саркоидозе, гранулематозе Вегенера, инородных телах, могут быть идиопатическими. Гранулематозный гастрит может наблюдаться при инфекционных заболеваниях, таких как туберкулез, сифилис, грибковые поражения желудка. Микроскопические изменения: апоптоз эпителиальных клеток, деструкция желез, рассеянная воспалительноклеточная инфильтрация, гранулярный эозинофильный детрит в просветах расширенных желез ("лопнувшие" криптальные клетки – симптом с 94% специфичностью, 41% чувствительностью).
Поражение желудка болезнью Крона характеризуется гранулематозными изменениями, изъязвлениями, утолщением стенки и сужением просвета пораженного отдела, образованием инфильтратов и свищей. Эндоскопические критерии: регионарное (прерывистое) поражение СО; булыжная мостовая; линейные язвы (язвы-трещины); афты; стриктуры (возможно); устья свищей (возможно). Биопсия обязательна, производится с мест поражения СО, не менее 6 кусочков. Морфологические критерии: саркоидные гранулемы (обнаруживаются обычно в стенке резецированного участка и только в 10–14 % случаев – в биоптатах СО); глубокие щелевидные язвы, проникающие в подслизистую основу или мышечный слой; трансмуральная воспалительная инфильтрация; регионарное поражение (по макропрепарату резецированного участка).
· Другие инфекционные гастриты – кроме НР, хроническое воспаление в желудке могут вызывать другие инфекционные агенты – вирусы, грибы, паразиты. Это достаточно редкая патология, которая наблюдается у пациентов с иммунодефицитом, при проведении иммуносупрессивной терапии.
Сифилис желудка – часто является манифестацией третичного сифилиса желудочно-кишечного тракта. Поражение чаще возникает в антральном отделе, реже – в теле желудка. Возможны различные макроскопические варианты сифилитического поражения желудка – в виде диффузной инфильтрации, вплоть до «сморщивания» его стенок (при третичном сифилисе); одного или нескольких, в том числе множественных, различных по величине изъязвлений (поверхностных и глубоких), нередко неправильной формы, в ряде случаев напоминающих изъязвленную опухоль. Иногда выявляется сужение антрального отдела желудка с отсутствием перистальтики, множественные поверхностные изъязвления, преимущественно антрального отдела и дистальной части тела желудка. Подобные морфологические изменения могут ошибочно рассматриваться как скирр желудка. СО в этой области отечна, инфильтрирована, умеренно ригидна, легкоранима; позднее ригидность усиливается. В отличие от доброкачественных язв желудка и луковицы ДПК изъязвления желудка при раннем сифилисе не имеют четких границ. Биопсия обязательна. При патоморфологической оценке материалов прицельных гастробиопсий сифилис желудка может быть расценен как доброкачественная язва желудка, лимфома, ретикулез, рак или лимфоплазмоцитарная изъязвленная лимфосаркома желудка.
Туберкулез желудка – в структуре туберкулеза ЖКТ преобладает туберкулез кишечника, а специфическое воспаление гастродуоденальной зоны развивается в 15,5% случаев гастроинтестинального туберкулеза. Считается, что туберкулез желудка, как правило, развивается в терминальной стадии туберкулеза легких и обусловлен спутогенным распространением инфекции. В единичных наблюдениях описывается изолированный туберкулезный гастрит. Туберкулезный дуоденит протекает в сочетанных и полиорганных специфических поражениях. Изолированный туберкулез желудка и туберкулез двенадцатиперстной кишки развиваются вследствие лимфогематогенного распространения инфекции из очагов, локализованных в органах брюшной полости, чаще всего в абдоминальном лимфатическом аппарате. По данным литературы, туберкулез желудка встречается в основном в язвенной форме, поражается преимущественно малая кривизна желудка и привратник. Описаны гиперпластическая форма туберкулезного гастрита, а также узелково-язвенная, инфильтративно-склеротическая и рубцовосклеротическая формы туберкулезного дуоденита. Дифференциальная диагностика с язвенной болезнью, симптоматическими эрозивно-язвенными гастродуоденальными заболеваниями, раком желудка, кандидозом и канцероматозом гастродуоденальной зоны. Следует отметить, что неспецифические гастроэнтерологические заболевания, чаще всего хронический гастрит/гастродуоденит, язвенная болезнь, сопутствуют абдоминальному туберкулезу в каждом втором (50,5%) случае. Диагностика туберкулезного гастрита и дуоденита основывается на клинических, эндоскопических, гистологических и микробиологических параметрах. В связи с редкостью данной патологии нет четкого представления о типичных проявлениях заболевания. При проведении гастроскопии выявляется инфильтрация, отек, изъязвления, множественные узелки на СО желудка и ДПК, рубцовые стенозы дуоденальной локализации. Каждая вторая туберкулезная гастральная язва осложняется ее перфорацией или желудочно-кишечным кровотечением, нередко с летальным исходом. Выявление в СО эпителиоидно-клеточных гранулем с клетками Пирогова-Лангханса и казеозным некрозом позволяет выставить диагноз туберкулезного гастрита и дуоденита. Возможно применение микробиологического исследования для обнаружения микобактерий туберкулеза.
Цитомегаловирусный гастрит – развивается при иммунодефицитных состояниях, иногда после пересадки костного мозга. Может сопровождаться перфорацией с образованием свища. Микроскопические изменения: эозинофильные внутриядерные включения, разнообразные пурпурные внутрицитоплазматические включения; в тяжелых случаях образуются изъязвления, кровоизлияния и перфорация.
Также возможны поражения желудка при других редких инфекционных заболеваниях – сибирской язве (макроскопические изменения: интенсивный острый геморрагический гастрит с некрозом); криптоспоридиозе (представляет собой протозойную инвазию, микроскопические изменения: округлые базофильные микроорганизмы размером 2-4 мкм прикреплены к поверхностному эпителию); гастрите, вызванном вирусом ЭпштейнаБарра (является осложнением инфекционного мононуклеоза; обычно – самопроходящий клинический синдром; желудочно-кишечные осложнения развиваются редко. Описано наблюдение тяжелой формы, сопровождавшееся диффузной лимфоидной гиперплазией, симулировавшей лимфому); гастрите, обусловленный вирусом герпеса (микроскопические изменения: базофильные округлые стекловидные включения в эпителиальных клетках); коревом гастрите (сопровождается кровотечением из верхних отделов ЖКТ. При эндоскопическом исследовании выявляется эрозивный гастрит или язвы с приподнятыми, бугристыми краями. Микроскопические изменения: выраженный гастрит с плотной плазмоцитарной инфильтрацией, варьирующим количеством нейтрофильных лейкоцитов и лимфоцитов, крупными, неправильными внутрицитоплазматическими включениями, группами гигантских многоядерных клеток в составе поверхностного эпителия и в собственной пластинке, васкулит без пролиферативной стадии); при подавлении иммунной системы и общем ослаблении организма возможно развитие грибкового гастрита, наиболее частым возбудителем которого являются представители рода Candida, Histoplasma, Mucor.
· Гипертрофическая гастропатия – этиологическими факторами могут являться: хроническая интоксикация (свинцом, алкоголем), алиментарные погрешности, недостаточное употребление витаминов, курение, перенесенные инфекционные заболевания (брюшной тиф, вирусный гепатит, шигеллез), нейрогенные и наследственные факторы, метаболические нарушения, пищевая аллергия. Одним из вариантов развития гастропатии, сопровождающейся гиперплазией СО желудка, является гиперпластическая и гиперсекреторная гастропатия при синдроме Золлингера-Элисона. Но наиболее грозным заболеванием, которое сопровождается гипертрофией складок СО желудка, является болезнь Менетрие. Гигантская гипертрофическая гастропатия, или болезнь Менетрие, характеризуется увеличением складок до огромных размеров, напоминающих мозговые извилины, покрытые густой слизью. Это достаточно редкое заболевание, сопровождающееся нарушением белкового обмена и развитием железодефицитной анемии. Среди механизмов, запускающих каскад иммунологических реакций при развитии болезни Менетрие, рассматриваются генетические, аллергические или инфекционные факторы. Диагностика основана на проведении рентгенологического и эндоскопического обследования. Биопсия не имеет большого диагностического значения при болезни Менетрие, поскольку она позволяет получить материал лишь из самого поверхностного участка СО, тогда как ее измененные железы в биоптат обычно не попадают. При гистологическом исследовании желудочных биоптатов при гипертрофическом гастрите обнаруживается резкое утолщение СО желудка, удлинение и расширение желудочных ямок, заполненных слизью. В эпителиальном слое находят признаки трансформации в кишечный эпителий, кисты. Могут обнаруживаться геморрагии и эрозии. Характерно отсутствие париетальных и главных клеток.
7.2.2. Системные и редкие поражения желудка
· Амилоидоз желудка – встречается у 70% больных первичным и вторичным амилоидозом. Клинически проявляется дисфагией, кровотечениями, нарушениями моторики и формированием кровоизлияний. Амилоидоз может приводить к нарушениям эвакуации из желудка вплоть до развития пареза. Амилоид при этом может откладываться во всех оболочках стенки или образовывать ограниченные скопления в подслизистой основе, имеющие вид опухоли и называемые амилоидомами. Очень редко встречается изолированный опухолевидный амилоидоз желудка, амилоидная опухоль желудка. Опухолевидное образование может локализоваться на малой или большой кривизне, достигать значительных размеров, ошибочно принимается за карциному. Опухоль обычно мягкой консистенции, неправильной формы. Изредка при амилоидозе возникает гастрит с инфильтративными изменениями и утолщением складок слизистой оболочки. Преимущественное отложение амилоида в стенках сосудов приводит к ишемии и очаговым некрозам, что нередко заканчивается желудочным кровотечением. Диагноз амилоидоза должен быть подтвержден при биопсии. Наиболее безопасными и информативными органами для производства биопсии являются язык (100% информативности), СО тонкой кишки (100%), десны (93%), СО толстой кишки (СО прямой кишки в 75-85% случаев вовлекается в процесс генерализованного амилоидоза), мышцы, кожа. Диагноз подтверждается гистологическим исследованием биоптата, со специфическими гистологическими окрасками на амилоид (либо поляризационной микроскопией).
· Гиалиноз желудка – встречается очень редко, обычно у больных, подвергшихся радиои химиотерапии. Почти вся стенка желудка (за исключением пилорического отдела) при гиалинозе утолщена и уплотнена. При гистологическом исследовании обнаруживают выраженный гиалиноз подслизистой основы, признаки воспаления отсутствуют. СО в таких участках атрофирована.
7.2.3. Морфологическая диагностика воспалительных заболеваний желудка
Для морфологической верификации воспалительных заболеваний желудка необходим забор материала (5 биоптатов) из следующих участков:
1) два кусочка из антрального отдела (3 см от привратника, по большой и по малой кривизне);
2) одной – из области угла желудка;
3) два кусочка из тела желудка (по малой кривизне на 4 см проксимальнее угла желудка, и из середины большой кривизны тела желудка).
Биопсийные фрагменты должны содержать всю толщу СО желудка вместе с гладкомышечной пластинкой. Высота СО желудка обычно не превышает 1 – 1,5 мм, что и определяет размер применяемых биопсийных щипцов. При гипертрофической гастропатии толщина СО желудка более высокая, биопсийные щипцы должны быть крупнее.
Флаконы должны быть заранее промаркированы – на них наносится порядковый номер флакона и номер (фамилия) пациента. В протоколе эндоскопического исследования и в направлении в морфологическую лабораторию уточняется, какому порядковому номеру флакона соответствует то или иное место забора кусочков.
АЛГОРИТМ МИКРОСКОПИЧЕСКОГО ИССЛЕДОВАНИЯ ГАСТРОБИОПТАТА
А. Определение принадлежности биопсийного фрагмента СО к тому или иному отделу желудка.
Б. Уточнение соответствия исследуемого фрагмента нормальному или патологически измененному строению СО желудка.
В. Определение распространенности патологических изменений в СО, т.е. уточнение, носит ли процесс ограниченный или диффузный характер (например, изменения затрагивают поверхностный эпителий, железистый компонент или строму, либо все три).
Г. Характеристика воспаления а. Тип:
б. острое (преобладают циркуляторные нарушения в сочетании с интенсивной инфильтрацией нейтрофильными лейкоцитами);
в. хроническое неактивное (сопровождается мононуклеарной, преимущественно лимфоплазмоклеточной и макрофагальной воспалительноклеточной инфильтрацией);
г. хроническое активное (наряду с мононуклеарной имеет место гранулоцитарная инфильтрация нейтрофильными, эозинофильными, базофильными лейкоцитами).
д. Локализация клеток воспалительного инфильтрата (поверхностный эпителий, эпителий ямок и желез, строма):
характеристика деструктивных изменений в СО желудка (дефект в пределах толщи собственной пластинки (эрозия): имеется или отсутствует; его вариант: эрозия острая – неполная, хроническая – полная).
Д. Определение соотношения стромы и железистого компонента: а. нормальное;
б. нарушенное за счет фиброза, атрофии желез, повышенной клеточности.
Е. Выявление гипертрофии СО за счет: а. удлинения (с извитостью) ямок; б. гипертрофии желез;
в. воспалительноклеточной инфильтрации собственной пластинки.
Ж. Характеристика строения желез – уточняется, располагаются ли железы параллельно друг к другу (ветвление и неравномерность распределения желез характерны для химического гастрита и болезни Менетрие).
З. Определение характера метапластической перестройки СО желудка (псевдопилорической, полной (тонкокишечной) и неполной (толстокишечной)).
И. Характеристика регенераторных и/или диспластических изменений с уточнением варианта последних (дисплазия легкая, тяжелая, неопределенная, глобоидная).
К. Характеристика кровеносных сосудов – сосуды нормального вида или патологически измененные (патологические изменения сосудов заключаются в эктазии (при химико-токсическом гастрите), тромбозе, утолщении стенок, атипических изменениях, опухолевой инвазии).
Л. Характеристика инфекционных агентов – обсемененность бактериями, грибами, наличие вирусных включений в клетках или вирустрансформированных клеток.
ТРЕБОВАНИЯ ПО ОФОРМЛЕНИЮ ПРОТОКОЛА (ЗАКЛЮЧЕНИЯ) ГИСТОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
А.Информация, представляемая врачом-эндоскопистом:
возраст и пол больного;
ведущие клинические симптомы;
предварительный клинический диагноз;
результаты эндоскопического исследования;
место забора (во флакон под каким номером помещено то или иное количество кусочков, взятых с того или иного участка);
сведения об употреблении лекарств (например, НПВП);
сведения о (пернициозной) анемии;
сведения о результатах бактериологического, вирусологического, серологического исследований (уреазные тесты, выявление в фекалиях антигена H. pylori, в сыворотке крови – антител к H. pylori, париетальным клеткам, внутреннему фактору и т.п.);
сведения о наличии иммуносупрессивного состояния (при наличии признаков иммунодефицита патологоанатом должен тщательно исследовать биоптат для исключения инфекции (например, цитомегаловирусной);
сведения о перенесенной хирургической операции;
семейный (наследственный) анамнез по раку желудка или аденоматозному полипозу;
результаты предыдущих биопсийных исследований заболеваний желудка (где, когда, под каким присвоенным номером проводились, каков результат).
Б. Требования по оформлению морфологической части протокола патогистологического исследования желудочного биоптата:
1. Макрои микроскопическая оценка и описание биоптатов СО желудка из разных отделов желудка осуществляются раздельно.
2. Микроскопическое исследование должно быть направлено на выявление и подробную характеристику выявленных отклонений от нормального гистологического строения исследуемого фрагмента СО того или иного отдела желудка: состав, плотность и локализация воспалительноклеточной инфильтрации, повреждение, перестройка эпителиальных структур (изменение функциональных свойств, дистрофические, атрофические, метапластические, диспластические изменения), нарушение целостности СО.
3. Заключение должно включать: а. этиологию (если известна);
б. топографию (антрум-гастрит, гастрит тела, мультифокальный гастрит, пангастрит);
в. морфологию (включая переменные и, при наличии, деструктивные изменения).
4. Переменные признаки (подлежат градации с применением визуально-аналоговой шкалы Модифицированной Сиднейской классификации гастрита):
а. хроническое воспаление (повышенная мононуклеарная воспалительно-клеточная инфильтрация (лимфоцитарная, плазмоклеточная, гистиоцитарная) собственной пластинки СО); степени воспаления: слабая, умеренная и выраженная:
б. активность (по наличию и распределению в СО желудка полиморфно-ядерных лейкоцитов); степени активности: слабая, умеренная или выраженная;
в. атрофия (утрата специализированных желез в теле или антральном отделе); степени: слабая, умеренная или выраженная;
г. вид и распространенность метапластических изменений; степени: слабая, умеренная, выраженная (дополнить ответ результатами использования дополнительных гистохимических методик, если использовались, в частности определение сульфмуцинов);
д. интенсивность H. pylori обсемененности; степени: слабая, умеренная, выраженная;
е. характер диспластических изменений; варианты: легкая, тяжелая, неопределенная, глобоидная.
7.2.4. Опухолевые заболевания желудка
Гистологическая классификация опухолей желудка1 (ВОЗ, 2010)
|
Эпителиальные опухоли | |
|
Интраэпителиальная неоплазия – Аденома |
8140/02 |
|
Раковые опухоли | |
|
Аденокарцинома |
8140/3 |
|
кишечный тип |
8144/3 |
|
диффузный тип |
8145/3 |
|
Сосочковая (папиллярная) аденокарцинома |
8260/3 |
|
Тубулярная аденокарцинома |
8211/3 |
|
Слизеобразующая (слизистая) аденокарцинома |
8480/3 |
|
Перстневидноклеточный рак |
8490/3 |
|
Железисто-плоскоклеточный рак |
8560/3 |
|
Плоскоклеточный рак |
8070/3 |
|
Мелкоклеточный рак |
8041/3 |
|
Недифференцированный рак |
8020/3 |
|
Другие | |
|
Карциноид (высокодифференцированная
|
8240/3 |
|
Неэпителиальные опухоли | |
|
Лейомиома |
8890/0 |
|
Шваннома (неврилеммома) |
9560/0 |
|
Зернисто-клеточная опухоль |
9580/0 |
|
Гломус-ангиома |
8711/0 |
|
Лейомиосаркома |
8890/3 |
|
Гастроинтестинальная стромальная опухоль (GIST) |
8936/1 |
|
доброкачественная |
8936/0 |
|
с неопределенным потенциалом злокачественности |
8936/1 |
|
злокачественная |
8936/3 |
|
Саркома Капоши |
9140/3 |
|
Другие | |
|
Опухоли лимфоидной ткани | |
|
В-клеточная лимфома маргинальной зоны (MALT) |
9690/3 |
|
Лимфома из клеток зоны мантии (мантийноклеточная) |
9673/3 |
|
Диффузная В-клеточная крупноклеточная |
9680/3 |
|
Другие | |
|
Вторичные опухоли |
1Классификация модифицирована по сравнению с предыдущей гистологической классификацией опухолей ВОЗ с учетом изменений в понимании природы поражений. В случае эндокринных новообразований классификация базируется на недавно принятой клинико-патологической классификации ВОЗ, но была упрощена для практической пользы в морфологической классификации.
2Морфологический код Международной классификации онкологических заболеваний (МКБ-О (ICD-O) и систематизированной медицинской номенклатуры. Кодировка: /0 – доброкачественная опухоль; /1 – неустановленный характер опухоли: пограничная либо неопределенная; /3 – злокачественная опухоль. ИЭН (интраэпителиальная неоплазия) не имеет общего кода в МКБ-O. Коды МКБ доступны только для поражений, отнесенных к категории железистой интраэпителиальной неоплазии класса III (8148/2) и аденокарциномы in situ (8140/2).
7.2.4.1. Доброкачественные опухоли желудка
Полипы желудка в широком смысле могут быть определены как образования, выступающие в просвет над поверхностью СО. Они являются относительно частыми в повседневной практике эндоскописта, и главной задачей является исключить возможность малигнизации. Имеются разные подтипы полипов, обычно подразделяющиеся на опухолевые и неопухолевые. Большинство полипов желудка выявляются случайно при эндоскопических исследованиях, проводимых в большинстве случаев по другому поводу. Иногда полипы становятся воспаленными или эрозированными, возможны осложнения в виде кровотечений из них и желудочная обструкция (непроходимость), связанная с большими размерами дистально расположенного полипа. Эндоскопические проявления вариабельные, от незначительно возвышающихся бляшек и папул до образований на широком основании или на ножке.
В соответствии с МСТ 3.0 по внешнему виду полипы могут подразделяться на злокачественные, аденоматозные, гиперпластические, воспалительные и псевдополипы. Однако, такое деление возможно только для полипов толстой кишки, в соответствие с классификацией рельефа их поверхности по Kudo. Для полиповидных образований в желудке нет ни одного патогномоничного симптома, по которому можно было достоверно сказать, какую природу имеет то или иное образование. Поэтому, особенно при отсутствии видеоэндоскопов с оптическим увеличением, функциями NBI и аутофлуоресценции, следует крайне осторожно относиться к определению типа полипа по его внешнему виду. Но некоторые характеристики полипа могут помочь врачу предположить диагноз с определенной степенью достоверности. Например, локализация образования. Так полипы фундальных желез никогда не бывают антральными, в отличие от аденом, которые чаще встречаются в дистальных отделах желудка. Некоторые полипы имеют тенденцию к множественному поражению, что характерно для гиперпластических полипов, полипов фундальных желез, карциноидов. Цвет образования имеет небольшую диагностическую ценность, так как чаще всего полипы имеют оранжево-розовый или розовый цвет. Следует отметить, что, несмотря на высокую диагностическую точность прицельной биопсии, только гистологическое исследование полностью удаленного полипа дает возможность окончательно решить вопрос о его морфологической структуре.
Эпителиальные доброкачественные опухоли желудка
· Аденома – определяется ВОЗ как ограниченное полиповидное поражение, состоящее из тубулярных и/или виллёзных структур, выстланных диспластическим эпителием. Распространенность от 0,5 до 3,8%, в странах с высоким риском рака желудка по некоторым данным до 20%. Часто развиваются на фоне атрофического гастрита с кишечной метаплазией. Локализация по частоте – антральный отдел, угол, тело желудка. Большинство представляют собой единичные, экзофитные образования, на широком основании или на ножке, размером от 3 мм до 4 см. Более редко обнаруживаются плоские поражения. Желудочные аденомы типично имеют бархатистую дольчатую поверхность, контрастирующую с гладкой прилегающей СО.
Риск малигнизации аденом связан с размером, степенью дисплазии и сосочковым ростом образования. Мелкие, имеющие ножку аденомы размером менее 1 см обычно состоят из тубулярного эпителия низкой степени дисплазии. Большие аденомы чаше сосочковые (папиллярные) с высокой степенью дисплазии и существенной склонностью к раковой трансформации. Риск малигнизации в аденомах размером больше 2-х см достигает 40% 50%. Тем не менее, очаги аденокарциномы могут быть обнаружены и в маленьких аденомах. Тот факт, что аденомы желудка являются предраковыми заболеваниями, подтверждается многими исследователями (Склянская О.А., 1998; Mai M., Takagi S., 1995; Fujiwara Y., 1996; Nishizuka S., 1996; Tamura G., 1996). Частота малигнизации доброкачественных эпителиальных опухолей желудка колеблется, по данным большинства исследователей (Белоус Т.А., 1986; Франк Г.А., 1986; Склянская О.А., 1998), в широком интервале 18-74 %. Биопсия обязательна. По возможности опухоль должна быть удалена целиком эндоскопически.
Опухолевидные/опухолеподобные поражения
· Гиперпластические полипы – эти доброкачественные поражения являются вторыми по частоте желудочными полипами после полипов фундальных желез. Могут быть на широком основании («сидячие») или на ножке, диагностируются в любом отделе желудка; локализация по частоте – антральный отдел, тело, кардиальный отдел. Чаще единичные (примерно в 2/3 случаях), иногда множественные (до неподдающихся подсчету опухолей, поражающих всю СО). Большинство менее 1 см в диаметре, полипы более 2 см составляют только 10% случаев. Малые полипы должны дифференцироваться от фовеолярной гиперплазии, макроскопическим проявлением которой могут быть папулы (Аруин Л.И., 1998). Мелкие поражения имеют гладкую, куполообразную поверхность. Большие полипы, иногда достигающие размеров более 10 см, обычно дольчатые и иногда имеют ножку. На больших полипах обычно появляются эрозии. При дистальном расположении большие полипы могут вызывать обструкцию выхода из желудка и пролабировать в двенадцатиперстную кишку. Большинство полипов развивается на фоне хронического атрофического гастрита или кишечной метаплазии, они могут развиваться в пищеводно-желудочном переходе у пациентов с хроническим пищеводным рефлюксом. Гистологически гиперпластические полипы характеризуются выраженным удлинением ямок с их ветвлением, что в результате дает спиралевидные проявления или кистозные расширения ямок. Другая картина – избыточная отечная собственная пластинка, инфильтрированная плазматическими клетками, лимфоцитами, эозинофилами, мастоцитами, макрофагами и вариабельным числом нейтрофилов. Разбросанные пучки гладкомышечных волокон наблюдаются обычно между желудочными ямками и возникают из утолщенного и расщепленного мышечного слоя СО. Ямки выстланы одним слоем гиперпластического эпителия фовеолярного типа, хотя могут быть обнаружены и железы пилорического типа, главные клетки, париетальные клетки и очаги кишечной метаплазии.
Есть мнение, что гиперпластические полипы не подвергаются малигнизации (Склянская О.А., 1998; Rosch W., 1979; Archimandritis A., 1996). Другие исследователи полагают, что гиперплазиогенные полипы могут трансформироваться в рак, однако их злокачественный потенциал низок и составляет от 0,125 до 7,1 % (Белоус Т.А., 1986; Виннер М.Г., 1987; Elster K., 1977; Burke C.A., van Stolk R.U., 1996). Малигнизации гиперпластического полипа, как правило, предшествует дисплазия его СО (Zea-Iriarte W.L., 1996), по мнению Г.А. Франка (1986) – дисплазия исключительно метаплазированного эпителия.
С течением времени гиперпластические полипы могут увеличиваться в количестве или регрессировать спонтанно, или под воздействием эрадикации хеликобактерной инфекции. Злокачественная трансформация наблюдается редко. Большие полипы должны быть полностью удалены для гистологической оценки. Биопсия обязательна – от 2-х до 6-и кусочков в зависимости от размеров образования.
· Воспалительный фиброзный полип – опухоль Vanek (эозинофильная гранулема, гранулобластома). В 1949 году Ванек описал воспалительный фиброзный полип как «желудочную подслизистую гранулему с эозинофильной инфильтрацией». Эти полипы характеризуются пролиферацией веретенообразных клеток, мелких кровеносных сосудов и воспалительных клеток, часто с преобладанием эозинофилов. Могут быть найдены в любом отделе ЖКТ, но наиболее часто – в антральном отделе желудка (80%). Диагностируются у взрослых мужчин и женщин и в некоторых случаях связаны с гипохлоргидрией и ахлоргидрией. Эндоскопически визуализируются как хорошо отграниченные, солитарные, мелкие сидящие или имеющие ножку образования, могут быть изъязвленными. Гистопатология – обычно располагаются в подслизистом слое, хотя описаны и чисто слизистые поражения. Состоят из мелких, тонкостенных сосудов, окруженных короткими веретенообразными клетками. ИГХ исследование показывает, что эти клетки позитивны по CD34 и негативны по c-kit, наряду с тем, что частая позитивность по фасцину указывает на дендритическое происхождение. Иногда видны многоядерные гигантские клетки с гиперхромными ядрами, имеющие вид мелкого цветка. Обычен инфильтрат клеток хронического воспаления, часто с преобладанием эозинофилов. У большинства пациентов нет симптомов, и диагноз является случайной находкой, эти полипы не рецидивируют после резекции. Поэтому удаление является адекватной терапией.
· Полипы фундальных желез (кистозная гамартома, киста фундальной железы, полипы Эльстера) – мелкие сидячие образованиями, обычно множественные. Локализация – свод, верхняя и средняя трети тела желудка. Могут быть диагностированы у мужчин и у женщин в любом возрасте. Эти полипы могут появляться спорадически у пациентов с семейным аденоматозным полипозом или как наследственное условие, ограниченное желудком без полипоза толстой кишки. Эндоскопически проявляются как гладкие, просвечивающие, сидячие полипы, менее 1 см в диаметре. Обсуждается их связь с длительным лечением ингибиторами протонной помпы. Считается, что они имеют гамартоматозное происхождение, частые находки генетических нарушений при семейном аденоматозном полипозе и при спорадических случаях, сильно склоняют к признанию этих поражений опухолевыми. Гистопатология – полипы фундальных желез состоят из кистозно-расширенных желез, выстланы эпителием фундальных желез, включая париетальные клетки и главные клетки, смешанные с нормальными железами. Вышележащие ямки укорочены и обычно без признаков воспаления и атипии. Может быть неравномерное распределение гладкомышечных волокон вокруг кистозных желез. У пациентов получающих ингибиторы протонной помпы они сочетаются с гипертрофией и гиперплазией париетальных клеток, которые выступают в просвет ямок, образуя зубчатый профиль.
Возможна спонтанная регрессия образований, и большинство этих полипов не являются предопухолевыми. Поэтому, несмотря на редкие случая дисплазии, эндоскопическое наблюдение за пациентами со спорадическими полипами фундальных желез не является необходимым. Однако обнаружение полипа фундальных желез у молодых пациентов требует исключения наличия семейного аденоматозного полипоза.
· Гамартозные полипы типа Peutz-Jegers (гамартомы – неправильно сформированные эмбриональные тканевые комплексы, расположенные дистопически, т.е. в органах, в которых в норме такие комплексы не наблюдаются). СО желудка может быть вовлечена в полипоз Пейтца-Егерса, хотя менее часто, чем тонкий или толстый кишечник. Желудочные гамартоматозные полипы состоят из гиперпластических желез, выстланных эпителием фовеолярного типа, и отделены ветвящейся ножкой из гладких мышц с атрофией глубокого железистого компонента. Описаны редкие случаи желудочной карциномы в полипе Пейтца-Егерса, но далеко не ясно, с какой частотой они появляются в предшествующих полипах.
· Ювенильный полип – изолированно в желудке данные полипы наблюдаются редко и чаще наблюдаются при ювенильном полипозе с поражением, как желудка, так и в целом ЖКТ (с наличием или отсутствием семейного анамнеза). Могут быть диагностированы в любом возрасте, часто сопровождаются анемией или гипопротеинемией. Локализуются чаще в антральном отделе. Состоят из отечной и воспаленной СО со значительным удлинением, извитостью, кистозными расширениями в фовеолярной зоне и поэтому могут быть легко спутаны с гиперпластическим полипом при отсутствии соответствующей клинической информации. Обладают высоким риском развития рака.
· Желудочные полипы при синдроме Кронхайт-Канада – появляются обычно в связи с поражениями другой части ЖКТ. Они не отличимы от ювенильных и гиперпластических полипов и могут быть диагностированы только при наличии клинических проявлений алопеции, атрофии ногтей или гиперпигментации. Озлокачествление их наблюдается редко.
Полипы в желудке могут также наблюдаться при синдроме Гарднера (сочетание аденоматозного полипоза ЖКТ с множественными остеомами черепа и нижней челюсти, эпидермальными кистами и мягкоткаными опухолями), семейном (диффузном) полипозе толстой кишки (желудок вовлекается в процесс менее чем в 5% случаев, злокачественный потенциал этого заболевания крайне высок).
Неэпителиальные (подслизистые) опухоли желудка
Подслизистые новообразования ЖКТ – собирательное понятие, включающее изменения, общим признаком которых является локализация патологического очага подслизистой стенки полого органа. Они составляют до 5% всех новообразований данной локализации и могут быть бессимптомными, являясь случайной находкой при эндоскопическом исследовании (0,4% наблюдений). По сообщениям некоторых авторов, при патологоанатомических исследованиях умерших в возрасте старше 50 лет подслизистые опухоли пищевода впервые выявляются в 5%, подслизистые опухоли желудка – в 50% случаев. Прижизненно подслизистые новообразования верхних отделов ЖКТ обнаруживаются с различной частотой. Наиболее часто они встречаются в желудке, составляя 60% всех подслизистых новообразований верхних отделов ЖКТ, на долю пищевода приходится 30%, на долю двенадцатиперстной кишки – 10%.
Длительное время подслизистые новообразования трактовались хирургами и эндоскопистами как доброкачественные и в большинстве подлежащие динамическому наблюдению. Исключение составляли новообразования больших размеров, которые имели клинические проявления и вынуждали хирургов к оперативному вмешательству. Чаще всего они выявляются при эндоскопическом или при рентгенологическом исследовании ЖКТ. Наиболее эффективным методом диагностики подслизистых опухолей является эндоскопическое исследование, при котором визуализируются округлой или овоидной формы образования, выбухающие в просвет органа и покрытые в большинстве наблюдений неизмененной СО. По косвенным эндоскопическим признакам можно предположить, что данное образование исходит из стенки полого органа, однако четкие критерии, позволяющие провести дифференциальную диагностику между подслизистым образованием и экстраорганной компрессией, отсутствуют. Также визуальное эндоскопическое исследование не дает ответа на вопрос о структуре образования и не позволяет определить, из какого именно слоя стенки полого органа оно происходит. С учетом локализации биопсия по стандартной методике при эндоскопическом исследовании также не дает возможности установить гистологическую природу этих новообразований. Возможности диагностики и дифференциальной диагностики неэпителиальных опухолей и неопухолевых образований стенки ЖКТ значительно расширяет эндоскопическая ультрасонография. Этот метод позволяет не только достоверно различать образования стенки и экстраорганные структуры, но и определять слой, из которого происходит новообразование, а оценивая его эхогенную характеристику четко дифференцировать неэпителиальные опухоли и неопухолевые образования ЖКТ. Подслизистые образования включают кисты, дистопию ткани поджелудочной железы и целую группу неэпителиальных опухолей мышечного, неврогенного и сосудистого происхождения.
· Лейомиома – в настоящее время встречается в 0,1% всех опухолей желудка. По гистологическому строению опухоли сходны с ГИСО, но в отличие от нее истинные мышечные опухоли чаще обнаруживаются у молодых пациентов, при ИГХ исследовании дают отрицательную реакцию на CD117 и CD34 и положительную на десмин и мышечный актин. Образования имеют округлую или овоидную форму, покрыты неизмененной СО, при эндосонографии гипоэхогенные, с ровным, четким контуром, гомогенной структуры, исходящие из II (мышечной пластинки слизистой) или IV (мышечного) эхослоя. В большинстве случае растут в виде одиночного узла, но встречаются опухоли из нескольких узлов. Описаны случаи, когда лейомиомы приобретали полиповидную форму, имели ножку. Могут поражать любой отдел желудка, иногда достигают гигантских размеров. При изъязвлении покрывающей СО может быть источником массивного кровотечения, приводя к анемии и обусловливая соответствующую клиническую картину.
· Липома – доброкачественная опухоль из жировой ткани, составляет от 1 до 3% всех доброкачественных неэпителиальных опухолей желудка. Опухоль обычно исходит из подслизистого слоя, гистологически имеет типичное строение (жировая ткань). При больших размерах может вызывать непроходимость и кровотечение. При EUS липома визуализируется как гиперэхогенное однородное образование, исходящее из подслизистого слоя.
· Шваннома (невринома, неврилеммома) – доброкачественная нейрогенная опухоль обычно возникает из интрамуральных нервных сплетений, развивается из леммоцитов. Наблюдается чаще у женщин в возрасте 4060 лет. Опухоли обычно одиночные, располагаются в подслизистом слое, чаще на малой кривизне, могут достигать больших размеров, изъязвляться. Микроскопически построена из клеток вытянутой формы с ядрами палочковидной формы, очень характерно формирование палисадных структур – чередование участков параллельно лежащих клеток с формированием телец Верокаи. При ИГХ исследовании дает положительную реакцию на S-100, иногда может быть положительной по CD34, но всегда отрицательна по CD117. По эндоскопической и эндосонографической картине сходна с лейомиомой и ГИСО, дифференциальная диагностика возможна только на основании гистологического и ИГХ исследований. Опухоль доброкачественная и при отсутствии клинических проявлений не требует хирургического лечения.
· Фиброма – доброкачественная соединительнотканная опухоль, редко возникающая в желудке, гистогенетически может быть фиброцитомой или гистиоцитомой. Ограниченная фиброма отчетливо отграничена от окружающей ткани.
· Нейрофиброма – нейрогенная опухоль, обычно исходящая из ауэрбаховского сплетения и локализующаяся в желудке, тонкой и ободочной кишке, чаще всего в подвздошной кишке. Обычно является признаком нейрофиброматоза типа I (болезнь Реклингхаузена) и часто сопровождается типичными проявлениями на коже (мелкие опухоли на ножке и пятна цвета кофе с молоком). Нейрофиброма может локализоваться в любом отделе желудка, при эндоскопии визуализируется как округлый очаг плотноэластической консистенции, при эндосонографии – как гипоэхогенное образование, локализующееся в IV слое, без гистологического исследования неотличимо от других образований, исходящих из мышечной стенки желудка. Опухоль доброкачественная, однако, может малигнизироваться и склонна к рецидивам после удаления.
· Гемангиома – зрелая доброкачественная опухоль из сосудов. Капиллярная гемангиома – это истинное новообразование с пролиферацией эндотелиальных клеток и формированием атипичных капилляров. Макроскопически представлена красным или синюшным узлом с гладкой или бугристой поверхностью, на разрезе имеет ячеистое строение. Микроскопически опухоль состоит из ветвящихся сосудов капиллярного типа с узким просветом, который не всегда заполнен кровью. Кавернозная гемангиома – новообразование, состоящее из причудливых полостей типа синусоидов различной величины, сообщающихся между собой. Макроскопически имеет вид четко отграниченного от окружающих тканей багрово-синюшного узла, на разрезе напоминающего губку. Микроскопически состоит из тонкостенных каверн, выстланных одним слоем эндотелиальных клеток и заполненных кровью. Венозная гемангиома микроскопически представлена преимущественно сосудами венозного типа. Гемангиомы нередко являются причиной кровотечений и требуют удаления хирургическим или эндоскопическим способом
Гетеротопии
· Эктопированная поджелудочная железа обычно выявляется случайно при эндоскопии, оперативных вмешательствах или на аутопсии. Новообразование имеет строение, характерное для поджелудочной железы, нередко на СО, покрывающей образование, можно визуализировать устье выводного протока. В большинстве наблюдений клиническая симптоматика отсутствует, однако возможно развитие осложнений в виде воспаления, кистозной трансформации, изъязвления, кровотечения и малигнизации. Чаще всего выявляется в дистальных отделах желудка. Диаметр от 1-2 мм до 6-7 мм, описаны поражения до 6 см. Выглядит как полиповидное образование на широком основании с характерным втяжением в центре, цвет и поверхность обычно соответствуют окружающей СО. Типичная картина добавочной поджелудочной железы не требует выполнения биопсии.
· Гетеротопия желудочных желез в подслизистом слое представлена элементами желудочных желез любого типа. Подобные изменения СО желудка описывают под названиями: глубокий кистозный гастрит, диффузная врожденная кистозная гиперплазия, диффузные подслизистые кисты.
7.2.4.2. Злокачественные опухоли желудка
Эпителиальные злокачественные опухоли желудка
· Рак желудка является наиболее часто встречающейся злокачественной опухолью желудка (до 90-95%) и занимает в мире четвёртое место среди всех злокачественных образований. В России по показателям заболеваемости (оба пола) РЖ устойчиво занимает 3-е ранговое место (8%) после рака кожи с меланомой и рака трахеи, бронхов, легкого и второе место по смертности от онкологических заболеваний. В течение последних 50 лет заболеваемость и смертность от этой патологии снижаются, особенно в экономически развитых странах.
В настоящее время развитие РЖ (в первую очередь «кишечного типа» по классификации P. Lauren) рассматривается как многоступенчатый процесс, включающий последовательность изменений СО желудка: хроническое воспаление, атрофия, кишечная метаплазия, дисплазия и аденокарцинома.
РЖ может возникать в одном или нескольких участках СО (мультифокальный рост), которые обычно расположены рядом и в последующем сливаются между собой. Значительно реже участки опухолевого роста расположены на значительном расстоянии друг от друга и тогда говорят о первично множественном раке желудка. Рак желудка может поражать любой отдел, но чаще локализуется в антральном отделе (50-70%).
Существуют различные классификации РЖ. В настоящее время, наиболее часто используются: по макроскопической структуре опухоли (классификации Bormann и Японской ассоциации по изучению рака, модифицированная – Парижская эндоскопическая классификация опухолевых поражений пищевода, желудка и толстой кишки (2002)); по гистиобиологическим свойствам опухоли (Lauren); по морфологическому строению опухоли; международная классификация по системе ТNМ.
Более 90% всех злокачественных опухолей желудка составляют аденокарциномы, и термин РЖ обычно относится к ним. Остальные формы рака встречаются значительно реже. По степени дифференцировки Международная гистологическая классификация предусматривает следующие виды РЖ:
высокодифференцированная аденокарцинома, представлена железистыми структурами, сходными по организации и строению с метаплазированным кишечным эпителием;
низкодифференцированная аденокарцинома имеет лишь с трудом обнаруживаемые железистые структуры;
умереннодифференцированная аденокарцинома занимает промежуточное положение между двумя вышеперечисленными видами.
Основные морфологические типы роста опухоли.
1. Полиповидный рак желудка – чётко очерченная, экзофитно растущая опухоль с широким основанием цилиндрической или полушаровидной формы, размерами чаще от 1,0 до 8,0 см. Поверхность опухоли может быть гладкой, бугристой и узловатой. Цвет – серовато-зеленоватый, ярко-красный. Нередко имеются изъязвления разнообразной формы и размера. Излюбленная локализация – тело и антральный отдел, чаще на большой кривизне, реже на передней и задней стенках, очень редко на малой кривизне. Чаще полиповидный рак бывает одиночным, но может быть множественным (2%). При инструментальной пальпации – опухоль ригидная, при биопсии – незначительная кровоточивость, «фрагментация» тканей. Если опухоль представлена одиночным узлом и отсутствует инфильтрация – полиповидный РЖ трудно дифференцировать от доброкачественного образования. Для повышения вероятности постановки правильного гистологического диагноза биопсию целесообразно брать из нескольких мест подозрительной СО.
2. Блюдцеобразный рак желудка – локализуется обычно в антральном отделе, чаще по передней стенке, большой кривизне, реже – по задней стенке. Опухоль имеет вид блюдца. Размеры от 2,0 до 10,0 см. Выглядит как глубокая язва с высокими, широкими, подрытыми краями в виде вала, высота которых неодинакова, края бугристой формы. Дно неровное, бугристое, покрыто налётом от грязно-серого до коричнево-чёрного цвета, наплывает на края в виде гребня. СО рядом с опухолью не инфильтрирована. Перистальтика вокруг отсутствует. При инструментальной пальпации края опухоли ригидные, при биопсии кровоточивость незначительная. Биопсия должна быть адекватной и множественной. При одиночно взятом биоптате из изъязвления, вероятность постановки правильного диагноза составляет 70%, а при биопсии, выполненной в восьми точках, эта вероятность повышается до 95–99% (J.Deutsch, 1999). Дальнейшее увеличение мест взятия биопсии не повышает вероятность постановки правильного диагноза.
3. Инфильтративная раковая язва – преимущественно локализуется на малой кривизне любого отдела желудка. Выглядит как язва с нечёткими контурами, неправильной формы и размерами от 2,0 до 6,0 см. Дно язвы бугристое с грязно-серым налётом. Воспалительный вал вокруг отсутствует или нерезко выражен, в последнем случае он никогда не окружает полностью всю язву, и её бугристое дно непосредственно переходит в окружающую слизистую оболочку. В этом основное отличие инфильтративной язвы от блюдцеобразного рака. Складки конвергируют к язве, но обрываются, не доходя до неё. Рельеф СО застывший вследствие раковой инфильтрации – складки ригидные, широкие, невысокие, не расправляются воздухом, перистальтические волны не прослеживаются. При инструментальной пальпации края ригидные, при биопсии – незначительная кровоточивость.
4. Диффузный инфильтративный рак. При подслизистом росте опухоли эндоскопическая диагностика этого типа рака довольно трудна и основывается на косвенных признаках: ригидности стенки органа в месте поражения, едва уловимой сглаженности рельефа и бледной окраске СО. При вовлечении в процесс СО развивается типичная эндоскопическая картина «злокачественного» рельефа: поражённый участок несколько выбухает, складки неподвижные, застывшие, плохо расправляются воздухом, снижена или отсутствует перистальтика, в окраске СО преобладают серые тона. Цвет поражённого участка может быть ярко-розовым или красным, наблюдаются внутрислизистые кровоизлияния, эрозии и даже язвы. Такая эндоскопическая картина инфильтративного рака может быть связана с присоединением инфекции и развитием воспалительной инфильтрации. При диффузном инфильтративном РЖ отмечаются уменьшение эластичности стенки органа и сужение его полости. При распространении процесса желудок превращается в узкую ригидную трубу. Даже небольшое нагнетание воздуха сопровождается его срыгиванием и болезненными ощущениями. Данный вид роста опухоли является наиболее трудным с точки зрения морфологического подтверждения, поэтому здесь необходимо выполнение множественной биопсии (от 10 фрагментов) и «ступенчатой» биопсии – с одного места вглубь стенки.
Ранние формы рака желудка. К ним относятся опухоли ограниченные СО или подслизистым слоем, независимо от площади их распространения, наличия метастазов в регионарных лимфатических узлах и гистогенеза. По результатам эндоскопии и щипцовой биопсии поставить диагноз раннего рака затруднительно. При подозрении на ранний РЖ должны быть применены все доступные методы исследования – хромоскопия, осмотр в узкоспектральном режиме, AFI, ZООМ-эндоскопия, эндосонография. Биопсия должна быть максимально прицельной, выполненной из наиболее подозрительных участков (участки с нарушением архитектоники ямочного и микрососудистого рисунка). Но следует помнить, что окончательная верификация раннего РЖ (как впрочем, и других органов ЖКТ) иногда возможна только после выполнения эндоскопической резекции СО или диссекции по подслизистому слою с последующим гистологическим исследованием удаленного фрагмента.
К подтипу 0-I (выступающему раку) относятся экзофитные полиповидные новообразования размером 0,5–2,0 см с невыраженной или короткой ножкой, широким основанием, плоской или втянутой верхушкой. Их окраска обычно ярче окраски окружающей СО, что в определенной степени обусловлено кровоизлияниями и микроэрозиями. При инструментальной «пальпации» и биопсии возникает кровоточивость. Новообразование обычно смещается вместе со СО относительно подлежащих тканей.
Подтип 0-IIа (приподнятый рак) представляет собой поверхностное образование, возвышающееся на 3–5 мм над поверхностью СО в виде плато, часто имеющее геморрагии, участки некрозов и углублений. Этот подтип встречается редко (до 4%). Чаще опухоли имеют углубление в центре и выбухание по краям. Окраска опухоли мало отличается от окраски окружающей слизистой, в связи с чем может быть не обнаружена. Для лучшей визуализации необходима хромоскопия с индигокармином.
Подтип 0-IIb (плоский рак) представляется в виде уплотнённого участка СО округлой формы, лишённого типичного рельефа, ригидного при инструментальной пальпации. Зона обесцвечивания очерчивает область поражения. Этот тип встречается реже всего, вероятно из-за сложности его диагностирования.
Подтип 0-IIс (вдавленный рак) характеризуется визуально чётко очерченными плоскими эрозивными полями, располагающимися на 2-3 мм ниже уровня СО, имеющими неровные, хорошо отграниченные края. В очаге поражения отсутствует блеск, характерный для слизистой оболочки, в области углубления иногда обнаруживаются участки интактной СО в виде островков и неровных выступов. Основание нередко кровоточащее.
Подтип 0-III (углублённый (подрытый) рак) – редкая форма, не отличимая при эндоскопическом исследовании от пептической язвы. Представляет собой дефект СО диаметром до 1–3 см с неоднородно утолщёнными ригидными краями, выступающими над поверхностью СО, и неровным дном, глубина которого может быть более 5 мм. Этот тип чаще встречается не в чистом виде, а в сочетании с другими.
Визуальная диагностика ранних форм рака желудка и дифференциальная диагностика их с доброкачественными полипами и язвами очень трудна в связи с отсутствием типичных эндоскопических признаков. Для правильной и своевременной диагностики необходимо применение дополнительных эндоскопических методик (биопсия, хромоскопия, ZOOM-эндоскопия, эндоскопия в узком спектре света и др.).
Неэпителиальные злокачественные опухоли желудка
Нейроэндокринные опухоли (НЭО) (см. также НЭО пищевода) представляют собой разнородную группу злокачественных новообразований, которые развиваются из нейроэндокринных клеток, выполняющих регуляторную функцию и расположенных диффузно по всему организму. Могут возникать в любых органах, где в норме имеются подобные клетки: в ЖКТ, легких, тимусе, почках, яичниках, предстательной, молочной и щитовидной железах, коже.
В органах пищеварительной системы большая часть НЭО развивается из различных типов нейроэндокринных клеток, образующих диффузную эндокринную систему (ДЭС) ЖКТ. НЭО ЖКТ редкие и обычно медленно растущие новообразования, при которых существенное ухудшение качества жизни пациентов даже при наличии метастазов происходит на поздней стадии болезни. Опухоли чаще бывают клинически нефункционирующими, а в случае функционирующих развиваются гиперфункциональные эндокринные синдромы, угрожающие жизни пациентов (представлены в табл. №14 (см. приложения)). В литературе и клинической практике для обозначения НЭО ЖКТ до сих пор используют несколько синонимов. Обендорфер в 1907 г. предложил термин «карциноид» для обозначения интестинальных опухолей с менее агрессивным, чем у аденокарцином, клиническим течением. Эндокринная природа этих опухолей была доказана Мерлингом в 1938 г. В настоящее время термин «карциноид» применяют только для НЭО ЖКТ, которые вызывают карциноидный синдром и клетки которых продуцируют серотонин, гистамин, тахикинин, простагландин и другие пептидные гормоны. В 1964 г. Пирс предложил для таких опухолей термин АПУДома на основании гипотезы об общем нейроэктодермальном происхождении эндокринных клеток ЖКТ, общим свойством которых, как он полагал, является способность утилизировать и декарбоксилировать предшественники аминов. В дальнейшем было доказано, что все эндокринные клетки ЖКТ происходят от общих стволовых клеток-предшественниц.
Термин «карциноид», который объединял всю группу нейроэндокринных новообразований, на данный момент для всех органов ЖКТ заменен диагностическими определениями «нейроэндокринная опухоль / нейроэндокринная карцинома». В классификацию Всемирной организации здравоохранения (WHO 2000) впервые были включены основные критерии оценки злокачественного потенциала и прогноза рассматриваемой категории новообразований. В дальнейшем Европейским обществом по изучению нейроэндокринных опухолей (ENETS) предложена дополнительная система определения степени злокачественности НЭО ЖКТ (Grade – G1, G2, G3 – по количеству митозов менее 2, от 2 до 20 и более 20), а также на основе оценки уровня пролиферативной активности опухолевых клеток (индекса Ki-67 (до 2, до 20 и более 20).
В 2010 г. Grade утверждена Американским Объединенным Комитетом по Онкологии (AJCC). Определение индекса Ki-67 является обязательным при изучении биопсий метастазов и маленьких образцов тканей, в которых невозможен точный подсчет количества митозов (Klimstra D.S. et al.; 2010). Индекс Ki-67 является не только показателем злокачественного потенциала опухоли, который коррелирует с выживаемостью, но важным критерием в алгоритме лечения НЭО желудочно-кишечного тракта (W. De Herder et al.; 2006).
В 2010г. ВОЗ разработана новая классификация нейроэндокринных новообразований ЖКТ.
Для НЭО желудка выделяют следующие основные категории новообразований:
Нейроэндокринная опухоль: НЭО G1 (карциноид), НЭО G2.
Нейроэндокринная карцинома: крупноклеточная НЭК, мелкоклеточная НЭК.
Смешанная аденонейроэндокринная карцинома (САНЭК): ЕСклеточная, серотонин-продуцирующая НЭО, гастрин-продуцирующая НЭО (гастринома).
Каждая категория НЭО желудка имеет характерные особенности с учетом клинико-морфологических критериев (размер опухоли, глубина опухолевой инвазии стенки органа, наличие инвазии сосудов, периневральной инвазии, метастазов в лимфатических узлах и отдаленных органах), а также пролиферативной активности опухолевых клеток и специфического типа клеток, определяющего секреторный профиль опухоли (представлены в таблице №11 (см. приложения)).
НЭО желудка формируются в большинстве случаев (90%) из энтерохромаффиноподобных (ECL) клеток, реже могут возникать из G-клеток антрального отдела желудка.
Кроме того, классификация WHO 2010 включает рекомендации по TNM стадированию для каждого анатомического места развития опухоли (AJCC-UICC-WHO 2010). Для НЭО желудка эти рекомендации полностью совпадают с предложениями Европейского общества по изучению нейроэндокринных опухолей (ENETS 2006–2007).
Заболеваемость НЭО желудка относительно невелика и составляет 2–3 случая на 100 000 населения в год (Hemminki K., 2001, Kontogeorgos G., 2010, Modlin I.M., 2003). По наблюдениям J.D. Godwin (1975) частота встречаемости таких новообразований не превышает 7,7% среди всех опухолей нейроэндокринной природы и 0,3–1% среди всех опухолей желудка. Коэффициент заболеваемости НЭО желудка у женщин выше и по данным программы SEER соотношение показателей у мужчин и женщин составляет 0,57 (Modlin I.M., 2003). Большинство НЭО желудка являются высокодифференцированными, гормонально неактивными новообразованиями, возникают особенно часто в кислотопродуцирующей зоне СО тела и свода желудка. Гормональноактивные опухоли встречаются редко и составляют около 1% всех НЭО данного органа.
Общепринятой является также патогенетическая классификация НЭО желудка, предложенная G. Rindi (2006), согласно которой высокодифференцированные новообразования подразделяются на три основных типа:
I тип (ассоциированный с атрофическим гастритом) – гастринзависимый. Это наиболее часто встречающийся вариант неоплазмы, который наблюдается в 70–80% случаев всех НЭО желудка. Для него характерен мультицентричный характер роста опухоли с преимущественным поражением тела желудка. Течение указанного типа НЭО является наименее агрессивным, не сопровождается специфической клинической симптоматикой, метастазирование наблюдается крайне редко (при достижении опухолью размеров свыше 1 см – не более чем в 2–5% случаев). В мировой литературе не описано ни одного летального исхода при этом варианте заболевания.
II тип (гастринома, синдром Золлингера-Эллисона) – менин-зависимый, гастрин-связанный. Встречается в 5–6% случаев всех НЭО желудка. Большинство гастрином являются спорадическими опухолями, однако приблизительно 12% обусловлены аутосомно-доминантным наследственным заболеванием – множественной эндокринной неоплазией 1-го типа (MEN1). Для течения этого типа НЭО характерны часто рецидивирующие доброкачественные изъязвления в желудке и луковице ДПК с неспецифическими клиническими проявлениями. Достаточно часто наблюдается мультицентричный характер роста опухоли. Метастазирует в 10–30% случаев. Летальные исходы, обусловленные опухолевым процессом, составляют менее 10%.
III тип – спорадический, гастрин-независимый. Среди всех НЭО желудка частота его встречаемости составляет, по разным данным, от 14 до 25%. Отличается от НЭО I и II типов значительно большей агрессивностью. Для спорадического типа НЭО характерно наличие единичного очага поражения, в 70% случаев размерами более 1 см. Часто данный тип опухоли выявляется уже при распространенном процессе, что обусловлено ее достаточно быстрым локальным ростом, а также высоким метастатическим потенциалом. При первичном обращении у таких пациентов более чем в 75% случаев имеется опухолевая инвазия, распространяющаяся на подслизистый слой и глубже, а в 69% обнаруживаются отдаленные метастазы (Masson A.P., 1914). Смертность больных НЭО желудка III типа составляет около 25% (Lawrence B., Kidd M., 2011).
Отдельной группой рассматриваются нейроэндокринные карциномы, которые являются относительно редкими низкодифференцированными неоплазмами, отличаются высокой степенью злокачественности и очень агрессивным клиническим течением. Чаще болеют мужчины. К моменту установления диагноза, как правило, имеются отдаленные метастазы, и смерть больных наступает в течение нескольких месяцев (Rindi G., Azzoni C., 1999).
Многообразие форм НЭО желудка и отсутствие специфической симптоматики заболевания определяют необходимость разработки методов выявления ранних стадий таких новообразований.
Поскольку на ранних стадиях НЭО желудка протекают без специфической клинической симптоматики или вообще асимптомны, они могут быть выявлены только при эндоскопических исследованиях. Вместе с тем подобные новообразования обычно отличаются полиморфизмом эндоскопической картины и очень часто имитируют иные патологические изменения в желудке. Поэтому нередко при рутинной эзофагогастродуоденоскопии выявленным изменениям не придается должное внимание, не проводится забор биопсийного материала, более того вследствие малых размеров такие новообразования пропускаются. В ряде случаев бывает также сложно провести дифференциальную диагностику НЭО желудка и других эпителиальных и неэпителиальных новообразований, в частности рака, лимфомы, метастатического поражения и др.
Между тем своевременная и правильная постановка диагноза с применением новых современных технологических разработок позволяет определить и выбрать наиболее рациональный подход к лечению этой группы больных, например, выполнить органосохраняющие оперативные вмешательства. Обязательно следует включать в план предоперационного обследования данной категории пациентов определение в крови уровня хромогранина А, серотонина, гастрина и анализ суточной мочи на 5-ГИУК для последующего мониторинга заболевания (Yao J.C., Hassan M., Phan A. et al., 2008).
Анализ данных, полученных в Российском онкологическом научном центре им. Н.Н.Блохина позволил определить три макроскопических формы НЭО желудка – плосковозвышающуюся, полиповидную и инфильтративную и выявить для них характерные эндоскопические и эндосонографические критерии при различных возможных вариантах осмотра (Перфильев И.Б.,
Делекторская В.В., Кувшинов Ю.П., Поддубный Б.К., 2011). По данным этих авторов частота выявления плосковозвышающейся формы составила 22,7%. Она характеризуется плоским или незначительно возвышающимся (не более 5 мм), гиперемированным образованием. При осмотре в режиме увеличения – архитектоника СО в зоне образования либо не нарушена, либо имеет гиперпластическую перестройку, определяющуюся удлинением и извитостью желудочных ямок, увеличением их глубины и расстояния между ними, видна сеть полнокровных, извитых сосудов, ограниченная зоной образования, которая более детально визуализируется в режиме NBI. При проведении эндосонографии определяется гипоэхогенное образование на уровне мышечной пластинки СО изоэхогенной плотности с ней. Полиповидная форма является наиболее часто встречающимся макроскопическим типом НЭО желудка (67,9%), характеризуется полиповидными образованиями размерами от 6 до 25 мм, плотной консистенции, при этом архитектоника СО не нарушена, часто сопровождается ее гиперпластическими изменениями. Патогномоничным признаком является изменение сосудистого рисунка СО полиповидного образования, проявляющееся полнокровными, извитыми сосудами, ограниченными областью патологического очага. Часто на верхушке образования отмечаются зоны повреждения СО. Основными эндосонографическими критериями полиповидной формы НЭО являются локализация опухоли относительно слоев стенки желудка и эхогенная плотность опухоли. Во всех случаях основание опухоли определялось на уровне мышечной пластинки СО, изоэхогенной плотности с ней. Инфильтративная форма по данным авторов являлась самым редко встречающимся макроскопическим вариантом НЭО желудка и была отмечена в 9,4% случаев. Согласно патогенетической классификации, чаще всего она соответствует III (спорадическому) типу НЭО и в отличие от первых двух форм наиболее трудна для дифференциальной диагностики, так как изменения сходны с картиной ограниченного рака желудка и не имеют специфических признаков. В данной работе отмечено, что очаг опухолевой инфильтрации во всех случаях был единичен, размеры его варьировали от 25 до 40 мм, изменений сосудистого рисунка выявлено не было, в том числе и при осмотре в режиме NBI.
ИГХ характеристика. Большинство НЭО желудка экспрессируют хромогранин А, синаптофизин, гистамин, гистидин, реже серотонин, грелин, гастрин, соматостатин. ECL-клеточные и гистамин-продуцирующие НЭО желудка в большинстве случаев являются опухолями I и II, реже III типа. ЕСклеточные, серотонин-продуцирующие НЭО желудка встречаются сравнительно редко и по гистологическому строению мало отличаются от соответствующих опухолей тонкой кишки.
· Гастроинтестинальные стромальные опухоли (ГИСО). Составляют до 1% всех злокачественных опухолей этой локализации и до 60-70% от всех ГИСО ЖКТ и являются наиболее распространенными среди неэпителиальных опухолей ЖКТ. Эти новообразования ранее расценивались как лейомиомы, лейомиобластомы и лейомиосаркомы, шванномы, плексомы, однако иммуногистохимические исследования показали их особую природу. При эндоскопическом исследовании опухоли могут выявляться в виде образований округлой или овоидной формы; небольшие образования покрыты неизмененной СО, однако нередко можно выявить изъязвление над опухолью, что служит прогностически неблагоприятным фактором относительно злокачественности образования и может стать источником желудочно-кишечных кровотечений с развитием анемии. В 50% наблюдений это является поводом для обращения пациентов к врачу и причиной выявления ГИСО. При эндосонографическом исследовании данная опухоль визуализируется как гипоэхогенное образование, которое в зависимости от степени злокачественности может иметь как гомогенную, так и гетерогенную структуру и исходить из мышечной пластинки СО или мышечного слоя стенки органа. Несмотря на различные варианты гистологического строения, все ГИСО считаются потенциально злокачественными. Даже после радикального удаления опухоли (макрои микроскопически в пределах здоровых тканей) частота рецидивов достигает 30—50%, проявляясь либо метастазами в печень, либо местным рецидивом (метастазы по брюшине). Основными путями генерализации гастроинтестинальной стромальной опухоли является метастазирование в печень и распространение по брюшине. Лимфогенное метастазирование для опухоли не характерно. В дифференциально-диагностическом ряду с гастроинтестинальными опухолями находятся мезенхимальные опухоли и другие новообразования, локализующиеся в стенке пищеварительной трубки и покрытые неизмененной СО. Наиболее часто ГИСО приходится дифференцировать с истинными гладкомышечными опухолями, липомой, шванномой, нейроэндокринной опухолью, эктопированной поджелудочной железой.
Большинство (около 95%) ГИСО позитивны на CD117 (c-kit) с цитоплазматическим, мембранным или перинуклеарным типом окрашивания. При негативной реакции на CD117 (опухоли эпителиоидного строения) полезным маркером могут служить антитела к PDGFRa. Белок DOG1 по специфичности и чувствительности имеет значительное сходство с CD117. До 80% случаев ГИСО дают мембранную реакцию на CD34, около 20% позитивны на гладкомышечный актин, менее 5% опухолей неравномерно окрашиваются на десмин. Пролиферативный индекс более 5% (по метке Ki-67) может отражать высокий потенциал метастазирования ГИСО. Кроме того, прогностическими факторами являются размер опухоли, число митозов на 50 полей зрения и разрыв новообразования. Необходимым этапом диагностики может быть анализ активирующих мутаций в гене c-kit.
· Лейомиосаркома – злокачественная гладкомышечная опухоль, часто приводящая к изъязвлению СО и кровотечению.
Как и при других подслизистых опухолях морфологическое подтверждение при неэпителиальных злокачественных опухолях крайне затруднено и часто биопсия бывает малоинформативна, здесь на первый план выходит эндосонография с тонкоигольной пункцией (EUS-FNA). Щипцовая биопсия выполняется при нарушении целостности СО.
Опухоли лимфоидной ткани
· Лимфома желудка. Желудок – нередкая первичная локализация возникновения экстранодальных лимфом. По гистологическому, иммунофенотипическому и цитогенетическому вариантам они разнообразны. Это могут быть В-, Т-клеточные опухоли, гистиоцитарные саркомы. Одними из наиболее частых вариантов являются MАLT-лимфома, диффузная Вклеточная крупноклеточная лимфома, фолликулярная лимфома, лимфома клеток зоны мантии и др. Чаще при лимфомах желудка поражается более двух его отделов, т.е. имеется мультицентричный и диффузный рост опухоли, тело желудка вовлекается в процесс практически в трети случаев и на третьем месте по частоте поражения находится проксимальный отдел желудка.
При лимфомах желудка встречаются следующие макроскопические формы: инфильтративно-язвенное поражение, инфильтративное, язвенная форма роста опухоли и гастритоподобный вариант опухоли. Реже встречаются смешанная и экзофитная формы (Поддубный Б.К., Малихова О.А., 2006).
ЭКЗОФИТНАЯ ФОРМА лимфомы встречается в виде бляшковидного, полиповидного вариантов и узловой формы роста. Бляшковидный вариант лимфомы характеризуется одиночными или множественными подслизистыми опухолевыми образованиями полушаровидной формы с углублением на верхушке. При полиповидном варианте опухоль имеет округлый, сферический или конусообразный вид, характеризуется наличием одиночных или множественных полиповидных образований на широком основании с разрыхленной СО белесовато-красного цвета, углублением на верхушке. Нарушение СО на их верхушке проявляется также в виде поверхностных эрозий и язв. Узловая форма роста может выглядеть в виде массивных бугристых экзофитных образований больших размеров, от 2 до 10 см в диаметре, чаще полушаровидной формы, над которыми слизистая оболочка желудка остается без изменений, а также иметь вид уплощенных узловых образований с эрозированной или изъязвленной поверхностью.
ИНФИЛЬТРАТИВНАЯ ФОРМА. Встречается бугристо-инфильтративный вариант, плоско-инфильтративный и гигантоскладочная форма роста. Плоско-инфильтративный вариант лимфомы желудка характеризуется диффузной опухолевой инфильтрацией, распространяющейся преимущественно по подслизистому слою стенки желудка. При этом имеется локальное или диффузное утолщение складок СО, их неравномерное расширение. Ориентация складок большой кривизны тела желудка нарушается, создается впечатление их извитости и местами прерывистости. Даже при значительном опухолевом поражении складки СО желудка остаются относительно подвижными при инструментальной пальпации, а стенка желудка сохраняет свою эластичность. Характерными для этой формы поражения являются гиперемия, рыхлость, легкая травмируемость и кровоточивость СО при инструментальной пальпации или контакте с эндоскопом. Для бугристо-инфильтративного варианта лимфомы желудка в дополнение к плоской форме присоединяются неравномерная бугристость и ограниченное утолщение складок в сочетании со значительным уменьшением просвета желудка при относительной сохранности и эластичности стенок. Зоны поражения могут чередоваться с интактными участками СО желудка. При гигантоскладочном варианте лимфомы определяются значительно утолщенные, высокие, извитые складки тела желудка, часто с переходом на свод, со стекловидным блеском и отечностью и неравномерной окраской СО, а также поверхностными эрозиями неправильной формы. При инсуффляции воздуха складки могут незначительно уплощаться, менять свою конфигурацию, что свидетельствует о частичной сохранности эластичности стенок желудка. Высота складок СО значительно превышает их размеры в отличие от других вариантов инфильтративной формы лимфомы желудка, что и послужило основанием для выделения данной макроскопической формы.
ЯЗВЕННАЯ ФОРМА лимфомы желудка. В некоторых случаях язвенный дефект выглядит как глубокая хроническая каллезная пептическая язва округлой формы с ровным дном, покрытым фибринозно-некротическим налетом, выраженной конвергенцией складок. Дифференциальнодиагностическим признаком могут служить более приподнятые утолщенные края язвы, что обусловлено перифокальной подслизистой опухолевой инфильтрацией. Другим вариантом данной формы лимфомы является наличие неглубокого полигональной формы язвенного дефекта, окруженного неизмененной СО, с гладкой поверхностью. Он может быть одиночным, но чаще встречается наличие нескольких язв, которые располагаются в различных отделах желудка с интактными участками слизистой желудка между ними.
ИНФИЛЬТРАТИВНО-ЯЗВЕННАЯ ФОРМА лимфомы желудка, при котором картина диффузной инфильтрации, неравномерно утолщенных инфильтрированных складок дополняется наличием массивных язвенных дефектов неправильной формы и различной глубины, покрытых фибринозным налетом. Размеры их и количество могут быть весьма вариабельными. СО желудка прослеживается до самого края язвенного дефекта, а также отсутствует ригидность стенки желудка прилежащей к язве.
ГАСТРИТОПОДОБНАЯ ФОРМА лимфомы желудка. Эндоскопическая картина этой формы лимфомы является наиболее вариабельной и по преобладанию макроскопических признаков может проявляться в виде:
• антрального гастрита
• эрозивного гастрита
• очагового гиперпластического гастрита
• смешанного гастрита
Такое деление является условным, эти формы выделяются по преобладанию наиболее выраженных признаков, симулирующих ту или иную форму гастрита. При гастритоподобной форме лимфомы желудка в виде антрального гастрита, как следует из самого определения, визуальные проявления опухоли симулируют воспалительные изменения в антральном отделе желудка. Как и при других вариантах, характерным является появление стекловидного блеска. При проведении биопсии подвижность и эластичность СО снижена, отмечается ее фрагментация. Изменения при лимфоме желудка в виде эрозивного гастрита характеризуются наличием множественных поверхностный эрозий неправильной или щелевидной формы на фоне пастозной, неравномерно гиперемированной СО с усиленным сосудистым рисунком. Лимфома желудка в виде локального гиперпластического гастрита характеризуется неравномерным утолщением складок на ограниченном участке, чаще по большой кривизне, и в проксимальном отделе желудка иногда с переходом на переднюю или заднюю стенки. Поверхность складок покрыта вязкой стекловидной слизью, разрыхлена. При инсуффляции складки СО пораженного участка, как правило, не расправляются полностью.
СМЕШАННАЯ ФОРМА лимфомы желудка характеризуется сочетанием различных макроскопических вариантов в виде участков плоской инфильтрации, бляшек, узлов, язвенных дефектов, Такое разнообразие, или, образно говоря, «пестрота» эндоскопической картины, является наиболее характерным отличительным признаком, позволяющим проводить дифференциальную диагностику лимфомы и рака желудка.
Особое место среди лимфом занимает MALT-лимфома (прежнее название мальтома). В свою очередь она делится на три типа: низкой степени злокачественности, с признаками бластной трансформации и высокой степени злокачественности.
MALT-лимфома низкой степени злокачественности развивается чаще у больных старше 60 лет. Отмечается длительный анамнез (наличие НРассоциированного гастрита, язвенной болезни в течение более 5 лет). Выраженных жалоб нет. Эндоскопическая картина – гастритоподобное поражение, эрозии, локальное утолщение складок. Нередко – одиночные язвы, а также опухолевое поражение в виде бляшек и узлов.
MALT-лимфома с признаками бластной трансформации характеризуется нарастающим болевым синдромом в эпигастрии, диспепсией. При эндоскопии выявляется экзофитный компонент с неравномерным утолщением складок СО, характерной рыхлой поверхностью и специфическим сосудистым рисунком. Заболевание имеет склонность к раннему метастазированию в регионарные лимфатические узлы. Могут встречаться множественные язвенные дефекты до 2 см.
MALT-лимфома высокой степени злокачественности – отличается выявлением преимущественно инфильтративно – язвенного типа опухолевого поражения желудка с большими размерами язвенных дефектов (до 4-5 см в диаметре), с развитием желудочных кровотечений и пенетрацией в соседние органы.
При любом подозрении на лимфому желудка необходима множественная биопсия (не менее 8 кусочков) с обязательным иммуногистохимическим, а в ряде случаев цитогенетическим исследованием биоптатов и исследованием на НР.
Ниже приведены собственные наблюдения по диагностике злокачественных опухолей желудка, количеству биоптатов при той или иной форме поражения.
За 2012-13гг. в отделении эндоскопии ГБУЗ НО «Нижегородский областной онкологический диспансер» при выполнении гастроскопии диагноз рак желудка или подозрение на него был выставлен 719 пациентам, из них у 196 имелось морфологическое подтверждение опухолевого процесса на догоспитальном этапе. 523 пациентам выполнена биопсия с последующим цитологическим и гистологическим исследованием материала. Результаты представлены в диаграммах 1-6.
Следует отметить, что в группу «имелось/получено морфологическое подтверждение опухоли» вошли пациенты со всеми злокачественными новообразованиями: рак, лимфома, нейроэндокринная опухоль, GIST и др., подтвержденными гистологически или цитологически.
Диаграмма 1. Распределение больных по макроскопической форме роста опухоли согласно Парижской классификации опухолевых заболеваний пищевода, желудка и толстой кишки (Японской ассоциации рака желудка (JGCA)) и морфологическому подтверждению на догоспитальном этапе
Низкий процент пациентов, у которых имелось морфологическое подтверждение опухоли на догоспитальном этапе, в большей степени связан с отсутствием в учреждениях квалифицированных морфологов, удаленностью от областного центра и длительными сроками ответа на выполненную биопсию. А крайне низкий процент в диагностике ранних форм заболевания – с нарушением протокола исследования. Практически всем пациентам с данной патологией эндоскопическое заключение было впервые выставлено при осмотре в нашем учреждении.
Для подтверждения или снятия диагноза злокачественного новообразования пациентам приходилось выполнять от одной до нескольких гастроскопий, максимально – 4 раза. В большинстве случаев (470 пациентов – 90,0%) однократной гастроскопии с биопсией было достаточно.
При распространенных формах роста опухоли морфологическое подтверждение после первого обследования составило от 85% при инфильтративно-язвенной форме до 93% при неклассифицируемой форме (диаграмма 2).
Диаграмма 2. Получено морфологическое подтверждение при первой гастроскопии
53 пациентам были выполнены повторные исследования (45 человек – гастроскопии 2 раза, 6 – 3 раза и 2 – выполнено 4 ГС). Повторные ГС с биопсией были эффективны для опухолей типа 0 и I, где количество подтвержденных диагнозов злокачественного поражения увеличились практически на 15%. При других формах роста опухоли повторные гастроскопии не дали значимых результатов, даже при выполнении множественной биопсии (от 8 до 12 биоптатов) (диаграмма 3).
Диаграмма 3. Получено морфологическое подтверждение при повторных гастроскопиях.
По нашим наблюдениям практически при всех формах роста опухоли для подтверждения диагноза было достаточно от 2-х до 5-и биоптатов (93,5% наблюдений) (диаграмма 4), в том числе при повторных исследованиях. Это не распространялось на диффузный рак, когда при повторных гастроскопиях приходилось брать от 8 до 15 биоптатов. И в тоже время, это чаще не приносило нужных результатов.
Диаграмма 4. Распределение пациентов в зависимости от количества биоптатов при первой гастроскопии, % морфологического подтверждения
У данной группы больных полное совпадение результатов цитологического и гистологического исследований составило 81,8% (с учетом пациентов, которым диагноз был снят) (диаграмма 5).
Диаграмма 5. Сравнение результатов гистологического и цитологического исследований
На диаграмме 6 представлены сводные результаты подтверждения диагноза злокачественного новообразования с учетом всех пациентов.
Диаграмма 6. Количество больных с установленным диагнозом злокачественного поражения с учетом больных имеющих морфологическое подтверждение на догоспитальном этапе
Гистопатологические формы раковых опухолей желудка:
Основной формой РЖ является аденокарцинома (АК). Она варьирует от высокодифференцированных до низкодифференцированных опухолей. Высокодифференцированные опухоли представлены железистыми, в т.ч. папиллярными структурами; в низкодифференцированных опухолях железы обнаруживают с трудом, а анапластические формы АК состоят из солидных пластов клеток опухоли. Атипия клеток обычно нарастает соответственно снижению структурной дифференцировки. РЖ обладает различным характером роста, стромаи слизеобразованием. Слизь в цитоплазме, просвете желез, строме имеет разные гистохимические свойства; часть АК не продуцирует слизь.
АК желудка формирует железистые структуры (тубулярные, ацинарные, папиллярные) или состоит из комбинации изолированных клеток с различной морфологией, иногда с небольшим количеством железистых, трабекулярных, альвеолярных, солидных структур. Преобладает обычно одна из 4 картин; диагноз основывается на преобладающем типе структур.
Тубулярная аденокарцинома. Представлена сформированными расширенными или щелевидными ветвящимися канальцами различного диаметра; могут присутствовать ацинарные структуры. Клетки опухоли могут быть цилиндрической, кубической, уплощенной формы, напоминают метаплазированный кишечный эпителий, присутствуют клетки со светлой цитоплазмой. Степень цитологической атипии варьирует от низкой до высокой. Последний вариант иногда называют солидным РЖ. А опухоли с инфильтрированной лимфоцитами стромой иногда называют медуллярным раком или РЖ с лимфоидной стромой. Низкодифференцированная АК состоит из с трудом распознаваемых атипических желез или изолированных клеток, небольших групп, больших комплексов с секрецией слизи.
Папиллярная аденокарцинома. Чаще высокодифференцированная экзофитная опухоль с вытянутыми пальцевидными отростками, выстланными цилиндрическими или кубическими клетками, расположенными на фиброваскулярном стержне. Клетки, как правило, сохраняют свою полярность. Некоторые опухоли имеют тубулярную дифференцировку (папиллотубулярные), изредка микропапиллярное строение. Степень клеточной атипии и митотический индекс варьируют, в ряде опухолей наблюдается тяжелая степень клеточной атипии. Края опухоли, как правило, резко отграничены от окружающих структур; строма опухоли может быть инфильтрирована клетками острого и хронического воспаления.
Слизистая аденокарцинома. По определению > 50% площади опухоли занимают поля внеклеточной муцинозной слизи. Две основные формы (1) железы, выстланные слизесодержащими эпителиальными клетками цилиндрической формы и интерстициальную слизь или (2) цепочки, комплексы клеток неправильной формы, свободно «плавающие» в «озерах» слизи. Присутствуют разбросанные перстневидные клетки, но они не доминируют в гистологической картине. Определять опухоль как муцинозная аденокарцинома ненадежно в опухолях, содержащих только несколько клеток. Термин «муцин-продуцирующая" не является синонимом муцинозная в этом контексте.
Перстневидно-клеточная карцинома. Более 50% опухоли состоит из изолированных или небольших групп злокачественных клеток, содержащих муцин внутри цитоплазмы. Клетки разбросаны в собственной пластинке слизистой, увеличено расстояние между ямками и железами. Клетки опухоли имеют пять морфологических типов: (1) ядро смещено к клеточной мембране, создавая классическую картину клетки в виде «перстня» с широкой глобоидной оптически светлой цитоплазмой; (2) другие диффузные карциномы содержат клетки с центральными ядрами, напоминающие гистиоциты с незначительной митотической активностью или вообще без нее; (3) маленькие эозинофильные клетки с видимыми мелкими цитоплазматическими гранулами, содержащими нейтральный муцин; (4) маленькие клетки с небольшим количеством или без муцина и (5) анапластические клетки с небольшим количеством или без муцина. Эти типы клеток могут встречаться в различном сочетании, что определяет различные формы опухоли. Перстневидные клетки нередко образуют «кружевные» и нежные трабекулярные структуры. Перстневидно-клеточный рак, как правило, инфильтративный; количество злокачественных клеток сравнительно небольшое, может быть выражена десмоплазия. Специальные окраски на слизь (ШИК-рекция, муци-кармин, альциановый голубой) или иммуноморфологические реакции помогают обнаружить разбросанные в строме клетки опухоли. Некоторые поражения могут имитировать перстневидно-клеточный рак: злокачественная лимфома; ксантома; содержащие слизь макрофаги в собственной пластинке слизистой оболочки; распадающиеся клетки при ХГ.
Железисто-плоскоклеточный рак. Поражение сочетает в себе аденокарциному и плоскоклеточный рак без количественного преобладания одного компонента над другим. Имеются переходы между обоими компонентами. Возможна четкая граница. Опухоли, содержащие дискретные фокусы плоскоклеточный метаплазии называются аденокарциномами с плоскоклеточной дифференцировкой (синоним аденоакантома).
Плоскоклеточный рак. В желудке встречается редко, напоминает плоскоклеточный рак других локализаций.
Недифференцированный рак. Признаки дифференцировки отсутствуют, за исключением того, что распознается эпителиальный фенотип (экспрессия цитокератинов). Клетки расположены в виде тяжей, комплексов или диффузно, изолированно друг от друга, реже в виде крупных солидных полей, четко отграниченных от окружающей ткани и обычно окруженных лимфоидным инфильтратом. Клетки полиморфные или относительно однотипные, с гиперхромными или светлыми пузырьковидными ядрами, цитоплазма едва заметная или обильная. Возможна выработка слизи с образованием изолированных перстневидных клеток или накоплением в строме. Ядро клетки расположено эксцентрически, часто пикнотического вида. Опухоль содержит клетки в разных стадиях накопления секрета. Иммуноморфологический анализ помогает уточнить гистологический диагноз.
Очень редко выявляют: аденокарциноид (комбинированная эндокринно-экзокринная опухоль), мелкоклеточный рак, эмбриональный рак, аденокарциному с большим количеством париетальных клеток, аденокарциному с большим количеством клеток Панета.
Предраковые состояния и изменения слизистой оболочки желудка
Различают предраковые состояния и предраковые изменения в желудке.
К первым относятся заболевания, которые могут привести к развитию
РЖ (например, атрофический гастрит, аденомы, наследственный неполипозный колоректальный рак (синдром Линча II), резецированный желудок, болезнь Менетрие), ко вторым – кишечная метаплазия и дисплазия (неоплазия) СО, свидетельствующие о развитии процесса в сторону злокачественного роста, но недостаточные для установления рака в настоящий момент. Первое понятие клиническое, ассоциированное с повышенным риском заболевания РЖ, в то время как второе – микроскопическая патология, участки, где рак развивается чаще, чем в нормальных тканях. По данным Л.И. Аруина (1998, 2004) и В.А. Исакова (2002), длительные наблюдения за пациентами с дисплазией и кишечной метаплазией эпителия желудка позволили предположить, что именно эти патологические изменения СО желудка существенно повышают риск развития злокачественного процесса. По мнению А.М. Нечипая (1987), риск развития РЖ связан с наличием диспластических изменений в метаплазированном эпителии. Диагностика таких очаговых структурных изменений СО желудка – одна из приоритетных задач современной эндоскопии. Обычное эндоскопическое исследование при освещении поверхности СО в белом световом режиме не позволяет точно дифференцировать и диагностировать предраковые состояния и изменения СО. Поэтому увеличительная хромоэндоскопия и узкоспектральная эндоскопия (как с увеличением изображения, так и без него) должны использоваться при обследовании пациентов этой группы, так как указанные методики улучшают диагностику подобных изменений СО желудка.
Выполнение биопсии чрезвычайно важно для правильной постановки диагноза при наличии предраковой патологии желудка. Как уже было сказано выше, при диагностике атрофического гастрита и кишечной метаплазии, согласно Модифицированной Сиднейской системы рекомендовано выполнять произвольную биопсию из 5 точек: 2 – из антрального отдела (3 см от привратника, по большой и по малой кривизне), одной – из области угла желудка и 2 – из тела желудка (по малой кривизне на 4 см проксимальнее угла желудка, и из середины большой кривизны тела желудка). Несмотря на то, что данный протокол взятия биопсии позволяет подтвердить наличие инфекции H. pylori и диагностировать хронический гастрит, количество биопсий, необходимых для правильного определения стадии предраковой патологии желудка, является спорным, поскольку чаще всего предраковые изменения имеют мультифокальный характер. Мультифокальная природа этих изменений влияет на их выявляемость, а от этого зависит тактика ведения и наблюдения пациентов. В литературе представлены пять доказательных исследований (Rugge M., 1991; Eriksson N.K., 2005; Guarner J., 2003; el-Zimaity H.M., 1999; de Vries A.C., 2010), проведенных на различных популяциях и посвященных количеству биопсий для точной диагностики гастрита и КМ, в которых рекомендуется выполнение различного количества биопсий – от 4 до 12. Значимость выполнения биопсии из области угла желудка в настоящее время остается спорной. Несмотря на то, что область угла желудка считается зоной повышенного риска развития атрофически – метапластической трансформации (Rugge M., 2003; Ricuarte O., 2005), в некоторых исследованиях (Eriksson N.K., 2005; Satoh K., 1998) сообщалось, что дополнительная биопсия из угла желудка дает мало информации к той, которая была получена при биопсии из тела и антрального отдела желудка. Вариабельность протоколов биопсии и полученных результатов зависят от распространенности предраковой патологии верхних отделов пищеварительного тракта в изучаемой популяции. Для точной диагностики предопухолевой и ранней опухолевой патологии в популяции с высоким риском развития РЖ необходимо меньшее количество точек биопсии по сравнению с популяциями, где этот риск ниже (Satoh K., 1998; You W.C., 1993; Dursun M., 2004).
На основании данных исследований в проекте Рекомендаций Российского эндоскопического общества для эндоскопистов, гастроэнтерологов, терапевтов, онкологов и хирургов «Принципы диагностики, лечения и наблюдения пациентов с предраковыми состояниями и изменениями желудка» рекомендовано, что следует выполнять биопсию, по крайней мере, из 2 точек в антральном отделе желудка (по большой и малой кривизне) и 2 точек в теле желудка (по большой или малой кривизне) для точного выявления пациентов с атрофией и/или кишечной метаплазии.
Кишечная метаплазия бывает полной и неполной. Полная метаплазия (синонимы: зрелая, тонкокишечная, метаплазия 1 типа) к предраковым изменениями не относится. Для неё характерны железистые, тубулярные образования, аналогичные строению тонкой кишки, а ямки идентичны кишечным криптам. При этом типе кишечной метаплазии определяется наличие в эпителии клеток Панета, желудочные мукоиды отсутствуют, тонкокишечный муцин содержится в бокаловидных клетках крипт.
Неполная кишечная метаплазия (синонимы: незрелая, толстокишечная, метаплазия 2 типа) обладает высокой вероятностью трансформации в РЖ (до 98%) и характеризуется появлением специализированного толстокишечного цилиндрического эпителия. При неполной метаплазии бокаловидные клетки расположены среди высоких призматических клеток, напоминающих колоноциты. Клетки Панета не выявляются.
Большое значение для гистологического диагноза имеет характер распространенности КМ в СО желудка, независимо от ее типа. В этих случаях важной становится оценка степени выраженности диспластических изменений метаплазированного эпителия. Дисплазия – диагноз исключительно морфологический. Основными гистологическим критериями дисплазии являются: клеточная атипия, которая характеризуется полиморфизмом ядер, нарушением полярности мукоцитов, псевдомногослойностью, дедифференцировкой эпителия без признаков инвазии в собственную пластинку СО (базальную мембрану).
Ранее было принято выделять три степени дисплазии: слабую, умеренную и тяжелую. Эти изменения представляют собой последовательные этапы трансформации клеток. Однако оставалась открытой дискуссия в отношении умеренной дисплазии. Эта степень не имеет четких разграничений между слабой и тяжелой дисплазией и диагностика ее достаточно субъективна.
В определенной мере эту проблему удалось решить путём введения новых понятий, прочно вошедших в практику за рубежом. Термин дисплазия СО желудка был заменён на «гастральную интраэпителиальную неоплазию»
– ГИН (GIN), которая подразделяется на две степени: ГИН-I (низкой степени) – куда относятся случаи лёгкой дисплазии, причем подавляющее большинство авторов в эту группу включают и умеренную дисплазию и ГИН-II (высокой степени), включающую тяжелую дисплазию и «carcinoma in situ».
Для ГИН-I характерно появление гиперхромии ядер, смещение ядерноцитоплазматического соотношения в эпителиальных клетках в сторону ядра. Выявляется псевдостратификация, тесное расположение групп желез («бок в бок»), ветвление, почкование желез. Этот диагноз ставится только при отсутствии активного воспаления в СО.
При ГИН-II отмечается большое количество мелких, округлых железистых структур, выстланных удлиненными клетками, утратившими способность к слизеобразованию. Изменения затрагивают поверхностный эпителий и железы собственной пластинки СО желудка. Ядра большей частью располагаются в базальных отделах клеток, нарастает полиморфизм ядер, усугубляется смещение ядерно-цитоплазматического соотношения в сторону ядра, оболочка ядер неравномерной толщины.
В случаях, когда вариабельность желез по форме и размеру сочетается с полным замещением эпителиальных клеток атипичными, полиморфными элементами с крупными гиперхромными ядрами, с большим количеством фигур деления, но при этом видны сохранность базальной мембраны, отсутствие инвазии в собственную пластинку, следует говорить о «carcinoma in situ» (Nishida T. et al., 2011).
8. БИОПСИЯ ПРИ ЗАБОЛЕВАНИЯХ ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ (ДПК)
8.1. Показания к выполнению биопсии из ДПК
Железодефицитная анемия неизвестного генеза независимо от возраста пациента.
Дефицит фолиевой кислоты: биопсия выполняется как из СО ДПК, так и из желудка.
Хроническая диарея: помимо биопсии из слизистой оболочки ДПК, биопсия производится из СО толстой и подвздошной кишки.
Подозрение на целиакию, даже если диагноз установлен на основании положительных антител. Множественная биопсия выполняется из Д1 и Д3 (отделы ДПК), т.к. атрофия ворсинок наиболее максимальна в дистальных отделах ДПК, а характерные изменения (увеличение количества лимфоцитов в клетках эпителия, гиперплазия крипт) чаще встречается в проксимальных отделах ДПК. Число биопсий, которые необходимо выполнить, как минимум, две, оптимально 4 фрагмента – по 2 из каждого отдела.
С целью оценки эффективности безглютеиновой диеты при целиакии через год после начала диеты.
При устойчивости симптоматики целиакии к лечению безглютеиновой диетой, с целью определения типа I или типа II (в данном случае необходимо запрашивать определение иммуномаркеров CD3 и CD8).
Подозрение на паразитарное поражение (лямблиоз, стронгилоидоз).
При подозрении на опухолевые образования ДПК.
При эндоскопической картине ворсинчатого образования биопсия необходима для выбора метода эндоскопического лечения или определения градации образования в контексте семейного аденоматозного полипоза.
В случае подозрения на болезнь Крона или хронического колита неизвестной этиологии необходимо выполнять биопсию из ДПК даже при отсутствии характерных гранулем.
8.2. Биопсия при некоторых заболеваниях двенадцатиперстной кишки
8.2.1. Воспалительные заболевания
8.2.1.1. Дуодениты и дуоденопатии
Различают острый и хронический дуоденит. Острый дуоденит в общей структуре дуоденитов встречается довольно редко (около 6% случаев), против 94% больных с явлениями хронического воспалительного процесса в ДПК. По аналогии с гастритом, дуоденит – это морфологическое понятие и его диагноз должен ставиться только после морфологического исследования (Логинов А. С. и соавт., 1993; Whitteheard R., 1990). На практике же обычно ограничиваются клинико-эндоскопическими данными, которые не совпадают с морфологическими на уровне 30% (Конорев М. Р., 2002).
Хронический дуоденит – длительно протекающее заболевание, характеризующееся развитием структурных изменений СО двенадцатиперстной кишки воспалительно-дистрофического, дисрегенераторного характера, приводящих к атрофии СО, и сопровождающееся нарушением основных функций ДПК (в первую очередь, пищеварительной). При эндоскопических заключениях рекомендуется использовать термин – дуоденопатия.
В отечественной литературе представлены современные классификации (Конорев М.Р., Литвяков А.М., Матвеенко М.Е., 2003) хронического дуоденита (представлены в таблицах 8-10).
Таблица 4. Этиологический раздел классификации хронического дуоденита
|
Тип |
Этиологические
|
Заболевания |
|
Кислотоассоциированный |
Ацидопептический |
Язва желудка и ДПК,
|
|
Токсический
|
Продукты азотистого обмена |
ХПН (терминальная
|
|
Лекарственный |
НПВП |
Заболевания, связанные с длительным приемом
|
|
Изолированный
|
Не установлены |
Не выявлены |
|
Особые формы | ||
|
Хеликобактерный |
H.Pylori |
Язва ДПК,
|
|
Гранулематозный |
Не установлены |
Болезнь Крона,
|
|
Узловой (нодулярный) |
Не установлены |
Болезнь Крона,
|
|
Ацидопептический |
Кислотоассоциированные
| |
|
Эозинофильный |
Не установленный
|
Эозинофильный
|
|
Лимфоцитарный |
Глютен (глиадиновая фракция) |
Целиакия (глютеновая
|
Таблица 5. Морфологический раздел классификации хронического дуоденита.
|
Морфологические термины |
Морфологическая
|
Локализация
|
|
Неспецифические |
Проксимальный и
| |
|
Активность |
Неатрофический | |
|
Воспаление | ||
|
Атрофия |
Атрофический | |
|
Специфические |
Особые формы |
Проксимальный |
|
Желудочная метаплазия,
|
Хеликобактерный | |
|
Лимфатические фолликулы |
Нодулярный |
Дистальный |
|
Желудочная гетеротопия | ||
|
Гранулемы |
Гранулематозный | |
|
Эозинофильная
|
Эозинофильный | |
|
Лимфоцитарная
|
Лимфоцитарный |
Дистальный |
Таблица 6. Эндоскопический раздел классификации хронического дуоденита
|
Эндоскопические термины |
Эндоскопическая характеристика |
Топографическая характеристика |
|
Гиперемия |
Эритематозный |
Проксимальный (бульбит)
|
|
Геморрагии |
Геморрагический | |
|
Атрофия |
Атрофический | |
|
Эрозии |
Эрозивный |
Диффузный (тотальный) |
|
Фолликулы |
Нодулярный
|
В тоже время следует придерживаться МСТ 3.0 ГАСТРОИНТЕСТИНАЛЬНОЙ ЭНДОСКОПИИ, которая рекомендует использовать в эндоскопическом заключении термины: дуоденопатия эрозивная, геморрагическая, эритематозная.
Наиболее часто хронический дуоденит поражает именно проксимальный отдел ДПК, ее луковицу (бульбит), а в дистальном направлении признаки воспаления обычно равномерно снижаются. Однако, если причинами воспаления являются патология системы желчевыводящих путей, поджелудочной железы или дистальные аномалии ДПК, то наблюдается главным образом постбульбарный дистальный дуоденит.
8.2.1.2. Поражение ДПК при инфекционных и системных заболеваниях
· Туберкулез кишечника (чаще поражает тонкую кишку, его дистальные отделы, ДПК – реже) обычно вторичный. Первичный туберкулез чаще возникает у детей и представляет собой типичный первичный туберкулезный комплекс – участок казеозного некроза с изъязвлением СО и регионарный лимфаденит. В 80-85% случаев первичный очаг излечивается самостоятельно с развитием рубца и кальциноза пораженных л/узлов, и только у 15-20% больных отмечается прогрессирование процесса. ДПК обычно вовлекается в специфический процесс одновременно с желудком и другими отделами тонкой кишки, но возможно и изолированное поражение (до 9% случаев). В пораженных участках кишки появляются специфические инфильтративноязвенные опухолевидные образования или множественные мелкие плотные узелки красного цвета (гранулемы), которые нагнаиваются и вскрываются с образованием кровоточащих сливающихся язв. Следует также отметить, что туберкулезное поражение органов гастродуоденальной зоны характеризуется как специфическим воспалением, так и неспецифическими проявлениями в виде дуоденита. Биопсия обязательна.
· Сифилитические заболевания ДПК представляют собой третичные формы сифилиса. Стенка кишки инфильтрирована, просвет может быть стенозирован. Гуммозные бляшки, располагаясь первоначально на слизистой оболочке кишки, могут распространяться на всю толщу стенки и вовлекать в процесс соседние ткани и органы. Гуммы могут быть одиночными и множественными, мелкими и крупными. При их распаде образуются глубокие язвы, которые могут осложняться пенетрацией и перфорацией. Биопсия обязательна.
· Кандидозный дуоденит. Диагноз устанавливается эндоскопически по характерным плотным желтовато-коричневым налетам на СО ДПК, плотно с ней спаянных, трещин и изъязвлений. Участки поражения могут быть единичными и множественными, иногда с явлениями некрозов и геморрагий. Подтверждение при гистологическом и цитологическом исследовании с выявлением мицелия и псевдомицелия, почкующихся клеток гриба.
· Болезнь Уиппла. Редкое системное иммунное заболевание с преимущественным поражением тонкой кишки инфекционной этиологии, вызываемое грамположительной бактерией Tropheryma whippelii. При болезни Уиппла ДПК поражается всегда. В течение заболевания выделяют 3 стадии:
1 – внекишечные симптомы (лихорадка, полиартрит);
2 – диарея, потеря массы тела, белковая недостаточность, нарушение всасывания питательных веществ (клиника мальабсорбции);
3 – системные проявления (неврологическая симптоматика, панкардит, полисерозит)
Характерной особенностью болезни Уиппла с локализацией в ДПК являются: выраженный отек всей стенки кишки при обострении процесса, деформация органа, иногда принимаемая за язвенную, сужение просвета, напоминающее опухолевое, вызывающее нарушение эвакуации, дуоденостаз. Эндоскопически можно видеть множественные желтые узелки в нисходящем отделе ДПК, при осмотре с близкого расстояния определяются застойные полнокровные ворсинки, также могут наблюдаться множественные диффузные белые бляшки, гиперемия, утолщение складок. Биопсия обязательна.
· Амилоидоз является системным, прогрессирующим заболеванием, характеризующимся нарушением белкового обмена и отложением белковых амилоидных структур в различных органах и тканях. Этиология не выяснена. Клиника поражения ДПК проявляется в основном диарейным синдромом. Нередко, при амилоидной инфильтрации сосудистых трактов СО, могут развиваться ишемические, некротические изменения в стенке ДПК с образованием эрозий и язв, осложняющихся кровотечением и прободением. Амилоидоз иногда протекает в типичной язвенно-подобной форме дуоденита и больного длительно ведут как больного с язвенной болезнью, опираясь на визуальную картину эрозивного поражения ДПК. При опухолевидной и стенозирующей формах могут наблюдаться симптомы частичной хронической дуоденальной непроходимости, развитие вторичного панкреатита. Диагноз подтверждается гистологическим исследованием биоптата, со специфическими гистологическими окрасками на амилоид (либо поляризационной микроскопией).
· Болезнь Крона (БК). Хроническое неспецифическое гранулематозное воспаление ЖКТ. Может поражать все отделы. Точная причина заболевания неизвестна. При БК чаще (70%) поражается терминальный отрезок подвздошной кишки. Литературные сведения о частоте поражения верхних отделов ЖКТ очень разнятся – от 1,4% (Киркин Б.В., 1989) до 71% (Cameron D.J., 1991). ДПК вовлекается в патологический процесс в 2 – 5% случаев (Василенко В.Х., Гребнев А.Л, 1981; Белоусов А.., Водолагин В.Д., Жаков В.П., 2002). Причем ДПК может поражаться изолированно (редко) или в сочетании с терминальным илеитом, колитом, или поражением желудка. Преимущественно поражаются нисходящий отдел, но процесс может захватывать и всю ДПК, включая луковицу. Дуоденальную локализацию БК следует подозревать всякий раз у пациентов с илеоцекальным поражением и развитием у них язвенноподобных изменений в ДПК. Макроскопически можно наблюдать множественные эрозии, афтоидные и щелевидные язвы, вид СО по типу «булыжная мостовая», деформацию ДПК, узелки, утолщенные складки и явления стеноза. На раннем этапе могут наблюдаться и мелкие афтоидные язвы с четкими краями на фоне неизмененной СО. Наиболее типичный признак БК – образование стриктур, суживающих просвет кишки за счет выраженного фиброза. В разных отделах и сегментах кишки можно одновременно определять различные этапы развития болезни (афты, линейные эрозии и стриктуры). Но такая классическая макроскопическая картина встречается далеко не всегда. Патогномоничным признаком служит обнаружение в морфологическом материале эпителиоидных гранулем, состоящих из гигантских и эпителиоидных многоядерных клеток Пирогова-Лангханса, напоминающих таковые при туберкулезе и саркоидозе. Однако в них не обнаруживается казеозного некроза в центре, гранулемы меньше размером, с нечеткими границами. Биопсия обязательна.
· Саркоидоз. Системное заболевание (болезнь Бенье-Бека-Шаумана), при котором поражаются многие органы и системы, характеризуется образованием в пораженных органах гранулем. Причина заболевания неизвестна. Саркоидоз – крайне редко встречающаяся форма поражения кишечника, сопровождающаяся вовлечением в патологический процесс лимфатических узлов, лимфоидной ткани кишки (лимфангиэктазии), образованием в стенке ДПК и других отделов тонкой кишки «штампованных» гранулем саркоидного типа, состоящих из эпителиоидных клеток, единичных гигантских клеток Пирогова-Лангханса (Tazi A. et al., 1991). Эндоскопически можно наблюдать отек, гиперемию СО, выраженное утолщение складок с множественными рассеянными эрозиями. Биопсия обязательна.
· Целиакия. Энтеропатия, поражающая тонкий кишечник у генетически предрасположенных детей и взрослых, проявляющаяся при употреблении пищи, содержащей глютен. Известна также под названием брюшная спру, глютен-чувствительная энтеропатия или нетропическая спру.
Основные симптомы заболевания: гастроинтестинальные симптомы (для взрослых – хроническая диарея, потеря веса, анемия, вздутие живота, утомляемость и недомогание; для детей – нарушение скорости роста, потеря веса, снижение весовых или ростовых пропорций, слабое телосложение, тошнота, диарея, рецидивирующие боли в животе, мышечная слабость, синдром раздраженной кишки, гипопротеинемия, возбудимость и дискомфорт), негастроинтестинальные симптомы (недостаточность железа/анемия, герпетиформный дерматит, периферическая нейропатия, дефицит фолиевой кислоты, снижение плотности костей, необъяснимое бесплодие).
Герпетиформные дерматиты (ГД) рассматриваются как кожные проявления глютеновой чувствительности у пациентов с целиакией, представляет собой тяжелую кожную болезнь с развитием выраженной зудящей сыпи и пузырей. Сыпь обычно возникает на локтях, коленях и ягодицах.
Целиакия возможна в случаях: необъяснимого дефицита фолиевой кислоты, железа или В12, снижения сывороточного альбумина, необъяснимой гипертрансаминаземии, остеопороза и остеомаляции, рецидивирующих болей в животе или вздутия живота, кожной сыпи.
Золотой стандарт в диагностике заболевания – эндоскопия с биопсией тонкого кишечника в сочетании с серологическими исследованиями. Хотя дуоденоскопия может предоставить данные для проведения морфологического исследования, сама она не является достаточно чувствительной для выявления всех проявлений целиакии в популяции.
Характерные эндоскопические находки включают:
• уменьшение высоты ворсинок СО ДПК;
• складки в виде гребешков, трещины и мозаичную картину СО;
• уплощенные складки;
• уменьшение размеров и/или исчезновение складок при максимальной инсуффляции.
Множественные биопсии берутся из второй или третьей части двенадцатиперстной кишки. Число биопсий, которые необходимо выполнить, как минимум, две, оптимально 4 фрагмента – по 2 из каждого отдела.
Гистологическая характеристика энтеропатии при целиакии.
Целиакия поражает СО проксимальной части тонкой кишки, тяжесть повреждения постепенно уменьшается по направлению к дистальной части тонкой кишки, хотя в некоторых случаях повреждение может распространяться и на подвздошную кишку. Степень проксимального поражения варьирует в значительной степени в зависимости от тяжести заболевания. Проксимальное поражение может быть очень умеренным при бессимптомных случаях заболевания с незначительными или даже гистологически не выявляемыми изменениями в средней части тощей кишки. В некоторых случаях могут иметь место изменения СО желудка и прямой кишки. Характерными гистологическими признаками являются: атрофия ворсинок, гиперплазия крипт, увеличение количества внутриэпителиальных лимфоцитов. Целиакия имеет свои морфологические критерии, предложенные M.N.Marsh в виде классификации повреждений тонкой кишки.
Стадия 0. Преинфильтративные изменения СО; у 5% пациентов с ГД
(герпетиформный дерматит) нет изменений СО тонкого кишечника.
Стадия I. Увеличенное количество интраэпителиальных лимфоцитов
(ИЭЛ) – более 30 на 100 энтероцитов.
Стадия II. Гиперплазия крипт, вдобавок к увеличению количества ИЭЛ увеличивается глубина крипт без уменьшения высоты ворсинок. Глютен может вызывать эти изменения, которые выявляются у 20% нелеченных пациентов с ГД и целиакией.
Стадия III. Атрофия ворсинок; А – частичная, В – субтотальная, С – тотальная. Так представлено классическое поражение, его находят у 40% с ГД и у 10-20% родственников первой степени больных целиакией.
Стадия IV. Тотальная атрофия ворсинок. Эти изменения могут рассматриваться в качестве конечной стадии повреждения у очень небольшой группы пациентов, которые нечувствительны к отмене глютена, у них могут развиться злокачественные осложнения. Могут присутствовать отложения коллагена в слизистой оболочке и в подслизистом слое.
Указанные изменения СО не патогномоничны для целиакии и могут возникать при различной патологии – при тяжелом лямблиозе, детской пищевой чувствительности, болезни трансплантат – против – хозяина, хронической ишемии тонкого кишечника, тропической спру, иммуноглобулиновой недостаточности и других иммунных дефицитах.
8.2.2 Опухолевые заболевания двенадцатиперстной кишки
Опухоли тонкой кишки и в частности ДПК встречаются намного реже, чем опухоли желудка и толстой кишки (Michelassi F. et al., 1989; Pyke C.M. et al., 1992; Gardiner G.W. et al., 1992). Среди всех доброкачественных и злокачественных опухолей ЖКТ на долю тонкой кишки приходится 2-3%, а среди опухолей кишечника только 3-6%. Злокачественные опухоли тонкой кишки преобладают над доброкачественными и составляют порядка 50-65% (Wilson
J.M. et al., 1974; Zollinger R.M.,1986), а частота колеблется на уровне 1% от всех случаев злокачественных опухолей ЖКТ. Однако карцинома в ДПК встречается в 10 раз чаще, чем в других отделах тонкой кишки (Логинов А.С., Парфенов А.И., 2000).
Гистологическая классификация опухолей тонкой кишки1 (ВОЗ, 2010)
Эпителиальные опухоли
Аденома 8140/02
Тубулярная 8211/0
Папиллярная (ворсинчатая) 8261/0
Тубулярно-папиллярная 8263/0
Интраэпителиальная неоплазия (дисплазия), ассоциированная с хроническими воспалительными заболеваниями
Интраэпителиальная железистая неоплазия низкой степени Интраэпителиальная железистая неоплазия высокой степени
Раковые опухоли
Аденокарцинома 8140/3
Муцинозная аденокарцинома 8480/3
Перстневидноклеточный рак 8490/3
Мелкоклеточный рак 8041/3
Плоскоклеточный рак 8070/3
Железистоплоскоклеточный рак 8560/3
Медуллярный рак 8510/3
Недифференцированный рак 8020/3
Карциноид (высокодифференцированная нейроэндокринная опухоль) 8240/3
Нейроэндокринные карциномы 8246/3
Гастрин-продуцирующая опухоль, функционирующая (гастринома) или нефункционирующая 8153/1
Соматостатин-продуцирующая опухоль 8156/3
Серотонин-продуцирующая опухоль 8241/3
Глюкагон-продуцирующая опухоль
Смешанная аденонейроэндокринная карцинома 8244/3
Ганглиоцитарная параганглиома 8683/0
Другие
Неэпителиальные опухоли:
Липома 8850/0
Лейомиома 8890/0
Гастроинтестинальная стромальная опухоль 8936/1
Лейомиосаркома 8890/3
Ангиосаркома 9120/3
Саркома Капоши 9140/3
Другие 9140/3
Злокачественные лимфомы
Иммунопролиферативная болезнь тонкого кишечника 9764/3
В-клеточная лимфома (MALT-лимфома) 9699/3
Лимфома из клеток зоны мантии (мантийноклеточная) 9673/3
Диффузная крупноклеточная В-клеточная лимфома 9680/3
Лимфома Беркитта 9687/3
Т-клеточная лимфома 9702/3
Другие
Вторичные опухоли
Полипы
Гиперпластический
Пейтц-Егерс
Ювенильные Классификация модифицирована по сравнению с предыдущей гистологической классификацией опухолей ВОЗ с учетом изменений в понимании природы поражений. В случае эндокринных новообразований классификация базируется на недавно принятой клинико-патологической классификации ВОЗ, но была упрощена для практической пользы в морфологической классификации.
Классификация модифицирована по сравнению с предыдущей гистологической классификацией опухолей ВОЗ с учетом изменений в понимании природы поражений. В случае эндокринных новообразований классификация базируется на недавно принятой клинико-патологической классификации ВОЗ, но была упрощена для практической пользы в морфологической классификации.
Морфологический код Международной классификации онкологических заболеваний (МКБ-О (ICD-O)) и систематизированной медицинской номенклатуры. Кодировка: /0
– доброкачественная опухоль; /1 – неустановленный характер опухоли: пограничная либо неопределенная; /3 – злокачественная опухоль. ИЭН (интраэпителиальная неоплазия) не имеет общего кода в МКБ-О. Коды МКБ доступны только для поражений, отнесенных к категории железистой интраэпителиальной неоплазии класса III (8148/2) и аденокарциномы in situ (8140/2).
8.2.2.1. Доброкачественные опухоли ДПК
Могут быть одиночными и множественными. Преимущественной локализации не выявлено. Текут бессимптомно. Клинические проявления при осложнениях (кровотечение, непроходимость).
Эпителиальные доброкачественные опухоли
· Аденома. Преимущественная локализация – в надсосочковой зоне. Чаще на широком основании. Имеют шаровидную, грибовидную или дольчатую форму. В 25% случаев являются множественными образованиями, часто встречаются при общем полипозе ЖКТ. Окраска более интенсивна, чем у окружающей СО. Имеют чётко отграниченное основание, которое впоследствии может трансформироваться в ножку. Высокий риск малигнизации (по данным литературы до 8%). Могут быть тубулярными, ворсинчатыми и тубулярно-ворсинчатыми. Наиболее часто встречаются тубулярные аденомы.
Так как полипы не имеют ни одного патогномоничного симптома, по которому можно было достоверно сказать, какую природу имеет то или иное образование биопсия обязательна, необходимо как минимум 2 кусочка из образования.
Подслизистые (неэпителиальные) доброкачественные опухоли
· Лейомиома. Составляют практически ¼ часть всех доброкачественных опухолей ДПК, источником развития являются гладкие мышцы стенки кишки. Представляют собой четко отграниченный узел плотной консистенции, окруженный слегка склерозированными тканями. Размеры могут быть самыми разнообразными, но при этом, даже достигая больших размеров, они могут не нарушать проходимости кишки. Иногда могут быть множественными в виде изолированных или сливающихся узлов. Обильно снабжены кровеносными сосудами. Нередко возникают нарушения микроциркуляции с образованием очагов некрозов и кист. При массивных очагах некрозов и расположении близко к слизистой оболочке могут осложняться кровотечением и перфорацией.
· Липома – зрелая опухоль из жировой ткани. Макроскопически характеризуется узловатой формой, реже бывает нечетко отграниченной. Микроскопически опухоль построена по типу обычной жировой ткани, обилие в некоторых липомах сосудов позволяет говорить об ангиолипомах.
· Невринома – редко встречающаяся доброкачественная опухоль ДПК, источником которой являются клетки оболочек нервных стволов. Наиболее распространенным вариантом является неврилеммома (шваннома). Опухоль обычно бывает одиночной и представляет узел, связанный с нервным стволом. Размеры неврином ДПК в описанных случаях обычно не превышают 6 – 8 см в диаметре, однако описаны случаи размером с головку новорожденного (Попов А.Ф и др., 1977). Масса может достигать 2,5 кг. В большинстве опухолей обнаруживаются так называемые тельца Верокаи – небольшие нежноволокнистые пространства, лишенные ядер, ограниченные правильно ориентированными клетками, расположенными в форме частокола. Характерно наличие в центральных отделах крупных сосудов, нередко ангиоматозно расширенных. Могут встречаться нейрофибромы.
· Гемангиома – является новообразованием, основную массу которого составляют мелкие сосуды капиллярного типа, расположенные в многоклеточной или фиброзной строме. Может сочетаться с поражением кожи лица, печени. Макроскопически выглядит как дольчатый узел, обычно располагается в подслизистом слое и выступают в просвет в виде полипа на широком основании. Часто служат источником кровотечения.
Биопсия при подслизистых образованиях неинформативна, выполнять только при наличии изъязвлений, предпочтительно выполнять эндоскопическую эндосонографию c тонкоигольной пункцией (EUS-FNA); при подозрении на гемангиома биопсия противопоказана. При наличии на поверхности опухоли язвы биопсию надо проводить через изъязвление или выполнять расширенную биопсию.
8.2.2.2. Злокачественные опухоли ДПК
Злокачественные опухоли ДПК являются относительно редкой патологией, на их долю приходится 0,3% всех опухолей ЖКТ и около 50% злокачественных новообразований тонкого кишечника. Опухоли ДПК не имеют специфических клинических проявлений, длительное время они могут протекать бессимптомно, что делает затруднительным раннюю диагностику заболевания.
· Рак ДПК, заболевание редкое, первичный рак составляет всего 0,30,5% среди всех опухолей ЖКТ и 33-45%, а по некоторым данным и 75%, от всех опухолей тонкой кишки (Пономарев А.А., Куликов В.П., 1996; Wilson
et al., 1974; Zollinger R.M.,1986). Преимущественно локализуется в нисходящей части, реже в нижней горизонтальной и крайне редко – в области верхней горизонтальной ветви ДПК. В нисходящей части различают супра-, инфраи периампулярное расположение. Последнее – наиболее частое и сложное для диагностики, т.к. не всегда удаётся дифференцировать от рака фатерова сосочка. Как правило, опухоль развивается из эпителия кишечных крипт и дуоденальных желез, чаще представлена аденокарциномой различной степени дифференцировки, реже удается выявить перстневидноклеточный рак, причем установить его источник не представляется возможным, т.к. зачастую он является следствием инвазии из дистальных отделов желудка. Очень трудно отличить от рака БДС, прорастания рака головки поджелудочной железы.
Рост раковой опухоли характеризуется:
распространением в проксимальном направлении;
частым изъязвлением (напоминающим хронические язвы), приводящим к профузным кровотечениям;
сравнительно медленным ростом, но частым и быстрым распространением на головку поджелудочной железы.
В равной степени часто встречается эндофитный и экзофитный рост опухоли.
Различают первичный и вторичный рак ДПК. Первичный рак исходит из стенки ДПК. Гистологически в 80% определяется аденокарцинома.
Классификация первичного рака ДПК:
I. Полипозная форма (экзофитный рак).
II. Инфильтративно-язвенная форма (эндофитный рак).
III. Скиррозно-стенозирующая форма (эндофитный рак).
Экзофитный рак встречается чаще, опухолевые узлы серо-красного цвета, часто с эрозиями или изъязвлением на вершине. Опухоль чётко отграничена от окружающей СО, инфильтрации нет. Может быть ригидной, но может быть и мягкой консистенции, легко распадающейся, кровоточащей.
Инфильтративно-язвенная форма – определяется неправильной формы плоский язвенный дефект ярко-красного цвета. Дно шероховатое, края часто с выступающими сосочками. При инструментальной пальпации – ригидность, лёгкая контактная кровоточивость.
Скиррозно-стенозирующая форма. Отмечается сужение просвета кишки, СО тусклая, бледная. Изменяется рельеф: поверхность неровная, узловатая, складки воздухом не расправляются. При инструментальной пальпации отмечается выраженная ригидность. Перистальтика отсутствует, контактная кровоточивость незначительная.
Вторичный рак ДПК исходит из соседних органов (прорастание из поджелудочной железы, фатерова сосочка, жёлчных протоков).
Выделяют 3 стадии распространения процесса.
I стадия – опухоль сращивается со стенкой кишки. Деформация просвета мало выражена (набухание, оттеснение стенки), СО подвижна, не изменена. Биопсия не информативна.
II стадия – опухоль прорастает стенку кишки без вовлечения СО. Стойкая деформация просвета, СО фиксирована, есть изменения воспалительного характера, эрозии. При биопсии – изменения воспалительного характера.
III стадия – имеется прорастание опухолью всех слоёв кишки. Деформация просвета стойкая, СО фиксирована, имеются разрастания опухолевой ткани. Есть свищи, и внутрипросветный рост опухоли. При биопсии – рак.
Диагноз достоверный при III степени, высокая достоверность при II
степени, при I степени эндоскопическая диагностика неэффективна.
· Саркома ДПК может иметь самое различное гистологическое строение: ретикулосаркома, лимфосаркома, круглоклеточная и полиморфноклеточная саркома, фибросаркома, нейросаркома, ангиосаркома и др. Может развиваться в субсерозном, интрамуральном или подслизистом слоях. Саркома, исходящая из подслизистого слоя, растет в просвет кишки и внешне напоминает полип. При интрамуральном распространении опухоль прорастает все слои стенки и циркулярно суживает ее. Исходящие из субсерозного слоя саркомы растут в свободную брюшную полость и могут достигать значительных размеров.
· Гастроинтестинальная стромальная опухоль. Относится к группе мезенхимальных сарком. Ключевое место в диагностике ГИСО занимает ИГХ исследование, основным отличием является экспрессия маркера CD117. Опухоль часто не имеет специфических симптомов и часто достигает больших размеров, без каких либо клинических проявлений, может диагностироваться случайно при скрининговых исследованиях. Реже эти новообразования манифестируют распадом (перфорацией опухоли, внутрибрюшным кровотечением или кишечной непроходимостью).
· Нейроэндокринные опухоли (НЭО). (см. также НЭО пищевода и желудка). НЭО ДПК по разным данным составляют от 5 до 22% всех НЭО ЖКТ, обычно протекают бессимптомно, чаще встречаются у мужчин (соотношение 1,5:1) в возрасте 50-60 лет. Возможные НЭО ДПК: гастриномы, соматостатиномы, серотонин-, гастринили кальцитонин-продуцирующие опухоли, нейроэндокринные карциномы и ганглиоцитарные параганглиомы. Наиболее часто (до 2/3 опухолей) встречаются дуоденальные гастриномы, ассоциированные с синдромом Золлингера-Эллисона (СЗЭ). Бывают как спорадическими, так и в рамках МЭН-1 (синдром множественной эндокринной неоплазии 1 типа), размером не более 1 см и локализуются обычно в верхних отделах двенадцатиперстной кишки. Имеют трабекулярное или железистое строение, дают положительную реакцию с гастрином, в рамках синдрома МЭН-1 бывают множественными. Несмотря на небольшие размеры образований и то, что они ограничены слизистым или подслизистым слоями, в момент постановки диагноза они часто выявляют метастазы в регионарные лимфатические узлы, которые могут быть крупнее, чем первичная опухоль, поэтому их иногда ошибочно принимают за первичные гастриномы поджелудочной железы и даже лимфатических узлов. Метастазы в регионарные лимфатические узлы дуоденальные гастриномы могут давать уже на ранних стадиях, а метастазы в печень – значительно позже.
Дуоденальные соматостатиномы составляют до 20% всех НЭО этой локализации, чаще встречаются в Фатеровом соске. Имеют железистое строение с наличием псаммомных телец, их клетки обычно дают положительную реакцию с соматостатином. При инвазии опухолью мышечной пластинки вероятность наличия метастазов в парадуоденальные лимфатические узлы очень велика. Опухоли обычно не дают специфического синдрома соматостатиномы (диабета, холелитиаза или диареи), но иногда ассоциированы с нейрофиброматозом 1 типа и с билатеральными феохромоцитомами.
Нефункционирующие дуоденальные НЭО обычно состоят из серотонин-, реже – из гастрини кальцитонин-продуцирующих клеток. Для них прогноз лучше, чем для СЗЭ-ассоциированных гастрином или соматостатином Фатерова соска. Если опухоли не прорастают подслизистый слой, они обычно не дают метастазов.
Нейроэндокринные карциномы ДПК обычно гормонально не активны и чаще возникают в области Фатерова соска. Это мелкоклеточные карциномы из недифференцированных клеток, которые в момент постановки диагноза уже обычно метастазируют в регионарные лимфатические узлы и печень, дают интенсивную реакцию с синаптофизином и очень слабую или отрицательную – с хромогранином А.
Дуоденальные ганглиоцитарные параганглиомы локализуются вблизи Фатерова соска и обычно доброкачественные, даже если они по размеру превышают 2 см и прорастают мышечную пластинку. Состоят из ганглиоцитарных и высокодифференцированных нейроэндокринных клеток, которые дают положительную реакцию с соматостатином, панкреатическим полипептидом и протеином S100.
Чаще встречаются опухоли небольших размеров (менее 2-х см). Большинство НЭО ДПК являются нефункционирующими. Низкодифференцированные НЭК ДПК встречаются редко и обычно имеют более крупные размеры (2-4 см). Опухоль, как правило, четко отграничена от окружающих тканей, располагается в подслизистой основе. Чаще бывает одиночной, редко множественной, имеет плотную консистенцию. Сверху опухоль покрыта неизмененной СО. При озлокачествлении возможно изъязвление СО, нередко наблюдается кровотечение или стеноз ДПК с явлениями частичной или полной высокой кишечной непроходимости.
· Саркома Капоши. Злокачественная опухоль с многоочаговым характером роста исходящая из кровеносных и лимфатических сосудов. Причинным фактором является вирус герпеса человека VIII типа, а важнейшим механизмом развития является нарушение противоопухолевого иммунитета.
Чаще всего болезнь проявляется новообразованиями кожи, но способна затрагивать слизистые оболочки, лимфатическую систему и внутренние органы (прежде всего, легкие и ЖКТ). Выделяют четыре клинические формы саркомы Капоши: классическая (европейская), иммуносупрессивная, эндемическая (африканская) и эпидемическая (ассоциированная со СПИДом). Обычно у опухоли пурпурная окраска, но иногда цвет имеет различные оттенки: красный, фиолетовый или бурый. Опухоль может быть плоской или слегка возвышаться над кожей, представляет собой безболезненные пятна или узелки. Саркома Капоши часто сочетается с повреждением слизистой неба, лимфоузлов. Течение заболевания медленное. Обнаружение саркомы Капоши при ВИЧ-инфекции дает основание для постановки диагноза СПИД. Саркома мягких тканей характеризуется малосимптомным течением и сходством клинической картины с доброкачественными опухолями и неопухолевыми заболеваниями. Гистологическая структура опухоли характеризуется множеством хаотично расположенных тонкостенных новообразованных сосудов и пучков веретенообразных клеток. Характерна инфильтрация опухоли лимфоцитами и макрофагами. Сосудистый характер резко увеличивает риск кровотечений. Часто в опухолевых узлах развивается некроз. При распаде опухолевого инфильтрата образуются ограниченные язвы, осложняющиеся кровотечением или перфорацией. В некоторых руководствах отмечено, что биопсию при данной патологии делать необязательно, так как диагноз можно поставить и без морфологического исследования, на основании клинической картины заболевания, а лечение неэффективно.
· Лимфогранулематоз (болезнь Ходжкина, злокачественная гранулема) – злокачественное заболевание лимфоидной ткани, характерным признаком которой является наличие гигантских клеток Березовского-Штернберга и клеток Ходжкина. ЛГМ ЖКТ чаще носит вторичный характер в результате распространения процесса с пораженных л/у, однако в ряде случаев, встречается первичное поражение, при котором опухолевые поражения вначале располагаются на месте лимфоидных фолликулов.
· Неходжкинская лимфома – группа более чем из 30 родственных заболеваний. Лимфома ДПК развиваются из лимфоидной ткани подслизистого слоя, прорастая в слизистую оболочку с образованием язв. Характеризуется местным инвазивным ростом, метастазирует в регионарные и внебрюшинные лимфоузлы, селезенку и печень.
При подозрении на злокачественное поражение ДПК биопсия обязательна. Обычно достаточно 4-х кусочков.
8.2.2.3. Опухолеподобные образования
Гиперплазиогенный полип. Могут быть на широком основании («сидячие») или на ножке. Чаще единичные, иногда множественные. Большинство менее 1 см в диаметре. Малые полипы морфологически должны дифференцироваться от фовеолярной гиперплазии. Мелкие поражения имеют гладкую, куполообразную поверхность. На больших полипах обычно появляются эрозии.
Гамартомы двенадцатиперстной кишки.
Это опухолевидные образования, развивающиеся из очагов аномально построенных тканей эмбрионального генеза, образовавшихся в результате нарушений эмбрионального развития органов и тканей, характеризующихся неправильным соотношением тканей в тех или иных анатомических структурах или сохранением (появлением) зародышевых образований, отсутствующих во взрослом организме (Логинов А.С., Парфенов А.И., 2000). Для гамартом характерно как нарушение структуры ткани органа, так и степени дифференцировки. В ряде случаев возможна малигнизация гамартом – до 1% от всех злокачественных опухолей ЖКТ. К гамартомам ДПК относятся:
· Синдром Пейтца-Егерса-Турена – кроме диффузного полипоза толстой кишки при этом заболевании может обнаруживаться и полипоз тощей, подвздошной, а также ДПК. По форме полипы могут быть плоскими, высокими, иметь различные размеры и поверхность (неровную, дольчатую). Гистологически полипы отличаются от аденом аномальным расположением перестроенных желез, как бы «прорывающихся» через мышечную пластинку СО. На самом деле имеет место неправильное расположение мышечного пласта мышечной пластинки СО. Этиология и патогенез неизвестны.
· Синдром Кронкайт-Канада характеризуется диффузным полипозом с поражением желудка и толстой кишки, реже (у 1/3 пациентов) поражается и ДПК. В состав синдрома, кроме полипоза, входят экссудативная энтеропатия с развитием мальабсорбции, гипопротеинемия, нарушение минерального обмена, полипозные изменения кожи, тотальная алопеция, изменения ногтей, диффузная гиперпигментация кожи. Данная патология относится к врожденным аномалиям, наследуемым по аутосомно-доминантному типу. Морфологическая картина напоминает аденоматозные полипы, характерно наличие кистозно-измененных желез (ретенционные кисты), мышечная пластинка СО утолщена, отечна, с участками воспалительной инфильтрации.
· Синдром Гарднера – доминантно-наследуемое заболевание, для которого характерны синдром соединительнотканной дисплазии, склонность к малигнизации (развитие аденокарциномы) после 10 – 15 летнего анамнеза заболевания. Полипоз очень часто локализуется в ДПК, а также сопровождается параллельным сопутствующим опухолевым поражением мягких тканей и костей (особенно черепа, лица), доброкачественными неэпителиальными опухолями (остеомы, атеромы, фибромы, дермоидные кисты, липомы).
· Ювенильный полипоз – полипоз тонкой и толстой кишки, сопутствующими аномалиями ротации и фиксации кишечника, врожденными пороками сердца, порфирией и другими врожденными аномалиями. Макроскопически полипы имеют типичный вид, чаще – на ножке, но могут иметь и широкое основание. Большие полипы приобретают дольчатое строение, напоминая папиллярные опухоли. Крупные полипы нередко малигнизируются (около 21%) (Логинов А.С., Парфенов А.И., 2000).
· Генерализованный нейрофиброматоз Реклингхаузена – системное заболевание, наследуемое по аутосомно-доминантному типу, характеризуется наличием на коже множественных пятен цвета «кофе с молоком», кожных опухолей и новообразований по ходу нервных стволов. Поражение ЖКТ характеризуется наличие нейрофибром в желудке, ДПК, брыжейке кишки и других отделов ЖКТ. Макроскопически небольшие опухолевые узлы располагаются ближе к серозной оболочке. Микроскопически нейрофибромы имеют строение, идентичное солитарным нейрофибромам, но с более выраженным фиброзом (Пономарев А.А, Куликов Е.П., 1996). Малигнизируются редко.
· Гамартома дуоденальных желез (аденома желез Бруннера, гиперплазия желез Бруннера) – гиперпластический пролиферативный патологический процесс (разрастание дуоденальных желез), имеющий макроскопическую картину полипа ДПК. Описаны две основные формы опухоли: диффузная гиперпластическая и узловая. Наиболее распространена первая форма. Опухоль располагается в подслизистом слое и имеет небольшие размеры (в пределах 6 мм). Чаще располагается в области передней стенки ДПК, не имеет ножки и капсулы, четко отграничена от окружающих тканей. Микроскопически опухоль состоит из хорошо дифференцированных бруннеровых желез с сильно выраженным разделением соединительнотканными прослойками на дольки разных форм и размеров, чаще округлых или овальных. Дольки состоят из типичных слизеобразующих клеток с базально расположенным ядром. СО кишки над опухолью обычно имеет признаки атрофии. Малигнизация наблюдается редко.
8.2.2.4. Опухоли большого дуоденального сосочка (БДС)
Опухоли БДС, как и опухоли ДПК, разделяют на эпителиальные и неэпителиальные, злокачественные и доброкачественные. Наиболее полная классификация опухолей области БДС предложена А.И.Едемским (1987). В упрощенном варианте, рекомендуемом А.А.Будзинским и М.А.Иванцовой (2002), все опухоли и опухолеподобные состояния БДС предложено делить на гиперпластические изменения, являющиеся обратимыми, и эпителиальные опухоли – аденомы (тубулярные, ворсинчатые, смешанные) и карциному БДС.
· Доброкачественные опухоли БДС
К доброкачественным эпителиальным опухолям БДС относятся папилломы и аденомы; к неэпителиальным – липомы, фибромы, нейрофибромы, лейомиомы и другие гиперпластические процессы тканей БДС. Наиболее часто встречаются папилломы БДС. Считается, что наиболее часто папилломатоз БДС наблюдается на фоне длительно предшествующего дистального или тотального дуоденита, папиллита, хронического холецистита, желчнокаменной болезни. Чаще наблюдаются при раздельном впадении в ДПК холедоха и вирсунгова протока, без образования ампулы фатерова сосочка (Медведева М.С., 1979). Макроскопически папилломатоз БДС характеризуется сосочковыми разрастаниями в устье протоков сосочка. Разрастания мелкие, ярко-розового или серо-красного цвета, заполняют отверстия протоков, выступая в просвет кишки. Папилломы имеют тонкие ножки, связанные со слизистой оболочкой БДС. Микроскопически состоят из фиброзно-эпителиальных и железистых элементов. Полипы покрыты высоким однорядным призматическим эпителием со светлой, слабо эозинофильной цитоплазмой и базально расположенными ядрами. В эпителии папиллом обнаруживаются бокаловидные клетки и эндокриноциты. Нередко имеются участки метаплазии в многослойный плоский эпителий.
Аденома БДС встречается несколько реже папилломатоза. Макроскопически аденома представляет собой солитарный узел или полиповидное образование, заполняющее ампулу фатерова сосочка и выступающее в просвет ДПК. Размеры опухоли чаще в пределах 1-2 см. Микроскопически аденома БДС образована эпителием, напоминающим нормальный эпителий, покрывающий БДС и ДПК, но приобретает черты атипии: клетки и ядра имеют большие размеры, ядра отличаются гиперхромностью, сильно вытянуты и расположены в клетках более хаотично, чем в папилломах. Аденомы могут малигнизироваться, индекс малигнизации колеблется в пределах 12-23% (А.А.Будзинский, М.А.Иванцова, 2002).
Иногда в просвете ампулы БДС или в области дистальных отделов желчного и панкреатического протоков возможно развитие гиперпластических интрапапиллярных полипов. Считается, что их возникновение связано с явлениями хронического воспаления (папиллит). Макрои микроскопические данные полипы идентичны таковым при папилломатозе устьев протоков, отличаются только расположением.
Ряд авторов к доброкачественным образованиям зоны БДС относят и железисто-кистозную гиперплазию переходной складки (Краевский Н.А. и др., 1993; Пономарев А.А. и др., 2000). Это довольно часто встречающаяся патология, при которой в зоне БДС образуются гроздевидные скопления, иногда полностью прикрывающие устье сосочка. В большинстве случаев заболевание течет бессимптомно и обнаруживается случайно при дуоденоскопии. Микроскопически данное образование представлено гиперплазированными и кистозно-расширенными железами СО переходной складки ДПК.
Аденомиоз сосочка – опухолеподобный пролиферат гиперпластического происхождения. Макроскопически фатеров сосочек при этом поражении имеет шаровидную форму, достигая до 1,5 см в диаметре. Ткань сосочка плотная, устье практически не определяется. Микроскопически выделяют три формы, которые последовательно сменяют друг друга при прогрессировании процесса: узловая, узловато-диффузная и диффузная. В целом аденомиоз относится к опухолевым образованиям больше за счет макроскопической и клинической картины, чем за счет морфологии.
Клиническая картина доброкачественных новообразований БДС одинакова и зависит на ранних стадиях процесса не столько от гистологического строения опухоли, сколько от степени нарушения отделения желчи и панкреатического секрета, нарушения функции сфинктера Одди.
Диагностика всех доброкачественных новообразований БДС основывается на клинической картине, данных рентгенологического и эндоскопического исследований. При дуоденоскопии должно быть взято за правило всегда осматривать зону фатерова сосочка. Дифференциальный диагноз проводится между доброкачественными и злокачественными поражениями, поэтому биопсия является обязательным звеном в диагностике заболевания. Частота верификации процесса при дифференциации аденомы и рака БДС на уровне 40 – 60% , даже при прицельной биопсии новообразования (Yamaguchi K. et al., 1990; Seifert E. et al., 1992).
· Злокачественные опухоли БДС
Злокачественные новообразования БДС, в отличие от рака самой ДПК, являются более часто встречающейся патологией дуоденальной зоны. В целом на долю злокачественных процессов в области БДС приходится 0,5 – 1,6% от всех злокачественных опухолей и более 3% от опухолей ЖКТ (Блохин Н.Н и др., 1982; Шалимов С.А., 1985, Белоусов А.С. и др., 2002, Frasali D. et al. 1990). Злокачественные новообразования БДС могут исходить из эпителия дистальных отделов холедоха и панкреатического протока, слизистой оболочки БДС, эпителия стенки ДПК в области сосочка. Иногда очень трудно установить первоначальное происхождение опухоли, что подчас имеет чисто академический интерес, так как все злокачественные опухоли этой зоны текут однотипно.
Макроскопически выделяют три формы рака БДС: полипозную, инфильтративную и язвенную (Tasaka K., 1977). Обычно опухоль небольших размеров (до 1,5 см) имеет ножку. Процесс длительно не выходит за пределы сосочка. Полипозная форма может приводить к обтурации просвета сосочка, а инфильтративная к его стенозу. Кроме того опухоль может инфильтрировать стенку ДПК. Для этой формы характерно отсутствие изменений СО над опухолью, поэтому биопсия может не дать результатов.
Поражение ДПК опухолевым процессом может привести к ее выраженной деформации, развитию вторичной динамической непроходимости – дуоденостазу, а изъязвление – к кровотечению.
9. ЯЗВЕННАЯ БОЛЕЗНЬ И ЯЗВЕННЫЕ ПОРАЖЕНИЯ ЖЕЛУДКА И ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ
Язвенная болезнь – заболевание с многофакторной этиологией и сложным патогенезом. В основе патологического процесса лежит воспаление СО гастродуоденальной зоны с формированием локального повреждения, морфологическим эквивалентом которого является дефект слизистой и подслизистой оболочки с исходом в соединительнотканный рубец.
Язвенная болезнь (в зарубежной литературе принят термин «хроническая пептическая язва желудка и ДПК») – это хроническое рецидивирующее заболевание, протекающее с чередованием периодов обострения и ремиссии, при котором в результате нарушения нервных и гуморальных механизмов, регулирующих секреторно-трофические процессы, под воздействием соляной кислоты и пепсина в желудке и ДПК образуются язвы.
Этиология язвенной болезни в настоящее время изучена достаточно хорошо. Раньше основными факторами развития заболевания считались соляная кислота и пепсин, но недавние исследования показали важнейшую роль Helicobacter pylori. Инфекционный процесс, вызванный этими микроорганизмами, является также фактором риска возникновения РЖ и некоторых типов лимфом желудка. В норме этим агрессивным факторам противостоят защитные механизмы СО желудка и ДПК, такие как слизь, бикарбонаты, простагландины, при нарушении синтеза которых возникает язва.
Общепринятой классификации ЯБ не существует. Прежде всего, в зависимости от наличия или отсутствия инфекции НР выделяют ЯБ, ассоциированную и не ассоциированную с инфекцией НР. Также различают ЯБ как самостоятельное заболевание и симптоматические язвы желудка и ДПК (лекарственные, «стрессовые», при эндокринной патологии, при некоторых хронических заболеваниях внутренних органов), которые возникают на фоне других заболеваний и по механизмам своего развития связаны с особыми этиологическими и патогенетическими факторами.
В зависимости от локализации выделяют язвы желудка (кардиального и субкардиального отделов, тела желудка, антрального отдела, пилорического канала), ДПК (луковицы, постбульбарного отдела), а также сочетанные язвы желудка и ДПК. При этом язвы могут располагаться на малой или большой кривизне, передней и задней стенках желудка и двенадцатиперстной кишки. По числу язвенных поражений различают одиночные и множественные язвы, а в зависимости от размеров язвенного дефекта – язвы малых (до 0,5 см в диаметре) и средних (0,6-1,9 см в диаметре) размеров, большие (2,0-3,0 см в диаметре) и гигантские (свыше 3,0 см в диаметре) язвы.
В диагнозе отмечаются стадия течения заболевания: обострения, рубцевания (эндоскопически подтвержденная стадия «красного» и «белого» рубца) и ремиссии, а также имеющаяся рубцово-язвенная деформация желудка и ДПК (В.Т.Ивашкин, А.А.Шептулин, Е.К.Баранская, А.С.Трухманов, 2013).
Язвенную болезнь необходимо дифференцировать с симптоматическими язвами, патогенез которых связан с определёнными фоновыми заболеваниями или конкретными этиологическими факторами – прием лекарственных средств (НПВС, глюкокортикоиды, антиагреганты, бисфосфонаты, антибиотики), длительная частая ишемия стенки желудка и ДПК, саркоидоз, болезнь Крона, идиопатическое гиперсекреторное состояние, ожоги и стресс, лучевое и химиотерапевтическое лечение в онкологии, бактериально-вирусные причины (цитомегаловирус, вирус простого герпеса и др.), а также с опухолевыми поражениями.
Симптоматические, особенно лекарственные, язвы чаще всего развиваются остро, проявляясь иногда желудочно-кишечным кровотечением или перфорацией. Клиническая картина обострения этих язв стёрта, отсутствует сезонность и периодичность заболевания.
Гастродуоденальные язвы при синдроме Золлингера-Эллисона отличаются крайне тяжёлым течением, множественной локализацией, упорной диареей. При обследовании таких больных выявляется резко повышенный уровень желудочной секреции (особенно базальной), содержание гастрина в сыворотке крови в 3-4 раза превышает норму. В диагностике синдрома Золлингера-Эллисона важное значение имеют провокационные тесты (с секретином, глюкагоном), ультразвуковое исследование поджелудочной железы.
Для гастродуоденальных язв у больных гиперпаратиреозом, помимо тяжёлого течения с частыми рецидивами и склонностью к кровотечению и перфорации, характерны признаки повышенной функции паращитовидных желёз: мышечная слабость, боли в костях, чувство жажды, полиурия. Диагноз ставится на основании изучения содержания кальция и фосфора в сыворотке крови, наличия гипертиреоидной остеодистрофии, характерных признаков поражения почек и неврологических расстройств.
Учитывая то, что для язв различного происхождения нет патогномоничных симптомов, по которым можно было бы однозначно судить о природе язвы, о характере, который имеет язва – доброкачественный или злокачественный, проведение биопсии обязательно. Особенно это касается язв желудка. Необходимо взятие не менее 4-6 биоптатов с краев язвы в зависимости от ее размеров (при гигантских язвах не менее 8-10). Биопсия из дна, малоинформативна, особенно при обильных гнойно-некротических налетах. Что касается язв ДПК, расположенных в луковице, биопсия при типичной картине необязательна (учитывая то, что первичный рак в зоне луковице наблюдается крайне редко), при наличии же язвы в постбульбарных отделах кишки и при подозрении на болезнь Крона, туберкулез, сифилис биопсия обязательна – не менее 3-4 кусочков.
10. ДИАГНОСТИКА HELICOBACTER PYLORI
В настоящее время установлено, что бактерия Helicobacter pylori является причиной развития хеликобактерного хронического гастрита, важнейшим фактором патогенеза язвенной болезни ДПК и желудка, лимфомы желудка низкой степени злокачественности (мальт-лимфомы), а также РЖ. Лечение ряда заболеваний гастродуоденальной зоны включает в себя в качестве обязательного компонента проведение эрадикационной терапии в случае обнаружения у больных в СО желудка HР.
С момента открытия НР было разработано большое количество методов диагностики, позволяющих выявлять и идентифицировать этот микроорганизм. Развитие и усовершенствование этих методов помогло в получении ценной информации об эпидемиологии хеликобактериоза, сыграло большую роль в понимании патогенеза этой инфекции. Тем не менее, ни один из существующих методов диагностики НР-инфекции не универсален. Пределы возможностей этих методов могут быть ограничены не только их чувствительностью, но, зачастую зависят от возраста пациента, его индивидуальных особенностей, стадии заболевания, а также индивидуальных особенностей течения инфекции.
Все существующие на сегодняшний день методы лабораторного определения НРинфекции делятся на две большие группы: инвазивные методы и неинвазивные.
Таблица 7. Методы лабораторной диагностики Helicobacter pylori инфекции
|
Инвазивные методы |
Неинвазивные методы |
|
Бактериологический метод Гистологический метод Быстрый уреазный тест Молекулярно-биологический метод (ПЦР в биоптате) Фазово-контрастная микроскопия |
Серологический метод Молекулярно-биологический метод (ПЦР в кале, слюне) Уреазный дыхательный тест ИФА в кале |
Все инвазивные методы диагностики НР-инфекции предусматривают проведение эндоскопического исследования с взятием биопсийного материала. Неинвазивные методы включают в себя различного рода иммунологические исследования, позволяющие определять наличие антител в сыворотке крови или бактериального антигена в фекалиях, ПЦР исследование на НР с определением ДНК Н.pylori в фекалиях и уреазный дыхательный тест на НР с С13 или С14 меченым атомом углерода.
Принципиальное значение для практики имеет проведение диагностики Н.pylori-инфекции до лечения – первичная диагностика, и после проведения противохеликобактерной терапии – контроль эффективности выбранной схемы лечения.
В международной практике наиболее значимыми (референсными) методами диагностики инфекции НР служат дыхательный тест с мочевиной, меченной 13С и определение антигена НР в кале. В силу малой доступности этих методов диагностики для первичного диагноза целесообразно применять любую методику, которая имеется в распоряжении врача. Необходимо учитывать, что лечение ингибиторами протонной помпы может привести к ложноотрицательным результатам диагностических тестов. Поэтому рекомендуется отменить ингибиторы не менее чем на 2 недели до проведения диагностики инфекции НР. Серологические методы исследования антитела к НР могут быть назначены в качестве первичной диагностики инфекции, в том числе после недавнего приема антисекреторных или антибактериальных лекарственных средств (Ивашкин В.Т., Лапина Т.Л., 2013).
Диагностика успешности эрадикационной терапии НР должна осуществляться не ранее, чем через 4 недели после окончания курса антихеликобактерной терапии, либо после окончания лечения любыми антибиотиками или антисекреторными средствами сопутствующих заболеваний. Серологические методы определения антител к НР в этой ситуации неприменимы. В случае отсутствия референсных методов диагностики целесообразно комбинировать доступные диагностические тесты или, при применении методов непосредственного обнаружения бактерии в биоптате СО желудка (бактериологический, морфологический, быстрый уреазный тест), необходимо исследование хотя бы 2-х биоптатов из тела желудка и 1-го биоптата из антрального отдела желудка (Ивашкин В.Т., Лапина Т.Л., 2013).
Если говорить о тенденциях в развитии методов диагностики, то в последние годы произошел сдвиг в сторону неинвазивных методов, где достигнут наибольший прогресс.
Характеристика некоторых методов диагностики НР – инфекции
1. Бактериологический метод: посев биоптата СО желудка или двенадцатиперстной кишки на дифференциально-диагностическую среду с целью выделения чистой культуры НР. Это единственный метод исследования, обладающий 100% специфичностью.
Недостатки метода: необходимость специального оборудования лаборатории и реактивов, специальных питательных сред, а также обученных специалистов, что влечет за собой большие материальные затраты; результаты исследования отсрочены от момента взятия биопсийного материала от 3 до 7 дней; инвазивность (необходимо проведение ЭГДС с взятием биопсийного материала).
Правила взятия и доставки биопсийного материала:
Для бактериологического исследования необходимо взятие не менее двух биопсийных образцов из тела и антрального отдела желудка. Оптимальным считается взятие 3-х биопсийных образцов. Обычно фрагменты СО желудка берутся из антрального отдела желудка по вершинам воображаемого равностороннего треугольника с привратником в центре, на расстоянии 2-4 см от него; из тела желудка по большой и малой кривизне и из свода желудка.
Поскольку Н.pylori – микроаэрофил и очень чувствителен к условиям внешней среды (при избытке кислорода быстро погибает), необходимо строго соблюдать правила транспортировки биопсийного материала на бактериологическое исследование для того, чтобы сохранить этот микроорганизм в жизнеспособном состоянии. Лучшей, в настоящее время, для транспортировки биопсийных образцов признана Pylori-среда (BioMerioux, Франция), которая способна стабильно поддерживать жизнеспособность Н.pylori в биопсийном материале до 2-х суток.
2. Гистологический метод – «золотой стандарт» диагностики НР инфекции, так как позволяет обнаружить возбудителя этой инфекции, определить положение бактериальных тел в слизи, покрывающей СО желудка, наблюдать взаимоотношение НР с апикальной мембраной эпителиоцитов, а также определить пути взаимодействия микроба с тканями макроорганизма.
Его специфичность составляет 81 – 97%, а чувствительность – 80 – 90%. Это прямой метод диагностики H. pylori, для которого используют окраски акридиновым оранжевым, по Гимзе, Граму, толуидиновым синим, серебрением по Вартину – Старри и др., он позволяет не только с высокой степенью надежности выявить наличие НР, но и количественно определить степень обсеменения. Наиболее чувствительными оказались окраски: акридиновым оранжевым (85%) и по Гимзе (79%); несколько меньше – по Грамму (72%) и серебрением по Warth-in-Starry (67%) (Simor A.E. и соавт., 1990).
Взятие биопсийного материала производится из мест с максимально выраженной гиперемией и отеком. Взятие материала из дна язв и эрозий, а также из их краев, является ошибкой, поскольку в них нет эпителиальных клеток, обладающих свойствами, необходимыми для адгезии и колонизации НР. Поскольку бактерии НР могут быть разбросаны по СО в виде очагов, то для повышения чувствительности метода биоптаты целесообразно брать из разных частей желудка. Гистологический метод позволяет также, и оценить состояние СО желудка.
Оценка биопсийных образцов проводится в соответствии с Сиднейской классификацией (1990 г.). НР определяются в виде мелких слегка извитых палочек, находящихся в просвете желудка в непосредственной близости от собственной пластинки СОЖ и на поверхности эпителиальных клеток.
Выделяют 3 степени обсемененности Н.pylori:
1. слабая (+) – до 20 микробных тел в поле зрения;
2. средняя (+) – до 50 микробных тел в поле зрения;
3. высокая (+++) – более 50 микробных тел в поле зрения. Гистологическое исследование имеет ряд преимуществ: широкая доступность, удобство хранения и транспортировки препаратов и возможность оценки в любое время любым специалистом, который легко может проводить ретроспективный анализ. Гистологический метод позволяет оценить любую из форм повреждения СОЖ.
3. Уреазный дыхательный тест – определение в выдыхаемом больным воздухе изотопов 13С или 14С; они выделяются в результате расщепления в желудке больного меченой мочевины под действием уреазы НР до НСО3Ї и NH4+. Из НСО3Ї образуется СО2, который попадая в кровоток, затем транспортируется в легкие.
В развитых странах в последние годы стандартным методом контроля за эрадикацией стал именно этот тест.
4. Быстрый уреазный тест: определение уреазный активности в биоптате СО желудка или ДПК путем помещения его в жидкую гелеобразную среду, содержащую субстрат, буфер и индикатор.
К недостаткам теста относится его инвазивность, получение ложноотрицательных (при малом количестве микробных тел) или ложноположительных (контаминирование материала другими уреазопродуцентами) результатов.
5. Молекулярно-биологический метод (ПЦР-исследование)
Метод предназначен для качественного обнаружения ДНК H.pylori в биологических образцах (биоптаты антрального отдела желудка, биоптаты ДПК, биоптаты десен, мазки из зубодесневого кармана, слюна.). Позволяет оценить генотипические и фенотипические характеристики возбудителя. Почти у каждого пациента имеется уникальный штамм HР. Выявлено, что вирулентность НР во многом обусловливает клинические проявления инфекции. Существует ряд генов, продукты которых – белки Cag A, Vac A, Ice A, Bab A – полагают факторами патогенности. В зависимости от их наличия выделяют два типа штаммов НР. Экспрессирующие Cag Aи Vac A-токсин относятся к первому типу, штаммы второго типа не экспрессируют указанные гены и считаются менее патогенными. Среди большого многообразия гибридизационных методов анализа ДНК, метод ПЦР наиболее широко используется в клинической лабораторной диагностике. В основе метода ПЦР лежит природный процесс – комплементарное достраивание ДНК матрицы, осуществляемое с помощью фермента ДНК-полимеразы. Эта реакция носит название репликации ДНК.
Взятие биопсийного материала проводится во время эндоскопического исследования. Перед началом эрадикационной терапии биопсийный образец берется из антрального отдела желудка. При контроле лечения взятие биопсийного образца проводится не ранее чем через 4 недели после проведения эрадикационной терапии из тела желудка. Взятый биопсийный образец опускается в стерильную сухую пробирку (эппендорф) и немедленно доставляется в лабораторию. Для более длительного хранения возможна заморозка взятого биопсийного материала при температуре -200оС.
Преимущества:
a. высокая специфичность;
b. адекватная чувствительность, позволяющая диагностировать не только острые, но и латентные инфекции в клинически значимом титре (возможно выявление даже единичных бактерий или вирусов);
c. сходный химический состав нуклеиновых кислот позволяет разрабатывать универсальные процедуры для выявления различных инфекционных агентов;
d. возможность идентификации возбудителя в течение 4,5-5 часов;
e. относительно низкая стоимость оборудования и тест-систем для проведения анализа, которые сочетаются с универсальностью метода.
6. Цитологический метод используется пожалуй только в России и в некоторых постсоветских странах. Метод основан на выявлении бактериальных тел в мазках-отпечатках биоптатов СО желудка. Помимо НР выявляется также клеточная инфильтрация, представленная в основном лимфоцитами и плазматическими клетками. По преобладанию тех или иных клеток можно приблизительно судить об активности и выраженности воспаления. Цитологическое исследование позволяет выявить наличие пролиферативных процессов, метаплазии и дисплазии, а также оценить степень их выраженности. Можно обнаружить и неопластические изменения, но этот метод недостаточно информирует о структурных изменениях СО. В развитых странах этот метод не используется из-за его очень низкой чувствительности, которая составляет в среднем 18-20%. НР в цитологических препаратах можно выявить только в случае максимального обсеменения слизистой оболочки.
7. Иммунологический (серологический) метод. Колонизация НР вызывает системный иммунный ответ. Через 3-4 недели после инфицирования в слизистой оболочке и в крови больных появляются антитела к НР, которые могут определяться путем иммуноферментного анализа. Выявляют антитела IgG, IgA, IgM-классов в крови и секреторные sIgA , sIgM в слюне и желудочном соке.
Данный метод идеален для первичной диагностики, так как при высокой чувствительности и специфичности (более 90% по сравнению с инвазивными методами, включая ПЦР) он на сегодняшний день самый дешевый. Увеличение чувствительности и специфичности метода, вследствие совершенствования технологии, позволило применить его для диагностики эрадикации, и если раньше диагностика эрадикации с помощью иммуноферментного анализа была возможна только через 8-12 месяцев после лечения, то для выпускаемых в настоящее время наборов для ИФА этот срок уменьшился до 3 месяцев.
8. ИФА в кале. Имеет высокую эффективность в определении эрадикации в сравнении с инвазивными методиками и дыхательным тестом. Более того, полученные данные свидетельствуют, что с помощью этого теста можно мониторировать лечение, то есть прогнозировать эффект антихеликобактерной терапии. Стоимость одного анализа пока остается на уровне дыхательного теста. Тест также зарегистрирован FDA в США.
9. ПЦР в кале. Тест показали высокую чувствительность и специфичность при первичной диагностике Н.pylori-инфекции и контроле лечения (A. Markristatis, 1998; D. Vaira, 1999; В.М. Говорун, 2000). Этот тест был признан «золотым стандартом» в диагностике Н.pylori-инфекции. Единственным ограничением широкого использования этого теста в клинической практике остается его высокая стоимость по сравнению с другими методами диагностики хеликобактериоза.
11. ЦИТОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
По мнению многих авторов только эндоскопия с биопсией и последующим морфологическим исследованием биоптатов позволяет объективно оценивать морфологические изменения, происходящие в СО (Одинцов С.В. с соавт., 1999; Никифоров П.А. с соавт., 2000; Шавликова Л.А., Суконко Т.Ф., 2001; Якутин В.С. с соавт., 2003; Котелевец С.М. с соавт., 2004; Иванова О.В., 2005; Lan C.S., 1990; Price A.B., 1991). В связи с этим взятие биоптатов при эндоскопическом исследовании и их гистологическое и (или) цитологическое изучение введено в стандарт клинического исследования больных с заболеваниями органов пищеварения (Аруин Л.И. с соавт., 1998; Никишаев В.И., 2003; Сельчук В.Ю., Никулин М.П., 2003). Но если необходимость гистологического изучения гастробиоптатов не обсуждается, то целесообразность их цитологического исследования, по данным литературы, остаётся спорной и недоказанной (Пасечников В.Д., Чуков С.З., 2002; Сарсенбаева А.С. с соавт., 2005; Маев И.В. с соавт., 2006; Alexander J.A. et al., 1997), его не всегда включают в стандарт обследования больных с заболеваниями желудка. Возможно, это связано с недостаточной информированностью врачей, выполняющих эндоскопическое исследование о возможностях цитологической диагностики. Между тем, цитологический метод исследования СО имеет ряд положительных качеств: быстрота и несложность приготовления цитологических препаратов, дешевизна исследований, выявление ранних признаков атипии клеток и возможность массового использования при профилактических осмотрах (Колосович И.В., 2002; Lan C.S., 1990; Saad R.S. et al., 2003). Цитологическое исследование отпечатков с биоптатов позволяет получить дополнительную диагностическую информацию и повысить эффективность морфологического исследования.
Существуют определенные ограничения цитологического метода, обусловленные способом получения материала, локализацией патологического очага, особенностями его гистологического строения, а также способностью врача-цитолога интерпретировать клеточный состав цитологического препарата.
При постановке правильного диагноза эндоскописты и морфологи должны идти в сотрудничестве. Если цитолог в каждом отдельном случае должен располагать клиническими данными, то эндоскописту и клиницисту, в свою очередь, нужно усвоить язык морфолога, его подход и требования к материалу, направленному на цитологические исследования. В составе комплексного обследования пациента эти исследования позволят более точно определить патологический процесс, и это должно входить в требование протокола диагностики и ведения больного.
Требования лаборатории на доаналитическом этапе цитологических исследований
Главной задачей цитологической лаборатории является проведение современных диагностических исследований для оптимального удовлетворения потребностей лечебного учреждения. Клиницист должен быть ориентирован на получение максимально полноценного клеточного материала, в противном случае преимущества, присущие этому методу, не реализуются, и цитологическое исследование для конкретного пациента теряет свое значение. Получение любого вида качественного цитологического материала требует соответствующей подготовки врачей клинических отделений и, кроме того, обязательного соблюдения медицинскими работниками всех уровней ряда условий, определяемых лабораторией, которые необученным специалистам могут казаться несущественными.
1. Клеточный материал наносят сухим инструментом тонким слоем в продольном направлении (или готовят отпечатки с ткани) на чисто вымытые, обезжиренные 96% спиртом и натертые досуха предметные стекла. Материал подсушивают на воздухе. Емкости для доставки материала (пробирки, чашки Петри и т.д.) используют только чистые, и после обработки в сухожаровом шкафу. Использование неподготовленных должным образом стекол, лабораторной посуды и других емкостей снижает информативность материала, так как часть клеток подвергается дегенеративным изменениям, и либо смывается с необезжиренной поверхности стекла во время его окраски, либо в процессе микроскопирования такого стекла клетки могут быть удалены с его поверхности вместе с иммерсионным маслом.
2. Цитологические препараты с тканевого кусочка готовят до его обработки формалином.
3. Обязательное требование: взятый для исследования материал недопустимо делить на части и рассылать в разные лаборатории или присылать материал не в полном объеме, так как характерные изменения могут быть в одной части материала и отсутствовать в другой, в связи с этим возможно расхождение диагнозов.
4. Любой материал, направляемый в лабораторию, маркируют. Способы маркировки могут быть разнообразные: на предметном стекле маркером обозначают фамилию пациента или другие символы; для емкостей чаще используют наклейки с необходимыми сведениями. Основная задача – не допустить несоответствия направляемого материала и информации в сопроводительном бланке.
5. Для срочных исследований необходимо сделать отметку в сопроводительном бланке – cito!
6. Цитологический материал доставляют в ближайшие сроки после его забора. Особенно это относится к жидкостям, мокроте, содержимому кист и любому кровянистому материалу. Для доставки материала необходимо иметь специализированные контейнеры для предметных стекол, пробирки, чашки Петри, емкости разного объема. Не допускается контакт нативного материала, в том числе подсушенного предметного стекла, непосредственно с бланком-направлением.
Формы цитологических заключений
1. Утвердительное заключение о характере процесса с уточнением гистологической формы. Если постановка диагноза невозможна, то – установление опухолевого, опухолеподобного или неопухолевого процесса.
Пример: «цитологическая картина плоскоклеточного ороговевающего рака».
Это заключение является руководством к действию.
2. Предположительное заключение о характере процесса с описанием клеточного состава препарата.
«…Подобная цитологическая картина не исключает наличие …»
Предположительное заключение ни в коем случае нельзя воспринимать ни как утвердительное, ни как отрицательное.
3. Описательное заключение
«В представленных мазках элементы крови, оксифильное межуточное вещество, вытянутые клетки типа фибробластов, макрофаги, плазматические клетки, нейтрофильные лейкоциты, единичные эозинофилы».
4. Заключение, в котором врач указывает на невозможность высказаться о характере процесса (с указанием причины).
5. Заключение о неудачно полученном клиницистом материале (неинформативный).
Оценка цитологической картины
1. Фон препарата, наличие и характер межуточного вещества.
Часто имеет большое диагностическое значение. Фоном препарата могут быть элементы периферической крови или воспаления, сопровождающего опухолевый процесс, клеточный детрит, межуточное вещество. Фон препарата в виде межуточного вещества может иметь диагностическое значение при определении тканевой принадлежности опухоли (хрящеобразующие опухоли) или гистологической формы (слизеобразующие аденокарциномы).
2. Количество и расположение клеток, образование комплексов или структур, сохранность клеточных границ.
Количество клеток в мазке определяется прочностью межклеточной связи, обилием стромы. Богатый клеточный состав бывает в низкодифференцированных опухолях – низкодифференцированный рак, ангиосаркома, лимфосаркома, опухоль Юинга и др. Единичные опухолевые клетки встречаются при остеопластической (склеротической) остеогенной саркоме, фиброзирующих раках и др.
Расположение клеток, образование комплексов и структур является одним из важных диагностических признаков. Так, для рака характерно образование самых разнообразных комплексов, наряду с разрозненно расположенными клетками. Наличие типичных железистоподобных, тубулярных, папиллярных структур позволяет говорить об аденокарциноме. В опухолях мезенхимальной природы клеточные элементы располагаются преимущественно разрозненно, хотя могут быть скопления без формирования определенных структур, тяжи клеток. В саркомах клетки располагаются иногда в виде пучков. Розеткоподобные структуры могут определяться в самых различных новообразованиях – опухоль Юинга, аденокарцинома и др.
3. Размеры и формы клеток.
4. Ядро – форма и размеры, расположение и окрашиваемость.
Форма – округлая, овальная, полигональная, неправильная, вытянутая, бобовидная и др. Размеры – мелкие (примерно, размеры лимфоцита), средних размеров, крупное, гигантское. Расположение – в центре, эксцентрично, занимает почти всю клетку, «голое» ядро (цитоплазма почти не определяется).
Окрашиваемость – гипохромия, гиперхромия. Состояние ядерной мембраны – сохранена, четкие контуры, нечетко очерчена, имеются разрывы.
5. Ядерно-цитоплазматическое соотношение.
6. Характер строения хроматина.
Равномерное, регулярное, хроматин тонкоперсный, мелкозернистый, грубозернистый, глыбчатый, распределен неравномерно, равномерно, разряжен.
7. Ядрышки – количество, форма, размеры, четкость границ.
8. Цитоплазма – объем, окраска, четкость границ, секреция включения, вакуолизация.
Обильная, умеренная, скудная, цвет (голубой, серо-голубой, розовый и др.), окрашена равномерно, неравномерно, стекловидная, включения (зерна, пылевидная зернистость, пенистая цитоплазма и др.), признаки секреции, четкость границ, вакуолизация. Существенным признаком является характер цитоплазмы, наличие включений в ней. Кератоз цитоплазмы значительного количества клеток позволяет думать о плоскоклеточном ороговевающем раке, наличие гранул меланина – о меланоме.
9. Наличие многоядерных клеток, фигур деления (атипичные митозы). Если материала достаточно, клетки сохранные, препарат хорошо приготовлен и окрашен, то часто без описания препарата дается заключение о гистологической форме опухоли с указанием степени дифференцировки (низкодифференцированная аденокарцинома, плоскоклеточный ороговевающий рак и т.д.).
В тех случаях, когда материал и цитологическая картина недостаточно убедительны для установления конкретного диагноза, дается описание препарата, отдельных клеточных элементов и при возможности их оценка.
Многочисленными и очень детальными исследованиями установлено, что клетка злокачественного новообразования не имеет строго специфичных морфологических и цитохимических признаков. Однако, основываясь на комплексе цитологических критериев злокачественности с достаточной степенью достоверности, можно установить принадлежность клетки к злокачественному новообразованию.
Признаки злокачественности
I. Клетка:
а) размер клеток превосходит размеры клеток той ткани, которая явилась источником опухолевого роста: клетки могут быть гигантских размеров. Изменение размера не абсолютный показатель – размеры клеток могут быть не изменены;
б) изменение формы клеток – не полностью или мало соответствует той форме, которая свойственная клеткам нормальной ткани. Форма может быть самая причудливая. Может определяться отчетливый клеточный полиморфизм (клетки разных размеров и формы);
г) изменяется ядерно-цитоплазматическое соотношение и, как правило, в пользу ядра (за счет увеличения последнего);
д) появление многоядерных клеток, с отчетливым ядерным полиморфизмом;
е) атипичное расположение ядра;
ж) диссоциация в созревании ядра и цитоплазма (молодое ядро в зрелой клетке, зрелое ядро в незрелой цитоплазме).
II. Ядро:
а) увеличение размера ядра;
б) изменение формы ядра, иногда ядра приобретают причудливую форму, ядерный полиморфизм;
в) контур ядра неправильный, неравномерно извилистый, иногда с глубокими вырезками, нередко грубо очерчен;
г) ядерная мембрана неравномерно утолщена, разрывы.
III. Строение хроматина:
а) неравномерность, грубость, разряжен;
б) в недифференцированных и низкодифференцированных опухолях может быть тонкодисперсный, распределен неравномерно;
в) окрашиваемость чаще всего – гиперхромия.
IV. Ядрышки:
а) чаще всего определяются; б) размеры увеличены;
в) форма неправильная, нередко полиморфизм; г) число увеличено.
Степень выраженности этих признаков может быть различна, у анаплазированных опухолей она чрезвычайно велика. Вместе с тем у высокозлокачественных низкодифференцированных новообразований признаки атипии (полиморфизм в строении ядра и цитоплазмы, нарушении регулярности строения хроматина и др.) могут быть минимальными.
Трактовка цитограмм
Картина воспаления – элементы воспаления (лейкоциты – нейтрофильные и эозинофильные, лимфоидные элементы, гистиоциты, клетки фибропластического ряда, плазматические клетки).
Пролифелирующие клетки.
Клетки с признаками атипии – это, как правило, доброкачественные элементы. Признаки атипии могут быть обусловлены быстрым ростом, воспалением (в таких случаях необходимо повторить исследование, лечить воспаление или доброкачественный процесс с обследованием после лечения).
Подозрение на принадлежность к злокачественным элементам.
Это клетки с выраженными признаками атипии, клетки с выраженными дистрофическими изменениями – в таких случаях необходимо обязательное повторное исследование, наблюдение. Чаще всего при таком заключении есть серьезные основания подозревать злокачественный процесс.
Описательный ответ – может быть дан при малом количестве материала, или он представлен в основном элементами воспаления или периферической крови, отдельными клеточными элементами с выраженными дистрофическими изменениями, затрудняющими дифференцировку клеток. В описании должно быть указано, что послужило причиной отсутствия диагностического заключения (малое количество материала, трудность трактовки обнаруженных клеточных элементов и всей цитологической картины).
Отрицательный ответ – клеток злокачественного новообразования не обнаружено. В таких случаях может быть указано, какие элементы обнаружены (периферическая кровь, элементы воспаления и др.).
Причины цитологической гиподиагностики:
1. небольшое количество материала;
2. плохое качество препарата;
3. высокая дифференцировка опухоли;
4. выраженные дистрофические изменения клеток, некротические процессы;
5. неопытность врача цитолога;
6. плохое качество препарата.
Причины цитологической гипердиагностики:
1. выраженная пролиферация клеточных элементов;
2. реактивные изменения эпителия;
3. выраженные дистрофические изменения клеток;
4. пролиферация эндотелия и гистиоцитов с образованием железистоподобных структур;
5. отсутствие клинических данных (лучевая терапия, прием лекарственных препаратов и т.д.);
6. объективные диагностические проблемы.
.
По теме:
Список литературы:
1. Автандилов Г.Г., Купрюшина Н.В. Гистоплоидометрическая диа- гностика новообразований желудка по биоптатам. Руководство. – М.: РМАПО, 2008. – с. 16 – 18. 4.
2. Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагно- стика болезней желудка и кишечника. - М.: Триада-Х. 1998. - С. 77-85, 219- 253, 272, 483.
3. Аруин Л.И. Новая международная классификация дисплазий слизи- стой оболочки желудка // Рос. журн. гастроэнтерол., гепатол., колопроктол. - 2002. - № 3. - C. 15-17.
4. Аруин Л.И. Helicobacter pylori: каким образом один возбудитель вы- зывает разные болезни // Эксперим. и клин. гастроэнтерол. - 2004. - № 1. - C. 36-41.
5. Аруин Л.И. Из 100 инфицированных Helicobacter pylori рак желудка возникает у двоих. Кто они? // Эксперим. и клин. гастроэнтерол. - 2004. - № 1 (внеочередной вып.). - С. 12-18.
6. Аруин Л.И., Кононов А.А., Мозговой С.И. Международная класси- фикация хронического гастрита: что следует принять и что вызывает сомне- ния // Архив патологии. – 2009. - №4. – С. 46-50.
7. Атлас эндоскопии пищеварительного тракта: возможности высоко- го разрешения и изображения в узком световом спектре / Под ред. Дж. Коэна; пер. с англ.; под ред. А.А. Будзинского. – М.:Логосфера, 2012. – 360 с.
8. Бебуришвили А.Г., Михин И.В., Зюбина Е.Н. Язвенная болезнь же- лудка и двенадцатиперстной кишки: Методические рекомендации для вра- чей. – Волгоград, 2007. – С. 72. 19.
9. Белоусова Е.А. Рекомендации по диагностике и лечению болезни Крона //Фарматека – 2009 – № 13. С. 38 – 44.
10. Блок Б., Шахшаль Г., Шмидт Г. Гастроскопия. Учебное пособие. М.:«Медпресс-информ» 2007. С.17, 23-24, 32, 50-65, 114, 119-128.
11. Василенко В.Х. Опухоли желудка. Клиника и диагностика /Василенко В.Х., Рапопорт С.И., Сальман М.М., Соколов Л.К., Цодиков Г.В. – М.: Медицина, 1989. – 288 с.
12. Васильев Ю.В. Поражение пищевода и желудка при раннем сифи- лисе //Международный медицинский журнал – 2004 – № 3. – С.60 – 64.
13. Голубова О.А. Редкие заболевания желудка и двенадцатиперстной кишки/Новости медицины и гастроэнтерологии – 2011. – № 390.
14. Гуревич Л.Е.Диагностика нейроэндокринных опухолей желудочно- кишечного тракта / Практическая онкология. – 2005. – №4. – С. 193 – 201.
15. Делекторская В.В., Павловская А.И. Морфологическая характери- стика основных типов нейроэндокринных опухолей// Вестник Московского онкологического общества – 2010 – №10.
16. Зак М.Ю. Классификация хронического гастрита: от Сиднейской системы к системе OLGA //Сучасна гастроэнтерологiя. – 2010 – № 6. – С. 116 – 126.
17. Ивашкин В.Т., Шептулин А.А. Болезни пищевода и желудка: Кратк. практическое руководство. – М.: МЕДпресс-информ, 2002. – С. 60 – 61, 62 – 64, 71 – 75.
18. Исаков В.А. Молекулярно-генетические основы патогенности
Helicobacter pylori // Рос.журн. гастроэнтерол., гепатол., колопроктол. – 2002.– №6. – С. 82-86.
19. Кабанец Н.С. Сосудистые заболевания пищевода /Кабанец Н.С., Моногарова Н.Е., Колкина В.Я., Крюк М.А. – Донецкий национальный ме- дицинский университет им. М. Горького //Новости медицины и фармации. – 2013 – № 473.
20. Коваленко В.Л., Куренков Е.Л., Кокшаров В.Н. Патоморфология и морфогенез приобретенных эпителиальных полиповидных образований же- лудка. – Челябинск, 2000. – 406 с.
21. Конорев М.Р. Принципы современной классификации дуоденитов /
М.Р. Конорев, А.М. Литвяков, М.Е. Матвиенко // Клинич. медицина. — 2003.– Т. 81,№2. – С. 15 – 16.
22. Король С.М., Колупаева Е.А. Болезни желудка и двенадцатиперст- ной кишки у детей и подростков: Учебно-методическое пособие. – Минск. – 2005. – 22 с.
23. Кудрявцева Л.В. Helicobacter pylori – инфекция: современные аспек- ты диагностики и терапии /Кудрявцева Л.В., Щербаков П.Л., Иваников И.О., Говорун В.М., М.: Пособие для врачей, 2004.
24. Кузьмин-Крутецкий М.И. Эндоскопическая диагностика и лечение заболеваний органов желудочно-кишечного тракта: Методические рекомен- дации. – Санкт-Петербург, 2006. – 175 с.
25. Кузьмина О.А., Таланова О.С., Холева А.О. и др. Туберкулезный га- стрит и дуоденит //Медицинские науки. Клиническая медицина. – 2012. – №3 (23) – С. 67 – 73.
26. Лапина Т.Л. Российские рекомендации по диагностике и лечению инфекции Helicobacter pylori //Рос. журн. гастроэнтерол., гепатол. и колопр- октол. – 1999. – №3. – С. 84 – 89.
27. Маев И.В. Хронический дуоденит (Алгоритм диагностики и лечеб- ной тактики) / Пособие для врачей общей практики, терапевтов, гастроэнте- рологов: Учебное пособие. - М: ГОУ ВУНМЦ МЗ и СР РФ, 2007. 80 с.
28. Маев И.В. Болезни двенадцатиперстной кишки /И.В. Маев, А.А.Самсонов. – М.:МЕДресс-информ, 2005. – 512с., илл.
29. Малихова О.А., Поддубный Б.К., Поддубная И.В. и др. Эндоскопи- ческие критерии диагностики различных макроскопических вариантов не- ходжскинских лимфом желудка // Клиническая гастроэнтерология. – 2010. –№ 9. С. 33 – 37.
30. Маржатка З. «Терминология, определения терминов и диагности- ческие критерии в эндоскопии пищеварительной системы». – 3 изд. – Номен- клатура ОМЕД.- 1996.-141с
31. Методы клинической цитологии: пособие для врачей. – Санкт- Петербург, 2003. – 103 с.
32. Морфологическая диагностика гастрита на биопсийном материале: Методические рекомендации. - Приказ Министерства здравоохранения Челя- бинской области от 14.02.2008 № 56.
33. Нечипай А.М. Роль эндоскопического исследования в диагностике предопухолевой патологии и формировании «группы риска». – Дисс. канд. мед. наук. – Москва. – 1987
34. А.Нечипай А.М., Поддубный Б.К. и др. Вероятность малигнизации полипов желудка // Вопр. онкологии. - 1989. - Т.35, №9. - С.1044-1049
35. Отчет о медицинской позиции Американской Ассоцииации Гастро- энтерологов в отношении ведения пищевода Барретта /перевод Никишаев В.И, Тумак И.Н., Пузир Н.В. – 2011.
36. Осипенко М.Ф., Бикбулатова Е.А. и др. Пищевод Барретта – совре- менное состояние проблемы // Рос. журн. гастроэнтерол., гепатол. и колопр- октол. – 2007. – № 4. – С. 11 – 19.
37. ПальцевМ.А., Коваленко В.Л., Аничков Н.М. Руководство по биоп- сийно-секционному курсу: Учебное пособие. – М.:Медицина, 2002. – 262 с.
38. Перфильев И.Б.. Делекторская В.В., Кувшинов Ю.П., Поддубный Б.К. и др. Современные аспекты эндоскопической семиотики нейроэндо- кринных опухолей желудка // Рос. журн. гастроэнтерол., гепатол. и колопр- октол. – 2011. – № 4. – С. 27 – 36.
39. Принципы диагностики, лечения и наблюдения пациентов с предраковыми состояниями и изменениями желудка (Проект рекомендаций Российского эндоскопического общества для эндоскопистов, гастроэнтеро- логов, терапевтов, онкологов и хирургов) /Доказательная гастроэнтерология.– 2012. – №1. – С. 58 – 81.
40. Пучков Ю.Г. Методологические принципы организации цитологи- ческих и гистологических исследований: пособие /Пучков Ю.Г., Соколова Н.М., Фионик А.М., Новик В.И. – Санкт-Петербург, 2001. – 74 с.
41. Рапопорт С.И. Гастриты: Пособие для врачей. - М.: ИД "Медпрактика-М", 2010. - 20 с.
42. Руководство по гастроэнтерологии: В трех томах /под общей редак- цией. Комарова Ф.И., Гребнева А.Л. Т.1 Болезни пищевода и желудка
/Комаров Ф.И., Гребнев А.Л. Шептулин А.А. и др. – М.: Медицина, 1995. – 672 с.
43. Сарсенбаева А.С. Методы диагностики инфекции Helicobacter pylo- ri: учебное пособие / Сарсенбаева А.С., Игнатова Г.Л. Воротникова С.В. – Челябинск, 2005. – 50 с.
44. Соломенцева Т.А. Редкие формы хронических гастритов и гастропа- тий //Здоровье Украины. – 2010. – сентябрь. – С.52 – 54.
45. Соломенцева Т.А. Эзофагит как междисциплинарная проблема //Лiки Украiни. – 2009. – № 6(132). – С. 59 – 64.
46. Старков Ю.Г., Солодина Е.Н., Новожилова А.В. Подслизистые но- вообразования желудочно-кишечного тракта в эндоскопической практике //Хирургия. – 2010. – № 2. – С. 51 – 59.
47. Субботин А.М., Кузин М.Н., Ефимова Е.И. Стандартизация эндо- скопической терминологии. Оформление протокола диагностической эзо- фагогастроскопии, колоноскопии (на основе МСТ 3.0 гастроинтестинальной эндоскопии): учебно-методическое пособие. – Н.Новгород. – 2013. – С. 106.
48. Тамулевичюте Д.И., Витенас А.М. Болезни пищевода и кардии. – М.: Медицина, 1986. – 224 с.
49. Федоров Е.Д. Стандарты эндоскопической диагностики ГЭРБ в России //Экспериментальная и клиническая гастроэнтерология. Специальный выпуск. – 2004. - №5. – с. 22 – 29.
50. Филин А.В., Мяукина Л.М., Зубовский Ю.Ю., Милейко В.Е., Рыбал- кин Ю.И. Эндоскопия верхних отделов пищеварительного тракта: подготов- ка, методика, возможности //Клиническая эндоскопия. – 2004 – №1 – стр. 5 – 10.
51. Харченко Н.В., Степанов Ю.М. Язва желудка и двенадцатиперстной кишки. Диагностические и лечебные алгоритмы: Практическое пособие //Здоровье Украины. – 2010. – апрель. – С. 27 – 30.
52. Ходкевич Б.С., Добродеев А.Ю. и др. Кисты пищевода. Клинические наблюдения и обзор литературы /Сибирский онкологический журнал. – 2007. – №2 (22). С. 84 – 88.
53. Шалимов А.Д., Саенко В.Ф., Шалимов С.А. Хирургия пищевода. – М.: Медицина, 1975.
54. Шапиро Н.А. Цитологическая диагностика заболеваний пищевода, желудка и кишки. – М. – Алматы, 2011. – 240 с.: ил.
55. Шамгунова Б.А. Клинико-морфологические особенности хрониче- ского геликобактерного гастрита у больных железодефицитной и смешанной (железо- и В12-дефицитной) анемиями.- Автореф. дис. на соиск. уч. степ. канд. мед. наук. - Астрахань, 2001. – 23 с.
56. Щербаков П.Л., Быстровская Е.В., Долгашева Г.М. Эндосонография в диагностике неэпителиальных опухолей пищевода, желудка и двенадцати- перстной кишки /Гастроэнтерология. – 2010. – № 10. – С. 29 – 31.
57. Эндоскопия желудочно-кишечного тракта /Под ред. проф. С.А. Блашенцевой. – М.: ГЭОТАР-Медицина, 2009. – 520 с.
58. Янкин А.В. Рак пищевода: от статистики к диагностике /Практическая онкология. – 2003. – т. 4. – № 2. – С. 61 – 65.
59. Bay J., Zeballos E., Fried M. et al. Целиакия: Практическое руковод- ство Всемирной организации гастроэнтерологов. – 2005. – февраль.
60. Do Youn Park, Gregory Y. Lauwers. Gastric Polyps: Classification and Management //Archives of Patology and Labaratory Medicine. – 2008. – Vol. 132, No. 4, pp. 633 – 640 (перевод статьи).
61. Fritz A, Percy C, Jack A, Shanmugaratnam K, Sobin L, Parkin DM, Whelan S. International Classification of Diseases for Oncology (ICD-O). 3rdth ed, WHO: Geneva. – 2000.
62. Marsh MN, Crowe PT. Morphology of the mucosal lesion in gluten sen- sitivity/ Baillieres Clin Gastroenterol. – 1995, 9:273–93.
63. Hamilton S.R., Aaltonen L.A. (Eds.): World Health Organization Classi- fication of Tumours. Pathology and Genetics of Tumours of the Digestive System. IARC Press: Lyon 2000.
64. Heresbach D., Napoleon B., Burtin P., Delchier J.-C. Биопсия при эн- доскопии верхних отделов пищеварительного тракта (Методические реко- мендации французкого общества гастроинтестинальной эндоскопии, 2009) (перевод Ким Е.В.) //Клиническая эндоскопия. – 2013. – 1(39). – С. 50 – 54.
65. Nishida T., Shusaku T., Kato M., et al. Treatment strategy for gastric non-invasive intraepithelial neoplasia diagnosed by endoscopic biopsy // World J Gastrointest Pathophysiol. – 2011. – December 15; 2(6): 93–99).
66. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon. November 30 to December 1, 2002 // Gastrointest. Endosc. – 2003. – Vol. 58. – Р.83-89, 810-843.
Статьи по теме
Рекомендуемые статьи
Эндоскопическая ретроградная холангиопанкреатография
- рентген-эндоскопический метод диагностики патологии желчных и панкреатических протоков.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.













.jpg)





.png)



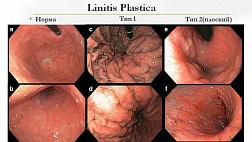











Комментарии