- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Роль эндоскопической биопсии в диагностике зубчатых образований толстой кишки
| Авторы: | К.Д. Халин1,2,*, М.Ю. Агапов3, Л.В. Зверева1, К.В. Стегний2,4 1 2020г. |
| Об авторах: |
1. 1. ЧУЗ «Клиническая больница «РЖД-Медицина»»; Владивосток, Российская Федерация 2. ФГБОУ ВО «Тихоокеанский государственный медицинский университет» Министерства здравоохранения Российской Федерации, Владивосток, Российская Федерация 3. СПбГБУЗ « |
Аннотация:
Введение. Перед эндоскопическим удалением эпителиальных образований толстой кишки рекомендуется их предварительная морфологическая верификация путем биопсии, однако степень совпадения гистологического заключения эндоскопической биопсии и удаленного зубчатого образования толстой кишки достоверно не установлена.
Цель. Оценить чувствительность, специфичность и точность эндоскопической биопсии в дифференциальной диагностике зубчатых аденом толстой кишки и проанализировать факторы риска расхождения данных биопсии и морфологического исследования полностью удаленных образований.
Материалы и методы. В исследование включены данные о 56 морфологически верифицированных зубчатых аденомах, выявленных и удаленных у 50 пациентов (мужчин 14, женщин 36; средний возраст 66,9 ± 10,5 года). Перед удалением всех образований выполняли эндоскопическую биопсию. Сравнивали результаты морфологического исследования по данным биопсии с результатами исследования удаленных опухолей. Оценивали чувствительность, специфичность и точность биопсии; анализировали влияние размера, типа образования и вида биопсийных щипцов.
Результаты исследования. Правосторонних образований выявлено 22 (39,3 %), левосторонних — 21 (37,5 %), в прямой кишке — 13 (23,2 %). Средний размер составил 28,5 ± 2,6 мм. Полиповидных было 17 (30,3 %), неполиповидных — 6 (10,7 %), поверхностно распространяющихся — 33 (59 %). Полное соответствие результатов морфологического исследования наблюдалось в 12 случаях (21,4 %). В 9 случаях (16 %) степень дисплазии на основании биопсии была расценена как легкая, тогда как в удаленном полностью образовании обнаруживались фокусы тяжелой дисплазии. В 10 удаленных новообразованиях были диагностированы фокусы аденокарциномы (из них два образования — с подслизистой инвазией), однако биопсия позволила определить злокачественное перерождение аденом только в двух случаях. В 32 случаях (57,1 %) было неверно распознано морфологическое строение образований.
Выводы. Предоперационная щипцовая биопсия имеет невысокую чувствительность для дифференциальной диагностики зубчатых образований толстой кишки, а также крайне низкую чувствительность для выявления очагов злокачественного перерождения зубчатых аденом.
Полный текст статьи:
Lhttps://doi.org/10.22416/1382437620203034248
Роль эндоскопической биопсии в диагностике зубчатых образований толстой кишки
К.Д. Халин1,2,*, М.Ю. Агапов3, Л.В. Зверева1, К.В. Стегний2,4
1 ЧУЗ «Клиническая больница «РЖДМедицина»»; Владивосток, Российская Федерация
2 ФГБОУ ВО «Тихоокеанский государственный медицинский университет»
Министерства здравоохранения Российской Федерации, Владивосток, Российская Федерация
3 СПбГБУЗ «Городской клинический онкологический диспансер», СанктПетербург, Российская Федерация 4 ФГАОУ ВО «Дальневосточный федеральный университет» Министерства науки и высшего образования Российской Федерации, Владивосток, Российская Федерация
Введение. Перед эндоскопическим удалением эпителиальных образований толстой кишки рекомендуется их предварительная морфологическая верификация путем биопсии, однако степень совпадения гистологического заключения эндоскопической биопсии и удаленного зубчатого образования толстой кишки достоверно не установлена.
Цель. Оценить чувствительность, специфичность и точность эндоскопической биопсии в дифференциальной диагностике зубчатых аденом толстой кишки и проанализировать факторы риска расхождения данных биопсии и морфологического исследования полностью удаленных образований.
Материалы и методы. В исследование включены данные о 56 морфологически верифицированных зубчатых аденомах, выявленных и удаленных у 50 пациентов (мужчин 14, женщин 36; средний возраст 66,9 ± 10,5 года). Перед удалением всех образований выполняли эндоскопическую биопсию. Сравнивали результаты морфологического исследования по данным биопсии с результатами исследования удаленных опухолей. Оценивали чувствительность, специфичность и точность биопсии; анализировали влияние размера, типа образования и вида биопсийных щипцов.
Результаты исследования. Правосторонних образований выявлено 22 (39,3 %), левосторонних — 21 (37,5 %), в прямой кишке — 13 (23,2 %). Средний размер составил 28,5 ± 2,6 мм. Полиповидных было
17 (30,3 %), неполиповидных — 6 (10,7 %), поверхностно распространяющихся — 33 (59 %). Полное соответствие результатов морфологического исследования наблюдалось в 12 случаях (21,4 %). В 9 случаях (16 %) степень дисплазии на основании биопсии была расценена как легкая, тогда как в удаленном полностью образовании обнаруживались фокусы тяжелой дисплазии. В 10 удаленных новообразованиях были диагностированы фокусы аденокарциномы (из них два образования — с подслизистой инвазией), однако биопсия позволила определить злокачественное перерождение аденом только в двух случаях. В 32 случаях (57,1 %) было неверно распознано морфологическое строение образований.
Выводы. Предоперационная щипцовая биопсия имеет невысокую чувствительность для дифференциальной диагностики зубчатых образований толстой кишки, а также крайне низкую чувствительность для выявления очагов злокачественного перерождения зубчатых аденом.
Ключевые слова: колоноскопия, биопсия, зубчатая аденома, толстая кишка, полип
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Для цитирования: Халин К.Д., Агапов М.Ю., Зверева Л.В., Стегний К.В. Роль эндоскопической биопсии в диагностике зубчатых образований толстой кишки. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2020;30(3):42– 48. https://doi.org/10.22416/1382437620203034248
Endoscopic Biopsy in Differential Diagnosis of Colorectal Serrated Lesions
Введение
Материалы и методы
Результаты
Обсуждение
Таблица. Факторы риска расхождения данных эндоскопической биопсии и морфологического исследования удаленных образований
|
Факторы Factors |
Зубчатые аденомы Serrated adenomas |
Степень дисплазии Dysplasia grade |
Фокус аденокарциномы Adenocarcinoma focus | |||||||
|
совпадение match |
расхождение mismatch |
р |
совпадение match |
расхождение mismatch |
р |
биопсия biopsy |
опухоль tumour |
р | ||
|
Размер Size |
<1 см <1 cm |
2 |
3 |
0,97 |
5 |
0 |
0,05 |
1 | ||
|
1–2,5 см 1–2.5 cm |
11 |
16 |
23 |
4 |
0 |
3 | ||||
|
>2,5 см >2.5 cm |
10 |
13 |
14 |
9 |
2 |
7 | ||||
|
Вид щипцов Forceps type |
стандарт standard |
12 |
23 |
0,16 |
27 |
8 |
0,8 |
1 |
8 |
1 |
|
Jumbo |
12 |
9 |
16 |
5 |
1 |
2 | ||||
|
Тип Type |
полиповидные образования polypoid |
11 |
6 |
0,01 |
10 |
7 |
0,06 |
0 |
2 |
0,72 |
|
неполиповидные образования nonpolypoid |
0 |
6 |
6 |
0 | ||||||
|
поверхностно распространяющиеся опухоли spreading |
13 |
20 |
27 |
6 |
2 |
8 | ||||
Литература / References
Сведения об авторах
Information about the authors
Konstantin D. Khalin1,2,*, Mikhail Yu. Agapov3, Lyudmila V. Zvereva1, Kirill V. Stegniy2,4
1 Clinical Hospital “RZhDMedicine”, Vladivostok, Russian Federation
2 Pacific State Medical University, Vladivostok, Russian Federation
3 Far Eastern Federal University, Vladivostok, Russian Federation
4 St. Petersburg City Clinical Oncology Dispensary, St. Petersburg, Russian Federation
Preoperative biopsy is recommended for morphological verification of colorectal epithelial neoplasms prior to their endoscopic resection. However, histological reports for endoscopic biopsy and resected lesions are not reliably consistent. Aim. Assessment of sensitivity, specificity and accuracy of endoscopic biopsy in differential diagnosis of colorectal serrated adenomas and risk factors for variance between biopsy results and morphological examination of completely resected lesions. Materials and methods. The assay used data on 56 morphologically verified serrated adenomas diagnosed and resected in 50 patients (14 men, 36 women; average age 66.9 ± 10.5 years). Biopsy was taken from all tumours before endoscopic resection. Results of morphological examination of biopsy samples and resected tumours were analysed and compared. Sensitivity, specificity and accuracy of biopsy was assessed, with the tumour size and type and biopsy forceps system taken as criteria. Results. The identified cases included 22 (39.3%) rightcolon, 21 (37.5%) leftcolon and 13 (23.2%) rectal lesions of 28.5 ± 2.6 mm average size. Polypoid were 17 (30.3%), nonpolypoid — 6 (10.7%) and spreading — 33 (59%) of the tumours. Full consistency of morphological examination was observed for 12 cases (21.4%). In 9 cases (16%), dysplasia was established as mildgraded with biopsy, whilst the eradicated tumours contained severe dysplastic foci. Foci of adenocarcinoma were detected in 10 tumours (including 2 with submucosal invasion), but only 2 cases were correctly diagnosed for malignant adenoma with biopsy. Tumour morphology was misidentified in 32 cases (57.1%). Conclusions. Preoperative forceps biopsy is shown to possess low sensitivity in differential diagnosis of serrated colorectal lesions and very low sensitivity to predict malignant serrated adenomas. Keywords: colonoscopy, biopsy, serrated adenoma, colon, polyp Conflict of Interest: the authors declare no conflict of interests. " />
For citation: Khalin K.D., Agpov M.Yu., Zvereva L.V., Stegniy K.V. Endoscopic Biopsy in Differential Diagnosis of Colorectal Serrated Lesions. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2020;30(3):42–48. https://doi.org/10.22416/1382437620203034248
Заболеваемость колоректальным раком в России находится на третьем месте среди всех онкологических заболеваний, как среди мужчин, так и среди женщин, а по смертности рак ободочной и прямой кишки в совокупности стоит на втором месте [1, 2]. В настоящее время описаны три основных механизма канцерогенеза рака толстой кишки: хромосомная нестабильность (путь аденомакарцинома), мутации при синдроме Линча и зубчатый путь канцерогенеза [3]. Зубчатые образования включают в себя гиперпластические полипы, традиционные зубчатые аденомы и зубчатые аденомы на широком основании; последние два вида образований являются предшественниками колоректального рака, причем степень риска его развития из данных образований сравнима, а по некоторым сообщениям превышает таковой при традиционных аденомах [4, 5]. Зубчатые аденомы выявляются в 7,5–8 % колоноскопий и подлежат удалению тем или иным эндоскопическим методом [3, 6, 7]. Ряд авторов рекомендуют выполнять биопсию из всех обнаруженных во время эндоскопического исследования эпителиальных новообразований толстой кишки с целью оценки их морфологического строения [8, 9]. Однако степень совпадения гистологических результатов предоперационной биопсии и удаленного образования до конца не изучена. Биопсия провоцирует развитие фиброза подслизистого слоя, что, в свою очередь, ухудшает результаты эндоскопического удаления новообразований, снижая уровень резекций единым блоком и увеличивая риск перфорации толстой кишки [10, 11].
Цель исследования — оценить чувствительность, специфичность и точность эндоскопической биопсии в дифференциальной диагностике зубчатых аденом толстой кишки и проанализировать факторы риска расхождения данных биопсии и морфологического исследования полностью удаленных образований.
В работу включены пациенты с морфологически верифицированными зубчатыми аденомами толстой кишки, выявленными и эндоскопически удаленными при колоноскопии с 01.01.17 по 01.03.19 на базе НУЗ «Отделенческая клиническая больница» на ст. Владивосток ОАО «РЖД». Подготовка толстой кишки к исследованию осуществлялась по двухэтапной схеме оригинальным препаратом
«Макрогол 4000» или оригинальным препаратом комбинации калия, магния и натрия сульфатов. Для уменьшения количества пены в просвете кишки в последнюю порцию препарата добавлялось
30 мг симетикона. Качество подготовки не различалось, в обоих случаях составляло ≥6 баллов по Бостонской шкале. Колоноскопии выполнены с помощью видеоэндоскопической стойки Fujinon 4400 с аппаратами 500 серии (Фуджифилм, Япония). Биопсии выполнены стандартными биопсийными щипцами “FlexiBite”© (Global Medicine, Германия) и биопсийными щипцами типа Jumbo “Radial Jaw”© (Boston Scientific, США). При обнаружении новообразования сначала оценивали в белом свете, затем в большинстве случаев выполняли хромоскопию раствором индигокармина.
Критериями исключения из исследования служили образования с явными эндоскопическими признаками злокачественной опухоли с глубокой инвазией (бесструктурная поверхность, Vn тип кишечных ямок по Kudo), размер образования <5 мм а также <6 баллов по Бостонской шкале подготовки толстой кишки. Всего включено 50 пациентов с 56 образованиями ободочной и прямой кишки (женщин — 36, мужчин — 14), средний возраст пациентов составил 66,9 ± 10,5 года. Из всех образований толстой кишки перед удалением бралась биопсия. Количество биоптатов зависело от размера образования: из образования менее 10 мм — один биоптат; из образования от 11 до 25 мм — два биоптата; от 26 до 40 мм — три биоптата; более 40 мм — четыре биоптата.
Полученные биоптаты фиксировали на полимерной основе и помещали в 10 %ный раствор формалина, в дальнейшем выполняли стандартную подготовку препаратов к морфологическому исследованию. После взятия биопсии образование удалялось тем или иным эндоскопическим методом: полипэктомия — 6 образований (10,7 %), эндоскопическая резекция слизистой (EMRendoscopic mucosal resection) — 28 образований (51,8 %), эндоскопическая диссекция в подслизистом слое (ESDendoscopic submucosal dissection) — 22 образования (37,5 %); промежуток между взятием биопсии и удалением не превышал
2 месяцев. Удаленное образование фиксировали за края на плотной основе (в том числе и удаленное фрагментами образование) и помещали в 10 %ный раствор формалина, в дальнейшем препарат стандартно подготавливали для морфологического исследования.
Тип образования оценивали согласно Парижской классификации эпителиальных неоплазий [12], локализация — согласно анатомическим ориентирам (от купола слепой кишки включительно до селезеночного изгиба — правосторонние образования, от селезеночного изгиба включительно до ректосигмоидного изгиба — левосторонние образования, отдельно — образования прямой кишки). Размер образования определяли по фиксированному на плоской поверхности удаленному препарату.
Морфологические заключения оформляли согласно классификации ВОЗ [13]. По результатам морфологического исследования биоптатов и удаленных образований рассчитывались чувствительность, специфичность и точность эндоскопической биопсии в оценке морфологического строения зубчатого образования толстой и прямой кишки. В качестве вероятных факторов риска расхождения данных биопсии и морфологического исследования удаленных образований (далее — расхождения) исследовались размер, тип образования и биопсийных щипцов; их значимость оценивали методом построения хиквадрата, достоверность различий принималась при р < 0,05
при 95 % доверительном интервале. Чувствительность, специфичность и точность рассчитывались по стандартным формулам с использованием таблицы сопряженности.
Для математического анализа данных использовался стандартный пакет Microsoft Office Excel 2010 (Microsoft, США).
По локализации зубчатые образования толстой и прямой кишки распределены следующим образом: правосторонние — 22 (39,3 %), левосторонние — 21 (37,5 %) и в прямой кишке — 13 образований (23,2 %). Средний размер образований — 28,5 ± 2,6 мм в наибольшем измерении. Полиповидных образований (0Ip, 0Isp, 0Is) — 17 (30,3 %), неполиповидных (0IIa, 0IIa+IIc) —
6 (10,7 %), поверхностно распространяющихся (LSTG, LSTNG) — 33 (59 %).
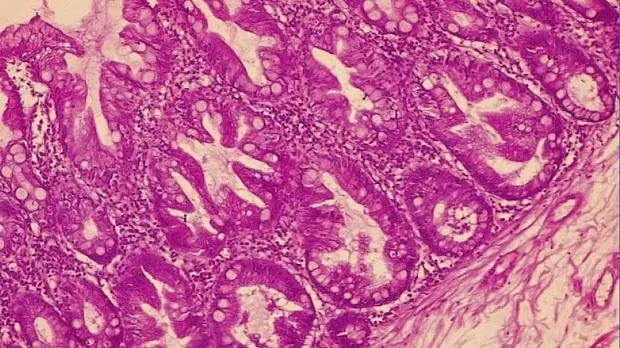
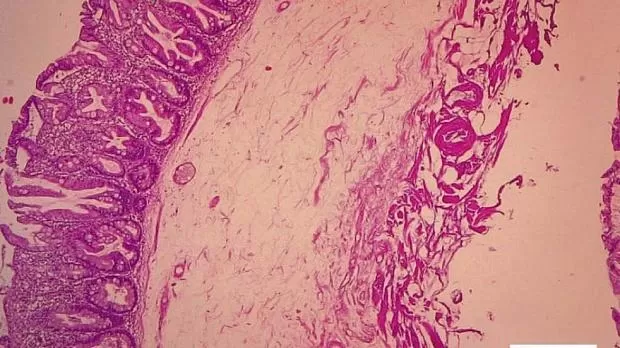
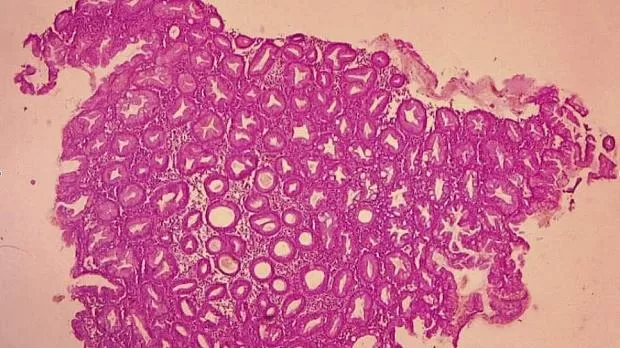
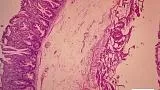
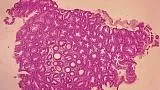
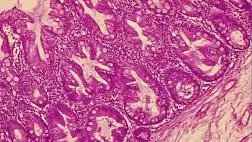
По данным предоперационной биопсии, зубчатые аденомы были диагностированы в 24 случаях (42,8 %). Полное соответствие результатов морфологического исследования биоптатов и удаленных образований наблюдалось в 12 случаях (21,4 %). В 9 наблюдениях (16 %) морфологический тип зубчатого образования по данным биопсии был определен верно, однако степень дисплазии была ошибочно оценена как «легкая», тогда как при исследовании удаленного препарата была выявлена тяжелая дисплазия. Из 10 неоплазий с фокусами аденокарциномы предоперационная биопсия позволила корректно верифицировать только 2 из них. В остальных случаях предоперационная биопсия продемонстрировала лишь аденому с тяжелой дисплазией. В 32 наблюдениях (57,1 %) морфологическое строение образований по данным биопсии было оценено неверно: в 10 случаях зубчатые аденомы были расценены как гиперплазия аберрантных метапластических крипт (рис. 1, 2), в 22 случаях — как традиционные аденомы (тубулярная, виллезная или тубуловиллезная).
Таким образом, чувствительность, специфичность и точность предоперационной биопсии в диагностике зубчатых аденом составила 44,6, 100 и 44,6 % соответственно; в диагностике тяжелой степени дисплазии — 71,8, 93,7 и 76,8 % соответственно; в диагностике очагов злокачественного перерождения зубчатой аденомы — 20, 100 и 85,7 % соответственно.
Тип образования по Парижской классификации эпителиальных неоплазий оказался единственным фактором, достоверно влияющим на диагностическую ценность эндоскопической биопсии при зубчатых образованиях — все неполиповидные образования не были диагностированы как зубчатые аденомы. Диагностическое значение биопсии в оценке степени дисплазии зависело только от размеров образования — чем больше размеры, тем больше риск расхождения (табл.).
Рис. 1. Микропрепарат удаленной зубчатой аденомы на широком основании Fig. 1. Microsection of resected sessile serrated adenoma
Рис. 2. Микропрепарат предоперационного биоптата Fig. 2. Preoperative biopsy microsection
Зубчатые аденомы являются доказанным предшественником колоректального рака, поэтому крайне важно дифференцировать их от гиперпластических полипов [14, 15]. Однако в литературе имеются сообщения о том, что дифференциальная диагностика зубчатых аденом с использованием биопсии крайне затруднительна [4, 16]. Особенностью морфологического строения зубчатых аденом являются Lи Тдеформации базальных отделов кишечных крипт; это делает сложной дифференциальную диагностику зубчатых новообразований путем взятия биопсии, поскольку биопсийные щипцы не позволяют взять адекватный фрагмент слизистой оболочки с базальными отделами для их детального анализа [4, 15]. Выявление Lи Тдеформации крипт базальных отделов при прижизненном гистологическом исследовании операционного материала меняет итоговое заключение с традиционной аденомы на зубчатую. Это подтверждается нашим исследованием: чувствительность и точность биопсии для диагностики зубчатых аденом является субоптимальной.
Вместе с тем, по сообщению T. Murakami et al. [17], чувствительность, специфичность и точность эндоскопической «оптической» биопсии при осмотре в белом свете в диагностике зубчатых аденом составила 75, 79 и 77 %, а при использовании технологии NBI — 89, 96 и 93 % соответственно, что несравненно выше полученных нами данных о рутинной щипцовой биопсии: 44,6, 100 и 44,6 % соответственно. В литературе имеются сообщения об улучшении диагностики различных заболеваний при использовании для биопсии щипцов типа Jumbo [18, 19], однако, согласно нашим данным, использование таких щипцов достоверно не улучшает диагностику зубчатых аденом. Достоверным фактором риска неверной диагностики зубчатых аденом исходя из полученных нами данных является неполиповидный тип образования а также поверхностно распространяющийся характер роста (р = 0,01). Помимо этого, размер образований достоверно влияет на точность определения степени дисплазии в образовании: чем больше образование, тем выше риск неверной диагностики. Вероятно, это может быть связано с очаговым
Table. Factors for variance between biopsy prediction and morphological examination of resected tumours
характером тяжелой дисплазии, и чем крупнее образование, тем меньше шанс того, что очаг тяжелой дисплазии попадет в биоптат.
Выбор метода эндоскопического удаления образований толстой кишки зависит от характера образования: образования с наличием фокусов аденокарциномы должны быть удалены с соблюдением онкологических принципов, а именно методом, с наибольшей вероятностью позволяющим удаление единым блоком в пределах здоровых тканей. Образования свыше 20 мм, а также образования с участком депрессии (LSTNGPD) затруднительно удалить единым блоком методом EMR, поэтому в ряде зарубежных руководств рекомендовано направлять таких пациентов в экспертные центры для решения вопроса об удалении таких образований методом ESD [20–22]. Наше исследование показало, что предоперационная биопсия обладает крайне низкой чувствительностью (20 %) в диагностике фокусов аденокарциномы в зубчатой аденоме независимо от типа, размера образования, а также типа используемых биопсийных щипцов.
Z. Tatomirovic et al. сообщали о 78,3, 100 и 80,8 % чувствительности, специфичности и точности биопсии в диагностике аденокарцином ободочной
и прямой кишки, что выше полученных нами цифр, однако из их исследования не были исключены заведомо инвазивные новообразования [23].
Уровень чувствительности и точности в определении тяжелой дисплазии у биопсии недостаточно высокий: 71,8 и 76,8 % соответственно. Степень дисплазии является прогностически значимым фактором: пациентов с образованиями с тяжелой дисплазией относят к группе высокого риска развития колоректального рака, поэтому интервалы послеоперационного наблюдения для этой группы меньше, чем для других групп [4, 24–26]. Кроме того, имеются данные, что в 42 % аденом с тяжелой дисплазией может быть аденокарцинома с подслизистой инвазией [27].
Таким образом, значение щипцовой биопсии в дифференциальной диагностике эпителиальных образований толстой кишки представляется несколько переоцененным; чувствительность и точность биопсии в диагностике зубчатых аденом, а также очагов малигнизации являются субоптимальными. По нашему мнению, тактика в отношении заведомо неинвазивных образований толстой кишки должна быть пересмотрена в сторону отказа от рутинной биопсии..
Список литературы:
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.

.jpg)





.png)


.jpg)














Комментарии