- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Оптимальное количество эндоскопических биопсий для диагностики раннего рака желудка 2019
| Авторы: | Masaki Nishitani1, 3, Naohiro Yoshida1, Shigetsugu Tsuji1, Teppei Masunaga1, Hirokazu Hirai1, Saori Miyajima1, Akihiro Dejima1, Takashi Nakashima1, Shigenori Wakita1, Kenichi Takemura1, Hiroshi Minato2, Shuichi Kaneko3, Hisashi Doyama1 2019г. |
Аннотация:
Предпосылки и цели исследования Нет рекомендаций по оптимальному количеству эндоскопических биопсий при раннем раке желудка (РЖ), и неясно, улучшается ли обнаружение раннего РЖ за счет увеличения количества биопсий. Поэтому мы оценили взаимосвязь между количеством биопсий и точностью диагностики.
Материалы и методы. Мы ретроспективно оценили 858 ранних ГК (623 из эндоскопической диссекции подслизистой оболочки и 235 хирургических образцов), которые мы классифицировали как полученные после одной, двух, трех или более биопсий. Мы оценивали диагностическую точность по количеству биопсий, а в подгруппах - по диаметру опухоли, макроскопическому типу и цвету поверхности.
Результаты Почти половина поражений была получена после каждой биопсии, 30% - после двух биопсий и 20% - после трех или более биопсий. Хотя диагностическая точность увеличивалась с увеличением количества биопсий, она была значительно выше в группе с двумя биопсиями, чем в группе с одной биопсией (92,5% против 83,9%, P = 0,0009), но существенно не различалась между двумя и тремя или подробнее - биопсийные группы. Этот результат был замечен, когда опухоли оценивались по размеру, а не по повышенному типу и цвету поверхности, для которых большее количество биопсий не улучшало диагностическую точность. Многомерный анализ показал, что две или более биопсии были независимыми значимыми факторами диагностической точности.
Выводы Две биопсии - оптимальное количество, необходимое для ранней диагностики ГК.
Полный текст статьи:
1 биоптат - 83,9%
2 биоптата - 92,5% 3 биоптата - 95,9%
Две биопсии - оптимальное количество, необходимое для диагностики РРЖ.
Вступление
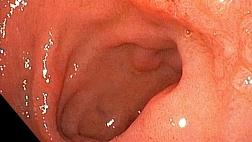
Рак желудка (РЖ) является третьей по частоте причиной смертности от рака во всем мире [ 1 ]. Как и в случае с другими видами рака, ранняя диагностика является важным фактором выживания при РЖ и обычно требует эндоскопического скрининга [ 2 ].
Диагностика ГК на основе эндоскопии часто использует увеличительную эндоскопию с узкополосной визуализацией (M-NBI) [ 3 ] [ 4 ] [ 5 ], для которой была создана система классификации сосуд плюс поверхность и использовалась в качестве «оптической биопсии» [ 4 ] [ 6 ]. Тем не менее, патологическая диагностика с использованием образцов биопсии по-прежнему является золотым стандартом диагностики ГК.
Несмотря на то, что для диагностики поздних стадий ГК рекомендовано проведение множественной биопсии [ 7 ] [ 8 ], практически нет рекомендаций или руководств по диагностике раннего ГК. В клинических условиях мы выполняем несколько биопсий из обнаруженных поражений, но неясно, улучшается ли диагностическая точность для ранней GC с большим количеством биопсий. Поэтому мы оценили взаимосвязь между количеством образцов биопсии и точностью диагностики, чтобы найти оптимальное количество биопсий для ранней GC.
Пациенты и методы
Дизайн и цели исследования
Это ретроспективное исследование проводилось в центральной больнице префектуры Исикава, специализированном специализированном центре в Японии. В соответствии с Хельсинкской декларацией, институциональный наблюдательный совет центральной больницы префектуры Исикава одобрил это исследование.
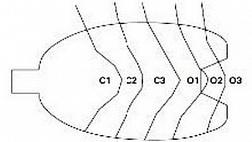
В это исследование были включены ранние ГК, которые лечили с помощью эндоскопической диссекции подслизистой оболочки (ЭСД) или хирургического вмешательства в нашей больнице. Критерии исключения: 1) гистологический диагноз, поставленный в других клиниках; 2) детали биопсии неизвестны (например, порядок биопсии); и 3) преднамеренная биопсия только окружающей незлокачественной слизистой оболочки (т. е. биопсия на карте). Чтобы исследовать оптимальное количество биопсий для правильной диагностики раннего GC, мы оценили диагностическую точность эндоскопической биопсии по количеству образцов, взятых из одного очага поражения.
Определение GC и демографических характеристик
Предоперационная гистологическая диагностика была основана на групповой классификации в соответствии с Японской классификацией рака желудка (JCGC) [ 9 ]: группе 4 (неопластическое поражение, которое предположительно является карциномой) и группе 5 (карцинома) до операции был поставлен диагноз GC. Группа 1 (нормальная ткань или неопухолевое поражение), группа 2 (материал, для которого трудно диагностировать неопластическое или неопухолевое поражение) и группа 3 (аденома) были диагностированы как неопухолевые.
Образцы, которым в послеоперационном периоде был поставлен диагноз ГК, были гистологически типированы в соответствии с JCGC [ 9 ]. Злокачественные эпителиальные опухоли, включая папиллярные, канальцевые (хорошо и умеренно дифференцированные), малодифференцированные (твердые и нетвердые), клеточные и муцинозные, были диагностированы как GC. Смешанная аденокарцинома (например, por2> sig> tub2) также была диагностирована как GC.
Опухоли, ограниченные слизистой или подслизистой оболочкой (независимо от метастазов в лимфатические узлы), считались ранними GC. Диаметр опухоли был максимальным; мы разделили поражения на ≥ 10 мм и <10 мм. Мы определили ГК <5 мм в самом длинном диаметре как мелкий рак желудка (мГК), а ГК размером от 5 до 10 мм в самом длинном диаметре - как малый рак желудка (рГК). Грубые типы были классифицированы как 0-I (выступающий), 0-IIa (поверхностный приподнятый), 0-IIb (поверхностный плоский), 0-IIc (поверхностный вдавленный) и 0-III (выемчатый), согласно JCGC [ 9]. В этом исследовании они были переклассифицированы в две группы: 0-I и / или 0-IIa считались повышенным типом, а остальные типы и поражения с более чем 2 компонентами, за исключением 0-I и IIa, были классифицированы как не повышенные. Цвет поражения классифицировался на красный / такой же, бледный или неопределенный. В этом исследовании мы анализировали покрасневших / одинаковых и бледных.
Все патологические диагнозы были выполнены двумя экспертами-патологами, все результаты были перепроверены.
Эндоскопическая система и процедура
Мы использовали эндоскоп, видеопроцессор и источник света одной компании (Olympus Co., Токио, Япония). Система NBI стала доступной в 2007 году. В нашей повседневной практике мы исследовали весь желудок с помощью обычной визуализации в белом свете (C-WLI), чтобы обнаружить подозрительные поражения для GC, которые имели неровные границы, неровные поверхности и / или неоднородные. цвет. Когда мы обнаружили такие поражения, мы провели детальное обследование с помощью хромоэндоскопии и / или M-NBI. Затем мы сделали биопсию раковой слизистой оболочки.
Эндоскописты
Эндоскопические обследования проводили специалисты и стажеры. Эксперты-эндоскописты имели опыт работы в эндоскопии не менее 6 лет с WLI и M-NBI. Стажеры имели опыт работы в эндоскопии менее 6 лет. В нашей больнице стажеры должны выполнять диагностические эндоскопии и биопсии вместе с экспертами. Следовательно, все исследования проводились только экспертами или экспертами и стажерами.
Конечные точки
Первичной конечной точкой была разница в диагностической точности эндоскопической биопсии в зависимости от количества биоптатов, взятых из одного очага поражения. Диагностическая точность определялась как чувствительность эндоскопической биопсии для диагностики ГК: доля ГК, которая была точно диагностирована при эндоскопической биопсии, среди гистологически подтвержденных ГК в резецированном образце. Когда какой-либо образец биопсии из одного поражения был злокачественным, поражение было диагностировано как GC и расценено как точный диагноз. С другой стороны, когда все образцы биопсии из одного поражения относились к Группам 1, 2 и 3, поражение было диагностировано как не связанное с GC и расценено как неправильный диагноз. У пациентов, которым в нашей больнице были сделаны несколько предоперационных эндоскопий и биопсий для одного и того же поражения, для анализа использовался результат последней эндоскопии.
Вторичными конечными точками были вклад диаметра опухоли, макроскопического типа и цвета поверхности в диагностическую точность.
статистический анализ
Непрерывные переменные были представлены как медианы и проценты с 95% доверительным интервалом (ДИ). Категориальные переменные сравнивали с использованием критерия ± 2 или точного критерия Фишера, когда ожидаемые значения были меньше пяти. Для выявления независимости от клинических факторов был проведен многомерный логистический регрессионный анализ факторов, которые до операции были диагностированы как GC или нет. Р <0,05 считали значимым. Все статистические анализы были выполнены с помощью EZR (версия 1.36, Saitama Medical Center, Jichi Medical University, Saitama, Japan), который представляет собой графический пользовательский интерфейс для R (The R Foundation for Statistical Computing, Вена, Австрия). Точнее, это модифицированная версия R commander, предназначенная для добавления статистических функций, часто используемых в биостатистике [ 10 ].
Полученные результаты
С января 2004 г. по июль 2016 г. в нашей больнице с помощью ЭСД или хирургического вмешательства прошли 2528 ранних ГК. Мы исключили 1632 очага поражения, потому что они были взяты на биопсию в других больницах, и 38 очагов поражения, поскольку не смогли установить их патологический диагноз для каждого образца биопсии. Таким образом, всего было проанализировано 858 очагов поражения (623 от ESD, 235 от операций; [ Рис. 1 ]). Аденокарцинома была послеоперационным диагнозом для всех поражений; аденома высокой степени злокачественности не включалась.
Рис. 1 Блок-схема пациентов, включенных в настоящее исследование.
Клинико-патологические характеристики 858 очагов суммированы в [ Таблица 1 ]. Почти у половины пациентов была проведена одна биопсия, у 30% поражений - две биопсии, а у 20% - три или более биопсии. Биопсии всех поражений были диагностированы как группы 2–5. При предоперационной биопсии 762 очага (89%) относились к группе 4 или 5, 75 очагов (9%) относились к группе 3 и 21 очаг (2%) были к группе 2.
|
Таблица 1 Клинико-патологическая характеристика 858 очагов по количеству биоптатов. | |||
|
Количество предоперационных биопсий | |||
|
1 (n = 434) |
2 (n = 254) |
≥ 3 (n = 170) | |
|
Гистологическая классификация биопсии, n (%) (высшая группа в образцах биопсии) | |||
|
· Группа 2 |
17 (4,0) |
4 (1,6) |
0 (0,0) |
|
· Группа 3 |
53 (12,2) |
15 (5,9) |
7 (4,2) |
|
· Группа 4 |
83 (19,1) |
32 (12,6) |
5 (2,9) |
|
· Группа 5 |
281 (64,7) |
203 (79,9) |
158 (92,9) |
|
Средний диаметр опухоли, мм (диапазон) |
12 (2–122) |
18 (1–123) |
30,5 (1-230) |
|
Диаметр опухоли, n (%) | |||
|
· <10 мм |
164 (37,8) |
47 (18,5) |
11 (6,5) |
|
· ≥ 10 мм |
270 (62,2) |
207 (81,5) |
159 (93,5) |
|
Тип брутто, n (%) | |||
|
· Повышенный |
150 (34,6) |
60 (23,6) |
26 (15,3) |
|
· Не возвышенный |
284 (65,4) |
194 (76,4) |
144 (84,7) |
|
Цвет поверхности, n (%) | |||
|
· Покрасневший / такой же |
316 (72,8) |
166 (65,4) |
68 (40,0) |
|
· Бледный |
107 (24,7) |
44 (17,3) |
34 (20,0) |
|
· Неопределенный |
11 (2,5) |
44 (17,3) |
68 (40,0) |
Диагностическая точность возрастает с увеличением количества биоптатов ([ Рис. 2 ]). Он составил 92,5% (95% ДИ: 88,6 - 95,4%), когда были взяты по крайней мере два образца, что было значительно выше, чем в группе с одной биопсией (83,9% [95% ДИ: 80,1 - 87,2%]; P = 0,0009 ). Однако, хотя диагностическая точность составила 95,9% (95% ДИ: 91,7–98,3%) в группе с тремя или более биопсиями, она не была значительно выше, чем в группе с двумя биопсиями.
Рис. 2 Диагностическая точность по количеству биоптатов в 858 очагах раннего рака желудка.
Диагностическая точность для подгрупп опухолей диаметром ≥ 10 мм и <10 мм также увеличивалась с увеличением количества биопсий ([ Рис. 3 ]). Независимо от размера опухоли диагностическая точность повышалась более чем на 90% при отборе двух образцов и была значительно выше, чем при отборе только одного образца (<10 мм: 79,9% [95% ДИ: 72,9 - 85,7%] до 93,6% [95] % ДИ: 82,5–98,7%], P = 0,028, ≥ 10 мм: от 86,3% [95% ДИ: 81,6–90,2%] до 92,3% [95% ДИ: 87,8–95,5%], P = 0,04), но не значительно различаются между двумя и тремя или более группами биопсии.
Рис. 3 Диагностическая точность по количеству образцов биопсии, классифицированных по диаметру опухоли (<10 мм или ≥ 10 мм).
В связи с этим мы также оценили вклад диаметра опухоли (≥ 5 мм против <5 мм) в диагностическую точность. Точно так же точность диагностики была значительно улучшена за счет увеличения количества образцов биопсии с одного до двух ([ Рис. 4 ]).
Рис. 4 Точность диагностики по количеству образцов биопсии, классифицированных по диаметру опухоли (<5 мм или ≥ 5 мм).
Диагностическая точность по макроскопическому типу (включая как повышенный тип, так и не повышенный тип) также увеличивалась с увеличением количества биопсий ([ Рис. 5 ]) - значительно улучшилась между одной и двумя биопсиями для не повышенного типа, но не для повышенного типа. (примерно от 70% до 80%).
Рис. 5 Точность диагностики в зависимости от количества образцов биопсии, классифицированных по макроскопическому типу (повышенный или не повышенный).
Точность диагностики по цвету поверхности (включая покраснение / одинаковый цвет и бледный цвет) имела тенденцию к увеличению с увеличением количества биопсий, но не значительно ([ Рис. 6 ]). При бледном цвете точность диагностики составляла примерно от 70% до 80%.
Рис. 6 Точность диагностики по количеству образцов биопсии, классифицированных по цвету поверхности (покрасневший / такой же или бледный).
[ Таблица 2 ] сравнивает факторы, связанные с предоперационной гистологической диагностикой ГК или нет. При однофакторном анализе эти факторы, за исключением цвета поверхности: покраснение / такой же, были достоверно положительно связаны с предоперационной диагностикой ГК. Многофакторный анализ выявил два фактора - количество предоперационных биопсий, два или более, и макроскопический тип: без повышенных - в качестве независимых значимых предикторов для GC.
Таблица 2 Однофакторный и многомерный логистический регрессионный анализ факторов для предоперационного диагноза ГК или нет.
ГК - рак желудка; ИЛИ - отношение шансов; ДИ, доверительный интервал
Обсуждение
Наши результаты показывают, что диагностическая точность значительно повысилась, когда количество образцов биопсии увеличилось с одного до двух, но не от двух до трех или более биопсий. В дополнение к этому, выполнение двух или более биопсий было независимым значимым фактором для диагностики раннего GC. Таким образом, оптимальное количество биопсий, необходимых для ранней диагностики ГК, очевидно, составляет два. Есть два возможных объяснения того, почему две биопсии лучше, чем одна. Во-первых, две биопсии уменьшат ошибку выборки, особенно при небольших поражениях. Во-вторых, два образца могут повысить уровень уверенности патологов в диагностике ГК более чем одного образца.
Считается, что множественные биопсии повышают диагностическую точность ГК. Несколько исследований, опубликованных в 1970-х и 1980-х годах, показали, что диагностическая точность ГК может достигать 97,4–100% после пяти или более биопсий подозреваемых поражений [ 11 ] [ 12 ] [ 13 ] [ 14 ]. Руководства, основанные на этих исследованиях, привели к рекомендациям по проведению восьми биопсий в Германии, шести в Великобритании и шести-восьми биопсий в США для диагностики ГК [ 15 ] [ 16 ] [ 17 ]. Однако эти рекомендации в основном предназначались для диагностики расширенного, а не раннего GC. Хотя многие исследования пришли к выводу, что антитромботические препараты не увеличивают риск кровотечения [18 ] [ 19 ], биопсия может вызвать локальный фиброз, что может затруднить эндоскопическое лечение. Поскольку большинство ранних ГК теперь можно эффективно лечить с помощью эндоскопии [ 20 ], это может стать серьезной проблемой. Большее количество биопсий также увеличивает нагрузку на патологов. Оптимизация количества биопсий для диагностики раннего ГК может решить эти проблемы. Поэтому мы провели это исследование, которое показало, что оптимальное количество биопсий - две.
В этом исследовании поражения, которые до операции были диагностированы как группа 2 или 3, считались неправильно диагностированными. Поскольку в этом исследовании было намного больше поражений в группе 3, чем в группе 2, считается, что группа 3 повлияла на наши результаты. Мы часто до операции воспринимаем поражения как аденомы желудка, которые после операции оказываются хорошо дифференцированными аденокарциномами. В отчете, в котором анализировалась эффективность эндоскопической резекции слизистой оболочки при поражениях группы 3, гистопатологически было обнаружено, что 37,2% являются аденокарциномой [ 21]. До операции отличить аденокарциному от аденомы с помощью биопсии может быть непросто. Неправильный диагноз биопсии может быть вызван: (а) образцами биопсии, взятыми только из секции аденомы, хотя поражение имеет как компоненты GC, так и аденомы; и (б) небольшие образцы биопсии могут быть недостаточными для точного диагноза [ 22 ]. Кроме того, некоторые неправильные диагнозы могут быть связаны с неадекватными биопсиями, которые невозможно получить с диагностической или технической точки зрения при раке. По сообщениям, эндоскопическое обследование, в том числе обнаружение покраснения, узловатости и депрессии с помощью C-WLI, полезно для дифференциации аденомы и GC [ 23 ]. В последние годы сообщалось, что объединение M-NBI и C-WLI позволяет проводить более точную дифференциальную диагностику [ 4 ] [ 5] [ 22]. В отличие от биопсии, которую часто получают из одной точки поражения, основным преимуществом эндоскопической оценки является возможность оценить все поражение сразу. Прицельная биопсия из области, где обнаружена раковая опухоль, на основании результатов эндоскопии может уменьшить количество ошибочных предоперационных диагнозов. Однако образцы биопсии, которые слишком малы для точного диагноза, остаются проблемой. Хотя увеличение количества биопсий является одним из способов решения этой проблемы, комплексная эндоскопическая и гистопатологическая диагностика, вероятно, была бы лучшей стратегией, учитывая высокую полезность эндоскопии и проблемы биопсии (т. Е. Лечение поражений, которые сильно подозреваются в GC. при эндоскопической оценке, даже если позднее при биопсии им был поставлен диагноз группы 3). Прогресс в технике эндоскопической резекции также поддерживает эту стратегию. Когда поражения удаляются эндоскопически, мы можем получить большой образец, который позволяет более точный гистологический диагноз по сравнению с биопсией. Таким образом, мы предлагаем провести две биопсии оптимальным образом, а план лечения должен определяться комплексной эндоскопической и гистопатологической диагностикой.
В этом исследовании, независимо от размера опухоли, диагностическая точность значительно повышалась с увеличением количества образцов биопсии с одного до двух. Некоторые исследования классифицировали небольшие поражения GC на mGC и sGC и сообщили, что такие небольшие поражения было трудно диагностировать и обнаружить [ 23 ] [ 24 ]. Очевидно, что мы должны стараться точно диагностировать рак, пока он как можно меньше, потому что такие небольшие виды рака можно вылечить с помощью эндоскопической хирургии. Наше исследование предлагает провести две биопсии, даже mGC или sGC, для точного диагноза. Однако две биопсии могут привести к разделению или исчезновению очень маленьких очагов, что затрудняет их обнаружение во время эндоскопической резекции. Следовательно, эти поражения следует лечить как можно скорее, до того, как исчезнут шрамы от биопсий.
Для возвышенных, покрасневших и одинаковых или бледных поражений точность диагностики существенно не повысилась, когда мы увеличили количество биопсий с одной до двух. Если ограничиваться повышенным шрифтом и бледным цветом, точность диагностики составляла всего 70–80%. Этот результат может отражать процент аденомы (повышенный тип: 21,2%; не повышенный тип: 4,0%; покрасневший / такой же: 5,7%; бледный: 19,4%). Для этих типов поражений более важна комплексная диагностика, включая эндоскопическое обследование.
Наше исследование имеет несколько ограничений. Во-первых, поскольку это было ретроспективное исследование, мы могли рассчитать только чувствительность как диагностическую эффективность; поэтому желательны проспективные исследования. Во-вторых, мы не могли полностью исключить эффект информационной предвзятости; Большие очаги поражения могут быть выполнены множественными биопсиями, а небольшие поражения могут быть выполнены за одну биопсию. В-третьих, фоны трех групп различались, что не могло быть скорректировано с помощью анализа подмножеств. В-четвертых, эндоскопическая система менялась на протяжении всего периода исследования. Хотя использование M-NBI могло повлиять на результат, было невозможно точно извлечь только то поражение, которое было диагностировано M-NBI. Для справки, мы разделили поражения на две группы с 2008 года, когда M-NBI стал стабильной техникой,Дополнительный рис. ]).
.
Вывод:
В заключение, наши результаты показывают, что две биопсии - оптимальное количество, необходимое для диагностики раннего GC.
Список литературы:
1. Fitzmaurice C, Akinyemiju T F, Al Lami F H et al.Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 29 cancer groups, 1990 to 2016. JAMA Oncol. 2018;4:1553–1568. [PMC free article] [PubMed] [Google Scholar]
2. Jun J K, Choi K S, Lee H Y et al.Effectiveness of the Korean National Cancer Screening Program in reducing gastric cancer mortality. Gastroenterology. 2017;152:1319–1928. [PubMed] [Google Scholar]
3. Muto M, Katada C, Sano Y et al.Narrow band imaging: a new diagnostic approach to visualize angiogenesis in superficial neoplasia. Clin Gastroenterol Hepatol. 2005;3:16–20. [PubMed] [Google Scholar]
4. Yao K, Anagnostopoulos G K, Ragunath K. Magnifying endoscopy for diagnosing and delineating early gastric cancer. Endoscopy. 2009;41:462–467. [PubMed] [Google Scholar]
5. Ezoe Y, Muto M, Uedo N et al.Magnifying narrowband imaging is more accurate than conventional white-light imaging in diagnosis of gastric mucosal cancer. Gastroenterology. 2011;141:2017–2025. [PubMed] [Google Scholar]
6. Yao K, Doyama H, Gotoda T et al.Diagnostic performance and limitations of magnifying narrow-band imaging in screening endoscopy of early gastric cancer: a prospective multicenter feasibility study. Gastric Cancer. 2014;17:669–679. [PubMed] [Google Scholar]
7. Hale M D, Gotoda T, Hayden J D et al.Endoscopic biopsies from gastrointestinal carcinomas and their suitability for molecular analysis: a review of the literature and recommendations for clinical practice and research. Histopathology. 2015;67:147–157. [PubMed] [Google Scholar]
8. Choi Y, Choi H S, Jeon W K et al.Optimal number of endoscopic biopsies in diagnosis of advanced gastric and colorectal cancer. J Korean Med Sci. 2012;27:36–39. [PMC free article] [PubMed] [Google Scholar]
9. JGCA . Japanese classification of gastric carcinoma: 3rd English edition. Gastric Cancer. 2011;14:101–112. [PubMed] [Google Scholar]
10. Kanda Y. Investigation of the freely-available easy-to-use software “EZR” (Easy R) for medical statistics. Bone Marrow Transplant. 2013;48:452–458. [PMC free article] [PubMed] [Google Scholar]
11. Dekker W, Tytgat G N. Diagnostic accuracy of fiberendoscopy in the detection of upper intestinal malignancy. A follow-up analysis. Gastroenterology. 1977;73:710–714. [PubMed] [Google Scholar]
12. Misumi A, Mori K, Ikeda T et al.Evaluation of fibergastroscopic biopsy in the diagnosis of gastric cancer: a study of 339 cases. Gastroenterol. Jpn. 1978;13:255–263. [PubMed] [Google Scholar]
13. Sancho-Poch F J, Balanzó J, Ocaña J et al.An evaluation of gastric biopsy in the diagnosis of gastric cancer. Gastrointest. Endosc. 1978;24:281–282. [PubMed] [Google Scholar]
14. Tatsuta M, Iishi H, Okuda S et al.Prospective evaluation of diagnostic accuracy of gastrofiberscopic biopsy in diagnosis of gastric cancer. Cancer. 1989;63:1415–1420. [PubMed] [Google Scholar]
15. Moehler M, Al-Batran S E, Andus T et al.German S3-guideline "Diagnosis and treatment of esophagogastric cancer". Z Gastroenterol. 2011;49:461–531. [PubMed] [Google Scholar]
16. Allum W H, Blazeby J M, Griffin S M. Guidelines for the management of oesophageal and gastric cancer. Gut. 2011;60:1449–1472. [PubMed] [Google Scholar]
17. Ajani J A, Bentrem D J, Besh S et al.Gastric cancer, version 2. 2013: featured updates to the NCCN Guidelines. J Natl Compr. Canc Netw. 2013;11:531–546. [PubMed] [Google Scholar]
18. Sieg A, Hachmoeller-Eisenbach U, Eisenbach T. Prospective evaluation of complications in outpatient GI endoscopy: a survey among German gastroenterologists. Gastrointest Endosc. 2001;53:620–627. [PubMed] [Google Scholar]
19. Johnson B, Basson M D. Absence of complications after endoscopic mucosal biopsy. Dig. Dis. 2018;36:328–332. [PubMed] [Google Scholar]
20. Ono H, Yao K, Fujishiro M et al.Guidelines for endoscopic submucosal dissection and endoscopic mucosal resection for early gastric cancer. Dig. Endosc. 2016;28:3–15. [PubMed] [Google Scholar]
21. Katsube T, Konnno S, Hamaguchi K et al.The efficacy of endoscopic mucosal resection in the diagnosis and treatment of group III gastric lesions. Anticancer Res. 2005;25:3513–3516. [PubMed] [Google Scholar]
22. Miwa K, Doyama H, Ito R et al.Can magnifying endoscopy with narrow band imaging be useful for low grade adenomas in preoperative biopsy specimens? Gastric Cancer. 2012;15:170–178. [PubMed] [Google Scholar]
23. Kozawa H, Nakazawa S, Yoshino J. Clinical and pathological study on minute and small gastric cancers, with special reference to their macroscopic classification. Gastroenterol Endosc. 1985;27:1523–1537. [Google Scholar]
24. Takahashi H, Hirata K, Sawada S et al.Endoscopic diagnosis of minute gastric cancers. Gastroenterol Endosc. 2011;53:1229–1240. [Google Scholar]
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.




.jpg)





.png)



.jpg)
















Комментарии