- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Эндоскопические методы лечения хронического лучевого проктита
| Авторы: | Е.А. Гришина, К.В. Шишин, И.Ю. Недолужко, Н.А. Курушкина, Л.В. Шумкина, А.В. Леонтьев 1 2020г. |
| Об авторах: |
1. ГБУЗ г. Москвы «Московский клинический научно-практический центр им. А.С. Логинова Департамента здравоохранения г. Москвь» |
Аннотация:
Эндоскопические технологии являются не только приоритетным методом диагностики и стадирования, но и основным методом эффективного лечения хронического лучевого проктита. Среди эндоскопических методов лечения могут применяться аппликации формалина, а также остановка кровотечения и устранение сосудистых трансформаций при помощи лигирующих устройств, различных видов лазерного облучения, биполярной коагуляции и криовоздействия, однако при применении этих методов описана большая частота осложнений, в то время как аргоноплазменная коагуляция и радиочастотная аблация являются эффективными, относительно безопасными способами лечения хронического лучевого проктита и легко переносятся пациентами.

Полный текст статьи:
Использование конформной и интенсивно модулированной лучевой терапии, активное применение брахитерапии при раке тазовой локализации позволило значительно повысить эффективность лечения и частоту полных ответов. Однако частота поздних
лучевых повреждений прямой кишки остается достаточно высокой и достигает 5—20 % [3].
Поздние лучевые повреждения прямой кишки в виде лучевого проктита являются распространенным осложнением после лучевой терапии злокачественных опухолей малого таза (рака вульвы, шейки, тела матки, предстательной железы и прямой кишки), развивающимся не ранее чем через 3 мес после окончания лечения и носящим хроническое рецидивирующее течение [1].
По мнению ряда авторов, причиной развития лучевых повреждений являются высокие разовые или суммарные дозы облучения в тех случаях, когда не учитываются особенности распределения дозы. При планировании лучевого лечения имеются весьма объективные сложности профилактики непреднамеренного
3 повреждения соседних органов, которые обусловлены ^ анатомически близким расположением органов в ма-£ лом тазу. Чаще лучевые повреждения являются соче-танными, изолированные поражения одного органа 2 наблюдаются крайне редко [4—6]. = При планировании лучевого лечения следует учи-
а тывать исходное состояние органов, располагающихся = в зоне потенциального воздействия. Наличие сопутст-в вующих заболеваний (сахарный диабет, гипертоническая болезнь, воспалительные заболевания кишечника) является дополнительным фактором риска развития лучевых поражений. Также необходимо принимать во внимание стадию опухолевого процесса и суммарную очаговую дозу воздействия [7, 8].
Особую группу составляют пациенты с системными заболеваниями соединительной ткани. У этой категории больных определяются исходные изменения структуры сосудистой стенки и патофизиологические особенности соединительной ткани, которые влияют на частоту и тяжесть лучевых поражений. В. Longobardi и соавт. оценили частоту возникновения лучевых повреждений у пациентов с ревматоидным артритом, системной красной волчанкой, склеродермией и выявили достоверную более высокую частоту поздних осложнений — 29,1 % по сравнению с 14 % в контрольной группе [9].
Хронический лучевой проктит (ХЛП) — одно из наиболее частых осложнений лучевой терапии в лечении онкологических заболеваний органов малого таза, развивается в 5—20 % случаев в зависимости от типа и дозы облучения. В основе заболевания лежит непосредственное радиационное повреждение слизистой оболочки прямой и сигмовидной кишки с минимальными воспалительными изменениями, поэтому термин «хроническая постлучевая проктопатия» является приоритетным для использования [10].
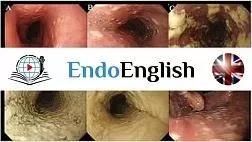
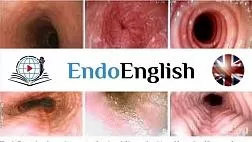
Патогенез ХЛП до сих пор полностью не изучен. Он начинается с радиационного поражения слизистой оболочки, которое приводит к дополнительному росту эндотелия и ремоделированию соединительной ткани, в результате чего возникают ишемические изменения тканей [11]. Излучение вызывает разрывы в цепочке ДНК, что приводит к гибели опухолевых клеток, однако это воздействие распространяется и на стволовые клетки кишечных крипт. Происходит массивная гибель клеток слизистого и подслизистого слоев стенки прямой кишки. В последующем активируется цитоки-новая система, приводящая к хронической ишемии слизистой оболочки, прогрессирующей атрофии эпителия, фиброзу и развитию облитерирующего эндар-териита. Все изменения в стенке прямой кишки, анальном канале приводят к развитию рецидивирующих кровотечений из вновь образованных сосудистых сплетений, стриктуре прямой кишки, образованию глубоких язв и ректовагинальных свищей [11, 12].
Лучевые повреждения прямой кишки подразделяют на острую и хроническую формы. Острые могут
возникать в процессе проведения лучевой терапии в первые 6 нед после ее окончания. В зависимости от степени выраженности клинических проявлений данные осложнения могут являться причиной временного прерывания курса лечения. Хронические формы проявляются в первые 2—3 года после проведенного курса лучевой терапии, могут иметь рефрактерный период и носят рецидивирующее течение [13, 14].
В 1959 г. F. Irving и J.W. McElwain впервые описали ХЛП и первые методы его лечения. Для ХЛП характерно наличие латентного периода после окончания лучевой терапии и до появления клинических симптомов. Бессимптомный период может составлять от нескольких месяцев до года, чаще 6—12 мес [6, 15].
Клиническими проявлениями ХЛП являются боли внизу живота различной интенсивности, которые усиливаются при акте дефекации, диарея, тенезмы и императивные позывы на дефекацию. Однако наиболее значимым клиническим проявлением заболевания являются ректальные кровотечения. Прямокишечное кровотечение — наиболее распространенный симптом, имеющий место более чем у 80 % пациентов с поздними лучевыми повреждениями прямой кишки. Ректальные кровотечения носят тяжелый и рефрактерный характер, часто не поддаются консервативной терапии и могут приводить к развитию анемии тяжелой степени [16].
При развернутой клинической картине заболевания существенно ограничивается ежедневная активность и снижается качество жизни пациентов. Механизм возникновения кровотечений обусловлен просачиванием крови через рыхлую ишемизирован-ную слизистую оболочку или разрывы телеангиэкта-зий. Кровотечения могут носить достаточно массивный характер и являться причиной анемии, требующей переливания компонентов крови. Симптомы заболевания неспецифичны, поэтому для окончательной постановки диагноза следует проводить дифференциальную диагностику с воспалительными заболеваниями кишечника [6, 17].
Для оценки повреждений прямой кишки используют шкалу степени выраженности постлучевого проктита RTOG/EORTC (Radiation Therapy Oncology Group Rectal Toxicity Scale, 1995) (табл. 1) [18].
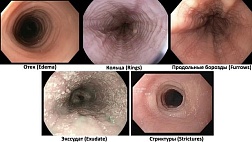
Стандартным методом диагностики ХЛП является эндоскопическое исследование прямой и сигмовидной кишки. Во время проведения колоноскопии выявляются бледность слизистой оболочки, отечность, рыхлая слизистая оболочка со спонтанными кровоизлияниями. При более тяжелом течении отмечаются язвенные дефекты слизистой, стриктуры и свищи. Морфологическое исследование слизистой оболочки прямой кишки у пациентов с поздними лучевыми повреждениями позволяет провести дифференциальную диагностику с другими воспалительными заболеваниями кишечника [17].
Таблица 1. Шкала оценки тяжести лучевого проктита Table 1. Scale for assessing radiation proctitis severity
Степень тяжести Клинические проявления
Severity 1
0 Без проявлений None
1 Легкая диарея (<5 раз в день), редкие спазмы, не требующие приема анальгетиков, незначительные выделения из прямой кишки Mild diarrhea (<5 times a day); rare spasms that do not require analgesics; minor discharge from the rectum
2 Диарея (>5 раз в день), значительные выделения слизи и непостоянные кровотечения Diarrhea (>5 times a day); significant mucus discharge and intermittent bleeding
3 Обильные кровотечения, требующие хирургического вмешательства, наличие стриктуры Severe bleeding that requires surgery; presence of stricture
4 Некроз стенки кишки, перфорация, образование свищей Necrosis of the intestinal wall; perforation; fistulas
5 Летальный исход, связанный с проявлениями заболевания Death associated with disease manifestations
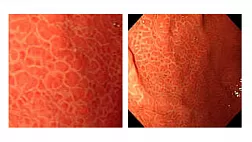
Для оценки степени тяжести поражения слизистой оболочки прямой кишки K.D. Chi была разработана система классификации ХЛП с учетом распространенности и степени выраженности телеангиэктазий — Rectal Telangiectasia Density Grading Scale. Применение шкалы Rectal Telangiectasia Density подразумевает оценку количества телеангиэктазий на слизистой оболочке прямой кишки с градацией от 0 до 3 (табл. 2).
Таблица 2. Шкала плотности ректальных телеангиэктазий Table 2. Scale for assessing rectal telangiectasia density
Степень тяжести хронического лучевого проктита Severity of chronic radiation proctitis Эндоскопический критерий
0 Нормальная слизистая оболочка, без изменений Normal mucous membrane, no changes
1 <10 отдельных телеангиэктазий <10 separate telangiectasias
2 1 участок сливных телеангиэктазий и/или 10 и более дискретных телеангиэктазий 1 area of confluent telangiectasias and/or 10 or more discrete telangiectasias
3 2 и более участков сливных телеангиэктазий 2 and more areas of confluent telangiectasias
При разработке классификации в исследование включались пациенты с клиническими проявлениями ХЛП по следующим критериям: кровотечение из прямой кишки 3 раза в неделю; кровотечение при каждом акте дефекации; кровотечение при уровне гемоглобина <100 (см. табл. 2) [19].
Гистологическое исследование биоптатов измененной слизистой оболочки прямой кишки не имеет специфических диагностических критериев ХЛП, однако позволяет исключить другие причины проктопатии (воспалительные и инфекционные заболевания кишки). Но следует отметить, что гистологическое исследование рекомендуется проводить только в отдельных случаях при сомнениях в диагнозе, так как при взятии гистологического материала высока вероятность возникновения кровотечения, изъязвления и последующего формирования свищей [20].
Лечение ректальных кровотечений у таких пациентов представляется достаточно сложной задачей. Медикаментозная терапия, как правило, малоэффективна, а стандартные хирургические подходы сопровождаются большим числом осложнений и высокой летальностью. Эндоскопические технологии являются не только приоритетным методом диагностики и ста-дирования заболевания, но и основным методом эффективного комплексного лечения. Среди эндоскопических методов лечения могут применяться аппликации формалина, а также остановка кровотечения и устранение сосудистых трансформаций при помощи лиги-рующих устройств, различных видов лазерного облучения, биполярной и аргоноплазменной коагуляции (АПК), криовоздействия, радиочастотной аблации (РЧА) [21].
Современные методы лечения ХЛП включают консервативную терапию, эндоскопическое и хирургическое лечение [22, 23].
Консервативную терапию можно разделить на медикаментозные и немедикаментозные методы лечения.
Медикаментозное лечение основано на применении нестероидных противовоспалительных препаратов, глюкокортикостероидов (метилпреднизолон, преднизолон), препаратов 5-аминосалициловой кислоты (месалазин), гастропротекторов (сукральфат), витаминов А, С и Е, клизмы с короткоцепочечными жирными кислотами (бутират) [21, 24]. На сегодняшний день медикаментозная терапия не является доказанным эффективным методом лечения ХПП и используется при легкой степени тяжести заболевания для профилактики прогрессирования [21, 25].
К немедикаментозным методам консервативного лечения относится гипербарическая оксигенация (ГБО). Метод оказывает ангиогенный эффект, стимулирует образование коллагена, усиливает активность антиоксидантных ферментов, вследствие чего снижается концентрация свободных радикалов и усиливаются процессы реэпителизации. Эффективность методики в купировании проявлений ХЛП достигает
80—90 %. Существенным недостатком ГБО является ^ его ограниченная доступность. Как правило, отделе-£ ния ГБО-терапии расположены только в крупных специализированных центрах. В настоящее время ГБО не 2 является рутинным повсеместно распространенным = методом лечения ХЛП и обычно используется в тех а случаях, когда выявляется резистентность к более до-= ступным методам лечения [22, 26]. Кроме того, дол-в госрочная эффективность ГБО до сих пор не изучена.
Еще одним методом лечения ХЛП является хирургический. Оперативное вмешательство показано в 10—15 % наблюдений, однако при этом выявляется большая частота осложнений и летального исхода. Показаниями к оперативному вмешательству являются выраженные стриктуры прямой кишки, свищи, рецидивирующие профузные кровотечения, требующие переливания компонентов крови [6, 27]. Объем оперативного вмешательства заключается в резекции или экстирпации прямой кишки с формированием коло-стомы. При этом в 10 % случаев выведение колостомы используют в качестве временной меры, однако в последующем большинство колостом становятся постоянными, что резко снижает качество жизни пациентов [28].
Среди эндоскопических методов можно выделить орошение слизистой оболочки раствором формалина, лигирование сосудистых трансформаций, криоабла-цию, АПК и РЧА. Основной целью эндоскопических методов лечения является уменьшение количества те-леангиэктазий, которые приводят к развитию прямокишечных кровотечений.
Раствор формалина может быть применен путем орошения как при помощи клизм, так и при прецизионном введении через канал эндоскопа. При воздействии формалина на ткани с интенсивной неоваскуляри-зацией происходит химически опосредованный некроз, который приводит к склерозированию вновь образующихся патологических сосудов; таким образом, снижается риск возникновения кровотечения [23]. Эффективность метода достигает 70—100 %, однако отмечается большое число осложнений, таких как боли в прямой кишке, стриктуры, язвы, свищи. В редких случаях в результате лечения могут возникнуть перфорация кишки и анальная инконтиненция [29, 30].
Т.Н. Ма и соавт. провели исследование пациентов, которые получили лечение ХЛП путем орошения формалина в прямую кишку под спинальной анестезией. В исследование были включены пациенты с 1—11 степенью ХЛП, резистентные к медикаментозному лечению (применение кортикостероидов, сукральфата и 5-аминосалициловой кислоты). Критерием исключения явились осложненные формы ХЛП: язвенные дефекты слизистой оболочки, стриктуры (вследствие высокого риска перфораций), а также наличие интенсивных кровотечений, требующих переливания компонентов крови, аллергическая реакция на формалин.
Перед исследованием выполнялась водяная клизма, затем — орошение слизистой прямой кишки 10—20 мл 4 % раствора формалина в течение 0,5—3,0 мин до полной остановки кровотечения. Авторы отметили эффективность метода у 79,1 % пациентов, при этом они отметили прекращение кровотечения в течение первых 2 сут после лечения. При эндоскопическом контроле также было отмечено уменьшение числа телеан-гиэктазий. У пациентов с обширными поражениями эффективность лечения была существенно ниже, с большим числом побочных эффектов в виде болевого синдрома, тенезм и формирования стриктур прямой кишки [31].
Таким образом, орошение формалином имеет ограниченное применение у пациентов с легкой степенью ХЛП. Также следует принимать во внимание высокую вероятность побочных эффектов (до 40—70 %) [3, 6, 32]. Кроме того, техника выполнения манипуляции, концентрация формалина и показатели эффективности лечения, о которых сообщалось в различных исследованиях, сильно различаются [26].
Эндоскопическое лигирование сосудистых трансформаций впервые применено в клинической практике в 1986 г. и в настоящее время считается методом выбора для профилактики и лечения кровотечений портального генеза из варикозно расширенных вен пищевода [33]. В 2012 г. В. MangiavШano и соавт. опубликовали результаты лечения 1 пациента с ХЛП с помощью лигирующего устройства. Этому больному ранее было проведено 2 сеанса АПК ангиэктазий, которые привели к осложнению в виде формирования большого язвенного дефекта на фоне продолжающегося кровотечения из телеангиэктазий. Было проведено лигирование сосудистых трансформаций. Процедура выполнялась стандартным гастроскопом и стандартным устройством для эндоскопического лигирования. На протяжении всего периода лечения пациент также получал медикаментозную терапию месалазином. Всего было выполнено 2 сеанса с перерывом в 20 дней. Отмечены улучшение состояния пациента, уменьшение болевого синдрома, а также прекращение эпизодов кровотечения. Через 45 дней пациенту выполнена колоноскопия, при которой признаки ХЛП отсутствовали [34].
Однако этот метод не получил широкого распространения. В настоящее время требуется больше данных и проведение дополнительных исследований для оценки его эффективности.
Криоаблация с применением жидкого азота представляет собой метод бесконтактного воздействия на очаги сосудистой трансформации [35]. В специализированной литературе опубликовано несколько исследований применения криоаблации [36, 37]. Криотерапия выполняется с помощью катетера, проводимого через канал эндоскопа. Распыление жидкого азота короткими сериями в виде спрея проводится под визуальным
контролем при расположении криозонда на расстоянии 0,5—1,0 см от стенки кишки. Описаны технические трудности выполнения процедуры в виде ухудшения визуализации. С целью уменьшения этих проявлений J.A. Dumot и B.D. Greenwald предложили использование колпачка для резекции слизистой оболочки [38].
После выполненного лечения пациенты отмечали уменьшение болевого синдрома и прекращение ректального кровотечения. Однако описаны осложнения в виде перфорации стенки слепой кишки, вероятнее всего, из-за чрезмерной аппликации жидкого азота во время проведения процедуры. По этой причине в последующих исследованиях сокращалось время воздействия жидкого азота на слизистую оболочку, а также проводилась тотальная колоноскопия после завершения криоаблации [37].
Применение криоаблации для лечения ХЛП до сих пор носит экспериментальный характер. В настоящее время нет исследований, сравнивающих криотерапию с другими методами лечения. Однако исследования на животных показали, что воздействие жидкого азота на ткани глубже, чем при применении АПК и РЧА; исходя из этого, можно предположить, что криотерапия — более опасная методика в отношении развития послеоперационных перфораций и свищей.
Аргоноплазменная коагуляция представляет собой бесконтактный метод поверхностной коагуляции слизистой оболочки, который реализуется в потоке инертного газа аргона, преобразующегося в плазму.
Методика АПК показана при ХЛП легкой и средней степени тяжести. После проведенного лечения в 80—90 % случаев пациенты отмечают уменьшение кровотечения из прямой кишки, также у 60—75 % пациентов уменьшаются симптомы диареи и тенезмы [39, 40]. Преимуществом метода является возможность проведения равномерной поверхностной коагуляции тканей на глубину от 0,5 до 3 мм. В нескольких исследованиях сообщается, что для достижения хорошего эффекта терапии и уменьшения количества телеанги-эктазий слизистой оболочки прямой кишки требуется проведение около 8 сеансов АПК [41]. Так, M. Kaassis и соавт. показали, что пациенты, получавшие АПК, после первых сеансов отмечали возникновение рецидивов кровотечения, которое удалось остановить. Для достижения стойкого эффекта им понадобилось проведение нескольких курсов АПК с интервалом между сеансами от 4 до 8 нед [42].
По сообщениям разных авторов, частота осложнений варьирует от 2 до 28 % и зависит от степени выраженности заболевания, опыта хирурга, выполняющего манипуляцию, характеристик оборудования. В процессе лечения могут возникать различные осложнения, вплоть до тяжелых, таких как глубокие язвенные дефекты, перфорация стенки кишки, стриктуры и свищи, что может быть связано с различиями использования режимов коагуляции [43]. На частоту
возникновения язвенных дефектов в прямой кишке з могут влиять технические параметры проведения ма- ^ нипуляции, такие как скорость потока газа, мощность £ коагуляции, интервал между сеансами [44]. е.
Технические особенности выполнения АПК до сих j= пор не стандартизированы. По различным исследова- = ниям диапазон использованных настроек мощности а составляет от 30 до 60 Вт при скорости потока газа = от 0,8 до 2,0 л. Однако прослеживается связь между в низкими параметрами установки мощности и частотой осложнений. Почти все осложнения описаны при установке мощности >45 Вт. Таким образом, низкие настройки уровня мощности вызывают более контролируемую по глубине коагуляцию слизистой оболочки [45].
Возникновение стриктур после АПК наблюдается значительно реже, частота осложнения варьирует от 2 до 13 %. Следует учитывать, что большинство стриктур прямой кишки протекают бессимптомно.
Аргоноплазменная коагуляция не применяется при ХЛП тяжелой степени, а также при обширных участках телеангиэктазий (более половины вовлеченной слизистой оболочки прямой кишки). Также достаточно сложной областью считается расположение пораженного участка непосредственно над зубчатой линией, что связано с высоким риском повреждения чувствительной зоны слизистой оболочки анального канала и развития стойкого болевого синдрома в послеоперационном периоде [44].
Радиочастотная аблация является сравнительно новой технологией эндоскопического лечения ХЛП. Ограниченная глубина проникновения термического воздействия не превышает 0,5—1,0 мм и зависит от установленной мощности плотности контакта и продолжительности воздействия. Опубликованные исследования последнего времени показывают эффективность и безопасность использования РЧА для лечения лучевого проктита с использованием электродов локального воздействия HALO 90 [35, 46—48].
Техника хирургического воздействия на слизистую оболочку прямой кишки имеет некоторые различия по сравнению с работой на пищеводе. Анатомические особенности и большой диаметр кишки практически исключают возможность эффективного использования циркулярных аблационных катетеров. При этом невозможно обеспечить плотный контакт электрода с поверхностью слизистой оболочки. Поэтому приоритетным является использование электродов локального воздействия. Второй особенностью вмешательства является работа в инверсионном положении эндоскопа. При этом четко визуализируется дисталь-ная граница патологических изменений и достигается полноценная обработка всей патологически измененной слизистой оболочки. Для оперативного вмешательства используются гастроскоп и стандартный аблационный катетер HALO 90, которым значительно
проще достигнуть комфортных условий работы в по-^ ложении инверсии. С учетом инверсивной работы при £ монтаже рабочий электрод следует располагать в нижней полуокружности поля зрения аппарата. 2 Для обеспечения оптимального гемостаза следует
= осуществлять плотный контакт электрода с поверхно-а стью слизистой оболочки прямой кишки. Сам элек-® трод должен быть чистым и свободным от коагуляци-в онного струпа, возникающего в процессе работы. С этой целью рекомендуется после каждых 8 циклов активации РЧА извлекать электрод и проводить его очистку. Следует начинать аблацию с дистального края поражения на 1 мм проксимальнее зубчатой линии с целью профилактики повреждения чувствительной зоны слизистой оболочки анального канала и возникновения болей в послеоперационном периоде. Для профилактики возникновения стриктуры прямой кишки нецелесообразно подвергать одномоментной циркулярной аблации >6 см кишки. При большой зоне поражения процедура аблации может повторяться с достижением конечного результата за несколько сеансов. На основании результатов проведенных ранее исследований рекомендуемые параметры плотности энергии составляют 12—15 Дж/см2 при мощности тока 40 Вт. При этом не происходит трансмурального термического повреждения тканей и минимизируется риск развития ожоговой стриктуры прямой кишки [35, 48].
Для полноценной обработки всей поверхности слизистой оболочки электрод последовательно перемещается по окружности кишки с небольшим перекрыванием области радиочастотного воздействия. Эффективность коагуляции осуществляется по визуальным параметрам. Как правило, проводится последовательная двукратная обработка участка слизистой
оболочки с последующим перемещением электрода. После циркулярной обработки слизистой оболочки электрод перемещается более проксимально, и цикл повторяется на другом уровне.
Болевые ощущения в послеоперационном периоде отмечаются примерно у 12 % больных и купируются приемом нестероидных воспалительных препаратов. После 1 или 2 сеансов РЧА достигается убедительный гемостатический эффект, который проявляется в виде редукции клинических проявлений и увеличения уровня гемоглобина крови [35, 48].
Также к преимуществам данного метода следует отнести реэпителизацию тканей без образования стенозов и изъязвлений. РЧА без дополнительного риска развития осложнений позволяет обрабатывать гораздо более обширные участки ткани по сравнению с другими методами лечения. Однако к недостаткам этого метода следует отнести стоимость расходных материалов на каждую процедуру.
Лечение ХЛП остается сложной и не изученной до конца задачей. В настоящее время эндоскопические технологии являются не только приоритетным методом диагностики и стадирования заболевания, но и основным методом эффективного лечения ХЛП. Несмотря на многообразие методов эндоскопического лечения, приоритетными являются АПК и РЧА. Эти методы эффективны, относительно безопасны и легко переносятся пациентами. Однако стоит отметить, что применение АПК эффективно при малой площади поражения слизистой оболочки прямой кишки, и для успешного результата может потребоваться несколько курсов лечения. РЧА по сравнению с другими методами лечения позволяет обрабатывать любые площади пораженной ткани без дополнительного риска развития осложнений..
Список литературы:
1. Beels L., Bacher K., Smeets P. et al. Dose-length product of scanners correlates with DNA damage in patients undergoing contrast CT. Eur J Radiol 2012;81(7): 1495-9. DOI: 10.1016/j.ejrad.2011.04.063.
2. Sarin A., Safar B. Management
of radiation proctitis. Gastroenterol Clin North Am 2013;42(4):913-25. DOI: 10.1016/j.gtc.2013.08.004.
3. Trzcinski R., Dziki A., Brys M. et al. Expression of vascular endothelial growth factor and its correlation with clinical symptoms and endoscopic findings in patients with chronic radiation proctitis. Colorectal Dis 2018;20(4):321-30. DOI: 10.1111/codi.13902.
4. Tabaja L., Sidani S.M. Management of radiation proctitis. Dig Dis Sci 2018;63(9):2180-8.
DOI: 10.1007/s10620-018-5163-8.
5. Vanneste B.G., Van De Voorde L.,
de Ridder R.J. et al. Chronic radiation
proctitis: tricks to prevent and treat. Int J Colorectal Dis 2015;30(10):1293-303. DOI: 10.1007/s00384-015-2289-4.
6. Weiner J.P., Wong A.T., Schwartz D. et al. Endoscopic and non-endoscopic approaches for the management of radiation-induced rectal bleeding. World J Gastroenterol 2016;22(31):6972-86. DOI: 10.3748/wjg.v22.i31.6972.
7. Kennedy G.D., Heise C.P. Radiation colitis and proctitis. Clin Colon Rectal Surg 2007;20(1):64-72.
DOI: 10.1055/s-2007-970202.
8. Sindelar W.F., Kinsella T.J. Normal tissue tolerance to intraoperative radiotherapy. Surg Oncol Clin N Am 2003;12(4):925-42. DOI: 10.1016/s1055-3207(03)00087-5.
9. Longobardi B., Berardi G., Fiorino C. et al. Anatomical and clinical predictors of acute bowel toxicity in whole pelvis irradiation for prostate cancer
with Tomotherapy. Radiother Oncol
2011;101(3):460-4.
DOI: 10.1016/j.radonc.2011.07.014.
10. Hong J.J., Park W., Ehienpieis E.D. Review article: current therapeutic options for radiation proctopathy. Aliment Pharmacol Ther 2001;15(9):1253-62. DOI: 10.1046/j.1365-2036.2001.01075.x.
11. Quastler H. Cell renewal and acute radiation damage. Radiology 1959;73:161-5. DOI: 10.1148/73.2.161.
12. Shadad A.K., Sullivan F.J., Martin J.D., Egan L.J. Gastrointestinal radiation injury: symptoms, risk factors and mechanisms. World J Gastroenterol 2013;19(2):185-98. DOI: 10.3748/wjg.v19.i2.185.
13. Pedersen D., Bentzen S.M., Overgaard J. Early and late radiotherapeutic morbidity in 442 consecutive patients with locally advanced carcinoma of the uterine cervix. Int J Radiat Oncol Biol Phys 1994;29(5):941-52.
DOI: 10.1016/0360-3016(94)90387-5.
14. Schultheiss T.E., Hanks G.E., Hunt M.A., Lee W.R. Incidence of and factors related to late complications in conformal and conventional radiation treatment of cancer of the prostate. Int J Radiat Oncol Biol Phys 1995;32(3):643-9.
DOI: 10.1016/0360-3016(95)00149-s.
15. Garg A.K., Mai W.Y., McGary J.E. et al. Radiation proctopathy in the treatment of prostate cancer. Int J Radiat Oncol Biol Phys 2006;66(5):1294-305.
DOI: 10.1016/j.ijrobp.2006.07.1386.
16. Tagkalidis P.P., Tjandra J.J. Chronic radiation proctitis. ANZ J Surg 2001;71(4):230—7.
DOI: 10.1046/j.1440-1622.2001.02081.x.
17. Leiper K., Morris A.I. Treatment of radiation proctitis. Clin Oncol (R Coll Radiol) 2007;19(9):724-9. DOI: 10.1016/j.clon.2007.07.008.
18. Cox J.D., Stetz J., Pajak T.F. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC). Int J Radiat Oncol Biol Phys 1995;31(5):1341—6. DOI: 10.1016/0360-3016(95)00060-C.
19. Chi K.D., Ehrenpreis E.D., Jani A.B. Accuracy and reliability of the endoscopic classification of chronic radiation-induced proctopathy using a novel grading method. J Clin Gastroenterol 2005;39(1):42-6.
20. Goldner G., Tomicek B., Becker G. et al. Proctitis after external-beam radiotherapy for prostate cancer classified by Vienna Rectoscopy Score and correlated with EORTC/RTOG score for late rectal toxicity: results of a prospective multicenter study of 166 patients. Int J Radiat Oncol Biol Phys 2007;67(1):78-83. DOI: 10.1016/j.ijrobp.2006.08.055.
21. Lenz L., Rohr R., Nakao F. et al. Chronic radiation proctopathy: A practical review of endoscopic treatment. World J Gastrointest Surg 2016;8(2):151—60. DOI: 10.4240/wjgs.v8.i2.151.
22. Clarke R.E., Tenorio L.M., Hussey J.R. et al. Hyperbaric oxygen treatment of chronic refractory radiation proctitis: a randomized and controlled double-blind crossover trial with long-term follow-up. Int J Radiat Oncol Biol Phys 2008;72(1): 134-43. DOI: 10.1016/j.ijrobp.2007.12.048.
23. Laterza L., Cecinato P., Guido A. et al. Management of radiation-induced rectal bleeding. Curr Gastroenterol Rep 2013;15(11):355.
DOI: 10.1007/s11894-013-0355-z.
24. Kochhar R., Patel F., Dhar A. et al. Radiation-induced proctosigmoiditis. Prospective, randomized, double-blind controlled trial of oral sulfasalazine plus rectal steroids versus rectal sucralfate. Dig Dis Sci 1991;36(1):103-7.
DOI: 10.1007/BF01300096.
25. Denton A., Forbes A., Andreyev J., Maher E.J. Non surgical interventions for late radiation proctitis in patients who have received radical radiotherapy
to the pelvis. Cochrane Database Syst Rev 2002;(1):CD003455. DOI: 10.1002/14651858.CD003455.
26. Denton A.S., Andreyev H.J., Forbes A., Maher E.J. Systematic review for nonsurgical interventions for the management of late radiation proctitis. Br J Cancer 2002;87(2):134-43.
DOI: 10.1038/sj.bjc.6600360.
27. Lund J.A., Kaasa S., Wibe A. et al. Late radiation effects to the rectum and anus after treatment for prostate cancer; validity of the LENT/SOMA score. Acta Oncol 2013;52(4):727-35.
DOI: 10.3109/0284186X.2013.747695.
28. Robertson I., Leung E., Hughes D. et al. Prospective analysis of stoma-related complications. Colorectal Dis 2005;7(3):279-85.
DOI: 10.1111/j.1463-1318.2005.00785.x.
29. Alfadhli A.A., Alazmi W.M., Ponich T.
et al. Efficacy of argon plasma coagulation compared to topical formalin application for chronic radiation proctopathy. Can J Gastroenterol 2008;22(2):129-32. DOI: 10.1155/2008/964912.
30. Raman R.R. Two percent formalin retention enemas for hemorrhagic radiation proctitis: a preliminary report. Dis Colon Rectum 2007;50(7):1032-9. DOI: 10.1007/s10350-007-0241-6.
31. Ma T.H., Yuan Z.X., Zhong Q.H. et al. Formalin irrigation for hemorrhagic chronic radiation proctitis. World J Gastroenterol 2015;21(12):3593-8. DOI: 10.3748/wjg.v21.i12.3593.
32. De Parades V., Etienney I., Bauer P. et al. Formalin application in the treatment
of chronic radiation-induced hemorrhagic proctitis — an effective but not risk-free procedure: a prospective study of 33 patients. Dis Colon Rectum 2005;48(8):1535-41. DOI: 10.1007/s10350-005-0030-z.
33. Bonilha D.Q., Lenz L., Correia L.M. et al. Propranolol associated
with endoscopic band ligation reduces recurrence of esophageal varices for primary prophylaxis of variceal bleeding: a randomized-controlled trial. Eur J Gastroenterol Hepatol 2015;27(1):84-90. DOI: 10.1097/MEG.0000000000000227.
34. Mangiavillano B., Morandi E., Viaggi P. et al. Rectal band ligation for treatment of extensive chronic hemorrhagic radiation proctitis. Endoscopy 2012;44(Suppl 2):UCTN:E375.
DOI: 10.1055/s-0032-1310062.
35. Rustagi T., Corbett F.S., Mashimo H. Treatment of chronic radiation proctopathy with radiofrequency ablation (with video). Gastrointest Endosc 2015;81(2):428-36.
DOI: 10.1016/j.gie.2014.04.038.
36. Moawad F.J., Maydonovitch C.L., Horwhat J.D. Efficacy of cryospray ablation for the treatment of chronic radiation proctitis in a pilot study. Dig Endosc 2013;25(2):174-9.
DOI: 10.1111/j.1443-1661.2012.01355.x.
37. Hou J.K., Abudayyeh S., Shaib Y. Treatment of chronic radiation proctitis with cryoablation [published correction appears in Gastrointest Endosc 2011;73(5):1073]. Gastrointest Endosc 2011;73(2):383-9.
DOI: 10.1016/j.gie.2010.10.044.
38. Dumot J.A., Greenwald B.D. Argon plasma coagulation, bipolar cautery, and cryotherapy: ABC's of ablative techniques. Endoscopy 2008;40(12):1026-32.
DOI: 10.1055/s-0028-1103414.
39. Andreyev H.J. Argon plasma coagulation in chronic radiation proctitis: Postgate et al. Endoscopy 2007;39(8):751-2. DOI: 10.1055/s-2007-966772.
40. Sebastian S., O'Connor H., O'Morain C., Buckley M. Argon plasma coagulation as first-line treatment for chronic radiation proctopathy. J Gastroenterol Hepatol 2004;19(10):1169-73.
DOI: 10.im/j.1440-1746.2004.03448.x.
41. Tjandra J.J., Sengupta S. Argon plasma coagulation is an effective treatment for refractory hemorrhagic radiation proctitis. Dis Colon Rectum 2001;44(12):1759-71. DOI: 10.1007/BF02234451.
42. Kaassis M., Oberti E., Burtin P., Boyer J. Argon plasma coagulation for the treatment of hemorrhagic radiation proctitis. Endoscopy 2000;32(9):673-6.
DOI: 10.1055/s-2000-9023.
43. Sato Y., Takayama T., Sagawa T. et al. Argon plasma coagulation treatment of hemorrhagic radiation proctopathy: the optimal settings for application and long-term outcome. Gastrointest Endosc 2011;73(3):543-9.
DOI: 10.1016/j.gie.2010.11.015.
44. Ravizza D., Fiori G., Trovato C., Crosta C. Frequency and outcomes of rectal ulcers during argon plasma coagulation for chronic radiation-induced proctopathy. Gastrointest Endosc 2003;57(4):519-25. DOI: 10.1067/mge.2003.144.
45. Canard J.M., Védrenne B., Bors G. et al. Résultats à long terme du traitement des rectites radiques hémorragiques par la coagulation au plasma d'argon [Long term results of treatment of hemorrhagic radiation proctitis by argon plasma coagulation]. Gastroenterol Clin Biol 2003;27(5):455-9.
46. Patel A., Pathak R., Deshpande V. et al. Radiofrequency ablation using BarRx for the endoscopic treatment of radiation proctopathy: a series of three cases. Clin Exp Gastroenterol 2014;7:453-60. DOI: 10.2147/CEG.S66534.
47. Pigo F., Bertani H., Manno M. et al. Radiofrequency ablation for chronic radiation proctitis: our initial experience with four cases. Tech Coloproctol 2014;18(11):1089-92.
DOI: 10.1007/s10151-014-1178-0.
48. Dray X., Battaglia G., Wengrower D. et al. Radiofrequency ablation for the treatment of radiation proctitis. Endoscopy 2014;46(11):970-6.
DOI: 10.1055/s-0034-1377756.
Статьи по теме
Рекомендуемые статьи
Гематохезия
наличие неизмененной крови в стуле
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.
















.jpg)




.png)














Комментарии