- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Качественные показатели для колоноскопии: современные идеи и предостережения. Ретроскоп. FUSE.
Полный текст статьи:
Качественные показатели для колоноскопии: современные идеи и предостережения
Хендрикус Дж. М. Пулленс, Питер Д Серсема
Хендрикус Дж. М. Пулленс, отделение гастроэнтерологии и гепатологии, Медицинский центр Меандер, 3800 BM Amersfoort, Нидерланды
Hendrikus JM Pullens, Peter D Siersema, Отделение гастроэнтерологии и гепатологии, Университетский медицинский центр Утрехт, 3508 GA Утрехт, Нидерланды
Авторский вклад : Pullens HJM и Siersema PD проанализировали и интерпретировали данные; Пулленс HJM составил рукопись; Сирсема П.Д. критически пересмотрел рукопись.
Опубликовано онлайн: 16 декабря 2014 г.
Колоноскопия является диагностическим методом выбора для изучения симптомов, предположительно связанных с толстой кишкой, и для выявления полипов и колоректального рака (CRC). Было показано, что колоноскопия с удалением обнаруженных полипов снижает частоту и смертность от последующих CRC. Во многих странах были начаты программы популяционного скрининга на CRC, либо путем отбора пациентов для колоноскопии с анализом кала на скрытую кровь, либо путем предложения колоноскопии непосредственно лицам со средним риском. Несколько обществ по эндоскопии разработали качественные показатели для колоноскопии. Эти качественные показатели почти всегда включаются в качестве показателей процесса, а не показателей результата. В этом обзоре рассматриваются показатели качества подготовки кишечника, частота интубации слепой кишки, время отмены, частота выявления аденомы, комфорт пациента, скорость седации и осложнений, а также обсуждает научные доказательства, подтверждающие их, а также их потенциальные недостатки и проблемы, которые необходимо решить. Например, до сих пор нет четкого и общепринятого определения адекватной подготовки кишечника, нет надежных научных данных, подтверждающих частоту интубации слепой кишки ≥ 90%, и связь между временем отмены и возникновением интервальных раков не была выяснена. Показатель выявления аденомы в настоящее время является единственным показателем качества, который, как было показано, связан с интервальным колоректальным раком, но в качестве показателя он не проводит различия между субъектами с одной или несколькими обнаруженными аденомами. до сих пор нет четкого и общепринятого определения адекватной подготовки кишечника, нет надежных научных данных, подтверждающих частоту интубации слепой кишки ≥ 90%, и связь между временем отмены и возникновением интервальных раков не была выяснена. Уровень обнаружения аденомы в настоящее время является единственным показателем качества, который, как было показано, связан с интервальным колоректальным раком, но в качестве показателя он не различает субъектов с одной или несколькими обнаруженными аденомами. до сих пор нет четкого и общепринятого определения адекватной подготовки кишечника, нет надежных научных данных, подтверждающих частоту интубации слепой кишки ≥ 90%, и связь между временем отмены и возникновением интервальных раков не была выяснена. Уровень обнаружения аденомы в настоящее время является единственным показателем качества, который, как было показано, связан с интервальным колоректальным раком, но в качестве показателя он не различает субъектов с одной или несколькими обнаруженными аденомами.
Основной совет: во многих обществах по эндоскопии сформулированы руководящие указания по показателям качества колоноскопии, включая подготовку кишечника, частоту интубации слепой кишки, время выведения и частоту выявления аденомы. В основном это показатели процесса, основанные на консенсусе, а не показатели результата. Научные доказательства, на которых они основаны, ограничены. Частота выявления аденомы в настоящее время является единственным показателем качества, который, как было установлено, напрямую связан с интервальным колоректальным раком, но также имеет свои недостатки.
![]()
ВСТУПЛЕНИЕ
Колоноскопия является диагностическим методом выбора для изучения симптомов, предположительно связанных с толстой кишкой, и для выявления полипов и колоректального рака (CRC). Было показано, что колоноскопия с полипэктомией снижает как частоту, так и смертность от последующих КРК [ 1 , 2 ].
Тем не менее, несмотря на то, что колоноскопия является золотым стандартом, она также не является идеальным тестом. По результатам колоноскопических исследований спина к спине, по оценкам, до 25% полипов пропускаются во время колоноскопии [ 3 , 4 ]. Кроме того, превентивный эффект колоноскопии является наиболее заметным для дистальных CRC, тогда как его роль в профилактике проксимальных CRC менее очевидна [ 5 , 6 ]. Наконец, до 8% CRCs происходят в течение 3 лет после предыдущей колоноскопии [ 7 - 12 ]. Несмотря на технические достижения и повышенную профессиональную осведомленность, эта доля промахов со временем не уменьшалась [ 12]. Более того, недавние исследования показали, что эти так называемые CRC после колоноскопии, скорее всего, являются следствием пропущенных поражений, а не являются совершенно новыми поражениями [ 13 , 14 ].
Заболеваемость КРР неуклонно растет во многих частях мира [ 15 ]. Во многих странах были начаты программы скрининга населения на CRC, либо путем отбора пациентов для колоноскопии с анализом кала на скрытую кровь (FOBT), либо путем предложения колоноскопии непосредственно лицам со средним риском [ 16 , 17 ]. Это привело к увеличению количества выполненных колоноскопий. Чтобы эти программы массового скрининга были успешными, крайне важно, чтобы колоноскопии были высокого качества и проводились в соответствии с последним уровнем знаний.
В целях оптимизации общей эффективности колоноскопии и уменьшения межиндивидуальных различий между врачами, выполняющими колоноскопию, в последние годы были предложены несколько качественных показателей [ 18].]. Эти показатели качества, однако, все являются показателями процесса, а не показателями результата. В идеале качество колоноскопии должно оцениваться по показателям клинического исхода. Целью колоноскопии в большинстве случаев является выявление новообразований. После удаления предраковых опухолевых образований пациенты вводят программу наблюдения. Частота встречаемости злокачественных новообразований или РКИ после колоноскопии, определяемая как РЦК, диагностированные в период между последней колоноскопией и плановой колоноскопией наблюдения, является более прямым и, вероятно, лучшим отражением качества выполненной колоноскопии, чем основной ток. качественные показатели, предложенные в руководящих принципах.
В этом обзоре мы обсудим основные текущие показатели качества для колоноскопии, научные доказательства, подтверждающие их, а также их потенциальные недостатки и проблемы, которые еще предстоит решить.
ПОДГОТОВКА ЧАШИ
Показатель качества, опубликованный в нескольких международных руководствах, заключается в том, что эндоскопист должен сообщать о качестве подготовки кишечника для каждой колоноскопии [ 18 , 19 ]. В нескольких руководствах указывается, что ≥ 90% пациентов, проходящих колоноскопию, должны были оценить работу кишечника как отличную или как минимум адекватную [ 19 , 20 ]. Было показано, что качество очистки кишечника влияет на способность и время, необходимое для достижения слепой кишки и обнаружения полипов, как малых, так и больших (≥ 10 мм) [ 21 , 22 ].
Существует несколько препаратов для подготовки кишечника и схемы лечения кишечника перед колоноскопией. Они варьируются от растворов на основе полиэтиленгликоля (ПЭГ), осмотических слабительных (фосфат натрия, цитрат магния, сульфат натрия) или слабительных стимуляторов (сенна, бисакодил, пикосульфат натрия), по отдельности или в комбинации.
В метаанализе рандомизированных контролируемых исследований было показано, что подготовка кишечника с разделенной дозой перед колоноскопией значительно улучшает количество удовлетворительных препаратов кишечника и связана с повышением приверженности пациента и уменьшением тошноты по сравнению с полной дозой ПЭГ [ 23 ]. В систематическом обзоре и мета-анализе Энестведт и др. [ 24 ] пришли к выводу, что подготовка кишечника с 4-литровым раствором ПЭГ с разделенной дозой превосходит другие методы подготовки кишечника. Некоторые общества эндоскопии в настоящее время рекомендуют PEG-раствор с разделенной дозой 4 литра в качестве препарата кишечника первого выбора [ 25].], хотя 2-литровый раствор PEG с аскорбатом может быть альтернативой для пациента без запора. Регулярное использование препаратов фосфата натрия не рекомендуется из соображений безопасности, особенно у пациентов с почечной недостаточностью [ 25 ]. У пациентов, использующих PEG-растворы, интервал между последней принятой дозой PEG-раствора и колоноскопией должен составлять 3-5 ч, так как это, как было показано, приводит к значительно лучшей подготовке кишечника [ 26 , 27 ].
В литературе было выявлено несколько факторов риска недостаточной подготовки кишечника. Увеличение возраста [ 28 - 31 ] и мужского пола [ 29 - 32 ] неоднократно сообщалось. История болезни колоректальной хирургии [ 28 , 29 ], диабета [ 28 , 29 ] и цирроза [ 29 , 32 ], а также стационарного статуса [ 30 , 32] также были определены в качестве факторов риска недостаточной подготовки кишечника в нескольких исследованиях. Другими факторами риска, которые были предложены в литературе, являются процедурный признак запора, сообщаемая неспособность успешно завершить промывание кишечника, использование трициклических антидепрессантов, история инсульта или деменции [ 32 ], история болезни Паркинсона, избыточный вес, положительный FOBT [ 29 ], гистерэктомия в анамнезе [ 28 ] и афроамериканское происхождение [ 31 ]. История предыдущей полипэктомии была негативным прогностическим фактором для неадекватной подготовки кишечника в исследовании Ness et al [ 32 ]. Кроме того, более позднее время начала колоноскопии в течение дня [ 30- 32 ] был связан с неадекватной подготовкой кишечника в нескольких исследованиях. Однако большинство этих исследований было проведено до широкого применения режима подготовки с разделенной дозой кишечника. Является ли эта ассоциация в настоящее время все еще действительной, еще предстоит выяснить.
Несколько шкал были разработаны для стандартизации отчетности о качестве подготовки кишечника. Арончик и др. [ 33 ] были первыми, кто предложил валидированную шкалу подготовки кишечника. Это 5-балльная категориальная шкала, оценивающая подготовку кишечника как отличную (небольшой объем прозрачной жидкости;> 95% видимой поверхности), хорошую (большой объем прозрачной жидкости, покрывающей 5-25% поверхности;> 90% поверхности, см. ) удовлетворительный (некоторый полутвердый стул всасывается или вымывается;> 90% видимой поверхности), плохой (полутвердый стул, который не может быть отсосан или вымыт; <90% видимой поверхности) или неадекватен (повторная подготовка кишечника) необходимо). К сожалению, достоверность этой шкалы для дистального отдела толстой кишки довольно низкая.
Ростом и Jolicoeur разработали и проспективно подтвердили еще одну шкалу подготовки кишечника, шкалу Оттавы [ 34 ]. В этом масштабе ободочная кишка разделена на три сегмента: правая ободочная кишка (слепая кишка и восходящая ободочная кишка), средняя ободочная кишка (поперечная и нисходящая ободочная кишка) и ректосигмоидальная кишка. Для каждого сегмента подготовка кишечника квалифицируется с использованием 4-балльной шкалы (от 0: совершенно ясно до 4: твердый стул и большое количество жидкости) для каждого сегмента толстой кишки индивидуально и от 0 до 2 балла количества жидкости в качестве общего значения для всей толстой кишки. Таким образом, шкала имеет диапазон от 0 (идеальная подготовка кишечника) до 14 (совершенно неподготовленный).
Наконец, в 2009 году Лай и др. [ 35 ] представили Бостонскую шкалу подготовки кишечника (BBPS). В этой проверенной шкале подготовки кишечника ободочная кишка делится на правую ободочную кишку (слепую кишку и восходящую ободочную кишку), поперечную ободочную кишку (включая изгиб печени и селезенки) и левую ободочную кишку (нисходящая ободочная кишка и ректосигмоидальная кишка). BBPS - это десятибалльная шкала (0-9) с 0-3 баллами, выделенными для каждого сегмента толстой кишки, т.е.., 0 (неподготовленный сегмент толстой кишки, который невозможно очистить), 1 (видимая часть слизистой оболочки сегмента толстой кишки, но другие области сегмента толстой кишки плохо видны из-за окрашивания, остаточного стула и / или непрозрачной жидкости), 2 (незначительный остаточное окрашивание, небольшие фрагменты стула и / или непрозрачной жидкости, но хорошо видна слизистая оболочка сегмента толстой кишки) 3 (хорошо видна вся слизистая оболочка сегмента толстой кишки без остаточного окрашивания, небольшие фрагменты стула или непрозрачная жидкость). В валидационном исследовании оценка ≥ 5 считалась адекватной. BBPS отличается от других шкал подготовки тем, что оценка применяется после того, как эндоскопист выполнил очистительные маневры, такие как отсасывание и промывание.
Все эти шкалы в основном использовались в исследованиях, сравнивающих новые формулы или различные схемы для подготовки кишечника [ 33 , 36 - 40 ], а не для оказания помощи в принятии клинических решений. В недавнем ретроспективном исследовании Calderwood et al [ 41] сообщили, что BBPS коррелировал с поведением эндоскописта в отношении рекомендаций относительно интервалов наблюдения для колоноскопии. Общий балл BBPS ≥ 6 и / или все сегменты ≥ 2 обеспечили стандартизированное определение «адекватной» подготовки кишечника, тогда как в 96% обследований с общим баллом ≤ 2 было рекомендовано повторное обследование в течение 1 года. Однако для баллов от 3 до 5 рекомендуемые интервалы наблюдения значительно различались у разных эндоскопистов. Будущие исследования должны быть сосредоточены на проспективной оценке этих пороговых значений для рекомендаций по интервалу наблюдения и в идеале связывать их с соответствующими показателями клинического исхода.
Широко принятый показатель качества подготовки кишечника имеет несколько недостатков. Прежде всего, до сих пор нет четкого и общепринятого определения адекватной подготовки кишечника. Кроме того, простое сообщение о качестве подготовки кишечника само по себе вряд ли существенно повлияет на качество выполненных колоноскопий, если только не станет более ясным, какое качество подготовки кишечника является абсолютным минимумом для выявления соответствующих результатов и предотвращения интервальных раковых заболеваний. Также нет четкой политики, как действовать, когда кишечник пациента недостаточно очищен; единственные соответствующие опубликованные исследования по этой теме имели либо небольшое число пациентов [ 42 ], либо ретроспективный дизайн [ 43 ].
Правило, согласно которому ≥ 90% пациентов, проходящих колоноскопию, должно иметь превосходную или адекватную подготовку кишечника, основано на консенсусе и нашло свое отражение в нескольких рекомендациях [ 19 , 20 ]. Тем не менее, нет никаких научных доказательств, подтверждающих это сокращение на 90%. Хотя было показано, что недостаточная подготовка кишечника негативно влияет на частоту обнаруженных полипов, это не относится к CRC [ 21 ]. Возможно, что из-за негативного влияния на обнаружение аденом неадекватная подготовка кишечника связана с более высокой частотой интервальных раковых образований, но на сегодняшний день нет прямых доказательств, подтверждающих это.
CECAL INTUBATION RATE
Для визуализации всей слизистой оболочки толстой кишки интубация эндоскопа в слепую кишку является обязательной. Интубация слепой кишки определяется как введение кончика колоноскопа в полюс слепой кишки, проксимальнее илеоцекального клапана, для визуализации всей слепой кишки. Хотя это иногда может быть сложным, существует мнение , что каждый эндоскопист должен иметь слепой кишки скорость интубации ≥ 90% всех случаев [ 18 - 20 , 44 , 45 ]. Если не принимать во внимание помехи CRC, неадекватную подготовку кишечника или тяжелый колит, этот скорректированный показатель интубации слепой кишки должен составлять ≥ 95% [ 18 ]. Кроме того, в ≥ 95% всех скрининговых колоноскопий слепая кишка должна быть интубирована [ 18 , 19]. Кроме того, интубация слепой кишки должна быть задокументирована путем присвоения имен и фотографирования ориентиров слепой кишки, т . Е. Аппендикулярного отверстия, илеоцекального клапана и / или терминального отдела подвздошной кишки.
В литературе несколько факторов были связаны с более высоким риском неполной колоноскопии или более сложной интубации, причем женский пол является наиболее часто упоминаемым прогностическим фактором [ 46 - 50 ]. Кроме того, у пациентов с преклонного возраста [ 46 , 49 , 50 ] или низким индексом массы тела [ 48 - 50 ], или у женщин , имеющих в анамнезе гистерэктомии [ 47 ] или дивертикулит [ 50 ], колоноскопию , как сообщается, больше , сложный и чаще всего неполный. Наконец, плохая подготовка кишечника и более низкий годовой объем эндоскопических случаев, как сообщается, связаны с более высоким риском неполной колоноскопии [ 49].].
Полнота колоноскопии связана со снижением смертности от КРК [ 6 ]. В исследовании, проведенном Neerincx и соавторами [ 51 ], вторичная колоноскопия после предыдущей неполной колоноскопии привела к изначально пропущенной прогрессирующей неоплазии (CRC или запущенной аденоме) у 4,3% пациентов. В исследовании по результатам КТ-колонографии после неполной колоноскопии у 136 пациентов, у 13,9% пациентов были обнаружены одно или несколько дополнительных новообразований толстой кишки (полип (ы) и / или CRC) [ 52 ].
Эти данные показывают, что в случаях неполной колоноскопии врач должен всегда выполнять дополнительную визуализацию, чтобы визуализировать оставшуюся толстую кишку. После неполной колоноскопии слепая кишка обычно может быть интубирована у большинства пациентов во время повторной колоноскопии с помощью легко доступных эндоскопических инструментов, что предполагает, что повторную колоноскопию всегда следует рассматривать [ 47 , 53 ]. КТ-колонография может быть полезной альтернативой в этих случаях, с дополнительным преимуществом выявления потенциально значимых внеколоновых результатов [ 52 ].
Важно иметь в виду, что не существует надежных научных данных для частоты интубации слепой кишки ≥ 90%. Хотя очевидно, что эндоскопист не может адекватно осмотреть сегменты толстой кишки, которые не были интубированы, принятая минимальная частота интубации слепой кишки основана на консенсусе, а не на научной основе.
ВРЕМЯ ВЫХОДА
В 2006 году Barclay и соавторы [ 54 ] были первыми, кто сообщил, что колоноскописты со средним временем отмены 6 минут и более имели более высокие показатели выявления любой неоплазии и прогрессирующей неоплазии. С тех пор рекомендованное среднее время отмены не менее 6 минут было сформулировано в качестве показателя качества в нескольких руководствах по колоноскопии [ 18 - 20 ].
Тем не менее, колоноскопии время вывода в качестве показателя качества не является бесспорным. Со времени первоначальной публикации Barclay и соавторов [ 54 ], в нескольких обсервационных исследованиях сообщалось о связи между временем колоноскопической абстиненции и количеством обнаруженных полипов [ 55 - 59 ]. Другие крупные исследования, однако, не могли подтвердить эти результаты [ 60 - 62 ]. Кроме того, вмешательства, направленные на оптимизацию времени вывода, в попытке улучшить обнаружение полипов, дали противоречивые результаты. Хотя Барклай и др. [ 63] сообщали о более высоких показателях общего и прогрессирующего выявления неоплазии во время скрининговой колоноскопии после реализации зависимого от времени протокола колоноскопической абстиненции, другие авторы не смогли обнаружить разницу в общей частоте выявления полипов после формальной реализации такой политики [ 64 , 65 ].
Gellad и соавторы [ 66 ] были первыми, кто исследовал связь между временем отмены во время начальной отрицательной колоноскопии и риском развития новообразования в течение следующих пяти лет. Они не обнаружили какой-либо существенной ассоциации. Тем не менее, среднее базовое время вывода в 13 участвующих центрах было довольно долгим (более 12 минут), что, возможно, объясняет неподтверждающие результаты. Возможно, что время отмены больше не является адекватной мерой качества для скрининга колоноскопии выше определенного порога.
Использование индикатора времени изъятия основано на предположении, что эндоскописты, которым требуется больше времени для изъятия колоноскопа, также используют специальные методы для улучшения визуализации всей слизистой оболочки толстой кишки. Исследование двух эндоскопистов с разной частотой пропущенных аденом действительно показало, что более качественная колоноскопическая техника отмены была связана с более длительным временем отмены [ 67 ]. Lee и соавторы [ 62 ] сообщили, что количество обнаруженных аденом было связано с качеством техники отмены, но не обязательно связано со временем отмены. Таким образом, метод вывода может быть более важным показателем качества колоноскопии, чем время отмены. В настоящее время, однако, не существует общепринятого способа количественной оценки оптимальной техники вывода.
Возможно, что в будущем время вывода выведенного показателя качества будет заменено показателем доли слизистой оболочки толстой кишки, которая адекватно визуализируется во время колоноскопии. Интересно, что Хонг и др. [ 68] недавно сообщили о полностью автоматизированной технике трехмерной реконструкции по отдельным изображениям в колоноскопии. Такая методика может в конечном итоге дать эндоскописту обратную связь в реальном времени на участках стенки толстой кишки, которые не были должным образом осмотрены, что позволит повторно посетить эти участки во время той же процедуры. Процент поверхности толстой кишки, который визуализируется эндоскопистом, потенциально может служить новым показателем качества для колоноскопии. Кроме того, информация об инспектируемых и неинспектированных участках стенки толстой кишки может помочь в обучении эндоскопистов, давая представление о возможных «слепых точках» при удалении области.
Как упомянуто выше, связь между временем вывода показателя качества и возникновением интервальных раковых заболеваний еще не выяснена.
ЧАСТОТА ОБНАРУЖЕНИЯ АДЕНОМЫ
Частота выявления аденомы (ADR) определяется как доля обследованных субъектов, у которых идентифицирован по меньшей мере один аденоматозный очаг [ 18 , 19 , 69 ]. В бессимптомной популяции скрининга ADR ≥ 25% у мужчин и ≥ 15% у женщин старше 50 лет было предложено в американских руководствах по скринингу [ 18 ], тогда как в Британских руководящих принципах обеспечения качества для колоноскопии установлен стандарт ADR На основании собственных экспериментальных данных, ≥ 35% всех скрининговых колоноскопий у пациентов с положительным FOBT [ 19 ].
Неоднократно были отмечены значительные различия между эндоскопистами в частоте обнаруженных полипов и аденом [ 70 - 74 ]. ADR является единственным текущим показателем качества, который, как было продемонстрировано, напрямую связан с интервальным колоректальным раком. В значительном исследовании Kaminski et al. [ 69 ] ADR ≥ 20% было связано с сокращением интервала колоректального рака. Недавнее исследование, проведенное Корли и др. [ 75 ], показало, что ADR обратно пропорционально связан с риском интервала CRC, а также с раком на поздней стадии и фатальным интервалом.
В соответствии с этими выводами многие недавние исследования были сосредоточены на способах оптимизации выявления аденомы, начиная от недорогих и простых в применении вмешательств в повседневной клинической практике, и заканчивая небольшими адаптациями используемого в настоящее время оборудования для колоноскопии для совершенно новых платформ для колоноскопии.
Сообщалось, что изменения положения во время отмены колоноскопа увеличивают растяжение просвета и могут снизить частоту пропущенных поражений [ 76 ]. Два небольших рандомизированных исследования действительно показали, что динамические изменения положения пациента могут улучшить обнаружение полипов [ 77 , 78 ], но в другом, более широком рандомизированном исследовании не было различий в частоте обнаружения полипов или аденомы [ 79 ].
Сообщается, что участие медсестры в эндоскопии в качестве второго наблюдателя во время колоноскопии значительно увеличивает общее количество обнаруженных полипов и аденом, обнаруженных во время колоноскопии [ 80 ], и представляется легко осуществимым вмешательством для увеличения частоты обнаружения полипов (PDR) и ADR [ 81 ]. ,
Кроме того, время проведения колоноскопии может влиять на ADR. Испытывая гипотезу о том, что усталость эндоскописта, которая увеличивается с течением дня, может повлиять на ADR, Санака и др. [ 82 ] были первыми, кто сообщил, что ADR эндоскопистов был значительно выше в утренних колоноскопиях, чем в дневных колоноскопиях. Время колоноскопии в течение дня было независимым предиктором для выявления аденомы. Эти результаты были подтверждены почти всеми другими исследованиями на эту тему [ 83 - 86 ]. Гуруду и др. [ 83] предложили, чтобы колоноскопия проводилась разными врачами в полдня. Они не обнаружили существенных различий в ADR между утренней и послеобеденной колоноскопией, когда эндоскописты проводят колоноскопию только в полдневных блоках.
Сообщается, что использование колоноскопии высокой четкости по сравнению со стандартной видеоколоноскопией оказывает лишь незначительное положительное влияние на обнаружение полипов и аденом толстой кишки в недавнем метаанализе [ 87 ]. Из-за неоднородности включенных исследований и того факта, что рандомизированных исследований не было, эти результаты следует интерпретировать с некоторой осторожностью.
Виртуальная хромоэндоскопия состоит из нескольких методов, которые используют узкий спектр длин волн с уменьшенной глубиной проникновения для улучшения визуализации. Свет коротких волн увеличивает контраст сосудов слизистой оболочки, потенциально улучшая визуализацию и идентификацию опухолевых очагов. Хотя имеются некоторые противоречивые данные, большинство исследований и мета-анализов не смогли продемонстрировать существенного увеличения ADR с помощью виртуальной хромоэндоскопии с панколоникой [ 88 - 90 ].
Колоноскопия с помощью колпачка выполняется путем прикрепления прозрачного колпачка к кончику колоноскопа. Эти колпачки были первоначально разработаны для использования во время эндоскопической резекции слизистой оболочки, но они также могут помочь в подавлении складок толстой кишки для улучшения визуализации всей слизистой оболочки толстой кишки. Тем не менее, в метаанализе 16 рандомизированных контролируемых исследований, включающих 8991 субъекта, Нг и соавторы [ 91 ] пришли к выводу, что колоноскопия с помощью колпачка оказывает лишь ограниченное влияние на ADR, хотя более высокая доля пациентов с полипом (ами) была обнаружена при крышка была прикреплена (относительный риск 1,08; 95% ДИ: 1,00-1,17).
Сообщалось, что ретрофлексия колоноскопа может помочь в удалении полипов, которые труднодоступны эндоскопически [ 92 , 93 ]. Очевидно, что осмотр с помощью ретрофлексированного колоноскопа также может помочь в увеличении визуализации проксимальных аспектов складок толстой кишки, особенно в правой ободочной кишке, и, таким образом, в увеличении ADR. Однако, хотя этот метод кажется безопасным в опытных руках, как рандомизированное исследование, так и большое проспективное обсервационное исследование не смогли продемонстрировать существенное увеличение числа обнаруженных полипов [ 94 , 95 ].
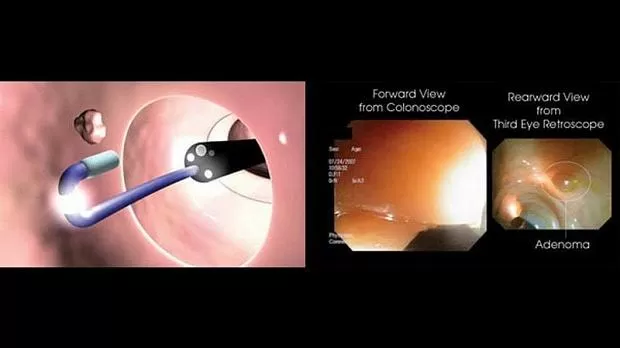
В последние годы было разработано несколько новых устройств для улучшения визуализации проксимальных сторон ободочной кишки и внутренних искривлений. Во-первых, Ретроскоп Третьего Глаза ® (Avantis Medical Systems, Inc) представляет собой универсальный катетер с камерой и источником света на кончике. После продвижения через рабочий канал колоноскопа катетер ретрофлексируется на 180 ° (рис. 1 ). Затем он обеспечивает 135-градусный ретроградный обзор толстой кишки. В рандомизированном многоцентровом исследовании «спина к спине» ретроспектива третьего глаза дала чистую дополнительную частоту обнаружения - 29,8% для полипов и 23,2% для аденом по сравнению со стандартной колоноскопией [ 96]. Преимущество этого устройства заключается в том, что его можно использовать со стандартным оборудованием для колоноскопии. Однако использование этого устройства в клинической практике может быть затруднено тем фактом, что ретроспективный анализ третьего глаза необходимо удалить из рабочего канала в случае использования ловушки для полипэктомии или щипцов для биопсии. Кроме того, когда устройство установлено, колоноскоп обладает пониженной способностью всасывания. Эти факторы могут увеличить процедурное время и могут быть утомительными для эндоскописта.
Недавно Гралнек и др. [ 97 ] сообщили о результатах первого международного многоцентрового рандомизированного параллельного исследования с новой платформой Full Spectrum Endoscopy ™ (FUSE; EndoChoice ® , Alpharetta, Джорджия, США). Колоноскоп полного спектра обеспечивает высокое разрешение просвета толстой кишки при 330 ° по сравнению со стандартными колоноскопами 140-170 ° (рис. 2 ). В их исследовании, включавшем 185 субъектов, частота пропадания аденомы была значительно ниже у пациентов, которым колоноскопия была выполнена с помощью эндоскопа полного спектра: во второй группе было пропущено пять (7%) из 67 аденом против 20 (41%) из 49 аденом в группе, которая сначала прошла стандартную колоноскопию ( P<0,0001). Хотя эти результаты кажутся многообещающими, необходимы дальнейшие исследования для определения потенциальной роли этой системы в неэкспертных центрах. Очевидный недостаток при внедрении этого нового устройства в повседневную клиническую практику заключается в том, что требуются новые колоноскопы и основные блоки управления.
Потенциальным недостатком современного определения ADR является то, что он не проводит различий между субъектами, у которых эндоскопист обнаруживает один против более чем одной аденомы. Было показано, что врачи чаще пропускают дополнительные аденомы во время колоноскопии, когда они уже обнаружили две или более [ 4 ].
Ван и др. [ 98 ] пришли к выводу, что, несмотря на сопоставимые и адекватные ADR, между эндоскопистами может быть значительная вариабельность в отношении общего количества аденом, обнаруженных при колоноскопии. Они ввели метрику, называемую ADR-plus, среднее число инкрементальных аденом после первой, и, связав ее с ADR, авторы смогли лучше отличить высокопроизводительных эндоскопистов от низкоэффективных. Lee и соавторы [ 99 ] представили две новые меры в дополнение к ADR, которые также могут предоставить дополнительную информацию о межличностных изменениях качества выполнения колоноскопии: средняя аденома на процедуру (MAP) и средняя аденома на позитивную процедуру (MAP +) , Однако, как эти новые метрики переводят к возникновению интервальных раков, в настоящее время неизвестно.
ПАЦИЕНТ КОМФОРТ И СЕДАЦИЯ
Несколько руководств рекомендуют регулярно сообщать о дозах седации, а также о показателях комфорта для пациентов [ 19 , 20 ]. В своем заявлении о качестве при скрининговой колоноскопии Европейское общество гастроинтестинальной эндоскопии предположило, что не более чем у 1% пациентов должно быть насыщение ниже 85% в течение более 30 с или должно потребоваться введение реверсивного агента [ 20 ].
Комфорт пациентов в условиях скрининга важен, поскольку пациенты, которые считают скрининг-колоноскопию слишком неудобным, с меньшей вероятностью будут участвовать [ 100 ]. Очевидно, что это может повлиять на эффект скрининга населения, когда значительная часть целевой группы населения не участвует. Недавно Ростом и др. [ 101] проспективно подтвердили оценку комфорта для медсестры в многоцентровом международном учреждении, что позволило единообразно зарегистрировать комфорт пациента и сравнить методы колоноскопии. Различные эндоскопические общества еще не приняли этот подтвержденный показатель комфорта. Какие оценки считаются приемлемыми и как избежать отсева из программы отбора, еще предстоит определить. Измерение комфорта имеет очевидное предостережение о том, что эндоскописты, медсестры и пациенты могут иметь разные мнения об уровне (дис) комфорта во время процедуры.
Дискомфорт во время колоноскопии может быть уменьшен введением успокоительных средств. Во всем мире существует большое разнообразие в использовании седации для колоноскопии [ 102 - 105 ]. В некоторых странах большинство пациентов подвергаются колоноскопии без лечения, в то время как в других странах стандартом лечения является седация бензодиазепинами в сочетании с опиатами. Энтонокс (закись азота и кислород) часто используется в некоторых странах, в то время как в других странах пропофол и общая анестезия все чаще используются в повседневной практике. Сообщалось, что тяжелые осложнения, связанные с седацией, редки: Behrens et al. [ 106] сообщили о частоте 0,01% в своем исследовании 388404 эндоскопии. Тем не менее, следует предотвращать побочные эффекты, связанные с седацией, особенно в остальном здоровом населении. Тем не менее, нет подтвержденного балла для регистрации уровня седации во время колоноскопии, а также нет общепринятого золотого стандарта в отношении седации для колоноскопии.
Интересно, что недавнее исследование программы скрининга в Соединенном Королевстве показало, что, хотя применение седации широко варьируется, индивидуальная практика приема лекарств у колоноскопистов, по-видимому, не связана с возникновением значительного дискомфорта [ 102 ]. Вместо этого предполагается, что лучшие эндоскописты вызывают меньший дискомфорт пациента при использовании меньшего седативного эффекта [ 103 ].
СКОРОСТЬ ОСЛОЖНЕНИЯ
Колоноскопия является инвазивной процедурой, которая непреднамеренно приведет к осложнениям у небольшого числа пациентов. Частота осложнений, очевидно, не обязательно связана с интервалом CRC. Однако для того, чтобы программа скрининга населения имела общий положительный эффект, крайне важно, чтобы частота осложнений была низкой.
Перфорация является наиболее серьезным осложнением колоноскопии. Он определяется как наличие воздуха, содержимого просвета или инструментов вне желудочно-кишечного тракта [ 19 ]. Это может быть вызвано механической травмой стенки кишечника, чрезмерной инсуффляцией толстой кишки или терапевтической процедурой. В литературе сообщается, что общие показатели перфорации колеблются от 0,1% до 0,6% [ 107 - 109 ]. Частота перфорации для диагностических колоноскопий ниже, чем для терапевтических вмешательств. Британские рекомендации по скринингу колоноскопии устанавливают стандарт риска перфорации <1: 1000 во всех колоноскопиях [ 19 , 20 ] и риск перфорации <1: 500 при колоноскопии, при которой проводится полипэктомия [19 ]. Это в значительной степени согласуется с американскими рекомендациями [ 18 ], хотя важно иметь в виду, что может существовать значительный разброс риска перфорации между группой скрининга, в которой каждый участник проходит колоноскопию, и группой скрининга, которая предварительно отобрана. с помощью фекального оккультного анализа крови. Пропорционально можно ожидать, что в последнем будет выполнено больше полипэктомий. Каждая страна должна установить свои собственные стандарты в соответствии со стратегией местного отбора.
Исторически хирургическое закрытие или резекция перфорированного сегмента толстой кишки было единственным терапевтическим вариантом в случае ятрогенной перфорации толстой кишки. В нескольких сериях случаев сообщалось об успешном эндоскопическом закрытии мелких ятрогенных дефектов стенки кишечника с использованием металлических эндоклипов, либо с использованием только эндоклипов, либо с использованием комбинированной техники эндоклипов и эндолупов [ 110 , 111 ]. В последние годы стал доступен универсальный зажим (Ovesco Endoscopy GmbH, Тюбинген, Германия) с высокими показателями успешного закрытия перфорации в первой серии зарегистрированных случаев [ 112 , 113 ].
Кровотечение является наиболее распространенным осложнением после полипэктомии. Основываясь на литературных источниках, несколько руководств устанавливают стандарт пост-полипэктомического кровотечения при колоноскопии <1: 100 с полипэктомией [ 18 , 19 ]. Известно, что риск кровотечения увеличивается с размером поражения и более проксимальным расположением в толстой кишке [ 114 ]. Несколько эндоскопических методов могут быть использованы для предотвращения кровотечения. Холодная ловушка мелких непонкулированных полипов может предотвратить отсроченное кровотечение [ 115 ] даже у пациентов с антикоагулянтом [ 116 ]. Подслизистая инъекция с физиологическим раствором и адреналином предотвращает немедленное кровотечение, но, вероятно, не задерживает кровотечение [ 117]. Кроме того, профилактическое размещение отрывной ловушки вокруг стебля плодоножки на полипе может предотвратить кровотечение [ 118 , 119 ], а также профилактическое закрытие участка полипэктомии металлическими зажимами после удаления больших (> 2 см) сидячих или плоских поражений [ 120 ].
Синдром коагуляции после полипэктомии (PPCS), или синдром трансмурального ожога, является известным осложнением колоноскопической полипэктомии. Он определяется развитием боли в животе, лихорадки, лейкоцитоза и воспаления брюшины при отсутствии выраженной перфорации, возникающей после полипэктомии с электрокоагуляцией [ 121 ]. Насколько нам известно, есть только одно исследование, специально посвященное PPCS. В этом большом ретроспективном исследовании его частота составляет 0,07% от всех колоноскопий с полипэктомией. Гипертония, размер поражения ≥ 10 мм и неполипоидная конфигурация поражения были независимо связаны с PPCS [ 121]. Правильная идентификация этого объекта важна, так как это может избежать ненужной исследовательской лапаротомии. PPCS обычно можно лечить с медицинской точки зрения без хирургического вмешательства и без смертности. PPCS еще не включен в текущие рекомендации.
ВЫВОД
Таким образом, все основные качественные показатели для колоноскопии имеют свои недостатки (Таблица 1 ). Большинство из них были сформулированы на основе консенсуса. Следуя рекомендациям Американского общества желудочно-кишечной эндоскопии от 2006 года о качестве показателей для колоноскопии [ 18 ], многие другие страны приняли эти же показатели качества. Однако научные данные, на которых они основаны, ограничены. Потенциальные меры по улучшению эффективности отдельных показателей качества приведены в таблице 2 .
Таблица 1 Качественные показатели и их недостатки.
|
Показатель качества |
Предлагаемый стандарт |
Нерешенные проблемы |
|
Подготовка кишечника |
В каждом отчете об эндоскопии должно быть указано качество подготовки кишечника [ 18 , 19 ] ≥ 90% пациентов, проходящих колоноскопию, должны были оценить качество подготовки кишечника как отличное или, по крайней мере, адекватное [ 19 , 20 ] |
Нет доказательств, подтверждающих сокращение ≥ 90%. Нет четкого и общепринятого определения адекватной подготовки кишечника. Неясно, какое качество подготовки кишечника является абсолютным минимумом для выявления соответствующих результатов и предотвращения интервальных раковых заболеваний. Нет четкой политики в отношении того, как действовать в случае неадекватности. подготовка кишечника |
|
Скорость интубации слепой кишки |
Общая частота интубации слепой кишки ≥ 90% [ 18 - 20 ] Скорректированная частота интубации слепой кишки ≥ 95% [ 18 , 19 ] Частота интубации слепой кишки ≥ 95% во всех скрининговых колоноскопиях [ 18 , 19 ] |
Нет достоверных научных данных, подтверждающих сокращение ≥ 90%. Нет доказательств, подтверждающих связь между частотой интубации слепой кишки и частотой интервального CRC. |
|
Время вывода |
≥ 6 минут при удалении от полюса слепой кишки до заднего прохода [ 18 - 20 ] |
Противоречивые отчеты о связи между временем вывода и количеством обнаруженных полипов. Вмешательства, направленные на оптимизацию времени вывода, дали противоречивые результаты. Нет доказательств, подтверждающих связь между временем вывода и возникновением интервала CRC. Лучшая эндоскопическая методика вывода не обязательно связана со временем вывода. косвенная мера для количественной оценки адекватной визуализации доли слизистой оболочки толстой кишки |
|
Уровень обнаружения аденомы |
≥ 25% у мужчин и ≥ 15% у женщин старше 50 лет [ 18 ] ≥ 35% всех скрининговых колоноскопий у пациентов с положительным анализом кала на скрытую кровь [ 19 ] |
Единственный показатель качества, который, как было показано, напрямую связан с интервалом CRC. Не делает различий между субъектами, у которых эндоскопист обнаруживает одну и более чем одну аденому. Не дает оптимального различия между высокопроизводительными и низкоэффективными эндоскопистами. |
|
Комфорт пациента и успокоение |
Регулярная отчетность и мониторинг показателей комфорта пациента и дозировки седативных препаратов [ 19 , 20 ] |
До недавнего времени не было подтвержденной оценки комфорта пациента. Пока не ясно, какие оценки комфорта пациента считаются приемлемыми. Эндоскопист, медсестра и пациент могут иметь разные мнения об уровне комфорта во время процедуры. Не существует золотого стандарта в отношении седации во время колоноскопии. оценить уровень седации во время колоноскопии |
|
Уровень сложности |
Перфорация при колоноскопии <1: 1000 [ 18 - 20 ] Пост-полипэктомическое кровотечение при колоноскопии <1: 100 с полипэктомией [ 18 , 19 ] |
Консенсусная частота осложнений в основном зависит от количества терапевтических колоноскопий, которые могут варьироваться в зависимости от стратегии скрининга (колоноскопический скрининг всей популяции по сравнению с отбором людей с высоким риском с помощью анализа крови на фекальную культуру) |
CRC: колоректальный рак.
Таблица 2 Потенциальные меры для улучшения производительности в зависимости от показателя качества.
|
Показатель качества |
Потенциальное вмешательство для улучшения производительности |
Сила научных данных |
|
Подготовка кишечника |
Разделенная доза препарата кишечника Последняя принятая доза PEG-раствора за 3-5 ч до колоноскопии |
Мета-анализ рандомизированных контролируемых исследований Наблюдательные, проспективные исследования |
|
Скорость интубации слепой кишки |
Дополнительное обучение и использование вспомогательных эндоскопических инструментов ( например , педиатрический колоноскоп) |
Мнение эксперта |
|
Уровень обнаружения аденомы |
Участие медсестры в эндоскопии в качестве второго наблюдателя. Выполняйте колоноскопию утром или в полдня. Колоноскопия высокой четкости (по сравнению со стандартной видеоколоноскопией, краевой эффект) Колоноскопия с помощью колпачка (маргинальный эффект) Ретроскоп третьего глаза Полнофункциональная эндоскопия |
Рандомизированные многоцентровые исследования Ретроспективные исследования Мета-анализ Мета-анализ рандомизированных контролируемых исследований Рандомизированное многоцентровое исследование Рандомизированное многоцентровое исследование |
|
Уровень сложности |
Холодная ловля мелких непонкулированных полипов может предотвратить кровотечение |
Проспективное многоцентровое обсервационное исследование и небольшое одноцентровое рандомизированное контролируемое исследование |
|
Подслизистая инъекция с физиологическим раствором и адреналином предотвращает немедленное кровотечение |
Рандомизированное исследование | |
|
Профилактическое размещение отрывной ловушки вокруг стебля ножного полипа предотвращает кровотечение |
Рандомизированные исследования | |
|
Профилактическое закрытие участка полипэктомии металлическими зажимами после удаления больших (> 2 см) сидячих или плоских повреждений может предотвратить кровотечение |
Ретроспективное исследование |
Что еще не ясно, это как действовать, если коллега или старший эндоскопист не соответствует требуемым стандартам. Индивидуальное дополнительное обучение или обязательный негативный совет для продолжения стипендии могут быть подходящими для обучения эндоскопистов. Тем не менее, это может быть трудно для старших эндоскопистов, которые практиковали в течение многих лет, особенно когда научная основа для этих качественных показателей все еще не достаточно хорошо установлена. Далее необходимо решить, как проверить, действительно ли эндоскописты выполняют колоноскопию в соответствии со стандартами медицинской помощи, установленными их коллегами или национальными руководящими принципами.
В настоящее время ADR является единственным показателем качества, который, как было показано, напрямую связан с интервалом измерения колоректального рака. Таким образом, представляется разумным позволить этому показателю преобладать в дискуссиях с эндоскопистами, которые не соответствуют установленным стандартам.
В идеале, эндоскописты должны оцениваться и сравниваться только с помощью наиболее релевантного показателя результата в контексте скрининга колоноскопии, то есть возникновения интервальных CRC. Поскольку частота интервальных КРК, к счастью, довольно низкая, а длительность между колоноскопией и интервальным КРК достаточно велика, это может оказаться слишком медленным и жестким показателем качества в повседневной практике, чтобы своевременно вмешиваться в случае некачественной колоноскопической работы.
До тех пор, пока мы не найдем лучшую меру для аппроксимации риска интервальных CRC, существующего набора показателей качества будет достаточно. Однако их необходимо интерпретировать с осторожностью и постоянно корректировать по мере поступления дополнительной информации. Например, как время отмены, так и ADR являются производными от качества, с которым вся слизистая оболочка толстой кишки визуализируется во время колоноскопии, и со временем могут быть заменены более прямым измерением доли слизистой оболочки толстой кишки, которая проверяется.
.
Список литературы:
Статьи по теме
Рекомендуемые статьи
Эндоскопическая ретроградная холангиопанкреатография
- рентген-эндоскопический метод диагностики патологии желчных и панкреатических протоков.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.















.jpg)




.png)

















Комментарии