- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Методы диагностики инфекции Хеликобактер пилори (Helicobacter pylori) в клинический практике
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- Viber
- Skype
- Telegram
| Авторы: | Бордин Дмитрий Станиславович 1 Войнован Ирина Николаевна 2 Колбасников Сергей Васильевич 3 Эмбутниекс Юлия Викторовна 4 2018г. |
| Об авторах: |
1. д.м.н., зав. отд. патологии поджелудочной железы, желчных путей и верхних отделов пищеварительного тракта МКНЦ им. А.С. Логинова, проф. каф. общеврачебной практики (семейной медицины) ФПДО ТГМУ 2. врач-гастроэнтеролог отд-ния патологии верхних отделов пищеварительного тракта МКНЦ им. А.С. Логинова 3. д.м.н., проф., зав. каф. общеврачебной практики (семейной медицины) ФДПО ТГМУ 4. д.м.н., зав. отделением патологии верхних отделов пищеварительного тракта МКНЦ им. А.С. Логинова |
Аннотация:
Диагностические тесты, применяемые для выявления инфекции Helicobacter pylori, подразделяются на инвазивные (требующие проведения эндоскопического исследования) и неинвазивные, прямые (выявление бактерии бактериологическим, гистологическим и молекулярным методами) и непрямые (выявление уреазной активности бактерии или антител к ней). Выбор теста определяется клинической ситуацией, а также его доступностью и стоимостью. На чувствительность большинства тестов влияет применение антисекреторных препаратов и антибиотиков.
Полный текст статьи:
АГ – антиген
БУТ – быстрый уреазный тест
ГМ – гистологический метод
ИПП – ингибиторы протонной помпы
ИФА – иммуноферментный анализ
ИХА – иммунохроматографический анализ
МА – моноклональные антитела
ПА – поликлональные антитела
СОЖ – слизистая оболочка желудка
УДТ – уреазный дыхательный тест
ЭГДС – эзофагогастродуоденоскопия
DOB – дельта по сравнению с исходным значением
FISH – флюоресцентная гибридизация in situ
HP – Helicobacter pylori
LCI – узкоспектральная визуализация (linked color imaging)
WLE – эндоскопия в белом свете (white-light endoscopy)
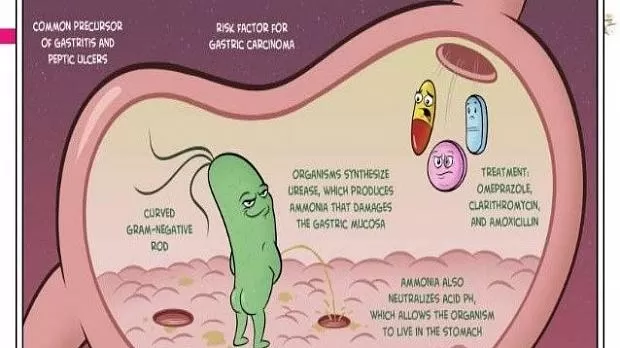
Helicobacter pylori (HP) относится к наиболее частым инфекциям человека. Распространенность этой инфекции в Москве составляет 60,7–88% [1, 2], в Санкт-Петербурге – 63,6% [3], в Восточной Сибири она достигает 90% [4, 5]. Опубликованный в 2017 г. метаанализ свидетельствует, что распространенность НР остается высокой в большинстве развивающихся стран, а также в отдельных коренных популяциях развитых стран и обычно связана с социально-экономическим статусом и уровнем гигиены [6]. При этом отмечается снижение распространенности НР в развитых странах, что объясняется повышением уровня жизни и улучшением гигиены [7]. Со снижением распространенности НР связано значительное уменьшение заболеваемости раком желудка и язвенной болезнью в Западной Европе, США и Японии [8].
Согласно современным представлениям, HP передается от человека к человеку и вызывает хронический активный гастрит у всех зараженных лиц. Это может привести к язвенной болезни, атрофическому гастриту, аденокарциноме желудка или MALT-лимфоме желудка. Устранение НР приводит к излечению гастрита, что является основой профилактики долгосрочных осложнений или рецидивов болезни. По этим причинам HР-ассоциированные заболевания считаются инфекционными, независимо от симптомов и стадии [9, 10]. Обоснование патогенетической роли и проведение эрадикации НР привело к принципиальному изменению течения язвенной болезни, ранее – тяжелого рецидивирующего заболевания [11]. После успешного устранения инфекции в большинстве случаев происходит, по сути, ее излечение. Так, в Москве к 2016 г. по сравнению с 1994 г. отмечено драматическое снижение заболеваемости язвенной болезнью на 77% (со 167 до 38,6 на 100 тыс. населения) и распространенности этого заболевания на 64% (с 1992 до 717,9 на 100 тыс. населения).
Значительный интерес привлекает эрадикация HP в качестве стратегии первичной профилактики рака желудка, до 90% случаев которого обусловлено НР [12]. Диагностика и устранение НР рекомендованы у больных, которым показано длительное лечение аспирином и нестероидными противовоспалительными средствами, а также ингибиторами протонной помпы (ИПП). Стратегия «тестируй-и-лечи» рекомендована при наличии симптомов диспепсии и отсутствии симптомов тревоги [9, 10]. Последние международные и отечественные консенсусы рекомендуют проведение эрадикационной терапии у всех инфицированных при отсутствии противопоказаний [9, 10, 13], поэтому крайне актуальной является информация о достоинствах и недостатках методов диагностики HP.
Лечение инфекции возможно только после ее выявления. После завершения терапии ее успех должен быть доказан. Диагностическая ценность большинства тестов снижается при низкой бактериальной обсемененности, что наблюдается при текущем или предшествующем приеме антисекреторных (ИПП, Н2-блокаторы) и антибактериальных препаратов, а также при атрофическом гастрите [14]. Адекватная интерпретация результатов возможна только при условии отмены ИПП за 2 нед, а антибиотиков и препаратов висмута – за 4 нед до проведения теста.
Каждый метод диагностики имеет свои преимущества, недостатки и ограничения. Их можно разделить на инвазивные и неинвазивные по признаку необходимости проведения эзофагогастродуоденоскопии (ЭГДС) с целью получения материала для исследования. Благодаря высокой чувствительности и специфичности современные неинвазивные тесты обеспечивают высокую надежность выявления НР. Целесообразность проведения ЭГДС только для диагностики НР сомнительна, однако забор биоптатов на НР при диагностической эндоскопии у пациентов с симптомами тревоги должен быть осуществлен [15] (табл. 1). Эндоскопия с биопсией слизистой оболочки желудка (СОЖ) оправдана для проведения бактериологического исследования НР и оценки чувствительности к антибиотикам.
Также методы диагностики НР условно можно разделить на прямые, которые определяют возбудитель, его генетический материал (антиген), и непрямые (косвенные), которые выявляют продукты метаболизма микроорганизма или антитела к бактерии в крови (табл. 2).
Бактериологический метод
Метод основан на идентификации возбудителя путем посева из биоптата СОЖ. Полученные при эндоскопии биоптаты помещают в пробирки с транспортными средами (Cary-Blaer или Pylori-средой). Посев материала желательно проводить в день его поступления в лабораторию. Инкубация посевов осуществляется в микроаэрофильных условиях при содержании кислорода ≤5%. В дальнейшем проводится идентификация выделенных культур, определяются их морфологические, тинкториальные свойства, чувствительность к антибиотикам. Специфичность метода – 98%, чувствительность – 76–90% [16], по другим данным – 50–90% [17]. Определенное количество ложноотрицательных результатов возникает при несоблюдении или неточном соблюдении методики исследования. Несмотря на точность метода, он редко используется в обычной клинической практике из-за длительности анализа (средняя продолжительность исследования – 7 дней), сложности его постановки и высокой стоимости. Метод рекомендуется после двух неудачных курсов эрадикационной терапии, когда выбор антибиотиков определяется чувствительностью НР к ним [10, 13].Гистологический метод
ГМ позволяет непосредственно визуализировать НP и может быть рекомендован для первичной диагностики у больных, которым показана ЭГДС. Материалом исследования является биоптат СОЖ. Преимуществами ГМ являются простота исполнения, удобство хранения, транспортировки. Специфичность гистологического метода может достигать 100%, а чувствительность – 91–93% [18].Высокочувствительным (97%) и высокоспецифичным (100%) методом для диагностики инфекции НР является флюоресцентная гибридизация in situ (метод FISH) на гистологических препаратах. Метод FISH может идентифицировать кокковидную форму НР, которая обычно не обнаруживается путем рутинного гистологического исследования. Кроме того, FISH – это быстрый, точный и экономически эффективный метод обнаружения устойчивости к кларитромицину НР в образцах биопсии желудка [15].
Несмотря на высокую чувствительность гистологического метода, на его диагностическую точность могут оказать влияние количество биоптатов и место их забора. Для получения оптимальной информации рекомендуется множественная биопсия, которая также обеспечивает морфологическую оценку СОЖ [19]. Сиднейская система рекомендует исследование не менее пяти биоптатов: по два из антрального отдела (2–3 см от привратника по большой и малой кривизне), по два из тела желудка (по большой и малой кривизне, примерно в 8 см от кардии) и один из угла желудка. Ценность исследования повышается при оценке степени и стадии гастрита по системе OLGA или OLGIM, которые позволяют оценить прогноз заболевания [20].
При малой обсемененности НР, а также при утрате бактерий в процессе подготовки препаратов вероятны ложноотрицательные результаты. При слабой подготовке гистолога возможна идентификация в качестве НР других микроорганизмов – ложноположительный результат.
Чувствительность и специфичность ГМ у пациентов с кровотечением из верхних отделов ЖКТ в среднем составляют лишь 70% [21]. Поэтому к вопросу диагностики и лечения НР следует вернуться в период ремиссии в плановом порядке.
Следует учитывать, что обнаружить НР удается только на достаточно тонких и хорошо окрашенных срезах. При наличии атрофических изменений в СОЖ повышается частота ложноотрицательных результатов. Более того, в области кишечной метаплазии HР в большинстве случаев не обнаруживается ни при обычных, ни при специальных методах окрашивания, несмотря на серологические признаки инфекции. Исчезновение HР коррелирует с развитием кишечной метаплазии и снижением секреции желудка [22]. У пациентов, принимающих антисекреторные средства (H2-блокаторы, ИПП), препараты висмута и антибиотики, чувствительность и специфичность ГМ снижены [19, 22]. Универсальной рекомендацией является отмена ИПП за 2 нед до проведения исследования, антибиотиков и препаратов висмута – за 30 дней [23].
Цитологический метод является одним из вариантов гистологического исследования. Материалом являются мазки-отпечатки биоптатов СОЖ, взятых при эндоскопическом исследовании, которые в последующем высушиваются и окрашиваются по методу Романовского–Гимзы.
Быстрый уреазный тест
БУТ является непрямым методом диагностики НР на основе выявления уреазной активности бактерии. Тест требует взятия биоптата СОЖ, который помещается в пробирку (лунку) с мочевиной и индикатором на жидкостной, гелевой или сухой основе. По изменению цвета индикатора при повышении рН среды в результате расщепления мочевины микробной уреазой можно с достаточно высокой точностью идентифицировать НР. В клинической практике при наличии показаний к эндоскопии и отсутствии противопоказаний к проведению биопсии БУТ рекомендуется использовать в качестве диагностического метода первой линии [24].Чувствительность БУТ в зависимости от количества биоптатов варьирует в пределах 80–90% [26] (по другим данным – от 61 до 74% [27]). Увеличение количества биоптатов, их забор из двух отделов желудка (из тела и антрума) позволяют увеличить чувствительность БУТ [28]. При использовании качественных тестов и нескольких гастробиоптатов, хорошей обработке биопсийных щипцов специфичность теста может достигать 95–100% [25, 26] (по другим данным – 90% [17]). Ложноположительные результаты наблюдаются редко и могут быть обусловлены присутствием других уреазосодержащих бактерий, таких как Proteus mirabilis, Citrobacter freundii, Klebsiella pneumoniae, Enterobacter cloacae и Staphylococcus aureus. Ложноотрицательные результаты теста наблюдаются чаще, чем ложноположительные, что не позволяет использовать отрицательный результат для исключения НР [10]. Ложноотрицательные результаты могут быть получены у пациентов, перенесших язвенное кровотечение, на фоне приема ИПП, антибиотиков, препаратов висмута, а также при выраженной атрофии или метаплазии СОЖ [29].
Таким образом, положительный результат БУТ свидетельствует о наличии НР и дает возможность назначать лечение, но отрицательный – не позволяет исключить НР, поэтому БУТ не рекомендован для оценки эффективности эрадикации [10].
13С/14С-уреазный дыхательный тест
УДТ также основан на выявлении уреазной активности НР. В присутствии НР происходит гидролиз принятого per os раствора мочевины, меченного изотопом углерода (13C или 14C). Углекислый газ (13CO2 или 14CO2) поступает в кровь и, в конечном итоге, выделяется через легкие в выдыхаемом воздухе. Пробы воздуха берутся исходно и через определенное время (при использовании 13C-мочевины – через 30 мин) после приема тестового раствора. Прирост меченого CO2 выражается как дельта по сравнению с исходным значением (DOB). Обычно в качестве критерия присутствия инфекции HР используют DOB >2,0‰. Показано, что значение DOB положительно коррелирует с бактериальной нагрузкой HР [30]. Чувствительность 13C-УДТ составляет 96%, специфичность – 93% [31].Изначально УДТ разработан с использованием мочевины, меченной слабо радиоактивным изотопом 14С, однако в настоящее время он практически полностью заменен на тест с мочевиной, меченной стабильным не радиоактивным изотопом 13С [31]. 13C-УДТ предпочтительнее 14C-УДТ, поскольку позволяет избежать даже минимального воздействия радиации. Однако меньшая стоимость теста и оборудования обеспечивает популярность 14C-УДТ в развивающихся странах. Точность диагностики 13C-УДТ и 14C-УДТ не отличается, и оба теста можно считать «золотым стандартом» среди неинвазивных методов диагностики HР [32]. Ложноположительные результаты редки, но могут наблюдаться после выполнения ЭГДС с биопсией непосредственно перед тестом, у больных, перенесших резекцию желудка, а также при значительном снижении секреции желудка. Небольшое количество ложноотрицательных результатов может быть связано с нарушением методики взятия и хранения проб выдыхаемого воздуха, физической нагрузкой накануне и в процессе выполнения теста. Как и при большинстве других тестов, достоверный результат УДТ может быть получен после 2-недельной отмены ИПП и не ранее чем через 4 нед после прекращения приема антибиотиков и препаратов висмута. Консенсус Маастрихт V оценивает УДТ с меченой мочевиной как лучший способ диагностики НР с высокой чувствительностью и специфичностью и с отличной производительностью как для первичной диагностики инфекции, так и для оценки эффективности эрадикации [10].
В России получил распространение дыхательный тест с немеченой мочевиной («Хелик-тест»). Результаты открытого многоцентрового исследования эффективности дыхательных тестов продемонстрировали его недостаточную чувствительность (78%) и низкую специфичность (62%) [33]. Авторы другого исследования «Хелик-теста» отметили, что низкая специфичность NH3-уреазных тестов и, как следствие, высокая частота ложноположительных результатов не допускают их использование для первичной диагностики инфекции и контроля эффективности эрадикации НР [34].
Исследование кала на наличие антигена НР
Анализ кала на антиген HР (АГ HР) – это другой неинвазивный метод диагностики с высокой чувствительностью (94%) и специфичностью (97%) [35]. Существует два варианта исследования: иммуноферментный анализ (ИФА) и иммунохроматографический анализ (ИХА) с использованием поликлональных (ПА) или моноклональных (МА) антител. Тесты на основе МА более точны, а ИФА обеспечивают более надежные результаты, чем ИХА [35]. Наряду с 13С-УДТ моноклональный тест на основе ИФА рекомендован как для первичной диагностики НР-инфекции, так и для контроля эрадикации [10]. Моноклональный АГ в кале является удобным и эффективным тестом для диагностики НР у детей [36, 37]. Кроме того, исследование антигена HР можно применять для эпидемиологических исследований и программ скрининга ввиду относительно невысокой стоимости исследования и оборудования [21]. Причинами ложноотрицательных результатов могут являться неравномерное распределение АГ в каловых массах, разрушение АГ при замедлении эвакуации каловых масс (запоры), желудочно-кишечное кровотечение [37].Серологический метод – выявление антител IgG к HР в плазме крови
Колонизация НР вызывает системный иммунный ответ. Через 3–4 нед после инфицирования в крови больных появляются антитела к НР Эти антитела определяются путем ИФА. Поскольку инфекция является хронической и ее спонтанный клиренс невозможен, то положительные серологические тесты у нелеченых пациентов указывают на наличие текущей инфекции. Специфичность метода – 93–94%, чувствительность – 59–71% [38].Несмотря на то что уровень антител в процессе успешной эрадикации падает, серологическая реакция остается положительной в течение ряда лет. Этот «серологический рубец» не позволяет использовать серологическое исследование крови для оценки эффективности лечения (причина ложноположительных результатов). Кроме того, серологический метод мало информативен у пациентов со слабым иммунным ответом, а антитела IgG появляются не ранее чем через месяц после инфицирования (причина ложноотрицательных результатов).
Преимуществом серологического метода для первичной диагностики НР является возможность его использования у лиц, принимающих ИПП и антибиотики [10], а также после состоявшегося желудочно-кишечного кровотечения и при атрофии СОЖ. Все перечисленные ситуации ассоциированы со снижением бактериальной «нагрузки», ввиду чего остальные диагностические тесты могут дать ложноотрицательный результат [39].
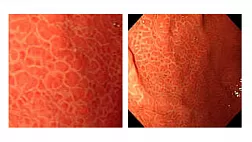
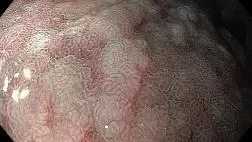
Растет интерес к расширению возможностей выявления НР-инфекции в режиме реального времени во время эндоскопического обследования желудка, что позволит сократить расходы на диагностику и лечение. Новые возможности для диагностики не только предраковых заболеваний желудка, но и НР-инфекции открыло исследование в узкоспектральном режиме. Узкоспектральная визуализация (linked color imaging – LCI) – новый метод визуальной эндоскопии, разработанный в Токио, основанный на использовании узкополосного коротковолнового света, что позволяет обнаружить воспаление или атрофию и предраковые изменения в слизистой оболочке. Проведено ретроспективное исследование эндоскопических изображений 60 пациентов (30 с доказанной HР-инфекцией и 30 – без НР), с целью сравнения точности LCI и традиционной эндоскопии в белом свете (white-light endoscopy – WLE) для диагностики HР-инфекции. Оценивалась эндоскопически выявленная диффузная гиперемия слизистой оболочки, которая могла коррелировать с НР-инфекцией. Авторы нашли более высокую точность, чувствительность и специфичность (85,8; 93,3 и 78,3%, соответственно) для диагностики HР с использованием LCI по сравнению с обычным WLE (74,2; 81,7 и 66,7%, соответственно). Авторы пришли к выводу, что эндоскопия с применением LCI более информативна, чем WLE, для выявления диффузной гиперемии СОЖ и, соответственно, подозрения на наличие HР [40].
Основными задачами, стоящими перед врачом, являются диагностика HР, подбор эффективной схемы терапии и, в дальнейшем, оценка эффективности проведенного лечения. При выборе метода тестирования HР необходимо, в первую очередь, учитывать его чувствительность и специфичность. Каждый из применяемых сегодня методов имеет свои недостатки, и поэтому ограничиваться в практической деятельности только одним из них нежелательно. Методы, которые можно использовать для первичной диагностики, представлены в табл. 3, для контроля эффективности терапии – в табл. 4.
Прием ИПП ограничивает точность диагностических методов в связи со снижением уреазной активности НР, а также уменьшением количества вегетативных (спиралевидных) форм бактерии. В одном исследовании при сравнении подавляющего действия ИПП на HР показано, что, в отличие от омепразола и лансопразола, пантопразол не ингибирует рост HР и уреазу [40]. Исследуется диагностическая ценность тестов после 7-дневной отмены ИПП. Тем не менее универсальной рекомендацией остается 14-дневная отмена любых ИПП перед большинством тестов.
В клинической практике нередко наблюдается ситуация, когда обращается пациент с симптомами диспепсии, которому ранее не проводилось лечение HР, но в настоящее время он принимает или недавно принимал ИПП, Н2-блокаторы, антибактериальные или висмутсодержащие препараты. В таком случае для диагностики НР возможно выполнение иммуноферментного анализа крови на антитела к НР класса IgG, остальные методы диагностики будут малоинформативны. Вместе с тем известно, что 28-дневный прием висмута трикалия дицитрата способен в ряде случаев (до 33%) привести к эрадикации НР [41], поэтому для принятия решения о лечении инфекции следует в плановом порядке провести неинвазивную диагностику (к примеру, 13С-УДТ) не ранее чем через 30 дней после проведенной терапии.
Если ранее пациент ранее лечился от HР и в настоящее время он принимает или принимал ИПП, Н2-блокаторы, антибактериальные или висмутсодержащие препараты, то достоверная диагностика НР возможна не ранее чем через 30 дней после завершения приема антибиотиков и препаратов висмута и не ранее чем через 2 нед после прекращения приема ИПП. Может быть использован любой тест, за исключением серологического. Если нет показаний для проведения ЭГДС, предпочтительна неинвазивная диагностика. Сводная характеристика методов диагностики НР представлена в табл. 5.
Контроль эффективности эрадикации НР, независимо от используемых тестов, следует проводить не ранее чем через 30 дней после завершения приема всех препаратов схемы. Несоблюдение этого правила ведет к ложному заключению об эффективности терапии. Предпочтение следует отдавать неинвазивным методам: 13С-УДТ и определению антигена HP в кале [9, 10]. Исключение могут составлять случаи, требующие проведения повторной ЭГДС, при которой может быть получен биоптат для гистологического, цитологического или бактериологического исследования. Вместе с тем обычно контрольная ЭГДС у больных с обострением язвенной болезни проводится на фоне продолжающегося приема ИПП, что делает невозможной диагностику НР. Проведение ЭГДС через месяц после завершения лечения только с целью выявления инфекции может быть оправданно только при недоступности и невозможности применения неинвазивных методов. При этом не следует использовать БУТ для исключения инфекции [10].
Одной из распространенных ошибок является применение для контроля эффективности эрадикации серологического метода: после успешного устранения НР в крови еще долго остаются антитела. Однако, по данным наблюдательного исследования «ПАРАД», серологический метод для контроля эрадикации применялся в 17,8% случаев, что является грубой ошибкой. Кроме того, контроль эффективности лечения проводился менее чем через 4 нед после окончания терапии в 62,3% случаев, что также является серьезным отклонением от рекомендаций [42]. Анализ данных российских пациентов, внесенных в Европейский регистр НР (Hp-EuReg), свидетельствует, что с целью контроля эффективности терапии серологический тест используется в 2,5–3,6% случаев [43, 44].
Высокая распространенность и этиопатогенетическая связь HP с наиболее значимыми заболеваниями желудка диктуют необходимость оптимизации диагностики этой инфекции с учетом чувствительности и специфичности тестов, а также условий их проведения. До назначения терапии инфекция должна быть выявлена, а после лечения – подтвержден его успех. Важно подчеркнуть, что отсутствие оценки эффективности эрадикации HP, с одной стороны, не позволяет документировать достижения цели у конкретного больного, а с другой – лишает врача возможности оценить эффективность назначаемых схем лечения в данном регионе. Последнее принципиально важно для критического переосмысления и улучшения клинической практики. Широкий арсенал диагностических тестов при рациональном их применении позволяет успешно решать эти задачи.
Список литературы:
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.













.jpg)




.png)



.jpg)












Комментарии